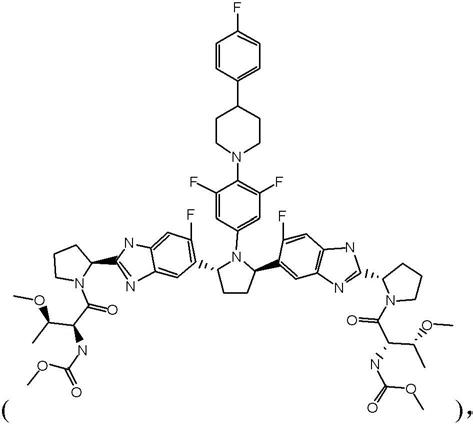
用于治疗hcv的固体药物组合物
发明领域
1.本发明涉及包含抗hcv化合物的固体药物组合物及其用于治疗hcv感染的方法。
2.发明背景
3.丙型肝炎病毒(hcv)是一种rna病毒,属于黄病毒科(flaviviridae family)的肝炎病毒属(hepacivirus genus)。包膜hcv病毒粒子含有正链rna基因组,其在单个不间断的开放阅读框中编码所有已知的病毒特异性蛋白质。开放阅读框包括约9500个核苷酸,并编码约3000个氨基酸的单个大聚合蛋白。聚合蛋白包括核心蛋白、包膜蛋白e1和e2、膜结合蛋白质p7以及非结构蛋白ns2、ns3、ns4a、ns4b、ns5a和ns5b。
4.慢性hcv感染与进行性肝脏病变相关,包含硬化和肝细胞癌。可以使用聚乙二醇干扰素
‑
α(peginterferon
‑
alpha)联合利巴韦林(ribavirin)治疗慢性丙型肝炎。疗效和耐受性仍有很大的局限性,因为许多使用者遭受副作用困扰,而且往往无法从体内完全清除病毒。此外,虽然有针对成人和12
‑
18岁的儿科人群的商业可用疗法,但对于3
‑
11岁的儿科人群来说,几乎没有选择。因此,需要新的药物来治疗这些儿科亚群的hcv感染。
技术实现要素:
5.本发明的特征在于包含化合物1和化合物2的固体药物组合物。在一个实施方案中,固体药物组合物包括(1)第一类型的膜包衣颗粒,其包含50mg的化合物1,以及药学上可接受的亲水性聚合物和药学上可接受的表面活性剂,所有这些都配制成无定形固体分散体;和(2)第二类型的膜包衣颗粒,其包含20mg的化合物2,以及药学上可接受的亲水性聚合物和药学上可接受的表面活性剂,所有这些都配制成无定形固体分散体。
6.在一个实施方案中,本发明提供了一种治疗儿科患者丙型肝炎病毒(hcv)感染的方法,包括施用(1)化合物1和(2)化合物2,其中(i)患者的年龄为3岁至小于6岁,化合物1的施用剂量约为150mg,化合物2的施用剂量约为60mg;(ii)患者的年龄为6岁至小于9岁,化合物1的施用剂量约为200mg,化合物2的施用剂量约为80mg;或(iii)患者为9岁至小于12岁,化合物1的施用剂量为约250mg,化合物2的施用剂量为约100mg。
7.在一个实施方案中,本发明提供了一种治疗儿科患者丙型肝炎病毒(hcv)感染的方法,包括施用一种膜包衣颗粒组合物,其包括
8.50mg的化合物1和20mg的化合物2,其中所述膜包衣颗粒组合物被提供在小袋中,并且其中所述患者为3岁至小于6岁并且施用三个小袋,包括总共约150mg的化合物1和约60mg的化合物2,并且患者在治疗后约12周获得持续病毒学应答(svr12)。
9.在一个实施方案中,本发明提供了一种治疗儿科患者丙型肝炎病毒(hcv)感染的方法,包括施用一种膜包衣颗粒组合物,其包括
10.50mg的化合物1和20mg的化合物2,其中所述膜包衣颗粒组合物被提供在小袋中,并且其中所述患者为6岁至小于9岁并且施用四个小袋,包括总共约200mg的化合物1和约80mg的化合物2,并且患者在治疗后约12周获得持续病毒学应答(svr12)。
11.在一个实施方案中,本发明提供了一种治疗儿科患者丙型肝炎病毒(hcv)感染的
方法,包括施用包含50mg的化合物1和20mg的化合物2的膜包衣颗粒组合物,其中所述膜包衣颗粒组合物被提供在小袋中,并且其中所述患者为9岁至小于12岁并且施用五个小袋,包括总共约250mg的化合物1和约100mg的化合物2,并且患者在治疗后约12周获得持续病毒学应答(svr12)。
12.在另一个实施方案中,患者为3岁至小于6岁,化合物1以约150mg的剂量施用,化合物2以约60mg的剂量施用。
13.在又一个实施方案中,患者为6岁至小于9岁,化合物1以约200mg的剂量施用,化合物2以约80mg的剂量施用。
14.在另一个实施方案中,患者为9岁至小于12岁,化合物1以约250mg的剂量施用,化合物2以约100mg的剂量施用。
15.在一个实施方案中,化合物1从包含无定形固体分散体的第一类型膜包衣颗粒施用,所述无定形固体分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs。进一步地,第一类型颗粒中化合物1的总量为50mg。
16.在另一个实施方案中,化合物2从包含无定形固体分散体的第二类型的膜包衣颗粒施用,所述无定形固体分散体包括(i)化合物2、(ii)共聚维酮和(iii)维生素e tpgs和丙二醇单辛酸酯。进一步地,第二类型颗粒中化合物2的总量为20mg。
17.一个实施方案提供了一种固体药物组合物,其包含:(1)50mg的化合物1,其配制成无定形固体分散体,该分散体进一步包含50重量%至80重量%的第一药学上可接受的聚合物和5重量%至15重量%的第一药学上可接受的表面活性剂;和(2)20mg的化合物2,其配制成无定形固体分散体,该分散体进一步包含50重量%至90重量%的第二药学上可接受的聚合物和5重量%至15重量%的第二药学上可接受的表面活性剂。此外,在一个实施方案中,该组合物是(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。此外,在一个实施方案中,其中配制化合物1的无定形固体分散体包含20重量%的化合物1,并且其中配制化合物2的无定形固体分散体包含10重量%的化合物2。在一个实施方案中,该组合物是(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。此外,所述第一和第二聚合物是共聚维酮,并且所述第一和第二表面活性剂是维生素e tpgs。在一个实施方案中,所述第一和第二聚合物是共聚维酮,并且所述第一表面活性剂是维生素e tpgs,并且所述第二表面活性剂是维生素e tpgs和丙二醇单辛酸酯的组合。
18.另一个实施方案提供了一种稳定、口服、立即释放固体药物组合物,其包含:(1)50mg的化合物1,其配制成无定形固体分散体,该分散体进一步包含50重量%至80重量%的第一药学上可接受的聚合物和5重量%至15重量%的第一药学上可接受的表面活性剂;和(2)20mg的化合物2,其配制成无定形固体分散体,该分散体进一步包含50重量%至90重量%的第二药学上可接受的聚合物和5重量%至15重量%的第二药学上可接受的表面活性剂,其中组合物在小袋中提供并且在小袋中稳定持续约24个月的保质期。
19.在一个实施方案中,该组合物是(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。
20.在一个实施方案中,其中配制化合物1的无定形固体分散体包含20重量%的化合物1,并且其中配制化合物2的无定形固体分散体包含10重量%的化合物2。
21.在一个实施方案中,该组合物是(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。
22.在一个实施方案中,第一和第二聚合物是共聚维酮,并且第一和第二表面活性剂是维生素e tpgs。
23.在一个实施方案中,第一和第二聚合物是共聚维酮,第一表面活性剂是维生素e tpgs,第二表面活性剂是维生素e tpgs和丙二醇单辛酸酯的组合。
24.在一个实施方案中,组合物具有根据以下曲线中的至少一种曲线的体外释放特征:(i)当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将组合物溶解在1000ml的溶解介质中时,组合物中至少80%的化合物1在3小时内释放,并且组合物中至少80%的化合物2在3小时内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0);(ii)当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将组合物溶解在1000ml的溶解介质中时,组合物中至少30%的化合物1在50分钟内释放,并且组合物中至少45%的化合物2在50分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0);或(iii)当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将组合物溶解在1000ml的溶解介质中时,组合物中至少5%的化合物1在25分钟内释放,并且组合物中至少10%的化合物2在25分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
25.在一个实施方案中,组合物具有根据以下曲线中的至少一种曲线的体外释放特征:(i)当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少80%的化合物1在40分钟内释放,并且组合物中至少80%的化合物2在40分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0);(ii)当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少30%的化合物1在20分钟内释放,并且组合物中至少45%的化合物2在20分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0);或(iii)当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少5%的化合物1在10分钟内释放,并且组合物中至少10%的化合物2在10分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
26.在一个实施方案中,向3岁至小于6岁的健康、非禁食患者群体施用的单剂量三小袋导致化合物1的平均auc值介于约6936ng
·
h/ml和约10838ng
·
h/ml之间,以及化合物2的平均auc值介于约1840ng
·
h/ml和约2875ng
·
h/ml之间。
27.在一个实施方案中,向6岁至小于9岁的健康、非禁食患者群体施用的单剂量四小袋导致化合物1的平均auc值介于约4776ng
·
h/ml和约7463ng
·
h/ml之间,以及化合物2的平均auc值介于约1216ng
·
h/ml和约1900ng
·
h/ml之间。
28.在一个实施方案中,向9岁至小于12岁的健康、非禁食患者群体施用的单剂量五小袋导致化合物1的平均auc值介于约5360ng
·
h/ml和约8375ng
·
h/ml之间,以及化合物2的平均auc值介于约1328ng
·
h/ml和约2075ng
·
h/ml之间。
29.另一个实施方案提供与本文所述的组合物生物等效的药物组合物。
30.另一个实施方案提供治疗丙型肝炎病毒(hcv)感染的方法,包括向有需要的患者施用本文所述的固体药物组合物,其中患者在治疗后约12周获得持续病毒学应答(svr12)。
31.另一个实施方案提供了一种含有上述固体药物组合物的分配容器。进一步,分配容器是小袋。
32.一种实施方案提供了一种治疗丙型肝炎病毒(hcv)感染的方法,包括向有需要的患者施用如上所述的固体药物组合物。
33.又一个实施方案提供了一种固体药物组合物,其包含:(1)50mg的化合物1,其配制成无定形固体分散体,该分散体进一步包含50重量%至80重量%的第一药学上可接受的聚合物和5重量%至15重量%的第一药学上可接受的表面活性剂;(2)20mg的化合物2,其配制成无定形固体分散体,该分散体进一步包含50重量%至90重量%的第二药学上可接受的聚合物和5重量%至15重量%的第二药学上可接受的表面活性剂,并且其中所述组合物被提供在分配容器中,该分配容器包括小袋。在另一个实施方案中,该组合物提供(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。
34.本发明的上述目标不意图为穷尽性的或将本发明限于所公开的确切内容。有可能根据教导进行修改和改变,或可以从本发明的实践中获得修改和改变。因此,应注意,本发明的范围由权利要求及其等同物限定。
附图说明
35.图1和图2各自描绘了根据本文所述的口服剂型(例如,膜包衣颗粒)用作分配容器的示例性小袋。
具体实施方式
36.本发明的特征在于可用于治疗hcv的固体药物组合物。这些固体药物组合物包括:
37.(1)
38.或其药学上可接受的盐,其配制成无定形固体分散体,和
39.(2)
40.或其药学上可接受的盐,其配制成无定形固体分散体。
41.化合物1是一种有效的hcv蛋白酶抑制剂,且描述于美国专利申请公开案第2012/0070416号中,通过引用以其全部并入本文中。化合物2是一种有效的ns5a抑制剂,且描述于美国专利申请公开案第2012/0220562号中,通过引用以其全部并入本文中。在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
42.(1)50mg的化合物1,其配制成无定形固体分散体,该分散体进一步包含50重量%至80重量%的第一药学上可接受的聚合物和5重量%至15重量%的第一药学上可接受的表面活性剂;和
43.(2)20mg的化合物2,其配制成无定形固体分散体,该分散体进一步包含50重量%至90重量%的第二药学上可接受的聚合物和5重量%至15重量%的第二药学上可接受的表面活性剂,其中组合物被提供在小袋中并且在小袋中约24个月的保质期期间是稳定的。
44.在一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。然后将这些固体分散体研磨和/或与其他赋形剂混合,以形成含有化合物1和化合物2的固体药物组合物。
45.在另一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。将包含化合物1的固体分散体研磨和/或与其他赋形剂混合,然后压制成片剂的第一层;将包含化合物2的固体分散体同样研磨和/或与其他赋形剂混合,并压制成同一片剂的第二层。
46.在另一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。将包含化合物1的固体分散体研磨和/或与其他赋形剂混合,然后压制成小片,每个小片的尺寸不超过5mm。将包含化合物2的固体分散体同样研磨和/或与其他赋形剂混合,压制成小片,每个小片的尺寸不超过5mm。然后将含有化合物1的小片与含有化合物2的小片混合,以提供化合物1和化合物2的所需剂量。
47.在另一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。将包含化合物1的固体分散体研磨和/或与其他赋形剂混合,然后压制成小片,每个小片的尺寸不超过3mm。将包含化合物2的固体分散体同样研磨和/或与其他赋形剂混合,压制成小片,每个小片的尺寸不超过3mm。然后将含有化合物1的小片与含有化合物2的小片混合,以
提供化合物1和化合物2的所需剂量。
48.在另一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。将包含化合物1的固体分散体研磨和/或与其他赋形剂混合,然后压制成小片,每个小片的尺寸不超过2mm。将包含化合物2的固体分散体同样研磨和/或与其他赋形剂混合,压制成小片,每个小片的尺寸不超过2mm。然后将含有化合物1的小片与含有化合物2的小片混合,以提供化合物1和化合物2的所需剂量。
49.在另一个实施方案中,化合物1和化合物2分别配制成不同的无定形固体分散体。将包含化合物1的固体分散体研磨和/或与其他赋形剂混合,然后压缩以形成颗粒。然后用非功能性膜包衣包覆含有化合物1的颗粒。将包含化合物2的固体分散体同样研磨和/或与其他赋形剂混合,然后压缩形成颗粒。然后用非功能性膜包衣包覆含有化合物2的颗粒。然后将含有化合物1的膜包衣颗粒与含有化合物2的膜包衣颗粒混合(例如,在分配容器如小袋中)以提供化合物1和化合物2的所需剂量。
50.又一个实施方案提供了一种固体药物组合物,其包含:(1)50mg的化合物1,其配制成无定形固体分散体,该分散体进一步包含50重量%至80重量%的第一药学上可接受的聚合物和5重量%至15重量%的第一药学上可接受的表面活性剂;(2)20mg的化合物2,其配制成无定形固体分散体,该分散体进一步包含50重量%至90重量%的第二药学上可接受的聚合物和5重量%至15重量%的第二药学上可接受的表面活性剂,并且其中所述组合物被提供在分配容器中,该分配容器包括小袋。在另一个实施方案中,该组合物提供(1)包括所述50mg的化合物1的第一类型的膜包衣颗粒和(2)包含所述20mg的化合物2的第二类型的膜包衣颗粒的混合物。
51.在又一个实施方案中,化合物1和化合物2配制成相同的无定形固体分散体。将固体分散体研磨和/或与其他赋形剂混合,以提供包含化合物1和化合物2两者的固体药物剂型。
52.在又一个实施方案中,化合物1和化合物2配制成相同的无定形固体分散体。将固体分散体研磨和/或与其他赋形剂混合,然后压制成片剂。
53.在又一个实施方案中,本发明的固体药物组合物包含:
54.(1)化合物1或其药学上可接受的盐,其被配制成第一无定形固体分散体,其中第一无定形固体分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂;和
55.(2)化合物2或其药学上可接受的盐,其被配制成第二无定形固体分散体,其中第二无定形固体分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂。
56.在又一个实施方案中,本发明的固体药物组合物是片剂,其包含:
57.(1)包含第一无定形固体分散体的第一层,其中第一无定形固体分散体包含(i)化合物1或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂;和
58.(2)包含第二无定形固体分散体的第二层,其中第二无定形固体分散体包含(i)化合物2或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂。
59.在又一个实施方案中,本发明的固体药物组合物包含:
60.(1)100mg化合物1,其配制成无定形固体分散体,该分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂;和
61.(2)40mg化合物2,其配制成无定形固体分散体,该分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂。
62.在又一个实施方案中,本发明的固体药物组合物包含:
63.(1)100mg化合物1,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e聚乙二醇琥珀酸酯(维生素e tpgs);和
64.(2)40mg化合物2,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e tpgs。
65.在又一个实施方案中,本发明的固体药物组合物包含:
66.(1)100mg化合物1,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e tpgs;和
67.(2)40mg化合物2,其配制成无定形固体分散体,该分散体进一步包含共聚维酮、维生素e tpgs和丙二醇单辛酸酯。
68.在又一个实施方案中,本发明的固体药物组合物包含:
69.(1)50mg化合物1,其配制成无定形固体分散体,该分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂;和
70.(2)20mg化合物2,其配制成无定形固体分散体,该分散体进一步包含药学上可接受的亲水性聚合物和药学上可接受的表面活性剂。
71.在又一个实施方案中,本发明的固体药物组合物包含:
72.(1)50mg化合物1,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e聚乙二醇琥珀酸酯(维生素e tpgs);和
73.(2)20mg化合物2,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e tpgs。
74.在又一个实施方案中,本发明的固体药物组合物包含:
75.(1)50mg化合物1,其配制成无定形固体分散体,该分散体进一步包含共聚维酮和维生素e tpgs;和
76.(2)20mg化合物2,其配制成无定形固体分散体,该分散体进一步包含共聚维酮、维生素e tpgs和丙二醇单辛酸酯。
77.在又一个实施方案中,本发明的固体药物组合物是片剂,其包含:
78.(1)第一层,其包含100mg的化合物1,以及药学上可接受的亲水性聚合物和药学上可接受的表面活性剂,所有均配制成无定形固体分散体;和
79.(2)第二层,其包含40mg的化合物2,以及药学上可接受的亲水性聚合物和药学上可接受的表面活性剂,所有均配制成无定形固体分散体。
80.在又一个实施方案中,本发明的固体药物组合物是片剂,其包含:
81.(1)第一层,其包含100mg化合物1,以及共聚维酮和维生素e tpgs,所有都配制成无定形固体分散体;和
82.(2)第二层,其包含40mg化合物2,以及共聚维酮和维生素e tpgs,所有都配制成无
定形固体分散体。
83.在又一个实施方案中,本发明的固体药物组合物是片剂,其包含:
84.(1)第一层,其包含100mg化合物1,以及共聚维酮和维生素e tpgs,所有都配制成无定形固体分散体;和
85.(2)第二层,其包含40mg化合物2,以及共聚维酮、维生素e tpgs和丙二醇单辛酸酯,所有都配制成无定形固体分散体。
86.在又一个实施方案中,本发明的固体药物组合物包含:
87.(1)第一类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物1或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂;和
88.(2)第二类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物2或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂。
89.在又一个实施方案中,本发明的固体药物组合物包含:
90.(1)第一类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物1或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂;和
91.(2)第二类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物2或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂。
92.在又一个实施方案中,本发明的固体药物组合物包含:
93.(1)第一类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物1或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂;和
94.(2)第二类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物2或其药学上可接受的盐,(ii)药学上可接受的亲水性聚合物和(iii)药学上可接受的表面活性剂。
95.在又一个实施方案中,本发明的固体药物组合物包含:
96.(1)第一类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物1,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物1的总量为100mg;和
97.(2)第一类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物2,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物2的总量为40mg。
98.在又一个实施方案中,本发明的固体药物组合物包含:
99.(1)第一类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物1,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物1的总量为100mg;和
100.(2)第一类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分
散体包括(i)化合物2,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物2的总量为40mg。
101.在又一个实施方案中,本发明的固体药物组合物包含:
102.(1)第一类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物1,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物1的总量为100mg;和
103.(2)第一类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物2,(ii)药学上可接受的亲水聚合物和(iii)药学上可接受的表面活性剂,其中第一类型的小片中化合物2的总量为40mg。
104.在又一个实施方案中,本发明的固体药物组合物包含:
105.(1)第一类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
106.(2)第二类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物2的总量为40mg。
107.在又一个实施方案中,本发明的固体药物组合物包含:
108.(1)第一类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
109.(2)第二类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物2的总量为40mg。
110.在又一个实施方案中,本发明的固体药物组合物包含:
111.(1)第一类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
112.(2)第二类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物2的总量为40mg。
113.在又一个实施方案中,本发明的固体药物组合物包含:
114.(1)第一类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
115.(2)第二类型的小片,每个小片的大小不超过5mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮以及(iii)维生素e tpgs和丙二醇单辛酸酯,并且其中第一类型的小片中化合物2的总量为40mg。
116.在又一个实施方案中,本发明的固体药物组合物包含:
117.(1)第一类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分
散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
118.(2)第二类型的小片,每个小片的大小不超过3mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮以及(iii)维生素e tpgs和丙二醇单辛酸酯,并且其中第一类型的小片中化合物2的总量为40mg。
119.在又一个实施方案中,本发明的固体药物组合物包含:
120.(1)第一类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的小片中化合物1的总量为100mg;和
121.(2)第二类型的小片,每个小片的大小不超过2mm,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮以及(iii)维生素e tpgs和丙二醇单辛酸酯,并且其中第一类型的小片中化合物2的总量为40mg。
122.在又一个实施方案中,本发明的固体药物组合物包含:
123.(1)第一类的膜包衣颗粒,其包含无定形固体分散体,该分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs,并且其中第一类型的颗粒中化合物1的总量为50mg;和
124.(2)第二类型的膜包衣颗粒,其包含无定形固体分散体,该分散体包括(i)化合物2、(ii)共聚维酮以及(iii)维生素e tpgs和丙二醇单辛酸酯,并且其中在第二类型的颗粒中包含的化合物2的总量是20mg。在一些这样的实施方案中,第一类型的膜包衣颗粒和/或第二类型的膜包衣颗粒包含在分配容器例如小袋中。
125.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物1的总重量相对于无定形固体分散体的总重量在10重量%至40重量%的范围内。更优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物1的总重量相对于无定形固体分散体的总重量在15重量%至30重量%的范围内。高度优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物1的总重量相对于无定形固体分散体的总重量为20重量%。
126.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物2的总重量相对于无定形固体分散体的总重量在5重量%至20重量%的范围内。更优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物2的总重量相对于无定形固体分散体的总重量为10重量%。
127.更优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物1的总重量相对于无定形固体分散体的总重量在15重量%至30重量%的范围内。并且无定形固体分散体中化合物2的总重量相对于无定形固体分散体的总重量在5重量%至15重量%的范围内。
128.高度优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体中化合物1的总重量相对于无定形固体分散体的总重量为20重量%。并且无定形固体分散体中化合物2的总重量相对于无定形固体分散体的总重量为10重量%。
129.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体可包含相对于无定形固体分散体的总重量为50重量%至80重量%的药学上可接受的亲
水聚合物,相对于无定形固体分散体的总重量为5重量%至15重量%的药学上可接受的表面活性剂。
130.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体可包含相对于无定形固体分散体的总重量为50重量%至90重量%的药学上可接受的亲水聚合物,相对于无定形固体分散体的总重量为5重量%至15重量%的药学上可接受的表面活性剂。
131.还优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体可包含相对于无定形固体分散体的总重量为60重量%至80重量%的药学上可接受的亲水聚合物,相对于无定形固体分散体的总重量为10重量%的药学上可接受的表面活性剂。
132.在本发明的任何方面、实施方案、实例、优选和组合物中,药学上可接受的亲水性聚合物可具有至少50℃的t
g
;优选地,药学上可接受的亲水性聚合物具有至少80℃的t
g
;更优选地,药学上可接受的亲水性聚合物具有至少100℃的t
g
。例如,药学上可接受的亲水聚合物可以具有80℃至180℃,或100℃至150℃的t
g
。
133.优选地,用于本发明的药学上可接受的亲水聚合物是水溶性的。本发明的固体药物组合物还可包含水溶性差或水不溶性的聚合物,例如交联聚合物。包含在本发明的固体药物组合物中的药学上可接受的亲水性聚合物在20℃以2%(w/v)溶解在水溶液中时优选具有1至5000mpa
·
s的表观粘度,更高优选1至700mpa
·
s,最优选5至100mpa
·
s。
134.在本发明的任何方面、实施方案、实例和组合物中,药学上可接受的亲水性聚合物可以选自n
‑
乙烯基内酰胺的均聚物、n
‑
乙烯基内酰胺的共聚物、纤维素酯、纤维素醚、聚环氧烷、聚丙烯酸酯、聚甲基丙烯酸酯、聚丙烯酰胺、聚乙烯醇、乙酸乙烯酯聚合物、寡糖、多糖或它们的组合。合适的亲水性聚合物的非限制性实例包括n
‑
乙烯基吡咯烷酮的均聚物、n
‑
乙烯基吡咯烷酮的共聚物、n
‑
乙烯基吡咯烷酮和乙酸乙烯酯的共聚物、n
‑
乙烯基吡咯烷酮和丙酸乙烯酯的共聚物、聚乙烯吡咯烷酮、甲基纤维素、乙基纤维素、羟烷基纤维素、羟丙基纤维素、羟烷基烷基纤维素、羟丙基甲基纤维素、邻苯二甲酸纤维素、琥珀酸纤维素、邻苯二甲酸醋酸纤维素、邻苯二甲酸羟丙基甲基纤维素、琥珀酸羟丙基甲基纤维素、醋酸琥珀酸羟丙基甲基纤维素、聚环氧乙烷、聚环氧丙烷、环氧乙烷和环氧丙烷的共聚物、甲基丙烯酸/丙烯酸乙酯共聚物、甲基丙烯酸/甲基丙烯酸甲酯共聚物、甲基丙烯酸丁酯/甲基丙烯酸2
‑
二甲氨基乙酯共聚物、聚(丙烯酸羟烷基酯)、聚(甲基丙烯酸羟烷基酯)、乙酸乙烯酯和巴豆酸的共聚物、部分水解的聚乙酸乙烯酯、角叉菜胶、半乳甘露聚糖、黄原胶或其组合。
135.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,聚合物是共聚维酮。
136.在本发明的任何方面、实施方案、实例、优选和组合物中,药学上可接受的表面活性剂可以具有至少10的hlb值。也可以使用hlb值小于10的表面活性剂。
137.在本发明的任何方面、实施方案、实例、优选和组合物中,药学上可接受的表面活性剂可以选自聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨糖醇单脂肪酸酯、聚氧乙烯烷基醚、聚氧乙烯烷基芳基醚、聚乙二醇脂肪酸酯、亚烷基二醇脂肪酸单酯、蔗糖脂肪酸酯、脱水山梨糖醇脂肪酸单酯或其组合。合适的表面活性剂的非限制性实例包括聚氧乙烯甘油三蓖麻醇酸酯或聚烃氧基35蓖麻油(el;basf corp.)或聚氧乙烯甘油氧硬脂酸酯,
例如聚乙二醇40氢化蓖麻油(rh 40,也称为聚烃氧基40氢化蓖麻油或聚乙二醇甘油羟基硬脂酸酯)或聚乙二醇60氢化蓖麻油(rh 60),聚氧乙烯脱水山梨糖醇单脂肪酸酯,例如聚氧乙烯(20)脱水山梨糖醇单脂肪酸酯,例如聚氧乙烯(20)脱水山梨糖醇单油酸酯(80),聚氧乙烯(20)脱水山梨糖醇单硬脂酸酯(60)、聚氧乙烯(20)脱水山梨糖醇单棕榈酸酯(40)或聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(20)、聚氧乙烯(3)月桂基醚、聚氧乙烯(5)十六烷基醚、聚氧乙烯(2)硬脂醚、聚氧乙烯(5)硬脂醚、聚氧乙烯(2)壬基苯基醚、聚氧乙烯(3)壬基苯基醚、聚氧乙烯(4)壬基苯基醚、聚氧乙烯(3)辛基苯基醚、peg
‑
200单月桂酸酯、peg
‑
200二月桂酸酯、peg
‑
300二月桂酸酯、peg
‑
400二月桂酸酯、peg
‑
300二硬脂酸酯、peg
‑
300二油酸酯、丙二醇单月桂酸酯(如lauroglycol)、蔗糖单硬脂酸酯、蔗糖二硬脂酸酯、蔗糖单月桂酸酯、蔗糖二月桂酸酯、脱水山梨糖醇单月桂酸酯、脱水山梨糖醇单油酸酯、脱水山梨糖醇单棕榈酸酯、脱水山梨糖醇硬脂酸酯或其组合。
138.优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,药学上可接受的表面活性剂是或包括d
‑
α
‑
生育酚聚乙二醇1000琥珀酸酯(维生素e tpgs)。
139.还优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,在包含化合物2的无定形固体分散体中使用的药学上可接受的表面活性剂是或包括维生素e tpgs和丙二醇单辛酸酯的组合。
140.高度优选地,在本发明的任何方面、实施方案、实例、优选和组合物中,药学上可接受的亲水性聚合物是共聚维酮,并且药学上可接受的表面活性剂是或包括维生素e tpgs。
141.在本发明的任何方面、实施方案、实例、优选和组合物中,无定形固体分散体优选包含或由单相(在热力学中定义)组成,其中化合物1或化合物2无定形地分散在含有药学上可接受的亲水性聚合物和药学上可接受的表面活性剂的基质中。使用差示扫描量热法(dsc)对无定形固体分散体的热分析通常仅显示一个单一t
g
,并且无定形固体分散体通常不含任何可检测的结晶化合物,如通过x射线粉末衍射光谱法测量的。
142.在本发明的任何方面、实施方案、实例、优选和组合物中,本发明的固体药物组合物可以是片剂。
143.在本发明的任何方面、实施方案、实例、优选和组合物中,本发明的固体药物组合物可以是小片的混合物。
144.在本发明的任何方面、实施方案、实例、优选和组合物中,本发明的固体药物组合物可以是颗粒的混合物,其可以包含在分配容器例如小包或小袋中。
145.在本发明的任何方面、实施例、实例、优选和组合物中,本发明的固体药物组合物可以制备成其他合适的剂型,例如胶囊剂、糖衣丸、颗粒剂或粉剂。
146.在本发明的任何方面、实施方案、实例、优选和组合物中,将本发明的固体药物组合物与食物一起施用于hcv患者以治疗hcv。当使用本发明的固体药物组合物递送时,与食物一起施用可以显著提高化合物1和化合物2在患者体内的生物利用度。
147.本发明的固体药物组合物可进一步包含另一种抗hcv药剂,例如选自hcv解旋酶抑制剂、hcv聚合酶抑制剂、hcv蛋白酶抑制剂、hcv ns5a抑制剂、cd81抑制剂、亲环蛋白抑制剂或内部核糖体进入位点(ires)抑制剂的药剂。
148.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
149.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)50重量%至80重量%的第一药学上可接受的聚合物和(iii)5重量%至15重量%的第一药学上可接受的表面活性剂;和
150.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)50重量%至90重量%的第二药学上可接受的聚合物和(iii)5重量%至15重量%的第二药学上可接受的表面活性剂。
151.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
152.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)50重量%至80重量%的共聚维酮和(iii)5重量%至15重量%的维生素e tpgs;和
153.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)50重量%至90重量%的共聚维酮和(iii)5重量%至15重量%的维生素e tpgs和丙二醇单辛酸酯。
154.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
155.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)50重量%至80重量%的第一药学上可接受的聚合物和(iii)5重量%至15重量%的第一药学上可接受的表面活性剂;和
156.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)50重量%至90重量%的第二药学上可接受的聚合物和(iii)5重量%至15重量%的第二药学上可接受的表面活性剂,
157.其中组合物被提供在小袋中并且在小袋中约24个月的保质期期间是稳定的。
158.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
159.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)50重量%至80重量%的共聚维酮和(iii)5重量%至15重量%的维生素e tpgs;和
160.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)50重量%至90重量%的共聚维酮和(iii)5重量%至15重量%的维生素e tpgs和丙二醇单辛酸酯,
161.其中组合物被提供在小袋中并且在小袋中约24个月的保质期期间是稳定的。
162.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
163.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)约172.5mg的共聚维酮和(iii)约25mg的维生素e tpgs;和
164.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)约158.0mg的共聚维酮和(iii)约16.0mg的维生素e tpgs和约4.0mg的丙二醇单辛酸酯。
165.在一个实施方案中,本发明提供了一种稳定的、口服的、立即释放的固体药物组合物,其包含:
166.(1)包含无定形固体分散体的第一类型的膜包衣颗粒,其包含(i)50mg化合物1,(ii)约172.5mg的共聚维酮和(iii)约25mg的维生素e tpgs;和
167.(2)包含无定形固体分散体的第二类型的膜包衣颗粒,其包含(i)20mg化合物2,(ii)约158.0mg的共聚维酮和(iii)约16.0mg的维生素e tpgs和约4.0mg的丙二醇单辛酸酯,
168.其中组合物被提供在小袋中并且在小袋中约24个月的保质期期间是稳定的。
169.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少80%的化合物1在3小时内释放,并且组合物中至少80%的化合物2在3小时内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
170.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少80%的化合物1在40分钟内释放,并且组合物中至少80%的化合物2在40分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
171.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少90%的化合物1在3小时内释放,并且组合物中至少90%的化合物2在3小时内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
172.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少75%的化合物1在105分钟内释放,并且组合物中至少80%的化合物2在105分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
173.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少80%的化合物1在100分钟内释放,并且组合物中至少80%的化合物2在100分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
174.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少40%的化合物1在50分钟内释放,并且组合物中至少50%的化合物2在50分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
175.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优
选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少30%的化合物1在50分钟内释放,并且组合物中至少45%的化合物2在50分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
176.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少30%的化合物1在20分钟内释放,并且组合物中至少45%的化合物2在20分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
177.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少10%的化合物1在25分钟内释放,并且组合物中至少20%的化合物2在25分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
178.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中至少5%的化合物1在25分钟内释放,并且组合物中至少10%的化合物2在25分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
179.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中至少5%的化合物1在10分钟内释放,并且组合物中至少10%的化合物2在10分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
180.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中80
‑
100%的化合物1在3小时内释放,并且组合物中80
‑
100%的化合物2在3小时内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
181.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中90
‑
100%的化合物1在3小时内释放,并且组合物中90
‑
100%的化合物2在3小时内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
182.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中75
‑
100%的化合物1在105分钟内释放,并且组合物中80
‑
100%的化合物2在105分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
183.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中80
‑
100%的化合物1在100分钟内释放,并且组合物中85
‑
100%的化合物2在100分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
184.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中40
‑
60%的化合物1在50分钟内释放,并且组合物中50
‑
80%的化合物2在50分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
185.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中30
‑
60%的化合物1在50分钟内释放,并且组合物中45
‑
80%的化合物2在50分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
186.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中10
‑
30%的化合物1在25分钟内释放,并且组合物中20
‑
40%的化合物2在25分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
187.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中5
‑
30%的化合物1在25分钟内释放,并且组合物中10
‑
40%的化合物2在25分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
188.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中10
‑
30%的化合物1在25分钟内释放并且组合物中20
‑
40%的化合物2在25分钟内释放,组合物中40
‑
60%的化合物1在50分钟内释放并且组合物中50
‑
80%的化合物2在50分钟内释放,组合物中80
‑
100%的化合物1在100分钟内释放并且组合物中85
‑
100%的化合物2在100分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
189.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的具有日本沉降片的标准usp溶解装置2(桨)将其溶解在1000ml的溶解介质中时,组合物中5
‑
30%的化合物1在25分钟内释放并且组合物中10
‑
40%的化合物2在25分钟内释放,组合物中30
‑
60%的化合物1在50分钟内释放并且组合物中45
‑
80%的化合物2在50分钟内释放,组合物中75
‑
100%的化合物1在105分钟内释放并且组合物中80
‑
100%的化合物2在105分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
190.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中80
‑
100%的化合物1在40分钟内释放,并且组合物中80
‑
100%的化合物2在40分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
191.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中30
‑
60%的化合物1在20分钟内释放,并且组合物中45
‑
80%的化合物2在20分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
192.如本文所述或考虑的本发明的任何组合物(例如,实施例1和2中所述的组合物)优选具有以下体外释放特征:当使用在75rpm、37℃下操作的标准usp溶解装置1(篮子)将组合物溶解在500ml的溶解介质中时,组合物中5
‑
25%的化合物1在10分钟内释放,并且组合物中10
‑
30%的化合物2在10分钟内释放,其中溶解介质是含1%聚山梨醇酯80的0.1m醋酸盐缓冲液(ph 4.0)。
193.另一方面,本发明提供与本文所述的固体药物组合物生物等效的组合物。在一些实施方案中,组合物根据其溶解曲线是生物等效的。在一些实施方案中,组合物根据其生物利用度曲线是生物等效的。例如,生物等效组合物的auc值可为本文所述固体药物组合物的auc值的约80%至约125%。在其他实例中,生物等效组合物的c
max
值可为本文所述固体药物组合物的c
max
值的约80%至约125%。
194.在另一方面,本文所述的固体药物组合物在其保质期内是稳定的。在一些实施方案中,组合物在小袋中具有约24个月的保质期。在一些实施方案中,组合物在小袋中具有约12个月的保质期。在一些实施方案中,组合物在小袋中具有约36个月的保质期。在一些实施方案中,组合物在小袋中具有约18个月的保质期。在一些实施方案中,组合物在小袋中具有约6个月的保质期。在一些实施例中,组合物在小袋中具有约6个月至约36个月的保质期。在一些实施例中,组合物在小袋中具有约6个月至约30个月的保质期。在一些实施例中,组合物在小袋中具有约6个月至约24个月的保质期。在一些实施例中,组合物在小袋中具有约6个月至约18个月的保质期。在一些实施例中,组合物在小袋中具有约6个月至约12个月的保质期。在一些实施方案中,组合物在小袋中具有最多约6个月的保质期。在一些实施方案中,组合物在小袋中具有最多约12个月的保质期。在一些实施方案中,组合物在小袋中具有最多约18个月的保质期。在一些实施方案中,组合物在小袋中具有最多约24个月的保质期。在一些实施方案中,组合物在小袋中具有最多约30个月的保质期。在一些实施方案中,组合物在小袋中具有最多约36个月的保质期。
195.另一方面,本发明的特征在于制备本发明的固体药物组合物的方法。该方法包括(1)制备包含目标化合物、药学上可接受的亲水性聚合物和药学上可接受的表面活性剂的熔体;和(2)固化所述熔体。固化的熔体可包含本文所述或考虑的任何无定形固体分散体。如本文所用,“目标化合物”是指化合物1或其药学上可接受的盐,或化合物2或其药学上可接受的盐。该方法可以进一步包括研磨固化的熔体,然后将研磨的产品与一种或多种其他赋形剂或成分一起压制(例如,将研磨的产品与一种或多种其他赋形剂或成分共混,然后压
制共混的混合物)以形成片剂、小片剂或片剂中的一层。这些其他赋形剂或成分可包括例如着色剂、调味剂、润滑剂或防腐剂。还可以将膜包衣添加到如此制备的片剂或小片剂中。
196.在一个实施方案中,在150至180℃的温度形成熔体。在另一个实施方案中,在150至170℃的温度形成熔体。在又一个实施方案中,在150至160℃的温度形成熔体。在又一个实施方案中,在160至170℃的温度形成熔体。
197.本文描述或考虑的任何无定形固体分散体,包括在本发明的任何方面、实施方案、实例、优选和组合物中描述或考虑的任何无定形固体分散体,可以根据本文描述或考虑的任何方法制备。
198.在又另一方面,本发明的特征在于根据本发明的方法制备的固体药物组合物。本文描述或考虑的任何方法可用于制备固体药物组合物,其包含感兴趣的化合物、药学上可接受的亲水性聚合物和药学上可接受的表面活性剂。
199.本发明进一步描述了使用本发明的固体药物组合物治疗hcv感染的方法。该方法包括向有需要的患者施用本发明的固体药物组合物。患者可能感染了hcv基因型1、2、3、4、5或6。
200.本发明中使用的无定形固体分散体可以通过多种技术制备,例如但不限于,熔融挤出、喷雾干燥、共沉淀、冷冻干燥或其他溶剂蒸发技术,优选熔融挤出和喷雾干燥。熔融挤出方法通常包括制备包含活性成分、药学上可接受的亲水性聚合物和优选药学上可接受的表面活性剂的熔体的步骤,然后冷却该熔体直至其固化。“熔融”意思指转变成液态或橡胶态,其中一种组分可嵌入,优选均匀地嵌入另外一种或多种组分中。在许多情况下,聚合物组分将熔化,而包括活性成分和表面活性剂在内的其他组分将溶解在熔体中,从而形成固溶体。熔融通常涉及加热超过聚合物的软化点。熔体的制备可通过多种方式进行。所述组分的混合可在熔体形成之前、期间或之后进行。例如,所述组分可先混合,然后熔融,或可同时进行混合和熔融。熔体也可被均质化以便高效地分散活性成分。此外,先将聚合物熔融,然后混入活性成分中并均质化可能是适宜的。在一个实施方案中,除了表面活性剂之外的所有材料被混合并进料到挤出机中,而药学上可接受的表面活性剂在外部熔融并在挤出过程中泵入。
201.为了开始熔融挤出工艺,活性成分(例如化合物1或化合物2)可以以其固体形式使用,例如它们各自的结晶形式。活性成分也可以作为在合适的液体溶剂例如醇、脂肪烃、酯或在某些情况下液体二氧化碳中的溶液或分散体使用。在制备熔体时可以除去溶剂,例如将其蒸发。
202.熔体中还可以包含各种添加剂,例如流动调节剂(例如胶体二氧化硅)、粘合剂、润滑剂、填充剂、崩解剂、增塑剂、着色剂或稳定剂(例如抗氧化剂、光稳定剂、自由基清除剂和针对微生物攻击的稳定剂)。
203.熔化和/或混合可以在通常用于该目的的设备中进行。特别合适的是挤出机或捏合机。适合挤出机包含单螺杆挤出机、啮合型螺杆挤出机或多螺杆挤出机,优选地双螺杆挤出机,所述挤出机可同向旋转或反向旋转,并且任选地装备有捏合盘。应了解,工作温度将由挤出机的种类或所用挤出机内配置的种类决定。挤出机中熔融、混合和溶解组分所需能量的一部分可由加热元件提供。然而,挤出机中材料的摩擦和剪切也可向混合物提供大量能量并有助于形成所述组分的均质熔体。
204.熔体的范围可以从稀薄到糊状再到粘稠。挤出物的成型可以方便地通过压延机进行,该压延机具有两个反向旋转的辊子,在它们的表面上具有相互匹配的凹陷。可以冷却挤出物并使其固化。挤出物也可以在凝固前(热切)或凝固后(冷切)切成碎片。
205.固化的挤出产品可以进一步研磨、磨碎或以其他方式减小成颗粒。固化的挤出物以及产生的每个颗粒包含活性成分在基质中的固体分散体,优选固溶体,所述基质由药学上可接受的亲水性聚合物和药学上可接受的表面活性剂组成。挤出产品也可以在研磨或磨碎成颗粒之前与其他活性成分和/或添加剂混合。颗粒可以进一步加工成合适的固体口服剂型。
206.在一个实例中,将共聚维酮和一种或多种表面活性剂(例如,维生素e tpgs)混合并造粒,然后添加气雾剂和感兴趣的化合物。将混合物研磨,然后进行挤出。如此产生的挤出物可被研磨和筛分以进一步加工以制造胶囊或片剂或小片剂。本实例中使用的表面活性剂可以例如通过挤出过程中的液体计量加入。
207.优选地,在其中化合物1和化合物2被包括在片剂中分开的层中的本发明的任何方面、实施方案、实例、优选和组合物中,化合物1在155℃至180℃的温度熔融挤出和化合物2在150℃至195℃的温度熔融挤出。对于这些情况,化合物2也可以在150至低于222℃的温度下熔融挤出。
208.已经发现难以产生可接受的无定形化合物2挤出物。例如,用于挤出的结晶化合物2的粒度分布(psd)显示出对挤出物外观有显著影响:颗粒越大,获得具有残余结晶度的混浊挤出物的风险就越高。因此,优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成中值颗粒尺寸(d50)不超过15μm的颗粒。更优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成中值颗粒尺寸(d50)不超过10μm的颗粒。高度优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成中值颗粒尺寸不超过9μm的颗粒。
209.而且,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d90不超过100μm的颗粒。更优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d90不超过80μm的颗粒。高度优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d90不超过60μm的颗粒。
210.优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d50不超过15μm和d90不超过100μm的颗粒。更优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d50不超过10μm和d90不超过80μm的颗粒。高度优选地,在其中化合物1和化合物2包含在片剂中的单独层中的本发明的任何方面、实施方案、实例、优选和组合物中,在熔融挤出之前,将结晶化合物2研磨成d50不超过9μm和d90不超过60μm的颗粒。
211.如本文所用,粒度通过使用mastersizer的激光衍射测量。d90是指这样的粒径,在其以下90%的颗粒存在。
212.如果需要,通过喷雾干燥的溶剂蒸发方法提供了允许在较低温度下加工的优点,并允许对工艺进行其他修改以进一步改善粉末性能。如果需要,然后可以进一步配制喷雾干燥的粉末,并且最终药物产品在是否需要胶囊、片剂、小片剂或任何其他固体剂型方面是灵活的。
213.示例性喷雾干燥工艺和喷雾干燥设备在k.masters,spray drying handbook(halstead出版社,纽约,第4版,1985)中描述。适用于本发明的喷雾干燥装置的非限制性实例包括由niro inc.或gea process engineering inc.、buchi labortechnik ag和spray drying systems,inc.制造的喷雾干燥器。喷雾干燥过程通常涉及将液体混合物破碎成小液滴,并在容器(喷雾干燥装置)中快速去除液滴中的溶剂,在容器中存在强大的驱动力从液滴中蒸发溶剂。雾化技术包括,例如,双流体或压力喷嘴,或旋转雾化器。例如,可以通过在干燥液滴的温度下将喷雾干燥设备中的溶剂分压保持在远低于溶剂蒸气压的水平来提供用于溶剂蒸发的强驱动力。这可以通过以下任一方式实现:(1)将喷雾干燥设备中的压力保持在部分真空;(2)将液滴与温热的干燥气体(例如加热的氮气)混合;或(3)两者。
214.可以选择干燥气体的温度和流速,以及喷雾干燥器的设计,以便液滴在到达设备壁时足够干燥。这有助于确保干燥的液滴基本上是固体并且可以形成细粉并且不会粘在设备壁上。喷雾干燥的产品可以通过手动、气动、机械或其他合适的方式移除材料来收集。达到优选干燥水平的实际时间长度取决于液滴的大小、配方和喷雾干燥器的操作。在固化之后,固体粉末可以在喷雾干燥室中停留额外的时间(例如,5
‑
60秒)以进一步从固体粉末中蒸发溶剂。当固体分散体离开干燥器时,固体分散体中的最终溶剂含量优选处于足够低的水平以提高最终产品的稳定性。例如,喷雾干燥粉末的残留溶剂含量可以小于2重量%。高度优选地,残留溶剂含量在国际协调会议(ich)指南中规定的限度内。此外,将喷雾干燥的组合物进一步干燥以将残留溶剂降低到甚至更低的水平可能是有用的。进一步降低溶剂含量的方法包括但不限于流化床干燥、红外线干燥、滚筒干燥、真空干燥以及这些方法的组合和其他方法。
215.与上述固体挤出物一样,喷雾干燥产品包含活性成分在由药学上可接受的亲水性聚合物和药学上可接受的表面活性剂组成的基质中的固体分散体,优选固溶体。
216.在加入喷雾干燥器之前,可以在溶剂中溶解活性成分(例如化合物1或化合物2)、药学上可接受的亲水性聚合物以及其他赋形剂例如药学上可接受的表面活性剂。合适的溶剂包括但不限于烷醇(例如甲醇、乙醇、1
‑
丙醇、2
‑
丙醇或其混合物)、丙酮、丙酮/水、烷醇/水混合物(例如乙醇/水混合物),或其组合。溶液也可以在送入喷雾干燥器之前预热。
217.通过熔融挤出、喷雾干燥或其他技术生产的固体分散体可以制备成任何合适的固体口服剂型。在一种实施方案中,可以将通过熔融挤出、喷雾干燥或其他技术制备的固体分散体(例如,挤出物或喷雾干燥的粉末)压制成片剂或小片剂。固体分散体可以直接压缩,或者在压缩前研磨或磨碎成颗粒或粉末。可以在压片机中(如在两个移动冲头之间的钢模中)完成压缩。
218.至少一种选自流动调节剂、粘合剂、润滑剂、填料、崩解剂或增塑剂的添加剂可用于压缩固体分散体。这些添加剂可以在压实之前与研磨或磨碎的固体分散体混合。崩解剂
促进胃中压块的快速崩解并使释放的颗粒彼此分开。合适崩解剂的非限制性实例是交联聚合物,例如交联聚乙烯吡咯烷酮、交联羧甲基纤维素钠或交联羧甲纤维素钠。合适的填料(也称为填充剂)的非限制性实例是乳糖一水合物、磷酸氢钙、微晶纤维素(例如avicell)、硅酸盐,特别是二氧化硅、氧化镁、滑石、马铃薯或玉米淀粉、异麦芽酮糖醇或聚乙烯醇。合适的流量调节剂的非限制性实例包括高度分散的二氧化硅(例如胶体二氧化硅,例如aerosil),以及动物或植物脂肪或蜡。合适的润滑剂的非限制性实例包含聚乙二醇(例如,分子量为1000到6000)、硬脂酸镁和硬脂酸钙、硬脂酰富马酸钠等。
219.各种其他添加剂或成分也可用于制备本发明的固体组合物,例如染料如偶氮染料、有机或无机颜料如氧化铝或二氧化钛,或天然来源的染料;稳定剂,例如抗氧化剂、光稳定剂、自由基清除剂、抗微生物攻击的稳定剂;或其他活性药物成分。
220.为了便于固体剂型的摄入,使剂型具有合适的形状是有利的。因此,可以舒适吞咽的大片剂优选是细长的而不是圆形的。
221.片剂上的膜包衣进一步有助于使片剂易于吞咽。膜包衣也改善口感并提供高雅外观。膜包衣通常包含聚合物成膜材料,如聚乙烯醇、羟丙基甲基纤维素、羟丙基纤维素和丙烯酸酯或甲基丙烯酸酯共聚物。除了成膜聚合物之外,薄膜包衣可以进一步包括增塑剂(例如,聚乙二醇)、表面活性剂(例如,聚山梨醇酯)和任选的色素(例如,二氧化钛或氧化铁)。例如,二氧化钛可用作遮光剂;和/或氧化铁红可用作着色剂。膜包衣还可包含填料,例如乳糖。膜包衣还可以包括滑石作为抗粘合剂。优选地,膜包衣占本发明的药物组合物的小于5重量%。也可以使用更高量的膜包衣。
222.本发明中使用的所有小片也可以进行膜包衣。优选地,膜包衣占每个小片的不超过30重量%。更优选地,膜包衣占每个小片的10
‑
20重量%。
223.本发明还意外地发现,为了使本文所述的小片剂提供与在相同固体分散体制剂中含有相同量药物的常规片剂类似的足够生物利用度,小片剂需要与食物一起施用。人体临床研究表明,食物可以显著提高配制成小片剂和固体分散体形式的化合物1和化合物2的生物利用度。例如,在没有食物的情况下,含有200mg化合物1的小片剂提供的auc比在与小片剂相同的固体分散体制剂中含有相同量的化合物1的两种常规片剂所提供的auc低41%。相比之下,当与食物一起施用时,小片剂提供的auc仅比常规片剂提供的低5%。同样,当不与食物一起施用时,含有120mg化合物2的小片剂提供的auc比在与小片剂相同的固体分散体制剂中含有相同量的化合物2的三种常规片剂提供的auc低28%;然而,当与食物一起施用时,小片剂提供的auc比常规片剂提供的auc高6%。常规片剂的所有参考auc均在禁食条件下测量。
224.因此,本发明的特征在于治疗hcv感染的方法,其中所述方法包括将本发明的固体药物组合物与食物一起施用至有需要的患者,所述固体药物组合物含有小片剂,使得由所述药物组合物提供的化合物1auc与由在与固体药物组合物相同的固体分散体制剂中包含相同量的化合物1的常规片剂提供的化合物1auc的比率为0.8至1.25,并且由固体药物组合物提供的化合物2auc与由与固体药物组合物相同的固体分散体制剂中包含相同量的化合物2的常规片剂提供的化合物2auc的比率为0.8至1.25。所有auc均为人类auc,常规片剂的所有auc均在禁食条件下施用常规片剂时测量。在这些方法中可以使用本文所述的包含小片剂的任何组合物。患者可能感染了hcv基因型1、2、3、4、5或6。
225.在另一方面,本发明的特征在于治疗hcv感染的方法,其中所述方法包括将本发明的固体药物组合物与食物一起施用至有需要的患者,所述固体药物组合物含有小片剂,使得由所述药物组合物提供的化合物1auc与由在与固体药物组合物相同的固体分散体制剂中包含相同量的化合物1(例如100mg)的常规片剂提供的化合物1auc的比率为0.8至1.25,并且由固体药物组合物提供的化合物2auc与由与固体药物组合物相同的固体分散体制剂中包含相同量的化合物2(例如40mg)的常规片剂提供的化合物2auc的比率为0.8至1.25。所有auc均为人类auc,常规片剂的所有auc均在禁食条件下施用常规片剂时测量。在这些方法中可以使用本文所述的包含小片剂的任何组合物。患者可能感染了hcv基因型1、2、3、4、5或6。
226.一方面,本公开提供了一种口服剂型,其包含在分配容器中的粉末、丸剂和/或颗粒剂(例如,膜包衣颗粒剂)。在某些实施方案中,本文所述的膜包衣颗粒包含在分配容器中。分配容器的例子包括管子、小包或小袋,以及单独的包装纸。在一些此类实施方案中,本文所述的膜包衣颗粒包含在小袋中。这种小袋通常由纸、箔和/或塑料膜制成。
227.在一些实施方案中,口服剂型包括含有化合物1的膜包衣颗粒和包含化合物2的膜包衣颗粒,其中这样的膜包衣颗粒共同包装在分配容器中,优选小袋中。在一些实施方案中,小袋可包含一个单位剂量的组合物或其约数,例如,包含约50mg化合物1的约319.0mg膜包衣颗粒和/或包含约20mg化合物2的约242.4mg膜包衣颗粒。
228.在某些实施方案中,单独的分配容器(例如,小袋)包含约40mg化合物1和约20mg化合物2,或者约45mg化合物1和约20mg化合物2,或者约50mg化合物1和约20mg化合物2,或者约55mg化合物1和约20mg化合物2,或者约40mg化合物1和约15mg化合物2,或者约45mg化合物1和约15mg化合物2,或者约50mg化合物1和约15mg化合物2,或者约55mg化合物1和约15mg化合物2。
229.在某些实施方案中,单独的分配容器(例如,小袋)包括第一量的化合物1和第二量的化合物2,其中第一和第二量分别地各自是所需剂量的化合物1和化合物2的约数。
230.在一些这样的实施方案中,小袋包含第一量的化合物1,其中第一量是120和165mg之间、或者130和165mg之间、或者160和245mg之间、或者180和220mg之间、或者在210和285mg之间、或者225和275mg之间的剂量的约数。在特定实施方案中,第一量是约150、200和/或250mg的剂量的约数。在一个特定实施方案中,第一量是约150、200和200mg的剂量的约数(例如,5、10、25或50mg)。
231.在一些这样的实施方案中,小袋包含第二量的化合物2,其中第二量是45和75mg之间、或者60和75mg之间、或者60和90mg之间、或者65和90mg之间、或者75和110mg之间、或者85和110mg之间的剂量的约数。在特定实施方案中,第二量是约60、80和/或100mg的剂量的约数。在一个特定实施方中,第二量是约60、80和100mg的剂量的约数(例如,4、5、10或20mg)。
232.在另一方面,本公开提供用于治疗hcv感染的方法,其中所述方法包括向有需要的患者施用包含第一膜包衣颗粒和第二膜包衣颗粒的口服剂型,其中所述第一膜包衣颗粒含有化合物1,第二膜包衣颗粒含有化合物2。
233.在某些实施方案中,第一膜包衣颗粒和第二膜包衣颗粒共同包装在分配容器例如小袋中。
234.在某些实施方案中,患者是儿科患者。
235.在这些方法中可以使用本文所述的包含颗粒的任何组合物。患者可能感染了hcv基因型1、2、3、4、5或6。
236.在又一方面,本公开提供用于治疗儿科患者的hcv感染的方法,其中所述方法包括向患者施用化合物1和化合物2。
237.在某些实施方案中,儿科患者为3岁至小于6岁并且化合物1以约120至约165mg、优选约135至约165mg的剂量施用。在某些实施方案中,儿科患者为6岁至小于9岁且化合物1以约160至约220mg、优选约180至约220mg的剂量施用。在某些实施方案中,儿科患者为9岁至小于12岁且化合物1以约210至约285mg、优选约225至约275mg的剂量施用。
238.在某些实施方案中,儿科患者的年龄为3岁至小于6岁并且化合物2以约45至约75mg的剂量施用。在某些实施方案中,儿科患者的年龄为6岁至小于9岁且化合物2以约60至约90mg的剂量施用。在某些实施方案中,儿科患者的年龄为9岁至小于12岁并且化合物1以约75至约110mg的剂量施用。
239.在某些实施方案中,(i)儿科患者的年龄为3岁至小于6岁,化合物1的施用剂量约为150mg,化合物2的施用剂量约为60mg;(ii)患者的年龄为6岁至小于9岁,化合物1的施用剂量约为200mg,化合物2的施用剂量约为80mg;或(iii)患者为9岁至小于12岁,化合物1的施用剂量为约250mg,化合物2的施用剂量为约100mg。
240.在某些实施方案中,儿科患者的年龄为3岁至小于6岁,化合物1的施用剂量约为150mg,化合物2的施用剂量约为60mg。在某些实施方案中儿科患者的年龄为6岁至小于9岁,化合物1的施用剂量约为200mg,化合物2的施用剂量约为80mg。在某些实施方案中儿科患者为9岁至小于12岁,化合物1的施用剂量为约250mg,化合物2的施用剂量为约100mg。
241.在某些实施方案中,儿科患者的年龄为3岁至小于6岁,化合物1以约150mg的剂量施用,化合物2以约60mg的剂量施用,并且患者在治疗后约12周获得持续病毒学应答(svr12)。在某些实施方案中,儿科患者的年龄为6岁至小于9岁,化合物1以约200mg的剂量施用,化合物2以约80mg的剂量施用,并且患者在治疗后约12周获得持续病毒学应答(smr12)。在某些实施方案中,儿科患者的年龄为9岁至小于12岁,化合物1以约250mg的剂量施用,化合物2以约100mg的剂量施用,并且患者在治疗后约12周获得持续病毒学应答(svr12)。
242.在某些实施方案中,化合物1从包含无定形固体分散体的第一类型膜包衣颗粒施用,所述无定形固体分散体包括(i)化合物1、(ii)共聚维酮和(iii)维生素e tpgs。在一些此类实施方案中,第一类型颗粒中化合物1的总量为50mg。
243.在某些实施方案中,化合物2从包含无定形固体分散体的第二类型的膜包衣颗粒施用,所述无定形固体分散体包括(i)化合物2、(ii)共聚维酮和(iii)维生素e tpgs和丙二醇单辛酸酯。在一些此类实施方案中,第二类型颗粒中化合物2的总量为20mg。
244.因此,本发明的特征在于治疗hcv感染的方法,其中该方法包括向有需要的儿科患者施用含有化合物1的第一类型的膜包衣颗粒和含有化合物2的第二类型的膜包衣颗粒,使得由第一类型的膜包衣颗粒提供的化合物1auc与由向成年患者施用包含100mg化合物1的片剂提供的化合物1auc的比率为0.8至1.25,并且由第二类型的膜包衣颗粒提供的化合物2auc与由向成年患者施用包含40mg化合物2的片剂提供的化合物2auc的比率为0.8至1.25。
所有auc均为人类auc,常规片剂的所有auc均在禁食条件下施用常规片剂时测量。
245.在某些实施方案中,施用第一类型的膜包衣颗粒产生的化合物1auc与施用包含100mg化合物1的片剂产生的化合物1auc是生物等效的,以及施用第二类型的膜包衣颗粒产生的化合物2auc与施用包含40mg化合物2的片剂产生的化合物2auc是生物等效的。所有auc均为人类auc,常规片剂的所有auc均在禁食条件下施用常规片剂时测量。
246.在某些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约8670
±
268ng
·
h/ml。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约5970
±
179ng
·
h/ml。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约6700
±
244ng
·
h/ml。
247.在某些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约8420ng
·
h/ml和约8938ng
·
h/ml之间。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约5791ng
·
h/ml和约6149ng
·
h/ml之间。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约6456ng
·
h/ml和约6944ng
·
h/ml之间。
248.在某些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc是化合物1几何平均auc的约80%至约125%。例如,在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约6936ng
·
h/ml和约10838ng
·
h/ml之间。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约4776ng
·
h/ml和约7463ng
·
h/ml之间。在一些实施方案中,由第一类型的膜包衣颗粒提供的化合物1auc为约5360ng
·
h/ml和约8375ng
·
h/ml之间。
249.在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约2300
±
114ng
·
h/ml。在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1520
±
72ng
·
h/ml。在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1660
±
59ng
·
h/ml。
250.在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约2186ng
·
h/ml和约2414ng
·
h/ml之间。在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1448ng
·
h/ml和约1592ng
·
h/ml之间。在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1601ng
·
h/ml和约1719ng
·
h/ml之间。
251.在某些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc是化合物2几何平均auc的约80%至约125%。例如,在一些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1840ng
·
h/ml和约2875ng
·
h/ml之间。在一些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1216ng
·
h/ml和约1900ng
·
h/ml之间。在一些实施方案中,由第二类型的膜包衣颗粒提供的化合物2auc为约1328ng
·
h/ml和约2075ng
·
h/ml之间。
252.在某些实施方案中,第一膜包衣颗粒和第二膜包衣颗粒共同包装在分配容器例如小袋中。
253.在这些方法中可以使用本文所述的包含颗粒的任何组合物。患者可能感染了hcv基因型1、2、3、4、5或6。
254.可使用各种量度来表达本发明的方法的有效性。一种此类量度是svr,其如本文所用,意指在治疗结束时和治疗结束后持续至少8周检测不到病毒(svr8);优选地,在治疗结
束时和治疗结束后持续至少12周检测不到病毒(svr12);更优选地,在治疗结束时和治疗结束后持续至少16周检测不到病毒(svr16);并且高度优选地,在治疗结束时和治疗结束后持续至少24周检测不到病毒(svr24)。svr24通常被认为是治愈的功能定义;且治疗后不到24周时的高svr率(例如svr8或svr12)可以预测高svr24率。
255.优选地,本文描述的方法达到至少70%的svr8。更优选地,本文描述的方法达到至少80%的svr8。高度优选地,本文描述的方法达到至少90%的svr8。最优选地,本文描述的方法达到至少95%的svr8。在某些实施方案中,用本文所述方法治疗的患者在治疗后第8周获得持续病毒学应答(svr8)。
256.优选地,本文描述的方法达到至少70%的svr12。更优选地,本文描述的方法达到至少80%的svr12。高度优选地,本文描述的方法达到至少90%的svr12。最优选地,本文描述的方法达到至少95%的svr12。在某些实施方案中,用本文所述方法治疗的患者在治疗后第12周获得持续病毒学应答(svr12)。
257.优选地,本文描述的方法达到至少70%的svr16。更优选地,本文描述的方法达到至少80%的svr16。高度优选地,本文描述的方法达到至少90%的svr16。在某些实施方案中,用本文所述方法治疗的患者在治疗后第16周获得持续病毒学应答(svr16)。
258.优选地,本文描述的方法达到至少70%的svr24。更优选地,本文描述的方法达到至少80%的svr24。高度优选地,本文描述的方法达到至少90%的svr24。在某些实施方案中,用本文所述方法治疗的患者在治疗后第24周获得持续病毒学应答(svr24)。
259.应当理解,上述实施方案和以下实施例是通过举例而非限制的方式给出的。根据本说明书,本发明范围内的各种改变和修改对本领域技术人员将变得显而易见。
260.实施例1.双层膜包衣片
261.将100mg化合物1和40mg化合物2制备成双层膜包衣片。双层膜包衣片的组成见表1a或表1b。片芯由两层组成,每一层分别基于包含化合物1(表2)和化合物2(表3)的挤出物中间体。压片用基于羟丙甲纤维素作为非功能性包衣的包衣制剂进行膜包衣。
262.表1a.化合物1/化合物2,100mg/40mg双层膜包衣片的组成
263.264.表1b.化合物1/化合物2,100mg/40mg双层膜包衣片的组成
[0265][0266]
表2.化合物1,20%挤出造粒的组成
[0267][0268]
表3.化合物2,10%挤出造粒的组成
[0269][0270]
实施例2.小片剂
[0271]
可以分别使用实施例1的表2和3中描述的挤出物制备含有化合物1或化合物2的小片剂。化合物1小片剂的制造可包括以下步骤:将化合物1挤出物(例如,实施例1的表2中所述的挤出物)研磨,然后与交联羧甲基纤维素、胶体二氧化硅和硬脂富马酸钠混合,然后用korsch xl 100轮转压片机,使用19倍2mm压片工具压片。
[0272]
化合物2小片剂的制造可包括以下步骤:将化合物2挤出物(例如,实施例1的表3中所述的挤出物)研磨,然后与胶体二氧化硅和硬脂富马酸钠混合,然后用korsch xl 100轮转压片机,使用19倍2mm压片工具压片。
[0273]
实施例3.包含在小袋中的膜包衣颗粒
[0274]
包含化合物1或化合物的颗粒通过将挤出物与颗粒外赋形剂共混来制备,如上文实施例1和2中一般描述的。将研磨的包含化合物1的挤出物共混物压制成颗粒(2mm,直径)并用基于羟丙甲纤维素作为非功能性包衣的包衣制剂进行膜包衣。类似地,将研磨的包含化合物2的挤出物共混物单独压制成颗粒(2mm,直径)并单独用基于羟丙甲纤维素作为非功能性包衣的包衣制剂进行膜包衣。然后将膜包衣颗粒混合在小袋中。
[0275]
包含化合物1的膜包衣颗粒的组成示于表4中。
[0276]
表4.化合物1,15.7%膜包衣颗粒的组成
[0277][0278]
包含化合物2的膜包衣颗粒的组成示于表5中。
[0279]
表5.化合物2,8.3%膜包衣颗粒的组成
[0280][0281]
将表4的膜包衣颗粒与表5的膜包衣颗粒一起装入小袋中以产生50mg化合物1/20mg化合物2小袋。
[0282]
实施例4.化合物1/化合物2双层片的生物利用度以及食物作用
[0283]
进行了1期、单剂量、四阶段、随机、完全交叉的临床试验,以确定化合物1/化合物2膜包衣双层片的生物利用度和食物作用。表1b中描述的片剂用于方案a、b和c,含有化合物1或化合物2的单独片剂用于方案d。
[0284]
受试者在每个阶段的第1天服用单剂的化合物1/化合物2。两次给药之间有4天的洗脱期。
[0285]
i.方案a和d:在禁食条件下服用研究药物。
[0286]
ii方案b:在中等脂肪早餐(来自脂肪的约30%卡路里)开始后约30分钟服用研究药物。
[0287]
iii.方案c:在高脂肪早餐(来自脂肪的约50%卡路里)开始后约30分钟服用研究药物。
[0288]
研究设计汇总在表6a和6b中。对于方案a、b和c,单剂量由表1b的三种片剂组成,每片剂含有100mg/40mg化合物1/化合物2。对于方案d,单剂量包含化合物1的三种片剂,每片剂包含100mg化合物1,以及化合物2的三种片剂,每片剂包含40mg化合物2。
[0289]
表6a.单剂量、四阶段、完整交叉的临床研究设计
[0290][0291]
表6b.单剂量、四阶段、完整交叉的临床研究设计
[0292][0293]
表7a显示了这些研究中化合物1的药代动力学特征,以及食物对化合物1生物利用度的影响。表7b显示了化合物2的药代动力学特征,以及食物对化合物2生物利用度的影响。
[0294]
表7a.化合物1药代动力学参数((几何平均(平均,cv%))
[0295]
药代动力学参数单位方案a(n=23)方案b(n=23)方案c(n=23)方案d(n=23)c
max
ng/ml294(384,78)937(1193,84)633(723,54)803(973,72)t
maxa
h3.0(1.5至5.0)4.0(3.0至5.0)5.0(4.0至6.0)2.0(1.0至3.0)t
1/2b
h6.0(24)6.0(16)6.3(18)5.7(16)auc
t
ng
·
h/ml1150(1430,70)3040(3460,60)2110(2390,54)2620(2970,53)auc
inf
ng
·
h/ml1150(1440,69)3040(3470,60)2120(2390,54)2620(2980,53)
[0296]
a.中位数(最小值到最大值)
[0297]
b.调和平均值(伪%cv)
[0298]
表7b.化合物2药代动力学参数((几何平均(平均,cv%))
[0299]
药代动力学参数单位方案a(n=23)方案b(n=23)方案c(n=23)方案d(n=23)c
max
ng/ml116(140,60)221(239,44)237(262,45)175(192,38)t
maxa
h4.0(2.0至5.0)5.0(3.0至5.0)5.0(4.0至6.0)4.0(2.0至5.0)t
1/2b
h13.3(9)13.0(10)13.5(9)12.5(8)auc
t
ng
·
h/ml910(1100,64)1280(1400,49)1390(1560,49)1420(1570,40)auc
inf
ng
·
h/ml960(1160,64)1350(1480,49)1460(1650,50)1490(1650,40)
[0300]
a.中位数(最小值到最大值)
[0301]
b.调和平均值(伪%cv)
[0302]
上述研究表明,与食物一起施用显著提高了化合物1和化合物2的生物利用度,并且在食物中的脂肪含量方面实现了改善。将膜包衣的与未包衣的双层片剂进行比较的其他研究进一步表明,膜包衣对共配制的化合物1和化合物2的生物利用度的影响最小。
[0303]
实施例5.化合物1/化合物2小片剂的生物利用度
[0304]
14名受试者参加了这项研究,并服用在小片剂中的共配制的化合物1/化合物2。研究设计汇总在表8a和8b中。一名受试者在第2阶段(方案g)的给药期间洒了4片小药片(总共100
‑
150片小药片)并且没有被排除在分析之外。根据与实施例2中描述的方法类似的方法制备小片剂。
[0305]
表8a.单剂量、交叉临床研究设计
[0306][0307]
表8b.单剂量、交叉临床研究设计
[0308][0309]
表9a显示了这些研究中化合物1的药代动力学特征,以及食物对化合物1生物利用度的影响。表9b显示了化合物2的药代动力学特征,以及食物对化合物2生物利用度的影响。
[0310]
表9a.化合物1药代动力学参数((几何平均(平均,cv%))
[0311]
药代动力学参数单位方案f(n=14)方案g(n=14)方案j(n=14)c
max
ng/ml123(164,103)166(314,209)212(333,159)t
maxa
h1.0(0.5至4.0)1.75(1.0至4.0)1.5(0.5至3.0)t
1/2b
h5.61(29)6.42(31)5.93(39)auc
t
ng
·
h/ml428(598,107)699(1020,150)738(1150,165)auc
inf
ng
·
h/ml432(602,107)704(1020,149)742(1160,164)
[0312]
a.中位数(最小值到最大值)
[0313]
b.调和平均值(伪%cv)
[0314]
表9b.化合物2药代动力学参数((几何平均(平均,cv%))
[0315]
药代动力学参数单位方案f(n=14)方案g(n=14)方案j(n=14)c
max
ng/ml96.0(110,61)177(198,55)139(169,75)t
maxa
h4.0(2.0至6.0)3.0(3.0至5.0)4.5(1.5至6.0)t
1/2b
h13.4(15)13.2(10)13.3(7)auc
t
ng
·
h/ml863(1050,80)1250(1480,70)1190(1570,91)auc
inf
ng
·
h/ml913(1110,80)1320(1560,71)1260(1660,92)
[0316]
a.中位数(最小值到最大值)
[0317]
b.调和平均值(伪%cv)
[0318]
上述研究表明,当以共同配制的小片剂递送时,与食物一起施用显著增加了化合物1和化合物2的生物利用度。
[0319]
实施例6.化合物1/化合物2膜包衣颗粒的生物利用度
[0320]
该研究旨在评估稳态auc并评估化合物1/化合物2在不同年龄组的儿科受试者中的药代动力学(pk)。令人惊讶的是,由于化合物1和化合物2之间的药物相互作用、化合物1和化合物2在研究年龄组中的非线性药代动力学特征以及其他预料之外的变量,该研究并不简单。
[0321]
受试者被纳入该研究并如上文实施例3中一般描述的那样给予含有化合物1/化合物2的膜包衣颗粒。研究组汇总在表10中。
[0322]
表10.第一组和第二组受试者的给药
[0323][0324]
在第2周就诊时进行了一次强化pk样品抽取,在给药前(0小时)和给药后2、4、6和12小时采集血样。
[0325]
调整前组。
[0326]
表11a显示了调整前组中化合物1的药代动力学特征。表11b显示了调整前组中化合物2的药代动力学特征。
[0327]
目标auc源自接受化合物1和化合物2的成年受试者群体的auc值的几何平均值。化合物1的目标auc确定为4800hr*ng/ml。化合物2的目标auc确定为1430hr*ng/ml。
[0328]
表11a.调整前受试者第2周的化合物1auc值
[0329]
组几何平均值(%cv)目标auc/auc
9至<12岁4070(211)1.186至<9岁1680(94)2.863至<6岁3030(52)1.58
[0330]
表11b.调整前受试者第2周的化合物2auc值
[0331]
组几何平均值(%cv)目标auc/auc9至<12岁1250(79)1.146至<9岁987(87)1.443至<6岁871(63)1.64
[0332]
如表11a和11b所示,每个群组的平均暴露量低于目标auc。
[0333]
调整后组。
[0334]
用调整前剂量(每小袋40mg化合物1 15mg化合物)观察到的低于预期的auc值导致后续受试者的剂量调整。
[0335]
表12a显示了调整后组中化合物1的药代动力学特征。表12b显示了调整后组中化合物2的药代动力学特征。
[0336]
表12a.调整后受试者第2周的化合物1auc和c
谷
值
[0337][0338]
表12b.调整后受试者第2周的化合物2auc和c谷值
[0339][0340]
基于研究中收集的所有pk信息(包括来自其他研究周的数据)的化合物1/化合物2
的预测pk暴露(“pop
‑
pk auc”)显示在表13和表13a中。
[0341]
表13.化合物1/化合物2auc/目标auc比率
[0342][0343]
在3个儿科受试者群组中,化合物1的auc/auc
目标
几何平均比率为1.08至1.31,化合物2的为1.00至1.02。
[0344]
表13a.化合物1/化合物2auc/目标auc比率
[0345][0346]
在3个儿科受试者群组中,化合物1的auc/auc
目标
几何平均比率为1.07至1.87,化合物2的为1.22至1.64。
[0347]
实施例7.小儿患者的治疗
[0348]
3岁至12岁以下,体重12公斤至45公斤以下的儿童
[0349]
表14和表15中提供了hcv基因型1、2、3、4、5或6感染的代偿性肝病(伴或不伴肝硬化)患者的推荐治疗持续时间。表16显示了基于儿童体重的小袋数量和剂量。小袋应与食物一起服用,每天一次。
[0350]
表14:未接受过先前hcv治疗的患者的推荐治疗持续时间
[0351][0352]
表15:先前使用peg
‑
ifn 利巴韦林 /
‑
索非布韦或索非布韦 利巴韦林治疗失败的患者的推荐治疗持续时间
[0353][0354]
表16:3至<12岁儿童的推荐剂量
[0355][0356]
成人剂量的化合物1/化合物2片剂应用于体重45kg或更重的儿童。
[0357]
包衣颗粒制剂拟用于3至12岁以下或体重12公斤至45公斤以下的儿童。体重45公斤或以上的儿童应使用片剂制剂。由于制剂具有不同的药代动力学特征,片剂和包衣颗粒不可互换。
[0358]
施用方法
[0359]
用于口服施用的小袋中包衣颗粒
[0360]
应指导患者与食物一起每天服用一次推荐剂量。
[0361]
此外,每日总剂量的颗粒应撒在少量含水量低的软食物上,这些食物会粘在勺子上,无需咀嚼即可吞咽(例如,花生酱、巧克力榛子酱、软/奶油奶酪、浓果酱或希腊酸奶)。
[0362]
不应使用会从勺子上滴落或滑落的液体或食物,因为药物可能会迅速溶解并变得不那么有效。
[0363]
食物与颗粒的混合物应立即吞咽;颗粒不应被压碎或咀嚼。
[0364]
临床疗效和安全性
[0365]
dora(第2部分)是一项开放标签研究,旨在评估48名3岁至12岁以下儿童的安全性和疗效,这些儿童接受小袋中的基于体重的包衣颗粒以口服施用8周。18名受试者接受初始较低剂量,30名受试者接受最终推荐剂量。中位年龄为7岁(范围:3至11岁);75%有hcv基因型1;23%有hcv基因型3;2%有hcv基因型4;60%是女性;6%是黑人;均未接受过hcv治疗;没有人患肝硬化;平均体重为26公斤(范围:13至44公斤)。在接受推荐剂量的受试者中,svr12率为100%(30/30)。服用推荐剂量的受试者均未出现病毒学失败。
[0366]
在根据患者体重推荐的剂量下,化合物1和化合物2在3至<12岁儿童中的暴露量与12岁至<18岁的青少年和2/3期研究的成人中的暴露量相当。
[0367]
药代动力学特性
[0368]
化合物1/化合物2的药代动力学特性提供于表17。
[0369]
表17:化合物1/化合物2的组分在健康受试者中的药代动力学特性
[0370][0371]
a.在健康受试者中单剂的化合物1和化合物2后的中位t
max
。
[0372]
b.中等至高脂肪膳食的平均全身暴露。
[0373]
c.在质量平衡研究中[
14
c]化合物1或[
14
c]化合物2的单剂施用。
[0374]
d.氧化代谢物或其副产物占放射性剂量的26%。在血浆中未观察到化合物1代谢物。
[0375]
本发明的前述描述提供说明和描述,但并不意图为穷尽性的或将本发明限于所公开的确切内容。有可能根据以上教示内容进行修改和改变,或可以从本发明的实践中获得修改和改变。因此,应注意,本发明的范围由权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。