:
1.本发明涉及电热传感技术和自动化控制技术领域。本方案可直接应用于呼吸道系统、消化道系统、结直肠道系统、宫颈阴道系统等人体自然通道内肿瘤病变组织(含良、恶性肿瘤病变组织)的无创热物理灭活的临床。
背景技术:
2.医学界公认,肿瘤细胞加热到40~43℃并持续20分钟就会发生死亡(即肿瘤细胞杀伤阀值);而正常组织细胞加热到45~47℃以上才开始逐渐死亡(即正常细胞杀伤阀值)(roemer,1999)。
3.现有热疗方法所面临的共同难题是,如何将热量定向输送到靶区肿瘤组织,既有效杀灭肿瘤组织而又不伤及正常组织。目前,各种热疗方法尚不具备实时测温功能,离临床应用均有很大距离,造成该状况的原因主要是受加热方式所限(《肿瘤热疗物理学》.p17.刘静.中科院理化所.2008.5)。
4.要想解决用温度热灭活肿瘤组织而又不伤及周边的正常组织这一难题,就必须实现理想的加热模式:即肿瘤组织被加热到其杀伤阀值温度即40~43℃以上,并维持以彻底摧毁病灶组织所需要的足够长的时间;同时肿瘤组织以外的正常组织要被控制在正常细胞杀伤阀值温度即45℃以下,避免肿瘤周围的正常组织或器官过热而受伤(《肿瘤热疗物理学》.p4.刘静.中科院理化所.2008.5)。
5.没有量的概念是不科学的。同样,没有对温度的准确把控,就没有肿瘤热疗(李鼎九,2003)。迄今为止,所有热疗在很大程度上不得不依靠医师的个人体会和经验进行控制,然而,经验背离于实际情况的结果在医疗中屡见不鲜(《肿瘤热疗技术与临床实践》.p107.刘珈.湖南省肿瘤医院放疗科热疗室主任.2009.8)。显然,若能符合肿瘤热疗的理想加热模式,对提高治疗准确性的把握度至关重要。
6.于是,要符合理想加热模式,真正实现肿瘤靶向热疗,医疗器械必须满足如下基本要求:
7.1、热量释放应尽可能只在目标区域(即肿瘤部位)产生足够高的温度,其余健康部位则处于安全温度范围。
8.2、恒温加热要持续治疗所需足够长的时间,目的是尽可能使肿瘤被热灭活的一次性。
9.3、肿瘤组织要全部包涵在40℃以上的温度内,以确保肿瘤组织被杀灭的完整性。
技术实现要素:
10.本发明设计了一种人体自然通道肿瘤无创靶向治疗镜,其解决的技术问题是:
11.为了改变目前人体各部位自然通道肿瘤病变组织因不当的治疗方式(如外科手术以及放、化疗)造成肿瘤患者极大痛苦和高复发率、高转移率而导致治疗无效的现状,本发明提供一种测控精准的、无创的、纯靶向的、热物理灭活人体自然通道肿瘤的治疗镜(系统)
及其治疗方法,根据临床需要,可以对人体自然通道内的目标组织(即良、恶性肿瘤病变组织)提供精准、实时、可控、恒定的、介于肿瘤细胞杀伤阀值与正常细胞杀伤阀值之间的温度,并持续足够长的恒温治疗时间(一般在20~40分钟),从而对腔道内不同位置的肿瘤病变组织实施一次性、完整性的热物理灭活,同时又不损伤邻近的正常组织细胞。
12.在以下说明中,会有一些图式说明,本技术图示并不代表部分组件的尺寸和比例,且有可能会将部分组件夸大表示以更佳地说明该组件相关之细节和特征。本说明书之目的并非限制以下实施例之内容。
13.人体自然通道肿瘤无创靶向治疗镜,包括:一带有视频图像采集单元11;一带有加热单元123;一带有测温单元121;一带有药物注入单元122;一带有可进入人体自然通道的软质套管1;
14.在本发明的一些实施例中,视频图像采集单元前端为透明半球罩111和视频镜112;
15.在本发明的一些实施例中,软质套管1前端至末端有刻度标注于软质套管1表面。
16.人体自然通道肿瘤无创靶向治疗控制器,包括:一带有可实时监测视频图像采集单元11的显示界面;一带有可控制加热单元123温度的电控箱及温度显示界面;一带有可实时监测温度单元121温度值的显示界面;一带有可控制药物注入单元122注射量的显示界面。
17.一种控制人体自然通道肿瘤无创靶向治疗的方法:控制器可以设定所述加热单元123最佳温度值;操作治疗镜进于所需治疗人体通道;观察控制器图像采集单元11的显示界面,当显示界面出现不规则肿瘤体始端31时,记录体外人体自然通道软质套管1上的刻度值,继续进入治疗镜至不规则肿瘤体末端32时,记录体外人体自然通道软质套管1上的刻度值,两次记录刻度值之差,即为不规则肿瘤体的长度;操作加热单元123于所需要治疗不规则肿瘤位置;操作控制器对所述加热单元123发出指令对治疗处进行加热,当所述测温单元121上升到设定温度值时,控制器会记录此时所述测温单元121的温度值,通过控制仪的控制,可以保证加热单元123的恒定温度值;通过控制器设定时间的加热,对人体自然通道肿瘤进行治疗。
18.在本发明的一些实施例中,设定温度值45~60℃之间范围内,根据不同情况,可以固定在一个温度值对患处恒温加热,也可实时变化所需温度值对患处进行加热。
19.在本发明的一些实施例中,设定时间在45分钟至240分钟的范围之内。
20.本发明的有益效果:
21.此方法由于利用了人体自然通道作为路径,避免了开刀、切除等大创伤方法带给患者的痛苦,真正实现无创、无痛的目的,不仅患者心理容易接受,而且有利于患者术后即时恢复健康常态。
22.此方法由于利用了镜头视频手段,医生可以通过视频,直视内部目标区域进行操作,在病变位置精准定位,真正实现了纯靶向治疗方法,有利于提高医生实施灭活术时的直观性和安全性。
23.此方法由于利用了低热灭活原理,且加热段同时具备超高精度的加温、测温和控温三种功能,不伤害临近正常组织,这便可以对病变组织持续临床所需足够长的加热灭活时间,从而达到肿瘤病变组织灭活的一次性和完整性。
24.此方法由于利用了低热灭活原理,被灭活的肿瘤病变组织没有被碳化、气化,因此就不会出现术后“吸收热”等多种并发症,更有利于人体快速吸收被灭活的肿瘤目标组织,使病变组织迅速在体内消失。
25.此方法由于被低热灭活的肿瘤病变组织细胞没有被碳化、气化,仍具有肿瘤细胞的基因特性和表达,在人体吸收这块被灭活的肿瘤病变组织过程中,它将大量释放具有本肿瘤细胞基因特性的抗原,激发机体产生抗肿瘤的免疫,有利于杀灭在周身游离的本肿瘤细胞,消除肿瘤转移、复发的可能性。
26.此方法由于可以激发机体产生抗肿瘤的免疫,因此对研制肿瘤疫苗具有重大意义。
27.此方法由于治疗全程采用了精准、实时、可视、可控方式方法,因此有利于调控手术进程和事后评估。
附图说明:
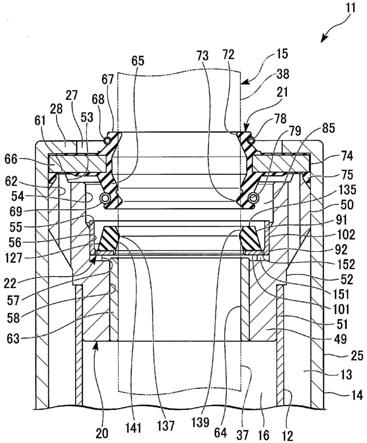
28.图1:是普通型号的治疗镜结构图;
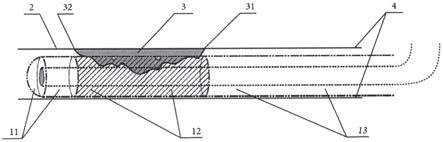
29.图2:是模拟人体自然通道内部生长的不规则肿瘤病变组织热灭活或药物热灭活原理图;
30.图3:是人体自然通道肿瘤无创靶向治疗镜的温度自动控制器的部件组成示意图;
31.图4:是人体自然通道肿瘤无创靶向治疗镜的视频镜显示仪的部件组成示意图;
32.图5:是加热治疗后恶性肿瘤组织内血管壁坏死病理形态学分析报告图;
33.图6:是加热治疗后恶性肿瘤组织内血管管腔闭塞病理形态学分析报告图;
34.图7:是加热治疗后恶性肿瘤组织广泛坏死病理形态学分析报告图;
35.图8:是加热治疗后恶性肿瘤组织广泛坏死病理形态学分析报告图;
36.图9:是加热治疗后恶性肿瘤组织内大量出现免疫淋巴细胞病理形态学分析报告图;
37.图10:是加热治疗后恶性肿瘤组织内大量出现免疫浆细胞病理形态学分析报告图。
38.图示,1、绝缘外壁软质套管;111、透明半球罩;112、视频镜;121、位于加热段边缘的温度传感器;122、药物注入孔;123、加热元件;11、视频图像采集段;12、加热段;13、导线传输段;14、手柄;15、导线;2、人体自然通道的内壁;3、内壁生长的不规则肿瘤病变组织;31、病变组织的始端;32、病变组织的终端;4、人体自然通道口。
具体实施方式:
39.本治疗镜是由相连的三部分即前端11、中端12和后端13三功能段组成(如图1),并由一套视频采集及自动化温度控制装置加以调控。前端11,是视频图像采集段,包括透明半球罩111和视频镜112;中端12,是可精准测控温度的加热段,包括位于加热段内部边缘的超高灵敏度(可在0.1秒传感0.1℃)微型温度传感器121、药物注入孔122和加热元件123,根据治疗部位和临床需要,制作材料可选用医用软硅胶等柔性绝缘热导体;后端13,是导线传输段,包括手柄14和若干根导线15。考虑人体不同部位肠、腔道的内径和缩张程度差异以及病变组织尺寸的不同,中端加热段12随着治疗镜的整体,可设计成粗、细、长、短不同的型号医
用级绝缘外壁软质套管1,套管外壁表面刻有毫米级长度单位。本治疗镜中的前端图像采集部分11、中端加热部分12中的温度传感器和加热元件等,由导线连接,与医用绝缘外壁软套管、手柄组成一个一体治疗镜体,经导线与控制装置连接,由触摸式控制屏幕进行手动或自动调控,构成视频采集与温度控制治疗镜系统。
40.如图1,在中端加热段12中,设置边缘的温度传感器121数值,预设其报警值为44℃(是介于肿瘤细胞与正常细胞杀伤阀值之间的温度),当中心加热元件123被通电加热升温后,根据热导体材料的热传导原理,经过短暂时间,加热段的边缘也随之开始升温,当边缘温度升至44℃并同时触发边缘温度传感器121报警时,测控装置则向中心加热元件123发出自动(或通过触摸屏手动)“停止继续升温”的指令,于是,短时间内便使加热段整体处于边缘温度为44℃(
±
0.1℃误差)的恒温状态,并持续20~40分钟。这种可提供精准、实时、可控与恒定温度并持续足够长时间的方法,可一次性灭活肿瘤病变组织,大幅提高临床操作的可控性、灵活性、安全性和治疗的有效性。加热段整体同时具备了加温、测温和控温三种功能,
41.另外,根据临床需求,必要时,可通过药物注入孔122向病变部位注入所需药物,达到纯靶向药、热物理灭活目标组织(即病变组织)的目的,提高疗效。
42.如图2,是运用上述操作的方法,病变组织实施热物理灭活的原理。人体自然通道(如肠、腔道)的内壁2,即阴影部分是模拟人体自然通道内壁生长的任意不规则的肿瘤病变组织3;假设视频图像采集段3的长度为2厘米,病变组织2的长度为5厘米,那么,选用加热段12的长度为5厘米并适合病变组织自然通道直径的治疗镜;将治疗镜从人体自然通道进入端端口4,沿着人体自然通道(如肠、腔道)的内壁2,向病变组织3的部位探入;假设,当视频采集段11的顶端已触碰到病变组织始端31,此时观察通道进入端端口的治疗镜表面长度单位已探入假设50厘米时,那么,继续探入7厘米(即“始端31”与“末端32”的长度),即治疗镜从通道口探入总长度为57厘米,这时便将长度为5厘米的加热段“12”的两端分别放置在了病变组织的始端31与末端32之间的位置上,使加热段12的整体与病变组织3的位置精准吻合,以达到精准靶向。接下来,可以按照“如图1”的工作原理进行操作,将病变组织一次性的热灭活,或同时注入药物进行治疗。
43.加热元件123是实施肿瘤灭活的核心单元,故对其精准温度控制是关键,同时对其加热电源的要求也很高。要求稳定直流电源,电压值在36v安全电压范围内。选用24v直流开关稳压电源,确保电源安全可靠。
44.如图3,是温度自动控制仪:
45.是由实时温度显示和预值温度显示组成的数字温度显示单元、加热温度控制单元、预值温度单元等三部分组成。
46.其中,“加热温度控制”是把加热电源和加热元件有机地连接在一起,通过加热元件123的温度传感器121输入反馈温度值与预值温度馈给值进行比较,用其差值控制加热元件123的电量增、减,控制调节加热元件的温度等于预值温度。由精确温度传感器、灵敏的比较器进行比较来完成。当传感温度高于预值温度0.1℃时,实时温度开始下调,当传感温度高低于预值温度0.1℃时,实时温度开始上调,所以“加热元件”的温度始终在预值温度值
±
0.1℃范围内对肿瘤进行高度定温杀灭,不会损伤健康机体。
47.实时加温温度值同时传至实时温度显示单元进行显示。
48.预值温度在输出至加热温度控制同时也输出至预值温度显示单元进行显示。
49.如图4,是视频镜显示仪:
50.通过视频镜在人体自然通道的逐渐探入,可在视频镜显示仪的屏幕上,采用视频图像的直观方式找到肿瘤病变组织的具体部位,并同时将加热段精准定位在病变位置,以达到精准靶向目的。在图3中的视频图像采集段11,由摄像头采集的视频信号输出至图4视频镜显示仪中,视频图像就会完全显示出本治疗的操作过程。
51.以上是实施方案的执行、处理、监控、检测的完整经过。
52.本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。