of cytokine response to tlr stimulation and alleviation of collagen
‑
induced arthritis in mice by schistosoma japonicum peptide sjmhe1.j cell mol med,2017mar;21(3):475
‑
486][schistosoma japonicum peptide sjmhe1 suppresses airway inflammation of allergic asthma in mice.j cell mol med,2019,23(11):819
‑
7829]。
[0006]
本发明经过实施例验证,sjmhe1多肽治疗可以明显减少空腹血糖、糖化血清白蛋白的水平,但对血脂和肝功能没有影响;sjmhe1多肽治疗改善葡萄糖耐量异常,提高其胰岛素的敏感性,改善肝脏糖异生;抑制肝脏炎症细胞浸润,减轻肝细胞水泡样变性及脂肪变性;抑制肝脏糖异生关键基因pepck、g6pase及其转录因子foxo1的表达;抑制肝细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α的表达;sjmhe1可通过抑制肝脏糖异生,调节血糖水平。小分子多肽sjmhe1用于糖尿病治疗,规避了蠕虫感染、蠕虫分泌产物或全长蛋白的各种弊端和免疫原性问题。多肽类药物具备药效高、易代谢、不易蓄积中毒、副作用低等众多优点。本发明所述血吸虫多肽sjmhe1在治疗糖尿病药物中的应用具有广阔的前景。
[0007]
本发明的技术方案是:
[0008]
一种多肽sjmhe1在治疗糖尿病药物中的应用。
[0009]
所述sjmhe1来源于日本血吸虫虫卵或成虫抗原,由24个氨基酸组成,其氨基酸序列为vpgggtallrcipvldtlstkned(val proglyglyglythr alaleuleuargcys ile proval leu asp thrleuserthr lys asnglu asp)。
[0010]
进一步的,所述多肽sjmhe1降低空腹血糖和糖化血清白蛋白的水平。
[0011]
所述多肽sjmhe1制备治疗糖尿病药物对血脂和肝功能没有影响。
[0012]
所述多肽sjmhe1能提高葡萄糖耐量、提高其胰岛素的敏感性、改善肝脏糖异生。
[0013]
所述多肽sjmhe1能减轻糖尿病肝脏炎症及脂肪变性。
[0014]
所述多肽sjmhe1能减少肝脏组织糖异生关键基因pepck、g6pase及转录因子foxo1的表达水平。
[0015]
所述多肽sjmhe1能减少肝原代细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α、foxo1的表达水平。
[0016]
所述多肽sjmhe1能减少hepg2细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α、foxo1表达水平。
[0017]
本发明还提供一种治疗糖尿病的药物,该药物包括多肽sjmhe1,还包括药学上可以接受的辅料。优选的,辅料为不完全福氏佐剂。
[0018]
与现有技术相比,本发明的有益效果是:
[0019]
本发明通过一系列的实验证实sjmhe1多肽治疗可以明显减少高脂喂养和链脲佐菌素(stz)诱导的t2dm小鼠的空腹血糖、糖化血清白蛋白的水平;但对糖尿病小鼠血脂和肝功能没有影响;sjmhe1多肽治疗改善糖尿病小鼠的葡萄糖耐量异常,提高其胰岛素的敏感性,改善肝脏糖异生;抑制糖尿病小鼠肝脏炎症细胞浸润,减轻肝细胞水泡样变性及脂肪变性;抑制糖尿病小鼠肝脏糖异生关键基因pepck、g6pase及其转录因子foxo1的表达;抑制肝细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α的表达;sjmhe1可通过抑制糖尿病小鼠肝脏糖异生,调节糖尿病小鼠的血糖水平。这种与人类共进化的、血吸虫来源小分子多肽sjmhe1治疗糖尿病,造福患者和社会具有重要意义。
附图说明
[0020]
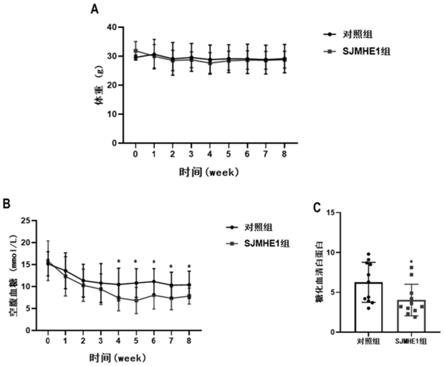
图1是小鼠血糖水平检测结果图;其中,图1a是小鼠体重改变图;图1b是小鼠空腹血糖水平改变图;图1c是小鼠糖化血清白蛋白的改变图;
[0021]
图2是小鼠血脂和肝功能检测结果图;其中,图2a是小鼠胆固醇水平(tc)图;图2b是小鼠甘油三脂水平(tg)图;图2c是小鼠丙氨酸转氨酶(alt)水平图;图2d是小鼠门冬氨酸转氨酶(ast)水平图;
[0022]
图3是小鼠葡萄糖耐量实验(gtt)、胰岛素耐量实验(itt)、丙酮酸耐量实验(ptt)血糖变化图;其中,图3a是小鼠gtt血糖变化及曲线下面积(auc)图;图3b是小鼠itt血糖变化及曲线下面积(auc)图;图3c是小鼠ptt血糖变化及曲线下面积(auc)图;
[0023]
图4是小鼠肝脏病理改变对比图;
[0024]
图5是小鼠肝脏糖异生关键基因pepck、g6pase及其转录因子foxo1的表达结果图;其中,图5a是小鼠肝脏pepck mrna的表达;图5b是小鼠肝脏g6pase mrna的表达;图5c是小鼠肝脏foxo1 mrna的表达;
[0025]
图6是小鼠肝原代细胞中糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α、foxo1的表达结果图;其中,图6a是小鼠肝细胞中pepck mrna的表达;图6b是小鼠肝细胞中g6pase mrna的表达;图6c是小鼠肝细胞中pgc1
‑
αmrna的表达;图6d是小鼠肝细胞foxo1 mrna的表达;
[0026]
图7是人hepg2细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α、foxo1的表达结果图;其中,图7a是人hepg2细胞中pepck mrna的表达;图7b是人hepg2细胞中g6pase mrna的表达;图7c是人hepg2细胞中pgc1
‑
αmrna的表达;图7d是人hepg2细胞foxo1 mrna的表达。
具体实施方式
[0027]
下面结合附图详细描述本发明的实施例,旨在用于解释本发明,而不能理解为对本发明的限制。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、材料等,如无特殊说明,均可从商业途径得到。
[0028]
实施例1:t2dm动物模型的构建
[0029]
(1)模型构建及分组:
[0030]
五周龄雄性c57bl/6j小鼠(购买于南京集萃药康生物科技股份有限公司),高脂饮食(hfd)和链脲佐菌素(stz)诱导小鼠糖尿病模型。小鼠予以高脂饲料d12492(南京协同制药生物工程有限公司),高脂饲料d12492含60%kcal脂肪,喂养8周后,stz(60mg/kg)配制于ph值为4.5的0.1m柠檬酸盐缓冲液中,腹腔注射。注射一周后,针刺尾静脉取血,使用血糖仪(德国拜耳公司)测量血糖,以空腹血糖≥16.7mmol/l为标准选择造模成功的2型糖尿病小鼠,随机分为数量相等的空白对照组(control)和实验组(sjmhe1),每组小鼠各11只;实验组小鼠腹腔注射sjmhe1多肽溶液(每100μl pbs缓冲液中含10μg的sjmhe1多肽),对照组中小鼠注射100μl pbs缓冲液作为对照。pbs和sjmhe1每周注射一次,共注射8次。
[0031]
(2)小鼠体重血糖检测:
[0032]
小鼠在注射sjmhe1(苏州强耀生物科技有限公司合成)、pbs前测量体重及空腹血糖,随后每周固定时间测量随机血糖和体重。测量结果如图1a所示,与control组相比,
sjmhe1组小鼠体重无明显差异;然而从第4周开始,sjmhe1组小鼠空腹血糖开始降低,与control相比,第四周sjmhe1组小鼠空腹血糖平均下降了10.25%;到第八周,sjmhe1组空腹血糖平均下降了24.61%,如图1b所示。
[0033]
(3)糖化血清白蛋白检测
[0034]
pbs和sjmhe1注射8周后,用1%戊巴比妥钠(50mg/kg)处死小鼠,摘除眼球,采集血样,在4℃条件下3000rpm离心20min获得血清,检测糖化血清白蛋白(ga)。如图1c所示,与control组相比,sjmhe1组小鼠ga平均下降了35.61%。
[0035]
实施例2:小鼠血脂及肝功能检测
[0036]
(1)小鼠血脂检测
[0037]
pbs和sjmhe1注射8周后,用1%戊巴比妥钠(50mg/kg)处死小鼠,摘除眼球,采集血样,在4℃条件下3000rpm离心20min获得血清,检测总胆固醇(tc)、甘油三酯(tg)。结果如图2a、2b所示,sjmhe1对糖尿病模型小鼠的血脂含量并无明显影响。
[0038]
(2)小鼠肝功能检测
[0039]
pbs和sjmhe1注射8周后,1%戊巴比妥钠(50mg/kg)处死小鼠,摘除眼球,采集血样,在4℃条件下3000rpm离心20min获得血清,检测丙氨酸氨基转移酶(alt)、天冬氨酸氨基转移酶(ast)(美国贝克曼生化分析仪)。结果如图2c、2d所示,sjmhe1对糖尿病模型小鼠的肝功能并没有明显影响。
[0040]
实施例3:小鼠gtt、itt及ptt检测
[0041]
(1)葡萄糖耐量实验(gtt)
[0042]
pbs和sjmhe1注射8周,各组小鼠禁食16h后,灌胃给予1g/kg葡萄糖,尾静脉针刺取血测量糖负荷前及给药后15、30、60、90、120分钟后血糖。血糖测量使用拜耳contour ts血糖仪测量血糖。结果如图3a所示,与control组相比,sjmhe1组小鼠在注射葡萄糖后血糖显著下降,曲线下面积(auc)也显著降低,平均下降了23%。本实施例结果表明,sjmhe1多肽处理可明显改善糖尿病小鼠的糖耐量水平。
[0043]
(2)胰岛素耐量实验(itt)
[0044]
pbs和sjmhe1注射8周后,各组小鼠在禁食4小时后腹腔注射0.75u/kg胰岛素,尾静脉针刺取血测量给药前及给药后15分钟、30分钟、60分钟、90分钟、120分钟后血糖。测量使用拜耳contour ts血糖仪测量血糖。结果如图3b所示,与control组相比,sjmhe1组小鼠在注射胰岛素后血糖显著下降,曲线下面积(auc)也显著降低,平均下降了18%。本实施例结果表明,sjmhe1处理可明显提高糖尿病小鼠胰岛素的敏感性。
[0045]
(3)丙酮酸耐量实验(ptt)
[0046]
pbs和sjmhe1注射8周后,各组小鼠在禁食16小时后腹腔注射1g/kg丙酮酸,尾静脉针刺取血测量给药前及给药后15分钟、30分钟、60分钟、90分钟、120分钟后血糖。测量使用拜耳contour ts血糖仪测量血糖。结果如图3c所示,与control组相比,sjmhe1组小鼠在注射丙酮酸后血糖显著下降,曲线下面积(auc)也显著降低,平均下降了23.46%。本实施例结果表明,sjmhe1处理可明显改善糖尿病小鼠肝脏糖异生。
[0047]
实施例4:sjmhe1多肽对糖尿病小鼠肝脏病理改变的影响
[0048]
pbs和sjmhe1注射8周后,用1%戊巴比妥钠(50mg/kg)处死小鼠,收集小鼠肝脏用福尔马林固定,常规石蜡包埋,4μm切片,放入二甲苯中脱残留石蜡2次,15min/次;酒精梯度
脱水(梯度分别为100%乙醇、85%乙醇、75%乙醇)各5min,蒸馏水1min;苏木素染色5min,流水1
‑
3s;盐酸乙醇分色5s,水洗10s;水洗蓝化20min;70%乙醇、80%乙醇各5min;伊红乙醇液20s;95%乙醇2次,5min/次;100%乙醇2次,5min/次;二甲苯2次,5min/次;中性树胶封片;用eclipse e100正置显微镜采集图像,观察肝脏病理改变。结果如图4所示,与control组相比,sjmhe1组肝脏炎症细胞浸润明显减少,肝细胞水泡样变性和脂肪变性明显减轻。可见,sjmhe1处理可减轻糖尿病小鼠肝脏炎症及脂肪变性。
[0049]
实施例5:sjmhe1多肽对小鼠肝脏糖异生关键基因的影响
[0050]
pbs和sjmhe1注射8周后,1%戊巴比妥钠(50mg/kg)处死小鼠后,收集小鼠肝脏,取30mg的肝脏组织剪碎pbs清洗后加入500μl的trizol(美国英杰生命技术有限公司),于冰上研磨直至组织与trizol充分混匀,漩涡震荡5s,室温静置5min。每管快速加入100μl的氯仿漩涡震荡15s后,室温静置3min,于4℃,10000g,离心10min。离心后分三层,吸上清液至一新的1.5ml ep管。每管加入250μl的异丙醇,上下颠倒10
‑
15次,置
‑
80℃冰箱10
‑
30min后于4℃,12000g离心10min后倒掉异丙醇。每管加入500μl的70%酒精,上下颠倒10
‑
15次以清洗蛋白。于4℃,12000g离心5min。倒掉70%酒精,室温晾10min,至管壁干即可。向样品中加入50μl ddh2o进行溶解,充分混匀,水浴锅55
‑
60℃,10min,测rna浓度(ng/μl),逆转录后,qrt
‑
pcr检测糖异生关键基因pepck、g6pase及转录因子foxo1的表达水平(上海生工生物工程有限公司)。如图5所示,与control组相比,sjmhe1组糖尿病小鼠肝脏组织糖异生关键基因pepck、g6pase及转录因子foxo1的表达水平明显降低,其中,pepck表达水平平均减少了45.36%,g6pase表达水平平均减少了60.75%,foxo1mrna的表达水平平均减少59.03%。
[0051]
实施例6:sjmhe1多肽对小鼠肝原代细胞中糖异生关键基因的影响
[0052]
(1)小鼠肝原代细胞的分离培养
[0053]
d
‑
hanks 0.2%edta、hanks 0.5mg/ml胶原酶ⅳ、原代专用培养基置于37℃水浴;小鼠麻醉后,肌注肝素抗凝,70%酒精喷洗,固定于板上。腹部正中切口打开腹腔,以棉签拨开肠管,暴露门静脉;分离门静脉,并于门静脉上下端穿线以备结扎固定。由门静脉注入10ml d
‑
hanks edta冲洗肝脏。然后剪开下腔静脉,使液体流出,继续冲洗,直至肝脏完全变白。小心分离肝脏,分离下的肝脏置于10cm培养皿盖上,继续以d
‑
hanks 0.2%edta冲洗一遍。冲洗干净的肝脏,转移至10cm培养皿,20ml hanks 0.5mg/ml胶原酶ⅳ开始消化,重复消化4
‑
5遍。消化下的肝细胞以100微米筛网过滤,室温下70g离心5分钟。吸去上层液体,细胞沉淀以4℃冷pbs 双抗(青霉素(100u/ml),链霉素(100μg/ml))(美国sigma公司),重悬清洗2
‑
3遍(室温100g离心5分钟,吸去上层液体)。血球计数板计数:先以1
‑
2ml原代培养基重悬细胞,然后吸取20μl重悬细胞加入180μl的原代培养基中稀释,充分混匀后,吸取10
‑
20μl稀释后的细胞,进行计数。根据计数结果,加入适当培养基,按4
×
105种板。台盼蓝(20μl台盼蓝 80μl细胞)染色粗略检测细胞状态。
[0054]
(2)小鼠肝原代细胞的糖异生模型构建及多肽刺激
[0055]
肝原代细胞置于37℃,5%co2恒温培养箱中培养6
‑
8小时贴壁后,于普通dmem培养基换液过夜,之后于含有0.25%bsa的5mm糖的dmem培养基 100nm地塞米松(美国sigma公司)预处理6小时,pbs洗一遍,使用含有0.25%bsa 糖异生底物(糖异生底物包括1μm丙酮酸钠、10μm乳酸钠、100nm地塞米松) 不同浓度的sjmhe1(sjmhe1的浓度为0.1μg/ml、0.5μg/ml)的无糖无酚培养基(美国gibco公司)处理12小时后,胰酶消化收细胞。
[0056]
(3)小鼠肝原代细胞糖异生关键基因的表达
[0057]
每管加入0.5ml的trizol,按上述实验方法提细胞rna,qrt
‑
pcr检测糖异生关键基因pepck、g6pase及转录因子pgc1
‑
α、foxo1的表达水平,结果如图6所示,与环磷酸腺苷 地塞米松(camp dex)组相比,sjmhe1组肝原代细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α(上海生工生物工程有限公司)、foxo1的表达水平明显减少,0.5μg/ml sjmhe1处理,pepck的表达水平平均减少了15.33%、g6pase的表达水平平均减少了35.03%、pgc1
‑
α的表达水平平均减少了21.13%、foxo1mrna的表达水平平均减少了32.72%。
[0058]
实施例7:sjmhe1多肽对人hepg2细胞糖异生关键基因的影响
[0059]
(1)人hepg2细胞胰岛素抵抗模型的构建及多肽刺激
[0060]
hepg2细胞(中国科学院上海细胞库)在温度37℃,5%co2的环境中,于含10%胎牛血清、100iu/ml青霉素和100μg/ml链霉素的dmem培养基培养。在达到70%
‑
80%贴壁后,用磷酸盐缓冲盐水(pbs)洗涤2次,用含0.25%bsa的无血清培养基饥饿过夜后,用0.25%bsa的无血清培养基 棕榈酸(0.2mm)在没有或存在不同浓度的sjmhe1(sjmhe1的浓度为0.1μg/ml、0.5μg/ml)中处理24小时后,胰酶消化收细胞。
[0061]
(2)人hepg2细胞糖异生关键基因的表达
[0062]
每管加入0.5ml的trizol,按实施例5中的方法提细胞rna,qrt
‑
pcr检测糖异生关键基因pepck、g6pase及转录因子pgc1
‑
α、foxo1的表达水平,结果如图7所示,与pa组相比,sjmhe1组hepg2细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α、foxo1的表达水平明显减少,0.5μg/ml的sjmhe1处理,pepck的表达水平平均减少了36.08%,g6pase的表达水平平均减少了37.43%,pgc1
‑
α的表达水平平均减少了50.87%,foxo1mrna的表达水平平均减少了25.43%。
[0063]
本发明通过一系列的实验证实sjmhe1多肽治疗可以明显减少高脂喂养和链脲佐菌素(stz)诱导的t2dm小鼠的空腹血糖、糖化血清白蛋白的水平;但对糖尿病小鼠血脂和肝功能没有影响;sjmhe1多肽治疗改善糖尿病小鼠的葡萄糖耐量异常,提高其胰岛素的敏感性,改善肝脏糖异生;抑制糖尿病小鼠肝脏炎症细胞浸润,减轻肝细胞水泡样变性及脂肪变性;抑制糖尿病小鼠肝脏糖异生关键基因pepck、g6pase及其转录因子foxo1的表达;抑制肝细胞糖异生关键基因pepck、g6pase及其转录因子pgc1
‑
α的表达;sjmhe1可通过抑制糖尿病小鼠肝脏糖异生,调节糖尿病小鼠的血糖水平,并取得明显优越的技术效果。
[0064]
本发明不限于这些公开的实例方案,本发明将覆盖在专利书中所描述的范围,以及权利要求范围的各种变型和等效变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。