1.本发明涉及通过给药单克隆干细胞来预防或治疗特应性皮炎的方法及组合物。并且,本发明涉及为了应用上述方法及组合物而筛选适合给药单克隆干细胞的特应性皮炎患者并预测其预后的组合物及方法。
背景技术:
2.以特应性湿疹而周知的特应性皮炎(atopic dermatitis,ad)为非常常见的炎症性皮肤疾病,据报告急性特应性皮炎的发病机制与以cd4 t细胞及嗜酸粒细胞的皮肤渗透、免疫球蛋白e(ige)及th2细胞因子的分泌增加为介导的th2炎症反应有关。特应性皮炎伴随严重的瘙痒和皮肤干燥等的症状,特应性皮炎的特征在于,在血液中表现高免疫球蛋白e的表达量且使嗜酸粒细胞增加。近来,据估计,特应性皮炎约占总人口的10%至20%,没有可根治的明确的治疗法,尤其,大部分诊断在5岁以下的稚龄,其中,50%的诊断在6个月至24个月之间。在韩国幼儿过敏呼吸系统学会中进行的全韩国流行病毒调查中,最近10年间的特应性皮炎的患病率逐渐增加,对其的社会关注也不断增加。特应性皮炎患儿的50%至75%表现出发展为哮喘、鼻炎的过敏性疾病的经过,因此,在早期诊断且管理作为发展为过敏的起点的特应性皮炎,对于预防发展为成人过敏非常重要。
3.特应性皮炎由如t淋巴细胞的活化、细胞因子系统的异常、细胞介导的免疫力降低、免疫球蛋白e的增加的免疫学异常和生理学因素以及皮肤的生化缺陷等诸多因素引起。为了治疗这种特应性皮炎,除了给干燥的皮肤保湿,通常还需要利用如类固醇的药物的治疗。作为特应性皮炎的治疗剂,在症状轻的情况下,使用保湿剂、局部类固醇剂、抗组胺剂、抗生素及局部免疫反应调节剂等。在严重的特应性皮炎的情况下,使用全身性类固醇剂或免疫抑制剂,但长期服用会有副作用,若停止服用该药物,则病变复发的可能性高,因此,需要长期使用也安全且有效的治疗法。
4.近来,尝试在各种炎症性疾病的治疗中利用干细胞。干细胞具有可生长为我们身体的210多个所有器官的组织的潜在能力,可且可无限分裂,并通过适当的操作而分化成所需的器官。由于这种干细胞的特性,干细胞作为新型治疗剂而备受瞩目,并且利用干细胞治疗难治性疾病的可能性非常高,预计可治疗许多疾病,如白血病、骨质疏松症、肝炎、帕金森病、老年性痴呆、烧伤等。
5.然而,在干细胞的情况下,在很难大量获取其的层面上仍然具有很多限制。作为获取干细胞的方法,可以说从冷冻胚芽细胞获取的方法为有效,但在伦理方面还存在许多争议。为了解决这种问题,还研究了利用体细胞核移植方法或成体干细胞来获取干细胞的方法。比胚芽干细胞研究更加活跃进行的领域为成体干细胞的研究。成体肝细胞作为存在于中枢神经系统或骨髓等各种器官中而参与生长期的器官发育及损伤时的再生的细胞,存在于各种器官中,因此可在包括骨髓、脾脏、脂肪细胞等的各种部位获取,但从骨髓获取的方法为最常见的方法。但是,在从许多各种骨髓细胞中分离并培养多个间充质干细胞的方面上,难以获取始终呈均匀形态的细胞,因此正在进行用于完善这种问题的研究。
6.本发明人曾发明命名为新型层分离培养方法的干细胞分离方法,以韩国专利申请第kr10
‑
2006
‑
0075676号提出申请并获取授权。比起其他方法,上述层分离培养法不仅能够以更低廉的成本进行,而且还可以无污染且不用顾虑混有其他干细胞地有效获取克隆间充质干细胞(cmsc),从这一层面上来看,比其他干细胞获取方法具有卓越的优秀性。但比起上述方法的优秀性,层分离培养法为了大量生产间充质干细胞来用作最终产物,需制备工作细胞库,经过通过此来获取最终产物的工序才能获取充分量的间充质干细胞,需要最少10次传代(passage)以上的培养,从这个层面来看,具有难以快速获取单克隆间充质干细胞的限制。
7.并且,有关能否通过向有需要的个体给药干细胞来改善特应性皮炎的多种临床症状的研究不足,而且,完全没有有关能够通过给药干细胞来期待卓越效果的患者组信息。因此,需要在确立能够大量生产表现出优秀的特应性皮炎治疗效果的干细胞的课题的同时,确立能够利用其来治疗特应性皮炎的新型治疗方法。
技术实现要素:
8.技术问题
9.本发明人在研究利用干细胞有效治疗特应性皮炎的方法的过程中,确认以特定的细胞浓度、周期向适当的患者组给药通过本技术独创的方法获取的单克隆间充质干细胞时可以有效治疗特应性皮炎,从而完成本发明。
10.因此,本发明的目的在于,提供用于筛选适合给药单克隆干细胞的特应性皮炎患者的组合物或者用于预测给药单克隆干细胞的特应性皮炎患者预后的组合物,包含选自由白细胞介素10(il
‑
10)、白细胞介素13(il
‑
13)、γ
‑
干扰素(ifng)、白细胞介素5(il
‑
5)以及白细胞介素17(il
‑
17)组成的组中的一种以上或者测定它们的表达的制剂。
11.并且,本发明的目的在于,提供用于筛选适合给药单克隆干细胞的特应性皮炎患者的方法、提供有关预测给药单克隆干细胞的特应性皮炎治疗预后的信息的方法,包括:步骤1),在特应性皮炎患者的试样中测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达。
12.并且,本发明的目的在于,提供以向特定患者组给药为用途的包含单克隆干细胞的用于预防或治疗特应性皮炎的药学组合物。
13.并且,本发明的目的在于,提供一种特应性皮炎的治疗方法,包括以一次1
×
103细胞/kg至1
×
108细胞/kg的给药量间隔1周至3周向个体给药通过本发明的方法获取的单克隆干细胞的步骤。
14.技术方案
15.为了实现上述目的,本发明提供一种用于筛选适合给药单克隆干细胞的特应性皮炎患者的组合物,包含选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上或者测定它们的表达的制剂。
16.并且,本发明提供一种用于预测给药单克隆干细胞的特应性皮炎患者预后的组合物,包含选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上或者测定它们的表达的制剂。
17.并且,本发明提供一种用于筛选适合给药单克隆干细胞的特应性皮炎患者的试剂
盒,包含上述用于筛选的组合物。
18.并且,本发明提供一种用于预测给药单克隆干细胞的特应性皮炎患者预后的试剂盒,包含上述用于预测预后的组合物。
19.并且,本发明提供一种用于筛选适合给药单克隆干细胞的特应性皮炎患者的方法,包括:步骤1),在特应性皮炎患者的试样中测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达。
20.并且,本发明提供一种提供有关预测给药单克隆干细胞的特应性皮炎治疗预后的信息的方法,包括:步骤1),在特应性皮炎患者的试样中测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达。
21.并且,本发明提供一种包含单克隆干细胞的用于预防或治疗特应性皮炎的药学组合物,当患者在治疗前出现如下情况时给药上述组合物:i)白细胞介素10为20pg/ml以上以及白细胞介素13为100pg/ml以上的情况;ii)未检测出γ
‑
干扰素及白细胞介素5的情况;或者iii)检测出白细胞介素17的情况。
22.并且,本发明提供一种特应性皮炎的治疗方法,包括:步骤1),在第一容器中培养从个体分离出的骨髓;步骤2),仅将上述第一容器的上清液移入新的容器来进行培养;步骤3),培养在上述新的容器中存在的细胞并获取上清液;步骤4),将上述步骤3)的上清液用作步骤2)的第一容器的上清液,将步骤2)及步骤3)重复一次以上来获取单克隆干细胞;步骤5),以50细胞/cm2至1000细胞/cm2(cell/cm2)的细胞密度将上述步骤4)的单克隆干细胞接种于培养基中并进行培养来获取单克隆干细胞;以及步骤6)以一次1
×
103细胞/kg至1
×
108细胞/kg的给药量间隔1周至3周向个体给药上述获取的单克隆干细胞。
23.发明的效果
24.根据本发明得以改善的干细胞的层分离培养及增殖方法,可通过单克隆间充质干细胞的快速增殖,在短时间内大量获取所需的单克隆间充质干细胞。并且,不仅可以通过以规定的周期、用法、剂量向患有特应性皮炎的患者给药通过上述方法获取的单克隆间充质干细胞来有效改善患者的过敏症状,尤其还可以根据标记确认并筛选适合本治疗的患者组来给药,从而实现优秀的特应性皮炎治疗效果。
附图说明
25.图1为示出从骨髓中分离单克隆间充质干细胞的现有的层分离培养法的图。
26.图2为示出通过显微镜观察并确认根据细胞培养密度及细胞培养传代的单克隆间充质干细胞的形态学变化的结果的图。
27.图3为示出通过流式细胞荧光分选技术(facs,flow cytometry)分析来将根据细胞培养密度及细胞培养传代的单克隆间充质干细胞的细胞大小及粒度(granularity)的变化以前向散射(fsc,forward scatter)(a部分)及侧向散射(ssc,side scatter)(b部分)光的平均值来进行确认的结果的图(*p<0.05,**p<0.01,***p<0.005)。
28.图4为示出通过β
‑
半乳糖苷酶(β
‑
gal)的活性染色来对细胞培养密度及细胞培养传代不同的单克隆间充质干细胞进行染色之后确认细胞是否老化的结果的图。
29.图5为示出以不同的细胞培养密度来培养传代15次(passage 15;p15)的单克隆间充质干细胞之后利用逆转录
‑
聚合酶链反应(rt
‑
pcr)来确认作为老化相关基因的p15、p16
及作为增殖标记的增殖细胞核抗原(pcna)的结果的图。
30.图6为示出通过群体倍增时间(population doubling time;pdt)及群体倍增水平(population doubling level;pdl)来确认根据细胞培养密度及细胞培养传代的单克隆间充质干细胞的增殖能力的结果的图(*p<0.05,**p<0.01,***p<0.005)。
31.图7为示出确认根据细胞培养密度及细胞培养传代的单克隆间充质干细胞的分化能力的结果的图(*p<0.05,**p<0.01,***p<0.005)。图7的a部分为通过油红(oil red)o组织学染色法来确认分化为根据细胞培养及细胞培养传代的单克隆间充质干细胞的脂肪细胞的分化能力的结果。图7的b部分示出对图7的a部分的组织学染色程度进行定量化的图。图7的c部分为通过茜素红s(alizarin red s)组织学染色来确认分化为根据细胞培养及细胞培养传代的单克隆间充质干细胞的骨化细胞的分化能力的结果,图7的d部分为示出对图7的c部分的组织学染色程度进行定量化的图。
32.图8为示出由根据细胞培养密度及细胞培养传代的单克隆间充质干细胞生产的总活性氧(ros,reactive oxygen species)生产(a部分)及通过彗星试验(comet assay)来确认(b)由根据细胞培养密度及细胞培养传代的总活性氧生产引起的脱氧核糖核酸(dna)损伤的结果的图(*p<0.05,**p<0.01,***p<0.005)。
33.图9为示出为了确认由根据细胞培养密度及细胞培养传代生产的活性氧引起的脱氧核糖核酸损伤程度而测定8
‑
羟基脱氧鸟苷(8
‑
ohdg,8
‑
hydroxy
‑
2'
‑
deoxyguanosine)浓度的结果的图(*p<0.05,**p<0.01,***p<0.005)。
34.图10为示出利用高密度条件单独(hd)或高密度条件 抗坏血酸(抗氧化剂的一种)追加(hd aa)来培养传代11次(p11)至传代15次(p15)的单克隆间充质干细胞之后确认细胞增殖能力的变化的结果图。
35.图11为示出利用高密度条件单独(hd)或高密度条件 抗坏血酸追加(hd aa)来培养传代15次(p15)的单克隆间充质干细胞之后对所生产的活性氧水平进行比较的结果的图(*p<0.05,**p<0.01,***p<0.005)。
36.图12a为比较示出现有的层分离培养法及得以改善的层分离培养法实验方法的图。
37.图12b为得以改善的层分离培养法的示意图,为示出与不同于现有的层分离培养法的传代2次之后相对应的低密度培养的示意图。
38.图13至图20为示出确认以1000细胞/cm2或4000细胞/cm2的密度接种通过层分离培养法取得的scm01至scm08单克隆间充质干细胞,并利用添加有或未添加有抗氧化剂的lg
‑
达尔伯克改良伊格尔培养基(lg
‑
dmem,dulbecc o's modified eagle medium,low glucose)、α
‑
伊格尔极限必需培养基(α
‑
mem,minimum essential mediumα)培养基来培养的细胞的增殖率的结果的图。各个图的a部分为示出根据各个实验组的传代1次(p1)至传代5次(p5)的细胞数的变化的图,各个图的b部分为示出各个实验组的群体倍增时间及群体倍增水平结果的图。
39.图21为示出利用未添加有抗氧化剂的lg
‑
达尔伯克改良伊格尔培养基且仅改变以1000细胞/cm2或4000细胞/cm2的密度的细胞密度的实验组中的细胞增殖率的结果的图。
40.图22为示出确认利用未添加有抗氧化剂的lg
‑
达尔伯克改良伊格尔培养基且仅改变以1000细胞/cm2或4000细胞/cm2的密度的细胞密度的实验组中的群体倍增时间及群体倍
增水平的结果的图。
41.图23为示出确认利用添加有抗氧化剂的α
‑
伊格尔极限必需培养基且仅改变以1000细胞/cm2或4000细胞/cm2的密度的细胞密度的实验组中的细胞增殖率的结果的图。
42.图24为示出确认利用添加有抗氧化剂的α
‑
伊格尔极限必需培养基且仅改变以1000细胞/cm2或4000细胞/cm2的密度的细胞密度的实验组中的群体倍增时间及群体倍增水平的结果的图。
43.图25为示出确认将细胞密度固定为1000细胞/cm2的密度并将培养基变更为lg
‑
达尔伯克改良伊格尔培养基或α
‑
伊格尔极限必需培养基的实验组中的细胞增殖率的结果的图。
44.图26为示出确认将细胞密度固定为1000细胞/cm2的密度并将培养基变更为lg
‑
达尔伯克改良伊格尔培养基或α
‑
伊格尔极限必需培养基的实验组中的群体倍增时间及群体倍增水平的结果的图。
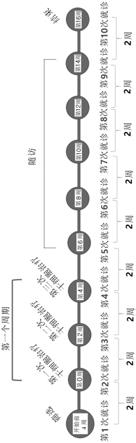
45.图27为根据本发明的特应性皮炎临床方案的示意图。
46.图28为示出按就诊次序确认患者a的临床分数的测定结果的图(图28a为湿疹面积及严重程度指数(easi),图28b为特应性皮炎评分(scorad),图28c为体表面积(bsa)结果)。
47.图29为示出a患者的湿疹面积及严重程度指数、特应性皮炎评分、体表面积数值及研究者整体评估(iga)、嗜酸性粒细胞计数结果的图。
48.图30为示出按就诊次序确认患者b的临床分数测定结果的图(图30a为湿疹面积及严重程度指数,图30b为特应性皮炎评分,图30c为体表面积的结果)。
49.图31为示出b患者的湿疹面积及严重程度指数、特应性皮炎评分、体表面积数值及研究者整体评估、嗜酸性粒细胞计数结果的图。
50.图32为示出在b患者中通过将表示瘙痒症和睡眠障碍尺度的pruritus及sleep数值分数化来确认的结果的图。
51.图33为示出确认给药本发明的单克隆干细胞的a患者的血液中的特应性相关因子的变化的结果的图。
52.图34为示出确认给药本发明的干细胞的b患者的血液中的特应性相关因子的变化的结果的图。
53.图35为示出比较确认为表现出治疗效果非常优秀的适合应用本发明的治疗方法的a患者组及b患者组与表现出治疗效果相对较低的患者组的标记表达的结果的图。
具体实施方式
54.本发明涉及用于筛选适合给药单克隆干细胞的特应性皮炎患者的组合物,包含选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上或者测定它们的表达的制剂。
55.并且,本发明涉及用于预测给药单克隆干细胞的特应性皮炎患者预后的组合物,包含选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上或者测定它们的表达的制剂。
56.并且,本发明涉及包含上述用于筛选的组合物的用于筛选适合给药单克隆干细胞的特应性皮炎患者的试剂盒或者包含上述用于预测预后的组合物的用于预测给药单克隆
干细胞的特应性皮炎患者预后的试剂盒。
57.并且,本发明涉及用于筛选适合给药单克隆干细胞的特应性皮炎患者的方法,包括:步骤1),在特应性皮炎患者的试样中测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达。还涉及提供有关预测给药单克隆干细胞的特应性皮炎治疗预后的信息的方法,包括:步骤1),在特应性皮炎患者的试样中测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达。
58.在本发明中,以所需的用法、剂量、周期向特应性皮炎患者给药本发明的单克隆干细胞,优选地,以一次1
×
103细胞/kg至1
×
108细胞/kg的给药量间隔1周至3周向个体给药,更优选地,例如,反复给药单克隆干细胞一个周期至五个周期,以0.5m/分钟至7m/分钟的速度给药5分钟至15分钟,确认特应性皮炎患者的各种临床症状及血清学指标,其结果,确认可以通过测定、检测特应性皮炎患者的白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17来有效筛选出在给药本发明的单克隆干细胞时能够表现出优秀治疗效果的适合的特应性皮炎患者,从而可以期待它们优秀的预后。
59.在本发明中,测定上述表达的制剂可以为测定白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17的信使rna(mrna)表达水平或蛋白质水平的制剂,测定mrna表达水平的制剂可以为与基因的mrna互补结合的正义引物及反义引物,或者探针,测定蛋白质水平的制剂可以为与由上述基因编码的蛋白质特异性结合的抗体。
60.在本发明中,“特应性皮炎”可以包括胎热,可以不受限制地包括以皮肤干燥症及瘙痒症为主要症状的皮肤的过敏性疾病。
61.在本发明中,“本发明的单克隆干细胞”为通过如下得以改善的层分离培养方法获取的干细胞:在能够快速无污染地获取干细胞的层分离培养法的优点基础上,通过单克隆干细胞的快速增殖,优选地,通过增殖单克隆间充质干细胞的快速增殖,即使没有工作细胞库(wcb,working cell bank)的制备步骤,也可以大量获取所需的单克隆干细胞。通过上述方法获取单克隆干细胞的特征在于,与通过现有的层分离培养方法获取的干细胞相比,其为特应性皮炎的治疗效果增大的干细胞。
62.具体地,本发明所使用的单克隆干细胞可以通过如下方法获取:步骤1),在第一容器中培养从个体分离出的骨髓;步骤2),仅将上述第一容器的上清液移入新的容器来进行培养;步骤3),培养在上述新的容器中存在的细胞并获取上清液;步骤4),将上述步骤3)的上清液用作步骤2)的第一容器的上清液,将步骤2)及步骤3)重复一次以上来获取单克隆干细胞;以及步骤5),以50细胞/cm2至1000细胞/cm2的细胞密度将上述步骤4)的单克隆干细胞接种于培养基中并进行培养。
63.上述步骤2)及步骤3)的培养在30℃至40℃的温度下培养4小时以下,优选地,培养1小时至3小时,更优选地,培养1小时30分钟至2小时30分钟,反复培养为在30℃至40℃的温度下培养4小时以下,优选地,培养1小时至3小时,更优选地,培养1小时30分钟至2小时30分钟,之后,在30℃至40℃的温度下培养12小时至36小时,优选地,培养18小时至30小时,反复培养2次至3次,接着,在30℃至40℃的温度下培养24小时至72小时,培养36小时至60小时,优选地,培养36小时至60小时,可以每次将上清液移至新的培养容器来进行。
64.本发明的实施例中分离的方法概要如下:
[0065][0066]
经培养的多个细胞形成单克隆细胞组,分离该多个单克隆细胞组之后可进行传代培养,本发明的特征在于,除了现有的层分离培养方法,包括步骤5)的传代培养步骤。
[0067]
本发明的“层分离培养(subfractionation culturing method,scm)”是指根据比重分离干细胞的方法,首先,提取人的骨髓来在细胞培养液中进行培养之后,仅获取上清液,并将其移入经涂层剂的处理或未经涂层剂的处理的培养容器中进行培养之后,重复数次相同过程的工序。像这种层分离培养的特征在于,重复不经离心分离过程且反复取得上清液来进行培养的工序,并且具有最后可无其他细胞的污染而取得单克隆干细胞,优选地,具有可取得单克隆间充质干细胞的优点。
[0068]
本发明的上述步骤1)至步骤5)中的步骤1)至步骤4)可与韩国kr10
‑
2006
‑
0075676号或kr10
‑
2014
‑
0170045号汇总所记载的层分离培养方法相同或等同地进行,韩国kr10
‑
2006
‑
0075676号可全文并入本发明中作为参考。
[0069]
并且,在现有的韩国kr10
‑
2014
‑
0170045号中,作为与特应性皮炎的治疗关联来获取细胞的方法,公开获取通过层分离培养法获取的克隆干细胞并利用其的特应性皮炎的预防或治疗方法,其包括:步骤(i),在第一容器培养包含来源于骨髓的间充质干细胞的样品来获取上清液;步骤(ii),将第一容器的上清液移入第二容器;步骤(iii),培养在上述第二容器中存在的细胞并获取上清液;步骤(iv),将步骤(ii)及步骤(iii)重复3次以上;步骤(v),分离来源于单细胞的菌落;以及步骤(vi),将细胞从上述菌落移入生长培养基并培养细胞,这为不进行离心分离且仅通过密度差异获取单克隆干细胞的方法,从而利用韩国kr10
‑
2006
‑
0075676号的现有的层分离培养方法。
[0070]
但是,上述韩国kr10
‑
2006
‑
0075676号及韩国kr10
‑
2014
‑
0170045号的层分离培养方法未公开在少的传代中有效获取单克隆干细胞,由此获取特应性皮炎治疗效果显著改善的单克隆干细胞的方法。
[0071]
如图1所示,在现有的层分离培养方法中,将从单菌落获取的所有细胞移动至6孔板,以80%~90%的克隆率(confluency)增殖后,为了将处于增殖状态的传代1次(p1)细胞作为种子细胞(seed cell)且没有对于密度调节的意识地获取大量的细胞,以4000细胞/cm2进行高密度培养。
[0072]
相反,本发明涉及基于在通过调节传代2次之后的培养中调节细胞密度来有效获取具有优秀的特应性皮炎的预防、治疗、改善效果的干细胞的“得以改善的层分离培养方法”,其特征在于,现有的层分离培养方法与种子细胞之后的培养步骤不同。例如,具体地,包括“步骤5),以50细胞/cm2至1000细胞/cm2的细胞密度将上述步骤4)的单克隆干细胞接种
于培养基中并进行培养”。相比于现有的层分离培养方法,得以改善的层分离培养方法可诱导单克隆干细胞的快速增殖,因此可快速取得最终产物,优选地,仅可通过如传代2次(p2)至传代8次(p8)的低于传代10次的培养来制备原始细胞库(mcb,master cell bank),可获取示出优秀的特应性皮炎的预防或治疗效果的单克隆干细胞。
[0073]
如现有的工序,当本发明的单克隆干细胞以4000细胞/cm2的高密度来进行培养时,细胞增殖能力显著降低,间充质干细胞的标记产生变化,并且,丧失干细胞的分化能力。因此,通过得以改善的层分离培养法取得的单克隆干细胞是指能够以低密度至中等程度的密度,即,以小于4000细胞/cm2的低细胞密度,例如,以3000细胞/cm2以下的细胞密度,优选地,以2000细胞/cm2以下的细胞密度,更优选地,以50细胞/cm2至1000细胞/cm2的细胞密度培养的单克隆干细胞。
[0074]
与以如4000细胞/cm2的高密度培养的间充质干细胞相比,当1000细胞/cm2以下的细胞密度培养单克隆间充质干细胞时存在如下的优点,即,细胞的增殖能力在整个长时间的培养期间保持显著的高水平,因此无需重复多次传代也可快速取得所期望量的单克隆细胞。因此,本发明的得以改善的层分离培养方法的特征在于,将种子细胞之后的传代培养步骤进低于传代10次,优选地,仅进行传代8次,与以往的层分离培养方法为了确保充足数量的细胞而最多进行传代25次相比,具有仅可通过少的传代培养大量生产单克隆干细胞的优点。
[0075]
并且,当以上述细胞密度培养单克隆间充质干细胞时,该细胞存在脱氧核糖核酸损伤少、老化受到抑制、可有效保持干细胞的分化能力的优点,因此可快速获取具有优秀的干细胞特性的单克隆间充质干细胞。
[0076]
并且,与以如4000细胞/cm2的高密度培养的单克隆干细胞相比,根据本发明的方法获取的单克隆干细胞示出优秀的特应性皮炎地预防、改善或治疗效果。
[0077]
用于本发明的培养基可包括所有不包含抗氧化剂的培养基、上述培养基中添加有抗氧化剂的培养基或包含抗氧化剂的培养基。
[0078]
作为不包含抗氧化剂的培养基,可使用达尔伯克改良伊格尔培养基(dmem),可根据需要向上述培养基额外地添加抗氧化剂来进行培养,但不限定于此。并且,根据需要可利用包含抗氧化剂的α
‑
伊格尔极限必需培养基进行培养。
[0079]
本发明的抗氧化剂可无限制地包含可用于细胞培养中的抗氧化剂,并且可以为选自由谷胱甘肽(glutathione)、半胱氨酸(cysteine)、半胱胺(cysteami ne)、泛醇(ubiquinol)、β
‑
巯基乙醇(β
‑
mercaptoethanol)及抗坏血酸(ascor bic acid;aa)组成的组中的一种以上。当培养基中添加有抗氧化剂时,上述抗氧化剂能够以10μg/ml至50μg/ml的浓度,优选地,以10μg/ml至30μg/ml的浓度,更优选地,以25μg/ml的浓度添加。
[0080]
在本发明的一例中,作为不包含抗氧化剂的培养基,使用达尔伯克改良伊格尔培养基,更优选地,使用lg
‑
达尔伯克改良伊格尔培养基,作为包含抗坏血酸来作为抗氧化剂的培养基,使用α
‑
伊格尔极限必需培养基。
[0081]
另一方面,可根据本发明的方法,非常有效地增殖单克隆干细胞,因此可省略利用原始细胞库来制备工作细胞库的工序。与现有的层分离培养法的制备原始细胞库之后需要伴随制备工作细胞库的方法相比,该方法使工序单纯化。
[0082]
当利用包含抗氧化剂的培养基来作为本发明的培养基时,上述培养基中还可添加
庆大霉素来作为抗生素。
[0083]
通过本发明的方法取得的间充质干细胞可以为最终优选地,以传代2次(p2)至传代10次(p10)的间充质干细胞,更优选地,可以为传代2次(p2)至传代8次(p8)的间充质干细胞,更加优选地,可以为传代2次(p2)至传代6次(p6)的间充质干细胞。
[0084]
这表示,与现有的最少传代10次(p10)至传代12次(p12)的间充质干细胞以最终产物来被取得的工序相比,本发明的干细胞为通过更少的传代数取得的干细胞,并且可通过细胞接种密度的调节来容易且大量取得在低的传代中快速得以增殖的间充质干细胞。
[0085]
在本发明中,与现有的层分离培养法取得的单克隆干细胞相比,如上所述的得以改善的层分离培养法,优选地,通过2000细胞/cm2以下的低密度,更优选地,通过1000细胞/cm2以下的低密度及抗氧条件的得以改善的层分离培养法取得的单克隆干细胞具有如下的优秀效果,即,可形成更小且均质的细胞,缓解诱发特应性皮炎的皮肤真皮或表皮的增厚,抑制选自由免疫球蛋白e、免疫球蛋白g1及白细胞介素4组成的组中的一种以上的生成、促进γ
‑
干扰素(inf
‑
γ)的生成以及抑制肥大细胞的效果优秀。
[0086]
在本发明中,筛选适合给药本发明单克隆干细胞的特应性皮炎患者或对给药单克隆干细胞的特应性皮炎患者的预后的预测以如下方式进行。
[0087]
首先,在特应性皮炎患者的试样中测定或检测出选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达,当上述患者出现如下情况时,筛选为适合单克隆干细胞给药法的患者,或者可以提供该患者在接受单克隆干细胞的给药时示出优秀的特应性皮炎治疗预后的信息:i)白细胞介素10为20pg/ml以上以及白细胞介素13为100pg/ml以上的情况;ii)未检测出γ
‑
干扰素及白细胞介素5的情况;和/或iii)检测出白细胞介素17的情况。
[0088]
在本发明中,上述测定或检测出选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上的表达的方法可以不受限制地使用相关领域常用的方法,优选地,可以使用酶联免疫吸附测定(elisa)。
[0089]
在本发明中,适合单克隆干细胞给药法的患者中白细胞介素10的表达可以为20pg/ml以上,优选地,可以为20pg/ml至500pg/ml,白细胞介素13的表达可以为100pg/ml以上,优选地,可以为100pg/ml至4000pg/ml。
[0090]
在本发明中,试样可以选自由特应性皮炎患者的血液、血清、血浆、淋巴液、脑脊髓液、腹水、尿液及组织活检组成的组织中。
[0091]
在通过上述方法筛选适合单克隆干细胞给药法的患者或确认治疗预后优秀的情况下,可以通过给药本发明的单克隆干细胞来治疗特应性皮炎,例如,以一次1
×
103细胞/kg至1
×
108细胞/kg的给药量间隔1周至3周给药,优选地,以2次至5次上述给药为一个周期来给药,可以根据患者的状态反复给药2个周期至5个周期。并且,优选地,以静脉给药的方式进行上述给药,在静脉给药的情况下,优选地,能够以0.5m/分钟至7m/分钟的速度给药5分钟至15分钟。
[0092]
在本发明最优选的一实例中,以间隔2周共给药3次为一个周期,可以根据患者的状态、好转度反复给药2个周期至5个周期。
[0093]
由此,本发明可以提供用于预防或治疗特应性皮炎的药学组合物,尤其,上述组合物可以用于治疗筛选为适合单克隆干细胞治疗法的患者的用途。
[0094]
因此,本发明提供一种包含单克隆干细胞的用于预防或治疗特应性皮炎的药学组合物,上述药学组合物在如下情况时用于给药:i)白细胞介素10为20pg/ml以上以及白细胞介素13为100pg/ml以上的情况;ii)未检测出γ
‑
干扰素及白细胞介素5的情况;以及iii)检测出白细胞介素17的情况。
[0095]
尤其,优选地,本发明的药学组合物所包含的单克隆干细胞通过如下步骤获取:步骤1),在第一容器中培养从个体分离出的骨髓;步骤2),仅将上述第一容器的上清液移入新的容器来进行培养;步骤3),培养在上述新的容器中存在的细胞并获取上清液;步骤4),将上述步骤3)的上清液用作步骤2)的第一容器的上清液,将步骤2)及步骤3)重复一次以上来获取单克隆干细胞;以及步骤5),以50细胞/cm2至1000细胞/cm2的细胞密度将上述步骤4)的单克隆干细胞接种于培养基中并进行培养来获取单克隆干细胞。
[0096]
并且,本发明提供一种特应性皮炎的治疗方法,包括:步骤1),在第一容器中培养从个体分离出的骨髓;步骤2),仅将上述第一容器的上清液移入新的容器来进行培养;步骤3),培养在上述新的容器中存在的细胞并获取上清液;步骤4),将上述步骤3)的上清液用作步骤2)的第一容器的上清液,将步骤2)及步骤3)重复一次以上来获取单克隆干细胞;步骤5),以50细胞/cm2至1000细胞/cm2的细胞密度将上述步骤4)的单克隆干细胞接种于培养基中并进行培养来获取单克隆干细胞;以及步骤6)以一次1
×
103细胞/kg至1
×
108细胞/kg的给药量间隔1周至3周向个体给药上述获取的单克隆干细胞。
[0097]
在本发明的预防或治疗特应性皮炎的方法及组合物中,上述单克隆干细胞可以为例如源自骨髓的间充质干细胞。
[0098]
在以预防、治疗或改善特应性皮炎为目的而使用上述干细胞的情况下,干细胞可以不受限制地使用新鲜型或冷冻型的形态,在新鲜型的情况下,给药周期可以更长,在冷冻型的情况下,可以比新鲜型的给药周期可以短。
[0099]
在向个体给药本发明的单克隆间充质干细胞的情况下,可以一次给药1
×
103细胞/kg至1
×
108细胞/kg,例如,可以间隔1周至3周向个体共给药2次至5次。并且,最优选地,能够以每次给药1
×
106细胞/kg的方式间隔2周共给药3次为一个周期,可以根据患者的状态反复1个周期至5个周期。
[0100]
并且,本发明提供以为与本发明的给药用法、剂量、周期相配地有效给药为目的的用于预防或治疗特应性皮炎的试剂盒。
[0101]
为了使用适当的用法、剂量,以包含1
×
103细胞/kg至1
×
108细胞/kg浓度的干细胞的一个区划为基本结构,上述试剂盒可以为包含1个区划10个区划的试剂盒,其形态不受限制。例如,在以给药3次为目的的情况下,上述试剂盒可以包含3个区划,以给药10次为目的的情况下,可以包含10个区划。
[0102]
本发明的单克隆干细胞可以通过用于干细胞治疗的多种途径向个体给药。优选地,可以为静脉内给药,在通过静脉给药的情况下,可以根据患者的体重、健康状态、疾病的状态适当地调节其速度,例如,以0.5m/分钟至10m/分钟、0.5m/分钟至7m/分钟的速度给药5分钟至15分钟。
[0103]
在本发明的治疗方法、组合物及试剂盒中,优选地,上述干细胞通过如下步骤获取:步骤1),在第一容器中培养从个体分离出的骨髓;步骤2),仅将上述第一容器的上清液移入新的容器来进行培养;步骤3),培养在上述新的容器中存在的细胞并获取上清液;步骤
4),将上述步骤3)的上清液用作步骤2)的第一容器的上清液,将步骤2)及步骤3)重复一次以上来获取单克隆干细胞;以及步骤5),以50细胞/cm2至1000细胞/cm2的细胞密度将上述步骤4)的单克隆干细胞接种于培养基中并进行培养来获取单克隆干细胞。
[0104]
并且,步骤5)的培养基为添加有抗氧化剂的培养基,上述干细胞可以为在上述培养基中培养而获取的单克隆干细胞,并且,上述步骤5)的培养为传代2次至传代8次的培养,上述干细胞可以为通过这种方法获取的单克隆干细胞。
[0105]
可以通过如下方法筛选适合本发明的治疗方法的特应性皮炎个体并预测其预后:测定选自由白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5以及白细胞介素17组成的组中的一种以上,或者测定它们的表达。
[0106]
因此,优选地,待给药给药本发明的用于预防或治疗特应性皮炎组合物的个体或需要接受本发明的特应性皮炎的治疗方法的个体的特征在于,在治疗之前,白细胞介素10的表达为20pg/ml以上、白细胞介素13的表达为100pg/ml以上,或者在治疗之前,不表达γ
‑
干扰素、白细胞介素5,表达白细胞介素17。
[0107]
在本发明中,上述“个体”包括需要预防或治疗特应性皮炎的个体,可以为哺乳动物或者除人类以外的哺乳动物。
[0108]
在向个体给药本发明的单克隆干细胞的情况下,可以与相关领域公知的预防或治疗特应性皮炎的药物联合给药,能够以与确认为可接受或对人体无害的相关领域公知的干细胞治疗剂赋形剂一同配制的形态来给药。.
[0109]
本发明的单克隆干细胞的特征在于,可有效缓解在诱发特应性皮炎的皮肤中表现出的硬皮、真皮的增厚及角质症状,尤其,缓解真皮或表皮的增厚。
[0110]
并且,本发明的单克隆干细胞可以改善在特应性皮炎中诱发的各种免疫、炎症因子,优选地,减少免疫球蛋白e、白细胞介素8、白细胞介素13,还可以有效减少已知在干性病变中作为重要标记的白细胞介素17。并且,可以减少作为以th2趋化因子反映过敏性疾病及疾病严重程度的活体指标的ccl17及ccl22的血液中浓度及引起表皮过度增殖的白细胞介素22(il
‑
22)。
[0111]
与通过现有的密度梯度离心分离方法取得的干细胞(gcm
‑
msc)和通过现有的层分离培养法取得的单克隆干细胞相比,通过本发明的方法获取的作为单克隆干细胞的特征在于,具有优秀的改善特应性皮炎相关的组织学因子、生理学因子的效果。
[0112]
并且,本发明的利用单克隆干细胞的预防或治疗特应性皮炎的方法及组合物可以有效改善用于评价特应性皮炎临床疾病严重程度的湿疹面积及严重程度指数、特应性皮炎评分、体表面积的数值及研究者整体评估、嗜酸性粒细胞的数值,具有改善伴随特应性皮炎患者的睡眠障碍及瘙痒症的效果。
[0113]
为了给药,除上述有效成分之外,本发明的药学组合物还可包含一种以上的药学上可接受的载体来制备。本发明的药学组合物中包含的药学上可接收的载体可在制剂时通常利用,包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯胶、磷酸钙、海藻酸、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油等,但并不限定于此。除上述成分之外,本发明的药学组合物还可包含润滑剂、湿润剂、甜味剂、调味剂、乳化剂、悬浮剂、保存剂等。
[0114]
本发明的药学组合物的剂量可根据上述药学组合物的制剂化方法、给药方式、给
药时间和/或给药途径不同,可根据包括通过上述药学组合物的给药实现的反应的种类和程度、成为给药对象的个体的种类、年龄、体重、常规健康状态、疾病的症状或程度、性别、饮食、排泄、在相应个体同时使用或与移植一同使用的药物其他组合物的成分等在内的各种因子及医药领域中周知的类似因子不同,本技术领域的普通技术人员可容易确定并处方对于所目的的治疗有效的剂量。
[0115]
本发明的药学组合物的给药途径及给药方式可各自独立,并不特别限制其方式,只要上述药学组合物可到达所目的的相应部位,可利用任意给药途径及给药方式。
[0116]
上述药学组合物可通过口服给药或胃肠外给药方式给药。例如,上述胃肠外方式包括例如静脉内给药、腹腔内给药、肌内给药、经皮给药或皮下给药等,还可利用将上述药学组合物涂敷在患病部位或者向患病部位喷雾、被患病部位吸入的方法,最优选地,以静脉给药的方式给药。
[0117]
在本发明的治疗方法及制备方法中,可相同地使用在上述说明中的组合物中记述的内容,为了避免说明书记载的复杂性,将省略所重复的内容。
[0118]
以下,通过实施例详细说明本发明。
[0119]
下述实施例用于例示本发明,本发明的内容并不限定于下述实施例。
[0120]
本发明实施方式
[0121]
实施例1:确立得以改善的层分离培养法
[0122]
为了制备对于特应性皮炎具有优秀的效果的单克隆间充质干细胞,利用了得以改善的间充质干细胞层分离培养法及增殖方法。得以改善的间充质干细胞层分离培养法及增殖方法的特征在于,在韩国专利申请10
‑
2006
‑
0075676号中所记载的层分离培养法的培养条件中改变了细胞密度及培养基。在以下实验中,使通过层分离培养法取得的单克隆间充质干细胞(cmsc)的细胞培养密度分别为50细胞/cm2(低密度)、1000细胞/cm2(中等密度)、4000细胞/cm2(高密度),并分析了由此所具有的细胞的特性。
[0123]
1.1根据细胞密度的间充质干细胞的形态学变化的确认
[0124]
首先,进行了用于确认长期培养中的根据细胞密度的间充质干细胞的形态学变化的实验。为了赋予长期培养条件,利用传代5次(p5)、传代10次(p10)、传代15次(p15)的间充质干细胞,分别以低密度、中等密度、高密度的条件接种于lg
‑
达尔伯克改良伊格尔培养基中。接着,通过显微镜观察细胞的形态学变化,并判断了干细胞的老化与否,将其结果在图2中示出。
[0125]
如图2所示,在传代5次(p5)及传代10次(p10)中,根据细胞密度,在细胞大小与形态学图案中呈现出差异,尤其,在传代15次(p15)的情况下,高密度培养条件中观察到了平坦且放大形态的间充质干细胞。像这种形态呈现典型的间充质干细胞的老化,并且确认了在长期培养中细胞的密度调节可调节间充质干细胞的老化。
[0126]
1.2根据细胞密度的间充质干细胞细胞大小及粒度的确认
[0127]
为了额外地确认根据细胞密度的干细胞的变化,通过流式细胞荧光分选技术分析来对周知为在经老化的细胞中增加的细胞大小及细胞的粒度进行了定量分析,并将其结果在图3中示出。
[0128]
如图3所示,确认了虽然在传代5次(p5)中细胞的大小未呈现出显著差异,但在传代10次(p10)及传代15次(p15)的情况下,根据细胞密度而呈现出显著的差异。尤其,在传代
10次(p10)及传代15次(p15)中可确认到在高细胞密度的培养条件下,细胞的大小显著增加,并且细胞老化进一步得以促进。与此相同地,在所有传代(passage)中呈现出了细胞的粒度也随着细胞的密度增加而显著增加的结果。
[0129]
因此,可确认到在间充质干细胞的长期培养中,细胞的密度的调节可成为调节细胞老化的因素,可通过降低细胞培养密度,来改善在后期传代中呈现的形态学变化。
[0130]
1.3根据培养细胞密度的间充质干细胞的老化确认
[0131]
为了确认实施例1.1及1.2中确认的形态学变化实际上是否为间充质干细胞的年龄依赖性(age
‑
dependent)现象,进行可选择性地染色老化细胞的利用β
‑
半乳糖苷酶的染色分析法,并且通过逆转录
‑
聚合酶链反应来比较了作为老化相关基因的传代15次(p15)、传代16次(p16)及作为增殖标记的增殖细胞核抗原基因的表达。并将其结果分别在图4及图5中示出。
[0132]
如图4所示,确认了在传代5次(p5)及传代10次(p10)中,在所有细胞密度中均未能确认老化的细胞的染色,但在传代15次(p15)中,随着细胞密度增大,老化的细胞的染色明显增加。并且,如图5所示,在传代15次(p15)中,随着细胞的培养密度增大,作为老化相关基因的cdk抑制剂,传代15次(p15)及传代16次(p16)的基因表达增加,并且作为增殖标记的增殖细胞核抗原减少。
[0133]
这种结果为表示间充质干细胞的形态学变化与间充质干细胞的老化存在关联的结果,并且为表示当进行传代培养时,细胞培养密度的调节可调节间充质干细胞的老化的结果。
[0134]
1.4根据培养细胞密度的间充质干细胞的增殖能力变化的确认
[0135]
众所周知,间充质干细胞的增殖能力随着传代、细胞的老化而逐渐减少。因此,增殖能力可用于确认间充质干细胞的老化的标准,并且进行行了长期细胞培养时的根据细胞培养密度的间充质干细胞的增殖能力比较。各个细胞的增殖能力通过初试接种细胞数与培养结束后取得的细胞的数量来计算各个传代的增殖率,并进行了确认,将其结果在表1及图6中示出。
[0136]
表1
[0137][0138]
如表1中所示,确认了在以低密度培养的间充质干细胞的情况下,传代5次(p5)、传代10次(p10)、传代15次(p15)中倍增(fold increase)88.4、34.3、16.4,反之,以中等密度培养的间充质干细胞为8.5、4.9、3.1,以高密度培养的间充质干细胞为3.0、1.9、1.1。并且,如图6所示,确认了群体倍增时间与群体倍增水平也呈现出了类似于倍增的图案。这种结果为表示在长期的间充质干细胞培养中可通过降低细胞密度来使间充质干细胞的增殖能力保持的结果,并且表示即使进行相同的传代培养,也可使间充质干细胞的老化受到抑制,可
使间充质干细胞的寿命延长。
[0139]
1.5根据培养细胞密度的间充质干细胞的分化能力变化的确认
[0140]
为了确认细胞培养密度是否影响干细胞功能,比较了根据传代5次(p5)至传代15次(p15)培养的分化能力。作为干细胞功能,确认了脂肪细胞分化能力及骨细胞分化能力,在各个传代及密度中进行了定性及定量分析。具体地,脂肪细胞分化培养液通过向高糖(high glusose)达尔伯克改良伊格尔培养基培养液中添加新生小牛血清(ncs,newborn calf serum,美国吉布科(gibco)公司产品)、10
‑7mol的地塞米松(dexamethasone)(美国西格玛(sigma)公司产品)、0.5mm的3
‑
异丁基
‑1‑
甲基黄嘌呤(ibmx,美国西格玛(sigma)公司产品)、10μg/ml的胰岛素(insulin,美国西格玛(sigma)公司产品)、100μm的吲哚美辛(indomethacin,美国西格玛(sigma)公司产品)来制备的培养基并进行了实验,7天分化之后,通过油红o(oil red o)组织学染色来进行了确认。并且,油红o组织学染色之后,利用异丙醇进行洗脱,并在500nm测定之后,通过定量分析来进行了确认。
[0141]
骨细胞分化培养液使用了向α
‑
伊格尔极限必需培养基培养液中添加有胎牛血清(fbs,美国吉布科(gibco)公司产品)、50μg/ml的抗坏血酸
‑2‑
磷酸酯(ascorbic2
‑
phosphate,美国西格玛(sigma)公司产品)、10
‑8mol的地塞米松(美国西格玛(sigma)公司产品)、10mm的β
‑
甘油磷酸钠(β
‑
glycerophosphate,美国西格玛(sigma)公司产品)的培养基,21天分化之后,通过茜素红s组织学染色进行了确认。并且,茜素红s组织学染色之后,利用10%的乙酸进行了洗脱,并在405nm测定之后,通过定量分析来进行了确认。将通过如上所述的方法来确认脂肪细胞分化能力及骨细胞分化能力的结果在图7中示出。
[0142]
如图7所示,确认了脂肪细胞分化能力随着传代整体上减少,但因密度导致的差异未明显呈现,反之,在骨细胞分化能力的情况下,确认了高密度条件的传代15次(p15)培养组中显著减少的现象。通过这种结果,确认了间充质干细胞的骨细胞分化能力在以低细胞密度培养的情况下,能够更好保持。
[0143]
1.6根据培养细胞密度的间充质干细胞的抗原谱分析
[0144]
进行了用于确认细胞培养密度是否还影响干细胞的抗原表达的实验,利用流式细胞荧光分选技术来确认根据各个传代及培养密度的阳性及阴性抗原表达的变化,并将其结果在表2中示出。
[0145]
表2
[0146][0147]
如表2所示,确认了阴性标记表达的变化未明显地确认出,但一部分阳性标记的情况在传代中也根据细胞培养密度呈现出表达量的变化。
[0148]
尤其,在传代15次(p15)中,以高密度培养细胞的情况下,大部分的阳性标记的表达量显著减少了,不仅如此,cd73、cd105呈现出阴性表达,因此确认到了保持细胞密度来进行细胞培养可成为非常重要的因素。
[0149]
1.7根据培养细胞密度的活性氧生产及脱氧核糖核酸损伤的比较
[0150]
据悉,间充质干细胞的功能的减少及脱氧核糖核酸损伤存在关联,尤其,由作为活性氧的活性氧诱导的脱氧核糖核酸损伤促进间充质干细胞的老化。因此,为了确认根据培养密度总活性氧生产及根据其的脱氧核糖核酸损伤是否不同,通过荧光强度分析来比较根据传代及细胞培养密度的总细胞性活性氧量,并通过彗星试验分析来确认脱氧核糖核酸损伤程度,将其结果在图8中示出。
[0151]
如图8所示,确认了总活性氧生产在所有传代中随着细胞培养密度增加而增加的倾向,尤其确认了在传代10次(p10)、传代15次(p15)中活性氧生产显著增加(a)。彗星试验分析中分类为从脱氧核糖核酸损伤最弱的cc1至损伤最严重的cc5来进行了数据分析,确认了在损伤最严重的cc5的情况下,随着细胞培养密度增大而显著增加的情况。反之,cc1呈现出了随着细胞密度增大而显著降低的倾向(b)。
[0152]
额外地,为了确认脱氧核糖核酸损伤是否为由活性氧诱发的,进行了用于确认因活性氧的脱氧核糖核酸损伤的8
‑
羟基脱氧鸟苷的浓度的实验。8
‑
羟基脱氧鸟苷分析方法如下。将从各个细胞取得的脱氧核糖核酸试样50μl放入8
‑
羟基脱氧鸟苷共轭涂层板(8
‑
ohdg conjugate coated plate)之后,在常温下培养了10分钟。之后,额外地放入抗
‑8‑
羟基脱氧
鸟苷抗体(anti
‑8‑
ohdg antibody)来在常温下培养了1小时,清洗3次之后,将二级抗体酶偶联物(sec ondary antibody enzyme conjugate)放入各个孔板(well)之后,重新在常温下培养了1小时。接着,重新清洗3次之后,放入基质溶液(substrate solution),在常温下培养了30分钟。最后,放入停止液(stopsolution)之后,在450nm下测定吸光度来进行了确认,将其结果在图9中示出。
[0153]
如图9所示,确认了在脱氧核糖核酸损伤出现最严重的传代15次(p15)组中,随着细胞培养密度增大,8
‑
羟基脱氧鸟苷的浓度显著增加。通过这种结果,因在高密度培养条件下所生产的活性氧而使脱氧核糖核酸损伤增加,由此促进了间充质干细胞的老化。
[0154]
这种结果为表示将细胞培养密度调低可起到从因间充质干细胞的活性氧生产增加所导致的脱氧核糖核酸损伤保护间充质干细胞的作用的结果。
[0155]
1.8根据抗氧化剂处理的间充质干细胞增殖及活性氧生产能力的确认
[0156]
为了确认间充质干细胞的增殖是否受到因在高密度培养条件所生产的活性氧而带来的影响,进行了活性氧消除实验。在传代11次(p11)至传代15次(p15)中,高密度培养条件及在高密度培养条件下添加作为抗氧化剂的抗坏血酸25μg/ml至培养基中进行培养之后,比较两组之间的增殖率的增殖倍数(fold)增加,将其结果在图10中示出。
[0157]
如图10所示,确认了在高密度培养条件下,倍增在传代11次(p11)至传代15次(p15)中分别为2.6、1.9、1.6,随着传代数增加而增殖能力减少,并开始呈现老化,但经抗氧化剂处理的情况下,在所有传代中增殖能力保持50%左右的高水平。并且,在抗氧化剂处理组中,增值倍数(growth fold increase)在传代11次(p11)至传代15次(p15)中分别为3.8、2.9、2.5,直到传代15次(p15)增殖能力也保持高水平。
[0158]
将确认了在作为端点(endpoint)的传代15次(p15)中,高密度培养条件单独及高密度培养条件 抗氧化剂处理两组之间的活性氧水平结在图11中示出。
[0159]
如图11所示,确认了通过处理作为抗氧化剂的抗坏血酸,增殖增加的条件下活性氧的水平也减少。因此,优选地,在低细胞密度下培养间充质干细胞,而不是高密度,当从高密度细胞培养诱导的活性氧生产利用抗氧化剂来进行消除的情况下,可使间充质干细胞的增殖能力增加。即,因高密度条件的活性氧而抑制间充质干细胞的增殖能力,随着细胞密度降低而活性氧减少,因此间充质干细胞增殖能力可得以促进。
[0160]
综上所述,确认了为了保持通过层分离培养来获取的单克隆间充质干细胞的增殖、培养及干细胞功能,在培养条件中将细胞密度调节为1000细胞/cm2以下的密度为重要,在添加抗氧化剂来进行培养的情况下,抑制可从细胞培养诱发的氧化应激,从而可有效地促进间充质干细胞增殖。并且,若比较相同的低细胞密度条件培养,则当如传代15次(p15)的传代10次以上的干细胞与如传代5次的小于传代10次的干细胞比较时,确认到如细胞的形态学变化突出、干细胞的老化促进、分化能力减少的结果,因此,以1000细胞/cm2以下的密度且小于传代10次的低传代数进行培养最为有效。
[0161]
实施例2:得以改善的层分离培养法的鉴定
[0162]
通过上述实施例1,在以层分离培养法取得的间充质干细胞培养中,细胞密度的调节、传代调节及抗氧化剂的添加可成为重要的因素,因此,通过韩国专利申请10
‑
2006
‑
0075676号中所记载的层分离培养法的现有工序获取的单克隆间充质干细胞以不同的细胞培养密度且改变添加有作为抗氧化剂的抗坏血酸的培养基,由此来比较了通过进行传代培
养来获取单菌落间充质干细胞的增殖能力及由此的细胞获取效果。
[0163]
在之前韩国专利申请10
‑
2006
‑
0075676号的实施例1中,公开了通过如图1的层分离培养方法从骨髓分离出间充质干细胞及培养的方法,将经层分离步骤获取的作为单一性细胞组的多个菌落以每孔100至600的细胞数移入至培养容器。
[0164]
并且,在韩国专利申请10
‑
2014
‑
0170045中公开了利用层分离培养法分离及来源于骨髓的间充质干细胞及培养的方法,还公开了将菌落以50细胞/cm2至100细胞/cm2涂抹的内容。
[0165]
但是,在韩国专利申请10
‑
2006
‑
0075676号及10
‑
2014
‑
0170045号仅公开对通过层分离培养法取得的单一性细胞组菌落进行计数来移动至6孔板后,为了制备用于以低浓度进行传代培养的种子细胞而扩张的结构,即,与传代1次相对应的菌落培养的条件,未公开并不是传代2次之后的菌落的对于个别细胞的反复培养细胞密度调节的结构及根据其的效果。根据在上述申请中记载的现有的层分离培养法,为了获取充足量的具有特应性皮炎的预防、治疗、改善效果的单克隆干细胞,需进行至少传代10次以上的培养。相反,在本发明的得以改善的层分离培养方法中,可通过传代2次之后的低细胞密度条件,最多传代8次以下的少的传代培养数有效获取大量的所目的的单克隆干细胞。
[0166]
具体地,在本改善方法中,培养通过层分离培养方法获取的传代1次(p1)的菌落后,传代2次(p2)之后,在传代培养中,分注作为低密度的1000细胞/cm2以下的细胞,并将其与4000细胞/cm2细胞培养的效果进行了比较。并且,将细胞培养基以不同的两种包含由抗氧化剂的α
‑
伊格尔极限必需培养基及未包含抗氧化剂的lg
‑
达尔伯克改良伊格尔培养基来比较了由此带来的细胞增殖效果。
[0167]
将用于确认得以改善的层分离培养法的效果的实验组在表3中示出,将相对于现有的层分离培养法得以改善的层分离培养方法的工序改善部分在图12a及图12b示意性地示出。
[0168]
如图12a所示,到获取传代1次的工序为止,将以往的层分离培养法和得以改善的层分离培养法以相同方式进行工序,但是,得以改善的层分离培养法与现有的层分离培养法的不同之处在于,将所扩张的传代1次细胞用作种子细胞来进行培养的步骤之后的传代培养工序。在现有的层分离培养法中,以4000细胞/cm2以上的高密度进行传代培养,在没有对于密度调节的认知下获取大量的细胞,在得以改善的层分离培养法中,将传代培养的密度调节成作为低密度的1000细胞/cm2以下,由此,仅可传代2次之后的最多传代8次以下的培养获取最终产物。将传代2次之后的培养工序在图12b中详细示出。
[0169]
表3
[0170][0171]
上述表3的细胞系为由层分离培养方法分离的细胞系,分别以scm01至scm08命名。
[0172]
2.1基于细胞系密度及培养基的增殖效果确认
[0173]
利用上述scm01至08细胞系来进行培养,分别利用细胞数、群体倍增时间、群体倍增水平来比较根据直至小于传代10次的传代5次的传代培养的细胞增殖效果,并在图13至图20示出。
[0174]
如图13至图20中所确认,在以每cm21000个的细胞密度接种并进行培养的所有实验组中呈现出比以每cm24000个的细胞密度接种并培养的实验组更优秀的细胞增殖效果。并且,尽管为相同的1000个细胞密度组,但在包含有作为抗氧化剂的抗坏血酸的α
‑
伊格尔极限必需培养基中所培养的1000α实验组中确认到了更为显著的细胞增殖效果。
[0175]
2.2根据细胞系密度的增殖效果比较
[0176]
为了进一步准确地比较根据培养细胞数的增殖率的比较,将培养基分别固定为lg达尔伯克改良伊格尔培养基或α
‑
伊格尔极限必需培养基,并比较了根据每cm21000个或4000个的细胞接种密度的根据传代培养的细胞增殖效果,并将其结果在图21至图24中示出。
[0177]
如图21所示,确认了当在lg达尔伯克改良伊格尔培养基中所培养的scm01至scm08细胞系均以每cm21000个细胞数接种并培养时,确认到传代2次(p2)至传代5次(p5)的增殖率显著高于每cm24000个的细胞数接种组,确认了与由传代5次(p5)中所确认的每cm24000个细胞接种相比,每cm21000个细胞接种组的增殖率为最小3.08倍至最大48.50倍。
[0178]
并且,如图22所示,确认了在所有细胞系中,每cm21000个的细胞接种组的群体倍增时间值也低于或接近每cm24000个细胞系接种,在所有细胞系中,群体倍增水平值也与每cm24000个细胞接种相比高。
[0179]
并且,如图23所示,确认了当在α
‑
伊格尔极限必需培养基中所培养的scm01至scm08细胞系均以1000个细胞数接种并培养时,呈现出与达尔伯克改良伊格尔培养基实验组相同的倾向,与传代5次(p5)中所确认的每cm24000个细胞系接种相比,每cm21000个细胞接种组的增殖率为最小6.32倍至最大85.63倍。并且,如图24所示,确认了在所有细胞系中,每cm21000个细胞接种组的群体倍增时间值也低于或接近于每cm24000个细胞接种,在所有细胞系中,群体倍增水平值也与每cm24000个细胞接种相比高。
[0180]
这种结果为表示与每cm24000个的高密度细胞接种培养相比,可通过每cm21000个以下的细胞接种来诱导单克隆间充质干细胞快速增殖的结果。
[0181]
2.3根据培养基的增殖效果比较
[0182]
在上文中,通过实施例2.2确认到了与4000细胞/cm2培养相比,1000细胞/cm2培养可呈现优秀的增殖效果,因此将细胞数固定为1000个,随着将培养基以变数进行改变来比较细胞增殖效果,从而额外地鉴定了根据培养基条件的增殖效果,并将其结果在图25及图26中示出。
[0183]
如图25所示,将培养基改变为α
‑
伊格尔极限必需培养基及达尔伯克改良伊格尔培养基来比较细胞增殖率的结果,与lg
‑
达尔伯克改良伊格尔培养基相比,在利用α
‑
伊格尔极限必需培养基的实验组中确认到了最小1.77倍至6.39倍的高细胞增殖率。并且,如图26所示,确认了群体倍增时间在所有α
‑
伊格尔极限必需培养基实验组中较低,而群体倍增水平增加。
[0184]
像这种实验结果表示,利用每cm21000个以下的细胞来调节细胞接种密度,除了以如传代2次(p2)至传代5次(p5)的低于传代10次的少的传代进行培养之外,在利用添加有抗氧化剂的培养基来培养的情况下,细胞增殖效率最大化。
[0185]
实施例3:改善工序的建立
[0186]
通过上述实施例确认到,就间充质干细胞培养而言,细胞密度的调节及抗氧化剂的添加成为重要的因素,除了韩国专利申请10
‑
2006
‑
0075676号及10
‑
2014
‑
0170045号中所记载的层分离培养法的现有工序之外,建立了当进行传代培养时,利用不同的细胞培养密度及培养基条件来在低于传代10次的少的传代中有效地获取单菌落的间充质干细胞的得以改善的工序,综上所述,在下列表4(利用达尔伯克改良伊格尔培养基的培养条件)及表5(利用α
‑
伊格尔极限必需培养基的培养条件)中示出。
[0187]
表4
[0188]
[0189][0190]
表5
[0191]
[0192][0193]
更具体地,如下进行了本发明的来源于骨髓的间充质干细胞的层分离培养工序及增殖培养。
[0194]
利用局部麻醉剂麻醉骨髓提供人的臀部之后,向坐骨扎入注射针来提取了骨髓。100mm的培养容器中放入20%的胎牛血清、1%的包含青霉素/链霉素的14ml的达尔伯克改良伊格尔培养基(dmem,dulbecco`s modified eagle`s medium,美国吉布科(gibco
‑
brl)产品,美国生命技术公司(life
‑
technologies),马里兰州(md),美国(usa))、1ml的人的骨髓,在37℃的温度条件下,5%的co2细胞培养仪中培养了2小时。培养之后,将培养容器稍微向一侧倾斜,以尽量使附着于底部的细胞不脱落方式仅将培养容器的上层培养液最大限度的移入新的容器。
[0195]
再重复一次相同的过程之后,将所取得的培养液移入底部涂敷有胶原蛋白
(collagen)的培养容器(becton dickinson)中之后,在37℃的温度条件下培养了2小时。将培养液重新移入新的涂敷有胶原蛋白的容器中,24小时之后再移入新的容器中,24小时之后再移入新的容器中。最终,48小时之后用肉眼确认到了移入新的容器之后残留的细胞附着于培养容器底部的情况。可推测出能够经过前部分的多个层分离步骤直至该步骤的细胞为细胞的比重显著小于其他细胞的小细胞。
[0196]
当经过约10日至14日的时间时,多细胞形成单菌落(single colony),将该单克隆细胞组用胰蛋白酶进行处理并分离之后,移入6
‑
孔培养容器中。在37℃的温度条件下,5%的co2细胞培养仪中培养了4日至5日之后,成长了约80%时,将多个细胞用0.05%的胰蛋白酶/1mm的乙二胺四乙酸(edta,美国吉布科(gibco
‑
brl)公司产品)进行处理之后,移入t175培养容器并以低细胞密度进行了传代培养。
[0197]
像这样,当将小于传代10次,优选地,传代8次以下的传代2次(p2)至传代5次(p5)中的细胞密度降低为1000细胞/cm2水平来进行培养时,尽管其他工序也均以相同的方式进行了调节,但间充质干细胞的增殖能力及干细胞特性优秀地保持,从而在相同的传代中也有效地诱导增殖。尤其,当降低细胞密度来进行培养时,可省略现有工序中所需的在间充质干细胞中制备工作细胞库的过程,并且可有效地缩短细胞制备期间。尤其,减少传代,可取得大量的未完成老化的细胞,并且当将这种细胞用作治疗剂时,有待其治疗效果优秀。
[0198]
并且,当利用添加有抗氧化剂的α
‑
伊格尔极限必需培养基来培养基时,由高密度的细胞培养所诱导的氧化应激因抗氧化剂处理而得以有效改善,并且可恢复间充质干细胞的细胞增殖能力,因此与现有的工序相比,显著缩短细胞的传代,可快速稳定地取得保持间充质干细胞的特性的且未进行老化的新鲜状态的单菌落间充质干细胞。
[0199]
综上所述可知,低密度细胞培养可短时间内取得大量细胞,因此,可简化制备工序,不仅如此,在长期培养(long
‑
term culture)当中也可取得完整保持着间充质干细胞的特性的且未进行老化的状态的细胞,因此可实现优质的干细胞生产。
[0200]
由此,在以下用于治疗的特应性皮炎的实验中利用了通过上述实施例构建的改良方法获取的干细胞。
[0201]
实施例4:单克隆间充质干细胞的特应性皮炎治疗方案的建立
[0202]
需要确立能够应用于人类特应性患者并诱导特应性皮炎的治疗效果的临床方案。因此,将实施例1至实施例3的通过改良的层分离培养法获取的源自同种骨髓的单克隆干细胞以新鲜型(以下称scm
‑
cgh)及冷冻型(以下称scm
‑
agh)的形态应用于特应性患者的临床急诊来确认其治疗效果。
[0203]
4.1临床参与患者的条件
[0204]
特应性急诊患者的临床方案的示意图如图27所示。临床实验在韩国仁荷大学医院医科大学(仁川,韩国)进行,在许可临床方案后,在24个月内向患者给药scm
‑
cgh或scm
‑
agh。向重症及症状严重的患有特应性疾病的20岁至60岁的成人多次给药scm
‑
cgh或scm
‑
agh来确认其效果及安全性。
[0205]
参与本临床试验的特应性患者以具有6个月特应性症状的患者为对象,特应性患者的临床入选标准(inclusion criteria)及临床排除标准(exclusion criteria)如下述表6所示,可接受的同时处置或禁止同时处置的标准如下述表7所示。
[0206]
表6
[0207][0208][0209]
表7
[0210]
[0211]
4.2临床方案的确立
[0212]
临床试验共进行4周,期间就诊3次,根据患者的症状程度决定是否追加周期(cycle)。具体地,通过患者的静脉以1
×
106细胞/kg的浓度给药scm
‑
cgh或scm
‑
agh,第一次给药后间隔2周给药2次,共给药3次(第一个周期;1
st cycle)。以2m/分钟至4.5m/分钟的速度向患者给药10分钟,为了确认根据给药的特应性皮炎治疗效果,进行了病变肉眼观察及患者的血清分析。在给药scm
‑
cgh或scm
‑
agh3次之后的第五次就诊开始,不给药scm
‑
cgh或scm
‑
agh,而是仅采取血清用于分析。
[0213]
第一个周期结束后,若患者的症状随着时间复发,则进行追加周期。
[0214]
4.3特应性皮炎治疗效果的确认方法
[0215]
给药scm
‑
cgh或scm
‑
agh的效果在给药3次后的12周内通过计算湿疹面积及严重程度指数、特应性皮炎评分、体表面积、视觉模拟评分(vas)、研究者整体评估(iga)来确认患者的疾病严重程度的相对减少的平均值,为了分析生物标记,在按照预定好的日程表进行就诊时采取血液进行sst(5ml的试管3个,共15ml)。第二次及第三次ip给药就诊(visit3、visit4)时,在ip给药前进行采血。分析作为血清生物标记的免疫球蛋白e;作为th2细胞因子及趋化因子的白细胞介素4(il4)、白细胞介素3(il3)、ccl17(胸腺活化调节趋化因子(tarc))、ccl22(巨噬细胞来源的趋化因子(mdc));作为th1细胞因子的白细胞介素8(il18);作为th17细胞因子的白细胞介素17(il17);以及作为th22细胞因子的白细胞介素22(il22),通过副作用反应、精神反应、生命体征、血液及小便检查确认耐药性及安全性,是否发生副作用则在给药4小时后评价。
[0216]
临床试验期间进行的评价内容如下述表8所示。
[0217]
表8
[0218]
[0219]
[0220][0221]
血常规(hematology):血红蛋白(hemoglobin)、血细胞比容(hematocrit)、红细胞(rbc)、白细胞(wbc)、不同白细胞的计数(wbc different cell count)、血小板(platelet)
[0222]
血液生化学(blood chemistry):碱性磷酸酶(alkaline phosphatase)、血尿素氮(bun)、肌酐(creatinine)、血清谷丙转氨酶(sgpt(alt))、血清谷草转氨酶(sgot(ast))、白蛋白(albumin)、总蛋白(total protein)、总胆红素(total bilirubin)、尿酸(uric acid)、葡萄糖(glucose)、钠(na)、钾(k)、氯(cl)、钙(calcium)、磷(phosphorus)
[0223]
尿液分析(urinalysis):比重(specific gravity)、颜色(color)、酸碱度(ph)、蛋白(protein)、葡萄糖、胆红素(bilirubin)、红细胞(blood)、白细胞
[0224]
湿疹面积及严重程度指数(easi,eczema area and severity index)测定特应性皮炎的疾病严重程度及程度,用于在身体的4个解剖学区域(头部、躯干、上肢及下肢)中测定红斑(erythema)、浸润(infiltration)、擦伤(excoriation)及苔藓化(lichenification)。总湿疹面积及严重程度指数分数从0(最小)到72(最大),高分反映特应性皮炎的严重程度。
[0225]
特应性皮炎评分(scorad,scoring atopic dermatitis)是在欧洲开发出来的用于评价特应性皮炎的疾病严重程度的临床工具,在国际上广泛使用。不仅评价主观症状(失眠症等),还评价湿疹的范围和强度并以分数表示。以2∶6∶2的比例评价出疹的范围、出疹的程度以及作为主观症状的瘙痒症和睡眠障碍等要素。总分数从0到103(重症)。
[0226]
通过体表面积(bsa,body surface area)评价受到特应性皮炎影响的患者的身体部位。各部位中的最高分数,头部及颈部为9%,前躯干(anterior trunk)为18%,后背(back)为18%,上肢(upper limbs)为18%,下肢(lower limbs)为36%以及外生殖器(genitals)为1%。
[0227]
视觉模拟评分(vas,visual analogue scale)在用于测定瘙痒程度的临床试验中
非常常用,其特征在于,具有很高的可靠性和有效性(validity)。左侧端点表示“不瘙痒”,右侧端点表示“最无法想象的瘙痒”。视觉模拟评分为0,表示无瘙痒症;视觉模拟评分<3,表示微弱的瘙痒症;3≤视觉模拟评分<7,表示中等程度的瘙痒症;7≤视觉模拟评分<9,表示重症瘙痒症;视觉模拟评分≥9,表示严重的瘙痒症。
[0228]
研究者整体评估(iga,investigator's global assessment)为通过5个阶段评价特应性皮炎的整体皮肤症状程度的方法,0表示透明;1表示几乎透明;2表示弱;3表示普通;4表示严重。当研究者整体评估的分数为0或1时,表示对治疗有反应的情况。
[0229]
4.4特应性皮炎治疗效果的确认
[0230]
1)患者信息及给药步骤
[0231]
参与临床试验的患者及给药的信息如下述表9所示。
[0232]
表9
[0233][0234][0235]
a患者为24岁女性患者,根据4.2中确立的临床方案第一次给药scm
‑
cgh2周后,再间隔2周追加给药2次(第一个周期)。在4周内共给药3次,采集血清后根据4.3的评价方法确认治疗效果。
[0236]
b患者在第一次给药scm
‑
cgh后,间隔两周再追加给药2次,在4周内共给药4次(第一个周期),在第一个周期结束7个月后,再次间隔2周给药2次,在4周内共给药3次(第二个周期)。
[0237]
2)患者疾病的严重程度减少的确认
[0238]
根据给药scm
‑
cgh的a患者的特应性皮炎疾病严重程度的改善效果如图28所示。
[0239]
如图28a所示,a患者在给药scm
‑
cgh后,确认表现特应性皮炎的疾病严重程度的湿疹面积及严重程度指数显著减小。具体地,a患者在进行第一个周期后的第12周(即临床试验开始后的第16周),湿疹面积及严重程度指数减少了87%,直到进行第一个周期后经过1年以上的第54周,湿疹面积及严重程度指数仍保持7.4的水平,确认减少了80%以上。
[0240]
如图28b所示,特应性皮炎评分虽然从随访(fu flollow
‑
up)端点之后到第54周表现出逐渐增加的趋势,但在随访端点上表现出减少70%的效果。
[0241]
如图28c所示,确认体表面积在进行第一个周期后在第12周减少,表现出与湿疹面积及严重程度指数相似的状态。
[0242]
a患者的湿疹面积及严重程度指数、特应性皮炎评分、体表面积的数值及研究者整体评估、嗜酸性粒细胞的计数结果如图29所示。
[0243]
如图29所示,在特应性皮炎评价指标中确认到均匀的症状改善效果。
[0244]
根据给药scm
‑
cgh的b患者的特应性皮炎疾病严重程度的改善效果如图30所示。
[0245]
b患者在第一个周期后确认了特应性皮炎症状的改善效果,但之后发现症状再次开始发生,于是在7个月后进行第二个周期。
[0246]
如图30a所示,b患者在进行第一个周期后的第12周(即临床试验开始后的第16周),湿疹面积及严重程度指数减少了80%以上,进行第二个周期后,湿疹面积及严重程度指数减少了50%以上。
[0247]
如图30b所示,特应性皮炎评分在第一个周期结束后表现出减少50%以上的趋势,尤其在第二个周期后,确认到持续低水平的特应性皮炎评分的减少。
[0248]
如图30c所示,体表面积测定结果,确认b患者在第一个周期后表现出非常优秀的体表面积减少趋势,第二个周期后减少的数值可以在长时间内保持一定的水平。
[0249]
在b患者的情况下,确认虽然仅通过第一个周期的给药就已使特应性皮炎的症状得到非常有效的好转,但随着时间的流逝,症状再次发生,当再次反复相同的周期时,减少了比第一个周期减少的幅度低的数值,可以在长时间内保持上述减少的数值。整体上,b患者的湿疹面积及严重程度指数评分保持在减少50%以上的水平,以第一次给药后约60周后为基准,保持了湿疹面积及严重程度指数减少72%,特应性皮炎评分减少55%的水平,本发明的临床应用结果表明可以表现出长期改善特应性皮炎的效果。
[0250]
b患者的湿疹面积及严重程度指数、特应性皮炎评分、体表面积的数值及研究者整体评估、嗜酸性粒细胞的计数结果如图31所示。
[0251]
如图31所示,确认b患者也通过第一个周期及第二个周期的干细胞给药在特应性皮炎评价指标中得到症状均匀改善的效果。
[0252]
进一步地,在b患者中调查了表现瘙痒症和睡眠障碍尺度的瘙痒(pruritus)及睡眠(sleep)。以0分到10分的分数评价了b患者的瘙痒症及睡眠障碍,其结果如图32所示。
[0253]
如图32所示,确认第二个周期后,患者的瘙痒症和睡眠障碍改善了50%以上,在第二个周期后经过34周的时间点,瘙痒症及睡眠障碍得到显著好转。
[0254]
3)患者的血清分析确认
[0255]
为了通过分子遗传学分析(酶联免疫吸附测定(elisa))从特应性皮炎患者中观察过敏性疾病的诊断及疾病严重程度的显著变化,采取注射干细胞治疗剂之前和之后的血清并进行分析。具体地,从a患者及b患者采取血清并进行了酶联免疫吸附测定分析。除血清以外,还可以在血浆、痰液、支气管肺泡液中稳定地测定,测定因再现性突出而作为反映哮喘及特应性皮炎之类的过敏性疾病的诊断及疾病严重程度的活体指标的ccl17、ccl22,从th1细胞测定作为促进γ干扰素(ifn
‑
g)生成的细胞因子的白细胞介素18(il
‑
18)、白细胞介素12(il
‑
12)及白细胞介素22(il
‑
22)。
[0256]
在a患者及b患者中测定效果的结果如图33及图34所示。
[0257]
如图33所示,确认在向a患者给药scm
‑
cgh后,血液中的特应性相关因子随着就诊次数的增加而持续减少。具体地,确认作为特应性标记的免疫球蛋白e浓度的结果表现出显著减少的趋势。并且,表现特应性皮炎的疾病严重程度的白细胞介素18及白细胞介素13也减少了,已知为在干性病变中增加的标记的白细胞介素17也显著减少了。作为th2趋化因子而反映过敏性疾病的诊断及疾病严重程度的活体指标的ccl17及ccl22的血液中浓度也显著减少了,尤其确认激活表皮的先天免疫反应并在干性病变中增加而引起表皮的过度增殖的白细胞介素22非常显著地减少了。
[0258]
如图34所示,在向b患者给药scm
‑
cgh后分析血液中特应性相关因子的变化的结果在b患者中也确认了相似的结果。b患者血液中的免疫球蛋白e在第一个周期给药之后减少了,在第二个周期给药后进一步减少了。虽然白细胞介素18、白细胞介素17及白细胞介素22在第一个周期给药后减少后又增加,但在第二个周期给药后减少了。白细胞介素13、ccl17及ccl22在血液中的浓度在第一个周期给药后减少,并在第二个周期给药后进一步减少。
[0259]
通过上述结果确认,在通过实施例4.2确立的临床方案给药本发明的单克隆间充质干细胞的情况下,可以在实际临床中治疗及改善特应性皮炎。
[0260]
4.5特应性治疗患者组确认标记的筛选
[0261]
根据在本发明中建立的临床方案,通过实施例4.4在a患者及b患者中确认了非常显著的特应性皮炎的治疗效果。然而,虽然在一部分患者组中表现出了特应性皮炎的改善效果,但临床症状的缓解效果相比于a患者组及b患者组显得微乎其微,因此追加分析了用于筛选适合本发明的临床方案的特应性治疗患者组的标记。将确认为治疗效果相对微弱的患者组设定为c至e的比较组,患者组的信息如表10所示。
[0262]
表10
[0263][0264]
在采取向患者注射干细胞治疗剂之前和之后的血液后,从血液中分离血清进行分析。具体地,从a患者至e患者中采取血清后,根据制造公司的说明书利用酶联免疫吸附测定分析程序比较分析标记的表达。
[0265]
比较确认为治疗效果非常优秀的适合应用本发明的治疗方法a患者组及b患者组与治疗效果相对较低的患者组的标记表达的结果,在白细胞介素10、白细胞介素13、γ
‑
干扰素、白细胞介素5中确认到显著的表达差异,其结果如图35所示。
[0266]
如图35所示,a患者组及b患者组同时显出白细胞介素10为20pg/ml以上,白细胞介素13为100pg/ml以上,与白细胞介素10为6pg/ml至15pg/ml,白细胞介素13为1.5pg/ml至40pg/ml的表现出低水平的c患者组至e患者组相比,显出很高的白细胞介素10、白细胞介素13的表达状态。
[0267]
并且,令人吃惊地在γ
‑
干扰素、白细胞介素5及白细胞介素17的表达方面也确认到完全不同的状态。在a患者组及b患者的情况下,在注射干细胞之前未检测出γ
‑
干扰素及白细胞介素5的表达,确认到白细胞介素17的表达,但在c患者至e患者的情况下,与此相反,检测到γ
‑
干扰素及白细胞介素5的表达,而未检测出白细胞介素17的表达。
[0268]
上述不同表明,在采用本发明的治疗方法之前,尤其可以通过测定上述标记的表达程度来预先筛选并确认特别适合的特应性皮炎患者组来预测预后。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。