slc25a26在制备抑制心肌肥厚的药物中的应用
技术领域
1.本发明属于生物医药技术领域,尤其涉及slc25a26在制备抑制心肌肥厚的药物中的应用。
背景技术:
2.在心脏后负荷增加的情况下,为适应血流动力学的改变,心脏代偿性发展为心肌肥厚。心力衰竭前,心肌肥厚的主要特征是心肌细胞体积增大,蛋白质合成增多。其中,代谢改变可微量调节蛋白质翻译活性。在心肌肥厚过程中,细胞如何通过协调代谢状态以维持蛋白质稳态尚待深入研究。
3.翻译的主要调控发生在核仁中,包括核糖体dna的转录与核糖体亚基的组装。心肌肥厚是最早被发现与核糖体dna转录障碍相关的疾病之一。在心肌肥厚进程中,dna聚合酶i(poli)的转录速率增加,使核糖体数量大幅增多。在心肌肥厚过程中,上游结合转录因子(upstream binding transcription factor,ubtf)已被证实可以调节poli的转录活性。但是,近些年有关翻译调控在心肌肥厚进程中的作用尚无实质性进展。
4.哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mtor)在蛋白质合成中发挥重要作用,主要是通过磷酸化70kd核糖体蛋白s6激酶(70kd ribosomal protein s6 kinase,p70s6k)与真核翻译起始因子4e结合蛋白1(eukaryotic translation initiation factor 4e binding protein
‑
1,4e
‑
bp1)引起一系列的信号转导进而促进核糖体运作。mtor对营养与生长因子高度敏感,其受到复杂而广泛的调控,且存在反馈调节机制。尽管mtor通常被认为与心肌肥厚的病理进程呈正相关,但其功能与调控机制仍不明确。研究发现,心肌特异性敲除mtor复合物的核心成分可损害心肌适应性肥大,同时会引起小鼠心力衰竭。另有研究报道,同时敲除编码p70s6k的两个基因,rps6kb1和rps6kb2,对小鼠压力超负荷诱导的心肌肥厚并无显著影响。我们前期研究发现,不同于mtorc1,mtorc2抑制了新生大鼠心肌细胞的心肌肥厚相关分子标志物,且能维持压力超负荷下的心肌收缩功能。此外,mtor信号激活具有瞬时性,其在激活后迅速消失。目前,尚不清楚mtor的持续活化对心肌肥厚过程中蛋白合成的影响。
5.s
‑
腺苷甲硫氨酸(s
‑
adenosylmethionine,sam)是一种营养感受的代谢产物,通过将甲基提供给dna,rna和蛋白质等生物大分子来调控一碳单位的代谢。细胞内sam利用mtorc1上游的sam传感器(sam sensor upstream of mtorc1,samtor或bmt2)与mtor信号通路紧密相关,但该调节过程是否参与心肌肥厚的进程尚不明确。
技术实现要素:
6.针对现有技术存在的问题,本发明提供了slc25a26在制备抑制心肌肥厚的药物中的应用,目的在于解决现有技术中的一部分问题或至少缓解现有技术中的一部分问题。
7.本研究揭示了心脏肥厚过程中slc25a26介导的sam稳态与蛋白质合成之间的内源性调控,为理解心肌肥厚过程中的复杂调控网络提供了一个新思路。本研究揭示了
slc25a26和sam/samtor/mtor信号轴在病理性心肌肥厚中的作用,本研究的结论可能同样也适用于其他疾病,例如癌症。
8.本发明提供了slc25a26在制备调控心肌肥厚和/或心力衰竭病程进展中的至少一项的试剂中的应用。具体为:slc25a26过表达能够减缓小鼠心肌肥厚,因此,促进slc25a26表达的试剂,如slc25a26的促进剂、增强剂,过表达质粒或载体等,均能够被制备成调控心肌肥厚的试剂或药物。
9.进一步地,所述心肌肥厚和/或心力衰竭由压力超负荷引起。
10.进一步地,所述压力超负荷包括tac手术诱导的压力超负荷。
11.进一步地,所述心肌肥厚和/或心力衰竭的病理改变包括心脏变大、左心室心肌细胞面积的增大、左心室厚度增大、左心室扩张、射血分数和短轴缩短率受损、血管周围和间质纤维化中的至少一种。
12.本发明还提供了slc25a26在制备调控sam水平的试剂中的应用。具体为促进slc25a26表达,使线粒体中sam含量增加,细胞核和细胞质中的sam水平减少。
13.本发明还提供了sam在制备调控slc25a26对心肌肥厚的影响、或slc25a26对蛋白质合成速率的影响的试剂中的应用。具体为:sam逆转slc25a26对心肌肥厚的保护作用,sam促进肥厚指标nppa、nppb及myh7的表达。sam在很大程度上逆转slc25a26过表达对蛋白质合成速率的抑制作用。
14.本发明还提供了slc25a26在制备负调控原代乳鼠心肌细胞(nrvm)的蛋白质合成的试剂中的应用。具体为:敲低slc25a26显著激活了蛋白翻译,过表达slc25a26则相反地抑制了蛋白翻译。
15.本发明还提供了雷帕霉素在制备调控slc25a26影响的nrvm的蛋白质合成的试剂中的应用。具体为:雷帕霉素显著逆转敲低slc25a26所诱导的蛋白合成的增加。
16.本发明还提供了samtor在制备调控slc25a26影响的nrvm的蛋白质合成的试剂中的应用。具体为:敲低samtor显著逆转过表达slc25a26对mef中蛋白质合成的抑制。
17.本发明还提供了slc25a26在制备调控p70s6k磷酸化水平的试剂中的应用。具体为:slc25a26缺失增强了细胞血清饥饿后的p70s6k磷酸化;而slc25a26过表达则抑制其磷酸化。
18.综上所述,本发明的优点及积极效果为:
19.本发明研究发现sam转运蛋白溶质载体家族25成员26(sam transporter solute carrier family 25 member 26,slc25a26)在心肌肥厚过程中受到动态调节。slc25a26作为抗心肌肥厚因子,通过控制细胞质中的sam水平和samtor/mtor信号传导来调节蛋白质合成速率。aav9介导的slc25a26在小鼠心脏中的过表达显著改善了经主动脉弓缩窄术(transverse aortic constriction,tac)诱导的心肌肥厚病理进程。本技术阐明了蛋白翻译调控在心肌肥厚进程中的作用,为通过靶向调控蛋白质合成防治心力衰竭提供了新思路。
20.本技术研究发现,sam在细胞核和线粒体中的含量相对较高,而在细胞质中较低。sam的亚细胞定位模式十分独特,不同于其他有机代谢物,而与离子(例如钙)相似。在tac诱导心力衰竭的小鼠心脏中,slc25a26易位至线粒体导致线粒体内的sam水平升高,但细胞核和细胞质中sam的水平不受影响。这些结果暗示sam的生物合成增加是为响应压力负荷,由
此增加的slc25a26发挥缓冲作用使细胞质中的sam维持在稳定水平。在线粒体中,sam转化为s
‑
腺苷同型半胱氨酸(sah)和高半胱氨酸(hcy),随后被转移至细胞质中进行降解或回收。因此,线粒体充当了细胞核或细胞质中产生的过量sam的储存场所。slc25a26介导的sam增加是否影响线粒体功能需要进一步深入研究。
21.作为sam的感受器,samtor的功能是向mtorc1提示甲硫氨酸是否充足。在甲硫氨酸剥夺条件下,samtor与gtpase激活蛋白raga/b(gtpase activating protein for raga/b,gator1)相互作用抑制溶酶体上mtorc1的激活。即使存在低浓度的sam,samtor
‑
gator1复合物也会被破坏。根据本技术中的观察,细胞质sam水平受slc25a26严格控制;而slc25a26如何感受sam水平,如何调节其活性以及如何转移sam有待更深入的研究。有趣的是,slc25a26和samtor在真核生物中均高度保守,表明这两种途径可能同时发生进化。
22.mtor为翻译调控的核心,因其整合了源自多种营养物质与生长因子的信号转导。令人困惑的是,不同的刺激因素如何通过单一的信号通路而导致不同的信号输出,mtor活性的代谢依赖性修饰可能提供了不同的解释维度。信号通路的活化时间窗通常很短,细胞会根据胞内代谢水平对胞外信号做出适当反应,以免反应过度。
23.考虑到mtor在细胞存活中的关键作用及其失活后存在的多种副作用,mtor并不适合作为治疗药物的靶点。本研究为心肌肥厚的防治提供了多个潜在的分子靶点。心脏中过表达slc25a26可有效降低细胞质中sam水平并抑制蛋白质合成,使其成为治疗心肌肥厚的潜在治疗靶点。降低sam生物合成或促进其降解对心肌肥厚的治疗也很有价值。
24.综上所述,本技术的研究揭示了心肌肥厚过程中slc25a26的动态调节过程。slc25a26作为抗心肌肥厚因子,将sam从细胞质转移至线粒体,恢复samtor对mtor信号的抑制作用,随后抑制蛋白质合成。因此,靶向细胞质中的sam将成为治疗心肌肥厚与心力衰竭的一种新型治疗策略。
附图说明
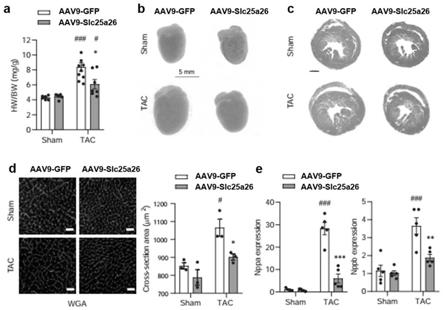
25.图1是slc25a26在心肌肥厚中向线粒体易位;tac术后slc25a26的mrna水平(a)和蛋白水平(b);tac术后细胞核、细胞质、线粒体中slc25a26蛋白(c)和sam水平(d)的变化。*p<0.05,**p<0.01。
26.图2是aav9
‑
slc25a26感染的小鼠线粒体内sam水平显著升高。(a)aav9
‑
gfp的感染效率检测;aav9
‑
slc25a26感染的小鼠的slc25a26mrna(b)和蛋白(c)水平,以及线粒体中的slc25a26蛋白水平(d);(e)aav9
‑
slc25a26感染小鼠线粒体、细胞核和细胞质内sam水平。*p<0.05,**p<0.01,***p<0.001 versus aav
‑
gfp。
27.图3是slc25a26过表达减轻tac手术诱导的心肌肥厚。aav9
‑
slc25a26感染小鼠在sham和tac术后心脏重量(a)、心脏大小(b)和左心室厚度(c);aav9
‑
slc25a26的对照组为aav9
‑
gfp。(d)tac术后aav9
‑
gfp和aav9
‑
slc25a26感染小鼠的心脏组织切片wga染色(标尺,10μm);(e)tac后nppa和nppb的表达上调被slc25a26过表达减轻。*p<0.05,**p<0.01,***p<0.001 versus aav
‑
gfp;#p<0.05,###p<0.001 versus control(students't test).
28.图4是slc25a26过表达可明显改善受损的心功能。(a)slc25a26过表达对有无手术小鼠左室心功能影响的代表性超声心动图。(b)射血分数(ef)和短轴缩短分数(fs),舒张末期左室后壁厚度(lvpw;d),(c)舒张末期左室内径(lvid;d),(d)tac术后各组masson染色组
织学分析(标尺50μm)。*p<0.05,***p<0.001 versus aav
‑
gfp;##p<0.01,###p<0.001 versus control(students't test).
29.图5是slc25a26抑制蛋白合成速率。nrvm在pe处理的条件下,敲低slc25a26对蛋白合成速率影响检测(a),及其量化统计结果(b);control为pe的对照,*p<0.05,***p<0.001 versus sineg;#p<0.05 versus control(students't test)。敲低(d)、过表达(f)slc25a26对mef细胞蛋白合成速率的影响;slc25a26敲低(c)过表达(e)效果检测。*p<0.05,***p<0.001(students't test)。
30.图6是slc25a26通过mtor信号通路抑制蛋白合成。(a)雷帕霉素显著抑制了mef中slc25a26敲低后增强的蛋白合成。在mef中敲低(b)或过表达(c)slc25a26,给与不同时间长度的饥饿处理,然后检测p
‑
p70s6k。**p<0.01,***p<0.001 versus dmso;###p<0.001 versus sineg(students't test).
31.图7是sam/samtor介导slc25a26对mtor信号通路的影响。(a)sam在很大程度上逆转了slc25a26对mef细胞中蛋白合成率的抑制作用。(b)mef中samtor的敲低效果检测。(c)sisamtor可逆转slc25a26对mef细胞中蛋白合成的抑制作用。*p<0.05,**p<0.01;#p<0.05(students't test).
32.图8是sam可以逆转slc25a26对心肌肥厚的保护作用。(a)rslc25a26的过表达水平检测;(b)过表达rslc25a26后nppa,nppb和myh7的减少被sam逆转。*p<0.05,**p<0.01,***p<0.001 versus dmso;#p<0.05,###p<0.001 versus control(students't test).
具体实施方式
33.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
34.根据本技术包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
35.为了更好地理解本发明而不是限制本发明的范围,在本技术中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。本发明中,“约”指给定值或范围的10%以内,优选为5%以内。
36.本发明下述各实施例中未特别限定温度时,则均为常温条件。常温是指四季中自然室温条件,不进行额外的冷却或加热处理,一般常温控制在10~30℃,最好是15~25℃。
37.本发明披露了slc25a26在制备抑制心肌肥厚的药物中的应用,本技术研究发现,slc25a26,一种s
‑
腺苷酸甲硫氨酸(sam)转运体,在心肌肥厚过程中转移至线粒体。slc25a26基因沉默加剧了苯甲基肾上腺素诱导的新生大鼠心肌细胞肥大。转录组分析表明
slc25a26对核糖体基因存在特异性调控。嘌呤霉素结合实验显示slc25a26负向调控蛋白质的合成,其潜在分子机制与调控核糖体的组装相关。sam处理或samtor基因沉默可逆转slc25a26对蛋白质合成的抑制作用。aav9介导的slc25a26过表达增加了小鼠心脏线粒体中的sam水平,但减少了细胞核和细胞质中的sam水平。slc25a26过表达显著缓解了tac手术诱导的心肌肥厚的病理性改变,包括心肌肥厚分子标志物的表达增加、心肌细胞横截面积增大和心功能障碍。本研究结果表明,亚细胞sam稳态在心肌肥厚的蛋白翻译控制中发挥着关键作用。
38.本技术的具体实验内容如下实施例所示:
39.实施例
40.本发明本实施例中的实验方法如下:
41.1、动物饲养
42.所有动物实验程序均由武汉大学人民医院动物管理与使用委员会(iacuc)审核批准,并按照美国国立卫生研究院(national institutes of health,usa)出版的实验动物管理与使用指南(第8版)执行。所有小鼠在spf环境中饲养,室温24
±
3℃,湿度55
±
5%,12小时光照/12小时黑暗循环,喂食正常饲料。本研究采用c57bl/6的9周龄雄性小鼠。c57bl/6的7周龄雄性小鼠随机分为两组,通过尾静脉注射等量的aav9
‑
gfp和aav9
‑
slc25a26病毒。
43.2、原代大鼠心肌细胞(nrvm)的分离及培养
44.以75%乙醇消毒sd大鼠新生乳鼠(出生3天内)的胸部皮肤。采用弯剪剪开胸部皮肤及肋骨,用弯镊取出心脏,放入置于冰上的盛有pbs的皿里。去除附着在心脏表面的大血管、心耳和心房,将心室组织剪碎至1mm2。添加0.08%ii型胶原酶(sigma)和0.125%胰蛋白酶(sigma)消化液,37℃消化20min/次。第一次丢弃上清,第二次开始收集上清。这一过程一直持续到心脏组织被完全消化。采用percoll(ge)密度梯度离心法分离成纤维细胞,在含10%胎牛血清(gbico)、1%青霉素/链霉素的高糖dmem(hyclone)培养基中培养。培养24h后,培养基改为含有1%its、1%青霉素/链霉素的高糖dmem。
45.3、小鼠胚胎成纤维细胞(mef)的培养
46.小鼠胚胎成纤维细胞(mef),用含10%胎牛血清(gbico)、1%青霉素/链霉素的高糖dmem(hyclone)培养基培养,每天观察换液。实验前一天,将细胞以5
×
105细胞/孔的密度置于6孔细胞培养板上,培养至80%的密度开始实验处理。
47.4、sam处理细胞
48.s
‑
(5
′‑
腺苷)
‑
l
‑
蛋氨酸氯化物二盐酸盐(sam,sigma
‑
aldrich),先用dmso进行溶解,再以0.22μm无菌滤膜在超净工作台过滤sam溶液。以1mm sam处理细胞36h后收获细胞。
49.5、雷帕霉素(rapamycin)处理细胞
50.雷帕霉素(sigma
‑
aldrich)以dmso进行溶解配制1mm储存液。收获细胞前24h,加入雷帕霉素100nm处理mef细胞。
51.6、质粒构建
52.小鼠和大鼠slc25a26的全长cdna序列mslc25a26(nm_026255.5)和rslc25a26(nm_001108638.1)从美国国家生物技术信息中心(ncbi)获得。按照分子生物学领域中的常规方法,将小鼠和大鼠slc25a26的整个编码区克隆到pcdna3.1
‑
ha质粒的nhei和xbai位点,构建pcdna3.1
‑
mslc25a26
‑
ha和pcdna3.1
‑
rslc25a26
‑
ha重组质粒。利用引物mslc25a26czf(5'
‑
gggagacccaagctggctagcgccaccatggacgcgccgggcttc
‑
3',seq id no.1)和mslc25a26czr(5'
‑
tacgtcgtatgggtatctagatgggctcttcctgcccac
‑
3',seq id no.2)扩增成熟mslc25a26肽的cdna片段。利用引物rslc25a26czf(5'
‑
gggagacccaagctggctagcgccaccatggacgccgggcttc
‑
3',seq id no.3)和rslc25a26czr(5'
‑
tacgtcgtatgggtatctagaagacctaaggtggaactgtggtct
‑
3',seq id no.4)扩增成熟rslc25a26肽的cdna片段。采用本领域常规方法,将pcdna3.1
‑
mslc25a26
‑
ha和pcdna3.1
‑
rslc25a26
‑
ha转入大肠杆菌dh
‑
5α,进行质粒的大规模复制。随后将质粒送往上海汉恒生物科技有限公司进行病毒包装。以编码绿色荧光蛋白基因的腺相关病毒载体作为对照。
53.7、细胞转染实验
54.细胞水平的过表达通过质粒转染完成。通过将pcdna3.1
‑
rslc25a26
‑
ha质粒转染nrvm或将pcdna3.1
‑
mslc25a26
‑
ha质粒转染mef,在大鼠和小鼠细胞中实现slc25a26过表达。转染试剂选用lipofectamine 2000(invitrogen),方法按照说明书进行。
55.通过sirna转染抑制细胞中某些基因的表达。rslc25a26、mslc25a26和msamtor特异性sirna寡核苷酸购自吉玛生物。使用的sirna的靶序列序列如下:rslc25a26sirna,5
’‑
ggacttgatattatttcctttggat
‑3’
,seq id no.23;mslc25a26sirna 5
’‑
cgtctctgtggacttgatattattt
‑3’
,seq id no.24;msamtor sirna,5
’‑
cctttgtgaaagggttgcacgtgta
‑3’
,seq id no.25。根据制造商的说明,使用lipofectamine imax(invitrogen)进行sirna转染。
56.8、嘌呤霉素掺入实验
57.对于nrvm或mef细胞,在检测其蛋白翻译速率时,需通过嘌呤霉素掺入实验来完成。收细胞前,在细胞培养基中加入嘌呤霉素,终浓度1μm处理30mins,然后,收细胞、提蛋白,通过wb实验用anti
‑
puromycin抗体来检测嘌呤霉素掺入量,从而反映蛋白翻译速率。
58.9、主动脉缩窄手术(tac)
59.主动脉缩窄术(tac)按照文献描述进行,均为本领域常规操作。aav
‑
gfp和aav
‑
slc25a26雄性c57bl/6j小鼠(9周龄,体重24
‑
26g)随机分为假手术组(sham)和tac组,分组信息在执行手术的研究者和数据分析者之间双盲。小鼠腹腔注射50mg/kg戊巴比妥钠麻醉,固定在手术台上,由小鼠微型呼吸机支撑(alcott生物技术,上海,中国)呼吸。呼吸速率设置为110次呼吸/分,潮气量为2ml,吸气/呼气比为1:2。实验过程中使用自调节加热垫将小鼠体温保持在37℃。用脱毛膏脱毛并常规消毒后,在胸骨旁第二肋骨处剪开小鼠皮肤。在显微镜下对第二根肋骨进行断开并撑开胸廓,在确定横主动脉后,将27号针放置于头臂干无名动脉与左颈总动脉之间,用7
‑
0丝线结扎主动脉,随后迅速取出针;然后胸腔被一层一层地缝合。在假手术对照小鼠中,除主动脉结扎外,整个过程是相同的。术后第二天采用超声多普勒检查证实主动脉成功缩窄。
60.10、心脏超声
61.主动脉缩窄术8周后,通过超声心动图评估心功能。首先,用1.5
‑
2%异氟烷对小鼠进行吸入性维持麻醉并处于仰卧位。用vevo2100系统经胸骨旁采集心脏短轴二尖瓣乳头肌段m型超声心动图。根据美国超声心动图学会的指南,至少测量连续3个心动周期的左室收缩期/舒张期室间隔厚度(left ventricular end systolic/diastolic interventricular septum thickness,ivss/ivsd),左室收缩末期/舒张末期后壁厚度
(left ventricular end systolic/diastolic posterior wall thickness,lvpws/lvpwd),左室收缩末期/舒张末期内径(left ventricular end systolic/diastolic internal diameter,lvids/lvidd),然后取平均值。并依此计算左心室收缩/舒张末期容积(left ventricular end systolic/diastolic volume,lvesv/lvedv)、左心室射血分数(left ventricular ejection fraction,lvef)和左心室短轴缩短率(left ventricular fractional shortening,lvfs)。
62.11、组织病理学分析
63.超声心动图检查完成后,小鼠被称量体重,并被处死以收获心脏。切除的心脏先用1mm氯化钾溶液浸泡,使心脏处于舒张期。然后,用0.9%生理盐水冲洗心脏,并用吸水纸吸干表面液体称重。取部分心脏组织以4%多聚甲醛在室温下固定24小时,然后行石蜡包埋。随后,这些心脏以5μm的厚度被横切,切片用苏木精
‑
伊红染色(he)进行组织病理学检查,用小麦胚芽凝集素染色(wga)测量心肌细胞横切面积(csa),用masson染色评估胶原沉积情况。这些染色切片在显微镜下观察,然后用image
‑
pro plus 6.0(media cybernetics,bethesda,md,usa)分析。每组有超过100个肌细胞测量计算csa。每组在左室间质和血管周围至少有50个区域测量心肌纤维化程度。
64.12、western blot
65.从细胞和心脏组织中提取总蛋白。细胞和心脏组织用ripa裂解缓冲液中裂解(beyotime,nanjing,china)。细胞溶解产物和心脏匀浆液在4℃,12000g离心15mins。用bca蛋白定量试剂盒测定蛋白浓度,取同等质量的蛋白质提取物进行凝胶电泳(sds
‑
page)进行蛋白分离,然后转移到pvdf膜上。用5%脱脂牛奶在室温下封闭pvdf膜1小时,然后用特异性一抗在4℃下孵育过夜。第二天,用tbst洗涤3次后,用二抗室温孵育1h,再用tbst洗涤3次。最后,用化学发光试剂(中国南京beyotime)检测膜上的蛋白条带。化学发光信号使用ecl成像仪定量,并使用quantity one软件(bio
‑
rad,hercules,ca,usa)进行分析。特异性一抗为:anti
‑
slc25a26(abclonal),anti
‑
gapdg(proteintech),anti
‑
histone3(proteintech),anti
‑
cox1(abcam),anti
‑
atp5a(abcam),anti
‑
p70s6k,anti
‑
p
‑
p70s6k和anti
‑
puromycin(merck millipore)。
66.13、实时定量pcr
67.使用genelute哺乳动物总rna miniprep试剂盒(sigma
‑
aldrich),按照制造商的说明从细胞和心脏组织中提取总rna。使用nanodrop(thermo fisher scientific)对rna进行定量。使用第一链cdna合成试剂盒(thermo fisher scientific,u.s.a.)逆转2μg rna合成cdna。采用特异性引物和ultra sybr mixture(mona,中国苏州)在cfx96m touch real
‑
time pcr检测系统(roche,basel,瑞士)上进行实时荧光定量pcr。qrt
‑
pcr的反应体系如下:
68.69.先将除cdna外的反应体系加入96孔板中,再将1μl的cdna加入相应的孔中,使用透明膜密封96孔板。96孔板在室温下4500rpm离心2min后,放入实时定量pcr仪进行检测。反应程序如下:
[0070][0071]
反应结束后,通过熔解曲线判断引物的特异性,通过ct值计算得出目的基因的含量。本技术所用pcr引物序列见表1。以gapdh为内源对照,测定基因的相对表达量。
[0072]
表1 引物序列
[0073]
[0074][0075]
14、sam含量分析
[0076]
为了检测小鼠心脏线粒体、细胞质和细胞核中sam的含量,对小鼠心脏线粒体、细胞质和细胞核组分进行了分离。首先,称取15
‑
30mg新鲜心肌组织,用pbs或生理盐水冲洗血液,并用滤纸将组织块表面剩余液体吸干。然后将组织放入置于冰上的离心管或培养皿中,用剪刀或刀片将组织切成非常细的组织碎片,并将其放入冰的玻璃匀浆器中。将200μl预冷线粒体分离液加入匀浆器,冰浴研磨20次。将组织匀浆移至另一干净离心管中,800g 4℃离心5mins。此时,细胞核在管的底部。将上清转移到另一个预冷的干净离心管中,8000g 4℃离心10mins,离心后上清为细胞质成分,转移上清到新的离心管中,沉淀为线粒体。在线粒体颗粒中加入1ml线粒体分离液洗涤,洗涤2
‑
3次,然后用60ul线粒体分离液(含蛋白酶抑制剂、磷酸酶抑制剂和pmsf)溶解线粒体颗粒,放置于冰上。然后用hlb(10mm tris(ph 7.5),10mm nacl,3mm mgcl2,0.3%(vol/vol)np
‑
40and10%(vol/vol)glycerol)清洗上述核蛋白沉淀3
‑
5次,再用100ul nlb(20mm tris ph 7.5,150mm kcl,3mm mgcl2,0.3%(vol/vol)np
‑
40and 10%(vol/vol)glycerol)(含蛋白酶抑制剂、磷酸酶抑制剂、pmsf)溶解核颗粒。最后,将线粒体溶液与细胞核溶液在冰浴中以20%功率超声3次,每次超声间隔2mins,每次超声时间为15s,然后在4℃下12000rpm离心10mins,得到上清液为线粒体蛋白和核蛋白。采用bca法测定各组分的蛋白质浓度,并将浓度调整到相同水平。
[0077]
将上述获得的细胞质蛋白溶液、线粒体蛋白溶液、核蛋白溶液通过elisa试剂盒(ml360827,mlbio,china)检测各组分sam含量,具体方法按试剂盒说明执行。
[0078]
15、统计学分析
[0079]
采用graphpad prism 8软件进行统计分析。所有实验数据以至少三个独立实验的平均值
±
sem表示。多重比较的统计学意义采用单因素方差分析或双因素方差分析,然后采用tukey检验。bonferroni调整用于事后分析。两组间比较采用t检验。p<0.05为差异有统计学意义。
[0080]
本发明本实施例中的实验结果如下:
[0081]
1.心肌肥厚进程中slc25a26转移至线粒体
[0082]
我们在小鼠tac术后的心脏组织中,发现其mrna水平降低(图1a);但slc25a26蛋白水平却增多,呈现相反的趋势(图1b)。有趣的是,亚细胞分离实验发现tac术后slc25a26蛋白向线粒体转移显著增加(图1c);同时,我们发现tac手术后线粒体中sam水平显著增加,但不影响细胞核或细胞质中的sam含量(图1d)。综上所述,我们发现slc25a26可能与心肌肥厚疾病进程紧密相关。
[0083]
2.slc25a26过表达能减缓tac手术诱导的小鼠心肌肥厚
[0084]
为探究slc25a26的治疗潜力,我们构建了小鼠slc25a26过表达的9型腺相关病毒(adeno
‑
associated virus 9,aav9),并以aav9
‑
gfp作为对照(图2a)。实验结果发现,感染aav9
‑
slc25a26小鼠的心脏,slc25a26mrna水平(图2b)和蛋白水平(图2c)均升高,其线粒体易位性也显著增强(图2d)。同时,我们观察到线粒体中sam含量显著增加,细胞核和细胞质中的sam水平明显减少(图2e)。
[0085]
随后,在tac手术构建的小鼠心肌肥厚模型中,我们发现与aav9
‑
gfp组相比,
slc25a26过表达显著降低了tac诱导的心重体重比增加(图3a)、心脏体积增大(图3b)和左心室室壁厚度增加(图3c)。在细胞水平上,slc25a26的过表达明显抑制了tac诱导的左心室心肌细胞横截面积的增大(图3d)。此外,tac手术诱导的nppa和nppb mrna水平增加在很大程度上被slc25a26过表达所逆转(图3e)。
[0086]
超声心动图显示slc25a26的过表达显著改善了tac术后受损的射血分数和短轴缩短分数,并阻止了左心室的扩张(图4a
‑
c)。另外,tac诱导的血管周围和间质纤维化基本上被slc25a26的过表达抑制(图4d)。综上所述,我们的实验结果表明slc25a26在压力超负荷引起的心肌肥厚和心力衰竭中具有保护作用。
[0087]
3.slc25a26通过mtor信号通路抑制蛋白合成速率
[0088]
嘌呤霉素具有与trna分子末端类似的结构,能够同氨基酸结合,代替氨酰化的trna同核糖体的a位点结合,并掺入到生长的肽链中。虽然嘌呤霉素能够同a位点结合,但是不能参与随后的任何反应,因而导致蛋白质合成的终止并释放出c
‑
末端含有嘌呤霉素的不成熟蛋白质。因此,我们通过嘌呤霉素掺入试验,以评估slc25a26对蛋白质合成的影响。在基础条件下和pe处理后,slc25a26降低导致nrvm的蛋白质合成速率加快(图5a,b)。在小鼠胚胎成纤维细胞(mef)中,敲低slc25a26显著增强了蛋白翻译水平(图5c,d),而过表达slc25a26则相反的抑制了蛋白翻译(图5e,f)。这些结果表明slc25a26对蛋白质合成具有保守的负调控作用。
[0089]
雷帕霉素是mtor的抑制剂,在slc25a26敲低后,雷帕霉素显著逆转了敲低slc25a26所诱导的蛋白合成的增加(图6a)。mtor信号通路对营养状态敏感。我们发现slc25a26降低增强了细胞血清饥饿后的p70s6k磷酸化(图6b);而slc25a26过表达则抑制其磷酸化(图6c),表明mtor信号参与了slc25a26介导的翻译调节。
[0090]
4.sam/samtor介导slc25a26对mtor信号通路的影响
[0091]
接着,我们检测slc25a26对蛋白质合成的调控是否依赖于其转运蛋白活性:即sam从细胞质转移到线粒体。sam的作用在很大程度上逆转了slc25a26对蛋白质合成速率的抑制作用(图7a),说明slc25a26的作用可能是细胞质中sam水平的降低,而不是线粒体中sam水平的升高。mtorc1上游s
‑
腺苷甲硫氨酸传感器(samtor;也被称为bmt2)既是sam的传感器,也是mtor的抑制剂。敲低samtor显著逆转了过表达slc25a26对mef中蛋白质合成的抑制(图7b,c)。这些数据表明sam/samtor介导slc25a26对mtor信号的调控。
[0092]
5.sam可以逆转slc25a26对心肌肥厚的保护作用
[0093]
为了进一步鉴定slc25a26发挥抑制心肌肥厚功能是否与其转运sam的功能相关,我们在大鼠原代心肌细胞中过表达大鼠的slc5a26(rslc5a26)同时加1mm的sam。图8a证明rslc25a26被明显过表达,且加sam不影响rslc25a26的表达;然后,检测肥厚指标nppa、nppb及myh7的表达发现,sam逆转slc25a26对心肌肥厚的保护作用(图8b)。从而证明,slc25a26发挥抑制心肌肥厚的功能与作为sam转运体转运sam有关。
[0094]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。