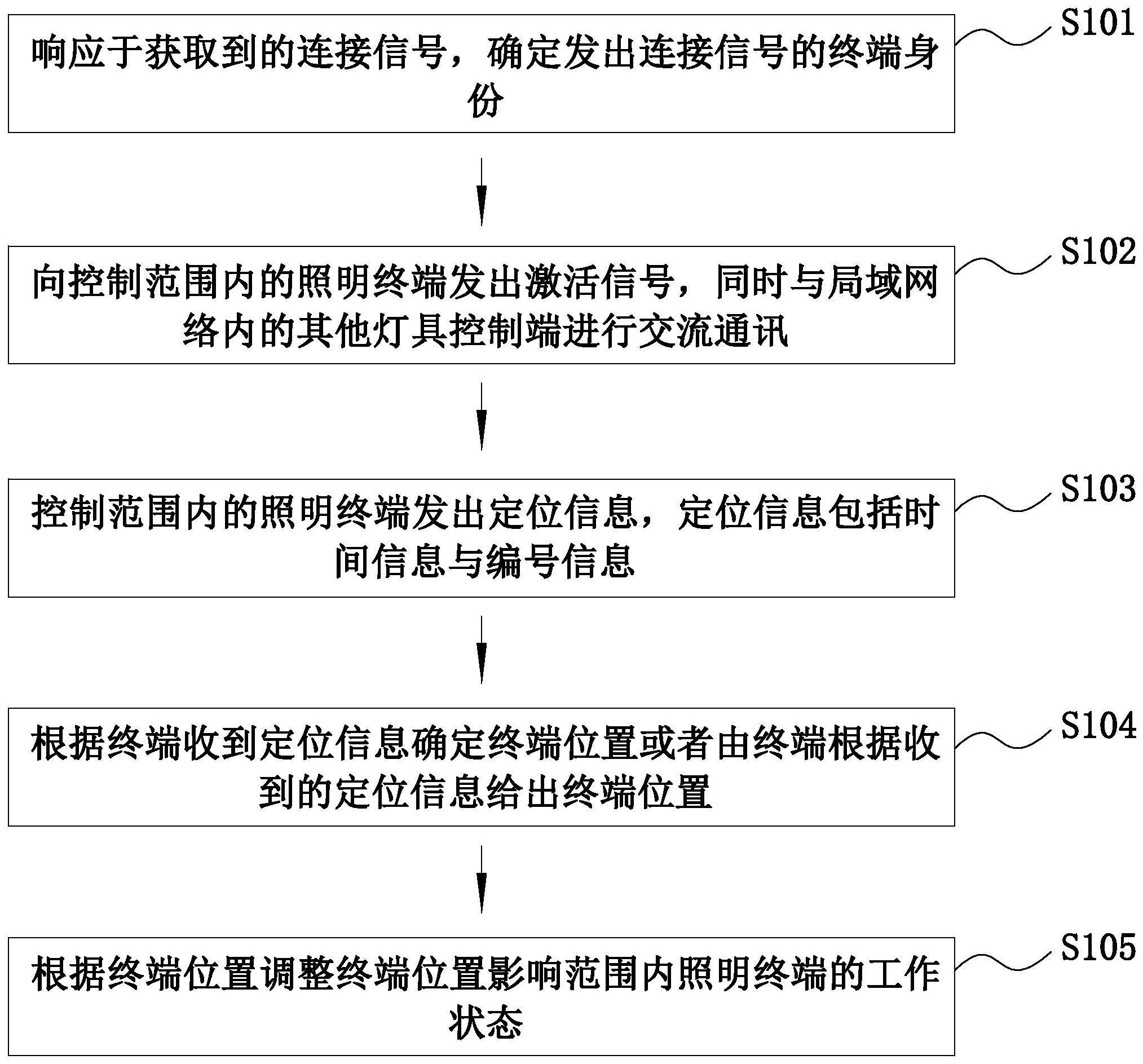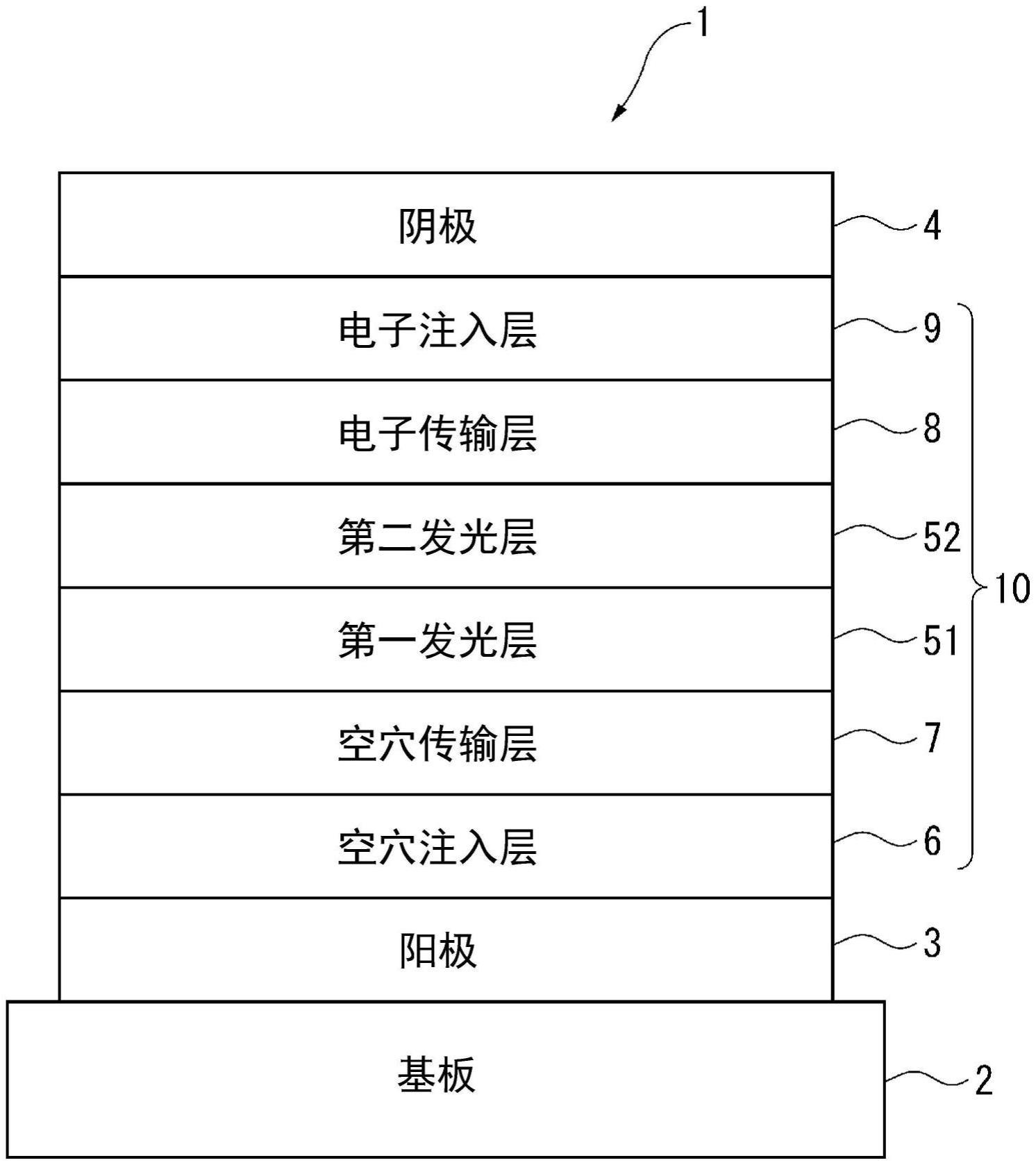
1.本发明涉及有机电致发光元件、电子设备和有机电致发光元件的制造方法。
背景技术:
2.有机电致发光元件(以下有时称为“有机el元件”。)应用于移动电话和电视等的全彩显示器。若对有机el元件施加电压,则从阳极向发光层注入空穴,而且从阴极向发光层注入电子。然后,在发光层中,所注入的空穴与电子发生复合而形成激子。此时,根据电子自旋的统计规则,单重态激子以25%的比例生成,以及三重态激子以75%的比例生成。
3.为了实现有机el元件的性能提高,例如专利文献1~3中研究了使多个发光层层叠。另外,专利文献1记载了由2个三重态激子生成1个单重态激子的现象(以下有时称为triplet-triplet fusion=ttf现象。)。专利文献1记载的有机发光元件其特征在于,由阳极、阴极和夹在该阳极与该阴极之间的由有机化合物形成的层构成,该由有机化合物形成的层包含由第一材料形成的第一发光区域和由该第一材料和第二材料形成的第二发光区域,该第二材料的能隙大于该第一材料的能隙,该第二材料的最低三重态激发能量小于该第一材料的最低三重态激发能量。
4.作为有机el元件的性能,例如可以举出亮度、发光波长、色度、发光效率、驱动电压和寿命。
5.现有技术文献
6.专利文献
7.专利文献1:日本特开2009-16478号公报
8.专利文献2:日本特开2011-103189号公报
9.专利文献3:美国专利申请公开2019/280209号说明书
技术实现要素:
10.发明要解决的问题
11.对于层叠有多个发光层的有机el元件,期望进一步提高性能。
12.本发明的目的之一是提供性能提高的有机电致发光元件。另外,本发明的另外的目的之一是提供发光效率提高的有机电致发光元件、提供搭载了该有机电致发光元件的电子设备、以及提供该有机电致发光元件的制造方法。
13.用于解决问题的手段
14.根据本发明的一个方案,提供一种有机电致发光元件,其具有
15.阳极、
16.阴极、和
17.配置于上述阳极与上述阴极之间的发光层,
18.上述发光层包含第一发光层和第二发光层,
19.上述第一发光层包含第一主体材料和第一发光性化合物,
20.上述第二发光层包含第二主体材料和第二发光性化合物,
21.上述第一主体材料与上述第二主体材料相互不同,
22.上述第一发光性化合物与上述第二发光性化合物相互相同或者不同,
23.上述第一主体材料的三重态能量t1(h1)与上述第二主体材料的三重态能量t1(h2)满足下述数学式(数学式1)的关系,
24.由扩散方程式算出的上述第一主体材料的三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上。
25.t1(h1)>t1(h2)
…
(数学式1)
26.根据本发明的一个方案,提供一种有机电致发光元件,其具有
27.阳极、
28.阴极、和
29.配置于上述阳极与上述阴极之间的发光层,
30.上述发光层包含第一发光层和第二发光层,
31.上述第一发光层包含第一主体材料和第一发光性化合物,
32.上述第二发光层包含第二主体材料和第二发光性化合物,
33.上述第一主体材料与上述第二主体材料相互不同,
34.上述第一发光性化合物与上述第二发光性化合物相互相同或者不同,
35.上述第一主体材料的三重态能量t1(h1)与上述第二主体材料的三重态能量t1(h2)满足下述数学式(数学式1)的关系,
36.上述第一主体材料的表面电势v1为-11(mv/nm)以下。
37.t1(h1)>t1(h2)
…
(数学式1)
38.根据本发明的一个方案,提供一种电子设备,其中搭载了上述的本发明的一个方案涉及的有机电致发光元件。
39.根据本发明的一个方案,提供一种有机电致发光元件的制造方法,所述有机电致发光元件具有阳极、阴极以及配置于上述阳极与上述阴极之间的第一发光层和第二发光层,
40.所述制造方法具有形成包含第一主体材料和第一发光性化合物的上述第一发光层的工序、和
41.形成包含第二主体材料和第二发光性化合物的上述第二发光层的工序,
42.上述第一主体材料与上述第二主体材料相互不同,
43.上述第一发光性化合物与上述第二发光性化合物相互相同或者不同,
44.在形成上述第一发光层的工序和形成上述第二发光层的工序中使用的上述第一主体材料和上述第二主体材料选自满足下述数学式(数学式1)和数学式(数学式6)的材料。
45.t1(h1)>t1(h2)
…
(数学式1)
46.d1≥3.0
×
10-9
(cm2/s)
…
(数学式6)
47.(在上述数学式(数学式1)和数学式(数学式6)中,
48.t1(h1)为上述第一主体材料的三重态能量t1(h1),
49.t1(h2)为上述第二主体材料的三重态能量t1(h2),
50.d1为由扩散方程式算出的上述第一主体材料的三重态能量t1(h1)的扩散系数。)
51.根据本发明的一个方案,提供一种有机电致发光元件的制造方法,所述有机电致发光元件具有阳极、阴极以及配置于上述阳极与上述阴极之间的第一发光层和第二发光层,
52.所述制造方法具有形成包含第一主体材料和第一发光性化合物的上述第一发光层的工序、和
53.形成包含第二主体材料和第二发光性化合物的上述第二发光层的工序,
54.上述第一主体材料与上述第二主体材料相互不同,
55.上述第一发光性化合物与上述第二发光性化合物相互相同或者不同,
56.在形成上述第一发光层的工序和形成上述第二发光层的工序中使用的上述第一主体材料和上述第二主体材料选自满足下述数学式(数学式1)和数学式(数学式6)的材料。
57.t1(h1)>t1(h2)
…
(数学式1)
58.d1≥3.0
×
10-9
(cm2/s)
…
(数学式6)
59.(在上述数学式(数学式1)和数学式(数学式6)中,
60.t1(h1)为上述第一主体材料的三重态能量t1(h1),
61.t1(h2)为上述第二主体材料的三重态能量t1(h2),
62.d1为由扩散方程式算出的上述第一主体材料的三重态能量t1(h1)的扩散系数。)
63.根据本发明的一个方案,能够提供性能提高的有机电致发光元件。另外,根据本发明的一个方案,能够提供发光效率提高的有机电致发光元件。另外,根据本发明的一个方案,能够提供搭载了该有机电致发光元件的电子设备。另外,根据本发明的一个方案,能够提供该有机电致发光元件的制造方法。
附图说明
64.图1是表示瞬态pl数据测定用试样1的瞬态pl光谱的图。
65.图2a是对于向瞬态pl数据测定用试样1入射激发光时的三重态的行为和密度进行说明的图。
66.图2b是对于从向瞬态pl数据测定用试样1入射激发光起经过时间t1时的三重态的行为和密度进行说明的图。
67.图2c是对于从向瞬态pl数据测定用试样1入射激发光起经过时间t2时的三重态的行为和密度进行说明的图。
68.图3是表示瞬态pl数据测定用试样1的瞬态pl光谱和进行拟合后的瞬态pl光谱的图。
69.图4是表示第一实施方式和第二实施方式涉及的有机电致发光元件的一例的大致构成的图。
70.图5是表示第一实施方式和第二实施方式涉及的有机电致发光元件的另一例的大致构成的图。
71.图6是表示实施例和比较例涉及的第一主体材料的三重态能量t1(h1)的扩散系数d1和层叠元件的ttf比率的关系的曲线图。
72.图7是表示瞬态el波形的测定系统的图。
73.图8a是表示源自ttf的发光强度比的测定方法的图,是表示el元件的发光强度的时间变化的曲线图。
74.图8b是表示源自ttf的发光强度比的测定方法的图,是表示光强度的平方根的倒数的时间变化的曲线图。
75.图9是表示实施例和比较例涉及的第一主体材料的表面电势v1和层叠元件的eqe的关系的曲线图。
具体实施方式
76.[定义]
[0077]
在本说明书中,氢原子意味着包含中子数不同的同位素、即氕(protium)、氘(deuterium)和氚(tritium)。
[0078]
在本说明书中,在化学结构式中,没有明确显示“r”等符号和表示氘原子的“d”的可键合位置设为键合有氢原子、即氕原子、氘原子或氚原子。
[0079]
在本说明书中,成环碳数是指原子以环状键合的结构的化合物(例如单环化合物、稠环化合物、桥环化合物、碳环化合物和杂环化合物)的构成该环自身的原子之中的碳原子的数量。该环被取代基取代时,取代基中所含的碳不包括在成环碳数中。下文中记载的“成环碳数”只要没有另行记载就同样设定。例如,苯环的成环碳数为6,萘环的成环碳数为10,吡啶环的成环碳数为5,呋喃环的成环碳数为4。另外,例如9,9-二苯基芴基的成环碳数为13,9,9
’‑
螺双芴基的成环碳数为25。
[0080]
另外,在苯环上作为取代基例如取代有烷基时,该烷基的碳数不包括在苯环的成环碳数中。因此,取代有烷基的苯环的成环碳数为6。另外,在萘环上作为取代基例如取代有烷基时,该烷基的碳数不包括在萘环的成环碳数中。因此,取代有烷基的萘环的成环碳数为10。
[0081]
在本说明书中,成环原子数是指原子以环状键合的结构(例如单环、稠环和联环(ring assemblies))的化合物(例如单环化合物、稠环化合物、桥环化合物、碳环化合物和杂环化合物)的构成该环自身的原子的数量。不构成环的原子(例如对构成环的原子的键进行封端的氢原子)、该环被取代基取代时的取代基中所含的原子不包括在成环原子数中。下文中记载的“成环原子数”只要没有另行记载就同样设定。例如,吡啶环的成环原子数为6,喹唑啉环的成环原子数为10,呋喃环的成环原子数为5。例如,键合于吡啶环的氢原子或构成取代基的原子的数量不包括在吡啶成环原子数的数量中。因此,键合有氢原子或取代基的吡啶环的成环原子数为6。另外,例如喹唑啉环的碳原子上键合的氢原子或构成取代基的原子不包括在喹唑啉环的成环原子数的数量中。因此,键合有氢原子或取代基的喹唑啉环的成环原子数为10。
[0082]
在本说明书中,“取代或未取代的碳数xx~yy的zz基”这样的表述中的“碳数xx~yy”表示zz基为未取代时的碳数,发生了取代时的取代基的碳数不包括在内。在此,“yy”大于“xx”,“xx”是指1以上的整数,“yy”是指2以上的整数。
[0083]
在本说明书中,“取代或未取代的原子数xx~yy的zz基”这样的表述中的“原子数xx~yy”表示zz基为未取代时的原子数,发生了取代时的取代基的原子数不包括在内。在此,“yy”大于“xx”,“xx”是指1以上的整数,“yy”是指2以上的整数。
[0084]
在本说明书中,未取代的zz基是表示“取代或未取代的zz基”为“未取代的zz基”的情况,取代的zz基表示“取代或未取代的zz基”为“取代的zz基”的情况。
[0085]
在本说明书中,表述为“取代或未取代的zz基”时的“未取代”是指zz基中的氢原子未与取代基发生置换。“未取代的zz基”中的氢原子为氕原子、氘原子或氚原子。
[0086]
另外,在本说明书中,表述为“取代或未取代的zz基”时的“取代”是指,zz基中的1个以上的氢原子与取代基发生了置换。表述为“被aa基取代的bb基”时的“取代”也同样地是指bb基中的1个以上的氢原子与aa基发生了置换。
[0087]“本说明书中记载的取代基”[0088]
以下对本说明书中记载的取代基进行说明。
[0089]
本说明书中记载的“未取代的芳基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
[0090]
本说明书中记载的“未取代的杂环基”的成环原子数只要本说明书中没有另行记载,则为5~50,优选为5~30,更优选为5~18。
[0091]
本说明书中记载的“未取代的烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
[0092]
本说明书中记载的“未取代的烯基”的碳数只要本说明书中没有另行记载,则为2~50,优选为2~20,更优选为2~6。
[0093]
本说明书中记载的“未取代的炔基”的碳数只要本说明书中没有另行记载,则为2~50,优选为2~20,更优选为2~6。
[0094]
本说明书中记载的“未取代的环烷基”的成环碳数只要本说明书中没有另行记载,则为3~50,优选为3~20,更优选为3~6。
[0095]
本说明书中记载的“未取代的亚芳基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
[0096]
本说明书中记载的“未取代的二价杂环基”的成环原子数只要本说明书中没有另行记载,则为5~50,优选为5~30,更优选为5~18。
[0097]
本说明书中记载的“未取代的亚烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
[0098]
·“取代或未取代的芳基”[0099]
作为本说明书中记载的“取代或未取代的芳基”的具体例(具体例组g1),可以举出以下的未取代的芳基(具体例组g1a)和取代的芳基(具体例组g1b)等。(在此,未取代的芳基是指“取代或未取代的芳基”为“未取代的芳基”的情况,取代的芳基是指“取代或未取代的芳基”为“取代的芳基”的情况。)在本说明书中,仅表述为“芳基”时,包括“未取代的芳基”和“取代的芳基”这两者。
[0100]“取代的芳基”是指“未取代的芳基”的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的芳基”,例如可以举出下述具体例组g1a的“未取代的芳基”的1个以上的氢原子与取代基发生了置换后的基团、以及下述具体例组g1b的取代的芳基的例子等。需要说明的是,在此列举的“未取代的芳基”的例子以及“取代的芳基”的例子仅为一例,本说明书中记载的“取代的芳基”中也包括下述具体例组g1b的“取代的芳基”中的芳基自身的碳原子上键合的氢原子进一步与取代基发生了置换后的基团、以及下述具体例组g1b的“取代的
芳基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
[0101]
·
未取代的芳基(具体例组g1a):
[0102]
苯基、
[0103]
对联苯基、
[0104]
间联苯基、
[0105]
邻联苯基、
[0106]
对三联苯-4-基、
[0107]
对三联苯-3-基、
[0108]
对三联苯-2-基、
[0109]
间三联苯-4-基、
[0110]
间三联苯-3-基、
[0111]
间三联苯-2-基、
[0112]
邻三联苯-4-基、
[0113]
邻三联苯-3-基、
[0114]
邻三联苯-2-基、
[0115]
1-萘基、
[0116]
2-萘基、
[0117]
蒽基、
[0118]
苯并蒽基、
[0119]
菲基、
[0120]
苯并菲基、
[0121]
非那烯基、
[0122]
芘基、
[0123]
基、
[0124]
苯并基、
[0125]
三亚苯基、
[0126]
苯并三亚苯基、
[0127]
并四苯基、
[0128]
并五苯基、
[0129]
芴基、
[0130]
9,9
’‑
螺双芴基、
[0131]
苯并芴基、
[0132]
二苯并芴基、
[0133]
荧蒽基、
[0134]
苯并荧蒽基、
[0135]
苝基以及
[0136]
从下述通式(temp-1)~(temp-15)所示的环结构除去1个氢原子从而衍生的一价芳基。
[0137]
【化学式1】
[0138][0139]
【化学式2】
[0140][0141]
·
取代的芳基(具体例组g1b):
[0142]
邻甲苯基、
[0143]
间甲苯基、
[0144]
对甲苯基、
[0145]
对二甲苯基、
[0146]
间二甲苯基、
[0147]
邻二甲苯基、
[0148]
对异丙基苯基、
[0149]
间异丙基苯基、
[0150]
邻异丙基苯基、
[0151]
对叔丁基苯基、
[0152]
间叔丁基苯基、
[0153]
邻叔丁基苯基、
[0154]
3,4,5-三甲基苯基、
[0155]
9,9-二甲基芴基、
[0156]
9,9-二苯基芴基、
[0157]
9,9-双(4-甲基苯基)芴基、
[0158]
9,9-双(4-异丙基苯基)芴基、
[0159]
9,9-双(4-叔丁基苯基)芴基、
[0160]
氰基苯基、
[0161]
三苯基甲硅烷基苯基、
[0162]
三甲基甲硅烷基苯基、
[0163]
苯基萘基、
[0164]
萘基苯基以及
[0165]
从上述通式(temp-1)~(temp-15)所示的环结构衍生的一价基团的1个以上的氢原子与取代基发生了置换后的基团。
[0166]
·“取代或未取代的杂环基”[0167]
本说明书中记载的“杂环基”是成环原子中包含至少1个杂原子的环状的基团。作为杂原子的具体例,可以举出氮原子、氧原子、硫原子、硅原子、磷原子和硼原子。
[0168]
本说明书中记载的“杂环基”是单环的基团或者稠环的基团。
[0169]
本说明书中记载的“杂环基”是芳香族杂环基或者非芳香族杂环基。
[0170]
作为本说明书中记载的“取代或未取代的杂环基”的具体例(具体例组g2),可以举出以下的未取代的杂环基(具体例组g2a)以及取代的杂环基(具体例组g2b)等。(在此,未取代的杂环基是指“取代或未取代的杂环基”为“未取代的杂环基”的情况,取代的杂环基是指“取代或未取代的杂环基”为“取代的杂环基”的情况。)在本说明书中,仅表述为“杂环基”时包括“未取代的杂环基”和“取代的杂环基”这两者。
[0171]“取代的杂环基”是指“未取代的杂环基”的1个以上的氢原子与取代基发生了置换后的基团。“取代的杂环基”的具体例可以举出下述具体例组g2a的“未取代的杂环基”的氢原子发生了取代后的基团、以及下述具体例组g2b的取代的杂环基的例子等。需要说明的是,在此列举的“未取代的杂环基”的例子、“取代的杂环基”的例子仅为一例,本说明书中记
载的“取代的杂环基”中还包括具体例组g2b的“取代的杂环基”中的杂环基自身的成环原子上键合的氢原子进一步与取代基发生了置换后的基团、以及具体例组g2b的“取代的杂环基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
[0172]
具体例组g2a例如包括以下的包含氮原子的未取代的杂环基(具体例组g2a1)、包含氧原子的未取代的杂环基(具体例组g2a2)、包含硫原子的未取代的杂环基(具体例组g2a3)以及从下述通式(temp-16)~(temp-33)所示的环结构去除1个氢原子从而衍生的一价杂环基(具体例组g2a4)。
[0173]
具体例组g2b例如包括以下的包含氮原子的取代的杂环基(具体例组g2b1)、包含氧原子的取代的杂环基(具体例组g2b2)、包含硫原子的取代的杂环基(具体例组g2b3)以及从下述通式(temp-16)~(temp-33)所示的环结构衍生的一价杂环基的1个以上的氢原子与取代基发生了置换后的基团(具体例组g2b4)。
[0174]
·
包含氮原子的未取代的杂环基(具体例组g2a1):
[0175]
吡咯基、
[0176]
咪唑基、
[0177]
吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、吲哚基、异吲哚基、吲嗪基、喹嗪基、喹啉基、异喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、苯并咪唑基、吲唑基、菲咯啉基、菲啶基、吖啶基、吩嗪基、
[0178]
咔唑基、
[0179]
苯并咔唑基、
[0180]
吗啉基、
[0181]
吩噁嗪基、
[0182]
吩噻嗪基、
[0183]
氮杂咔唑基、以及
[0184]
二氮杂咔唑基。
[0185]
·
包含氧原子的未取代的杂环基(具体例组g2a2):
[0186]
呋喃基、
[0187]
噁唑基、
[0188]
异噁唑基、
[0189]
噁二唑基、
[0190]
呫吨基、
[0191]
苯并呋喃基、
[0192]
异苯并呋喃基、
[0193]
二苯并呋喃基、
[0194]
萘并苯并呋喃基、
[0195]
苯并噁唑基、
[0196]
苯并异噁唑基、
[0197]
吩噁嗪基、
[0198]
吗啉基、
[0199]
二萘并呋喃基、
[0200]
氮杂二苯并呋喃基、
[0201]
二氮杂二苯并呋喃基、
[0202]
氮杂萘并苯并呋喃基以及
[0203]
二氮杂萘并苯并呋喃基。
[0204]
·
包含硫原子的未取代的杂环基(具体例组g2a3):
[0205]
噻吩基、
[0206]
噻唑基、
[0207]
异噻唑基、
[0208]
噻二唑基、
[0209]
苯并噻吩基(benzothienyl)、
[0210]
异苯并噻吩基(isobenzothienyl)、
[0211]
二苯并噻吩基(dibenzothienyl)、
[0212]
萘并苯并噻吩基(naphthobenzothienyl)、
[0213]
苯并噻唑基、
[0214]
苯并异噻唑基、
[0215]
吩噻嗪基、
[0216]
二萘并噻吩基(dinaphthothienyl)、
[0217]
氮杂二苯并噻吩基(azadibenzothienyl)、
[0218]
二氮杂二苯并噻吩基(diazadibenzothienyl)、
[0219]
氮杂萘并苯并噻吩基(azanaphthobenzothienyl)以及
[0220]
二氮杂萘并苯并噻吩基(diazanaphthobenzothienyl)。
[0221]
·
从下述通式(temp-16)~(temp-33)所示的环结构去除1个氢原子从而衍生的一价杂环基(具体例组g2a4):
[0222]
【化学式3】
[0223][0224]
【化学式4】
[0225][0226]
在上述通式(temp-16)~(temp-33)中,xa和ya各自独立地为氧原子、硫原子、nh或ch2。其中,xa和ya之中的至少1个为氧原子、硫原子或nh。
[0227]
在上述通式(temp-16)~(temp-33)中,xa和ya的至少任一个为nh或ch2时,从上述通式(temp-16)~(temp-33)所示的环结构衍生的一价杂环基包括从这些nh或ch2除去1个氢原子而得到的一价基团。
[0228]
·
包含氮原子的取代的杂环基(具体例组g2b1):
[0229]
(9-苯基)咔唑基、
[0230]
(9-联苯基)咔唑基、
[0231]
(9-苯基)苯基咔唑基、
[0232]
(9-萘基)咔唑基、
[0233]
二苯基咔唑-9-基、
[0234]
苯基咔唑-9-基、
[0235]
甲基苯并咪唑基、
[0236]
乙基苯并咪唑基、
[0237]
苯基三嗪基、
[0238]
联苯基三嗪基、
[0239]
二苯基三嗪基、
[0240]
苯基喹唑啉基、以及
[0241]
联苯基喹唑啉基。
[0242]
·
包含氧原子的取代的杂环基(具体例组g282):
[0243]
苯基二苯并呋喃基、
[0244]
甲基二苯并呋喃基、
[0245]
叔丁基二苯并呋喃基以及
[0246]
螺[9h-呫吨-9,9
’‑
[9h]芴]的一价残基。
[0247]
·
包含硫原子的取代的杂环基(具体例组g2b3):
[0248]
苯基二苯并噻吩基、
[0249]
甲基二苯并噻吩基、
[0250]
叔丁基二苯并噻吩基以及
[0251]
螺[9h-噻吨-9,9
’‑
[9h]芴]的一价残基。
[0252]
·
从上述通式(temp-16)~(temp-33)所示的环结构衍生的一价杂环基的1个以上的氢原子与取代基发生了置换后的基团(具体例组g2b4):
[0253]
上述“一价杂环基的1个以上的氢原子”是指,选自该一价杂环基的成环碳原子上键合的氢原子、xa和ya的至少任一个为nh时的氮原子上键合的氢原子以及xa和ya中的一者为ch2时的亚甲基的氢原子中的1个以上的氢原子。
[0254]
·“取代或未取代的烷基”[0255]
作为本说明书中记载的“取代或未取代的烷基”的具体例(具体例组g3),可以举出以下的未取代的烷基(具体例组g3a)和取代的烷基(具体例组g3b)。(在此,未取代的烷基是指“取代或未取代的烷基”为“未取代的烷基”的情况,取代的烷基是指“取代或未取代的烷基”为“取代的烷基”的情况。)以下,仅表述为“烷基”时,包括“未取代的烷基”和“取代的烷基”这两者。
[0256]“取代的烷基”是指“未取代的烷基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的烷基”的具体例,可以举出下述的“未取代的烷基”(具体例组g3a)中的1个以上的氢原子与取代基发生了置换后的基团以及取代的烷基(具体例组g3b)的例子等。在本说明书中,“未取代的烷基”中的烷基是指链状的烷基。因此,“未取代的烷基”包括作为直链的“未取代的烷基”以及作为支链状的“未取代的烷基”。需要说明的是,在此列举的“未取代的烷基”的例子、“取代的烷基”的例子仅为一例,本说明书中记载的“取代的烷基”还包括具体例组g3b的“取代的烷基”中的烷基自身的氢原子进一步与取代基发生了置换后的基团以及具体例组g3b的“取代的烷基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
[0257]
·
未取代的烷基(具体例组g3a):
[0258]
甲基、
[0259]
乙基、
[0260]
正丙基、
[0261]
异丙基、
[0262]
正丁基、
[0263]
异丁基、
[0264]
仲丁基以及
[0265]
叔丁基。
[0266]
·
取代的烷基(具体例组g3b):
[0267]
七氟丙基(包括异构体)、
[0268]
五氟乙基、
[0269]
2,2,2-三氟乙基以及
[0270]
三氟甲基。
[0271]
·“取代或未取代的烯基”[0272]
作为本说明书中记载的“取代或未取代的烯基”的具体例(具体例组g4),可以举出以下的未取代的烯基(具体例组g4a)以及取代的烯基(具体例组g4b)等。(在此,未取代的烯基是指“取代或未取代的烯基”为“未取代的烯基”的情况,“取代的烯基”是指“取代或未取代的烯基”为“取代的烯基”的情况。)在本说明书中,仅仅表述为“烯基”时,包括“未取代的烯基”和“取代的烯基”这两者。
[0273]“取代的烯基”是指“未取代的烯基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的烯基”的具体例,可以举出下述的“未取代的烯基”(具体例组g4a)具有取代基的基团以及取代的烯基(具体例组g4b)的例子等。需要说明的是,在此列举的“未取代的烯基”的例子、“取代的烯基”的例子仅为一例,本说明书中记载的“取代的烯基”还包括具体例组g4b的“取代的烯基”中的烯基自身的氢原子进一步与取代基发生了置换后的基团以及具体例组g4b的“取代的烯基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
[0274]
·
未取代的烯基(具体例组g4a):
[0275]
乙烯基、
[0276]
烯丙基、
[0277]
1-丁烯基、
[0278]
2-丁烯基以及
[0279]
3-丁烯基。
[0280]
·
取代的烯基(具体例组g4b):
[0281]
1,3-丁二烯基、
[0282]
1-甲基乙烯基、
[0283]
1-甲基烯丙基、
[0284]
1,1-二甲基烯丙基、
[0285]
2-甲基烯丙基以及
[0286]
1,2-二甲基烯丙基。
[0287]
·“取代或未取代的炔基”[0288]
作为本说明书中记载的“取代或未取代的炔基”的具体例(具体例组g5),可以举出以下的未取代的炔基(具体例组g5a)等。(在此,未取代的炔基是指“取代或未取代的炔基”为“未取代的炔基”的情况。)以下仅表述为“炔基”时,包括“未取代的炔基”和“取代的炔基”这两者。
[0289]“取代的炔基”是指“未取代的炔基”中的1个以上的氢原子与取代基发生了置换后
的基团。作为“取代的炔基”的具体例,可以举出下述的“未取代的炔基”(具体例组g5a)中的1个以上的氢原子与取代基发生了置换后的基团等。
[0290]
·
未取代的炔基(具体例组g5a):
[0291]
乙炔基
[0292]
·“取代或未取代的环烷基”[0293]
作为本说明书中记载的“取代或未取代的环烷基”的具体例(具体例组g6),可以举出以下的未取代的环烷基(具体例组g6a)以及取代的环烷基(具体例组g6b)等。(在此,未取代的环烷基是指“取代或未取代的环烷基”为“未取代的环烷基”的情况,取代的环烷基是指“取代或未取代的环烷基”为“取代的环烷基”的情况。)在本说明书中,仅表述为“环烷基”时,包括“未取代的环烷基”和“取代的环烷基”这两者。
[0294]“取代的环烷基”是指“未取代的环烷基”中的1个以上的氢原子与取代基发生了置换后的基团。作为“取代的环烷基”的具体例,可以举出下述的“未取代的环烷基”(具体例组g6a)中的1个以上的氢原子与取代基发生了置换后的基团以及取代的环烷基(具体例组g6b)的例子等。需要说明的是,在此列举的“未取代的环烷基”的例子、“取代的环烷基”的例子仅为一例,本说明书中记载的“取代的环烷基”还包括具体例组g6b的“取代的环烷基”中的环烷基自身的碳原子上键合的1个以上的氢原子与取代基发生了置换后的基团以及具体例组g6b的“取代的环烷基”中的取代基的氢原子进一步与取代基发生了置换后的基团。
[0295]
·
未取代的环烷基(具体例组g6a):
[0296]
环丙基、
[0297]
环丁基、
[0298]
环戊基、
[0299]
环己基、
[0300]
1-金刚烷基、
[0301]
2-金刚烷基、
[0302]
1-降冰片基以及
[0303]
2-降冰片基。
[0304]
·
取代的环烷基(具体例组g6b):
[0305]
4-甲基环己基。
[0306]
·
“‑
si(r
901
)(r
902
)(r
903
)所示的基团”[0307]
作为本说明书中记载的-si(r
901
)(r
902
)(r
903
)所示的基团的具体例(具体例组g7),可以举出
[0308]-si(g1)(g1)(g1)、
[0309]-si(g1)(g2)(g2)、
[0310]-si(g1)(g1)(g2)、
[0311]-si(g2)(g2)(g2)、
[0312]-si(g3)(g3)(g3)以及
[0313]-si(g6)(g6)(g6)。在此,
[0314]
g1为具体例组g1中记载的“取代或未取代的芳基”。
[0315]
g2为具体例组g2中记载的“取代或未取代的杂环基”。
[0316]
g3为具体例组g3中记载的“取代或未取代的烷基”。
[0317]
g6为具体例组g6中记载的“取代或未取代的环烷基”。
[0318]-si(g1)(g1)(g1)中的多个g1相互相同或不同。
[0319]-si(g1)(g2)(g2)中的多个g2相互相同或不同。
[0320]-si(g1)(g1)(g2)中的多个g1相互相同或不同。
[0321]-si(g2)(g2)(g2)中的多个g2相互相同或不同。
[0322]-si(g3)(g3)(g3)中的多个g3相互相同或不同。
[0323]-si(g6)(g6)(g6)中的多个g6相互相同或不同。
[0324]
·
“‑
o-(r
904
)所示的基团”[0325]
作为本说明书中记载的-o-(r
904
)所示的基团的具体例(具体例组g8),可以举出
[0326]-o(g1)、
[0327]-o(g2)、
[0328]-o(g3)以及
[0329]-o(g6)。
[0330]
在此,
[0331]
g1为具体例组g1中记载的“取代或未取代的芳基”。
[0332]
g2为具体例组g2中记载的“取代或未取代的杂环基”。
[0333]
g3为具体例组g3中记载的“取代或未取代的烷基”。
[0334]
g6为具体例组g6中记载的“取代或未取代的环烷基”。
[0335]
·
“‑
s-(r
905
)所示的基团”[0336]
作为本说明书中记载的-s-(r
905
)所示的基团的具体例(具体例组g9),可以举出
[0337]-s(g1)、
[0338]-s(g2)、
[0339]-s(g3)以及
[0340]-s(g6)。
[0341]
在此,
[0342]
g1为具体例组g1中记载的“取代或未取代的芳基”。
[0343]
g2为具体例组g2中记载的“取代或未取代的杂环基”。
[0344]
g3为具体例组g3中记载的“取代或未取代的烷基”。
[0345]
g6为具体例组g6中记载的“取代或未取代的环烷基”。
[0346]
·
“‑
n(r
906
)(r
907
)所示的基团”[0347]
作为本说明书中记载的-n(r
906
)(r
907
)所示的基团的具体例(具体例组g10),可以举出
[0348]-n(g1)(g1)、
[0349]-n(g2)(g2)、
[0350]-n(g1)(g2)、
[0351]-n(g3)(g3)以及
[0352]-n(g6)(g6)。
[0353]
在此,
[0354]
g1为具体例组g1中记载的“取代或未取代的芳基”。
[0355]
g2为具体例组g2中记载的“取代或未取代的杂环基”。
[0356]
g3为具体例组g3中记载的“取代或未取代的烷基”。
[0357]
g6为具体例组g6中记载的“取代或未取代的环烷基”。
[0358]-n(g1)(g1)中的多个g1相互相同或不同。
[0359]-n(g2)(g2)中的多个g2相互相同或不同。
[0360]-n(g3)(g3)中的多个g3相互相同或不同。
[0361]-n(g6)(g6)中的多个g6相互相同或不同。
[0362]
·“卤素原子”[0363]
作为本说明书中记载的“卤素原子”的具体例(具体例组g11),可以举出氟原子、氯原子、溴原子以及碘原子等。
[0364]
·“取代或未取代的氟烷基”[0365]
本说明书中记载的“取代或未取代的氟烷基”是指“取代或未取代的烷基”中的构成烷基的碳原子上键合的至少1个氢原子与氟原子发生了置换后的基团,也包括“取代或未取代的烷基”中的构成烷基的碳原子上键合的全部氢原子经氟原子置换后的基团(全氟基团)。“未取代的氟烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。“取代的氟烷基”是指“氟烷基”的1个以上的氢原子与取代基发生了置换后的基团。需要说明的是,本说明书中记载的“取代的氟烷基”中也包括“取代的氟烷基”中的烷基链的碳原子上键合的1个以上的氢原子进一步与取代基发生了置换后的基团以及“取代的氟烷基”中的取代基的1个以上的氢原子进一步与取代基发生了置换后的基团。作为“未取代的氟烷基”的具体例,可以举出上述“烷基”(具体例组g3)中的1个以上的氢原子与氟原子发生了置换后的基团的例子等。
[0366]
·“取代或未取代的卤烷基”[0367]
本说明书中记载的“取代或未取代的卤烷基”是指“取代或未取代的烷基”中的构成烷基的碳原子上键合的至少1个氢原子与卤素原子发生了置换后的基团,也包括“取代或未取代的烷基”中的构成烷基的碳原子上键合的全部氢原子经卤素原子取代后的基团。“未取代的卤烷基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。“取代的卤烷基”是指“卤烷基”的1个以上的氢原子与取代基发生了置换后的基团。需要说明的是,本说明书中记载的“取代的卤烷基”还包括“取代的卤烷基”中的烷基链的碳原子上键合的1个以上的氢原子进一步与取代基发生了置换后的基团以及“取代的卤烷基”中的取代基的1个以上的氢原子进一步与取代基发生了置换后的基团。作为“未取代的卤烷基”的具体例,可以举出上述“烷基”(具体例组g3)中的1个以上的氢原子与卤素原子发生了置换后的基团的例子等。卤烷基有时称为卤代烷基。
[0368]
·“取代或未取代的烷氧基”[0369]
作为本说明书中记载的“取代或未取代的烷氧基”的具体例,为-o(g3)所示的基团,在此,g3为具体例组g3中记载的“取代或未取代的烷基”。“未取代的烷氧基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。
[0370]
·“取代或未取代的烷硫基”[0371]
作为本说明书中记载的“取代或未取代的烷硫基”的具体例,为-s(g3)所示的基
团,在此,g3为具体例组g3中记载的“取代或未取代的烷基”。“未取代的烷硫基”的碳数只要本说明书中没有另行记载,则为1~50,优选为1~30,更优选为1~18。
[0372]
·“取代或未取代的芳氧基”[0373]
作为本说明书中记载的“取代或未取代的芳氧基”的具体例,为-o(g1)所示的基团,在此,g1为具体例组g1中记载的“取代或未取代的芳基”。“未取代的芳氧基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
[0374]
·“取代或未取代的芳硫基”[0375]
作为本说明书中记载的“取代或未取代的芳硫基”的具体例,为-s(g1)所示的基团,在此,g1为具体例组g1中记载的“取代或未取代的芳基”。“未取代的芳硫基”的成环碳数只要本说明书中没有另行记载,则为6~50,优选为6~30,更优选为6~18。
[0376]
·“取代或未取代的三烷基甲硅烷基”[0377]
作为本说明书中记载的“三烷基甲硅烷基”的具体例,为-si(g3)(g3)(g3)所示的基团,在此,g3为具体例组g3中记载的“取代或未取代的烷基”。-si(g3)(g3)(g3)中的多个g3相互相同或不同。“三烷基甲硅烷基”的各烷基的碳数只要本说明书中没有另行记载,则为1~50,优选为1~20,更优选为1~6。
[0378]
·“取代或未取代的芳烷基”[0379]
作为本说明书中记载的“取代或未取代的芳烷基”的具体例,为-(g3)-(g1)所示的基团,在此,g3为具体例组g3中记载的“取代或未取代的烷基”,g1为具体例组g1中记载的“取代或未取代的芳基”。因此,“芳烷基”为“烷基”的氢原子与作为取代基的“芳基”发生了置换后的基团,为“取代的烷基”的一个方案。“未取代的芳烷基”为取代有“未取代的芳基”的“未取代的烷基”,“未取代的芳烷基”的碳数只要本说明书中没有另行记载,则为7~50,优选为7~30,更优选为7~18。
[0380]
作为“取代或未取代的芳烷基”的具体例,可以举出苄基、1-苯基乙基、2-苯基乙基、1-苯基异丙基、2-苯基异丙基、苯基叔丁基、α-萘基甲基、1-α-萘基乙基、2-α-萘基乙基、1-α-萘基异丙基、2-α-萘基异丙基、β-萘基甲基、1-β-萘基乙基、2-β-萘基乙基、1-β-萘基异丙基以及2-β-萘基异丙基等。
[0381]
本说明书中记载的取代或未取代的芳基只要本说明书中没有另行记载,则优选为苯基、对联苯基、间联苯基、邻联苯基、对三联苯-4-基、对三联苯-3-基、对三联苯-2-基、间三联苯-4-基、间三联苯-3-基、间三联苯-2-基、邻三联苯-4-基、邻三联苯-3-基、邻三联苯-2-基、1-萘基、2-萘基、蒽基、菲基、芘基、基、三亚苯基、芴基、9,9
’‑
螺双芴基、9,9-二甲基芴基以及9,9-二苯基芴基等。
[0382]
本说明书中记载的取代或未取代的杂环基只要本说明书中没有另行记载,则优选为吡啶基、嘧啶基、三嗪基、喹啉基、异喹啉基、喹唑啉基、苯并咪唑基、菲咯啉基、咔唑基(1-咔唑基、2-咔唑基、3-咔唑基、4-咔唑基或9-咔唑基)、苯并咔唑基、氮杂咔唑基、二氮杂咔唑基、二苯并呋喃基、萘并苯并呋喃基、氮杂二苯并呋喃基、二氮杂二苯并呋喃基、二苯并噻吩基、萘并苯并噻吩基、氮杂二苯并噻吩基、二氮杂二苯并噻吩基、(9-苯基)咔唑基((9-苯基)咔唑-1-基、(9-苯基)咔唑-2-基、(9-苯基)咔唑-3-基或(9-苯基)咔唑-4-基)、(9-联苯基)咔唑基、(9-苯基)苯基咔唑基、二苯基咔唑-9-基、苯基咔唑-9-基、苯基三嗪基、联苯基三嗪基、二苯基三嗪基、苯基二苯并呋喃基以及苯基二苯并噻吩基等。
[0383]
在本说明书中,咔唑基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
[0384]
【化学式5】
[0385][0386]
在本说明书中,(9-苯基)咔唑基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
[0387]
【化学式6】
[0388][0389]
上述通式(temp-cz1)~(temp-cz9)中,*表示键合位置。
[0390]
在本说明书中,二苯并呋喃基以及二苯并噻吩基只要本说明书中没有另行记载,则具体而言为以下任一个基团。
[0391]
【化学式7】
[0392][0393]
上述通式(temp-34)~(temp-41)中,*表示键合位置。
[0394]
本说明书中记载的取代或未取代的烷基只要本说明书中没有另行记载,则优选为甲基、乙基、丙基、异丙基、正丁基、异丁基以及叔丁基等。
[0395]
·“取代或未取代的亚芳基”[0396]
本说明书中记载的“取代或未取代的亚芳基”只要没有另行记载,就是从上述“取代或未取代的芳基”除去芳基环上的1个氢原子从而衍生的二价基团。作为“取代或未取代的亚芳基”的具体例(具体例组g12),可以举出从具体例组g1中记载的“取代或未取代的芳基”除去芳基环上的1个氢原子从而衍生的二价基团等。
[0397]
·“取代或未取代的二价杂环基”[0398]
本说明书中记载的“取代或未取代的二价杂环基”只要没有另行记载,就是从上述“取代或未取代的杂环基”除去杂环上的1个氢原子从而衍生的二价基团。作为“取代或未取代的二价杂环基”的具体例(具体例组g13),可以举出从具体例组g2中记载的“取代或未取代的杂环基”除去杂环上的1个氢原子从而衍生的二价基团等。
[0399]
·“取代或未取代的亚烷基”[0400]
本说明书中记载的“取代或未取代的亚烷基”只要没有另行记载,就是从上述“取代或未取代的烷基”除去烷基链上的1个氢原子从而衍生的二价基团。作为“取代或未取代的亚烷基”的具体例(具体例组g14),可以举出从具体例组g3中记载的“取代或未取代的烷基”除去烷基链上的1个氢原子从而衍生的二价基团等。
[0401]
本说明书中记载的取代或未取代的亚芳基只要本说明书中没有另行记载,则优选为下述通式(temp-42)~(temp-68)中的任一基团。
[0402]
【化学式8】
[0403][0404]
【化学式9】
[0405][0406]
上述通式(temp-42)~(temp-52)中,q1~q
10
各自独立地为氢原子或取代基。
[0407]
上述通式(temp-42)~(temp-52)中,*表示键合位置。
[0408]
【化学式10】
[0409][0410]
上述通式(temp-53)~(temp-62)中,q1~q
10
各自独立地为氢原子或取代基。
[0411]
式q9和q
10
可以经由单键相互键合而形成环。
[0412]
上述通式(temp-53)~(temp-62)中,*表示键合位置。
[0413]
【化学式11】
[0414][0415]
上述通式(temp-63)~(temp-68)中,q1~q8各自独立地为氢原子或取代基。
[0416]
上述通式(temp-63)~(temp-68)中,*表示键合位置。
[0417]
本说明书中记载的取代或未取代的二价杂环基只要本说明书中没有另行记载,则优选为下述通式(temp-69)~(temp-102)中的任一基团。
[0418]
【化学式12】
[0419][0420]
【化学式13】
[0421][0422]
【化学式14】
[0423][0424]
上述通式(temp-69)~(temp-82)中,q1~q9各自独立地为氢原子或取代基。
[0425]
【化学式15】
[0426][0427]
【化学式16】
[0428][0429]
【化学式17】
[0430][0431]
【化学式18】
[0432][0433]
上述通式(temp-83)~(temp-102)中,q1~q8各自独立地为氢原子或取代基。
[0434]
以上是对于“本说明书中记载的取代基”的说明。
[0435]
·“键合而形成环的情况”[0436]
在本说明书中,表述为“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的单环、或者相互键合而形成取代或未取代的稠环、或者不相互键合”的情况,是指“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况、“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况和“由
…
相邻的2个以上组成的组中的1组以上不相互键合”的情况。
[0437]
以下,对于本说明书中的“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况以及“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况(以下有时将这些情况合称为“键合而形成环的情况”。)进行说明。以母骨架为蒽环的下述通式(temp-103)所示的蒽化合物的情况为例进行说明。
[0438]
【化学式19】
[0439][0440]
例如,在由r
921
~r
930
之中的“相邻的2个以上组成的组中的1组以上相互键合而形成环”的情况中,作为1组的由相邻的2个组成的组是指,r
921
与r
922
的组、r
922
与r
923
的组、r
923
与r
924
的组、r
924
与r
930
的组、r
930
与r
925
的组、r
925
与r
926
的组、r
926
与r
927
的组、r
927
与r
928
的组、r
928
与r
929
的组、以及r
929
与r
921
的组。
[0441]
上述“1组以上”是指,上述由相邻的2个以上组成的组中的2组以上可以同时形成环。例如,在r
921
与r
922
相互键合而形成环qa而且同时r
925
与r
926
相互键合而形成环qb时,上述通式(temp-103)所示的蒽化合物由下述通式(temp-104)表示。
[0442]
【化学式20】
[0443][0444]“由
…
相邻的2个以上组成的组”形成环的情况不仅包括如前述例子那样由相邻的“2个”组成的组发生键合的情况,还包括由相邻的“3个以上”组成的组发生键合的情况。例如,是指r
921
与r
922
相互键合而形成环qa,并且r
922
与r
923
相互键合而形成环qc,由相互相邻的3个(r
921
、r
922
和r
923
)组成的组相互键合而形成环并稠合于蒽母骨架的情况,这种情况下,上述通式(temp-103)所示的蒽化合物由下述通式(temp-105)表示。在下述通式(temp-105)中,环qa和环qc共有r
922
。
[0445]
【化学式21】
[0446][0447]
所形成的“单环”或“稠环”中,作为仅所形成的环的结构,可以为饱和的环也可以为不饱和的环。即便是“由
…
相邻的2个组成的组中的1组”形成“单环”或“稠环”的情况下,该“单环”或“稠环”也可以形成饱和的环或不饱和的环。例如,在上述通式(temp-104)中所形成的环qa和环qb各自为“单环”或“稠环”。另外,在上述通式(temp-105)中所形成的环qa以
及环qc为“稠环”。上述通式(temp-105)的环qa与环qc通过环qa与环qc稠合而形成了稠环。上述通式(tmep-104)的环qa如果为苯环,则环qa为单环。上述通式(tmep-104)的环qa如果为萘环,则环qa为稠环。
[0448]“不饱和的环”是指芳香族烃环或芳香族杂环。“饱和的环”是指脂肪族烃环或非芳香族杂环。
[0449]
作为芳香族烃环的具体例,可以举出具体例组g1中作为具体例举出的基团被氢原子封端而成的结构。
[0450]
作为芳香族杂环的具体例,可以举出具体例组g2中作为具体例举出的芳香族杂环基被氢原子封端而成的结构。
[0451]
作为脂肪族烃环的具体例,可以举出具体例组g6中作为具体例举出的基团被氢原子封端而成的结构。
[0452]“形成环”是指,仅由母骨架的多个原子形成环,或者由母骨架的多个原子与另外的1个以上的任选元素形成环。例如,上述通式(temp-104)所示的r
921
与r
922
相互键合而形成的环qa是指由r
921
所键合的蒽骨架的碳原子、r
922
所键合的蒽骨架的碳原子与1个以上的任选元素形成环。作为具体例,在由r
921
与r
922
形成环qa的情况之中,在由r
921
所键合的蒽骨架的碳原子、r
922
所键合的蒽骨架的碳原子和4个碳原子形成单环的不饱和的环的情况下,由r
921
与r
922
形成的环为苯环。
[0453]
在此,“任选元素”只要本说明书中没有另行记载,则优选为选自由碳元素、氮元素、氧元素以及硫元素组成的组中的至少1种元素。在任选元素中(例如碳元素或氮元素的情况下),不形成环的键可以被氢原子等封端,也可以被后述的“任选取代基”所取代。在包含碳元素以外的任选元素时,所形成的环为杂环。
[0454]
构成单环或稠环的“1个以上的任选元素”只要本说明书中没有另行记载,则优选为2个以上且15个以下,更优选为3个以上且12个以下,进一步优选为3个以上且5个以下。
[0455]
本说明书中只要没有另行记载,则“单环”以及“稠环”之中优选为“单环”。
[0456]
本说明书中只要没有另行记载,则“饱和的环”以及“不饱和的环”之中优选为“不饱和的环”。
[0457]
本说明书中只要没有另行记载,则“单环”优选为苯环。
[0458]
本说明书中只要没有另行记载,则“不饱和的环”优选为苯环。
[0459]“由
…
相邻的2个以上组成的组中的1组以上”“相互键合而形成取代或未取代的单环”的情况下或者“相互键合而形成取代或未取代的稠环”的情况下,本说明书中只要没有另行记载,则优选为由
…
相邻的2个以上组成的组中的1组以上相互键合而形成由母骨架的多个原子和1个以上且15个以下的选自由碳元素、氮元素、氧元素以及硫元素组成的组中的至少1种元素形成的取代或未取代的“不饱和的环”。
[0460]
上述的“单环”或“稠环”具有取代基时的取代基例如为后述的“任选取代基”。上述的“单环”或“稠环”具有取代基时的取代基的具体例为在上述的“本说明书中记载的取代基”的项中所描述过的取代基。
[0461]
上述的“饱和的环”或“不饱和的环”具有取代基时的取代基例如为后述的“任选取代基”。上述的“单环”或“稠环”具有取代基时的取代基的具体例为在上述的“本说明书中记载的取代基”的项中所描述过的取代基。
[0462]
以上是对于“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的单环”的情况以及“由
…
相邻的2个以上组成的组中的1组以上相互键合而形成取代或未取代的稠环”的情况(“键合而形成环的情况”)的说明。
[0463]
·
表述为“取代或未取代的”时的取代基
[0464]
在本说明书中的一个实施方式中,上述表述为“取代或未取代的”时的取代基(在本说明书中,有时称为“任选取代基”。)例如为选自由未取代的碳数1~50的烷基、
[0465]
未取代的碳数2~50的烯基、
[0466]
未取代的碳数2~50的炔基、
[0467]
未取代的成环碳数3~50的环烷基、
[0468]-si(r
901
)(r
902
)(r
903
)、
[0469]-o-(r
904
)、
[0470]-s-(r
905
)、
[0471]-n(r
906
)(r
907
)、
[0472]
卤素原子、氰基、硝基、
[0473]
未取代的成环碳数6~50的芳基以及
[0474]
未取代的成环原子数5~50的杂环基
[0475]
组成的组中的基团等,
[0476]
在此,r
901
~r
907
各自独立地为
[0477]
氢原子、
[0478]
取代或未取代的碳数1~50的烷基、
[0479]
取代或未取代的成环碳数3~50的环烷基、
[0480]
取代或未取代的成环碳数6~50的芳基、或者
[0481]
取代或未取代的成环原子数5~50的杂环基。
[0482]
在r
901
存在有2个以上时,2个以上的r
901
相互相同或不同,
[0483]
在r
902
存在有2个以上时,2个以上的r
902
相互相同或不同,
[0484]
在r
903
存在有2个以上时,2个以上的r
903
相互相同或不同,
[0485]
在r
904
存在有2个以上时,2个以上的r
904
相互相同或不同,
[0486]
在r
905
存在有2个以上时,2个以上的r
905
相互相同或不同,
[0487]
在r
906
存在有2个以上时,2个以上的r
906
相互相同或不同,
[0488]
在r
907
存在有2个以上时,2个以上的r
907
相互相同或不同。
[0489]
在一个实施方式中,上述表述为“取代或未取代的”时的取代基为选自由
[0490]
碳数1~50的烷基、
[0491]
成环碳数6~50的芳基以及
[0492]
成环原子数5~50的杂环基组成的组中的基团。
[0493]
在一个实施方式中,上述表述为“取代或未取代的”时的取代基为选自由
[0494]
碳数1~18的烷基、
[0495]
成环碳数6~18的芳基以及
[0496]
成环原子数5~18的杂环基组成的组中的基团。
[0497]
上述任选取代基的各基的具体例是在上述的“本说明书中记载的取代基”的项中
所描述的取代基的具体例。
[0498]
在本说明书中只要没有另行记载,则可以由相邻的任选取代基彼此形成“饱和的环”或“不饱和的环”,优选形成取代或未取代的饱和的五元环、取代或未取代的饱和的六元环、取代或未取代的不饱和的五元环或者取代或未取代的不饱和的六元环,更优选形成苯环。
[0499]
在本说明书中只要没有另行记载,则任选取代基可以还具有取代基。作为任选取代基进一步具有的取代基,则与上述任选取代基同样。
[0500]
在本说明书中,使用“aa~bb”表示的数值范围是指以“aa~bb”的前面记载的数值aa作为下限值、以“aa~bb”的后面记载的数值bb作为上限值而包含的范围。
[0501]
[第一实施方式]
[0502]
(有机电致发光元件)
[0503]
本实施方式涉及的有机el元件具有阳极、阴极和配置于上述阳极与上述阴极之间的发光层。上述发光层包含第一发光层和第二发光层。上述第一发光层包含第一主体材料和第一发光性化合物。上述第二发光层包含第二主体材料和第二发光性化合物。
[0504]
上述第一主体材料与上述第二主体材料相互不同。上述第一发光性化合物与上述第二发光性化合物相互相同或者不同。
[0505]
上述第一主体材料的三重态能量t1(h1)与上述第二主体材料的三重态能量t1(h2)满足下述数学式(数学式1)的关系,由扩散方程式算出的上述第一主体材料的三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上。
[0506]
t1(h1)>t1(h2)
…
(数学式1)
[0507]
在本实施方式涉及的有机el元件中,上述第一主体材料的三重态能量t1(h1)的扩散系数d1是基于透射光的瞬态pl光谱由扩散方程式算出的,所述透射光的瞬态pl光谱是使用将在上述第一主体材料中添加第一磷光络合物而成的第一解析层与在上述第一主体材料中添加第二磷光络合物而成的第二解析层层叠而成的扩散速度解析层,以激发光从上述第一解析层侧入射、所述透射光从上述第二解析层透射的方式测定的。
[0508]
上述第一主体材料的三重态能量t1(h1)与上述第一磷光络合物的三重态能量t1(c1)满足下述数学式(数学式x)的关系。
[0509]
上述第一主体材料的三重态能量t1(h1)与上述第二磷光络合物的三重态能量t1(c2)满足下述数学式(数学式y)的关系。
[0510]
t1(c1)>t1(h1)
…
(数学式x)
[0511]
t1(h1)>t1(c2)
…
(数学式y)
[0512]
本发明人等发现,在层叠有第一发光层和第二发光层的有机el元件中,通过选择满足上述数学式(数学式1)的关系的第一主体材料和第二主体材料并且选择由扩散方程式算出的三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上的材料作为第一主体材料,能够进一步提高发光效率。
[0513]
首先,对于作为用于提高有机el元件的发光效率的技术而已知的tripret-tripret-annhilation(有时称为tta。)进行说明。
[0514]
以往,作为用于提高有机电致发光元件的发光效率的技术,已知tripret-tripret-annhilation(有时称为tta。)。tta是三重态激子与三重态激子发生碰撞而生成单
重态激子这样的机制(机理)。需要说明的是,tta机理有时也被称为ttf机理。
[0515]
对ttf现象进行说明。从阳极注入的空穴与从阴极注入的电子在发光层内发生复合而生成激子。其自旋状态如以往所知,是单重态激子为25%、三重态激子为75%的比率。在以往已知的荧光元件中,25%的单重态激子弛豫至基态时发出光,其余的75%的三重态激子不发出光而经过热失活过程恢复到基态。因此,据称以往的荧光元件的内部量子效率的理论极限值为25%。
[0516]
另一方面,在理论上对于在有机物内部生成的三重态激子的行为进行了研究。根据s.m.bachilo等人(j.phys.chem.a,104,7711(2000)),若假定五重态等高次的激子立即恢复到三重态,则在三重态激子(以下记为3a
*
)的密度逐渐上升时,三重态激子彼此碰撞而发生下述式所示的反应。在此,1a表示基态,1a
*
表示最低激发单重态激子。
[0517]3a* 3a*
→
(4/9)1a (1/9)1a* (13/9)3a*
[0518]
即,成为53a
*
→
41a 1a
*
,预测起初生成的75%的三重态激子之中,1/5即20%变化为单重态激子。因此,以光的形式做出贡献的单重态激子成为在起初生成的25%份量上加上75%
×
(1/5)=15%而得的40%。此时,总发光强度中所占的源自ttf的发光比率(ttf比率)成为15/40、即37.5%。另外,若起初生成的75%的三重态激子彼此碰撞而生成单重态激子(由2个三重态激子生成1个单重态激子),则可得到在起初生成的单重态激子25%份量上加上75%
×
(1/2)=37.5%而得的62.5%这样非常高的内部量子效率。此时,ttf比率为37.5/62.5=60%。
[0519]
(第一发光层中的第一主体材料的三重态能量t1(h1)与第二发光层中的第二主体材料的三重态能量t1(h2)满足上述数学式(数学式1)的关系的意义)
[0520]
接着,对于第一发光层中的第一主体材料的三重态能量t1(h1)与第二发光层中的第二主体材料的三重态能量t1(h2)满足上述数学式(数学式1)的关系的意义进行说明。
[0521]
根据本实施方式涉及的有机el元件,认为对于在第一发光层中通过空穴与电子复合而生成的三重态激子而言,即便在该第一发光层与直接相接的有机层的界面存在过剩的载流子,在第一发光层与该有机层的界面存在的三重态激子也不容易被淬灭。例如,在复合区域局部地存在于第一发光层与空穴传输层或电子阻挡层的界面的情况下,可考虑过剩的电子导致的淬灭。另一方面,在复合区域局部地存在于第一发光层与电子传输层或空穴阻挡层的界面的情况下,可考虑过剩的空穴导致的淬灭。
[0522]
本实施方式涉及的有机el元件通过以满足上述数学式(数学式1)的关系的方式具备至少2个发光层(即,第一发光层和第二发光层),在第一发光层中生成的三重态激子没有被过剩载流子所淬灭而移动至第二发光层,另外,能够抑制从第二发光层向第一发光层反向移动。其结果,在第二发光层中,表现出ttf机理而高效生成单重态激子,发光效率提高。
[0523]
如此,有机el元件具备主要生成三重态激子的第一发光层、和有效利用从第一发光层移动过来的三重态激子而主要表现ttf机理的第二发光层作为不同区域,作为第二发光层中的第二主体材料,使用具有比第一发光层中的第一主体材料更小的三重态能量的化合物,设置三重态能量之差,由此发光效率提高。
[0524]
接着,对于在本实施方式涉及的有机el元件中使用三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上的第一主体材料的意义进行说明。
[0525]
如上所述,本实施方式的有机el元件在将发光层设为层叠结构的基础上,进一步
(h1)进行选择。
[0547]
例如,在2.2ev≥t1(h1)≥2.0ev的情况下,优选的是,第一磷光络合物为ir(ppy)3,第二磷光络合物为ir(piq)2(acac)。以下示出ir(ppy)3和ir(piq)2(acac)的结构。
[0548]
另外,在2.0ev>t1(h1)≥1.9ev的情况下,可以使用ir(ppy)3作为第一磷光络合物,可以使用ptoep(铂八乙基卟啉)作为第二磷光络合物。
[0549]
【化学式22】
[0550][0551]
瞬态pl数据测定用试样例如利用下述的步骤进行制作。
[0552]
在玻璃基板上共蒸镀作为第一主体材料的化合物target和作为第二磷光络合物的化合物c2而形成第二解析层。
[0553]
接着,在第二解析层之上共蒸镀作为第一主体材料的化合物target和作为第一磷光络合物的化合物c1而形成第一解析层。如此进行,得到在玻璃基板上层叠有第一解析层和第二解析层的扩散速度解析层。
[0554]
接着,将扩散速度解析层利用密封玻璃进行密封。
[0555]
按照以上方式,得到瞬态pl数据测定用试样。
[0556]
化合物target、化合物c1和化合物c2以满足上述数学式(数学式x)和上述数学式(数学式y)的方式进行选择。
[0557]
第一解析层的膜厚d1调整至10nm以上且200nm以下。第二解析层的膜厚d2调整至10nm以上且200nm以下。
[0558]
瞬态pl数据测定用试样的构成为d1=100nm、d2=20nm,简略示出则如下所示。
[0559]
透射光侧/glass(0.7mm)/化合物target:化合物c2(20nm,95%:5%)/化合物target:化合物c1(100nm,80%:20%)/密封玻璃(0.6mm)/入射光侧
[0560]
需要说明的是,括弧内的数字表示膜厚。同样地在括弧内,以百分比显示的数字(95%:5%)表示化合物target和化合物c2的比例(质量%)。以百分比显示的数字(80%:20%)表示化合物target和化合物c1的比例(质量%)。
[0561]
(2)瞬态pl光谱的测定
[0562]
使用在上述(1)中制作的瞬态pl数据测定用试样,以激发光从第一解析层侧入射、透射光从第二解析层透射的方式测定上述透射光的瞬态pl光谱。具体而言,利用下述条件(测定系统)以瞬态pl光谱的形式测定第二解析层中的化合物c2(第二磷光络合物)的延迟
发光分量。
[0563]-条件-[0564]
·
使用光源:nanoled-340
[0565]
·
检测器:horiba制ppd850
[0566]
·
检测波长:620nm
[0567]
化合物c2(第二磷光络合物)的延迟发光分量与第二磷光络合物的发光光谱的峰值波长处的强度相当。
[0568]
一般而言,在不包含重原子的有机化合物的光激发中,由于三重态激子(三重态)为禁戒跃迁,因而通常形成单重态激子。因此,作为将第一主体材料的单重态激子转换为三重态激子的敏化剂,使用满足上述数学式(数学式x)的关系的化合物c1(第一磷光络合物)。通过作为敏化剂的化合物c1,单重态激子被转换为三重态激子,进而由化合物c1生成的三重态激子向第一主体材料的三重态激子进行能量转移。
[0569]
因此,在第一解析层中生成的第一主体材料的单重态激子是微量的,来自第一主体材料的单重态激子的能量转移可以忽略。
[0570]
另外,第一主体材料与化合物c1的最低三重态激发能级之差、以及第一主体材料与化合物c2的最低三重态激发能级之差由于满足上述数学式(数学式x)和(数学式y)的关系,因而从化合物c1和化合物c2向第一主体材料的反向能量转移也可以忽略。
[0571]
对于所测定的瞬态pl光谱进行说明。
[0572]
图1是使用下述化合物bh1-c(第一主体材料)作为化合物target而制作的瞬态pl数据测定用试样1的瞬态pl光谱。
[0573]
图2a~图2c是用于对于向瞬态pl数据测定用试样1入射激发光(入射光)时(t=0)、经过时间t1时和经过时间t2时的三重态的行为和密度进行说明的图。
[0574]
图2a~图2c中,tp表示三重态,“来自c2的发光”表示来自化合物c2(第二磷光络合物)的发光。
[0575]
【化学式23】
[0576][0577]
图1中,瞬态pl数据测定用试样1的构成如下所述。
[0578]
·
瞬态pl数据测定用试样1
[0579]
透射光侧/glass(0.7mm)/化合物bh1-c:ir(piq)2(acac)(20,95%:5%)/化合物bh1-c:ir(ppy)3(100,80%:20%)/密封玻璃(0.6mm)/入射光侧
[0580]
图1中,t=0表示向瞬态pl数据测定用试样入射激发光(入射光)时,t=t1表示从入射时起经过时间t1时,t=t2表示从入射时起经过时间t2时。这些与图2a~图2c所示的t=0、t=t1和t=t2对应。
[0581]
对于三重态的行为进行具体说明。
[0582]
在图1和图2a中,在t=0时,若激发光从第一解析层侧入射,则化合物c1(第一磷光
络合物)被入射光所激发,生成与激发光的吸收量相对应的三重态tp。生成与下述数学式(数学式10b)所示的朗伯定律相对应的量的激子。此处,假定所吸收的能量均转换为三重态。
[0583]
【数学式1】
[0584][0585]
t(x):测定试样内的位置x处的triplet浓度[cm-3
]
[0586]
a:吸光系数/cm
[0587]
to:在入射端面(x=0)上在t=0生成的triplet浓度/cm3[0588]
在图1和图2b中,在t=t1时,在第一解析层中生成的三重态tp由于上述数学式(数学式1)所示的关系而向第二解析层扩散。
[0589]
在图1和图2c中,在t=t2时,扩散至第二解析层而到达第二磷光络合物的三重态tp进行磷光发光。需要说明的是,来自第二解析层的磷光发光是基于化合物c2被入射光激发而生成的三重态和从第一解析层扩散的三重态tp这两者的发光(图2c中的“来自c2的发光”)。
[0590]
使用以上说明的模型(三重态tp的行为),利用下述数学式(数学式100a)所示的扩散方程式,根据瞬态pl光谱(光强度)算出三重态能量t1(h1)的扩散系数d1。
[0591]
需要说明的是,设定不存在t>0时的向x=0的能量的产生和流入地进行计算(设定t(t>0,x=0)=0。)
[0592]
(3)第一主体材料的三重态能量t1(h1)的扩散系数d1的算出
[0593]
第一主体材料的三重态能量t1(h1)的扩散系数d1利用以下的步骤算出。
[0594]
在以下的说明中,对于基于图1所示的瞬态pl数据测定用试样1的瞬态pl光谱的测定结果,利用下述数学式(数学式100a)所示的扩散方程式算出第一主体材料的三重态能量t1(h1)的扩散系数d1的方法进行说明。
[0595]
【数学式2】
[0596][0597]
t:triplet浓度[cm-3
]
[0598]
d:扩散系数[cm2/s]
[0599]ktt
:ttf速度[cm-3
/s]
[0600]kt
:自失活速度[/s]
[0601]
对于扩散方程式的数值解法进行说明。
[0602]
作为数值解法,应用显式法。如下述表1所示,显式法是指,将空间
·
时间分割为网格状,逐次算出下一个值,最终算出整体的值的方法。在瞬态pl数据测定用试样1的情况下,将空间(从入射光侧的第一解析层的表面(表2中、x=0)朝向测定器侧的第二解析层的表面(表2中、x=a)的厚度方向)设为x、将时间设为t时,“triplet浓度的时间空间分布t(x,t)”例如如表2所示那样制作。表2中,t1浓度表示triplet浓度。
[0603]
在瞬态pl数据测定用试样1中,由于第一解析层和第二解析层的总厚度为120nm,
因此在表2中,x=a中的a相当于120nm。因此,从空间x1至空间x20表示第一解析层和第二解析层在厚度方向上被分割为20个部分。
[0604]
同样地,在表2中,时间t=t15中的t15相当于图1中的t2。因此,从时间t1至时间t15表示时间t2被分割为15个部分。
[0605]
【表1】
[0606][0607]
【表2】
[0608][0609]
此处,在表2中,各单元格中算出的值为triplet浓度的时间空间分布t(x,t),因此需要转换为发光。
[0610]
若对铱络合物进行激发,则可利用时间依赖性得到发光强度int(t)。时刻t的铱络
合物的发光强度由下述数学式(数学式101)表示。
[0611]
【数学式3】
[0612]
int(t)=∑t(τ)
×
i(τ)
···
(101)
[0613]
τ=0~t
[0614]
t:triplet浓度[cm-3
]
[0615]
τ:triplet发光寿命[s]
[0616]
i:规范化发光强度[a.u.]
[0617]
利用最小二乘法进行瞬态pl数据测定用试样1的瞬态pl光谱的拟合。
[0618]
图3示出瞬态pl数据测定用试样1的瞬态pl光谱和进行拟合后的瞬态pl光谱。
[0619]
接着,利用上述数学式(数学式100a)所示的扩散方程式求出扩散系数(d)、ttf速度(k
tt
)和自失活速度(k
t
)。需要说明的是,用于拟合的时间范围设为从t=0至1.0e-05(sec)。此处,e表示10的乘方。
[0620]
将所算出的扩散系数(d)设为上述化合物bh1-c(第一主体材料)的三重态能量t1(h1)的扩散系数d1。按照以上方式,算出第一主体材料的三重态能量t1(h1)的扩散系数d1。
[0621]
(ttf比率)
[0622]
本实施方式涉及的有机el元件通过包含满足上述数学式(数学式1)的关系的第一主体材料和第二主体材料,并且选择三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上的第一主体材料,能够使相对于总发光的源自ttf的发光强度比为高的值。
[0623]
源自ttf的发光强度比可以通过瞬态el法进行测定。瞬态el法是指,对于除去对元件施加的dc电压后的el发光的衰减行为(瞬态特性)进行测定的方法。el发光强度分类为来自在最初的复合中生成的单重态激子的发光分量和来自经由ttf现象生成的单重态激子的发光分量。由于单重态激子的寿命为纳秒级,非常短,因此在dc电压除去后快速衰减。
[0624]
另一方面,ttf现象由于为来自经由寿命长的三重态激子而生成的单重态激子的发光,因此缓慢地衰减。如此,由于来自单重态激子的发光与来自三重态激子的发光在时间上存在大幅差异,因此能够求出源自ttf的发光强度。具体可以通过以下的方法进行确定。
[0625]
瞬态el波形如下进行测定(参见图7)。将由电压脉冲发生器(pg)输出的脉冲电压波形施加于el元件。将施加电压波形输入示波器(osc)。若将脉冲电压施加于el元件,则el元件产生脉冲发光。将该发光经由光电增倍管(pmt)而导入示波器(osc)。使电压波形和脉冲发光同步并导入个人电脑(pc)。
[0626]
然后,如下所述,通过瞬态el波形的解析来确定源自ttf的发光强度比。
[0627]
求解三重态激子的衰减行为的速率方程式,将基于ttf现象的发光强度的衰减行为模型化。发光层内部的三重态激子密度n
t
的时间衰减可以使用基于三重态激子的寿命的衰减速度α和基于三重态激子的碰撞的衰减速度γ由以下所示的速率方程式表示。
[0628]
【数学式4】
[0629][0630]
若对该微分方程式进行近似求解,则得到以下式子。此处,i
ttf
为源自ttf的发光强度,a为常数。如此,如果瞬态el发光基于ttf,则其强度的平方根的倒数由直线近似来表示。
因此,将所测定的瞬态el波形数据拟合为下述近似式而求出常数a。此时,除去dc电压的时刻t=0的发光强度1/a2定义为源自ttf的发光强度比。
[0631]
【数学式5】
[0632][0633]
图8a的曲线图是对el元件施加规定的dc电压并且在之后除去电压时的测定例,表示el元件的发光强度的时间变化。在图8a的曲线图中,在时刻约3
×
10-8
秒的位置除去dc电压。需要说明的是,曲线图是将除去电压时的亮度设为1进行表示的。之后,至约2
×
10-7
秒为止的快速衰减之后,出现缓慢的衰减分量。图8b的曲线图是将电压除去时点取作原点,在电压除去后,将至10-5
秒为止的光强度的平方根的倒数进行绘制而得到的曲线图,可知能够良好地近似为直线。将直线部分延长至时间原点时的与纵轴的交点a的值为2.41。于是,由该瞬态el波形得到的源自ttf的发光强度比为1/2.412=0.17,总发光强度之中的17%源自ttf。
[0634]
向直线的拟合优选通过最小二乘法进行。此时,优选使用至10-5
秒为止的值进行拟合。
[0635]
施加由脉冲发生器(agilent technologies公司制、8114a)输出的电压脉冲波形(脉冲宽度:500微秒、频率:20hz、电压:相当于0.1~100ma/cm2的电压),将el发光输入光电增倍管(滨松光电公司制r928),使脉冲电压波形与el发光同步并输入示波器(tektronix公司制2440)而得到了瞬态el波形。将其解析而确定ttf比率。
[0636]
[第二实施方式]
[0637]
(有机电致发光元件)
[0638]
第二实施方式涉及的有机el元件具有阳极、阴极和配置于上述阳极与上述阴极之间的发光层,上述发光层包含第一发光层和第二发光层,上述第一发光层包含第一主体材料和第一发光性化合物,上述第二发光层包含第二主体材料和第二发光性化合物,上述第一主体材料与上述第二主体材料相互不同,上述第一发光性化合物与上述第二发光性化合物相互相同或者不同,上述第一主体材料的三重态能量t1(h1)与上述第二主体材料的三重态能量t1(h2)满足下述数学式(数学式1)的关系,上述第一主体材料的表面电势v1为-11(mv/nm)以下。
[0639]
t1(h1)>t1(h2)
…
(数学式1)
[0640]
本发明人等发现,在层叠有第一发光层和第二发光层的有机el元件中,通过选择满足上述数学式(数学式1)的关系的第一主体材料和第二主体材料,并且选择表面电势v1为-11(mv/nm)以下的材料作为第一主体材料,能够进一步提高发光效率。
[0641]
第一发光层中的第一主体材料的三重态能量t1(h1)与第二发光层中的第二主体材料的三重态能量t1(h2)满足上述数学式(数学式1)的关系的意义与在第一实施方式中进行的说明相同。
[0642]
接着,在第二实施方式涉及的有机el元件中,对使用表面电势v1为-11(mv/nm)以下的第一主体材料的意义进行说明。
[0643]
第二实施方式的有机el元件在将发光层设为层叠结构的基础上,进一步使用满足
上述数学式(数学式1)的关系的第一主体材料和第二主体材料,实现了发光效率的提高。
[0644]
若在第一发光层中空穴与电子进行复合,则在第一主体材料中生成单重态激子和三重态激子。由第一主体材料生成的单重态激子在向第一发光性化合物的单重态激子发生能量转移后发出光,在第一主体材料中生成的三重态激子其生存寿命长,发生自失活,因此难以有助于在第一发光层中的发光。因此,在第一发光层中,使空穴与电子尽可能地发生复合对于元件性能的提高是重要的。
[0645]
在第二实施方式涉及的有机el元件中,在第一发光层与第二发光层的层叠顺序是从阳极侧起为第一发光层和第二发光层的顺序(以下有时称为“顺层叠”。)的情况下,通过选择表面电势v1在负侧大的(-11(mv/nm)以下)材料作为第一主体材料,第一发光层的能级在向第二发光层侧的朝向上在负侧增大。其结果,空穴容易从阳极侧进入第一发光层,因而在第一发光层中的复合概率升高,其结果,发光效率提高。
[0646]
另外,通过选择表面电势v1在负侧大的(-11(mv/nm)以下)材料作为第一主体材料,在第一主体材料中,由于对空穴以及电子的电荷的能量施加反方向的偏移,因此可抑制无用的载流子蓄积。其结果,认为电荷淬灭得到抑制从而发光效率提高。
[0647]
在第二实施方式涉及的有机el元件中,由于第一发光层的膜厚比较薄(优选为2nm以上且20nm以下),因此要发挥发光效率的提高效果,则表面电势v1在负侧越大则越优选。
[0648]
需要说明的是,在第二实施方式涉及的有机el元件中,在第一发光层与第二发光层的层叠顺序是从阳极侧起为第二发光层和第一发光层的顺序(以下有时称为“逆层叠”。)的情况下,通过选择表面电势v1在负侧大的材料(-11(mv/nm)以下的材料)作为第一主体材料,第一发光层的能级在向阴极侧的朝向上在负侧增大。其结果,电子容易从阴极侧进入第一发光层,因而在第一发光层中的复合概率增高。因此,即便发光层是逆层叠,也期待与上述顺层叠的情况同样的效果。
[0649]
《表面电势v1>
[0650]
在第二实施方式涉及的有机el元件中,第一主体材料的表面电势v1(mv/nm)满足下述数学式(数学式10)。
[0651]
第一主体材料的表面电势v1优选满足下述数学式(数学式10a)。第一主体材料的表面电势v1在负侧越大则越优选,从抑制过度的电压上升的观点出发,下限值为-400(mv/nm)以上。
[0652]v1
≤-11(mv/nm)
…
(数学式10)
[0653]v1
≤-15(mv/nm)
…
(数学式10a)
[0654]
《第一主体材料的表面电势v1>
[0655]
第一主体材料的表面电势v1(mv/nm)是使用利用后述的方法制作的表面电势测定用试样1、2,以开尔文探针法算出的。在下文中,有时将表面电势测定用试样1称为试样1。有时将表面电势测定用试样2称为试样2。
[0656]
在本说明书中,将试样2的第一主体材料层(膜厚d2(单位:nm))的功函数w(d2)(单位:mv)与试样1的第一主体材料层(膜厚d1(单位:nm))的功函数w(d1)(单位:mv)的差值除以试样2的第一主体材料层的膜厚d2(单位:nm)与试样1的第一主体材料层的膜厚d1(单位:nm)的差值而得到的值定义为“第一主体材料的表面电势v1(mv/nm)”。
[0657]
即,在本说明书中,由下述数学式(数学式100)算出的值定义为“第一主体材料的
表面电势v1(mv/nm)”。
[0658]
第一主体材料的表面电势v1=(w(d2)-w(d1))/(d2-d1)
…
(数学式100)
[0659]
依次对于试样1、2的制作方法和表面电势v1的测定方法进行说明。
[0660]
(表面电势测定用试样1、2的制作方法)
[0661]
表面电势测定用试样1、2例如利用下述的步骤进行制作。
[0662]
准备带ito(indium tin oxide)透明电极的玻璃基板。
[0663]
在带ito透明电极的玻璃基板上蒸镀作为第一主体材料的化合物target,形成膜厚d1的第一主体材料层。如此进行,得到试样1。
[0664]
在带ito透明电极的玻璃基板上蒸镀作为第一主体材料的化合物target,形成与膜厚d1不同的膜厚d2的第一主体材料层。如此进行,得到试样2。
[0665]
膜厚d1(试样1的第一主体材料层的膜厚)调整为10nm以上且100nm以下。膜厚d2(试样2的第一主体材料层的膜厚)调整为10nm以上且100nm以下。其中,膜厚d2与膜厚d1之差调整为20nm以上且50nm以下。
[0666]
试样1、2的构成为d1=20nm、d2=60nm,简略示出则如下所示。
[0667]
试样1:玻璃基板(0.7mm)/ito(130nm)/化合物target(20nm)
[0668]
试样2:玻璃基板(0.7mm)/ito(130nm)/化合物target(60nm)
[0669]
需要说明的是,括弧内的数字表示膜厚。
[0670]
(表面电势v1的测定方法)
[0671]
与探针对置地将试样1设置于试样台。探针在截面部具备的不锈钢电极(参比电极)。
[0672]
通过探针使不锈钢电极上下振动,在试样1的ito透明电极与不锈钢电极间施加外部电场vex。输出信号为0mv时的vex设为试样1的第一主体材料层的功函数w(d1)(mv)。
[0673]
对于试样2,也利用与试样1同样的方法测定试样2的第一主体材料层的功函数w(d2)(mv)。
[0674]
在以下的装置中,将功函数w(d1)、w(d2)的值通过与参比样品(au)的比较进行修正并输出。
[0675]
测定条件如下所述。
[0676]-条件-[0677]
·
装置:kp technology ltd制uhvkp020
[0678]
·
测定区域:
[0679]
在第一实施方式和第二实施方式涉及的有机el元件中,上述第一主体材料的最高已占轨道的能级homo(h1)的绝对值与上述第一发光性化合物的最高已占轨道的能级homo(d1)的绝对值优选满足下述数学式(数学式2)的关系。
[0680]
|homo(h1)|-|homo(d1)|≥0.2ev
…
(数学式2)
[0681]
若homo(h1)的绝对值与homo(d 1)的绝对值满足上述数学式(数学式2)的关系,则容易产生空穴阱。其结果,复合容易在第一发光层的内部发生。
[0682]
第一主体材料的最高已占轨道的能级homo(h1)的绝对值优选为7.0ev以下。
[0683]
在本说明书中,最高已占轨道的能级homo在大气下使用光电子分光装置进行测
定。具体而言,能够通过实施例记载的方法测定最高已占轨道的能级homo。
[0684]
在第一实施方式和第二实施方式涉及的有机el元件中,在第一发光层与第二发光层的层叠顺序是从阳极侧起为第一发光层和第二发光层的顺序的情况下,第二主体材料的电子迁移率μe(h2)与第一主体材料的电子迁移率μe(h1)优选满足下述数学式(数学式4)的关系。
[0685]
μe(h2)>μe(h1)
…
(数学式4)
[0686]
通过第一主体材料与第二主体材料满足上述数学式(数学式4)的关系,在第一发光层中的空穴与电子的复合能力提高。
[0687]
在第一实施方式和第二实施方式涉及的有机el元件中,在第一发光层与第二发光层的层叠顺序是从阳极侧起为第一发光层和第二发光层的顺序的情况下,第一主体材料的空穴迁移率μh(h1)与第二主体材料的空穴迁移率μh(h2)也优选满足下述数学式(数学式40)的关系。
[0688]
μh(h1)>μh(h2)
…
(数学式40)
[0689]
在第一实施方式和第二实施方式涉及的有机el元件中,在第一发光层与第二发光层的层叠顺序是从阳极侧起为第一发光层和第二发光层的顺序的情况下,第一主体材料的空穴迁移率μh(h1)、第一主体材料的电子迁移率μe(h1)、第二主体材料的空穴迁移率μh(h2)和第二主体材料的电子迁移率μe(h2)也优选满足下述数学式(数学式40a)的关系。
[0690]
(μe(h2)/μh(h2))>(μe(h1)/μh(h1))
…
(数学式40a)
[0691]
电子迁移率可以使用阻抗谱法利用以下的方法进行测定。
[0692]
利用阳极和阴极夹持厚度100nm~200nm的测定对象层,一边施加偏置dc电压一边施加100mv以下的微小交流电压。测定此时流通的交流电流值(绝对值和相位)。一边改变交流电压的频率一边进行本测定,根据电流值和电压值算出复阻抗(z)。此时,求出模量m=iωz(i:虚数单位、ω:角频率)的虚数部(imm)的频率依赖性将imm达到最大值的频率ω的倒数定义为在测定对象层内传导的电子的响应时间。然后,通过以下的式子算出电子迁移率。
[0693]
电子迁移率=(测定对象层的膜厚)2/(响应时间
·
电压)
[0694]
空穴迁移率可以使用阻抗谱法利用与电子迁移率同样的方法进行测定。
[0695]
通过以下的式子算出空穴迁移率。
[0696]
空穴迁移率=(测定对象层的膜厚)2/(响应时间
·
电压)
[0697]
在第一实施方式和第二实施方式涉及的有机el元件中,第一发光性化合物的三重态能量t1(d1)与上述第二主体材料的三重态能量t1(h2)优选满足下述数学式(数学式3)的关系。
[0698]
t1(d1)>t1(h2)
…
(数学式3)
[0699]
若t1(d1)与t1(h2)满足上述数学式(数学式3)的关系,则容易产生第二主体材料的三重态。其结果,容易在第二主体材料中高效地发生ttf。
[0700]
在第一实施方式和第二实施方式涉及的有机el元件中,第一主体材料的单重态能量s1(h1)与第二主体材料的单重态能量s1(h2)优选满足下述数学式(数学式5)的关系。
[0701]
s1(h1)>s1(h2)
…
(数学式5)
[0702]
若s1(h1)与s1(h2)满足上述数学式(数学式5)的关系,则容易发生从第一主体材料向第二主体材料的单重态激子的能量转移。认为其结果能够将复合部位与发光部位分离,
因此发光效率提高、或者驱动寿命增长。
[0703]
在第一实施方式和第二实施方式涉及的有机el元件中,通过分子轨道计算所算出的第一主体材料的范德华半径优选为1.08nm以上,更优选为1.20nm以上。
[0704]
若第一主体材料的范德华半径为1.08nm以上,则自失活得到抑制。其结果,容易高效地发生向第二主体材料的能量转移,发光效率提高。
[0705]“化合物(第一主体材料)的范德华半径”如下算出:将通过分子轨道计算法最优化后的结构利用winmoster进行显示时,根据“化合物的范德华体积”由下述数学式(数学式102)算出。分子轨道计算使用量子化学计算程序(gaussian 09(gaussian inc.);计算方法:b3lyp/6-31g*(是指理论使用b3lyp,基函数使用6-31g*))进行。
[0706]“化合物的范德华体积”是指,由基于构成化合物的“原子的范德华半径”的范德华球所占有的区域的体积,是指使用分子轨道计算软件,以pm3法求出稳定结构,由此计算得到的值。
[0707]
v=4/3
×
πr3…
(数学式102)
[0708]
(v为化合物的范德华体积,r为化合物的范德华半径。)
[0709]
在第一实施方式和第二实施方式涉及的有机el元件中,第一发光层的膜厚优选为2nm以上且20nm以下,更优选为5nm以上且10nm以下。
[0710]
若第一发光层的膜厚为2nm以上且20nm以下,则由第一主体材料生成的三重态容易不发生失活地发生向第二主体材料的能量转移。其结果,效率提高。
[0711]
在本说明书中,“主体材料”是指,例如含量为“层的50质量%以上”的材料。因此,在第一发光层中,例如第一主体材料的含量为第一发光层的总质量的50质量%以上。在第二发光层中,例如第二主体材料的含量为第二发光层的总质量的50质量%以上。
[0712]
(有机el元件的发光波长)
[0713]
第一实施方式和第二实施方式涉及的有机el元件优选在元件驱动时发射最大峰值波长为500nm以下的光。
[0714]
第一实施方式和第二实施方式涉及的有机电致发光元件更优选在元件驱动时发射最大峰值波长为430nm以上且480nm以下的光。
[0715]
在元件驱动时有机el元件发射的光的最大峰值波长的测定如下进行。对于对有机el元件施加电压使得电流密度为10ma/cm2时的分光发射亮度光谱,利用分光发射亮度计cs-2000(konica minolta公司制)进行测量。在所得到的分光发射亮度光谱中,测定发光强度最大的发光光谱的峰值波长,将其作为最大峰值波长(单位:nm)。
[0716]
(第一发光层)
[0717]
第一发光层包含第一主体材料和第一发光性化合物。第一主体材料是与第二发光层含有的第二主体材料不同的化合物。
[0718]
上述第一发光性化合物的最大峰值波长优选为500nm以下,更优选为480nm以下。第一发光性化合物的最大峰值波长优选为430nm以上。
[0719]
第一发光层含有的第一发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物,进一步优选为显现480nm以下的荧光发光的荧光发光性化合物。第一发光层含有的第一发光性化合物优选为显现最大峰值波长为430nm以上的荧光发光的荧光发光性化合物。
(单位:nm)。
[0735]
在第一实施方式和第二实施方式涉及的有机el元件中,第一主体材料的单重态能量s1(h1)与第一发光性化合物的单重态能量s1(d1)优选满足下述数学式(数学式20)的关系。
[0736]
s1(h1)>s1(d1)
…
(数学式20)
[0737]
单重态能量s1是指最低激发单重态与基态的能量差。
[0738]
通过第一主体材料与第一发光性化合物满足数学式(数学式20)的关系,由此在第一主体材料上生成的单重态激子容易从第一主体材料向第一发光性化合物发生能量转移,有助于第一发光性化合物的发光(优选为荧光性发光)。
[0739]
在第一实施方式和第二实施方式涉及的有机el元件中,第一主体材料的三重态能量t1(h1)与第一发光性化合物的三重态能量t1(d1)优选满足下述数学式(数学式20a)的关系。
[0740]
t1(d1)>t1(h1)
…
(数学式20a)
[0741]
通过第一主体材料和第一发光性化合物满足数学式(数学式20a)的关系,在第一发光层内生成的三重态激子并不在具有更高三重态能量的第一发光性化合物上,而是在第一主体材料上移动,因此容易向第二发光层移动。
[0742]
第一实施方式和第二实施方式涉及的有机el元件优选满足下述数学式(数学式20b)的关系。
[0743]
t1(d1)>t1(h1)>t1(h2)
…
(数学式20b)
[0744]
(三重态能量t1)
[0745]
作为三重态能量t1的测定方法,可以举出下述的方法。
[0746]
将成为测定对象的化合物溶解于epa(二乙醚:异戊烷:乙醇=5:5:2(容积比))中使得浓度为10-5
mol/l以上且10-4
mol/l以下,将该溶液加入石英比色池中作为测定试样。对于该测定试样,在低温(77[k])测定磷光光谱(纵轴设为磷光发光强度、横轴设为波长。),对于该磷光光谱的短波长侧的升起引切线,将基于该切线与横轴的交点的波长值λ
edge
[nm],根据以下换算式(f1)算出的能量作为三重态能量t1。
[0747]
换算式(f1):t1[ev]=1239.85/λ
edge
[0748]
对于磷光光谱的短波长侧的升起的切线如下引出。从磷光光谱的短波长侧起直至光谱的极大值之中最短波长侧的极大值为止在光谱曲线上进行移动时,朝向长波长侧考量曲线上的各点处的切线。该切线随着曲线升起(即随着纵轴增加)而斜率增加。在该斜率的值取极大值的点处所引的切线(即拐点处的切线)作为该对于磷光光谱的短波长侧的升起的切线。
[0749]
需要说明的是,具有光谱的最大峰值强度的15%以下的峰强度的极大点不包括在上述的最短波长侧的极大值中,将与最短波长侧的极大值最接近的、斜率的值取极大值的点处所引的切线作为该对于磷光光谱的短波长侧的升起的切线。
[0750]
磷光的测定可以使用株式会社日立高新技术制的f-4500型分光荧光光度计主体。需要说明的是,测定装置不限于此,可以通过组合冷却装置和低温用容器、激发光源以及受光装置来进行测定。
[0751]
(单重态能量s1)
[0752]
作为使用溶液的单重态能量s1的测定方法(有时称为溶液法。),可以举出下述的方法。
[0753]
制备成为测定对象的化合物的10-5
mol/l以上且10-4
mol/l以下的甲苯溶液并加入至石英比色池中,在常温(300k)测定该试样的吸收光谱(纵轴设为吸收强度、横轴设为波长)。对于该吸收光谱的长波长侧的下坠引切线,将该切线与横轴的交点的波长值λ
edge
[nm]代入随后所示的换算式(f2)算出单重态能量。
[0754]
换算式(f2):s1[ev]=1239.85/λ
edge
[0755]
作为吸收光谱测定装置,例如可以举出日立公司制的分光光度计(装置名:u3310),不限于此。
[0756]
对于吸收光谱的长波长侧的下坠的切线如下引出。从吸收光谱的极大值之中最长波长侧的极大值起沿长波长方向在光谱曲线上移动时,考量曲线上的各点处的切线。该切线随着曲线下坠(即随着纵轴的值减少),其斜率重复减少而后增加的情况。将斜率的值在最长波长侧(其中不包括吸光度为0.1以下的情况)取极小值的点处所引的切线作为该对于吸收光谱的长波长侧的下坠的切线。
[0757]
需要说明的是,吸光度的值为0.2以下的极大点不包括在上述最长波长侧的极大值中。
[0758]
在第一实施方式和第二实施方式涉及的有机el元件中,第一发光性化合物在第一发光层中的含量优选超过1.1质量%。即,在第一发光层中,第一发光性化合物的含量优选超过第一发光层的总质量的1.1质量%,更优选含量为第一发光层的总质量的1.2质量%以上,进一步优选含量为第一发光层的总质量的1.5质量%以上。
[0759]
在第一发光层中,第一发光性化合物的含量优选为第一发光层的总质量的10质量%以下,含量更优选为第一发光层的总质量的7质量%以下,含量进一步优选为第一发光层的总质量的5质量%以下。
[0760]
在第一实施方式和第二实施方式涉及的有机el元件中,在第一发光层中,作为第一主体材料的第一化合物的含量优选为第一发光层的总质量的60质量%以上,含量更优选为第一发光层的总质量的70质量%以上,含量进一步优选为第一发光层的总质量的80质量%以上,含量更进一步优选为第一发光层的总质量的90质量%以上,含量进而更优选为第一发光层的总质量的95质量%以上。
[0761]
在第一发光层中,第一主体材料的含量优选为第一发光层的总质量的99质量%以下。
[0762]
其中,在第一发光层含有第一主体材料和第一发光性化合物的情况下,第一主体材料和第一发光性化合物的合计含有率的上限为100质量%。
[0763]
需要说明的是,第一实施方式和第二实施方式不排除在第一发光层中包含除第一主体材料和第一发光性化合物以外的材料。
[0764]
第一发光层可以仅包含1种第一主体材料,也可以包含2种以上。第一发光层可以仅包含1种第一发光性化合物,也可以包含2种以上。
[0765]
(第二发光层)
[0766]
第二发光层包含第二主体材料和第二发光性化合物。第二主体材料是与第一发光层含有的第二主体材料不同的化合物。
[0767]
上述第二发光性化合物的最大峰值波长优选为500nm以下,更优选为480nm以下。第二发光性化合物的最大峰值波长优选为430nm以上。
[0768]
第二发光层含有的第二发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物,进一步优选为显现480nm以下的荧光发光的荧光发光性化合物。第二发光层含有的第二发光性化合物优选为显现最大峰值波长为430nm以上的荧光发光的荧光发光性化合物。
[0769]
化合物的最大峰值波长的测定方法如上所述。
[0770]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层优选在元件驱动时发射最大峰值波长为500nm以下的光。
[0771]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物的最大峰的半峰宽优选为1nm以上且20nm以下。
[0772]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物的斯托克斯位移优选超过7nm。
[0773]
如果第二发光性化合物的斯托克斯位移超过7nm,则容易防止因自吸收导致的发光效率的下降。
[0774]
自吸收是指,同一化合物吸收所放出的光的现象,是引起发光效率下降的现象。由于在斯托克斯位移小(即,吸收光谱与荧光光谱的重叠大)的化合物中观测到显著的自吸收,因此要抑制自吸收,优选使用斯托克斯位移大(吸收光谱与荧光光谱的重叠小)的化合物。斯托克斯位移能够利用以下记载的方法进行测定。
[0775]
将成为测定对象的化合物以2.0
×
10-5
mol/l的浓度溶于甲苯,制备测定用试样。对于加入石英比色池中的测定用试样,在室温(300k)照射紫外-可见区域的连续光,测定吸收光谱(纵轴:吸光度、横轴:波长)。吸收光谱测定可以使用分光光度计,例如可以使用日立高新技术科学公司的分光光度计u-3900/3900h型。另外,将成为测定对象的化合物以4.9
×
10-6
mol/l的浓度溶于甲苯,制备测定用试样。对于加入石英比色池中的测定用试样,在室温(300k)照射激发光,测定荧光光谱(纵轴:荧光强度、横轴:波长)。荧光光谱测定可以使用分光光度计,例如可以使用日立高新技术科学公司的分光荧光光度计f-7000型。
[0776]
根据这些吸收光谱和荧光光谱,算出吸收极大波长与荧光极大波长之差,求出斯托克斯位移(ss)。斯托克斯位移ss的单位为nm。
[0777]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物的三重态能量t1(d2)与第二主体材料的三重态能量t1(h2)优选满足下述数学式(数学式3a)的关系。
[0778]
t1(d2)>t1(h2)
…
(数学式3a)
[0779]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物与第二主体材料通过满足上述数学式(数学式3a)的关系,由此在第一发光层中生成的三重态激子在向第二发光层移动时,不是向具有更高三重态能量的第二发光性化合物而是进行向第二主体材料的分子的能量转移。另外,在第二主体材料上空穴和电子复合而产生的三重态激子不会向具有更高三重态能量的第二发光性化合物移动。在第二发光性化合物的分子上复合而产生的三重态激子快速进行向第二主体材料的分子的能量转移。
[0780]
通过第二主体材料的三重态激子不向第二发光性化合物移动而是借助ttf现象在
第二主体材料上三重态激子彼此有效碰撞,由此生成单重态激子。
[0781]
在第一实施方式和第二实施方式涉及的有机el元件中,第二主体材料的单重态能量s1(h2)与第二发光性化合物的单重态能量s1(d2)优选满足下述数学式(数学式41)的关系。
[0782]
s1(h2)>s1(d2)
…
(数学式41)
[0783]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物与第二主体材料通过满足上述数学式(数学式41)的关系,由此第二发光性化合物的单重态能量由于小于第二主体材料的单重态能量,因此借助ttf现象生成的单重态激子进行从第二主体材料向第二发光性化合物的能量转移,有助于第二发光性化合物的发光(优选为荧光性发光)。
[0784]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物优选为分子中不包含吖嗪环结构的化合物。
[0785]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物优选并非含硼络合物,第二发光性化合物更优选并非络合物。
[0786]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层优选不含有金属络合物。另外,在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层也优选不含有含硼络合物。
[0787]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层优选不包含磷光发光性材料(掺杂剂材料)。
[0788]
另外,第二发光层优选不包含重金属络合物和磷光发光性的稀土金属络合物。此处,作为重金属络合物,例如可以举出铱络合物、锇络合物、和铂络合物等。
[0789]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光性化合物在第二发光层中的含量优选超过1.1质量%。即,在第二发光层中,第二发光性化合物的含量优选超过第二发光层的总质量的1.1质量%,更优选含量为第二发光层的总质量的1.2质量%以上,进一步优选含量为第二发光层的总质量的1.5质量%以上。
[0790]
第二发光层中,第二发光性化合物的含量优选为第二发光层的总质量的10质量%以下,更优选含量为第二发光层的总质量的7质量%以下,进一步优选含量为第二发光层的总质量的5质量%以下。
[0791]
第二发光层中,作为第二主体材料的第二化合物的含量优选为第二发光层的总质量的60质量%以上,含量更优选为第二发光层的总质量的70质量%以上,含量进一步优选为第二发光层的总质量的80质量%以上,含量更进一步优选为第二发光层的总质量的90质量%以上,含量进而更加优选为第二发光层的总质量的95质量%以上。
[0792]
第二发光层中,第二主体材料的含量优选为第二发光层的总质量的99质量%以下。
[0793]
第二发光层含有第二主体材料和第二发光性化合物的情况下,第二主体材料和第二发光性化合物的合计含量的上限为100质量%。
[0794]
需要说明的是,第一实施方式和第二实施方式不排除在第二发光层中包含除第二主体材料和第二发光性化合物以外的材料。
[0795]
第二发光层中,第二主体材料可以仅包含1种,也可以包含2种以上。第二发光层
中,第二发光性化合物可以仅包含1种,也可以包含2种以上。
[0796]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层的膜厚优选为5nm以上,更优选为10nm以上。如果第二发光层的膜厚为5nm以上,则易于抑制从第一发光层向第二发光层移动过来的三重态激子再次回到第一发光层。另外,如果第二发光层的膜厚为5nm以上,则能够充分从第一发光层中的复合部分分离三重态激子。
[0797]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层的膜厚优选为30nm以下。如果第二发光层的膜厚为30nm以下,则能够提高第二发光层中的三重态激子的密度从而更容易引起ttf现象。
[0798]
在第一实施方式和第二实施方式涉及的有机el元件中,第二发光层的膜厚优选为5nm以上且30nm以下。
[0799]
在第一实施方式和第二实施方式涉及的有机el元件中,第一发光性化合物的三重态能量t1(d1)与第一主体材料的三重态能量t1(h1)优选满足下述数学式(数学式11a)的关系。
[0800]
0ev《t1(d1)-t1(h1)《0.6ev
…
(数学式11a)
[0801]
在第一实施方式和第二实施方式涉及的有机el元件中,第一主体材料的三重态能量t1(h1)优选满足下述数学式(数学式12)的关系。
[0802]
t1(h1)>2.0ev
…
(数学式12)
[0803]
(有机el元件的其他层)
[0804]
第一实施方式和第二实施方式涉及的有机el元件除了第一发光层以及第二发光层以外还可以具有1个以上的有机层。作为有机层,例如可以举出选自由空穴注入层、空穴传输层、发光层、电子注入层、电子传输层、空穴阻挡层以及电子阻挡层组成的组中的至少任一个层。
[0805]
在第一实施方式和第二实施方式涉及的有机el元件中,可以仅由第一发光层以及第二发光层构成,也可以还具有选自由例如空穴注入层、空穴传输层、电子注入层、电子传输层、空穴阻挡层、和电子阻挡层等组成的组中的至少任一层。
[0806]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选第一发光层配置于阳极与阴极之间,第二发光层配置于第一发光层与阴极之间。可以从阳极侧起依次具有第一发光层和第二发光层,也可以从阳极侧起依次具有第二发光层和第一发光层。在第一发光层和第二发光层的顺序为任一种的情况下,通过选择满足上述数学式(数学式1)的关系的材料的组合,也能够期待发光层为层叠结构所带来的效果。
[0807]
图4示出第一实施方式和第二实施方式涉及的有机el元件的一例的大致构成。
[0808]
有机el元件1包含透光性的基板2、阳极3、阴极4和配置于阳极3与阴极4之间的有机层10。有机层10是从阳极3侧起依次地将空穴注入层6、空穴传输层7、第一发光层51、第二发光层52、电子传输层8和电子注入层9按照该顺序层叠而构成的。
[0809]
图5示出第一实施方式和第二实施方式涉及的有机el元件的另一例的大致构成。
[0810]
有机el元件1a包含透光性的基板2、阳极3、阴极4和配置于阳极3与阴极4之间的有机层10。有机层10a是从阳极3侧起依次地将空穴注入层6、空穴传输层7、第二发光层52、第一发光层51、电子传输层8和电子注入层9按照该顺序层叠而构成的。
[0811]
本发明不限定于图4和图5所示的有机el元件的构成。
[0812]
(第三发光层)
[0813]
第一实施方式和第二实施方式涉及的有机el元件可以还包含第三发光层。
[0814]
第三发光层包含第三主体材料,第一主体材料、第二主体材料和第三主体材料相互不同,第三发光层至少包含第三发光性化合物,第一发光性化合物、第二发光性化合物和第三发光性化合物相互相同或者不同,第一主体材料的三重态能量t1(h1)与第三主体材料的三重态能量t1(h3)优选满足下述数学式(数学式1a)的关系。
[0815]
t1(h1)>t1(h3)
…
(数学式1a)
[0816]
上述第三发光性化合物的最大峰值波长优选为500nm以下。
[0817]
上述第三发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物。
[0818]
在第一实施方式和第二实施方式涉及的有机el元件包含第三发光层的情况下,第二主体材料的三重态能量t1(h2)与第三主体材料的三重态能量t1(h3)优选满足下述数学式(数学式1b)的关系。
[0819]
t1(h2)>t1(h3)
…
(数学式1b)
[0820]
在第一实施方式和第二实施方式涉及的有机el元件中,优选第一发光层与第二发光层直接相接。
[0821]
在本说明书中,“第一发光层与第二发光层直接相接”的层结构例如也可包含以下的方案(ls1)、(ls2)和(ls3)中的任一方案。
[0822]
(ls1)在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中产生第一主体材料和第二主体材料两者混存的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
[0823]
(ls2)在第一发光层和第二发光层包含发光性的化合物的情况下,在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中生成第一主体材料、第二主体材料和发光性的化合物混存的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
[0824]
(ls3)在第一发光层和第二发光层包含发光性的化合物的情况下,在经过第一发光层涉及的化合物的蒸镀工序和第二发光层涉及的化合物的蒸镀工序的过程中生成由该发光性的化合物形成的区域、由第一主体材料形成的区域或由第二主体材料形成的区域,而该区域存在于第一发光层与第二发光层的界面的方案。
[0825]
第一实施方式和第二实施方式涉及的有机el元件包含第三发光层的情况下,优选第一发光层与第二发光层直接相接,第二发光层与第三发光层直接相接。
[0826]
在本说明书中,“第二发光层与第三发光层直接相接”的层结构也可以包含例如以下的方案(ls4)、(ls5)和(ls6)中的任一方案。
[0827]
(ls4)在经过第二发光层涉及的化合物的蒸镀工序与第三发光层涉及的化合物的蒸镀工序的过程中生成第二主体材料和第三主体材料两者混存的区域,而该区域存在于第二发光层与第三发光层的界面的方案。
[0828]
(ls5)在第二发光层和第三发光层包含发光性的化合物的情况下,在经过第二发光层涉及的化合物的蒸镀工序与第三发光层涉及的化合物的蒸镀工序的过程中生成第二主体材料、第三主体材料和发光性的化合物混存的区域,而该区域存在于第二发光层与第
三发光层的界面的方案。
[0829]
(ls6)在第二发光层和第三发光层包含发光性的化合物的情况下,在经过第二发光层涉及的化合物的蒸镀工序与第三发光层涉及的化合物的蒸镀工序的过程中生成由该发光性的化合物形成的区域、由第二主体材料形成的区域或由第三主体材料形成的区域,而该区域存在于第二发光层与第三发光层的界面的方案。
[0830]
另外,第一实施方式和第二实施方式涉及的有机el元件也优选还具有扩散层。
[0831]
第一实施方式和第二实施方式涉及的有机el元件具有扩散层的情况下,扩散层优选配置于第一发光层与上述第二发光层之间。
[0832]
对于有机el元件的构成进行进一步的说明。以下,有时省略符号的记载。
[0833]
(基板)
[0834]
基板被用作有机el元件的支撑体。作为基板,例如可以使用玻璃、石英以及塑料等。另外,可以使用挠性基板。挠性基板是指,能够弯折的(柔性的)基板。例如可以举出塑料基板等。作为形成塑料基板的材料,例如可以举出聚碳酸酯、聚芳酯、聚醚砜、聚丙烯、聚酯、聚氟乙烯、聚氯乙烯、聚酰亚胺以及聚萘二甲酸乙二醇酯等。另外,也可以使用无机蒸镀膜。
[0835]
(阳极)
[0836]
形成在基板上的阳极优选使用功函数大(具体而言为4.0ev以上)的金属、合金、导电性化合物以及它们的混合物等。具体而言,例如可以举出氧化铟-氧化锡(ito:indium tin oxide,铟锡氧化物)、含有硅或氧化硅的氧化铟-氧化锡、氧化铟-氧化锌、含有氧化钨和氧化锌的氧化铟、石墨烯等。此外,可以举出金(au)、铂(pt)、镍(ni)、钨(w)、铬(cr)、钼(mo)、铁(fe)、钴(co)、铜(cu)、钯(pd)、钛(ti)或者金属材料的氮化物(例如氮化钛)等。
[0837]
这些材料通常通过溅射法进行成膜。例如,氧化铟-氧化锌可以通过使用相对于氧化铟加入了1质量%以上且10质量%以下的氧化锌的靶利用溅射法而形成。另外,例如,含有氧化钨和氧化锌的氧化铟可以通过使用相对于氧化铟含有0.5质量%以上且5质量%以下氧化钨和0.1质量%以上且1质量%以下氧化锌的靶利用溅射法而形成。另外,也可以通过真空蒸镀法、涂布法、喷墨法、旋涂法等进行制作。
[0838]
在形成在阳极上的el层之中,与阳极相接地形成的空穴注入层由于使用与阳极的功函数无关地容易进行空穴(hole)注入的复合材料形成,因此,可以使用能够作为电极材料的材料(例如金属、合金、导电性化合物以及它们的混合物,此外也包括属于元素周期表的第一族或第二族的元素)。
[0839]
也可以使用作为功函数小的材料的属于元素周期表的第一族或第二族的元素、即锂(li)、铯(cs)等碱金属和镁(mg)、钙(ca)、锶(sr)等碱土金属以及包含它们的合金(例如mgag、alli)、铕(eu)、镱(yb)等稀土金属以及包含它们的合金等。需要说明的是,使用碱金属、碱土金属以及包含它们的合金形成阳极时,可以使用真空蒸镀法、溅射法。此外,在使用银浆等时,可以使用涂布法、喷墨法等。
[0840]
(阴极)
[0841]
阴极优选使用功函数小的(具体而言为3.8ev以下)金属、合金、导电性化合物以及它们的混合物等。作为这样的阴极材料的具体例,可以举出属于元素周期表的第一族或第二族的元素、即锂(li)、铯(cs)等碱金属和镁(mg)、钙(ca)、锶(sr)等碱土金属以及包含它们的合金(例如mgag、alli)、铕(eu)、镱(yb)等稀土金属以及包含它们的合金等。
[0842]
需要说明的是,在使用碱金属、碱土金属、包含它们的合金形成阴极时,可以使用真空蒸镀法、溅射法。另外,在使用银浆等时,可以使用涂布法、喷墨法等。
[0843]
需要说明的是,通过设置电子注入层,可以与功函数的大小无关地使用al、ag、ito、石墨烯、含有硅或氧化硅的氧化铟-氧化锡等各种各样的导电性材料形成阴极。这些导电性材料可以使用溅射法、喷墨法、旋涂法等进行成膜。
[0844]
(电子传输层)
[0845]
在第一实施方式和第二实施方式涉及的有机el元件中,优选包含位于发光层与阴极之间的电子传输层。
[0846]
电子传输层是包含电子传输性高的物质的层。电子传输层中可以使用1)铝络合物、铍络合物、锌络合物等金属络合物、2)咪唑衍生物、苯并咪唑衍生物、吖嗪衍生物、咔唑衍生物、菲咯啉衍生物等杂芳香族化合物、3)高分子化合物。具体而言,作为低分子的有机化合物,可以使用alq、三(4-甲基-8-羟基喹啉)铝(简称:almq3)、双(10-羟基苯并[h]喹啉)铍(简称:bebq2)、balq、znq、znpbo、znbtz等金属络合物等。另外,在金属络合物以外,也可以使用2-(4-联苯基)-5-(4-叔丁基苯基)-1,3,4-噁二唑(简称:pbd)、1,3-双[5-(对叔丁基苯基)-1,3,4-噁二唑-2-基]苯(简称:oxd-7)、3-(4-叔丁基苯基)-4-苯基-5-(4-联苯基)-1,2,4-三唑(简称:taz)、3-(4-叔丁基苯基)-4-(4-乙基苯基)-5-(4-联苯基)-1,2,4-三唑(简称:p-ettaz)、红菲咯啉(简称:bphen)、浴铜灵(简称:bcp)、4,4
’‑
双(5-甲基苯并噁唑-2-基)茋(简称:bzos)等杂芳香族化合物。在本实施方式中,可以适宜地使用苯并咪唑化合物。在此所述的物质主要是具有10-6
cm2/(v
·
s)以上的电子迁移率的物质。需要说明的是,只要是电子传输性高于空穴传输性的物质,则也可以使用上述以外的物质作为电子传输层。另外,电子传输层也可以由单层构成,也可以由上述物质形成的层层叠二层以上而构成。
[0847]
另外,电子传输层中也可以使用高分子化合物。例如可以使用聚[(9,9-二己基芴-2,7-二基)-co-(吡啶-3,5-二基)](简称:pf-py)、聚[(9,9-二辛基芴-2,7-二基)-co-(2,2
’‑
联吡啶-6,6
’‑
二基)](简称:pf-bpy)等。
[0848]
(电子注入层)
[0849]
电子注入层是包含电子注入性高的物质的层。电子注入层中可以使用锂(li)、铯(cs)、钙(ca)、氟化锂(lif)、氟化铯(csf)、氟化钙(caf2)、锂氧化物(liox)等之类的碱金属、碱土金属或它们的化合物。另外,也可以使用使具有电子传输性的物质中含有碱金属、碱土金属或它们的化合物而成的材料,具体而言可以使用使alq中含有镁(mg)而成的材料等。需要说明的是,此时可以更高效地进行从阴极的电子注入。
[0850]
或者,电子注入层中也可以使用将有机化合物与供电子体(供体)混合而成的复合材料。这样的复合材料由于通过供电子体而在有机化合物中产生电子,因此电子注入性和电子传输性优异。此时,作为有机化合物,优选为所产生的电子的传输优异的材料,具体而言,例如可以使用上述的构成电子传输层的物质(金属络合物、杂芳香族化合物等)。作为供电子体,只要是对于有机化合物显示给电子性的物质即可。具体而言,优选碱金属、碱土金属、稀土金属,可以举出锂、铯、镁、钙、铒、镱等。另外,优选碱金属氧化物、碱土金属氧化物,可以举出锂氧化物、钙氧化物、钡氧化物等。另外,也可以使用氧化镁这样的路易斯碱。另外,也可以使用四硫富瓦烯(简称:ttf)等有机化合物。
[0851]
(层形成方法)
[0852]
作为第一实施方式和第二实施方式的有机el元件的各层的形成方法,除了在上文中特别提及的以外没有限制,可以采用真空蒸镀法、溅射法、等离子体法、离子镀法等干式成膜法、旋涂法、浸渍法、流涂法、喷墨法等湿式成膜法等公知的方法。
[0853]
(膜厚)
[0854]
第一实施方式和第二实施方式的有机el元件的各有机层的膜厚除了在上文中特别提及的情况以外没有限定。一般而言,若膜厚过薄,则容易产生针孔等缺陷,若膜厚过厚,则需要高的施加电压,效率变差,因此通常有机el元件的各有机层的膜厚优选为几nm至1μm的范围。
[0855]
(第一主体材料、第二主体材料和第三主体材料)
[0856]
在第一实施方式涉及的有机el元件中,作为第一主体材料,只要为满足上述数学式(数学式1)的关系且上述扩散系数d1为3.0
×
10-9
(cm2/s)以上的主体材料则没有特别限定。作为第二主体材料,只要为满足上述数学式(数学式1)的关系的主体材料则没有特别限定。
[0857]
在第二实施方式涉及的有机el元件中,作为第一主体材料,只要为满足上述数学式(数学式1)的关系且上述表面电势v1为-11(mv/nm)以下的主体材料则没有特别限定。作为第二主体材料,只要为满足上述数学式(数学式1)的关系的主体材料则没有特别限定。
[0858]
在第一实施方式和第二实施方式涉及的有机el元件中,作为第一主体材料,优选为具有稠合芳环的化合物、具有稠合杂芳环的化合物、或者具有稠合芳环和稠合杂芳环的化合物。作为稠合芳环,优选具有选自蒽骨架、芘骨架、荧蒽骨架、菲骨架、萘骨架、芴骨架、骨架、三亚苯骨架、并四苯骨架、苯并蒽骨架和苯并骨架中的1个以上的骨架的化合物。作为稠合杂芳环,优选具有选自二苯并呋喃骨架、二苯并噻吩骨架、呫吨骨架和苯并呫吨骨架中的1个以上的骨架的化合物。
[0859]
在第一实施方式涉及的有机el元件中,作为第一主体材料,例如可以在下述通式(1)、通式(1x)、通式(12x)、通式(13x)、通式(14x)、通式(15x)或通式(16x)所示的第一化合物和下述通式(2)所示的第二化合物之中,选择使用满足上述数学式(数学式1)的关系且上述扩散系数d1为3.0
×
10-9
(cm2/s)以上的化合物。
[0860]
在第二实施方式涉及的有机el元件中,作为第一主体材料,例如可以在下述通式(1)、通式(1x)、通式(12x)、通式(13x)、通式(14x)、通式(15x)或通式(16x)所示的第一化合物和下述通式(2)所示的第二化合物之中,选择使用满足上述数学式(数学式1)的关系且上述表面电势v1为-11(mv/nm)以下的化合物。
[0861]
在第一实施方式和第二实施方式涉及的有机el元件中,作为第二主体材料,例如可以在下述通式(1)、通式(1x)、通式(12x)、通式(13x)、通式(14x)、通式(15x)或通式(16x)所示的第一化合物和下述通式(2)所示的第二化合物之中,选择使用满足上述数学式(数学式1)的关系的化合物。
[0862]
在第一实施方式和第二实施方式涉及的有机el元件中,也可以将第一化合物用作第一主体材料和第二主体材料,在这种情况下,用作第二主体材料的下述通式(1)或者下述通式(1x)、通式(12x)、通式(13x)、通式(14x)、通式(15x)或通式(16x)所示的化合物有时为了方便而称为第二化合物。
[0863]
在第一实施方式和第二实施方式涉及的有机el元件中,作为第三主体材料,没有特别限定,例如可以使用下述通式(1)、通式(1x)、通式(12x)、通式(13x)、通式(14x)、通式(15x)或通式(16x)所示的第一化合物、或者下述通式(2)所示的第二化合物。
[0864]
(第一化合物)
[0865]
·
通式(1)所示的化合物
[0866]
【化学式24】
[0867][0868]
(上述通式(1)中,
[0869]r101
~r
110
各自独立地为
[0870]
氢原子、
[0871]
取代或未取代的碳数1~50的烷基、
[0872]
取代或未取代的碳数1~50的卤烷基、
[0873]
取代或未取代的碳数2~50的烯基、
[0874]
取代或未取代的碳数2~50的炔基、
[0875]
取代或未取代的成环碳数3~50的环烷基、
[0876]-si(r
901
)(r
902
)(r
903
)所示的基团、
[0877]-o-(r
904
)所示的基团、
[0878]-s-(r
905
)所示的基团、
[0879]
取代或未取代的碳数7~50的芳烷基、
[0880]-c(=o)r
801
所示的基团、
[0881]-coor
802
所示的基团、
[0882]
卤素原子、
[0883]
氰基、
[0884]
硝基、
[0885]
取代或未取代的成环碳数6~50的芳基、
[0886]
取代或未取代的成环原子数5~50的杂环基、或者
[0887]
上述通式(11)所示的基团,
[0888]
其中,r
101
~r
110
的至少1个为上述通式(11)所示的基团,
[0889]
在上述通式(11)所示的基团存在多个的情况下,多个上述通式(11)所示的基团相互相同或不同,
[0890]
l
101
为
[0891]
单键、
[0892]
取代或未取代的成环碳数6~50的亚芳基、或者
[0893]
取代或未取代的成环原子数5~50的二价杂环基,
[0894]
ar
101
为
[0895]
取代或未取代的成环碳数6~50的芳基、或者
[0896]
取代或未取代的成环原子数5~50的杂环基,
[0897]
mx为0、1、2、3、4或5,
[0898]
在l
101
存在2个以上的情况下,2个以上的l
101
相互相同或不同,
[0899]
在ar
101
存在2个以上的情况下,2个以上的ar
101
相互相同或不同,
[0900]
上述通式(11)中的*表示与上述通式(1)中的芘环的键合位置。)
[0901]
(在第一实施方式和第二实施方式涉及的第一化合物中,r
901
、r
902
、r
903
、r
904
、r
905
、r
906
、r
907
、r
801
和r
802
各自独立地为
[0902]
氢原子、
[0903]
取代或未取代的碳数1~50的烷基、
[0904]
取代或未取代的成环碳数3~50的环烷基、
[0905]
取代或未取代的成环碳数6~50的芳基、或者
[0906]
取代或未取代的成环原子数5~50的杂环基,
[0907]
在r
901
存在多个的情况下,多个r
901
相互相同或不同,
[0908]
在r
902
存在多个的情况下,多个r
902
相互相同或不同,
[0909]
在r
903
存在多个的情况下,多个r
903
相互相同或不同,
[0910]
在r
904
存在多个的情况下,多个r
904
相互相同或不同,
[0911]
在r
905
存在多个的情况下,多个r
905
相互相同或不同,
[0912]
在r
906
存在多个的情况下,多个r
906
相互相同或不同,
[0913]
在r
907
存在多个的情况下,多个r
907
相互相同或不同,
[0914]
在r
801
存在多个的情况下,多个r
801
相互相同或不同,
[0915]
在r
802
存在多个的情况下,多个r
802
相互相同或不同。)
[0916]
在第一实施方式和第二实施方式涉及的有机el元件中,上述通式(11)所示的基团优选为下述通式(111)所示的基团。
[0917]
【化学式25】
[0918][0919]
(上述通式(111)中,
[0920]
x1为cr
123r124
、氧原子、硫原子、或者nr
125
,
[0921]
l
111
和l
112
各自独立地为
[0922]
单键、
[0923]
取代或未取代的成环碳数6~50的亚芳基、或者
[0924]
取代或未取代的成环原子数5~50的二价杂环基,
[0925]
ma为0、1、2、3或4,
[0926]
mb为0、1、2、3或4,
[0927]
ma mb为0、1、2、3或4,
[0928]
ar
101
与上述通式(11)中的ar
101
含义相同,
[0929]r121
、r
122
、r
123
、r
124
和r
125
各自独立地为
[0930]
氢原子、
[0931]
取代或未取代的碳数1~50的烷基、
[0932]
取代或未取代的碳数1~50的卤烷基、
[0933]
取代或未取代的碳数2~50的烯基、
[0934]
取代或未取代的碳数2~50的炔基、
[0935]
取代或未取代的成环碳数3~50的环烷基、
[0936]-si(r
901
)(r
902
)(r
903
)所示的基团、
[0937]-o-(r
904
)所示的基团、
[0938]-s-(r
905
)所示的基团、
[0939]
取代或未取代的碳数7~50的芳烷基、
[0940]-c(=o)r
801
所示的基团、
[0941]-coor
802
所示的基团、
[0942]
卤素原子、
[0943]
氰基、
[0944]
硝基、
[0945]
取代或未取代的成环碳数6~50的芳基、或者
[0946]
取代或未取代的成环原子数5~50的杂环基,
[0947]
mc为3,
[0948]
3个r
121
相互相同或不同,
[0949]
md为3,
[0950]
3个r
122
相互相同或不同。)
[0951]
上述通式(111)所示的基团中的下述通式(111a)所示的环结构中的碳原子*1~*8的位置之中,l
111
键合于*1~*4中的任一位置,r
121
键合于*1~*4中的其余3个位置,l
112
键合于*5~*8中的任一位置,r
122
键合于*5~*8中的其余3个位置。
[0952]
【化学式26】
[0953]
[0954]
例如,在上述通式(111)所示的基团中,在l
111
键合于上述通式(111a)所示的环结构中的*2的碳原子的位置,l
112
键合于上述通式(111a)所示的环结构中的*7的碳原子的位置的情况下,上述通式(111)所示的基团由下述通式(111b)表示。
[0955]
【化学式27】
[0956][0957]
(上述通式(111b)中,
[0958]
x1、l
111
、l
112
、ma、mb、ar
101
、r
121
、r
122
、r
123
、r
124
和r
125
各自独立地与上述通式(111)中的x1、l
111
、l
112
、ma、mb、ar
101
、r
121
、r
122
、r
123
、r
124
和r
125
含义相同,
[0959]
多个r
121
相互相同或不同,
[0960]
多个r
122
相互相同或不同。)
[0961]
在第一实施方式和第二实施方式涉及的有机el元件中,上述通式(111)所示的基团优选为上述通式(111b)所示的基团。
[0962]
在第一实施方式和第二实施方式涉及的有机el元件中,优选的是,ma为0、1或2,mb为0、1或2。
[0963]
在第一实施方式和第二实施方式涉及的有机el元件中,优选的是,ma为0或1,mb为0或1。
[0964]
在第一实施方式和第二实施方式涉及的有机el元件中,ar
101
优选为取代或未取代的成环碳数6~50的芳基。
[0965]
在第一实施方式和第二实施方式涉及的有机el元件中,
[0966]
ar
101
优选为
[0967]
取代或未取代的苯基、
[0968]
取代或未取代的萘基、
[0969]
取代或未取代的联苯基、
[0970]
取代或未取代的三联苯基、
[0971]
取代或未取代的芘基、
[0972]
取代或未取代的菲基、或者
[0973]
取代或未取代的芴基。
[0974]
在第一实施方式和第二实施方式涉及的有机el元件中,ar
101
也优选为下述通式(12)、通式(13)或者通式(14)所示的基团。
[0975]
【化学式28】
[0976][0977]
(上述通式(12)、通式(13)和通式(14)中,
[0978]r111
~r
120
各自独立地为
[0979]
氢原子、
[0980]
取代或未取代的碳数1~50的烷基、
[0981]
取代或未取代的碳数1~50的卤烷基、
[0982]
取代或未取代的碳数2~50的烯基、
[0983]
取代或未取代的碳数2~50的炔基、
[0984]
取代或未取代的成环碳数3~50的环烷基、
[0985]-si(r
901
)(r
902
)(r
903
)所示的基团、
[0986]-o-(r
904
)所示的基团、
[0987]-s-(r
905
)所示的基团、
[0988]-n(r
906
)(r
907
)所示的基团、
[0989]
取代或未取代的碳数7~50的芳烷基、
[0990]-c(=o)r
124
所示的基团、
[0991]-coor
125
所示的基团、
[0992]
卤素原子、
[0993]
氰基、
[0994]
硝基、
[0995]
取代或未取代的成环碳数6~50的芳基、或者
[0996]
取代或未取代的成环原子数5~50的杂环基,
[0997]
上述通式(12)、通式(13)和通式(14)中的*表示与上述通式(11)中的l
101
的键合位置、或者与上述通式(111)或通式(111b)中的l
112
的键合位置。)
[0998]
·
通式(1x)所示的化合物
[0999]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(1x)所示的化合物。
[1000]
【化学式29】
[1001][1002]
(上述通式(1x)中,
[1003]r101
~r
112
各自独立地为
[1004]
氢原子、
[1005]
取代或未取代的碳数1~50的烷基、
[1006]
取代或未取代的碳数1~50的卤烷基、
[1007]
取代或未取代的碳数2~50的烯基、
[1008]
取代或未取代的碳数2~50的炔基、
[1009]
取代或未取代的成环碳数3~50的环烷基、
[1010]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1011]-o-(r
904
)所示的基团、
[1012]-s-(r
905
)所示的基团、
[1013]
取代或未取代的碳数7~50的芳烷基、
[1014]-c(=o)r
801
所示的基团、
[1015]-coor
802
所示的基团、
[1016]
卤素原子、
[1017]
氰基、
[1018]
硝基、
[1019]
取代或未取代的成环碳数6~50的芳基、
[1020]
取代或未取代的成环原子数5~50的杂环基、或者
[1021]
上述通式(11x)所示的基团,
[1022]
其中,r
101
~r
112
的至少1个为上述通式(11x)所示的基团,
[1023]
在上述通式(11x)所示的基团存在多个的情况下,多个上述通式(11x)所示的基团相互相同或不同,
[1024]
l
101
为
[1025]
单键、
[1026]
取代或未取代的成环碳数6~50的亚芳基、或者
[1027]
取代或未取代的成环原子数5~50的二价杂环基,
[1028]
ar
101
为
[1029]
取代或未取代的成环碳数6~50的芳基、或者
[1030]
取代或未取代的成环原子数5~50的杂环基,
[1031]
mx为1、2、3、4或5,
[1032]
在l
101
存在2个以上的情况下,2个以上的l
101
相互相同或不同,
[1033]
在ar
101
存在2个以上的情况下,2个以上的ar
101
相互相同或不同,
[1034]
上述通式(11x)中的*表示与上述通式(1x)中的苯并[a]蒽环的键合位置。)
[1035]
在第一实施方式和第二实施方式涉及的有机el元件中,上述通式(11x)所示的基团优选为下述通式(111x)所示的基团。
[1036]
【化学式30】
[1037][1038]
(上述通式(111x)中,
[1039]
x1为cr
143r144
、氧原子、硫原子、或者nr
145
,
[1040]
l
111
和l
112
各自独立地为
[1041]
单键、
[1042]
取代或未取代的成环碳数6~50的亚芳基、或者
[1043]
取代或未取代的成环原子数5~50的二价杂环基,
[1044]
ma为1、2、3或4,
[1045]
mb为1、2、3或4,
[1046]
ma mb为2、3或4,
[1047]
ar
101
与上述通式(11x)中的ar
101
含义相同,
[1048]r141
、r
142
、r
143
、r
144
和r
145
各自独立地为
[1049]
氢原子、
[1050]
取代或未取代的碳数1~50的烷基、
[1051]
取代或未取代的碳数1~50的卤烷基、
[1052]
取代或未取代的碳数2~50的烯基、
[1053]
取代或未取代的碳数2~50的炔基、
[1054]
取代或未取代的成环碳数3~50的环烷基、
[1055]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1056]-o-(r
904
)所示的基团、
[1057]-s-(r
905
)所示的基团、
[1058]
取代或未取代的碳数7~50的芳烷基、
[1059]-c(=o)r
801
所示的基团、
[1060]-coor
802
所示的基团、
[1061]
卤素原子、
[1062]
氰基、
[1063]
硝基、
[1064]
取代或未取代的成环碳数6~50的芳基、或者
[1065]
取代或未取代的成环原子数5~50的杂环基,
[1066]
mc为3,
[1067]
3个r
141
相互相同或不同,
[1068]
md为3,
[1069]
3个r
142
相互相同或不同。)
[1070]
上述通式(111x)所示的基团中的下述通式(111ax)所示的环结构中的碳原子*1~*8的位置之中,l
111
键合于*1~*4中的任一位置,r
141
键合于*1~*4中的其余3个位置,l
112
键合于*5~*8中的任一位置,r
142
键合于*5~*8中的其余3个位置。
[1071]
【化学式31】
[1072][1073]
例如,在上述通式(111x)所示的基团中,在l
111
键合于上述通式(111ax)所示的环结构中的*2的碳原子的位置,l
112
键合于上述通式(111ax)所示的环结构中的*7的碳原子的位置时,上述通式(111x)所示的基团由下述通式(111bx)表示。
[1074]
【化学式32】
[1075][1076]
(上述通式(111bx)中,
[1077]
x1、l
111
、l
112
、ma、mb、ar
101
、r
141
、r
142
、r
143
、r
144
和r
145
各自独立地与上述通式(111x)
中的x1、l
111
、l
112
、ma、mb、ar
101
、r
141
、r
142
、r
143
、r
144
和r
145
含义相同,
[1078]
多个r
141
相互相同或不同,
[1079]
多个r
142
相互相同或不同。)
[1080]
在第一实施方式和第二实施方式涉及的有机el元件中,上述通式(111x)所示的基团优选为上述通式(111bx)所示的基团。
[1081]
在上述通式(1x)所示的化合物中,优选的是,ma为1或2,mb为1或2。
[1082]
在上述通式(1x)所示的化合物中,优选的是,ma为1,mb为1。
[1083]
在上述通式(1x)所示的化合物中,ar
101
优选为取代或未取代的成环碳数6~50的芳基。
[1084]
在上述通式(1x)所示的化合物中,ar
101
优选为
[1085]
取代或未取代的苯基、
[1086]
取代或未取代的萘基、
[1087]
取代或未取代的联苯基、
[1088]
取代或未取代的三联苯基、
[1089]
取代或未取代的苯并[a]蒽基、
[1090]
取代或未取代的芘基、
[1091]
取代或未取代的菲基、或者
[1092]
取代或未取代的芴基。
[1093]
·
通式(12x)所示的化合物
[1094]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(12x)所示的化合物。
[1095]
【化学式33】
[1096][1097]
(上述通式(12x)中,
[1098]
由r
1201
~r
1210
之中的相邻的2个以上组成的组中的1组以上
[1099]
相互键合而形成取代或未取代的单环、或者
[1100]
相互键合而形成取代或未取代的稠环,
[1101]
不形成上述取代或未取代的单环且不形成上述取代或未取代的稠环的r
1201
~r
1210
各自独立地为
[1102]
氢原子、
[1103]
取代或未取代的碳数1~50的烷基、
[1104]
取代或未取代的碳数1~50的卤烷基、
[1105]
取代或未取代的碳数2~50的烯基、
[1106]
取代或未取代的碳数2~50的炔基、
[1107]
取代或未取代的成环碳数3~50的环烷基、
[1108]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1109]-o-(r
904
)所示的基团、
[1110]-s-(r
905
)所示的基团、
[1111]
取代或未取代的碳数7~50的芳烷基、
[1112]-c(=o)r
801
所示的基团、
[1113]-coor
802
所示的基团、
[1114]
卤素原子、
[1115]
氰基、
[1116]
硝基、
[1117]
取代或未取代的成环碳数6~50的芳基、
[1118]
取代或未取代的成环原子数5~50的杂环基、或者
[1119]
上述通式(121)所示的基团,
[1120]
其中,上述取代或未取代的单环具有取代基时的该取代基、上述取代或未取代的稠环具有取代基时的该取代基、以及r
1201
~r
1210
中的至少1个为上述通式(121)所示的基团,
[1121]
在上述通式(121)所示的基团存在多个的情况下,多个上述通式(121)所示的基团相互相同或不同,
[1122]
l
1201
为
[1123]
单键、
[1124]
取代或未取代的成环碳数6~50的亚芳基、或者
[1125]
取代或未取代的成环原子数5~50的二价杂环基,
[1126]
ar
1201
为
[1127]
取代或未取代的成环碳数6~50的芳基、或者
[1128]
取代或未取代的成环原子数5~50的杂环基,
[1129]
mx2为0、1、2、3、4或5,
[1130]
在l
1201
存在2个以上的情况下,2个以上的l
1201
相互相同或不同,
[1131]
在ar
1201
存在2个以上的情况下,2个以上的ar
1201
相互相同或不同,
[1132]
上述通式(121)中的*表示与上述通式(12x)所示的环的键合位置。)
[1133]
上述通式(12x)中,由r
1201
~r
1210
之中的相邻的2个组成的组是指,r
1201
与r
1202
的组、r
1202
与r
1203
的组、r
1203
与r
1204
的组、r
1204
与r
1205
的组、r
1205
与r
1206
的组、r
1207
与r
1208
的组、r
1208
与r
1209
的组、以及r
1209
与r
1210
的组。
[1134]
·
通式(13x)所示的化合物
[1135]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(13x)所示的化合物。
[1136]
【化学式34】
[1137][1138]
(上述通式(13x)中,
[1139]r1301
~r
1310
各自独立地为
[1140]
氢原子、
[1141]
取代或未取代的碳数1~50的烷基、
[1142]
取代或未取代的碳数1~50的卤烷基、
[1143]
取代或未取代的碳数2~50的烯基、
[1144]
取代或未取代的碳数2~50的炔基、
[1145]
取代或未取代的成环碳数3~50的环烷基、
[1146]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1147]-o-(r
904
)所示的基团、
[1148]-s-(r
905
)所示的基团、
[1149]
取代或未取代的碳数7~50的芳烷基、
[1150]-c(=o)r
801
所示的基团、
[1151]
一coor
802
所示的基团、
[1152]
卤素原子、
[1153]
氰基、
[1154]
硝基、
[1155]
取代或未取代的成环碳数6~50的芳基、
[1156]
取代或未取代的成环原子数5~50的杂环基、或者
[1157]
上述通式(131)所示的基团,
[1158]
其中,r
1301
~r
1310
的至少1个为上述通式(131)所示的基团,
[1159]
在上述通式(131)所示的基团存在多个的情况下,多个上述通式(131)所示的基团相互相同或不同,
[1160]
l
1301
为
[1161]
单键、
[1162]
取代或未取代的成环碳数6~50的亚芳基、或者
[1163]
取代或未取代的成环原子数5~50的二价杂环基,
[1164]
ar
1301
为
[1165]
取代或未取代的成环碳数6~50的芳基、或者
[1166]
取代或未取代的成环原子数5~50的杂环基,
[1167]
mx3为0、1、2、3、4或5,
[1168]
在l
1301
存在2个以上的情况下,2个以上的l
1301
相互相同或不同,
[1169]
在ar
1301
存在2个以上的情况下,2个以上的ar
1301
相互相同或不同,上述通式(131)中的*表示与上述通式(13x)中的荧蒽环的键合位置。)
[1170]
在第一实施方式和第二实施方式涉及的有机el元件中,由并非上述通式(131)所示的基团的r
1301
~r
1310
之中的相邻的2个以上组成的组均相互不键合。上述通式(13x)中,由相邻的2个组成的组是指,r
1301
与r
1302
的组、r
1302
与r
1303
的组、r
1303
与r
1304
的组、r
1304
与r
1305
的组、r
1305
与r
1306
的组、r
1307
与r
1308
的组、r
1308
与r
1309
的组、以及r
1309
与r
1310
的组。
[1171]
·
通式(14x)所示的化合物
[1172]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(14x)所示的化合物。
[1173]
【化学式35】
[1174][1175]
(上述通式(14x)中,
[1176]r1401
~r
1410
各自独立地为
[1177]
氢原子、
[1178]
取代或未取代的碳数1~50的烷基、
[1179]
取代或未取代的碳数1~50的卤烷基、
[1180]
取代或未取代的碳数2~50的烯基、
[1181]
取代或未取代的碳数2~50的炔基、
[1182]
取代或未取代的成环碳数3~50的环烷基、
[1183]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1184]-o-(r
904
)所示的基团、
[1185]-s-(r
905
)所示的基团、
[1186]
取代或未取代的碳数7~50的芳烷基、
[1187]-c(=o)r
801
所示的基团、
[1188]-coor
802
所示的基团、
[1189]
卤素原子、
[1190]
氰基、
[1191]
硝基、
[1192]
取代或未取代的成环碳数6~50的芳基、
[1193]
取代或未取代的成环原子数5~50的杂环基、或者
[1194]
上述通式(141)所示的基团,
[1195]
其中,r
1401
~r
1410
的至少1个为上述通式(141)所示的基团,
[1196]
在上述通式(141)所示的基团存在多个的情况下,多个上述通式(141)所示的基团相互相同或不同,
[1197]
l
1401
为
[1198]
单键、
[1199]
取代或未取代的成环碳数6~50的亚芳基、或者
[1200]
取代或未取代的成环原子数5~50的二价杂环基,
[1201]
ar
1401
为
[1202]
取代或未取代的成环碳数6~50的芳基、或者
[1203]
取代或未取代的成环原子数5~50的杂环基,
[1204]
mx4为0、1、2、3、4或5,
[1205]
在l
1401
存在2个以上的情况下,2个以上的l
1401
相互相同或不同,
[1206]
在ar
1401
存在2个以上的情况下,2个以上的ar
1401
相互相同或不同,
[1207]
上述通式(141)中的*表示与上述通式(14x)所示的环的键合位置。)
[1208]
·
通式(15x)所示的化合物
[1209]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(15x)所示的化合物。
[1210]
【化学式36】
[1211][1212]
(上述通式(15x)中,
[1213]r1501
~r
1514
各自独立地为
[1214]
氢原子、
[1215]
取代或未取代的碳数1~50的烷基、
[1216]
取代或未取代的碳数1~50的卤烷基、
[1217]
取代或未取代的碳数2~50的烯基、
[1218]
取代或未取代的碳数2~50的炔基、
[1219]
取代或未取代的成环碳数3~50的环烷基、
[1220]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1221]-o-(r
904
)所示的基团、
[1222]-s-(r
905
)所示的基团、
[1223]
取代或未取代的碳数7~50的芳烷基、
[1224]-c(=o)r
801
所示的基团、
[1225]-coor
802
所示的基团、
[1226]
卤素原子、
[1227]
氰基、
[1228]
硝基、
[1229]
取代或未取代的成环碳数6~50的芳基、
[1230]
取代或未取代的成环原子数5~50的杂环基、或者
[1231]
上述通式(151)所示的基团,
[1232]
其中,r
1501
~r
1514
的至少1个为上述通式(151)所示的基团,
[1233]
在上述通式(151)所示的基团存在多个的情况下,多个上述通式(151)所示的基团相互相同或不同,
[1234]
l
1501
为
[1235]
单键、
[1236]
取代或未取代的成环碳数6~50的亚芳基、或者
[1237]
取代或未取代的成环原子数5~50的二价杂环基,
[1238]
ar
1501
为
[1239]
取代或未取代的成环碳数6~50的芳基、或者
[1240]
取代或未取代的成环原子数5~50的杂环基,
[1241]
mx5为0、1、2、3、4或5,
[1242]
在l
1501
存在2个以上的情况下,2个以上的l
1501
相互相同或不同,
[1243]
在ar
1501
存在2个以上的情况下,2个以上的ar
1501
相互相同或不同,
[1244]
上述通式(151)中的*表示与上述通式(15x)所示的环的键合位置。)
[1245]
·
通式(16x)所示的化合物
[1246]
在第一实施方式和第二实施方式涉及的有机el元件中,第一化合物也优选为下述通式(16x)所示的化合物。
[1247]
【化学式37】
[1248][1249]
(上述通式(16x)中,
[1250]r1601
~r
1614
各自独立地为
[1251]
氢原子、
[1252]
取代或未取代的碳数1~50的烷基、
[1253]
取代或未取代的碳数1~50的卤烷基、
[1254]
取代或未取代的碳数2~50的烯基、
[1255]
取代或未取代的碳数2~50的炔基、
[1256]
取代或未取代的成环碳数3~50的环烷基、
[1257]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1258]-o-(r
904
)所示的基团、
[1259]-s-(r
905
)所示的基团、
[1260]
取代或未取代的碳数7~50的芳烷基、
[1261]-c(=o)r
801
所示的基团、
[1262]-coor
802
所示的基团、
[1263]
卤素原子、
[1264]
氰基、
[1265]
硝基、
[1266]
取代或未取代的成环碳数6~50的芳基、
[1267]
取代或未取代的成环原子数5~50的杂环基、或者
[1268]
上述通式(161)所示的基团,
[1269]
其中,r
1601
~r
1614
的至少1个为上述通式(161)所示的基团,
[1270]
在上述通式(161)所示的基团存在多个的情况下,多个上述通式(161)所示的基团相互相同或不同,
[1271]
l
1601
为
[1272]
单键、
[1273]
取代或未取代的成环碳数6~50的亚芳基、或者
[1274]
取代或未取代的成环原子数5~50的二价杂环基,
[1275]
ar
1601
为
[1276]
取代或未取代的成环碳数6~50的芳基、或者
[1277]
取代或未取代的成环原子数5~50的杂环基,
[1278]
mx6为0、1、2、3、4或5,
[1279]
在l
1601
存在2个以上的情况下,2个以上的l
1601
相互相同或不同,
[1280]
在ar
1601
存在2个以上的情况下,2个以上的ar
1601
相互相同或不同,
[1281]
上述通式(161)中的*表示与上述通式(16x)所示的环的键合位置。)
[1282]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选第一主体材料在分子中具有包含以单键连接的苯环与萘环的连接结构,该连接结构中的苯环和萘环上各自独立地进一步稠合有单环或稠环或者未进行稠合,该连接结构中的苯环与萘环在该单键以外的至少1个部分通过交联而进一步进行了连接。
[1283]
通过第一主体材料具有这样的包含交联的连接结构,能够期待抑制有机el元件的色度恶化。
[1284]
此时的第一主体材料只要在分子中具有下述式(x1)或式(x2)所示那样的包含以单键连接的苯环与萘环的连接结构(有时称为苯-萘连接结构。)作为最小单位即可,也可以在该苯环上进一步稠合有单环或稠环,也可以在该萘环上进一步稠合有单环或稠环。例如,对于第一主体材料而言,由于在下述式(x3)、式(x4)或式(x5)所示那样的包含以单键连接的萘环和萘环的连接结构(有时称为萘-萘连接结构)中,其中一个萘环包含苯环,因此也成为在分子中包含苯-萘连接结构。
[1285]
【化学式38】
[1286][1287]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选上述交联包含双键。
[1288]
即,也优选具有上述苯环与上述萘环在单键以外的部分通过包含双键的交联结构进一步连接的结构。
[1289]
若苯-萘连接结构中的苯环与萘环在单键以外的至少1个部分通过交联进一步连接,则例如在上述式(x1)的情况下,形成下述式(x11)所示的连接结构(稠环),在上述式(x3)的情况下,形成下述式(x31)所示的连接结构(稠环)。
[1290]
若苯-萘连接结构中的苯环与萘环在单键以外的部分通过包含双键的交联进一步连接,则例如在上述式(x1)的情况下,形成下述式(x12)所示的连接结构(稠环),在上述式(x2)的情况下,形成下述式(x21)或式(x22)所示的连接结构(稠环),在上述式(x4)的情况下,形成下述式(x41)所示的连接结构(稠环),在上述式(x5)的情况下,形成下述式(x51)所示的连接结构(稠环)。
[1291]
若苯-萘连接结构中的苯环与萘环在单键以外的至少1个部分通过包含杂原子(例如氧原子)的交联进一步连接,则例如在上述式(x1)的情况下,形成下述式(x13)所示的连接结构(稠环)。
[1292]
【化学式39】
[1293][1294]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选第一主体材料在分子中具有第一苯环与第二苯环以单键连接而成的联苯结构,该联苯结构中的第一苯环与第二苯环在该单键以外的至少1个部分通过交联进一步进行了连接。
[1295]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选上述联苯结构中的第一苯环与第二苯环在上述单键以外的1个部分通过上述交联进一步进行了连接。通过第一主体材料具有这样的包含交联的联苯结构,能够期待抑制有机el元件的色度恶化。
[1296]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选上述交联包含双键。
[1297]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选上述交联不包含双键。
[1298]
上述联苯结构中的第一苯环与第二苯环也优选在上述单键以外的2个部分通过上述交联进一步进行了连接。
[1299]
在第一实施方式和第二实施方式涉及的有机el元件中,也优选上述联苯结构中的第一苯环与第二苯环在上述单键以外的2个部分通过上述交联进一步进行了连接,上述交联不包含双键。通过第一主体材料具有这样的包含交联的联苯结构,能够期待抑制有机el元件的色度恶化。
[1300]
例如,若下述式(bp1)所示的上述联苯结构中的第一苯环与第二苯环在单键以外的至少1个部分通过交联进一步连接,则该联苯结构形成下述式(bp11)~(bp15)等连接结构(稠环)。
[1301]
【化学式40】
[1302][1303]
上述式(bp11)是在上述单键以外的1个部分通过不包含双键的交联连接的结构。
[1304]
上述式(bp12)是在上述单键以外的1个部分通过包含双键的交联连接的结构。
[1305]
上述式(bp13)是在上述单键以外的2个部分通过不包含双键的交联连接的结构。
[1306]
上述式(bp14)是在上述单键以外的2个部分中的一个部分通过不包含双键的交联连接而在上述单键以外的2个部分中的另一个部分通过包含双键的交联连接的结构。
[1307]
上述式(bp15)是在上述单键以外的2个部分通过包含双键的交联连接的结构。
[1308]
在第一化合物和第二化合物中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
[1309]
(第一化合物的制造方法)
[1310]
第一化合物可以通过公知的方法进行制造。另外,第一化合物也可以仿效公知的方法,使用与目标物质对应的已知的替代反应和原料来进行制造。
[1311]
(第一化合物的具体例)
[1312]
作为第一实施方式涉及的有机el元件中可以使用的第一化合物的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第一化合物的具体例。
[1313]
【化学式41】
[1314][1315]
作为第二实施方式涉及的有机el元件中可以使用的第一化合物的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第一化合物的具体例。
[1316]
【化学式42】
[1317][1318]
(第二化合物)
[1319]
在第一实施方式和第二实施方式涉及的有机el元件中,第二主体材料优选为具有稠合芳环的化合物、具有稠合杂芳环的化合物、或者具有稠合芳环和稠合杂芳环的化合物。作为稠合芳环,优选具有选自蒽骨架、芘骨架、荧蒽骨架、菲骨架、萘骨架、芴骨架、骨架、
三亚苯骨架、并四苯骨架、苯并蒽骨架和苯并骨架中的1个以上的骨架的化合物。作为稠合杂芳环,优选具有选自二苯并呋喃骨架、二苯并噻吩骨架、呫吨骨架和苯并呫吨骨架中的1个以上的骨架的化合物。
[1320]
尤其,第二主体材料优选为比第一主体材料更高效地发生ttf的化合物,优选为具有蒽骨架的化合物,更优选为下述通式(2)所示的化合物。
[1321]
【化学式43】
[1322][1323]
(上述通式(2)中,
[1324]
r2
01
~r2
08
各自独立地为
[1325]
氢原子、
[1326]
取代或未取代的碳数1~50的烷基、
[1327]
取代或未取代的碳数1~50的卤烷基、
[1328]
取代或未取代的碳数2~50的烯基、
[1329]
取代或未取代的碳数2~50的炔基、
[1330]
取代或未取代的成环碳数3~50的环烷基、
[1331]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1332]-o-(r
904
)所示的基团、
[1333]-s-(r
905
)所示的基团、
[1334]-n(r
906
)(r
907
)所示的基团、
[1335]
取代或未取代的碳数7~50的芳烷基、
[1336]-c(=o)r
801
所示的基团、
[1337]-coor
802
所示的基团、
[1338]
卤素原子、
[1339]
氰基、
[1340]
硝基、
[1341]
取代或未取代的成环碳数6~50的芳基、或者
[1342]
取代或未取代的成环原子数5~50的杂环基,
[1343]
l
201
和l
202
各自独立地为
[1344]
单键、
[1345]
取代或未取代的成环碳数6~50的亚芳基、或者
[1346]
取代或未取代的成环原子数5~50的二价杂环基,
[1347]
ar
201
和ar
202
各自独立地为
[1348]
取代或未取代的成环碳数6~50的芳基、或者
[1349]
取代或未取代的成环原子数5~50的杂环基。)
[1350]
(在第一实施方式和第二实施方式涉及的第二化合物中,r
901
、r
902
、r
903
、r
904
、r
905
、r
906
、r
907
、r
801
和r
802
各自独立地为
[1351]
氢原子、
[1352]
取代或未取代的碳数1~50的烷基、
[1353]
取代或未取代的成环碳数3~50的环烷基、
[1354]
取代或未取代的成环碳数6~50的芳基、或者
[1355]
取代或未取代的成环原子数5~50的杂环基,
[1356]
在r
901
存在多个的情况下,多个r
901
相互相同或不同,
[1357]
在r
902
存在多个的情况下,多个r
902
相互相同或不同,
[1358]
在r
903
存在多个的情况下,多个r
903
相互相同或不同,
[1359]
在r
904
存在多个的情况下,多个r
904
相互相同或不同,
[1360]
在r
905
存在多个的情况下,多个r
905
相互相同或不同,
[1361]
在r
906
存在多个的情况下,多个r
906
相互相同或不同,
[1362]
在r
907
存在多个的情况下,多个r
907
相互相同或不同,
[1363]
在r
801
存在多个的情况下,多个r
801
相互相同或不同,
[1364]
在r
802
存在多个的情况下,多个r
802
相互相同或不同。)
[1365]
在第一实施方式和第二实施方式涉及的有机el元件中,
[1366]
优选的是,r2
01
~r2
08
各自独立地为
[1367]
氢原子、
[1368]
取代或未取代的碳数1~50的烷基、
[1369]
取代或未取代的碳数1~50的卤烷基、
[1370]
取代或未取代的碳数2~50的烯基、
[1371]
取代或未取代的碳数2~50的炔基、
[1372]
取代或未取代的成环碳数3~50的环烷基、
[1373]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1374]-o-(r
904
)所示的基团、
[1375]-s-(r
905
)所示的基团、
[1376]-n(r
906
)(r
907
)所示的基团、
[1377]
取代或未取代的碳数7~50的芳烷基、
[1378]-c(=o)r
801
所示的基团、
[1379]-coor
802
所示的基团、
[1380]
卤素原子、
[1381]
氰基、或者
[1382]
硝基,
[1383]
l
201
和l
202
各自独立地为
[1384]
单键、
[1385]
取代或未取代的成环碳数6~50的亚芳基、或者
[1386]
取代或未取代的成环原子数5~50的二价杂环基,
[1387]
ar
201
和ar
202
各自独立地为
[1388]
取代或未取代的成环碳数6~50的芳基、或者
[1389]
取代或未取代的成环原子数5~50的杂环基。
[1390]
在第一实施方式和第二实施方式涉及的有机el元件中,
[1391]
优选的是,l
201
和l
202
各自独立地为
[1392]
单键、或者
[1393]
取代或未取代的成环碳数6~50的亚芳基,
[1394]
ar
201
和ar
202
各自独立地为取代或未取代的成环碳数6~50的芳基。
[1395]
在第一实施方式和第二实施方式涉及的有机el元件中,
[1396]
优选的是,ar2
01
和ar2
02
各自独立地为
[1397]
苯基、
[1398]
萘基、
[1399]
菲基、
[1400]
联苯基、
[1401]
三联苯基、
[1402]
二苯基芴基、
[1403]
二甲基芴基、
[1404]
苯并二苯基芴基、
[1405]
苯并二甲基芴基、
[1406]
二苯并呋喃基、
[1407]
二苯并噻吩基、
[1408]
萘并苯并呋喃基、或者
[1409]
萘并苯并噻吩基。
[1410]
在第一实施方式和第二实施方式涉及的有机el元件中,上述通式(2)所示的第二化合物优选为下述通式(201)、通式(202)、通式(203)、通式(204)、通式(205)、通式(206)、通式(207)、通式(208)或者通式(209)所示的化合物。
[1411]
【化学式44】
[1412][1413]
【化学式45】
[1414][1415]
【化学式46】
[1416][1417]
【化学式47】
[1418][1419]
【化学式48】
[1420][1421]
【化学式49】
[1422][1423]
【化学式50】
[1424][1425]
【化学式51】
[1426][1427]
【化学式52】
[1428][1429]
(上述通式(201)~(209)中,
[1430]
l
201
和ar
201
与上述通式(2)中的l
201
和ar
201
含义相同,
[1431]
r2
01
~r2
08
各自独立地与上述通式(2)中的r
201
~r
208
含义相同。)
[1432]
上述通式(201)~(209)中,r2
02
和r2
03
各自独立地优选为-l
203-ar
203
,更优选r2
02
和r2
03
中的一者为-l
203-ar
203
。
[1433]
此时,l
203
与上述通式(2)中的l
201
含义相同,ar2
03
与上述通式(2)中的ar
201
含义相同。
[1434]
l
203
与l
201
相互相同或者不同,ar
203
与ar
201
相互相同或者不同。
[1435]
在r
202
和r
203
为-l
203-ar
203
的情况下,2个l
203
相互相同或者不同,2个ar
203
相互相同或者不同。
[1436]
在第一实施方式和第二实施方式涉及的有机el元件中,在第二主体材料为上述通式(2)所示的第二化合物的情况下,在上述通式(2)所示的第二化合物中,作为蒽骨架的取代基的r
201
~r
208
从防止分子间的相互作用受到抑制、抑制电子迁移率的下降的观点出发,优选为氢原子,但r
201
~r
208
也可以为取代或未取代的成环碳数6~50的芳基或者取代或未取代的成环原子数5~50的杂环基。
[1437]r201
~r
208
成为烷基和环烷基等高位阻的取代基的情况下,分子间的相互作用受到抑制,电子迁移率相对于第一主体材料下降,有可能不满足上述数学式(数学式4)记载的μe(h2)>μe(h1)的关系。在将第二化合物作为第二主体材料用于第二发光层的情况下,能够期待通过满足μe(h2)>μe(h1)的关系由此抑制第一发光层中的空穴(hole)与电子的复合能力的下降以及发光效率的下降。需要说明的是,作为取代基,卤烷基、烯基、炔基、-si(r
901
)(r
902
)(r
903
)所示的基团、-o-(r
904
)所示的基团、-s-(r
905
)所示的基团、-n(r
906
)(r
907
)所示的基团、芳烷基、-c(=o)r
801
所示的基团、-coor
802
所示的基团、卤素原子、氰基以及硝基有可能形成高位阻,烷基以及环烷基有可能形成更高位阻。
[1438]
在上述通式(2)所示的第二化合物中,作为蒽骨架的取代基的r
201
~r
208
优选并非高位阻取代基,优选并非烷基和环烷基,更优选并非烷基、环烷基、卤烷基、烯基、炔基、-si(r
901
)(r
902
)(r
903
)所示的基团、-o-(r
904
)所示的基团、-s-(r
905
)所示的基团、-n(r
906
)(r
907
)所示的基团、芳烷基、-c(=o)r
801
所示的基团、-coor
802
所示的基团、卤素原子、氰基以及硝基。
[1439]
在第一实施方式和第二实施方式涉及的有机el元件中,在上述通式(2)所示的第二化合物中,也优选的是,r
201
~r
208
各自独立地为氢原子、取代或未取代的碳数1~50的烷基、取代或未取代的成环碳数3~50的环烷基、或者-si(r
901
)(r
902
)(r
903
)所示的基团。
[1440]
在第一实施方式和第二实施方式涉及的有机el元件中,在上述通式(2)所示的第二化合物中,r
201
~r
208
优选为氢原子。
[1441]
第二化合物中,r2
01
~r
208
中的表述为“取代或未取代的”时的取代基也优选不包含上述的有可能形成高位阻的取代基,尤其不包含取代或未取代的烷基以及取代或未取代的环烷基。r
201
~r
208
中的表述为“取代或未取代的”时的取代基通过不包含取代或未取代的烷基以及取代或未取代的环烷基,防止因烷基和环烷基等高位阻取代基的存在所导致的分子间的相互作用受到抑制,能够防止电子迁移率的下降,另外,在将这样的第二化合物作为第二主体材料用于第二发光层的情况下,能够抑制第一发光层中的空穴(hole)与电子的复合能力的下降以及发光效率的下降。
[1442]
进一步优选的是,作为蒽骨架的取代基的r
201
~r
208
并非高位阻取代基,作为取代基的r
201
~r
208
是未取代的。另外,在作为蒽骨架的取代基的r
201
~r
208
并非高位阻取代基的情况下,在作为位阻不高的取代基的r
201
~r
208
上键合取代基的情况下,该取代基也优选并非高位阻取代基,在作为取代基的r
201
~r
208
上键合的该取代基优选并非烷基和环烷基,更
优选并非烷基、环烷基、卤烷基、烯基、炔基、-si(r
901
)(r
902
)(r
903
)所示的基团、-o-(r
904
)所示的基团、-s-(r
905
)所示的基团、-n(r
906
)(r
907
)所示的基团、芳烷基、-c(=o)r
801
所示的基团、-coor
802
所示的基团、卤素原子、氰基以及硝基。
[1443]
在第二化合物中,记载有“取代或未取代”的基团均优选为“未取代”的基团。
[1444]
(第二化合物的制造方法)
[1445]
第二化合物可以通过公知的方法进行制造。另外,第二化合物也可以仿效公知的方法,通过使用与目标物质相应的已知的替代反应和原料来进行制造。
[1446]
(第二化合物的具体例)
[1447]
作为第二化合物的具体例,例如可以举出以下的化合物。其中,本发明不限定于这些第二化合物的具体例。
[1448]
【化学式53】
[1449][1450]
(第一发光性化合物、第二发光性化合物和第三发光性化合物)
[1451]
在第一实施方式和第二实施方式涉及的有机el元件中,第一发光性化合物、第二发光性化合物和第三发光性化合物各自独立地优选为具有稠合芳环的化合物、具有杂环的化合物、或者具有稠合芳环和稠合杂芳环的化合物。另外,杂环优选具有硼原子。杂环优选为杂芳环。第一发光性化合物、第二发光性化合物和第三发光性化合物各自独立地优选为芘衍生物、苯乙烯基胺衍生物、衍生物、荧蒽衍生物、芴衍生物、二胺衍生物、三芳基胺衍生物、咔唑衍生物、或者具有硼原子的杂芳环。
[1452]
作为第一发光性化合物、第二发光性化合物和第三发光性化合物,例如可以举出下述第三化合物和下述第四化合物等。
[1453]
第三化合物和第四化合物各自独立地为选自由下述通式(3)所示的化合物、下述通式(4)所示的化合物、下述通式(6)所示的化合物、下述通式(7)所示的化合物、下述通式(8)所示的化合物、下述通式(9)所示的化合物和下述通式(10)所示的化合物组成的组中的1种以上的化合物。
[1454]
(通式(3)所示的化合物)
[1455]
对于通式(3)所示的化合物进行说明。
[1456]
【化学式54】
[1457][1458]
(上述通式(3)中,
[1459]
由r
301
~r
310
之中的相邻的2个以上组成的组中的1组以上
[1460]
相互键合而形成取代或未取代的单环、
[1461]
相互键合而形成取代或未取代的稠环、或者
[1462]
相互不键合,
[1463]r301
~r
310
的至少1个为下述通式(31)所示的一价基团,
[1464]
不形成上述单环、不形成上述稠环且并非下述通式(31)所示的一价基团的r
301
~r
310
各自独立地为
[1465]
氢原子、
[1466]
取代或未取代的碳数1~50的烷基、
[1467]
取代或未取代的碳数2~50的烯基、
[1468]
取代或未取代的碳数2~50的炔基、
[1469]
取代或未取代的成环碳数3~50的环烷基、
[1470]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1471]-o-(r
904
)所示的基团、
[1472]-s-(r
905
)所示的基团、
[1473]-n(r
906
)(r
907
)所示的基团、
[1474]
卤素原子、
[1475]
氰基、
[1476]
硝基、
[1477]
取代或未取代的成环碳数6~50的芳基、或者
[1478]
取代或未取代的成环原子数5~50的杂环基。)
[1479]
【化学式55】
[1480][1481]
(上述通式(31)中,
[1482]
ar
301
和ar
302
各自独立地为
[1483]
取代或未取代的成环碳数6~50的芳基、或者
[1484]
取代或未取代的成环原子数5~50的杂环基,
[1485]
l
301
~l
303
各自独立地为
[1486]
单键、
[1487]
取代或未取代的成环碳数6~30的亚芳基、或者
[1488]
取代或未取代的成环原子数5~30的二价杂环基,
[1489]
*表示在上述通式(3)中的芘环中的键合位置。)
[1490]
在第三化合物和第四化合物中,r
901
、r
902
、r
903
、r
904
、r
905
、r
906
和r
907
各自独立地为
[1491]
氢原子、
[1492]
取代或未取代的碳数1~50的烷基、
[1493]
取代或未取代的成环碳数3~50的环烷基、
[1494]
取代或未取代的成环碳数6~50的芳基、或者
[1495]
取代或未取代的成环原子数5~50的杂环基,
[1496]
为取代或未取代的碳数1~50的烷基、或者
[1497]
取代或未取代的成环碳数6~50的芳基,
[1498]
在r
901
存在多个的情况下,多个r
901
相互相同或不同,
[1499]
在r
902
存在多个的情况下,多个r
902
相互相同或不同,
[1500]
在r
903
存在多个的情况下,多个r
903
相互相同或不同,
[1501]
在r
904
存在多个的情况下,多个r
904
相互相同或不同,
[1502]
在r
905
存在多个的情况下,多个r
905
相互相同或不同,
[1503]
在r
906
存在多个的情况下,多个r
906
相互相同或不同,
[1504]
在r
907
存在多个的情况下,多个r
907
相互相同或不同。
[1505]
上述通式(3)中,优选r
301
~r
310
之中的2个为上述通式(31)所示的基团。
[1506]
在一个实施方式中,上述通式(3)所示的化合物为下述通式(33)所示的化合物。
[1507]
【化学式56】
[1508][1509]
(上述通式(33)中,
[1510]r311
~r
318
各自独立地与上述通式(3)中的并非上述通式(31)所示的一价基团的r
301
~r
310
含义相同,
[1511]
l
311
~l
316
各自独立地为
[1512]
单键、
[1513]
取代或未取代的成环碳数6~30的亚芳基、或者
[1514]
取代或未取代的成环原子数5~30的二价杂环基,
[1515]
ar
312
、ar
313
、ar
315
和ar
316
各自独立地为
[1516]
取代或未取代的成环碳数6~50的芳基、或者
[1517]
取代或未取代的成环原子数5~50的杂环基。)
[1518]
上述通式(31)中,l
301
优选为单键,l
302
和l
303
优选为单键。
[1519]
在上述通式(33)中,l
311
和l
314
优选为单键,l
312
、l
313
、l
315
和l
316
优选为单键。
[1520]
上述通式(31)中,优选ar
301
和ar
302
之中的至少1个为下述通式(36)所示的基团。
[1521]
在上述通式(33)中,优选ar
312
和ar
313
之中的至少1个为下述通式(36)所示的基团。
[1522]
在上述通式(33)中,优选ar
315
和ar
316
之中的至少1个为下述通式(36)所示的基团。
[1523]
【化学式57】
[1524][1525]
(上述通式(36)中,
[1526]
x3表示氧原子或硫原子,
[1527]
由r
321
~r
327
之中的相邻的2个以上组成的组中的1组以上
[1528]
相互键合而形成取代或未取代的单环、
[1529]
相互键合而形成取代或未取代的稠环、或者
[1530]
相互不键合,
[1531]
不形成上述单环且不形成上述稠环的r
321
~r
327
各自独立地为
[1532]
氢原子、
[1533]
取代或未取代的碳数1~50的烷基、
[1534]
取代或未取代的碳数2~50的烯基、
[1535]
取代或未取代的碳数2~50的炔基、
[1536]
取代或未取代的成环碳数3~50的环烷基、
[1537]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1538]-o-(r
904
)所示的基团、
[1539]-s-(r
905
)所示的基团、
[1540]-n(r
906
)(r
907
)所示的基团、
[1541]
卤素原子、
[1542]
氰基、
[1543]
硝基、
[1544]
取代或未取代的成环碳数6~50的芳基、或者
[1545]
取代或未取代的成环原子数5~50的杂环基,
[1546]
*表示与l
302
、l
303
、l
312
、l
313
、l
315
或l
316
的键合位置。)
[1547]
x3优选为氧原子。
[1548]
优选的是,r
321
~r
327
之中的至少1个为
[1549]
取代或未取代的碳数1~50的烷基、
[1550]
取代或未取代的碳数2~50的烯基、
[1551]
取代或未取代的碳数2~50的炔基、
[1552]
取代或未取代的成环碳数3~50的环烷基、
[1553]
取代或未取代的成环碳数6~50的芳基、或者
[1554]
取代或未取代的成环原子数5~50的杂环基。
[1555]
上述通式(31)中,优选的是,ar
301
为上述通式(36)所示的基团,ar
302
为取代或未取代的成环碳数6~50的芳基。
[1556]
在上述通式(33)中,优选的是,ar
312
为上述通式(36)所示的基团,ar
313
为取代或未取代的成环碳数6~50的芳基。
[1557]
在上述通式(33)中,优选的是,ar
315
为上述通式(36)所示的基团,ar
316
为取代或未取代的成环碳数6~50的芳基。
[1558]
(通式(4)所示的化合物)
[1559]
对于通式(4)所示的化合物进行说明。
[1560]
【化学式58】
[1561][1562]
(上述通式(4)中,
[1563]
z各自独立地为cra或氮原子,
[1564]
a1环和a2环各自独立地为
[1565]
取代或未取代的成环碳数6~50的芳香族烃环、或者
[1566]
取代或未取代的成环原子数5~50的杂环,
[1567]
在ra存在多个的情况下,由多个ra之中的相邻的2个以上组成的组中的1组以上
[1568]
相互键合而形成取代或未取代的单环、
[1569]
相互键合而形成取代或未取代的稠环、或者
[1570]
相互不键合,
[1571]
n21和n22各自独立地为0、1、2、3或4,
[1572]
在rb存在多个的情况下,由多个rb之中的相邻的2个以上组成的组中的1组以上
[1573]
相互键合而形成取代或未取代的单环、
[1574]
相互键合而形成取代或未取代的稠环、或者
[1575]
相互不键合,
[1576]
在rc存在多个的情况下,由多个rc之中的相邻的2个以上组成的组中的1组以上
[1577]
相互键合而形成取代或未取代的单环、
[1578]
相互键合而形成取代或未取代的稠环、或者
[1579]
相互不键合,
[1580]
不形成上述单环且不形成上述稠环的ra、rb和rc各自独立地为
[1581]
取代或未取代的碳数1~50的烷基、
[1582]
取代或未取代的碳数2~50的烯基、
[1583]
取代或未取代的碳数2~50的炔基、
[1584]
取代或未取代的成环碳数3~50的环烷基、
[1585]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1586]-o-(r
904
)所示的基团、
[1587]-s-(r
905
)所示的基团、
[1588]-n(r
906
)(r
907
)所示的基团、
[1589]
卤素原子、
[1590]
氰基、
[1591]
硝基、
[1592]
取代或未取代的成环碳数6~50的芳基、或者
[1593]
取代或未取代的成环原子数5~50的杂环基。)
[1594]
a1环和a2环的“芳香族烃环”为与向上述的“芳基”导入氢原子而成的化合物相同的结构。
[1595]
a1环和a2环的“芳香族烃环”包含上述通式(4)中央的稠合2环结构上的2个碳原子作为成环原子。
[1596]
作为“取代或未取代的成环碳数6~50的芳香族烃环”的具体例,可以举出向具体例组g1中记载的“芳基”导入氢原子而成的化合物等。
[1597]
a1环和a2环的“杂环”为与向上述的“杂环基”导入氢原子而成的化合物相同的结构。
[1598]
a1环和a2环的“杂环”包含上述通式(4)中央的稠合2环结构上的2个碳原子作为成环原子。
[1599]
作为“取代或未取代的成环原子数5~50的杂环”的具体例,可以举出向具体例组g2中记载的“杂环基”导入氢原子而成的化合物等。
[1600]
rb键合于形成作为a1环的芳香族烃环的碳原子中的任一个、或者键合于形成作为a1环的杂环的原子中的任一个。
[1601]
rc键合于形成a2环的芳香族烃环的碳原子中的任一个、或者键合于形成作为a2环的杂环的原子中的任一个。
[1602]
ra、rb和rc之中,优选至少1个为下述通式(4a)所示的基团,更优选至少2个为下述通式(4a)所示的基团。
[1603]
【化学式59】
[1604]
*-l
401-ar
401
ꢀꢀꢀꢀꢀꢀ
(4a)
[1605]
(上述通式(4a)中,
[1606]
l
401
为
[1607]
单键、
[1608]
取代或未取代的成环碳数6~30的亚芳基、或者
[1609]
取代或未取代的成环原子数5~30的二价杂环基,
[1610]
ar
401
为
[1611]
取代或未取代的成环碳数6~50的芳基、
[1612]
取代或未取代的成环原子数5~50的杂环基、或者
[1613]
下述通式(4b)所示的基团。)
[1614]
【化学式60】
[1615][1616]
(上述通式(4b)中,
[1617]
l
402
和l
403
各自独立地为
[1618]
单键、
[1619]
取代或未取代的成环碳数6~30的亚芳基、或者
[1620]
取代或未取代的成环原子数5~30的二价杂环基,
[1621]
由ar
402
和ar
403
组成的组
[1622]
相互键合而形成取代或未取代的单环、
[1623]
相互键合而形成取代或未取代的稠环、或者
[1624]
相互不键合,
[1625]
不形成上述单环且不形成上述稠环的ar
402
和ar
403
各自独立地为
[1626]
取代或未取代的成环碳数6~50的芳基、或者取代或未取代的成环原子数5~50的杂环基。)
[1627]
在一个实施方式中,上述通式(4)所示的化合物由下述通式(42)表示。
[1628]
【化学式61】
[1629][1630]
(上述通式(42)中,
[1631]
由r
401
~r
411
之中的相邻的2个以上组成的组中的1组以上
[1632]
相互键合而形成取代或未取代的单环、
[1633]
相互键合而形成取代或未取代的稠环、或者
[1634]
相互不键合,
[1635]
不形成上述单环且不形成上述稠环的r
401
~r
411
各自独立地为氢原子、
[1636]
取代或未取代的碳数1~50的烷基、
[1637]
取代或未取代的碳数2~50的烯基、
[1638]
取代或未取代的碳数2~50的炔基、
[1639]
取代或未取代的成环碳数3~50的环烷基、
[1640]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1641]-o-(r
904
)所示的基团、
[1642]-s-(r
905
)所示的基团、
[1643]-n(r
906
)(r
907
)所示的基团、
[1644]
卤素原子、
[1645]
氰基、
[1646]
硝基、
[1647]
取代或未取代的成环碳数6~50的芳基、或者
[1648]
取代或未取代的成环原子数5~50的杂环基。)
[1649]r401
~r
411
之中,优选至少1个为上述通式(4a)所示的基团,更优选至少2个为上述通式(4a)所示的基团。
[1650]
优选r
404
和r
411
为上述通式(4a)所示的基团。
[1651]
在一个实施方式中,上述通式(4)所示的化合物为在a1环上键合有下述通式(4-1)或通式(4-2)所示的结构的化合物。
[1652]
另外,在一个实施方式中,上述通式(42)所示的化合物为在r
404
~r
407
所键合的环上键合有下述通式(4-1)或通式(4-2)所示的结构的化合物。
[1653]
【化学式62】
[1654][1655]
(上述通式(4-1)中,2个*各自独立地与上述通式(4)的作为a1环的芳香族烃环的成环碳原子或杂环的成环原子键合,或者与上述通式(42)的r
404
~r
407
中的任一个键合,
[1656]
上述通式(4-2)的3个*各自独立地与上述通式(4)的作为a1环的芳香族烃环的成环碳原子或杂环的成环原子键合,或者与上述通式(42)的r
404
~r
407
中的任一个键合,
[1657]
由r
421
~r
427
之中的相邻的2个以上组成的组中的1组以上
[1658]
相互键合而形成取代或未取代的单环、
[1659]
相互键合而形成取代或未取代的稠环、或者
[1660]
相互不键合,
[1661]
由r
431
~r
438
之中的相邻的2个以上组成的组中的1组以上
[1662]
相互键合而形成取代或未取代的单环、
[1663]
相互键合而形成取代或未取代的稠环、或者
[1664]
相互不键合,
[1665]
不形成上述单环且不形成上述稠环的r
421
~r
427
以及r
431
~r
438
各自独立地为
[1666]
氢原子、
[1667]
取代或未取代的碳数1~50的烷基、
[1668]
取代或未取代的碳数2~50的烯基、
[1669]
取代或未取代的碳数2~50的炔基、
[1670]
取代或未取代的成环碳数3~50的环烷基、
[1671]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1672]-o-(r
904
)所示的基团、
[1673]-s-(r
905
)所示的基团、
[1674]-n(r
906
)(r
907
)所示的基团、
[1675]
卤素原子、
[1676]
氰基、
[1677]
硝基、
[1678]
取代或未取代的成环碳数6~50的芳基、或者
[1679]
取代或未取代的成环原子数5~50的杂环基。)
[1680]
在一个实施方式中,上述通式(4)所示的化合物为下述通式(41-3)、通式(41-4)或通式(41-5)所示的化合物。
[1681]
【化学式63】
[1682][1683]
【化学式64】
[1684][1685]
【化学式65】
[1686][1687]
(上述通式(41-3)、式(41-4)和式(41-5)中,
[1688]
a1环与上述通式(4)中的定义相同,
[1689]r421
~r
427
各自独立地与上述通式(4-1)中的r
421
~r
427
含义相同,
[1690]r440
~r
448
各自独立地与上述通式(42)中的r
401
~r
411
含义相同。)
[1691]
在一个实施方式中,上述通式(41-5)的作为a1环的取代或未取代的成环碳数6~50的芳香族烃环为
[1692]
取代或未取代的萘环、或者
[1693]
取代或未取代的芴环。
[1694]
在一个实施方式中,上述通式(41-5)的作为a1环的取代或未取代的成环原子数5~50的杂环为
[1695]
取代或未取代的二苯并呋喃环、
[1696]
取代或未取代的咔唑环、或者
[1697]
取代或未取代的二苯并噻吩环。
[1698]
(通式(6)所示的化合物)
[1699]
对于通式(6)所示的化合物进行说明。
[1700]
【化学式66】
[1701][1702]
(上述通式(6)中,
[1703]
a环、b环和c环各自独立地为
[1704]
取代或未取代的成环碳数6~50的芳香族烃环、或者
[1705]
取代或未取代的成环原子数5~50的杂环,
[1706]r601
和r
602
各自独立地与上述a环、b环或c环键合而形成取代或未取代的杂环、或者不形成取代或未取代的杂环,
[1707]
不形成上述取代或未取代的杂环的r
601
和r
602
各自独立地为
[1708]
取代或未取代的碳数1~50的烷基、
[1709]
取代或未取代的碳数2~50的烯基、
[1710]
取代或未取代的碳数2~50的炔基、
[1711]
取代或未取代的成环碳数3~50的环烷基、
[1712]
取代或未取代的成环碳数6~50的芳基、或者
[1713]
取代或未取代的成环原子数5~50的杂环基。)
[1714]
a环、b环和c环是与由硼原子和2个氮原子构成的上述通式(6)中央的稠合2环结构稠合的环(取代或未取代的成环碳数6~50的芳香族烃环、或者取代或未取代的成环原子数5~50的杂环)。
[1715]
a环、b环和c环的“芳香族烃环”是与向上述的“芳基”导入氢原子而成的化合物相同的结构。
[1716]
a环的“芳香族烃环”包含上述通式(6)中央的稠合2环结构上的3个碳原子作为成环原子。
[1717]
b环和c环的“芳香族烃环”包含上述通式(6)中央的稠合2环结构上的2个碳原子作为成环原子。
[1718]
作为“取代或未取代的成环碳数6~50的芳香族烃环”的具体例,可以举出向在具体例组g1中记载的“芳基”导入氢原子而成的化合物等。
[1719]
a环、b环和c环的“杂环”是与向上述的“杂环基”导入氢原子而成的化合物相同的结构。
[1720]
a环的“杂环”包含上述通式(6)中央的稠合2环结构上的3个碳原子作为成环原子。b环和c环的“杂环”包含上述通式(6)中央的稠合2环结构上的2个碳原子作为成环原子。作为“取代或未取代的成环原子数5~50的杂环”的具体例,可以举出向在具体例组g2中记载
的“杂环基”导入氢原子而成的化合物等。
[1721]r601
和r
602
各自独立地可以与a环、b环或c环键合而形成取代或未取代的杂环。此时的杂环包含上述通式(6)中央的稠合2环结构上的氮原子。此时的杂环也可以包含氮原子以外的杂原子。r
601
和r
602
与a环、b环或c环键合具体而言是指,构成a环、b环或c环的原子与构成r
601
和r
602
的原子进行键合。例如,也可以是r
601
与a环键合而形成稠合有包含r
601
的环与a环的2环稠合(或3环以上稠合)的含氮杂环。作为该含氮杂环的具体例,可以举出与具体例组g2之中包含氮的2环以上稠合的杂环基对应的化合物等。
[1722]r601
与b环键合的情况、r
602
与a环键合的情况以及r
602
与c环键合的情况也与上文相同。
[1723]
在一个实施方式中,上述通式(6)中的a环、b环和c环各自独立地为取代或未取代的成环碳数6~50的芳香族烃环。
[1724]
在一个实施方式中,上述通式(6)中的a环、b环和c环各自独立地为取代或未取代的苯环或萘环。
[1725]
在一个实施方式中,上述通式(6)中的r
601
和r
602
各自独立地为
[1726]
取代或未取代的成环碳数6~50的芳基、或者
[1727]
取代或未取代的成环原子数5~50的杂环基,
[1728]
优选为取代或未取代的成环碳数6~50的芳基。
[1729]
在一个实施方式中,上述通式(6)所示的化合物为下述通式(62)所示的化合物。
[1730]
【化学式67】
[1731][1732]
(上述通式(62)中,
[1733]r601a
与选自r
611
和r
621
中的1个以上键合而形成取代或未取代的杂环、或者不形成取代或未取代的杂环,
[1734]r602a
与选自r
613
和r
614
中的1个以上键合而形成取代或未取代的杂环、或者不形成取代或未取代的杂环,
[1735]
不形成上述取代或未取代的杂环的r
601a
和r
602a
各自独立地为
[1736]
取代或未取代的碳数1~50的烷基、
[1737]
取代或未取代的碳数2~50的烯基、
[1738]
取代或未取代的碳数2~50的炔基、
[1739]
取代或未取代的成环碳数3~50的环烷基、
[1740]
取代或未取代的成环碳数6~50的芳基、或者
[1741]
取代或未取代的成环原子数5~50的杂环基,
[1742]
由r
611
~r
621
之中的相邻的2个以上组成的组中的1组以上
[1743]
相互键合而形成取代或未取代的单环、
[1744]
相互键合而形成取代或未取代的稠环、或者
[1745]
不相互键合,
[1746]
不形成上述取代或未取代的杂环、不形成上述单环且不形成上述稠环的r
611
~r
621
各自独立地为
[1747]
氢原子、
[1748]
取代或未取代的碳数1~50的烷基、
[1749]
取代或未取代的碳数2~50的烯基、
[1750]
取代或未取代的碳数2~50的炔基、
[1751]
取代或未取代的成环碳数3~50的环烷基、
[1752]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1753]-o-(r
904
)所示的基团、
[1754]-s-(r
905
)所示的基团、
[1755]-n(r
906
)(r
907
)所示的基团、
[1756]
卤素原子、
[1757]
氰基、
[1758]
硝基、
[1759]
取代或未取代的成环碳数6~50的芳基、或者
[1760]
取代或未取代的成环原子数5~50的杂环基。)
[1761]
上述通式(62)的r
601a
和r
602a
分别为与上述通式(6)的r
601
和r
602
对应的基团。
[1762]
例如,可以r
601a
与r
611
键合而形成稠合有包含它们的环和对应于a环的苯环的2环稠合(或3环以上稠合)的含氮杂环。作为该含氮杂环的具体例,可以举出与具体例组g2之中包含氮的2环以上稠合的杂环基对应的化合物等。r
601a
与r
621
键合的情况、r
602a
与r
613
键合的情况以及r
602a
与r
614
键合的情况也与上文相同。
[1763]
由r
611
~r
621
之中的相邻的2个以上组成的组中的1组以上可以
[1764]
相互键合而形成取代或未取代的单环、或者
[1765]
相互键合而形成取代或未取代的稠环。
[1766]
例如,可以r
611
与r
612
键合而形成对于它们所键合的六元环稠合苯环、吲哚环、吡咯环、苯并呋喃环或苯并噻吩环等而成的结构,所形成的稠环成为萘环、咔唑环、吲哚环、二苯并呋喃环或二苯并噻吩环。
[1767]
在一个实施方式中,不参与形成环的r
611
~r
621
各自独立地为
[1768]
氢原子、
[1769]
取代或未取代的碳数1~50的烷基、
[1770]
取代或未取代的成环碳数6~50的芳基、或者
[1771]
取代或未取代的成环原子数5~50的杂环基。
[1772]
在一个实施方式中,不参与形成环的r
611
~r
621
各自独立地为氢原子、
[1773]
取代或未取代的成环碳数6~50的芳基、或者取代或未取代的成环原子数5~50的杂环基。
[1774]
在一个实施方式中,不参与形成环的r
611
~r
621
各自独立地为氢原子、或者
[1775]
取代或未取代的碳数1~50的烷基。
[1776]
在一个实施方式中,不参与形成环的r
611
~r
621
各自独立地为氢原子、或者
[1777]
取代或未取代的碳数1~50的烷基,
[1778]r611
~r
621
之中的至少1个为取代或未取代的碳数1~50的烷基。
[1779]
(通式(7)所示的化合物)
[1780]
对于通式(7)所示的化合物进行说明。
[1781]
【化学式68】
[1782][1783]
【化学式69】
[1784][1785]
(上述通式(7)中,
[1786]
r环为在相邻环的任意的位置稠合的上述通式(72)或通式(73)所示的环,
[1787]
q环和s环各自独立地为在相邻环的任意的位置稠合的上述通式(74)所示的环,
[1788]
p环和t环各自独立地为在相邻环的任意的位置稠合的上述通式(75)或通式(76)
所示的结构,
[1789]
x7为氧原子、硫原子或nr
702
。
[1790]
在r
701
存在有多个的情况下,相邻的多个r
701
[1791]
相互键合而形成取代或未取代的单环、
[1792]
相互键合而形成取代或未取代的稠环、或者
[1793]
不相互键合,
[1794]
不形成上述单环且不形成上述稠环的r
701
和r
702
各自独立地为
[1795]
取代或未取代的碳数1~50的烷基、
[1796]
取代或未取代的碳数2~50的烯基、
[1797]
取代或未取代的碳数2~50的炔基、
[1798]
取代或未取代的成环碳数3~50的环烷基、
[1799]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1800]-o-(r
904
)所示的基团、
[1801]-s-(r
905
)所示的基团、
[1802]-n(r
906
)(r
907
)所示的基团、
[1803]
卤素原子、
[1804]
氰基、
[1805]
硝基、
[1806]
取代或未取代的成环碳数6~50的芳基、或者
[1807]
取代或未取代的成环原子数5~50的杂环基,
[1808]
ar
701
和ar
702
各自独立地为
[1809]
取代或未取代的碳数1~50的烷基、
[1810]
取代或未取代的碳数2~50的烯基、
[1811]
取代或未取代的碳数2~50的炔基、
[1812]
取代或未取代的成环碳数3~50的环烷基、
[1813]
取代或未取代的成环碳数6~50的芳基、或者
[1814]
取代或未取代的成环原子数5~50的杂环基,
[1815]
l
701
为
[1816]
取代或未取代的碳数1~50的亚烷基、
[1817]
取代或未取代的碳数2~50的亚烯基、
[1818]
取代或未取代的碳数2~50的亚炔基、
[1819]
取代或未取代的成环碳数3~50的亚环烷基、
[1820]
取代或未取代的成环碳数6~50的亚芳基、或者
[1821]
取代或未取代的成环原子数5~50的二价杂环基,
[1822]
m1为0、1或2,
[1823]
m2为0、1、2、3或4,
[1824]
m3各自独立地为0、1、2或3,
[1825]
m4各自独立地为0、1、2、3、4或5,
[1826]
在r
701
存在有多个的情况下,多个r
701
相互相同或不同,
[1827]
在x7存在有多个的情况下,多个x7相互相同或不同,
[1828]
在r
702
存在有多个的情况下,多个r
702
相互相同或不同,
[1829]
在ar
701
存在有多个的情况下,多个ar
701
相互相同或不同,
[1830]
在ar
702
存在有多个的情况下,多个ar
702
相互相同或不同,
[1831]
在l
701
存在有多个的情况下,多个l
701
相互相同或不同。)
[1832]
上述通式(7)中,p环、q环、r环、s环和t环的各环与相邻环共有2个碳原子地稠合。稠合的位置和方向没有限定,能够在任意的位置和方向进行稠合。
[1833]
在一个实施方式中,在作为r环的上述通式(72)或通式(73)中,m1=0或m2=0。
[1834]
(通式(8)所示的化合物)
[1835]
对于通式(8)所示的化合物进行说明。
[1836]
【化学式70】
[1837][1838]
(在上述通式(8)中,
[1839]r801
与r
802
、r
802
与r
803
、和r
803
与r
804
中的至少一组相互键合而形成下述通式(82)所示的二价基团,
[1840]r805
与r
806
、r
806
与r
807
、和r
807
与r
808
中的至少一组相互键合而形成下述通式(83)所示的二价基团。)
[1841]
【化学式71】
[1842][1843]
(不形成上述通式(82)所示的二价基团的r
801
~r
804
、和r
811
~r
814
中的至少1个为下述通式(84)所示的一价基团,
[1844]
不形成上述通式(83)所示的二价基团的r
805
~r
808
、和r
821
~r
824
中的至少1个为下述通式(84)所示的一价基团,
[1845]
x8为氧原子、硫原子、或nr
809
,
[1846]
不形成上述通式(82)和通式(83)所示的二价基团且并非上述通式(84)所示的一价基团的r
801
~r
808
、并非上述通式(84)所示的一价基团的r
811
~r
814
和r
821
~r
824
、以及r
809
各自独立地为
[1847]
氢原子、
[1848]
取代或未取代的碳数1~50的烷基、
[1849]
取代或未取代的碳数2~50的烯基、
[1850]
取代或未取代的碳数2~50的炔基、
[1851]
取代或未取代的成环碳数3~50的环烷基、
[1852]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1853]-o-(r
904
)所示的基团、
[1854]-s-(r
905
)所示的基团、
[1855]-n(r
906
)(r
907
)所示的基团、
[1856]
卤素原子、
[1857]
氰基、
[1858]
硝基、
[1859]
取代或未取代的成环碳数6~50的芳基、或者
[1860]
取代或未取代的成环原子数5~50的杂环基。)
[1861]
【化学式72】
[1862][1863]
(上述通式(84)中,
[1864]
ar
801
和ar
802
各自独立地为
[1865]
取代或未取代的成环碳数6~50的芳基、或者
[1866]
取代或未取代的成环原子数5~50的杂环基,
[1867]
l
801
~l
803
各自独立地为
[1868]
单键、
[1869]
取代或未取代的成环碳数6~30的亚芳基、
[1870]
取代或未取代的成环原子数5~30的二价杂环基、或者
[1871]
选自由取代或未取代的成环碳数6~30的亚芳基和取代或未取代的成环原子数5~30的二价杂环基组成的组中的2~4个基团键合而形成的二价连接基团,
[1872]
上述通式(84)中的*表示与上述通式(8)所示的环结构、通式(82)或通式(83)所示的基团的键合位置。)
[1873]
上述通式(8)中,形成上述通式(82)所示的二价基团和通式(83)所示的二价基团的位置没有特别限定,能够在r
801
~r
808
的可能位置形成该基团。
[1874]
(通式(9)所示的化合物)
[1875]
对于通式(9)所示的化合物进行说明。
[1876]
【化学式73】
[1877][1878]
(上述通式(9)中,
[1879]a91
环和a
92
环各自独立地为
[1880]
取代或未取代的成环碳数6~50的芳香族烃环、或者、
[1881]
取代或未取代的成环原子数5~50的杂环,
[1882]
选自a
91
环和a
92
环中的1个以上的环
[1883]
与下述通式(92)所示的结构的*键合。)
[1884]
【化学式74】
[1885][1886]
(上述通式(92)中,
[1887]a93
环为
[1888]
取代或未取代的成环碳数6~50的芳香族烃环、或者
[1889]
取代或未取代的成环原子数5~50的杂环,
[1890]
x9为nr
93
、c(r
94
)(r
95
)、si(r
96
)(r
97
)、ge(r
98
)(r
99
)、氧原子、硫原子或硒原子,
[1891]r91
和r
92
[1892]
相互键合而形成取代或未取代的单环、
[1893]
相互键合而形成取代或未取代的稠环、或者
[1894]
不相互键合,
[1895]
不形成上述单环且不形成上述稠环的r
91
和r
92
、以及r
93
~r
99
各自独立地为
[1896]
氢原子、
[1897]
取代或未取代的碳数1~50的烷基、
[1898]
取代或未取代的碳数2~50的烯基、
[1899]
取代或未取代的碳数2~50的炔基、
[1900]
取代或未取代的成环碳数3~50的环烷基、
[1901]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1902]-o-(r
904
)所示的基团、
[1903]-s-(r
905
)所示的基团、
[1904]-n(r
906
)(r
907
)所示的基团、
[1905]
卤素原子、
[1906]
氰基、
[1907]
硝基、
[1908]
取代或未取代的成环碳数6~50的芳基、或者
[1909]
取代或未取代的成环原子数5~50的杂环基。)
[1910]
选自a
91
环和a
92
环中的1个以上的环与上述通式(92)所示的结构的*键合。即,在一个实施方式中,a
91
环的上述芳香族烃环的成环碳原子或上述杂环的成环原子与上述通式(92)所示的结构的*键合。另外,在一个实施方式中,a
92
环的上述芳香族烃环的成环碳原子或上述杂环的成环原子与上述通式(92)所示的结构的*键合。
[1911]
在一个实施方式中,下述通式(93)所示的基团键合于a
91
环和a
92
环中的一者或这两者。
[1912]
【化学式75】
[1913][1914]
(上述通式(93)中,
[1915]
ar
91
和ar
92
各自独立地为
[1916]
取代或未取代的成环碳数6~50的芳基、或者
[1917]
取代或未取代的成环原子数5~50的杂环基,
[1918]
l
91
~l
93
各自独立地为
[1919]
单键、
[1920]
取代或未取代的成环碳数6~30的亚芳基、
[1921]
取代或未取代的成环原子数5~30的二价杂环基、或者
[1922]
选自由取代或未取代的成环碳数6~30的亚芳基和取代或未取代的成环原子数5~30的二价杂环基组成的组中的2~4个键合而形成的二价连接基团,
[1923]
上述通式(93)中的*表示与a
91
环和a
92
环中的任一者的键合位置。)
[1924]
在一个实施方式中,除了a
91
环以外,还有a
92
环的上述芳香族烃环的成环碳原子或上述杂环的成环原子与上述通式(92)所示的结构的*键合。这种情况下,上述通式(92)所示的结构相互可以相同也可以不同。
[1925]
在一个实施方式中,r
91
和r
92
各自独立地为取代或未取代的成环碳数6~50的芳基。
[1926]
在一个实施方式中,r
91
和r
92
相互键合而形成芴结构。
[1927]
一个实施方式中,环a
91
和环a
92
各自独立地为取代或未取代的成环碳数6~50的芳香族烃环,例如为取代或未取代的苯环。
[1928]
在一个实施方式中,环a
93
为取代或未取代的成环碳数6~50的芳香族烃环,例如为
取代或未取代的苯环。
[1929]
在一个实施方式中,x9为氧原子或硫原子。
[1930]
(通式(10)所示的化合物)
[1931]
对于通式(10)所示的化合物进行说明。
[1932]
【化学式76】
[1933][1934]
【化学式77】
[1935][1936]
(上述通式(10)中,
[1937]
ax1环为在相邻环的任意的位置稠合的上述通式(10a)所示的环,
[1938]
ax2环为在相邻环的任意的位置稠合的上述通式(10b)所示的环,
[1939]
上述通式(10b)中的2个*与ax3环的任意的位置键合,
[1940]
xa和xb各自独立地为c(r
1003
)(r
1004
)、si(r
1005
)(r
1006
)、氧原子或硫原子,
[1941]
ax3环为
[1942]
取代或未取代的成环碳数6~50的芳香族烃环、或者
[1943]
取代或未取代的成环原子数5~50的杂环,
[1944]
ar
1001
为
[1945]
取代或未取代的成环碳数6~50的芳基、或者
[1946]
取代或未取代的成环原子数5~50的杂环基,
[1947]r1001
~r
1006
各自独立地为
[1948]
氢原子、
[1949]
取代或未取代的碳数1~50的烷基、
[1950]
取代或未取代的碳数2~50的烯基、
[1951]
取代或未取代的碳数2~50的炔基、
[1952]
取代或未取代的成环碳数3~50的环烷基、
[1953]-si(r
901
)(r
902
)(r
903
)所示的基团、
[1954]-o-(r
904
)所示的基团、
[1955]-s-(r
905
)所示的基团、
[1956]-n(r
906
)(r
907
)所示的基团、
[1957]
卤素原子、
[1958]
氰基、
[1959]
硝基、
[1960]
取代或未取代的成环碳数6~50的芳基、或者
[1961]
取代或未取代的成环原子数5~50的杂环基,
[1962]
mx1为3,mx2为2,
[1963]
多个r
1001
相互相同或不同,
[1964]
多个r
1002
相互相同或不同,
[1965]
ax为0、1或2,
[1966]
在ax为0或1的情况下,“3-ax”所示的括弧内的结构相互相同或不同,
[1967]
在ax为2的情况下,多个ar
1001
相互相同或不同。)
[1968]
在一个实施方式中,ar
1001
为取代或未取代的成环碳数6~50的芳基。
[1969]
在一个实施方式中,ax3环为取代或未取代的成环碳数6~50的芳香族烃环,例如为取代或未取代的苯环、取代或未取代的萘环或者取代或未取代的蒽环。
[1970]
在一个实施方式中,r
1003
和r
1004
各自独立地为取代或未取代的碳数1~50的烷基。
[1971]
在一个实施方式中,ax为1。
[1972]
[第三实施方式]
[1973]
(有机电致发光元件的制造方法)
[1974]
第三实施方式涉及的有机el元件的制造方法(以下也称为第三实施方式的制造方法)是具有阳极、阴极以及配置于上述阳极与上述阴极之间的第一发光层和第二发光层的有机电致发光元件的制造方法。
[1975]
第三实施方式涉及的有机el元件的制造方法具有形成包含第一主体材料和第一发光性化合物的上述第一发光层的工序和形成包含第二主体材料和第二发光性化合物的上述第二发光层的工序。
[1976]
第一主体材料与第二主体材料相互不同。
[1977]
第一发光性化合物与第二发光性化合物相互相同或者不同。
[1978]
在形成第一发光层的工序和形成第二发光层的工序中使用的第一主体材料和第二主体材料选自满足下述数学式(数学式1)和数学式(数学式6)的材料。
[1979]
t1(h1)>t1(h2)
…
(数学式1)
[1980]
d1≥3.0
×
10-9
(cm2/s)
…
(数学式6)
[1981]
(在上述数学式(数学式1)和数学式(数学式6)中,
[1982]
t1(h1)为上述第一主体材料的三重态能量t1(h1),
[1983]
t1(h2)为上述第二主体材料的三重态能量t1(h2),
[1984]
d1为由扩散方程式算出的上述第一主体材料的三重态能量t1(h1)的扩散系数。)
[1985]
在第三实施方式的制造方法中,上述第一主体材料的三重态能量t1(h1)的扩散系数d1基于透射光的瞬态pl光谱算出,所述透射光的瞬态pl光谱是使用将在上述第一主体材料中添加第一磷光络合物而成的第一解析层与在上述第一主体材料中添加第二磷光络合物而成的第二解析层层叠而成的扩散速度解析层,以激发光从上述第一解析层侧入射、所
述透射光从上述第二解析层透射的方式进行测定的,上述第一主体材料的三重态能量t1(h1)与上述第一磷光络合物的三重态能量t1(c1)满足下述数学式(数学式x)的关系,上述第一主体材料的三重态能量t1(h1)与上述第二磷光络合物的三重态能量t1(c2)满足下述数学式(数学式y)的关系。
[1986]
t1(c1)>t1(h1)
…
(数学式x)
[1987]
t1(h1)>t1(c2)
…
(数学式y)
[1988]
在第三实施方式的制造方法中,上述第一发光性化合物的最大峰值波长优选为500nm以下。
[1989]
上述第一发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物。
[1990]
在第三实施方式的制造方法中,上述第二发光性化合物的最大峰值波长优选为500nm以下。
[1991]
上述第二发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物。
[1992]
第三实施方式的制造方法具有:
[1993]
形成包含三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上的第一主体材料和第一发光性化合物的第一发光层的工序、和
[1994]
形成包含满足数学式(数学式1)的第二主体材料和第二发光性化合物的第二发光层的工序。
[1995]
通过第三实施方式的制造方法,制造例如在第一实施方式中说明的有机el元件。因此,根据第三实施方式的制造方法,可制造发光效率提高的有机el元件。
[1996]
能够在第三实施方式的制造方法中使用的第一主体材料、第一发光性化合物、第二主体材料和第二发光性化合物与在第一实施方式中说明的第一主体材料、第一发光性化合物、第二主体材料和第二发光性化合物同样,优选范围也是同样的。
[1997]
第一主体材料的三重态能量t1(h1)的扩散系数d1利用与在第一实施方式中说明的方法同样的方法算出。该扩散系数d1的优选范围也与第一实施方式同样。
[1998]
第一解析层中所包含的第一磷光络合物和第二解析层中所包含的第二磷光络合物优选根据第一主体材料的三重态能量t1(h1)进行选择。
[1999]
例如,在t1(h1)≥2.0ev的情况下,优选的是,第一磷光络合物为ir(ppy)3,第二磷光络合物为ir(piq)2(acac)。
[2000]
另外,在2.0ev>t1(h1)≥1.9ev的情况下,可以使用ir(ppy)3作为第一磷光络合物,可以使用ptoep作为第二磷光络合物。
[2001]
(形成第一发光层的工序和形成第二发光层的工序)
[2002]
作为第一发光层和第二发光层的形成方法,可以举出在第一实施方式的“层形成方法”的项中所说明的方法。
[2003]
形成第一发光层的工序优选为通过将第一主体材料和显现最大峰值波长为500nm以下的发光的第一发光性化合物共蒸镀而形成第一发光层的工序。
[2004]
形成第二发光层的工序优选为通过将第二主体材料和显现最大峰值波长为500nm以下的发光的第二发光性化合物共蒸镀而形成第二发光层的工序。
[2005]
第三实施方式的制造方法可以为具有在阳极与阴极之间形成第一发光层的工序和在第一发光层与阴极之间形成第二发光层的工序的制造方法,也可以为具有在阳极与阴极之间形成第二发光层的工序和在第二发光层与阴极之间形成第一发光层的工序的制造方法。
[2006]
另外,第三实施方式的制造方法可以具有进一步形成1个以上的有机层的工序,可以具有形成在第一实施方式中说明的第三发光层的工序。
[2007]
作为有机层,例如可以举出选自空穴注入层、空穴传输层、发光层、电子注入层、电子传输层、空穴阻挡层和电子阻挡层中的至少任一层。
[2008]
作为各层的形成方法,可以举出在第一实施方式的“层形成方法”的项中说明的方法。第三实施方式的制造方法除了在上文中的说明以外也可以使用在第一实施方式中说明的构成。
[2009]
[第四实施方式]
[2010]
(有机电致发光元件的制造方法)
[2011]
第四实施方式涉及的有机el元件的制造方法(以下也称为第四实施方式的制造方法)为具有阳极、阴极以及配置于上述阳极与上述阴极之间的第一发光层和第二发光层的有机电致发光元件的制造方法。
[2012]
第四实施方式的制造方法具有形成包含第一主体材料和第一发光性化合物的上述第一发光层的工序和形成包含第二主体材料和第二发光性化合物的上述第二发光层的工序。
[2013]
第一主体材料与第二主体材料相互不同。
[2014]
第一发光性化合物与第二发光性化合物相互相同或者不同。
[2015]
在形成第一发光层的工序和形成第二发光层的工序中使用的第一主体材料和第二主体材料选自满足下述数学式(数学式1)和数学式(数学式10)的材料。
[2016]
t1(h1)>t1(h2)
…
(数学式1)
[2017]v1
≤-11(mv/nm)
…
(数学式10)
[2018]
(在上述数学式(数学式1)和数学式(数学式10)中,
[2019]
t1(h1)为上述第一主体材料的三重态能量t1(h1),
[2020]
t1(h2)为上述第二主体材料的三重态能量t1(h2),
[2021]v1
为上述第一主体材料的表面电势。)
[2022]
在第四实施方式的制造方法中,上述第一发光性化合物的最大峰值波长优选为500nm以下。
[2023]
上述第一发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物。
[2024]
在第四实施方式的制造方法中,上述第二发光性化合物的最大峰值波长优选为500nm以下。
[2025]
上述第二发光性化合物更优选为显现最大峰值波长为500nm以下的荧光发光的荧光发光性化合物。
[2026]
第四实施方式的制造方法具有
[2027]
形成包含表面电势v1为-11(mv/nm)以下且满足数学式(数学式1)的第一主体材料
和第一发光性化合物的第一发光层的工序、和
[2028]
形成包含满足数学式(数学式1)的第二主体材料和第二发光性化合物的第二发光层的工序。
[2029]
通过第四实施方式的制造方法,例如制造在第二实施方式中说明的有机el元件。因此,根据第四实施方式的制造方法,可制造发光效率提高的有机el元件。
[2030]
能够在第四实施方式的制造方法中使用的第一主体材料、第一发光性化合物、第二主体材料和第二发光性化合物与在第二实施方式中说明的第一主体材料、第一发光性化合物、第二主体材料和第二发光性化合物同样,优选范围也是同样的。
[2031]
第一主体材料的表面电势v1利用与在第二实施方式中说明的方法同样的方法算出。第一主体材料的表面电势v1的优选范围也与第二实施方式同样。
[2032]
(形成第一发光层的工序和形成第二发光层的工序)
[2033]
作为第一发光层和第二发光层的形成方法,可以举出在第二实施方式的“层形成方法”的项中说明的方法。
[2034]
形成第一发光层的工序优选为通过将第一主体材料和第一发光性化合物(优选为显现最大峰值波长为500nm以下的发光的第一发光性化合物)共蒸镀而形成第一发光层的工序。
[2035]
形成第二发光层的工序优选为通过将第二主体材料和第二发光性化合物(优选为显现最大峰值波长为500nm以下的发光的第二发光性化合物)共蒸镀而形成第二发光层的工序。
[2036]
第四实施方式的制造方法可以为具有在阳极与阴极之间形成第一发光层的工序和在第一发光层与阴极之间形成第二发光层的工序的制造方法,可以为具有在阳极与阴极之间形成第二发光层的工序和在第二发光层与阴极之间形成第一发光层的工序的制造方法。
[2037]
第四实施方式的制造方法优选为具有在阳极与阴极之间形成第一发光层的工序和在第一发光层与阴极之间形成第二发光层的工序的制造方法。
[2038]
另外,第四实施方式的制造方法可以具有进一步形成1个以上的有机层的工序,可以具有形成在第二实施方式中说明的第三发光层的工序。
[2039]
作为有机层,例如可以举出选自空穴注入层、空穴传输层、发光层、电子注入层、电子传输层、空穴阻挡层和电子阻挡层中的至少任一层。
[2040]
作为各层的形成方法,可以举出在第二实施方式的“层形成方法”的项中说明的方法。第四实施方式的制造方法除了上文中的说明以外也可以使用在第二实施方式中说明的构成。
[2041]
[第五实施方式]
[2042]
(电子设备)
[2043]
第五实施方式涉及的电子设备搭载有上述实施方式中的任一有机el元件。作为电子设备,例如可以举出显示装置和发光装置等。作为显示装置,例如可以举出显示部件(例如有机el面板模块等)、电视、移动电话、平板电脑和个人电脑等。作为发光装置,例如可以举出照明和车辆用灯具等。
[2044]
[实施方式的变形]
[2045]
需要说明的是,本发明不限定于上述的实施方式,在能够达成本发明的目的的范围内的变更、改良等包括在本发明中。
[2046]
例如,发光层不限于2层,可以层叠有超过2个的多个发光层。在有机el元件具有超过2个的多个发光层的情况下,只要至少2个发光层满足在上述实施方式中说明过的条件即可。例如,其他发光层可以为荧光发光型的发光层,也可以为利用了基于从三重激发态直接向基态的电子跃迁的发光的磷光发光型的发光层。
[2047]
另外,有机el元件具有多个发光层的情况下,可以是这些发光层相互相邻地设置,也可以是隔着中间层层叠多个发光单元而成的所谓串联型的有机el元件。
[2048]
另外,例如可以在发光层的阴极侧相邻地设置阻挡层。在发光层的阴极侧直接相接地配置的阻挡层优选阻挡空穴和激子中的至少任一种。
[2049]
例如在发光层的阴极侧相接地配置有阻挡层的情况下,该阻挡层传输电子,并且阻止空穴到达比该阻挡层更靠阴极侧的层(例如电子传输层)。有机el元件在包含电子传输层的情况下,优选在发光层与电子传输层之间包含该阻挡层。
[2050]
另外,为了激发能量不从发光层漏出至其周边层,可以将阻挡层与发光层相邻地设置。阻止在发光层中生成的激子向比该阻挡层更靠电极侧的层(例如电子传输层和空穴传输层等)移动。
[2051]
优选发光层与阻挡层接合。
[2052]
此外,本发明的实施中的具体结构以及形状等在能够达成本发明的目的的范围内可以设为其他结构等。
[2053]
实施例
[2054]
以下,举出实施例对本发明进行进一步的详细说明。本发明不受这些实施例的任何限定。
[2055]
《化合物》
[2056]
以下示出实施例1~5涉及的有机el元件的制造中使用的第一主体材料。
[2057]
【化学式78】
[2058][2059]
【化学式79】
[2060][2061]
以下示出比较例1涉及的有机el元件的制造中使用的比较化合物的结构。
[2062]
【化学式80】
[2063][2064]
以下示出实施例1~5和比较例1涉及的有机el元件的制造中使用的其他化合物的结构。
[2065]
【化学式81】
[2066][2067]
【化学式82】
[2068][2069]
【化学式83】
[2070][2071]
《有机el元件的制作1》
[2072]
如下制作、评价有机el元件。
[2073]
[实施例1]
[2074]
将25mm
×
75mm
×
1.1mm厚的带ito(indium tin oxide)透明电极(阳极)的玻璃基板(geomatec株式会社制)在异丙醇中进行超声波清洗5分钟后,进行uv臭氧清洗30分钟。ito透明电极的膜厚设为130nm。
[2075]
将清洗后的带透明电极线的玻璃基板安装于真空蒸镀装置的基板架,首先在形成有透明电极线的一侧的面上以覆盖透明电极的方式共蒸镀化合物ht1和化合物ha1,形成了膜厚10nm的空穴注入层(hi)。该空穴注入层中的化合物ht1的比例设为90质量%,化合物ha1的比例设为10质量%。
[2076]
继空穴注入层的形成之后蒸镀化合物ht1,形成了膜厚85nm的第一空穴传输层(ht)。
[2077]
继第一空穴传输层的形成之后蒸镀化合物ht3,形成了膜厚5nm的第二空穴传输层(也称为电子阻挡层)(ebl)。
[2078]
在第二空穴传输层上共蒸镀化合物bh1-a(第一主体材料(bh))和化合物bd(第一发光性化合物(bd))使得化合物bd的比例为2质量%,形成了膜厚5nm的第一发光层。
[2079]
在第一发光层上共蒸镀化合物bh2(第二主体材料(bh))和化合物bd(第二发光性化合物(bd))使得化合物bd的比例为2质量%,形成了膜厚15nm的第二发光层。
[2080]
在第二发光层上蒸镀化合物et1,形成了膜厚5nm的第一电子传输层(有时也称为空穴阻挡层(hbl)。)。
[2081]
在第一电子传输层上共蒸镀化合物et2和化合物liq,形成了膜厚25nm的第二电子传输层(et)。该第二电子传输层中的化合物et2的比例设为50质量%,化合物liq的比例设为50质量%。需要说明的是,liq为(8-羟基喹啉)锂((8-quinolinolato)lithium)的简称。
[2082]
在第二电子传输层上蒸镀化合物liq而形成了膜厚1nm的电子注入层。
[2083]
在电子注入层上蒸镀金属al而形成了膜厚80nm的阴极。
[2084]
实施例1的元件构成简略示出则如下所示。
[2085]
ito(130)/ht1:ha1(10,90%:10%)/ht1(85)/ht3(5)/bh1-a:bd(5,98%:2%)/bh2:bd(15,98%:2%)/et1(5)/et2:liq(25,50%:50%)/liq(1)/al(80)
[2086]
需要说明的是,括弧内的数字表示膜厚(单位:nm)。
[2087]
同样地在括弧内,以百分比显示的数字(90%:10%)表示空穴注入层中的化合物ht1和化合物ha1的比例(质量%),以百分比显示的数字(98%:2%)表示第一发光层或第二发光层中的主体材料(化合物bh1-a或bh2)和发光性化合物(化合物bd)的比例(质量%),以百分比显示的数字(50%:50%)表示第二电子传输层中的化合物et2和化合物liq的比例(质量%)。
[2088]
[实施例2~5和比较例1]
[2089]
实施例2~5和比较例1的有机el元件除了将实施例1的第一发光层中的化合物bh1-a(第一主体材料)变更为表3记载的化合物以外,与实施例1同样地进行制作。
[2090]
《第一主体材料的三重态能量t1(h1)的扩散系数d1>
[2091]
使用实施例1的第一主体材料,利用之前已描述的方法制作了具备将第一解析层和第二解析层层叠而成的扩散速度解析层的瞬态pl数据测定用试样。使用该瞬态pl数据测定用试样算出第一主体材料的三重态能量t1(h1)的扩散系数d1。结果示于表3。
[2092]
需要说明的是,作为第一磷光络合物,使用ir(ppy)3,作为第二磷光络合物,使用ir(piq)2(acac)。
[2093]
在上述数学式(数学式10b)中,吸光系数a使用1.0e5,使用to=1.0e17(/cm3)。
[2094]
在上述数学式(数学式101)中,ir(piq)2(acac)的i(τ)设为i(τ)=exp(-τ/τph),使用τph=3.5e-7(s)。
[2095]
实施例1的瞬态pl数据测定用试样的构成简略示出则如下所示。
[2096]
透射光侧/glass(0.7mm)/bh1-a:ir(piq)2(acac)(20nm,95%:5%)/bh1-a:ir(ppy)3(100nm,80%:20%)/密封玻璃(0.6mm)/入射光侧
[2097]
需要说明的是,括弧内的数字表示膜厚。同样地在括弧内,以百分比显示的数字(95%:5%)表示化合物bh1-a和ir(piq)2(acac)的比例(质量%)。以百分比显示的数字(80%:20%)表示化合物bh1-a和ir(ppy)3的比例(质量%)。
[2098]
实施例2~5和比较例1的瞬态pl数据测定用试样除了将在实施例1中使用的化合物bh1-a(第一主体材料)变更为表3记载的化合物以外,与实施例1同样地进行制作。
[2099]
【表3】
[2100][2101]
《有机el元件的评价》
[2102]
对于所制作的有机el元件进行以下的评价。结果示于表4和图6。
[2103]
·
ttf比率
[2104]
利用之前已描述的方法测定ttf比率。具体测定条件如下所述。
[2105]
对于在各例中制作的有机el元件,在室温(25℃)下通电,在时刻约3
×
10-8
秒的位置除去脉冲电压。
[2106]
将电压除去时点取作原点,根据将在电压除去后至1.5
×
10-5
秒为止的光强度的平方根的倒数进行绘制而成的该曲线图求出ttf比率。
[2107]
·
外部量子效率eqe
[2108]
利用分光发射亮度计cs-2000(konica minolta株式会社制)测量对元件施加电压使得电流密度达到10ma/cm2时的分光发射亮度光谱。根据所得到的分光发射亮度光谱,假定进行了朗伯辐射,算出外部量子效率eqe(单位:%)。
[2109]
【表4】
[2110]
[2111]
如表4和图6所示,实施例1~5的有机el元件由于使用了满足数学式(数学式1)且三重态能量t1(h1)的扩散系数d1为3.0
×
10-9
(cm2/s)以上的第一主体材料,因而相较于比较例1的有机el元件,ttf比率高且显示了高外部量子效率eqe。
[2112]
《化合物》
[2113]
以下示出实施例1a~4a涉及的有机el元件的制造中使用的第一主体材料。需要说明的是,化合物bh1-a1是与上述化合物bh1-e相同的化合物。化合物bh1-d1是与上述化合物bh1-c相同的化合物。
[2114]
【化学式84】
[2115][2116]
【化学式85】
[2117][2118]
以下示出比较例1a涉及的有机el元件的制造中使用的比较化合物的结构。
[2119]
【化学式86】
[2120][2121]
以下示出实施例1a~4a和比较例1a涉及的有机el元件的制造中使用的其他化合物的结构。
[2122]
【化学式87】
[2123][2124]
【化学式88】
[2125][2126]
【化学式89】
[2127][2128]
《有机el元件的制作2》
[2129]
如下制作、评价有机el元件。
[2130]
[实施例1a]
[2131]
将25mm
×
75mm
×
1.1mm厚的带ito(indium tin oxide)透明电极(阳极)的玻璃基板(geomatec株式会社制)在异丙醇中进行超声波清洗5分钟后,进行uv臭氧清洗30分钟。ito透明电极的膜厚设为130nm。
[2132]
将清洗后的带透明电极线的玻璃基板安装于真空蒸镀装置的基板架,首先在形成有透明电极线的一侧的面上以覆盖透明电极的方式共蒸镀化合物ht1和化合物ha1,形成了膜厚10nm的空穴注入层(hi)。该空穴注入层中的化合物ht1的比例设为90质量%、化合物ha1的比例设为10质量%。
[2133]
继空穴注入层的形成之后蒸镀化合物ht1,形成了膜厚85nm的第一空穴传输层(ht)。
[2134]
继第一空穴传输层的形成之后蒸镀化合物ht3,形成了膜厚5nm的第二空穴传输层(也称为电子阻挡层)(ebl)。
[2135]
在第二空穴传输层上共蒸镀化合物bh1-a1(第一主体材料(bh))和化合物bd(第一发光性化合物(bd))使得化合物bd的比例为2质量%,形成了膜厚5nm的第一发光层。
[2136]
在第一发光层上共蒸镀化合物bh2(第二主体材料(bh))和化合物bd(第二发光性化合物(bd))使得化合物bd的比例为2质量%,形成了膜厚15nm的第二发光层。
[2137]
在第二发光层上蒸镀化合物et1,形成了膜厚5nm的第一电子传输层(有时也称为空穴阻挡层(hbl)。)。
[2138]
在第一电子传输层上共蒸镀化合物et2和化合物liq,形成了膜厚25nm的第二电子传输层(et)。该第二电子传输层中的化合物et2的比例设为50质量%,化合物liq的比例设为50质量%。需要说明的是,liq为(8-羟基喹啉)锂((8-quinolinolato)lithium)的简称。
[2139]
在第二电子传输层上蒸镀化合物liq而形成了膜厚1nm的电子注入层。
[2140]
在电子注入层上蒸镀金属al而形成了膜厚80nm的阴极。
[2141]
实施例1a的元件构成简略示出则如下所示。
[2142]
ito(130)/ht1:ha1(10,90%:10%)/ht1(85)/ht3(5)/bh1-a1:bd(5,98%:2%)/bh2:bd(15,98%:2%)/et1(5)/et2:liq(25,50%:50%)/liq(1)/al(80)
[2143]
需要说明的是,括弧内的数字表示膜厚(单位:nm)。
[2144]
同样地在括弧内,以百分比显示的数字(90%:10%)表示空穴注入层中的化合物ht1和化合物ha1的比例(质量%),以百分比显示的数字(98%:2%)表示第一发光层或第二发光层中的主体材料(化合物bh1-a1或bh2)和发光性化合物(化合物bd)的比例(质量%),以百分比显示的数字(50%:50%)表示第二电子传输层中的化合物et2和化合物liq的比例(质量%)。
[2145]
[实施例2a~4a和比较例1a]
[2146]
实施例2a~4a和比较例1a的有机el元件除了将实施例1a的第一发光层中的化合物bh1-a1(第一主体材料)变更为表5记载的化合物以外,与实施例1a同样地进行制作。
[2147]
《第一主体材料的表面电势v1>
[2148]
使用实施例1a的第一主体材料(化合物bh1-a1),利用之前已描述的方法制作了表面电势测定用试样1、2。
[2149]
实施例1a的表面电势测定用试样1、2的构成简略示出则如下所示。
[2150]
试样1:玻璃基板(0.7mm)/ito(130nm)/化合物bh1-a1(20nm)
[2151]
试样2:玻璃基板(0.7mm)/ito(130nm)/化合物bh1-a1(60nm)
[2152]
需要说明的是,括弧内的数字表示膜厚。
[2153]
使用所制作的试样1、2,利用之前已描述的方法(依据kp technologyltd制uhvkp020的步骤)测定试样1的第一主体材料层的功函数w(d1)(mv)和试样2的第一主体材料层的功函数w(d2)(mv),得到了w(d1)和w(d2)的值。
[2154]
使用上述数学式(数学式100)算出实施例1a的第一主体材料(化合物bh1-a1)的表面电势v1(mv/nm)。结果示于表5。
[2155]
测定条件如下所述。
[2156]-条件-[2157]
·
装置:kp technology ltd制uhvkp020
[2158]
·
测定区域:
[2159]
实施例2a~4a和比较例1a的表面电势测定用试样1、2除了将在实施例1a中使用的化合物bh1-a1(第一主体材料)变更为表5记载的化合物以外,利用与实施例1a同样的方法进行制作。使用所制作的表面电势测定用试样1、2,利用与实施例1a同样的方法,算出实施例2a~4a和比较例1a的第一主体材料的表面电势v1(mv/nm)。结果示于表5。
[2160]
【表5】
[2161][2162]
《有机el元件的评价》
[2163]
对于所制作的有机el元件,进行以下的评价。结果示于表6和图9。
[2164]
·
外部量子效率eqe
[2165]
利用分光发射亮度计cs-2000(konica minolta株式会社制)测量对元件施加电压使得电流密度达到10ma/cm2时的分光发射亮度光谱。根据所得到的分光发射亮度光谱,假定进行了朗伯辐射,算出外部量子效率eqe(单位:%)。
[2166]
【表6】
[2167][2168]
如表6和图9所示,实施例1a~4a的有机el元件由于使用了满足数学式(数学式1)且表面电势v1为-11(mv/nm)以下的第一主体材料,因而相较于比较例1a的有机el元件,显
示出高外部量子效率eqe。
[2169]
《化合物的评价方法》
[2170]
对于表3~6中的化合物,进行以下的评价。
[2171]
(三重态能量t1)
[2172]
将成为测定对象的化合物溶解于epa(二乙醚:异戊烷:乙醇=5:5:2(容积比))中以使得浓度达到10μmol/l,将该溶液加入石英比色池中作为测定试样。对于该测定试样,在低温(77[k])测定磷光光谱(纵轴设为磷光发光强度、横轴设为波长。),对于该磷光光谱的短波长侧的升起引切线,将基于该切线与横轴的交点的波长值λ
edge
[nm],根据以下换算式(f1)算出的能量作为三重态能量t1。需要说明的是,三重态能量t1根据测定条件可能产生上下0.02ev程度的误差。
[2173]
换算式(f1):t1[ev]=1239.85/λ
edge
[2174]
对于磷光光谱的短波长侧的升起的切线如下引出。从磷光光谱的短波长侧起直至光谱的极大值之中最短波长侧的极大值为止在光谱曲线上进行移动时,朝向长波长侧考量曲线上的各点处的切线。该切线随着曲线升起(即随着纵轴增加)而斜率增加。在该斜率的值取极大值的点处所引的切线(即拐点处的切线)作为该对于磷光光谱的短波长侧的升起的切线。
[2175]
需要说明的是,具有光谱的最大峰值强度的15%以下的峰强度的极大点不包括在上述的最短波长侧的极大值中,将与最短波长侧的极大值最接近的、斜率的值取极大值的点处所引的切线作为该对于磷光光谱的短波长侧的升起的切线。
[2176]
磷光的测定使用株式会社日立高新技术制的f-4500型分光荧光光度计主体。
[2177]
(单重态能量s1)
[2178]
制备成为测定对象的化合物的10μmol/l甲苯溶液并加入至石英比色池中,在常温(300k)测定该试样的吸收光谱(纵轴设为吸收强度、横轴设为波长)。对于该吸收光谱的长波长侧的下坠引切线,将该切线与横轴的交点的波长值λ
edge
[nm]代入随后所示的换算式(f2)算出单重态能量。
[2179]
换算式(f2):s1[ev]=1239.85/λedge
[2180]
作为吸收光谱测定装置,使用日立公司制的分光光度计(装置名:u3310)。
[2181]
对于吸收光谱的长波长侧的下坠的切线如下引出。从吸收光谱的极大值之中最长波长侧的极大值起沿长波长方向在光谱曲线上移动时,考量曲线上的各点处的切线。该切线随着曲线下坠(即随着纵轴的值减少),其斜率重复减少而后增加的情况。将斜率的值在最长波长侧(其中不包括吸光度为0.1以下的情况)取极小值的点处所引的切线作为该对于吸收光谱的长波长侧的下坠的切线。
[2182]
需要说明的是,吸光度的值为0.2以下的极大点不包括在上述最长波长侧的极大值中。
[2183]
(最高已占轨道的能级homo)
[2184]
最高已占轨道的能级homo在大气下使用光电子分光装置(理研计量仪器株式会社制、“ac-3”)进行测定。具体而言,对材料照射光,测定此时通过电荷分离而产生的电子量,由此测定化合物的最高已占轨道的能级homo。
[2185]
(荧光发光最大峰值波长(fl-peak)的测定)
[2186]
将化合物bd以4.9
×
10-6
mol/l的浓度溶于甲苯,制备化合物bd的甲苯溶液。使用荧光光谱测定装置(分光荧光光度计f-7000(株式会社日立高新技术科学制)),测定将化合物bd的甲苯溶液在390nm进行激发时的荧光发光最大峰值波长。
[2187]
化合物bd的荧光发光最大峰值波长为455nm。
[2188]
(化合物的范德华半径)
[2189]
利用之前已描述的方法算出“化合物的范德华半径”。
[2190]
化合物bh1-a的范德华半径经计算为1.08nm。化合物bh1-b的范德华半径经计算为1.27nm。化合物bh1-c的范德华半径经计算为1.50nm。化合物bh1-d的范德华半径经计算为1.24nm。化合物bh1-e的范德华半径经计算为1.09nm。化合物ref-1的范德华半径经计算为1.08nm。化合物bh1-a1的范德华半径经计算为1.09nm。化合物bh1-b1的范德华半径经计算为1.18nm。化合物bh1-c1的范德华半径经计算为1.30nm。化合物bh1-d1的范德华半径经计算为1.50nm。
[2191]
符号说明
[2192]
1,1a
…
有机el元件、2
…
基板、3
…
阳极、4
…
阴极、51
…
第一发光层、52
…
第二发光层、6
…
空穴注入层、7
…
空穴传输层、8
…
电子传输层、9
…
电子注入层。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。