1.本发明属于生物技术领域,尤其涉及一种小鼠严重创伤/全身炎症反应模型的构建方法及其应用。
背景技术:
2.创伤泛指多种原因(自然因素、社会因素、人为因素)引起人体结构完整性的破坏和功能障碍。严重创伤是45岁以下群体死亡的首要原因。严重创伤的患者,治疗周期长,医疗资源消耗大,是当今医疗领域的重要难题之一,是严重影响社会安定、百姓福祉、个人健康的重要公共卫生问题。
3.严重创伤患者有3个死亡高峰。第一个死亡高峰即事故发生几分钟之内,死亡原因主要为脑、脑干、高位脊髓的严重创伤或心脏主动脉等大血管撕裂以及各种原因导致的窒息、大出血导致的休克、重要脏器的严重毁损等,在此阶段医疗手段难以发挥作用。第二个死亡高峰是事故发生后的1小时之内,死亡原因主要为血气胸、肝脾破裂、骨盆及骨折等多发伤造成的大出血。这一时期又称为抢救的“黄金时间”,如抢救及时得当,大部分病人可免于死亡。第三个死亡高峰出现在伤后数周。由于病人伤情复杂、抵抗力下降,极易出现严重感染或器官功能衰竭,导致死亡。在第二个死亡高峰积极挽救生命,尽可能预防第三个死亡高峰是目前严重创伤领域最关注的问题。
4.严重创伤后机体病理生理机制变化复杂。伤后早期,机体可出现失血性休克、低体温、酸中毒、凝血功能异常等症状。在第二次世界大战爆发后,医疗技术快速发展,损伤控制复苏和损伤控制手术以及对治疗创伤性出凝血病治疗的进步,使得此类患者救治成功率不断提高。但仍有一部分患者,即使在第二个死亡高峰生存下来,却仍然难以摆脱死亡的威胁。临床上许多幸存者会继续发展成脓毒症,继而导致多器官功能衰竭甚至死亡,主要原因在于初期组织损伤加上大量失血引起全身炎性反应应答,加上凝血系统剧烈变化,神经内分泌系统剧烈作用等,会给患者全身稳态以严重的打击。越来越多的研究表明,这些打击会直接影响患者结局。因此,伤后早期的剧烈病理生理变化是影响患者结局的关键;探索严重创伤后早期病理生理对严重创伤的救治有重要意义。许多疾病治疗理念的更新和方法的进步都源自于动物实验的研究成果,建立合理有效的实验室动物模型进行探究尝试,是提高严重创伤临床救治率,探究更科学治疗方案的基础。目前严重创伤动物模型主要包括大动物模型(如猪,牛等)和小动物模型(如兔子,大鼠,小鼠等)。大动物模型难于饲养繁殖,实验操作不便,而小动物模型则具有易饲养,易繁殖,操作简便,成本相对较低等优点,因此,目前科研实验探究多用小动物模型。以往的小动物创伤模型由于考虑到易操作性,多使用大鼠或兔子。
5.以往研究尝试了多种方法建立严重创伤模型,但存在以下不足:(1)多数研究以某一特定损伤脏器(颅脑,肺)为研究对象,对动物模型全身的探索较少;(2)操作不便,模型建立不稳定,如出血量难以控制,实验模型不能做到均一化;(3)不能满足目前科学研究需求。随着基础学科的发展,不断推动医疗走向精准医学模式,基因层面的探索愈发重要,以往兔
子、大鼠的模型无法实现基因编辑技术,如针对某目标基因进行敲除,研究目标基因缺失对疾病的影响。至今尚未建立公认的广泛使用的严重创伤动物模型。
6.基于上述问题,需要建立一个稳定的,能够模拟临床状况的,且能够满足目前科学研究需求的的动物模型。
技术实现要素:
7.本发明的目的之一在于提供一种小鼠严重创伤/全身炎症反应模型的构建方法,通过股动脉放血、股骨骨折、腹部脏器暴露给小鼠造成严重损伤,该模型作为一种损伤、休克和无菌性炎症的疾病模型,具有一定严重程度的损伤,可以作为在感染、免疫和炎症等更普遍情况下的科学研究的模型。
8.为实现上述目的,本发明一种小鼠严重创伤/全身炎症反应模型的构建方法采取下述技术方案:一种小鼠严重创伤/全身炎症反应模型的构建方法,包括以下步骤:(1)造模前3天用肝素盐水浸泡动脉插管;(2)用异氟烷麻醉小鼠,麻醉称重后固定于手术台上,再用异氟烷面罩吸入持续麻醉,小鼠备皮,进行表面消毒;(3)
①ꢀ
于小鼠右侧腹股沟处做切口i;结扎远心端,在靠近近心端处提起血管,做切口ii,置入肝素浸盐水浸泡后的动脉插管,连接测量仪,监测血压;
②ꢀ
于小鼠左侧股骨处做切口iii;
③ꢀ
依小鼠中线做切口iv,自腹股沟处至胸骨下缘剪开小鼠腹部皮肤、腹膜,暴露腹部器官,暴露,完成后用6-0丝线缝合腹膜、皮肤;
④ꢀ
腹部暴露同时通过动脉插管快速放血,放出小鼠全身血量的30%,造成失血性休克;
⑤ꢀ
造模完成后用6-0丝线缝和伤口,麻醉至造模完成1h后停止。
9.优选地,步骤(1)中,肝素盐水的用量为100 units/ml。
10.优选地,步骤(2)中,小鼠为10周龄,且体重在20~22g的健康雄性c57bl/6小鼠。
11.进一步优选地,步骤(2)中,用5%异氟烷麻醉小鼠,麻醉称重后以仰卧位固定于手术台上,再用2%异氟烷面罩吸入持续麻醉,小鼠备皮,并用碘伏三次,完成皮肤表面消毒。
12.优选地,步骤(3)中,
①ꢀ
于小鼠右侧腹股沟处做长度为0.8~1cm垂直于血管走向切口i,分离肌肉组织和结缔组织,游离股静脉和股动脉;结扎股动脉远心端,在靠近近心端处提起血管,用显微剪刀于血管做切口ii,置入肝素浸盐水浸泡后的动脉插管,连接测量仪,监测血压;
②ꢀ
于小鼠左侧股骨处沿股骨方向做长度为0.8~1cm纵行切口iii,暴露肌肉,钝性拨开肌肉,暴露股骨,于股骨中部剪断左侧股骨,再用无菌棉球填充断端;
③ꢀ
依小鼠中线做切口iv,自腹股沟处至胸骨下缘依次剪开小鼠腹部皮肤、腹膜,暴露腹部器官且无出血,暴露30min,完成后用6-0丝线缝合腹膜、皮肤;
④ꢀ
腹部暴露同时通过动脉插管快速放血,放出小鼠全身血量的30%,造成失血性休克;
⑤ꢀ
造模完成后用6-0丝线缝和伤口,麻醉至造模完成1h后停止。
13.进一步优选地,步骤(3)中,小鼠全身血量计算公式如式1所示:血量 = 体重 *α
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
式1其中,血量的单位为ml,体重的单位为g,α=0.07 ml/g。
14.本发明目的之二在于提供一种小鼠严重创伤/全身炎症反应模型的应用,该模型
用于探索严重创伤后疾病发展的病理生理变化,如机体全身炎性反应变化,脏器损伤机制等。
15.为实现上述目的,本发明一种小鼠严重创伤/全身炎症反应模型的应用采取下述技术方案:一种小鼠严重创伤/全身炎症反应模型的应用,小鼠严重创伤/全身炎症反应模型用于创伤疾病机理研究、分子靶标鉴定或创伤药物的筛选。
16.优选地,小鼠严重创伤/全身炎症反应模型用于严重创伤引起的出血性休克、系统性炎性反应、器官损伤、出凝血障碍以及复苏病机理研究、分子靶标鉴定或创伤药物的筛选。
17.优选地,小鼠严重创伤/全身炎症反应模型用于损伤、休克和无菌性炎症的机理研究、分子靶标鉴定或创伤药物的筛选。
18.有益效果:本发明通过股动脉放血、股骨骨折、腹部脏器暴露给小鼠造成严重损伤,用于探索严重创伤后疾病发展的病理生理变化。该模型操作方便,出血量精准控制,且模型实现了均一化。本模型可广泛用于创伤类疾病动物模型实验邻域。小鼠严重创伤/全身炎症反应模型可广泛应用于严重创伤所致的出血性休克、系统性炎性反应、器官损伤、出凝血障碍以及复苏策略等研究;还可作为一种损伤、休克和无菌性炎症的疾病模型,具有一定严重程度的损伤,可以作为在感染、免疫和炎症等更普遍情况下科学研究的模型。
19.本发明建立一种小鼠严重创伤/全身炎症反应模型,通过监测血压、体温、乳酸变化、全身炎性反应指标,重要脏器病理学变化等,提供一种探索创伤疾病的动物模型,也可以作为在感染、免疫和炎症等更普遍情况下科学研究的模型。
20.该模型选择小鼠为操作对象,相对于其他小动物,该模型优势在于可添加基因编辑技术,如针对某目标基因进行敲除,研究目标基因缺失对小鼠表型或疾病的影响,从而确定该基因的作用。并且该模型重点关注到小鼠出现全身炎性反应及非直接打击部位以外的重要脏器发生损伤。
附图说明
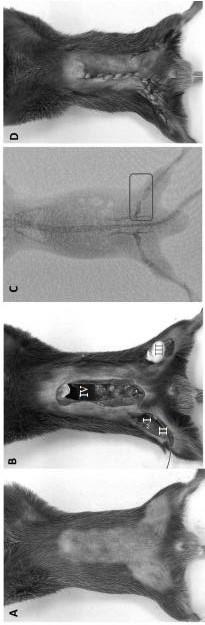
21.图1为造模前后的模型外像,a为备皮完成,造模前小鼠外像,b为造模完成时小鼠外像,c为造模完成时小鼠x线像,d为造模后小鼠外像;图2为造模完成早期小鼠平均动脉压(map)随时间变化曲线;图3 为造模完成早期小鼠体温随时间变化曲线;图4为造模后小鼠体内乳酸随时间变化的示意图;图5为造模后外周血炎性因子变化,a为对照组和模型组在造模后1h,2h,3h,6h,12h外周血中tnf-α浓度,b为对照组和模型组在造模后1h,2h,3h,6h,12h外周血中il-6浓度,c为对照组和模型组在造模后1h,2h,3h,6h,12h外周血中il-1β浓度,d为对照组和模型组在造模后1h,2h,3h,6h,12h外周血中mcp-1浓度;图6为造模后肺部病理变化,a为对照组小鼠肺部免疫组化及巨噬细胞染色,b为造模后2h小鼠肺部免疫组化及巨噬细胞染色;图7为造模后早期肠,肺,肝,脾,肾重要脏器病理变化,a组分别为对照组小鼠肠、
肺、肝、脾和肾组织病理he染色,b组分别为多发伤后1h小鼠肠、肺、肝、脾和肾组织病理he染色,c组分别为多发伤后2h小鼠肠、肺、肝、脾和肾组织病理he染色,d组分别为多发伤后3h小鼠肠、肺、肝、脾和肾组织病理he染色,e组分别为多发伤后6h小鼠肠、肺、肝、脾和肾组织病理he染色。
具体实施方式
22.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
23.实施例1一种小鼠严重创伤/全身炎症反应模型的构建方法,包括以下步骤:(1)造模前3天用100 units/ml 肝素盐水浸泡动脉插管;(2)选用10周龄,且体重在20~22g的健康雄性c57bl/6小鼠;先用5%异氟烷麻醉小鼠,麻醉称重后以仰卧位固定于手术台上,再用2%异氟烷面罩吸入持续麻醉,小鼠备皮,并用碘伏三次,完成皮肤表面消毒;(3)
①ꢀ
于小鼠右侧腹股沟处做长度为0.8~1cm垂直于血管走向切口i,分离肌肉组织和结缔组织,游离股静脉和股动脉;结扎股动脉远心端,在靠近近心端处提起血管,用显微剪刀于血管做切口ii,置入肝素浸盐水浸泡后的动脉插管,连接测量仪,监测血压;
②ꢀ
于小鼠左侧股骨处沿股骨方向做长度为0.8~1cm纵行切口iii,暴露肌肉,钝性拨开肌肉,暴露股骨,于股骨中部剪断左侧股骨,再用无菌棉球填充断端;
③ꢀ
依小鼠中线做切口iv,自腹股沟处至胸骨下缘依次剪开小鼠腹部皮肤、腹膜,暴露腹部器官且无出血,暴露30min,完成后用6-0丝线缝合腹膜、皮肤;
④ꢀ
腹部暴露同时通过动脉插管快速放血,放出小鼠全身血量的30%,造成失血性休克;
⑤ꢀ
造模完成后用6-0丝线缝和伤口,麻醉至造模完成1h后停止;其中,小鼠全身血量计算公式如式1所示:血量 = 体重 *α
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
式1式中,血量的单位为ml,体重的单位为g,α=0.07 ml/g。
24.实施例2一种小鼠严重创伤/全身炎症反应模型的构建方法,具体实施时,包括以下步骤:(1)造模前3天用肝素盐水(100 usp units/ml)浸泡动脉插管(kz1101,wpi),持续浸泡至造模时使用取出。
25.(2)选取10周龄、体重在20~22g的雄性c57bl/6小鼠,使用5%的异氟醚诱导小鼠麻醉;麻醉称重后以仰卧位固定于显微手术台上,采用2%的异氟醚面罩吸入维持麻醉。小鼠备皮,并用碘伏消毒三次,完成皮肤表面消毒(图1a)。
26.(3)于小鼠右侧腹股沟处做长度约1cm垂直于血管走向切口i(图1b中i),分离肌肉组织和结缔组织,游离股静脉和股动脉,暴露股动脉;结扎股动脉远心端,在靠近近心端处提起血管,用显微剪刀于血管做切口ii(图1b中ii),置入肝素浸盐水浸泡后的动脉插管,用于放血和监测血压,连接测量仪(labaide 834,wpi),实时监测血压,置管后待血压平稳时记录基线平均动脉压;于小鼠左侧股骨处沿股骨方向做长度约1cm纵向切口iii(图1b中iii),分离、暴露肌肉,钝性拨开肌肉,暴露股骨,直视下于股骨中部剪断左侧股骨,立刻用无菌棉球填充断端,避免失血;依小鼠中线做切口iv(图1b中iv),自腹股沟处至胸骨下缘依
次剪开小鼠腹部皮肤、腹膜,暴露腹部器官且无出血,暴露30min,完成后用6-0丝线缝合腹膜、皮肤;腹部暴露同时通过动脉插管快速放血,放出小鼠全身血量的30%,其中,小鼠全身血量计算公式:血量(ml)=体重(g)*0.07(ml/g),造成失血性休克(图1b和1c);造模完成后用6-0丝线缝和伤口,麻醉至造模完成1h后停止(图1d)。
27.完成上述操作后持续测血压及体温,每隔5min记录一次持续监测1h。
28.(4)小鼠腹部在暴露30min后缝合切口。期间不影响监测。
29.(5)将股动脉导管撤出并结扎血管,丝线依次缝合切口,消毒并给予局部止痛,停止麻醉将动物移入笼中观察。
30.(6)对照组小鼠在相同条件下维持相同麻醉状态和麻醉时间后取材。对照组于小鼠右侧腹股沟处做相同切口,用相同方式分离股动脉,置入动脉插管,在相同时间点进行监测血压。不进行其他操作。
31.(7)分别在小鼠造模后即刻、1h、2h、3h、6h、12h取材。包括小鼠全身血液及小鼠主要脏器。
32.(8)取小鼠造模后即刻、1h、2h、3h、6h、12h外周血,测量乳酸值。
33.(9)取小鼠造模后1h、2h、3h、6h、12h外周血,3000转/min 离心15取血清,用elisa法测量il-6、tnf-α、il-1β、mcp-1四种炎性因子含量,反应全身炎性反应水平。
34.(10)取小鼠造模后1h、2h、3h、6h肺、肝、肾、小肠、脾做免疫组化,观察脏器的病理变化。
35.(11)取小鼠造模后2h肺做免疫组化,观察小鼠肺部巨噬细胞浸润。
36.所用材料、试剂等如无特殊说明,均为常规方法、常规器材。
37.结果与分析由图2可知,模型小鼠造模完成后map明显下降,由小鼠基础map(83.o
±
4.9)mmhg造模完成时下降至最低(35.5
±
2.6)mmhg(p《0.05)。后逐步恢复,在45min时基本恢复到基线值。
38.由图3可知,模型小鼠造模完成后体温明显下降,由小鼠基础体温(33.6
±
0.5
°
c)造模完成时下降至最低(30.4
±
0.4
°
c)(p《0.05)。后逐步恢复,在40min时基本恢复到基线值。
39.由图4可知,模型小鼠造模完成后乳酸值明显升高,在造模后1h显著高于基线(p《0.05);造模后2h时乳酸值略降低,但依然高于正常水平(p《0.05);大约3h时逐渐恢复至正常值。结果表明小鼠有低体温、酸中毒表现,符合失血性休克“死亡三联征”表现。
40.由图5可知,模型小鼠造模完成后有明显的全身炎性反应。能够反应体内炎症状态的炎性因子tnf-α(图5a),il-6(图5b),il-1β(图5c),mcp-1(图5d)在造模后1h明显升高(p《0.05),与对照组相比,均有明显差异。tnf-α,il-6,il-1β在造模完成后3h持续高于对照组小鼠(p《0.05),mcp-1在造模完成后6h持续高于对照组小鼠(p《0.05)。炎性因子高于正常水平,可持续影响组织器官状态。
41.如图6所示,模型小鼠造模后2h,肺部巨噬细胞浸润明显升高。
42.如图7所示,组织病理学分析结果显示,模型小鼠造模完成后不同时间点肠,肺,肝,脾,肾均出现了不同程度的损伤。
43.肠在多发伤造模后1h已存在损伤,在造模后6h损伤最为显著,黏膜层局部绒毛可
见炎性细胞弥散性浸润;部分绒毛上皮细胞坏死脱落。
44.肺在多发伤造模后1h已存在损伤,肺组织内可见大量肺泡萎缩,形态不规则;肺组织内局部可见炎性细胞弥散性浸润;部分肺泡上皮细胞轻度增生。随着时间的延长,损伤逐渐加重。在造模后6h,肺组织内可见大量肺泡上皮细胞增生,肺泡隔增厚,肺泡萎缩加重,炎性细胞弥散性浸润加重。
45.肝组织在多发伤造模后1h时肝细胞轻度水肿,肝组织内大量肝细胞中度水肿,细胞明显肿胀、胞浆淡染,细胞内可见形态不规则的空泡。在造模后前3h,肝组织病理表现相似,在造模后6h,损伤表现加重,部分出现肝索排列紊乱。
46.脾组织在多发伤造模后1h时未见明显病理改变,造模后2h时红髓内可见含铁血黄素沉积,未见其他明显病理改变;该病理表现持续到造模后6h。
47.肾脏组织在多发伤造模后1h时已存在损伤。部分肾小管上皮细胞轻度水肿,细胞肿胀、胞浆淡染;部分肾小管损伤,上皮细胞刷状缘脱落;随着时间的延长,损伤逐渐加重,在造模后3h时上述症状加重,并出现组织内部分肾小球萎缩,球内毛细血管显著减少。在造模后6h肾小管上皮细胞水肿程度减轻。
48.小鼠在造模完成后的状态为:受到严重创伤,全身炎性反应重,有对远隔脏器的打击,但是能够稳定存活。
49.综上,本小鼠严重创伤/全身炎症反应模型能够模拟临床严重创伤患者病理生理状态:模型小鼠严重损伤发生休克,同时外周血循环中炎性因子明显升高,没有受到直接打击的远隔器官产生损伤。
50.本发明选取10周龄体重在20~22g的雄性c57bl/6小鼠,使用异氟醚麻醉小鼠。麻醉称重后以仰卧位固定于显微手术台上用异氟醚面罩吸入维持麻醉。小鼠备皮,表面消毒。于小鼠左侧股骨处沿股骨方向做长约1cm切口,暴露肌肉,钝性拨开肌肉,于股骨中部剪短左侧股骨(立刻用无菌棉球填充断端,避免失血)。依小鼠中线做切口iv,自腹股沟处至胸骨下缘依次剪开小鼠腹部皮肤、腹膜,暴露腹部器官(无出血,暴露30min)。于小鼠右侧腹股沟处做一长约1cm垂直于血管走形切口,分离肌肉组织结缔组织,游离股静脉和股动脉。结扎股动脉远心端,在靠近近心端处提起血管,用显微剪刀做一切口,置入导管,用于放血造成失血性休克(放出小鼠全身血量的30%),监测小鼠造模过程及造模完成早期血压;监测小鼠造模过程及造模完成早期体温;监测小鼠造模后即刻、1h、2h、3h、6h、12h乳酸变化;监测小鼠造模后1h、2h、3h、6h、12h全身炎性反应水平;监测小鼠造模后主要远隔脏器免疫组化。通过该模型模拟人体遭受多发伤的发生发展过程。
51.本模型可操作性强,整体稳定,可广泛用于创伤类疾病动物模型实验邻域。此外,该模型作为一种损伤、休克和无菌性炎症的疾病模型,具有一定严重程度的损伤,可以作为在感染、免疫和炎症等更普遍情况下科学研究的模型。
52.本发明建立的小鼠严重创伤/全身炎症反应模型,可广泛应用于严重创伤所致的出血性休克、系统性炎性反应、器官损伤、出凝血障碍以及复苏策略等研究;并且模型可作为一种损伤、休克和无菌性炎症的疾病模型,具有一定严重程度的损伤,可以作为在感染、免疫和炎症等更普遍情况下科学研究的模型。
53.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述
实施例进行变化、修改、替换和变型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
