抑制ror-β
表达的用于诱导不对称rnai的核酸分子
技术领域
1.本发明涉及一种抑制ror-β(retinoid-related orphan nuclear receptor)表达的用于诱导不对称rnai的核酸分子及其用途,具体地,涉及一种用于诱导不对称rnai的核酸分子以及用于改善或治疗视网膜疾病的药物组合物,所述用于诱导不对称rnai的核酸分子包括包含与编码ror-β的mrna互补的序列的反义链以及与所述反义链形成互补键的有义链,所述组合物包括所述用于诱导不对称rnai的核酸分子。
背景技术:
2.视网膜色素变性是一种因赋予视杆细胞特征的基因发生突变而破坏视杆细胞,并进一步破坏视锥细胞而最终导致失明的疾病。ror-β(retinoid-related orphan nuclear receptor)是一种在视杆细胞和视锥细胞的分化中起重要作用的转录因子,其对调节向杆状细胞分化的neural retina leucine zipper(nrl)表达进行调节,并参与其它多种视网膜功能。ror-β有rorβ1和rorβ2两种同源异构体,rorβ1在nrl的上游阶段(upstream)诱导nrl表达,而rorβ2是受nrl调节的因子,其使nrl的表达得到强化。即,ror-β和nrl两个基因之间发生正反馈作用,从而稳定视杆细胞分化。(fu et al.,"feedback induction of a photoreceptor-specific isoform of retinoid-related orphan nuclear receptorβby the rod transcription factor nrl"journal of biological chemistry 2014nov 21;289(47):32469-80.)。特别是,以与ror-β密切相关的nrl为例,通过视网膜变性的小鼠模型观察到当用腺病毒相关病毒(aav)传递的crispr/cas9敲除时,视杆细胞获得部分视锥细胞的性质,使得视杆细胞在赋予视杆细胞特征的基因发生突变时不被破坏并得以保持,进而防止视锥细胞的损失(yu,wenhan,et al.,"nrl knockdown by aav-delivered crispr/cas9 prevents retinal degeneration in mice."nature communications 8(2017):14716)。这种现象类似于在缺损ror-β的小鼠中视杆细胞获得视锥细胞特性的研究类似(jia et al,"retinoid-related orphan nuclear receptor rorβis an early-acting factor in rod photoreceptor development"proceedings of the national academy of sciences of the united states of america(2009)13;106(41):17534-9.),由此可见,nrl和ror-β在视网膜内视杆细胞和视锥细胞的分化过程中起到非常重要的作用。
3.另一方面,利用rna干扰现象治疗疾病使用的是靶向mrna并在翻译水平中调节基因表达的sirna,因此可以更加安全地治疗疾病。小干扰rna(small interfering rna;sirna)由具有与靶mrna相同序列的有义链以及具有与其互补序列的反义链组成。常规sirna具有19bp至21bp的短双链体,并且两个核苷酸从两条链的3'突出。sirna进入细胞附着于靶mrna后分解靶mrna,从而抑制靶基因的表达。由于可以通过改变寡核苷酸序列来靶向所有的mrna,因此可以抑制结构复杂的蛋白质的表达,从而使当前难以治疗的癌症、病毒感染以及遗传病等疾病得到治疗。然而,引入细胞内的sirna可能引起免疫反应的诱导、脱靶基因的抑制等副作用,其中,将sirna导入细胞内的传递系统在利用sirna的治疗药物研发中成为最关键的问题。
4.sirna因磷酸骨架而带有负电荷,其与带负电荷的细胞膜有排斥力,因此需要一个传递系统将sirna导入细胞。作为传递系统的实例,广泛使用的是利用具有正电荷的脂质体或聚合物包裹sirna来抵消负电荷,从而将其导入细胞的方法。然而,带正电荷的载体会引起各种副作用,例如附着在带负电荷的细胞膜上,表现出不需要的毒性,或者通过与细胞中各种类型的蛋白质相互作用形成不需要的复合物等。此外,由于sirna会被血液中的核酸酶快速分解,因此到达靶细胞的sirna量可能不足以显着降低靶基因的表达。因此,需要一种安全有效地将sirna传递至靶细胞的方法。
5.为此,本发明人为选择可抑制ror-β表达的靶向ror-β的sirna,并研发出无需传递物质也可传递至细胞且对核酸酶具有高抵抗力的sirna而付出努力,最终设计出靶向ror-β的sirna,通过筛选选择出最有效抑制ror-β的sirna,并证实通过修饰可以解决细胞内传递问题,以此完成了本发明。
6.本背景技术部分中描述的上述信息仅用于提高对本发明背景的理解,因此可以不包括构成本发明所属领域技术人员已知的现有技术的信息。
技术实现要素:
7.技术问题
8.本发明的目的在于提供一种特异性抑制ror-β表达的用于诱导不对称rnai的核酸分子。
9.本发明的另一目的在于提供一种用于改善或治疗视网膜疾病的药物组合物或改善或治疗视网膜疾病的方法。
10.技术方案
11.为了实现上述目的,本发明提供一种用于诱导rnai的核酸分子,其特征在于包括包含与编码ror-β(retinoid-related orphan nuclear receptor)的mrna互补的序列的反义链以及与所述反义链形成互补键的有义链,并且所述反义链的5’末端和所述有义链的3’末端形成平端(blunt end)。
12.本发明另外提供一种用于改善或治疗视网膜疾病的药物组合物,其包括所述用于诱导rnai的核酸分子。
13.本发明另外提供一种改善或治疗视网膜疾病的方法,其包括将所述用于诱导rnai的核酸分子施用于个体。
14.有益效果
15.根据本发明,筛选出可有效抑制在视杆细胞和视锥细胞的分化过程中起到非常重要作用的ror-β表达的不对称sirna,通过化学修饰使所述sirna在没有载体的情况下引入细胞内并对核酸酶具有抵抗力,以去除载体引起的细胞毒性,并且体内实现更加有效的基因表达抑制,从而可有效用作包括视网膜色素变性在内的视网膜疾病的治疗药物。
附图说明
16.图1是示意性示出由16mer的有义链和19mer的反义链组成的ror-βasirna结构的图。
17.图2是用62种ror-βasirna处理y-79细胞后确认ror-β蛋白表达变化的结果。
18.图3是用13种ror-βasirna处理y-79细胞后确认ror-β蛋白表达变化的结果。
19.图4是用13种ror-βasirna处理y-79细胞后确认ror-βmrna表达变化的结果。
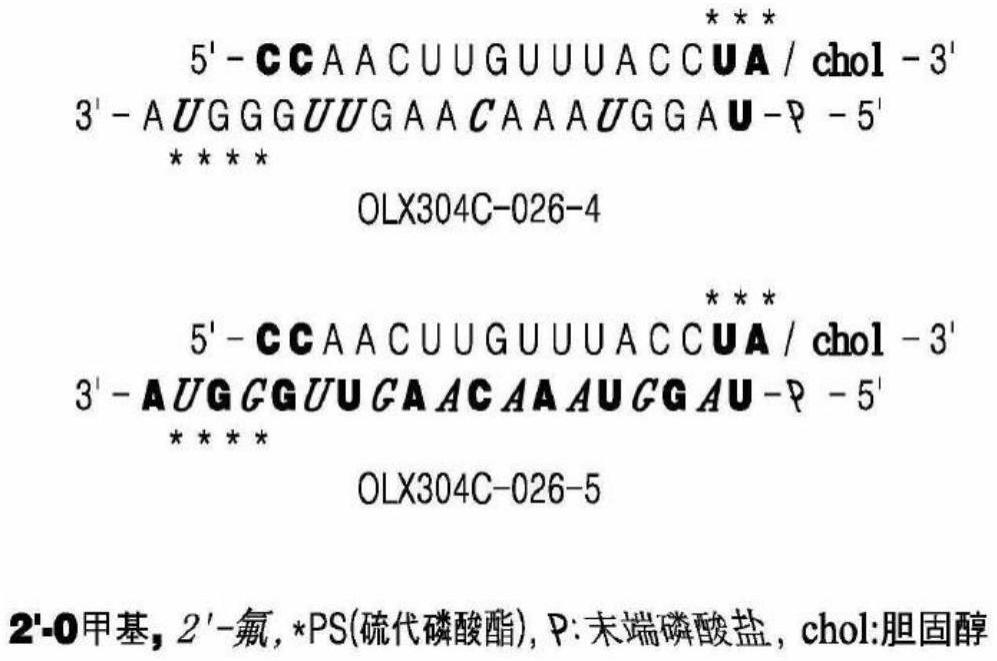
20.图5是用67种ror-βcp-asirna处理y-79细胞后确认ror-β蛋白表达变化的结果。
21.图6是用10种ror-βcp-asirna处理y-79细胞后确认ror-β蛋白表达变化的结果。
22.图7是通过ror-β质粒用10种cp-asirna处理瞬时表达ror-β的a549细胞后,确认ror-β蛋白表达变化的结果。
23.图8是通过ror-β质粒用5种cp-asirna处理瞬时表达ror-β的a549细胞后,确认ror-βmrna表达变化的结果。
24.图9是通过ror-β质粒用5种cp-asirna处理瞬时表达ror-β的a549细胞后,确认ror-β蛋白表达变化的结果。
25.图10示出ror-βcp-asirna 4(olx304c-026-4)和ror-βcp-asirna 5(olx304c-026-5)的序列和修饰信息(有义链:16mer,反义链:19mer)。图11是在正常小鼠眼球中处理两种ror-βcp-asirna(olx304c-026-4,olx304c-026-5)后,确认ror-β蛋白表达变化的结果。分别是(a)分离正常小鼠的视网膜组织后确认ror-β蛋白表达变化的结果,(b)分离正常小鼠的视网膜色素上皮细胞/脉络膜层后确认ror-β蛋白表达变化的结果。
26.图12是在正常小鼠眼球中按照剂量处理两种ror-βcp-asirna(olx304c-026-4,olx304c-026-26)后,确认视网膜组织中相对于不同剂量的ror-βmrna表达变化的结果。
27.图13是在正常小鼠眼球中按照剂量处理一种ror-βcp-asirna(olx304c-026-4)后,确认视网膜组织中相对于不同剂量的ror-βmrna表达抑制效果的持续时间的结果。
28.图14是在导入视网膜色素变性相关人类基因的小鼠模型中处理最佳剂量的两种ror-beta cp-asirna(olx304c-026-4,olx304c-026-26)后,通过眼球组织的h&e染色比较每个层厚度的结果。
29.图15是在导入视网膜色素变性相关人类基因的小鼠模型中处理最佳剂量的两种ror-beta cp-asirna(olx304c-026-4,olx304c-026-26)后进行视网膜电图(electroretinogram:erg)的结果,分别为(a)确认a波振幅变化的结果,(b)确认b波振幅变化的结果。
具体实施方式
30.本说明书中使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义相同的含义。除非另有定义。一般而言,本说明书中使用的命名法是本领域已知和常用的。
31.在本发明的详细描述中使用的主要术语的定义如下。
[0032]“rnai(rna interference;rna干扰)”是指,通过将由具有靶基因mrna的同源序列的链及其互补系列的链所组成的双链rna(dsrna)导入细胞等来诱导靶基因mrna的分解,从而抑制靶基因表达的机制。
[0033]“诱导rnai的核酸分子”是指能够以序列特异性方式介导所述rna干扰来抑制或下调基因表达或病毒复制的任意核酸分子。所述术语可指单个核酸分子、多个所述核酸分子或者所述核酸分子库。在一具体实施例中,所述用于诱导rnai的核酸分子可以是sirna。
[0034]“sirna(small interfering rna:小干扰rna)”是指,以序列特异性方式介导有效
基因沉寂(gene silencing)的短双链rna(dsrna)。
[0035]“反义链(antisense strand)”是指,对感兴趣的目标核酸实际或100%互补的多核苷酸,例如,可以与mrna(messenger rna)、非mrna的rna序列(例如,microrna、piwirna、trna、rrna以及hnrna)或者编码或非编码dna序列全部或部分互补。
[0036]“有义链(sense strand)”是指,具有与靶核酸相同的核酸序列的多核苷酸,并且是与mrna、非mrna的rna序列(例如,microrna、piwirna,、trna、rrna以及hnrna),或者与编码或非编码dna序列整体或部分相同的多核苷酸。
[0037]“基因”应被视作最广泛的含义,并且可以编码结构蛋白或调节蛋白。此时,调节蛋白包括转录因子、热休克蛋白或参与dna/rna复制、转录和/或翻译的蛋白质。在本发明中,作为表达抑制对象的靶基因是病毒基因组中固有的基因,其可以整合到动物基因或作为染色体外构成要素存在。例如,靶基因可以是hiv基因组上的基因。在此情况下,sirna分子可用于使哺乳动物细胞中hiv基因的翻译失活。
[0038]“视黄酸相关孤儿核受体(retinoid-related orphan nuclear receptor;
[0039]
ror-β)”是调节视网膜中视杆细胞和视锥细胞分化的重要转录因子,已知其发挥使光感受器前体分化为视杆细胞的nrl(neural retina leucine zipper)以及其下位基因nr2e3(nuclear receptor subfamily2、group e、member3)的上游调节剂作用。另一方面,报告指出ror-β基因缺陷的rorb-/-小鼠的nrl和nr2e3表达显着降低且视杆细胞相关基因减少,而视锥细胞相关基因表达增加,并且在由ror-beta和nrl诱导的视杆细胞分化信号调节中发挥重要作用。
[0040]
视网膜色素变性是一种因赋予视杆细胞特征的基因发生突变而破坏视杆细胞,并进一步破坏视锥细胞的疾病。意一项研究结果表明,当对光感受器功能重要的基因发生突变时,有害效果在完全分化的光感受器中达到最高。因此,ror-β是诱导向杆状细胞分化的nrl的上位基因,当其被敲除时,视杆细胞在形态上变为与视锥细胞相似的细胞,从而失去视杆细胞的功能,但即使是形态和功能改变的视杆细胞也能够防止视锥细胞进一步的损失,因此有望作为视网膜色素变性的疗法。
[0041]
本发明的目的可分为两个,第一个是设计靶向ror-β的sirna,并通过筛选选择最有效抑制ror-β的sirna,第二个是在没有载体的情况下将sirna传递至细胞内,并导入化学修饰以提高对核酸酶的抵抗力。为了通过由磷脂组成的细胞膜,必须很小或具有疏水性。然而,sirna的磷酸骨架带负电荷,因此其难以穿透细胞膜。此外,应通过提高对核酸酶的抵抗力,使其在血清中具有较长的寿命,从而使到达靶标的量足以有效引起rnai。因此,通过导入修饰克服了sirna的传递传问题。
[0042]
在本发明的一实施例中,首先,设计靶向ror-β的asirna,并在表达ror-β的细胞中转染asirna,从而选出敲低效率最优异的ror-βasirna。在选出的sirna中导入以下4种修饰,以修饰asirna具有细胞穿透能力以及对核酸酶的抵抗力。第一,将胆固醇添加到有义链的3’末端,使得sirna穿透细胞膜。第二,将有义链和反义链的5’末端或3’末端附近的磷酸骨架替换为硫代磷酸酯,以使其对核酸外切酶具有抵抗力,从而实现被细胞吸收以及在体内的sirna的生物利用。第三,通过用o甲基修饰糖的2’赋予核酸酶的抵抗力,并且通过降低sirna免疫原性而减少脱靶效应。第四,通过用氟修饰糖的2’赋予双链双链体稳定性,从而提高在血清中的稳定性,并实现体外和体内的有效沉寂。通过对sirna进行上述修饰,sirna
获得细胞穿透能力并在血清中停留更长时间,因此足量的sirna被传递至靶细胞,从而可以有效抑制基因。
[0043]
因此,本发明在一方面涉及一种用于诱导rnai的核酸分子,其特征在于包括包含与编码ror-β的mrna互补的序列的反义链以及与所述反义链形成互补键的有义链,并且所述反义链的5’末端和有义链的3’末端形成平端(blunt end)。本发明中的sirna是包括所有具有一般rnai(rna干扰)作用的所有物质的概念。rnai是1998年首次在秀丽隐杆线虫中发现的细胞内基因调控机制,已知其作用机理是引入细胞内的rna双链中的反义链与靶基因的mrna互补结合,从而诱导靶基因的分解。其中,sirna是一种在“体外”抑制基因表达的方法。理论上19bp至21bp的sirna可以选择性抑制几乎所有基因,因此可以研发成癌症、病毒感染等多种基因相关疾病的治疗药物,并且是目前最热门的新药研发候选技术。首次尝试在哺乳动物中使用sirna进行体内治疗是在2003年中期,此后大量报告显示有关体内治疗的针对应用研究的尝试。
[0044]
然而,与其可利用性相反,不断有报告指出sirna的副作用和缺点。为了研发出基于rnai的治疗药物,需要克服以下问题:1)缺乏有效的传递系统,2)脱靶效应,3)免疫反应的诱导,4)细胞内rnai机制的饱和等。尽管sirna是可直接调节靶基因表达的有效方法,但由于上述问题研发治疗药物遇到瓶颈。对此,,不对称sirna(asymmetric shorter duplex sirna,asirna)是不对称rnai诱导结构,其具有比现有sirna所具有的19 2结构短的双链。其克服了在现有sirna结构技术中发现的脱靶效应、rnai机制饱和tlr3免疫反应等问题,由此能够研发出副作用少的rnai新药。
[0045]
基于此,在一实施例中,提出一种包括有义链以及与所述有义链互补的反义链的不对称sirna,根据一实施例的sirna不引起脱靶效应、rnai机制饱和等问题,因此保持稳定且较高的传递效率,并且能够以所需程度有效抑制对ror-β靶基因的表达。
[0046]
在本发明中,所述用于诱导rnai的核酸分子的特征可以在于,所述有义链具有15nt至17nt的长度,并且所述反义链具有大于或等于18nt的长度。尽管不限于此,所述反义链的特征可以在于具有18nt至31nt的长度,优选具有18nt至23nt的长度。进一步优选地,所述有义链的长度为16nt,与其互补的反义链的长度为19nt、20nt、21nt或22nt,但不限于此。
[0047]
所述有义链的3’末端和反义链的5’末端形成平端。反义链的3’末端可以包括例如1nt至16nt的突出端。
[0048]
在本发明的一实施例中,为了抑制ror-β的表达,设计了62个ror-βasirna,并且在表达ror-β的细胞或一时表达ror-β的瞬时细胞中确认到mrna水平和蛋白质水平。
[0049]
在本发明中,所述有义链的特征可以在于选自由seq id no:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、101、103、105、107、109、111、113、115、117、119、121以及123所组成的组。
[0050]
具体地,所述有义链可以选自由例如seq id no:27、29、51、83、85、91、95、97、103、105、107、109以及115所组成的组,或者由seq id no:27、29、51以及109所组成的组,例如,seq id no:51或109。
[0051]
在本发明中,所述反义链的特征可以在于选自由seq id no:2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42,44,46,48,50,52,54,56,58,60,62,64,
66,68,70,72,74,76,78,80,82,84,86,88、90、92、94、96、98、100、102、104、106、108、110、112、114、116、118、120、122以及124所组成的组。
[0052]
具体地,所述反义链可以选自由例如seq id no:28、30、52、84、86、92、96、98、104、106、108、110以及116所组成的组,或者选自由seq id no:28、30、52以及110所组成的组,例如,seq id no:52或110。
[0053]
在本发明中,所述用于诱导rnai的核酸分子的有义链或反义链的特征可以在于包括至少一种化学修饰。
[0054]
常规的sirna由于磷酸盐骨架结构的高负电荷和高分子量等原因无法穿过细胞膜,并且在血液中迅速分解、去除,因此难以将用于诱导rnai的足够量传递至实际靶位点。目前,在体外传递时,已研发出利用阳离子脂质和阳离子聚合物的高效传递方法,但在体内时难以像在体外高效传递sirna,并且因体内存在的各种蛋白质相互作用而使sirna的传递效率下降。
[0055]
因此,本发明人通过在不对称sirna结构中导入化学修饰研发出一种具有自我传递能力的asirna构建体(cp-asirna),其可以在没有载体的情况下有效地传递至细胞内。
[0056]
在本发明中,所述有义链或反义链中的化学修饰可以包括选自由以下组成的组中的至少一种:在核苷酸内糖结构2’碳位中,oh基团被-ch3(甲基)、-och3(甲氧基)、-nh2、-f(氟)、-o-2-甲氧基乙基-o-丙基、-o-2-甲硫基乙基、-o-3-氨基丙基、-o-3-二甲基氨基丙基所取代;核苷酸内糖结构的氧被硫所取代;核苷酸键修饰为硫代磷酸酯、硼磷酸酯或膦酸甲酯;或者修饰为pna(peptide nucleic acid),lna(locked nucleic acid)或una(unlocked nucleic acid)形式;以及磷酸基团、亲脂性化合物或细胞穿透肽键。
[0057]
在本发明中,所述亲脂性化合物的特征可以在于选自由胆固醇、生育酚、硬脂酸、视黄酸、dha、棕榈酸、亚油酸、亚麻酸以及具有10个或更多个碳原子的长链脂肪酸所组成的组。优选特征可以在于其是胆固醇,但不限于此。
[0058]
在一具体实施例中,所述有义链可包括选自以下的至少一种化学修饰:3’末端附近的两个至四个核苷酸键修饰为硫代磷酸酯、硼磷酸酯或膦酸甲酯;两个或更多个核苷酸内糖结构2’碳位中,oh基团被-ch3(甲基)、-och3(甲氧基)、-nh2、-f(氟)、-o-2-甲氧基乙基-o-丙基、-o-2-甲硫基乙基、-o-3-氨基丙基、-o-3-二甲基氨基丙基所取代;亲脂性化合物或细胞穿透肽与3'末端结合。
[0059]
在一具体实施例中,所述反义链可包括选自以下的任意一种或多种化学修饰:3’末端附近的三个至五个核苷酸键修饰为硫代磷酸酯、硼磷酸酯或膦酸甲酯;两个或更多个核苷酸内糖结构2’碳位中,oh基团被-ch3(甲基)、-och3(甲氧基)、-nh2、-f(氟)、-o-2-甲氧基乙基-o-丙基、-o-2-甲硫基乙基、-o-3-氨基丙基、-o-3-二甲基氨基丙基所取代;磷酸基团或细胞穿透肽与5'端结合。在另一具体实施例中,所述用于诱导rnai的核酸分子的特征可以在于包括选自由以下组成的组中的至少一种修饰:在有义链或反义链的两个或更多个核苷酸内糖结构2’碳位中,oh基团被-och3(甲氧基)或-f(氟)所取代的修饰;在有义链或反义链中,10%或更高的核苷酸键被修饰为硫代磷酸酯;胆固醇或棕榈酸与有义链的3’末端结合;以及磷酸基团与反义链的5’末端结合。
[0060]
优选地,所述有义链的特征可以在于其为选自由下表1(a)至(l)所组成的组中的任一种,反义链的特征可以在于其为选自由下表1(m)至(x)所组成的组中的任一种。
[0061]
【表1】
[0062] 序列(5
′
》3
′
)(a)mcmcaacuuguuuacc*mu*ma*chol(b)mccmaamcumugmuumuamcc*mu*a*chol(c)mccmamacuumguuumacc*u*ma*chol(d)mcmcaamcmumugmumumuamcmc*mu*a*chol(e)mcfcmafamcfumufgmufumufamcfc*mu*fa*chol(f)mcmagaagcuucagga*ma*ma*chol(g)mcamgamagmcumucmagmga*ma*a*chol(h)mcmamgmamamgcuucmamgmgma*ma*ma*chol(i)mcagaagmcmumumcagga*a*a*chol(j)mcmamgmamamgfcfufufcmamgmgma*ma*ma*chol(k)mcfamgfamafgmcfumufcmafgmgfa*ma*fa*chol(l)mcmcaacuuguuuacc*mu*ma*pa(m)p-muamggmuamaamcamagmuumg*g*mg*u*ma(n)p-muagguaaacmamamguumg*mg*mg*u*ma(o)p-muaggmuaaamcaagmuug*g*g*mu*a(p)p-muaggfuaaafcaagfufug*g*g*fu*a(q)p-mufamgfgmufamafamcfamafgmufumg*fg*mg*fu*ma(r)p-muumucmcumgamagmcumucmu*g*mg*a*mc(s)p-muuuccugamamgmcmumucmu*mg*mg*ma*mc(t)p-muuuccumgmamamgcuucu*mg*mg*ma*c(u)p-muuuccugaagmcmumucmu*g*g*a*mc(v)p-mufufufcfcfumgmamamgfcfufufcfu*mg*mg*ma*fc(w)p-mufufufcfcfugaagfcfufufcfu*g*g*a*fc(x)p-mufumufcmcfumgfamafgmcfumufcmu*fg*mg*fa*mc
[0063]
在所述序列中,*指硫代磷酸酯键,m指2
’‑
0-甲基,2
’‑
f-指2
’‑
氟(fluoro),chol指胆固醇,pa指棕榈酸,p指5
’‑
磷酸基团。
[0064]
具体地,所述有义链可以是上表1的(a)至(e)、(1)中的任一个,并且所述反义链可以是上表1的(m)至(q)中的任一个;所述有义链可以是上表1的(f)至(k)中的任一个,并且所述反义链可以是上表1的(r)至(x)中的任一个;所述有义链可以是上表1的(a)或(l),并且所述反义链可以是上表1的(p)或(q)。
[0065]
在本发明中,一个至三个磷酸基团可以与所述反义链的5’末端结合,但不限于此。
[0066]
在本发明的一实施例中,有义链统一地在3’末端中的三个磷酸键被硫代磷酸酯键取代,并添加了胆固醇或棕榈酸。反义链统一地在3’末端中的四个磷酸键被硫代磷酸酯键取代。此外,通过改变糖2’的o甲基和氟(fluoro)的取代数量和取代位置,合成了12条有义链和12条反义链。共以68中情况进行退火处理,选出在没有载体的情况下最好地击倒ror-β的修饰,并选择了最有效地击倒ror-β的ror-βcp-asirna。
[0067]
本发明另一方面涉及一种用于改善或治疗视网膜疾病的药物组合物,其包括所述
用于诱导rnai的核酸分子。
[0068]
在本发明中,所述视网膜疾病的特征可以在于,其为usher综合征、stargardt病、巴尔得-别德尔综合征、贝斯特氏病、脉络膜缺损、脉络膜视网膜萎缩、视网膜色素变性、视网膜黄斑变性、先天性黑蒙、bcm(blue-cone monochromacy)、视网膜劈裂症、ml(malattia leventinese)、小口氏病或雷夫叙姆病,但不限于此。
[0069]
所述药物组合物可以除了作为活性成分的用于诱导rnai的核酸分子之外,通过进一步包括至少一种药学上可接受的载体来制备。药学上可接受的载体应与本发明的活性成分相容,并且可以混合盐水、无菌水、林格氏溶液、缓冲盐水、葡萄糖溶液、麦芽糖糊精溶液、甘油、乙醇以及这些成分中的一种或者两种或更多种来使用,并且可以根据需要添加抗氧化剂、缓冲剂、抑菌剂等其它常规添加剂。此外,还可通过添加稀释剂、分散剂、表面活性剂、粘合剂以及润滑剂配制成配制水溶液、悬浮液、乳液等注射用制剂。特别地,优选配制成冻干形式的制剂后提供。为了制备冻干制剂,可以使用本发明所属领域常规已知的方法,并且可以添加用于冻干的稳定剂。
[0070]
所属领域技术人员可以根据常规患者的症状和疾病的严重程度来确定所述药物组合物的施用方法。此外,可以配制成散剂、片剂、胶囊剂、溶液剂、注射剂、软膏剂、糖浆剂等多种制剂,并且能够以单位剂量或多剂量容器来提供,例如密封的安瓿和瓶子。
[0071]
本发明的药物组合物可以口服或肠胃外施用。根据本发明的组合物的施用途径不限于此,但可以是例如,玻璃体腔注射(ivt)、口腔、静脉内、肌肉内、动脉内、骨髓内、硬脑膜内、心脏内、经皮、皮下、腹腔内、肠内,舌下或局部施用。根据本发明的组合物剂量根据患者的体重、年龄、性别、健康状况、饮食、施用时间、施用方法、排泄率或患病程度等而具有多种范围,所属领域的技术人员可以容易地进行确定。此外,可以使用已知技术将本发明的组合物配制成适当的制剂,以用于临床施用。
[0072]
本发明另一方面涉及一种改善或治疗视网膜疾病的方法,其包括将所述用于诱导rnai的核酸分子施用于个体。包括在根据本发明的改善或治疗方法中的构成要素与以上描述的发明包括的构成要素相同,因此上述描述也可以相同地适用于改善或治疗方法。
[0073]
术语“施用”可以是指,使根据一具体实施例的用于诱导rnai的核酸分子至少部分定位到所需部位的方法或者使根据一具体实施例的用于诱导rnai的核酸分子通过途径配置到个体内。
[0074]
所述“个体”可以是哺乳动物,例如人、牛、马、猪、狗、羊、山羊、猴或猫。所述个体可以是需要改善视网膜色素变性等视网膜疾病的个体,例如需要ror-β基因表达抑制效果的个体。
[0075]
本发明另一方面涉及一种所述用于诱导rnai的核酸分子的用途,所述用于诱导rnai的核酸分子用于制备改善或治疗视网膜疾病的药物。在所述用途中,用于视网膜疾病、改善、治疗、用于诱导rnai的的核酸分子如上所述。
[0076]
以下,通过实施例进一步详细描述本发明。这些实施例仅用于示例性描述本发明,所属领域技术人员能够理解本发明的范围不应解释为受限于这些实施例。
[0077]
实施例1:靶向ror-β的62种rnai诱导双链核酸分子
[0078]
在本实施例中,设计了用于筛选的ror-β不对称sirna(asirna)。常规sirna是在两条链3’中具有两个核苷酸突出端的19个碱基对的双链体。asirna中反义链的5’为平端,并
且具有15个至16个碱基对的短双链体,因此表现出与sirna相等的抑制效率,并且由于缩短的有义链长度而具有降低的脱靶效应。因此,设计成16mer(有义链)至19mer(反义链)的asirna(图1)。
[0079]
为了进行动物实验,ror-βasirna考虑到智人(人)、小家鼠(小鼠)、穴兔(兔)、猕猴(猴)的同源性而设计,并且与这些物种100%一致的序列。下表2示出62个ror-βasirna的序列。
[0080]
【表2】
[0081]
[0082]
[0083]
[0084][0085]
实施例2:筛选靶向ror-β的rnai诱导双链核酸分子
[0086]
在本实施例中,为了证实所述实施例1的ror-βasirna的表达抑制效果,将10nm的不对称sirna转染到y-79细胞(atcc)后,通过蛋白质印迹法检测了ror-β蛋白的表达水平。具体地,将y-79细胞以1
×
105cells/well接种到12孔板中,然后使用lipofectamine rnaimax transfection reagent(invitrogen,13778030)按照invitrogen提供的方案转染48小时10nm的asirna。此后,破碎转染的细胞后获得细胞裂解物,并进行蛋白质印迹法。针对所述获得的细胞裂解物,使用12% sds-聚丙烯酰胺凝胶、ror-β抗体(proteintech,cat.#17635-1)、以及vinculin抗体(santa cruz biotechonology,cat.#sc-73614)按照每个制造商的方案检测了ror-β蛋白的表达水平。在本实施例中,阴性对照组利用了未处理组。
[0087]
结果如图2所示,证实了根据ror-βasirna处理的ror-β蛋白的表达抑制效果。具体地,在62个ror-βasirna中,确认到13个(#14、#15、#26、#42、#43、
[0088]
#46、#48、#49、#52、#53、#54、#55、#58)表现出优异的ror-β蛋白表达抑制效果的不对称sirna。
[0089]
实施例3:确认针对导出的asirna的ror-β表达抑制效率
[0090]
3.1.确认ror-β蛋白表达抑制效果
[0091]
在本实施例中,为了证实从所述实施例2推导出的ror-βasirna(#14、#15、
[0092]
#26、#42、#43、#46、#48、#49、#52、#53、#54、#55、#58)的蛋白质表达抑制效果,将1nm或5nm的不对称sirna转染到y-79细胞(atcc)后,通过蛋白质印迹法检测了ror-β蛋白的表达水平。具体地,将y-79细胞以1
×
105cells/well接种到12孔板中,然后使用lipofectamine rnaimax transfection reagent(invitrogen,13778030)按照invitrogen提供的方案转染48小时1nm或5nm的asirna。此后,破碎转染的细胞后获得细胞裂解物,并进行蛋白质印迹法。通过与实施例2相同的方法针对所述获得的细胞裂解物,利用12%sds-聚丙烯酰胺凝胶、ror-β抗体(proteintech,cat.#17635-1)以及vinculin抗体(santa cruz biotechonology,cat.#sc-73614)按照每个制造商的方案检测了ror-β蛋白的表达水平。在本实施例中,阴性对照组利用了未处理组。
[0093]
结果如图3所示,证实了根据ror-βasirna处理的浓度依赖性的ror-β蛋白的表达抑制效果。特别地,以1nm处理结果为准,在#14、#26和#55中观察到约50%或更高的蛋白质表达抑制。
[0094]
3.2.确认ror-βmrna表达抑制效果
[0095]
在本实施例中,为了证实从所述实施例2推导出的ror-βasirna(#14、#15、#26、#42、#43、#46、#48、#49、#52、#53、#54、#55、#58)的mrna表达抑制效果,将1nm或10nm的不对称sirna转染到y-79细胞(atcc)后,通过实时荧光定量pcr检测了ror-βmrna的表达水平。具体地,将y-79细胞以6
×
104cells/well接种到24孔板中,然后使用lipofectamine rnaimax transfection reagent(invitrogen,13778030)按照invitrogen提供的方案转染24小时1nm或10nm的asirna。然后,利用tri-rna reagent(favorgen,fatrr001)提取总rna后,使用high-capacity cdna反转录试剂盒(applied biosystems,4368813)合成了cdna。然后,利用gene expression assays(applied biosystems)的ror-β(hs00199445_m1)以及rn18s1(hs03928985_g1)、probe qpcr mix(toyobo,qps-101),通过cfx connect实时荧光定量pcr检测系统(biorad)检测了ror-βmrna的表达水平。使用rn18s1标准化ror-βmrna的表达水平,并且阴性对照组利用了未处理组。
[0096]
如图4所示,证实根据ror-βasirna的ror-βmrna的表达抑制效果。特别地,以1nm处理结果为准,在#15、#26和#55中观察到约60%或更高的mrna表达抑制。总结本实施例3的结果,推导出ror-βmrna和蛋白质表达抑制功效优异的前三种序列均包括的两种序列(#26、#55)。
[0097]
实施例4:设计并制备导入化学修饰的不对称sirna
[0098]
在本实施例中,针对在所述实施例3中已证实表达抑制效果的ror-βasirna中的两种(#26、#55),设计了导入化学修饰的不对称sirna(cell penetrating-asymmetric sirna:cp-asirna)。与所述asirna相比,通过本实施例设计的cp-asirna经多种化学修饰
(2'ome,ps,fluoro),其为向细胞内的传递得到提高的不对称sirna。
[0099]
在本实施例中制备的共67种cp-asirna的序列信息如下表3所示。
[0100]
【表3】
[0101]
[0102]
[0103]
[0104][0105]
[0106]
另一方面,在所述表3中,由“*”、“m”、“f”以及“chol”所表示的化学修饰如下表4所示。
[0107]
【表4】
[0108]
标记方法化学修饰*硫代磷酸酯键m2
’‑
o-甲基f2’氟chol胆固醇
[0109]
具体地,在所述表3中,“*”表示现有的磷酸二酯键被硫代磷酸酯键取代的形态,“m”表示现有的2
’‑
oh被2
’‑
0-甲基取代的形态。另外,“f”是指,例如以fg为例,现有的g(鸟嘌呤)的2
’‑
0h被氟取代的形态,“chol”是指胆固醇添加到3’末端的形态。
[0110]
实施例5:筛选导入化学修饰的不对称sirna
[0111]
5.1确认ror-β蛋白表达抑制效果
[0112]
在本实施例中,为了确认所述实施例4的ror-βcp-asirna的表达抑制效果,将各cp-asirna处理到y-79细胞并进行孵育(free uptake)后,通过蛋白质印迹法检测了ror-β蛋白的表达水平。具体地,将y-79细胞以1
×
105cells/well接种到12孔板中,经过24小时后在其中添加1μmξ
á
cp-asirna,然后再包括10%fbs(fetal bovine serum,gibco,16000-044)的rpmi(gibco,11875-093)培养基条件下孵育细胞(free uptake)。经过48小时后,破碎转染的细胞后获得细胞裂解物,并进行蛋白质印迹法。针对所述获得的细胞裂解物,使用12%sds-聚丙烯酰胺凝胶、ror-β抗体(proteintech,cat.#17635-1)、以及vinculin抗体(santa cruz biotechonology,cat.#sc-73614)检测了ror-β蛋白的表达水平。在本实施例中,阴性对照组使用了未处理组,阳性对照组使用了通过lipofectamine rnaimax以10nm的浓度对未导入化学修饰的ror-βasirna进行转染的组。
[0113]
结果如图5所示,证实了根据ror-βcp-asirna处理的ror-β蛋白的表达抑制效果。特别地,确认了其中表现出优异ror-β蛋白表达抑制效果的十种(4、5、6、10、24、25、32、43、52、53)ror-βcp-asirna。
[0114]
为了再次确认10种cp-asirna的ror-β蛋白抑制效果,通过相同过程以2μm浓度进行处理后检测了ror-β蛋白的表达水平。结果如图6所示,证实了根据ror-βcp-asirna处理的ror-β蛋白的表达抑制效果。特别地,在其中的cp-asirna4、5、10、24、25、32和52中证实了ror-β蛋白表达抑制效果的再现性。
[0115]
5.2.确认ror-β条件下的ror-β蛋白抑制效果
[0116]
在本实施例中,使用ror-β质粒(origene,rc208666)确认了在一时表达ror-β的细胞(transient cell line)中cp-asirna的蛋白抑制效果。更具体地,利用添加有10%fbs的ham's f-12k(kaighn's)培养基(gibco,21127022),将a549细胞以每孔5
×
104个接种到12孔板中,经过24小时后在lipofectamine2000(invitrogen,11668-019)和opti-mem还原血清培养基(gibco,31985-070)中孵育200ng的ror-β质粒后,用细胞进行处理。6小时后使用pbs进行板清洗,然后在opti-mem还原血清培养基条件下与1μm的cp-asirna一同孵育(free uptake)了24小时。第二天换成ham's f-12k(kaighn's)培养基(10%fbs),在经过1天后破碎细胞获得细胞裂解物,然后使用12%sds-聚丙烯酰胺凝胶、ror-β抗体(proteintech,
cat.#17635-1)、vinculin抗体(santa cruz biotechonology,cat.#sc-73614)以及新霉素磷酸转移酶2抗体(invitrogen,cat.ma5-15275)检测了ror-β蛋白的表达水平。在本实施例中,新霉素磷酸转移酶2抗体用作质粒转染的对照组,阴性对照组利用了处理ror-β质粒的cp-asirna未处理组。
[0117]
结果如图7所示,证实比未处理组更高的蛋白表达抑制效果。特别地,确认到本实施例的结果表现出与实施例5.1的y-79细胞株中ror-β蛋白抑制效果相似的趋势,总结实施例5.1和5.2的结果确认到ror-β蛋白表达抑制效果优异的五种cp-asirna(4、5、10、24、25)。
[0118]
实施例6:确认针对导出的cp-asirna的ror-β表达抑制效率
[0119]
6.1.确认ror-βmrna表达抑制效果
[0120]
在本实施例中,为了确认在所述实施例5中导出的五种ror-βcp-asirna(4、5、10、24、25)的ror-βmrna表达抑制效果,在一时表达ror-β的a549细胞株中处理200nm或500nm的cp-asirna后,通过实时荧光定量pcr检测了ror-βmrna的表达水平。具体地,将a549细胞以8
×
103cells/well接种到96孔板中,第二天在lipofectamine 2000(invitrogen,11668-019)和opti-mem还原血清培养基(gibco,31985-070)中孵育10ng的ror-β质粒后,用细胞进行了处理。6小时后使用pbs进行板清洗,然后在opti-mem还原血清培养基条件下与200nm或500nm的cp-asirna一同孵育(free uptake)了24小时。然后,利用superprep ii cell lysis&rt kit for qpcr(toyobo,scq-101)按照制造商的方案从细胞裂解物中合成cdna后,利用gene express ion assays(applied biosystems,ror-beta;hs00199445_m1,rn18s1;s03928985_g1),probe qpcr mix(toyobo,qps-101)以及cfx connect实时荧光定量pcr检测系统(bio-rad),分析了作为由定量实时逆转录聚合酶链反应(qrt-pcr)的靶mrna的ror-β的表达水平。在本实施例中,阴性对照组使用了已处理ror-β质粒的cp-asirna未处理组,阳性对照组使用了通过lipofectamine rnaimax以10nm的浓度对未导入化学修饰的ror-βasirna进行转染的组。
[0121]
结果如图8所示,证实五种cp-asirna均在以500nm的浓度处理时表现出大于或等于80%的mrna表达抑制效果,并且在以200nm的浓度处理时表现出大于或等于70%的mrna表达抑制效果。
[0122]
6.2.确认ror-β蛋白表达抑制效果
[0123]
在本实施例中,为了确认在所述实施例5中导出的五种ror-βcp-asirna(4、5、10、24、25)的ror-β蛋白表达抑制效果,在一时表达ror-β的a549细胞株中处理200nm或500nm的cp-asirna后,通过蛋白质印迹法检测了ror-β蛋白的表达水平。具体地,利用添加有10%fbs的ham's f-12k(kaighn's)培养基(gibco,21127022),将a549细胞以每孔5
×
104个接种到12孔板中,经过24小时后在lipofectamine 2000(invitrogen,11668-019)和opti-mem还原血清培养基(gibco,31985-070)中孵育200ng的ror-β质粒后,用细胞进行处理。6小时后使用pbs进行板清洗,然后在opti-mem还原血清培养基条件下与200nm或500nm的cp-asirna一同孵育(free uptake)了24小时。第二天替换成ham's f-12k(kaighn's)培养基(10%fbs),1天后通过与所述实施例5.2相同的方法检测了ror-β蛋白的表达水平。在本实施例中,阴性对照组使用了已处理ror-β质粒的cp-asirna未处理组,阳性对照组使用了通过lipofectamine rnaimax以10nm的浓度对未导入化学修饰的ror-βasirna进行转染的组。
[0124]
结果如图9所示,证实了根据ror-βcp-asirna处理的ror-β蛋白的表达抑制效果。
特别地,在其中最终导出ror-β蛋白抑制效果优异的cp-asirna4和5。图10示出cp-asirna为4和5的olx304c-026-4和olx304c-026-5。
[0125]
实施例7:在正常小鼠眼球中确认ror-β蛋白表达抑制效果
[0126]
在本实施例中,为了确认在所述实施例6中导出的两种ror-βcp-asirna(olx304c-026-4,olx304c-026-5)在体内是否也具有高的ror-β蛋白表达抑制效果,将olx304c-026-4或olx304c-026-5施用于正常小鼠的眼球中,然后通过蛋白质印迹法检测了ror-β蛋白的表达水平。具体地,通过玻璃体腔注射以0.6μg/μl的剂量在8周龄的雄性c57b16小鼠的双眼中施用1μl的olx304c-026-4或olx304c-026-5。使用过程具体为,在滴注mydrin-p滴眼液(santen,e00170121)后,使用0.3ml的31g胰岛素注射器(bd,328822)腹腔注射麻醉剂进行麻醉后,滴注爱尔凯因(alcaine)滴眼液(alcon,e07370271)进行了眼球麻醉。用手术显微镜(leica,m844 f40)确认已出现散瞳和麻醉的小鼠眼球的同时,用0.3ml的31g胰岛素注射器在眼球的巩膜上制造了一个小孔。施用附着有microthin dual gauge needle with taper 90
°
(35g)(ito co.,dwg.no.5-0608)的10μl的exmire微量注射器(ito co,ms*ne10u)分别施用了1μl的olx304c-026-4或olx304c-026-5。涂布maxitrol眼膏(alcon,e07370151)防止炎症,并为了保持体温,在加热垫上等待麻醉消退。施用第7天摘除眼球,分别分离视网膜和视网膜色素上皮细胞(rpe)/脉络膜层后提取蛋白质。在8% sds-聚丙烯酰胺凝胶中以每孔20μg电泳萃取的蛋白质后,确认了ror-β(17635-1-ap,1:500)、黏着斑蛋白(vinculin)(sc-73614,1:2000)。
[0127]
结果如图11所示,当用0.6μg剂量处理时,olx304c-026-4和olx304c-026-5均在正常小鼠视网膜组织中表现出60%至78%的ror-β蛋白表达抑制效果,同样地,在rpe/脉络膜层中也表现出约40%的蛋白质抑制效果。
[0128]
实施例8:在正常小鼠眼球中确认相对于不同施用剂量的ror-βmrna表达抑制效果
[0129]
在本实施例中,为了确认在所述实施例6中导出的两种ror-βcp-asirna之一的olx304c-026-4以及在olx304c-026-4的有义链3’末端添加棕榈酸而取代胆固醇后另外合成的olx304c-026-26是否在体内具有高的ror-βmrna表达抑制效果,将olx304c-026-4或olx304c-026-26施用于正常小鼠的眼球后,通过实时荧光定量pcr检测了ror-βmrna的表达水平。具体地,除了通过玻璃体腔注射(ivt)向7周龄雄性c57bl6的双眼以0.4μg/μl、0.4μg/μl、1.0μg/μl的olx304c-026-4,以及0.4μg/μl、1.0μg/μl、4.0μg/μl的olx304c-026-26剂量共施用1μl之外,与所述实施例7相同的过程进行,并在施用第7天摘除眼球后从视网膜组织中提取了rna。使用rneasy plue mini kit(qiagen,74136)并按照制造商的方案进行了rna提取。提取的rna使用high-capacity cdna反转录试剂盒(applied biosystems
tm
,4368814)按照制造商的方案进行cnda合成,然后利用tbpremix ex taq
tm
ii(takara,rr820b)产品和cfx connect real-time pcr detection system(bio-rad)分析了作为因qrt-pcr的靶mrna的ror-β的表达水平。使用ror-β(f:5`-tgcccaagtccgaaggttatt-3`(seq id no:125),r:5`-ccatgccagctgatggagtt-3`(seq id no:126),gapdh(f:5`-gggtgtgaaccacgagaaat-3`(seq id no:127),r:5`-gtcatgagcccttccacaat-3`(seq id no:128))引物进行了qrt-pcr。
[0130]
结果如图12所示,证实两种cp-asirna均以剂量依赖性地表现出ror-βmrna表达抑制效果,并且olx304c-026-4在1.0μg时表现出约97%的表达抑制效果,olx304c-026-26在
4.0μg时表现出约87%的表达抑制效果。
[0131]
【表5】
[0132][0133]
在所述表5中,由“*”、“m”、“f”以及“pa”所表示的化学修饰如下表6所示。
[0134]
【表6】
[0135]
标记方法化学修饰*硫代磷酸酯键m2
’‑
o-甲基f2’氟pa棕榈酸
[0136]
实施例9:在正常小鼠眼球中确认ror-βmrna表达抑制效果的持续时间在本实施例中,为了确认在所述实施例7中导出的两种ror-βcp-asirna之一的olx304c-026-4的ror-βmrna抑制效果持续时间,将olx304c-026-4施用于正常小鼠眼球后,通过实时荧光定量pcr检测了ror-βmrna的表达水平。具体地,出了通过玻璃体腔注射以1.0μg/μl或2.0μg/μl的剂量在7周龄的雄性c57b16小鼠的眼球施用1μl的olx304c-026-4后,在施用第14天、第21天或第28天摘除眼球后从视网膜组织中提取rna之外,与所述实施例8相同的方法进行了实验。结果如图13所示,olx304c-026-4在施用2μg后到第28天还保持着约44%的ror-βmrna表达抑制效果。确认到比起施用1μg时,施用2μg时长时间保持的功效更加显着,并且在施用第28天后,在两种剂量中表现出相似的ror-βmrna表达抑制效果。此外,确认到当以1μg施用时,直到第3周表现出约50%或更高的ror-βmrna表达抑制效果。
[0137]
实施例10:在视网膜色素变性(rp)疾病小鼠模型中确认治疗效果
[0138]
在本实施例中,通过施用在所述实施例8中得到验证的最佳ror-βmrna表达抑制剂量,在视网膜色素变性疾病小鼠模型中进行功效试验。具体地,在实验中使用了已知是代表性视网膜色素变性疾病小鼠模型的rhop23h敲入小鼠的杂合子。根据所述实施例8的结果,施用1.0μg的olx304c-026-4以及4.0μg的olx304c-026-26之后,于第21天进行眼球组织分析和视网膜电图(erg)检验,以确认治疗效果。与实施例8相同地在眼球腔中注射olx304c-026-4或olx304c-026-5,并且利用石蜡切片获得的组织切片通过自动载玻片染色机进行了h&e染色。在拍摄一天前将小鼠放入暗室进行暗适应,并在保持无光的状态下进行了erg成像。与实施例8相同地进行散瞳和麻醉,然后将接地电极固定在尾巴正上方的皮肤上,参比电极固定在前额上。在眼球中涂布2%hicell灭菌液(samil-pharm,a05050401),并调整位置以使眼球很好地与ganzfeld erg(phoenix,micron ganzfeld erg)仪器接触,然后从低强度的光刺激到高强度的光刺激依次进行了成像。
[0139]
结果如图14所示,在olx304c-026-4和olx304c-026-26中通过眼球组织的h&e染色比较每个层厚度的结果显示,证实施用olx304c-026-4和olx304c-026-26的眼球组织的厚度显着增加。比起对照组,特别是感光细胞主要所在的onl(outer nuclear layer)厚度的
增加可能与视觉功能的恢复有关,由此可知,施用olx304c-026-4或olx304c-026-26可保护onl层免于瓦解。
[0140]
与此相同地,在示出erg检测结果的图15中,在施用olx304c-026-4或olx304c-026-26的组中,损伤的a波分别恢复约25%、25%,b波分别恢复约42%、65%,相比对照组显着得到恢复。这是一种在视网膜色素变性患者中将具有各种遗传缺陷的视杆细胞转化为视锥细胞的策略,这表明可通过玻璃体腔注射靶向ror-β的olx304c-026-4或olx304c-026-26来延缓或治疗视觉损伤。
[0141]
以上,对本发明的特定部分进行了详细说明,对于所属领域的技术人员而言显而易见的是这些具体技术仅仅是优选的实施方式,本发明的范围不限于此。因此,本发明的实际范围由所附权利要求及其等同物而定义。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。