1.本发明属于生物医药领域,更具体而言,本发明涉及一种白蛋白/乳铁蛋白嵌合纳米粒,及其制备方法和用于制备药物的用途。
背景技术:
2.脑胶质瘤是中枢神经系统最普遍的原发性肿瘤,其中恶性程度较高的iii/iv级恶性脑胶质瘤(如胶质母细胞瘤)约占50%,平均总生存期仅12-18个月,预后极差。目前的一线治疗方法仍然无法有效地延长患者生存期。
3.脑胶质瘤治疗手段受限、疗效差的主要原因可总结为以下几点:1、血脑屏障阻碍了大部分的外源物质进入。2、脑胶质瘤的异质性使得对化疗药物、放射治疗等响应率低。3、肿瘤复杂的肿瘤免疫微环境(tumor immune microenvironment,time)对肿瘤细胞生长起着关键的支撑作用,同时还保护着肿瘤细胞免受药物攻击。4、联合治疗具有许多优势,但是当前的联合疗法仍处于依赖临床经验的探索性模式。药物由于理化性质的差异使得体内的命运不同步。近年来对脑胶质瘤药物治疗的研究进展较为缓慢,最近一个获fda批准治疗脑质瘤的药物贝伐单抗(bevacizumab)疗效仍不尽如人意。
4.白蛋白是含量最丰富的血浆蛋白,在生理情况下作为载体运输许多内源性和外源性物质,同时白蛋白是肿瘤细胞生长的主要营养来源。因此,白蛋白是一种理想的肿瘤靶向仿生载体,可用于药物递送并改善药物的体内命运。
5.白蛋白结合蛋白——sparc(富含半胱氨酸的分泌蛋白)具有重要的作用,由于许多肿瘤过表达sparc,白蛋白是sparc特异性的底物,能介导白蛋白递药系统优先在肿瘤组织中积累。基于白蛋白的递药系统已被成功的用于小鼠脑胶质瘤模型的治疗,借助sparc的靶向作用使白蛋白纳米粒有效的富集于脑胶质瘤附近,同时在纳米粒上修饰穿膜肽(低分子量鱼精蛋白),从而实现高效的bbb穿透和肿瘤内渗透(lin t,zhao p,jiang y,et al.blood-brain-barrier-penetrating albumin nanoparticles for biomimetic drug delivery via albumin-binding protein pathways for antiglioma therapy[j].acs nano,2016,10(11):9999-10012.)。
[0006]
脑毛细血管内皮细胞上高表达低密度脂蛋白相关蛋白(lrp),而乳铁蛋白(lactoferrin,lf)是lrp-1(又叫cd91)和lrp-2(又叫megalin)的天然底物。lf的跨bbb是特异性单向转运过程。此外,lrp在脑胶质瘤细胞表面高表达。因此,lf被广泛用于脑胶质瘤仿生递药。但是,lf的血浆浓度低(约5nmol/l),且体内半衰期极短(约10min)。因此基于乳铁蛋白的递药系统可能被机体快速清除,长期用药可能有潜在的风险。
[0007]
有鉴于此,特提出本发明。
技术实现要素:
[0008]
为解决现有技术中存在的技术问题,本发明人进行了广泛深入的研究,最终得到本发明。
[0009]
本发明的一个目的是提供一种白蛋白/乳铁蛋白嵌合纳米粒。
[0010]
本发明的另一个目的是提供一种上述白蛋白/乳铁蛋白嵌合纳米粒的制备方法。
[0011]
本发明的再一个目的是提供一种上述白蛋白/乳铁蛋白嵌合纳米粒在药物制备中的用途。
[0012]
为了实现本发明的上述目的,特采用以下技术方案:
[0013]
根据第一方面,本发明提供了一种白蛋白/乳铁蛋白嵌合纳米粒,所述白蛋白/乳铁蛋白嵌合纳米粒主要由白蛋白、乳铁蛋白和任选的药物活性成分制成;
[0014]
其中,白蛋白和乳铁蛋白的质量比为7~9:3~1(例如7:3、7:2、7:1、8:3、8:2、8:1、9:3、9:2、9:1),优选为7:3;
[0015]
优选地,所述白蛋白/乳铁蛋白嵌合纳米粒的粒径约为50-500nm,优选为100-300nm,更优选为130-170nm。
[0016]
粒径由激光粒度仪测得。
[0017]
需要注意的是,“白蛋白/乳铁蛋白嵌合纳米粒”中的“/”表示“和”的含义,“嵌合纳米粒”表示白蛋白和乳铁蛋白在高压均质的物理剪切力作用下,蛋白结构被破坏,两种蛋白中疏水性氨基酸与任选的疏水性药物和磷脂自组装形成疏水核,而亲水性氨基酸部分则分布于疏水核周围,使得两种蛋白的结构相互嵌合到一起,形成统一的整体。
[0018]
对白蛋白没有特别的限制,可以为本领域中已知的用于制备纳米粒的任何白蛋白,优选为牛血清白蛋白。
[0019]
进一步的,药物活性成分选自具有抗肿瘤活性的药物活性成分,包括但不限于,阿霉素、米托蒽醌、槲皮素、紫草素、雷公藤红素、藤黄酸、双硫仑、双硫仑/铜络合物等中的一种或多种。
[0020]
在一些实施方式中,药物活性成分为紫草素和/或双硫仑,最优选为紫草素和双硫仑。特别地,双硫仑和紫草素的质量比为0.5~8:1(例如0.5:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1),优选为2:1。
[0021]
紫草素(shikonin,shk)是一种从中药紫草中分离出来的萘醌类化合物。紫草素被报道可以有效的诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death,icd),刺激dc细胞成熟,从而激活t细胞免疫。同时,肿瘤细胞的代谢方式遵循warburg效应,即肿瘤细胞葡萄糖摄取增加,主要通过糖酵解来产生三磷酸腺苷(atp)供能,同时产生大量乳酸。紫草素被鉴定为一种潜在的丙酮酸激酶同工酶2(pyruvate kinase isozyme type m2,pkm2)抑制剂,可显著抑制肿瘤细胞糖酵解。
[0022]
双硫仑(disulfiram,dsf)是一种不可逆的乙醛脱氢酶(acetaldehyde dehydrogenase,aldh)抑制剂。研究发现,肿瘤细胞内的还原型辅酶i(nadh)可通过线粒体氧化磷酸化产生atp能继续支持肿瘤生长,可能作为肿瘤细胞供能的替代途径。乙醛脱氢酶1蛋白家族l1(aldh1l1)又叫10-甲酰基四氢叶酸脱氢酶,是一种叶酸代谢中的关键酶,将10-甲酰基-四氢叶酸转化为四氢叶酸,同时产生副产物nadh,可通过氧化磷酸化转化为atp。
[0023]
发明人经试验研究发现,dsf具有aldh1l1抑制活性,从而调控叶酸-nadh能量代谢途径,并通过联合应用shk后,进一步耗竭肿瘤细胞内的atp,从而调控肿瘤能量代谢,起到治疗肿瘤的目的。
[0024]
在一些实施方式中,白蛋白/乳铁蛋白嵌合纳米粒的载药量为0.5~10wt%,例如1wt%、2wt%、3wt%、4wt%、5wt%。
[0025]
根据第二方面,本发明提供了一种上述白蛋白/乳铁蛋白嵌合纳米粒的制备方法,所述方法包括以下步骤:
[0026]
1)将白蛋白(优选牛血清白蛋白)和乳铁蛋白溶解于水中,得到水相。磷脂(优选卵磷脂,更优选大豆卵磷脂)以及任选的药物活性成分溶解于有机溶剂中,得到油相。
[0027]
2)将油相在水相中均质,得到白蛋白/乳铁蛋白嵌合纳米粒。
[0028]
关于白蛋白、乳铁蛋白、药物活性成分的含义,与第一方面中的对应含义一致,在此不再赘述。
[0029]
在上述步骤1)中,所述有机溶剂为甲醇、乙醇、丙酮、二氯甲烷、三氯甲烷(氯仿)中的一种或多种。
[0030]
在上述步骤(2)中,可以先将油相与水相混合制备初乳,然后进行均质。例如,在高速分散机的剪切力作用下将油相滴入水相,分散3~8min(优选5min),得到初乳;在高压均质机的均质作用下将初乳均质5~15个(优选10个)循环。
[0031]
在一些实施方式中,高速分散机的剪切速率为10000-25000rpm,优选为20000rpm;高压均质机的工作压力为6000-20000psi,优选为12,000psi。
[0032]
在一个实施例中,白蛋白/乳铁蛋白嵌合纳米粒如下制备:牛血清白蛋白和乳铁蛋白以质量比7:3溶解于水中,得到水相;将药物活性成分(优选双硫仑和紫草素,更优选两者质量比2:1)和磷脂溶于有机溶剂(优选无水乙醇/氯仿混合体系,体积比:2:1)中作为油相,然后加入到水相中,高速搅拌得到初乳,然后高压均质,由此得到包载药物活性成分的白蛋白/乳铁蛋白嵌合纳米粒。
[0033]
在一个实施例中,白蛋白/乳铁蛋白嵌合纳米粒的具体制备方法如下:
[0034]
称取牛血清白蛋白(bsa)21mg和乳铁蛋白(lf)9mg溶解于5ml水中,得到水相。称取2mg双硫仑、1mg紫草素和20mg大豆卵磷脂溶解于无水乙醇(0.6ml)和氯仿(0.3ml)混合溶剂中,得到油相。在高速分散机的剪切力作用下(剪切速率20000rpm),将油相缓慢滴入水相,继续高速分散5min,得到初乳。然后,高压均质机12,000psi的工作压力下将初乳均质10次循环,即得到纳米粒。
[0035]
根据本发明的白蛋白/乳铁蛋白嵌合纳米粒的制备方法还可以进一步包括纯化步骤。可以采用任何合适的方法纯化纳米粒,例如洗涤,过滤,色谱柱分离等。
[0036]
在一个实施方式中,用sephadex g-50柱纯化纳米粒,具体如下,sephadex g-50凝胶填柱,将纳米粒溶液上样,以pbs作为流动相进行洗脱。由于纳米粒尺寸较大经柱子死体积后出柱,而过量的药物则进入g-50凝胶的孔径中延后出柱从而实现分离,收集纯化后的纳米粒溶液,冻干备用。
[0037]
根据另一个方面,本发明提供了一种白蛋白/乳铁蛋白嵌合纳米粒在药物制备中的用途。
[0038]
所述药物能够治疗的疾病与纳米粒中所负载的药物活性成分的治疗疾病一致,因而不做特别限制。
[0039]
在一个实施例中,所述白蛋白/乳铁蛋白纳米粒中所载药物活性成分选自具有抗肿瘤活性的药物活性成分,包括但不限于,阿霉素、米托蒽醌、槲皮素、紫草素、雷公藤红素、
藤黄酸、双硫仑、双硫仑/铜络合物等中的一种或多种。
[0040]
因此,本发明提供所述负载有具有抗肿瘤活性的药物活性成分的白蛋白/乳铁蛋白纳米粒在制备用于治疗肿瘤的药物中的用途。特别地,所述肿瘤为实体瘤,优选地为皮下移植瘤或原位肿瘤,更优选地,为原位脑胶质瘤。在一些实施方式中,药物活性成分为紫草素和/或双硫仑,优选紫草素和双硫仑。特别地,紫草素和双硫仑的质量比为0.5~8:1(例如0.5:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1),优选为2:1。
[0041]
本发明上述实施例的技术方案具有以下有益效果:
[0042]
(1)本发明白蛋白/乳铁蛋白嵌合纳米载体(未载药空白纳米粒)表现出高效的脑靶向作用,在脑部的蓄积量比乳铁蛋白更具优势,而在各个脏器中的荧光蓄积量与bsa np相似,具有更优越的体内药动学特性,而体系中的乳铁蛋白则赋予了纳米粒理想的靶向能力,使纳米粒高效蓄积于脑胶质瘤;在原位gl261小鼠模型上,白蛋白/乳铁蛋白嵌合纳米粒高效地将双硫仑和紫草素以协同比例蓄积于脑胶质瘤部位(肿瘤药物蓄积较游离药物组提高了10倍以上),从而有效延长了动物的生存期。
[0043]
(2)本发明的包载抗肿瘤药物或疏水性药物的白蛋白/乳铁蛋白嵌合纳米粒不仅可以提高难溶性药物的溶解度,还巧妙使用载体实现仿生肿瘤靶向,同时降低毒副反应。
[0044]
本发明的包载双硫仑和紫草素的白蛋白/乳铁蛋白嵌合纳米粒具有以下优点:一方面,载体生物相容性良好,生物可降解,能将双硫仑和紫草素以协同比例共递送到脑胶质瘤部位;另一方面,这两个药物相互协调,实现肿瘤代谢和免疫微环境互动调控,有效地延长原位脑胶质瘤小鼠的生存期。以上共递送双硫仑和紫草素的纳米载体及其对模型小鼠的治疗作用,将为该治疗策略在肿瘤临床及兽用肿瘤治疗上均提供可行的前期研究基础。
[0045]
本发明不仅为肿瘤临床治疗提供新的纳米载体递送策略,也为今后开发兽用肿瘤治疗提供了一种新的纳米递送技术。
[0046]
(3)本发明通过蛋白嵌合载体技术手段,制备白蛋白和乳铁蛋白嵌合的仿生纳米载药系统,以同时保留白蛋白和乳铁蛋白的各种递药优势。通过简单的乳化-高压均质法制备仿生纳米载药系统,工艺成熟,制备的纳米药物分布良好、稳定性佳。
[0047]
本发明白蛋白/乳铁蛋白纳米粒的制备方法具有以下优点:避免了毒性交联剂,技术成熟,便捷可控,纳米粒稳定、批间差异小。更为重要的是载体材料避免了靶向配体的修饰,所述纳米粒制备方法具有普适性,增强了白蛋白的载药能力,可实现两种或两种以上药物的同时包载。
[0048]
本发明不仅为肿瘤临床治疗提供新的纳米载体递送策略,也为开发兽用肿瘤治疗纳米药物提供了一种新的技术。
[0049]
另外,本发明的白蛋白/乳铁蛋白嵌合纳米粒递送技术,包载的优选药物优选紫草素和双硫仑也为兽用,特别是宠物用肿瘤治疗(包括各种实体瘤,特别是脑胶质瘤),提供一种靶向的、协同增效的、工艺可行的一种有治疗前景的新技术。
[0050]
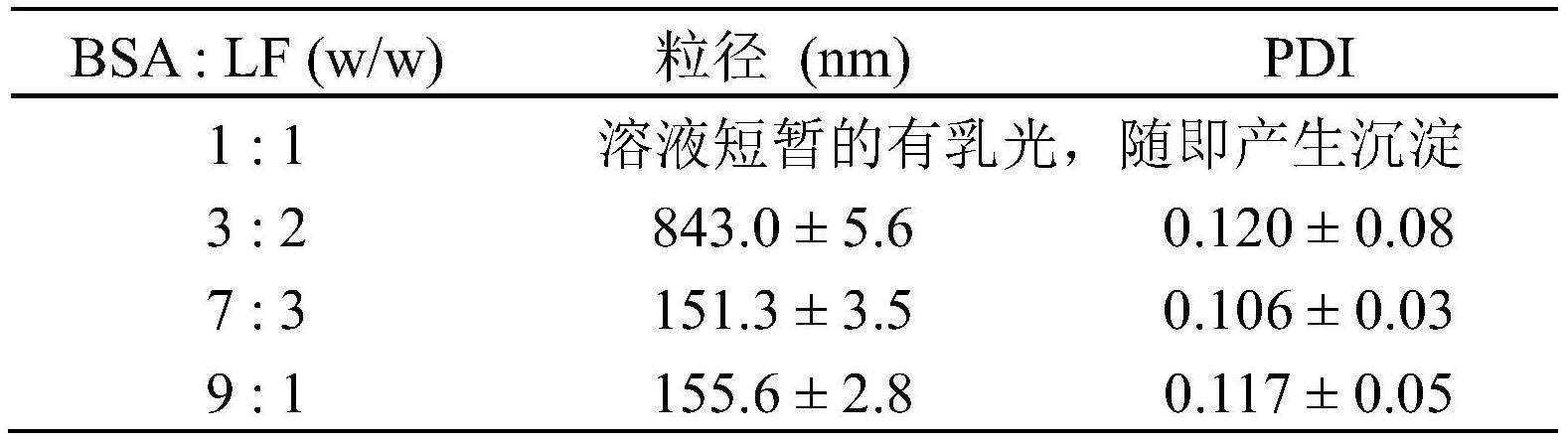
在上文中已经详细地描述了本发明,但是上述实施方式本质上仅是例示性,且并不欲限制本发明。此外,本文并不受前述现有技术或发明内容或以下实施例中所描述的任何理论的限制。
[0051]
除非另有明确说明,在整个申请文件中的数值范围包括其中的任何子范围和以其中给定值的最小子单位递增的任何数值。除非另有明确说明,在整个申请文件中的数值表
nadh-atp代谢轴,其中,a为药物处理后gl261细胞内atp变化情况;b,c为不同关键的代谢环节用抑制剂阻断后gl261细胞内atp变化情况;d为药物处理后gl261细胞内aldh1l1和pkm2表达量变化;e,f为不同关键的代谢环节用抑制剂阻断后gl261细胞内nadh/nad
变化情况;
[0062]
图10为本发明实验实施例4中载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒对肿瘤代谢/免疫互动调控;其中,a为纳米粒处理gl261细胞后乳酸分泌量变化;b为乳酸抑制dc成熟;c为乳酸促进tregs生成(cd3ε和cd28刺激作为阳性对照,mature dc:lps(终浓度200ng/ml)刺激bmdc24h);
[0063]
图11为本发明实验实施例4中联合疗法诱导肿瘤细胞发生免疫原性细胞死亡(icd),其中,a,b为药物处理后诱导钙网蛋白外翻流式检测的直方图和平均荧光强度统计;c为药物处理后细胞培养上清中hmgb-1含量检测。
[0064]
图12为本发明实验实施例4中载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒诱导肿瘤细胞icd,并与dc细胞共孵育检测刺激dc细胞成熟的效果。
[0065]
图13为本发明实验实施例4中载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒诱导icd刺激dc成熟后对t细胞的增殖和诱导效应t细胞成熟,其中,a,b为效应t细胞(cd8 ifn-γ
/granzyme b
)比例变化;c为增殖性t细胞(ki 67
cd8
)相对倍数变化;d为调节性t细胞(cd25
foxp 3
)比例变化(所有相对倍数变化均以未处理组为基准进行归一化)。
[0066]
图14为本发明实验实施例4中载药纳米粒对巨噬细胞的调控作用,其中,a为gl261细胞与m2φ竞争性摄取白蛋白纳米粒或白蛋白/乳铁蛋白嵌合纳米粒;b为药物处理后m1型巨噬细胞相对倍数变化;c为药物处理后m2型巨噬细胞相对倍数变化(所有相对倍数变化均以m2φ组为基准进行归一化);d为western blot检测药物处理后不同表型巨噬细胞frount,mr,arg-1的表达;
[0067]
图15为本发明实验实施例5中药物在脑胶质瘤组织中的分布,其中,a专属性实验;b为给游离药组的脑胶质瘤组织中dsf及shk含量随时间变化;c为给游离药组的脑胶质瘤组织中dsf与shk的比例;d,e为脑胶质瘤组织中不同时间点dsf及shk含量变化;f为脑胶质瘤组织中dsf与shk的比例(药物含量表示为每克组织的注射剂量%id/g)。
[0068]
图16为本发明实验实施例6中载药白蛋白纳米粒或载药白蛋白/乳铁蛋白嵌合纳米粒治疗原位脑胶质瘤的效果,其中,a为第6,10,14天注射荧光素钾盐后脑部生物荧光信号(小鼠死亡导致数据缺失);b为生物荧光信号-时间曲线;c为肿瘤抑制率;d,e为gl261胶质瘤小鼠治疗后的生存曲线和中位生存期;
[0069]
图17为本发明实验实施例6中载药白蛋白纳米粒或载药白蛋白/乳铁蛋白嵌合纳米粒治疗后肿瘤组织中免疫细胞亚群分析,其中,a为肿瘤组织中cd8
t细胞相对倍数变化;b为增殖型cd8
t细胞(ki 67
)相对倍数变化;c,d为效应t细胞(cd8
ifn-γ
/granzyme b
)相对倍数变化;e为肿瘤组织中tregs相对倍数变化;f为治疗后肿瘤组织中m2φ相对倍数变化;g为治疗后肿瘤组织中m1φ相对倍数变化(所有相对倍数均以生理盐水组进行归一化),h为western blot分析肿瘤组织中各巨噬细胞相关标志物的表达)。
[0070]
图18为本发明实验实施例6中载药白蛋白纳米粒或载药白蛋白/乳铁蛋白嵌合纳米粒治疗后肿瘤组织中atp和乳酸含量检测,其中a,b为治疗后肿瘤组织中atp和乳酸含量变化。
[0071]
图19为本发明实验实施例6中载药白蛋白/乳铁蛋白嵌合纳米粒在免疫缺陷/正常
小鼠脑胶质瘤皮下模型中的药效评价,其中,a,b为嵌合纳米粒在balb/c-nude裸鼠皮下瘤模型上的治疗效果;c,d为嵌合纳米粒在c57bl/6黑鼠皮下瘤模型上的治疗效果;e为肿瘤抑制率;f为western blot分析治疗后肿瘤组织中aldh1l1及pkm2表达;g,h,i分别为治疗后肿瘤组织中atp水平、nadh/nad
水平和乳酸水平变化。
具体实施方式
[0072]
下面结合实施例对本发明作进一步的说明,需要说明的是,提供以下实施例仅出于说明目的并不构成对本发明要求保护范围的限制。
[0073]
除特殊说明外,在实施例中所采用的原料、试剂、方法等均为本领域常规的原料、试剂、方法。
[0074]
试剂和药品
[0075]
紫草素(道斯夫生物科技有限公司,南京);双硫仑、水溶性cy5-nhs酯(美仑生物技术有限公司,大连);乳铁蛋白(圣赛化工有限公司,南京);牛血清白蛋白(amresco,usa);大豆卵磷脂、蛋黄卵磷脂、胆固醇、dspe-peg2000(艾韦特医药科技有限公司,上海);乙醛脱氢酶活性检测试剂盒(索莱宝科技有限公司,北京);dmem细胞培养基(gibco,thermo fisher scientific,usa);胎牛血清(gemini,usa);0.25%胰蛋白酶、青/链霉素双抗、增强型atp检测试剂盒和nad
/nadh检测试剂盒(碧云天生物技术有限公司);d-荧光素钾盐(caliper perkinelmer,usa);脂多糖(lps)、碘化丙啶(pi)和mtt(sigma-aldrich,usa);小鼠淋巴细胞分离液(达科为生物技术有限公司,上海);鼠重组巨噬细胞集落刺激因子(m-csf)、鼠重组粒-巨噬细胞集落刺激因子(gm-csf)、鼠重组干扰素gamma(ifn-γ)、鼠重组白细胞介素4(il-4)(peprotech,usa);兔抗sparc多克隆抗体、兔抗甘露糖受体(mr)多克隆抗体、兔抗aldh1l1抗体和兔抗pkm2抗体(爱必信生物科技有限公司,上海);兔抗钙网蛋白(calreticulin)抗体-alexa fluor 488偶联物(crt-af488)、兔抗inos抗体-alexa fluor 488偶联物(inos-af488)、兔抗lrp1多克隆抗体和兔抗arg-1多克隆抗体(cell signaling technology,usa);色谱甲醇(百灵威科技有限公司);5
×
蛋白上样缓冲液(新赛美生物科技有限公司,苏州);小鼠cd3ε和cd28抗体(biolegend,usa);所有流式抗体均购买自biolegend(usa)或bd pharmingen(usa)公司;细胞固定破膜/破核试剂盒(becton dickinson,usa);小鼠高迁移率族蛋白(hmgb-1)elisa试剂盒(沪震实业有限公司,上海);乳酸检测试剂盒(建成生物工程研究所,南京);甲氨蝶呤(mtx)、2-脱氧葡萄糖(2-dg)和nct-503(selleck,usa);氟乙酸盐(安耐吉化学,萨恩化学技术有限公司,上海);其余试剂购买于国药集团化学试剂有限公司。
[0076]
制备实施例1:荧光标记的白蛋白和乳铁蛋白以及荧光标记的白蛋白纳米粒、白蛋白/乳铁蛋白嵌合纳米粒的制备
[0077]
1.白蛋白和乳铁蛋白荧光标记
[0078]
蛋白与水溶性cy5-nhs酯按物质的量之比1:1.5进行投料,具体如下:称取200mg bsa或242mg lf(物质的量:3.03
×
10-3
mmol)溶解于4ml ph7.2的磷酸盐缓冲液中。称取3.43mg水溶性cy5-nhs酯(物质的量:4.54
×
10-3
mmol),溶于100μl超纯水中。将cy5-nhs酯溶液逐滴加到蛋白溶液中,边加边搅拌,于室温中反应3小时。同时将desalting柱(hitraptm 5ml,ge healthcare,usa)和fplc进行连接,使用pbs预平衡柱子。待反应完成后,将样品注
入fplc进行洗脱,收集cy5-bsa或cy5-lf,冻干备用。
[0079]
2.cy5标记的纳米粒制备
[0080]
称取cy5-bsa 30mg或cy5-bsa 21mg cy5-lf 9mg或cy5-lf 30mg溶解于5ml水中,得到水相。称取20mg大豆卵磷脂溶解于无水乙醇(0.6ml)和氯仿(0.3ml)混合溶剂中,得到油相。在高速分散机的剪切力作用下(剪切速率20000rpm),将油相缓慢滴入水相,继续高速分散5min,得到初乳。然后,高压均质机12,000psi的工作压力下将初乳均质10次循环,即得到cy5标记的纳米粒,分别为cy5标记的牛血清白蛋白纳米粒(cy5-bsa np),cy5标记的乳铁蛋白纳米粒(cy5-lf np)和cy5标记的白蛋白/乳铁蛋白嵌合纳米粒(cy5-bsa/lf np)。用sephadex g-50柱纯化纳米粒。
[0081]
3.香豆素-6标记的纳米粒制备
[0082]
称取bsa 30mg或bsa 21mg lf 9mg溶解于5ml水中,得到水相。称取20mg大豆卵磷脂加0.3ml氯仿,同时加入0.6ml香豆素-6的无水乙醇溶液(200μg/ml),溶解后得到油相。在高速分散机的剪切力作用下(剪切速率20000rpm),将油相缓慢滴入水相,继续高速分散5min,得到初乳。然后,高压均质机12,000psi的工作压力下将初乳均质10次循环,即得到香豆素-6标记的纳米粒,分别为香豆素-6标记的牛血清白蛋白纳米粒(香豆素-6-bsa np),香豆素-6标记的白蛋白/乳铁蛋白嵌合纳米粒(香豆素-6-bsa/lf np)。用sephadex g-50柱纯化纳米粒。
[0083]
制备实施例2:载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒的制备
[0084]
载药纳米粒制备:
[0085]
称取bsa 30mg或bsa 21mg lf 9mg溶解于5ml水中,得到水相。称取2mg双硫仑、1mg紫草素和20mg大豆卵磷脂溶解于无水乙醇(0.6ml)和氯仿(0.3ml)混合溶剂中,得到油相。在高速分散机的剪切力作用下(剪切速率20000rpm),将油相缓慢滴入水相,继续高速分散5min,得到初乳。然后,高压均质机12,000psi的工作压力下将初乳均质10次循环,即得到纳米粒,分别为载药白蛋白纳米粒(载药bsa np)以及载药白蛋白/乳铁蛋白嵌合纳米粒(载药bsa/lf np)。用sephadex g-50柱纯化纳米粒。
[0086]
实验实施例1:纳米载体(未载药的白蛋白纳米粒以及白蛋白/乳铁蛋白嵌合纳米粒)的靶向性和体内药动学研究
[0087]
(1)载体的体内药动学研究
[0088]
用cy5标记的纳米粒(制备实施例1-2)进行体内pk实验,具体如下:sd大鼠随机分成4组(n=3),保持充足的食物和饮水。分别尾静脉注射游离cy5,cy5-bsa np,cy5-lf np,和cy5-bsa/lf np(12μg/kg,以cy5含量计算)。根据荧光染料cy5的含量变化对纳米载体的体内行为进行评价。在预设时间点,用异氟烷麻醉大鼠,眼眶静脉丛采血0.5ml至抗凝管,离心(5,000rpm,5min),收集血浆,荧光分光光度计检测血浆中的荧光强度,根据标曲计算血浆中cy5的浓度。通过das 2.0软件拟合药动学模型并计算药动学参数。
[0089]
cy5,cy5-bsanp,cy5-lf np和cy5-bsa/lf np载体的体内药动学曲线如图1中a所示,计算得到的生物利用度(auc)参数结果如图1中b所示,半衰期(mrt)参数结果如图1中c所示,清除率(cl)参数结果如图1中d所示。
[0090]
从图1可以看出,白蛋白纳米粒(bsa np)较乳铁蛋白纳米粒(lf np)拥有更好的药动学特性,包括更大的生物利用度(auc)、更长的半衰期(mrt)和较小的清除率(cl)。而白蛋
白/乳铁蛋白嵌合纳米粒(bsa/lf np)表现出与bsa np相似的药动学特征。
[0091]
(2)载体的体内靶向性研究
[0092]
用cy5标记的纳米粒(制备实施例1-2)进行体内靶向性研究,具体如下:gl261原位胶质瘤小鼠随机分成4组(n=4),分别尾静脉注射cy5-bsa np,cy5-lf np和cy5-bsa/lf np(制备实施例1-2)。12h后小鼠深度麻醉,进行心脏灌流。剥取其主要脏器(心、肝、脾、肺、肾)和脑组织,用活体成像系统检测纳米粒在各个器官中的分布。并根据荧光信号的roi值进行半定量分析。
[0093]
纳米粒在脑组织中的蓄积结果如图2中a所示,脑组织的荧光roi值统计结果如图2中b所示,在其他主要脏器中的蓄积结果如图2中c、d所示。
[0094]
从图2中可以看出,lf np比bsa np能更有效的蓄积于脑部,但同时lf np在各个脏器中的蓄积也普遍高于bsa np。这表明乳铁蛋白介导的脑靶向效果强于白蛋白,同时乳铁蛋白也存在系统毒性的风险。bsa/lf np表现出高效的脑靶向作用,在脑部的蓄积量比乳铁蛋白更具优势,而在各个脏器中的荧光蓄积量与bsa np相似。这些结果说明,bsa/lf np具有更优越的体内药动学特性,而体系中的乳铁蛋白则赋予了纳米粒理想的靶向能力,使纳米粒高效蓄积于脑胶质瘤。
[0095]
实验实施例2:白蛋白与乳铁蛋白最优比例及纳米粒中最佳载药比
[0096]
(1)白蛋白与乳铁蛋白最优比例
[0097]
为了确定嵌合纳米粒中bsa和lf的最佳比例,使用不同比例bsa和lf(总量:20mg)用于制备嵌合纳米粒,以粒径作为评价指标。
[0098]
如表1所示,当bsa:lf=1:1时,无法形成稳定的纳米粒,随即产生沉淀。减少lf用量有助于形成稳定的纳米粒,当bsa:lf=3:2时,纳米粒分布良好,但粒径较大,体内给药后难以穿透血脑屏障。
[0099]
实验实施例1结果表明,lf的脑靶向性能更佳,在确保粒径适宜的前提下,体系中含有尽可能多的lf有利于靶向脑胶质瘤,当bsa:lf=7~9:3~1(w/w)时,得到的纳米粒粒径适宜,pdi较小,稳定性佳。因此确定bsa:lf=7~9:3~1为载体材料的最佳比例,更优地选择bsa:lf=7:3。
[0100]
表1嵌合纳米粒在不同bsa和lf比例下的粒径
[0101][0102]
(2)联合治疗最佳比例确定
[0103]
gl261细胞接种于96孔板(5
×
103细胞/孔),培养12h后,分别将培养基替换成含一定的浓度梯度的dsf,shk和不同比例的dsf&shk,继续培养48h。然后,加入mtt溶液(20μl/孔)孵育4h,去上清,加入dmso(200μl/孔),轻摇使甲臜结晶溶解,酶标仪检测各孔吸光度(检测波长:490nm);绘制细胞存活率-浓度曲线并拟合各组的ic
50
值,并按下面公式计算细胞存活率和协同系数(ci)。
[0104][0105][0106]
其中,d为单药剂量,d
x
为联合剂量,单位:μm。
[0107]
各组的细胞存活率结果如图3中a所示,各组的ic
50
值如图3中b所示,结果表明,紫草素对gl261细胞显示出较强的增殖抑制作用,ic
50
值约为0.8μm,而双硫仑的细胞增殖抑制作用则较小。
[0108]
用协同系数(combined index,ci)评价两种药物的协同效应,当ci《1,=1和》1分别代表协同作用,加和作用和拮抗作用。经计算,不同比例dsf和shk的ci结果如图3中b,结果表明,dsf和shk两药以物质的量之比1:2,2:1,4:1,8:1联用下均表现出协同效应(ci《1),在2:1时ci值最小(0.486),为强协同作用,而4:1时协同系数为0.49,与2:1的协同作用类似。
[0109]
钙网蛋白(calreticulin,crt)外翻,这是细胞发生了icd的标志之一。为了确定两药在各个比例下诱导icd的效果,gl261细胞分别用dsf,shk,和不同比例的dsf&shk处理12h。收集细胞,封闭,crt-af488抗体染色。使用流式细胞技术检测了gl261细胞钙网蛋白外翻情况。
[0110]
结果如图3中c所示,在dsf:shk=1:2(mol/mol)时,不能明显增加crt外翻,与紫草素处理组无显著性差异。当dsf:shk=2:1(mol/mol)时,crt外翻显著增加,继续增加双硫仑量(4:1,8:1)crt外翻不再明显增加。
[0111]
这些结果说明,dsf和shk联用具有协同效应,且在dsf:shk=2:1(mol/mol)表现出最强的协同作用。因此,确定dsf:shk=2:1(mol/mol)为后续联合疗法的最佳药物比例。
[0112]
(3)药物以协同比例包载于纳米粒
[0113]
同时需要检测包载于纳米粒中的药物比例是否接近于最佳协同比例。分别用不同比例的dsf和shk制备纳米粒,并检测包载于纳米粒中的两种药物。结果见表2,包载于纳米粒中的两药比例基本接近于投药比。为了使纳米粒中包载药物接近于最佳协同比例,确定dsf:shk=2:1为纳米粒制备投药比。
[0114]
表2 dsf和shk不同投药比纳米粒的载药量
[0115][0116][0117]
实验实施例3:载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒(制备实施例2)的体外表征实验
[0118]
(1)嵌合纳米粒中两种蛋白比例表征
[0119]
分别取一定量的bsa,lf,bsa lf物理混合(7:3,w/w)和载药bsa/lf np冻干粉溶解
于pbs中,用bca法测定各样品的浓度,并调整至浓度一致(~1mg/ml)。取40μl各样品和10μl 5
×
蛋白上样缓冲液(含dtt),混合均匀,水浴煮沸30min,使蛋白中的二硫键充分打开。将各样品进行sds-page凝胶电泳,然后加考马斯亮蓝g250染色液,置于水平摇床上染色过夜,次日加脱色液洗至条带清晰,如图4中a。通过imagej 1.46r软件(nih,usa)分析各个条带灰度以确定纳米粒中白蛋白和乳铁蛋白的比例,如图4中b。
[0120]
图4中a和b的考马斯亮蓝染色结果显示嵌合纳米粒中bsa与lf比例与投入的两蛋白比例接近,约为7:3(w/w)。说明两种蛋白按照一定比例形成嵌合纳米粒。
[0121]
(2)粒径和电位
[0122]
在zetasizer nano zs90,malvern,uk上使用动态光散射检测纳米粒的粒径和电位。
[0123]
载药bsa np和载药bsa/lf np的电位如图4中c所示,载药bsa np的粒径分布如图4中d所示,载药bsa/lf np的粒径分布如图4中e所示。
[0124]
如图4所示,载药bsanp的ζ电位约为-19mv,载药bsa/lf np由于阳离子lf的引入,ζ电位则增大到约为-12.4mv(图4中c)。载药bsanp的z均粒径约为139nm,呈规则球形(图4中d),分布良好(pdi(pdi是指分布系数,代表粒子尺寸的分布宽度,一般0.1以下表示尺寸较为均匀,从zetasizer nano软件中获得)约为0.18)。相比之下,载药bsa/lf嵌合纳米粒平均粒径增大,约为153nm,呈规则球形(图4中e),粒径分布同样较窄(pdi约为0.16)。
[0125]
(3)体外释放和稳定性实验
[0126]
纳米粒的稳定性在含10%新生牛血清的pbs(ph 7.4)溶液中进行测试,将纳米粒置于恒温37℃的摇床中,在预定时间点分别取0.1ml样品,以粒径为指标评价稳定性。
[0127]
结果如图5中a所示,纳米粒在含血清的介质中能维持24h的稳定性,粒径未有明显增大。
[0128]
体外药物释放研究使用透析袋法,释放介质为0.5%sds/pbs(ph 7.0)。具体如下:将纳米粒溶液或游离药物装入透析袋(截留分子量14,000)内,两端封闭后,投入释放介质中,置于恒温摇床内(37℃,140rpm),在预设时间点各取样0.3ml样品,并补充同体积介质。释放的药物通过hplc法进行测定,计算累计药物释放率,并绘制药物累计释放曲线。结果如图5中b和c所示。
[0129]
结果表明,游离药物能快速达到完全释放(6h内累计释放达到80%以上)。纳米粒显示出缓释效应,72h药物累计释放大于80%。并且,两种纳米粒的药物释放行为相似(图5中d)。
[0130]
(4)细胞摄取
[0131]
考察了gl261细胞的摄取纳米粒能力。具体如下:gl261细胞1
×
105细胞/孔的密度接种于12孔板,继续培养12h。加入含等量香豆素-6标记的bsa np或bsa/lf np(制备实施例1-3的香豆素-6-bsa np、香豆素-6-bsa/lf np),共孵育1h。收集细胞,用pbs洗涤3次,使用流式细胞仪分析细胞内荧光强度。另取一块板,操作同上,共孵育后弃去上清,pbs洗涤3次,用4%多聚甲醛固定,细胞核使用dapi染色液染色,用荧光显微镜观察并拍照。结果如图6所示,其中,a为荧光照片;b为用imagej软件统计荧光照片的荧光强度;c,d为纳米粒被gl261摄取后流式直方图和平均荧光强度统计分析。
[0132]
结果表明,香豆素-6-bsa np和香豆素-6-bsa/lf np共孵育后的gl261细胞均有绿
色荧光(图6中a),说明两种纳米粒均能被gl261细胞摄取。同时,嵌合纳米粒能更高效的被肿瘤细胞摄取,荧光强度约是bsanp组的1.4倍(图6中b)。流式结果也进一步证实,香豆素-6-bsa/lf嵌合纳米粒具有更强的入胞效率,荧光强度约是bsa np组的1.5倍(图6中c和d)。乳铁蛋白有效提高了纳米粒的入胞效率。
[0133]
(5)体外血脑屏障穿透实验
[0134]
bcec细胞以5
×
104接种于transwell装置的上室中,培养至跨内皮电阻(teer)不小于200ω
·
cm2,即成体外血脑屏障(bbb)模型(图7中a)。然后在下室接种gl261细胞(1
×
105细胞/孔),在上室加入含等量香豆素-6标记的bsa np或bsa/lf np(制备实施例1-3的香豆素-6-bsa np、香豆素-6-bsa/lf np),孵育3h。收集下室的gl261细胞,用pbs洗涤3次,流式细胞仪检测细胞内荧光强度,结果如图7中b和c所示,其中b为纳米粒穿透体外血脑屏障模型后被gl261摄取的流式直方图,c为平均荧光强度统计分析。
[0135]
如图7中的b和c所示,香豆素-6-bsa/lf np能更高效的穿透bbb,从而被gl261细胞摄取,荧光强度约是香豆素-6-bsa np的1.8倍。
[0136]
为了进一步研究纳米粒入胞机制,用western blot检测了gl261和bcec的营养转运蛋白(sparc和lrp-1)表达,结果如图7中d所示。
[0137]
如图7中的d所示,bcec表达lrp-1水平相对较高,sparc的水平较低。而当bcec细胞与gl261共培养(用transwell装置进行共培养,将bcec细胞种于下室,gl261细胞种于上室,标记为bcec(co))后sparc和lrp-1表达水平均显著上调。基于白蛋白的仿生递送系统能有效通过sparc介导穿透bbb,而香豆素-6-bsa/lf嵌合纳米粒能通过sparc和lrp-1双受体协同介导从而具有更高的bbb穿透效率。
[0138]
(6)纳米粒对肿瘤细胞的增殖抑制作用
[0139]
gl261细胞5
×
103细胞/孔接种于96孔板,继续培养12h。分别将培养基替换成含一定浓度梯度的dsf&shk,载药bsa np和载药bsa/lf np(制备实施例2得到的纳米粒,含药量以shk计),继续培养48h。然后,加入mtt溶液(20μl/孔)孵育4h,去上清,加入dmso(200μl/孔),轻摇使甲臜结晶溶解,酶标仪检测各孔吸光度(检测波长:490nm),并按公式(1)计算细胞存活率;绘制细胞存活率-浓度曲线并拟合ic
50
值。结果如图8所示。
[0140]
结果表明,游离药物联合能有效的抑制gl261细胞增殖,表现出与载药bsanp效果相当,ic
50
约为0.2μm。载药bsa/lf np表现出最强的增殖抑制活性,ic
50
约为0.15μm。
[0141]
实验实施例4:联合疗法调控肿瘤细胞能量代谢和免疫微环境
[0142]
(1)紫草素和双硫仑介导的葡萄糖-糖酵解/叶酸-nadh-atp代谢轴调控
[0143]
gl261细胞1
×
105细胞/孔接种于12孔板,继续培养12h。分别设pbs,dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm)给药组,处理24h。同时,设置一系列对照组:氟乙酸盐(fa,50μm)抑制三羧酸(tca)循环,2-脱氧葡萄糖(2-dg,2mm)来阻断糖酵解,甲氨蝶呤(mtx,1μm)抑制二氢叶酸还原酶(dhfr),nct-503(3μm)抑制磷酸甘油酸脱氢酶(phgdh)。此外,由于丝氨酸-甘氨酸转化联系了糖酵解和叶酸循环,用不加外源丝氨酸的dmem细胞培养基培养细胞后进行上述实验,以验证调控能量代谢的机制。分别裂解细胞并测定细胞内atp和nadh水平变化。结果如图9所示,其中a为药物处理后gl261细胞内atp变化情况;b,c为不同关键的代谢环节用抑制剂阻断后gl261细胞内atp变化情况;d为药物处理后gl261细胞内aldh1l1和pkm2表达量变化;e,f为不同关键的代谢环节用抑制剂阻断后gl261细胞内nadh/nad
变
化情况。
[0144]
shk处理能有效抑制pkm2(图9中d),从而抑制糖酵解,导致胞内atp水平下降至40%左右(图9中a)。dsf&shk处理能进一步降低胞内atp水平。这些结果说明肿瘤细胞可能主要通过糖酵解供能,但不是唯一的供能途径,存在供能的替代途径。
[0145]
进一步研究结果显示,甲氨蝶呤(methotrexate,mtx,二氢叶酸还原酶抑制剂)处理能有效降低胞内atp,约为未处理组的60%(图9中b)。说明抑制叶酸代谢也能下调gl261细胞中约40%的atp。
[0146]
用dsf处理细胞后,aldh1l1表达量下调(图9中d),胞内atp量降低约40%,与mtx处理组相似(图9中a和b)。说明aldh1l1可能是叶酸代谢中atp产生的关键调节酶。
[0147]
如图9中c所示,在培养基中不添加外源丝氨酸,同时抑制phgdh阻断内源丝氨酸合成后,细胞内atp水平显著下调。
[0148]
进一步检测了细胞内nadh水平变化。结果如图9中e所示,dsf处理能有效下调细胞内nadh/nad
水平,与atp的变化趋势一致。并且图9中f所示,在外源添加丝氨酸的情况下,抑制phgdh后不会明显影响细胞内nadh/nad
水平,而不添加外源丝氨酸同时抑制phgdh阻断内源丝氨酸合成后,细胞内atp水平显著下调。说明叶酸代谢中产生的nadh确实能产生atp为细胞供能。通过联合应用紫草素和双硫仑能有效的抑制肿瘤细胞中的能量供应途径,从而起治疗作用。
[0149]
(2)载药白蛋白纳米粒以及载药白蛋白/乳铁蛋白嵌合纳米粒(制备实施例2)的肿瘤代谢/免疫互动调控
[0150]
gl261细胞1
×
105细胞/孔的密度接种于12孔板,继续培养12h。分别设pbs,dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm),载药bsanp和载药bsa/lf np(游离联合组剂量相当)给药组,继续孵育24h。收集培养上清,按照乳酸检测试剂盒说明书,测定培养上清中的乳酸含量,结果如图10中a。为了证实乳酸的免疫抑制作用,在dc成熟及抗原呈递实验中加入乳酸(5mm)。然后流式细胞仪分析相应细胞亚群,结果如图10中b。
[0151]
结果表明,载药bsa/lf嵌合纳米粒能有效抑制糖酵解,从而减少乳酸生成(图10中a)。而乳酸处理(lps刺激bmdc细胞同时在体系中加入乳酸;untreated:未做处理的gl261细胞与bmdc共孵育)能显著的抑制lps刺激的bmdc细胞表达cd80和cd86(图10中b),说明乳酸能有效的抑制dc细胞成熟。shk处理(shk:shk处理gl261细胞24h后再与bmdc共孵育)后能有效的诱导肿瘤细胞icd并抑制pkm2活性,从而减少乳酸产生(图9中d,图10中b),因此,cd80
cd86
的dc亚群比例有所回升,但是这种趋势在外源加入乳酸后(shk la:shk处理gl261细胞24h后,与bmdc共孵育同时加入乳酸)即回落到未处理组水平(图10中b)。
[0152]
进一步研究了乳酸在dc细胞抗原呈递过程中的作用,以200ng/ml lps刺激bmdc成熟,然后与小鼠总淋巴细胞共孵育(bmdc:总淋巴细胞=1:10),并加入乳酸(5mm)。48h后收集细胞,孵育流式抗体,用流式细胞仪分析。
[0153]
结果如图10中c,结果显示,成熟dc细胞(lps诱导)在与淋巴细胞共孵育后能有效刺激ctls成熟同时促进cd8
t细胞增殖。然而,在共孵育体系中加入乳酸后,效应t细胞和cd8
t细胞增殖被有效抑制,同时tregs的比例有所增加。这些结果说明,乳酸不仅能抑制dc细胞成熟,还能干扰dc细胞的抗原呈递功能,同时有利于tregs的生成。
[0154]
(3)联合疗法调控肿瘤免疫微环境
[0155]
a.诱导肿瘤细胞免疫原性细胞死亡(icd)
[0156]
gl261细胞1
×
105细胞/孔接种于12孔板,继续培养12h。分别设pbs,dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm)给药组,继续孵育12h。收集培养上清,使用elisa法检测培养上清中的hmgb-1含量,结果如图11中c所示。同时,收集细胞,用流式细胞仪分析pi-af488
细胞亚群占比。结果如图11中a和b所示,其中a为药物处理后诱导钙网蛋白外翻流式检测的直方图,b为平均荧光强度统计。
[0157]
结果表明,shk能有效的诱导gl261细胞crt外翻(图11中的a和b)和hmgb-1释放(图11中的c);dsf&shk处理能进一步加强icd效应,显著增加crt外翻和hmgb-1释放。
[0158]
b.免疫原性细胞死亡刺激树突状细胞成熟
[0159]
gl261细胞1
×
105细胞/孔的密度接种于12孔板,继续培养12h。分别设pbs,dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm),载药bsanp和载药bsa/lf np(游离联合组剂量相当)给药组,孵育24h。然后加入bmdc细胞继续共孵育24h。以加入200ng/ml lps刺激的bmdc作为阳性对照。用流式细胞仪分析cd80
cd86
细胞亚群占比。结果如图12所示,shk处理gl261细胞后(诱导icd效应),能显著的上调cd80
cd86
细胞亚群(即表达共刺激分子的成熟dc细胞),而bsa/lf np处理后,cd80
cd86
细胞亚群比例甚至达到了阳性对照的80%。说明载药bsa/lf np处理gl261细胞引发的icd效应能高效的刺激dc细胞并诱导其成熟(cd80
cd86
的dc细胞认为是成熟的dc细胞)。
[0160]
c.免疫原性细胞死亡激活t细胞免疫
[0161]
gl261细胞1
×
105细胞/孔的密度接种于12孔板,继续培养12h。分别设pbs,dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm),载药bsanp和载药bsa/lf np(游离联合组剂量相当)给药组,孵育24h。然后加入bmdc细胞继续共孵育24h;最后再加入小鼠总淋巴细胞(bmdc:总淋巴细胞=1:10)继续共孵育48h。以cd3ε和cd28刺激小鼠总淋巴细胞作为阳性对照。用流式细胞仪分析相应免疫细胞亚群。结果如图13所示,其中,a,b为效应t细胞(cd8
ifn-γ
/granzyme b
)比例变化,c为增殖性t细胞(ki 67
cd8
)相对倍数变化,d为调节性t细胞(cd25
foxp 3
)比例变化。
[0162]
结果表明,载药bsa/lf np处理后,ifn-γ
或granzyme b
的cd8
t细胞比例升高了至少2倍(图13中a和b)。此外,bsa/lf np处理后,cd8
ki 67
细胞亚群的比例显著增加,约为对照组的8倍(图13中c),说明诱导icd效应能促进cd8
t细胞增殖。icd激活t细胞免疫的同时,由于乳酸生成减少,调节性t细胞(tregs)生成明显减少,bsa/lf np处理组tregs比例最少(图13中d),说明微环境的免疫抑制得到有效改善。
[0163]
这些结果表明,嵌合纳米粒能最有效地诱导gl261细胞发生免疫原性细胞死亡,释放的信号分子(crt,hmgb-1等)能有效刺激dc细胞成熟,并将抗原呈递给初始t细胞,激活t细胞免疫,促进cd8
t细胞增殖同时释放肿瘤杀伤性的效应因子(ifn-γ
和granzyme b
等)攻击肿瘤细胞,从而起到免疫治疗的作用。同时,乳酸生成减少,tregs生成受到抑制,进一步有利于免疫治疗的进行。
[0164]
d.调控巨噬细胞
[0165]
将gl261和m2φ分别计数,按照1:1混合,加入含等量cy5标记的bsa np或bsa/lf np(即制备实施例1-2的cy5-bsanp、cy5-bsa/lf np)共孵育1h。用pbs洗涤3次,加f4/80-bv421在冰上孵育30min。用流式细胞仪分析cy5
bv421
细胞亚群(mφ)与cy5
bv421-细胞亚
群(gl261)的比例。同时,将mφ极化分型后,对m2φ加药物处理,设dsf(1μm),shk(0.5μm),dsf&shk(0.2μm 0.1μm),bsanp和bsa/lf np(游离联合组剂量相当)组,同时以m1,m2型巨噬细胞作为对照,处理24h。收集细胞,用流式细胞仪分析,结果如图14中a、b、c所示,另取一份细胞,按相同方式和剂量进行给药处理,孵育24h。收集细胞,western blot分析frount,mr,arg-1的表达,结果如图14中d所示。
[0166]
结果表明,在bsanp孵育组中,m2φ处于纳米粒摄取优势地位,纳米粒阳性细胞亚群中两细胞的比例约为gl261:m2φ=38:62。而在bsa/lf np孵育组中,纳米粒阳性细胞亚群中两细胞比约为gl261:m2φ=44:56,基本接近于初始比例(图14中a)。这些结果表明,高表达sparc和lrp1的肿瘤细胞和m2φ在摄取纳米粒上,保持竞争平衡,在脑胶质瘤组织中有足够量的bsa/lf np被肿瘤细胞摄取。frount在促进肿瘤的m2φ中高表达,dsf处理能显著的下调frount表达,并上调cd80
inos
细胞亚群比例,显著下调cd206
frount
细胞亚群比例,而bsa/lf np对巨噬细胞重极化作用最强(图14中b和c)。western blot结果进一步显示,联合用药和纳米粒处理后,能进一步有效下调m2φ的frount,mr,arg-1表达水平(图14中d)。这些结果表明,通过dsf介导的frount抑制作用,使得纳米粒治疗有效的抑制m2φ的促肿瘤活性,并重极化为m1φ。
[0167]
实验实施例5:载药白蛋白纳米粒及载药白蛋白/乳铁蛋白嵌合纳米粒(制备实施例2)脑靶向共递送紫草素和双硫仑
[0168]
(1)gl261原位瘤建立
[0169]
首先,腹腔注射舒泰50将小鼠麻醉(60mg/kg),用电动剃毛器剃除小鼠头部毛发,并用脱毛膏彻底清除剩余毛发。碘伏棉球擦拭皮肤消毒,小心剪开小鼠头部皮肤,以前囟(矢状缝与冠状缝的交汇处)为原点,用立体定位仪进行定位,然后用电钻在小鼠颅骨上钻孔。吸取5μl(2
×
105个细胞)gl261-luc细胞,用立体定位仪将细胞注入3.5mm深处,保持5min后撤针,用骨蜡进行封孔,最后进行伤口缝合。待小鼠苏醒后,塞来昔布灌胃给药(10mg/kg,每天给药,共2次)以减轻术后疼痛,头孢曲松钠尾静脉注射以预防术后感染(20mg/kg,每天给药,共2次),同时用碘伏棉球擦拭伤口(每天擦拭一次,共3次)。将小鼠继续饲养在spf条件下。6天后,注射d-荧光素钾盐(150mg/kg,i.p.),通过ivis成像系统检测成瘤率。
[0170]
(2)脑胶质瘤内药物分布
[0171]
为了进一步评价纳米粒的肿瘤共递送和肿瘤药物蓄积量,采用hplc法评价脑胶质瘤中的药物蓄积。将gl261原位瘤模型小鼠随机分成3组。尾静脉单次注射含等量药物的游离dsf shk(剂量:10mg/kg 5mg/kg),载药bsa np,载药bsa/lf np,分别在第4,12,22小时每组随机选取3只小鼠,执行安乐死并获取脑组织。使用组织破碎仪将各小鼠大脑(接种胶质瘤侧大脑组织,即右侧脑组织)匀浆,加入有机溶剂与脑组织样本在摇床中振荡1h以充分提取组织中的药物,离心取上清,并在真空干燥箱中将溶剂挥干。残渣加少量色谱甲醇复溶,离心取上清进行hplc分析。结果如图15所示,其中a为hplc图,b为给游离药组的脑胶质瘤组织中dsf及shk含量随时间变化;c为给游离药组的脑胶质瘤组织中dsf与shk的比例;d,e为脑胶质瘤组织中不同时间点dsf及shk含量变化;f为脑胶质瘤组织中dsf与shk的比例。
[0172]
从图15中a可见,dsf和shk之间有较好的分离度,并且不受生物样品成分的干扰,可以实现两个药物同步定量分析。
[0173]
从图15中b分析可以看出,给药4h后,游离药注射组只有极少量的药物能达到胶质瘤部位,而在12h时药物含量即低于定量下限。
[0174]
从图15中c分析可以看出,游离药注射组虽然以协同比例给药,肿瘤部位的两药比例却发生了改变。
[0175]
从图15中d和e分析可以看出,给药后12h,纳米粒注射组的胶质瘤组织药物蓄积量达到峰值,其中bsa/lf np组具有绝对优势,药物蓄积量约是bsanp组的1.6倍。
[0176]
从图15中f分析可以看出,纳米粒注射组在各个时间两药比例均能保持在协同比例(2:1,mol/mol),说明纳米粒能将两种药物以协同比例实现脑胶质瘤的靶向递送,从而发挥最强的治疗作用。
[0177]
实验实施例6:载药白蛋白纳米粒及载药白蛋白/乳铁蛋白嵌合纳米粒(制备实施例2)治疗原位脑胶质瘤效果及其抗肿瘤机制验证
[0178]
(1)脑原位瘤小鼠模型抗肿瘤效应
[0179]
gl261-luc原位胶质瘤小鼠随机分成4组(n=3),设生理盐水,dsf shk(10mg/kg 5mg/kg,物质的量比约为2:1),bsanp和bsa/lf np治疗组,尾静脉注射,隔日治疗,共计3次。在种瘤后的第6,10,14天腹腔注射荧光素钾盐(15mg/kg),用活体成像检测脑部生物荧光信号,根据荧光强度变化评估胶质瘤生长情况和治疗效果。结果如图16中a-c所示,其中,a为第6,10,14天注射荧光素钾盐后脑部生物荧光信号;b为生物荧光信号-时间曲线;c为肿瘤抑制率(b是对a信号进行量化而得,c是根据a,b的结果计算的抑制率)。结果表明,通过三次治疗后,游离药联合治疗组显示出一定的疗效,而纳米粒治疗组的效果较为明显,载药bsa/lf np组肿瘤生长最慢,肿瘤抑制率达80%以上。这些结果说明,载药bsa/lf np具有良好的疗效,能有效延长荷胶质瘤小鼠生存期。
[0180]
另随机将gl261原位胶质瘤小鼠分成4组(n=10),设生理盐水,dsf shk(10mg/kg 5mg/kg,物质的量比约为2:1),载药bsanp和载药bsa/lf np治疗组,尾静脉注射,隔日治疗,共计5次。隔日统计小鼠的体重,并密切观察小鼠的生存状态。根据实验动物福利相关要求:当小鼠体重减轻超过15%,严重偏瘫或超过48小时不进食等情况即判定为动物死亡,执行安乐死。待数据收集完整,绘制生存曲线,结果如图16中d,用kaplan-meier法分析中位生存期,结果如图16中e。从图16中d和e可以看出,游离药联用组显示出一定的治疗效果(中位生存期:16
±
0.4天),载药纳米粒治疗组显示出较好的效果,载药bsa np治疗后,中位生存期为19
±
1.5天,相对于生理盐水治疗组的14
±
0.3天,延长了5天(p《0.001)。而载药bsa/lf np治疗后,动物中位生存期达到26
±
1.9天,在载药bsa np的基础上,又延长了7天(p=0.002),相对于生理盐水治疗组,中位生存期延长了一倍。这些结果说明载药bsa/lf np优越的脑胶质瘤靶向性和治疗效果,从而能有效延长动物的生存期。
[0181]
(2)体内抗肿瘤机制验证
[0182]
a.肿瘤组织中的免疫细胞分析
[0183]
按照实验实施例6(1)的治疗方案治疗小鼠,通过三次治疗后,将小鼠安乐死,获取脑组织。称取约100mg脑组织于4ml ep管中,用组织剪充分剪碎,加入2ml含酶消化液(胶原酶ⅳ:1mg/ml,dna酶:0.2mg/ml,用无血清培养基配制),置于恒温摇床中,37℃,150rpm,消化30min(至管内液体浑浊)。过200目尼龙网,除去未消化完全的组织碎片,用滴管吹打分散细胞团,得到单细胞悬液。用fc封闭抗体在冰上孵育60min,然后进行t细胞和巨噬细胞的流
式抗体染色,用流式细胞仪上机分析相应的免疫细胞亚群。结果如图17中a~g,其中,a为肿瘤组织中cd8
t细胞相对倍数变化;b为增殖型cd8
t细胞(ki 67
)相对倍数变化;c,d为效应t细胞(cd8
ifn-γ
/granzyme b
)相对倍数变化;e为肿瘤组织中tregs相对倍数变化;f为治疗后肿瘤组织中m2φ相对倍数变化;g为治疗后肿瘤组织中m1φ相对倍数变化。同时,western blot进一步检测肿瘤组织中frount,cd206,inos等蛋白的表达。结果如图17中h所示。
[0184]
图17中a和b表明,载药纳米粒治疗能显著促进cd8
t细胞的增殖(ki67
),肿瘤组织中ki 67
cd8
亚群占比明显增加。
[0185]
图17中c和d表明,载药bsa/lf np治疗后肿瘤组织中ifn-γ
/granzyme b
的cd8
t细胞比例最高,约为生理盐水对照组的6倍。
[0186]
图17中e表明,载药纳米粒治疗后能有效下调肿瘤组织中的tregs数量,其中载药bsa/lf np治疗后,肿瘤组织中tregs的相对占比约为生理盐水组的20%。这些结果说明,载药bsa/lf np治疗后有效的解除了time的免疫抑制,同时激活了t细胞免疫,促进cd8
t细胞的增殖和ctls的产生,从而有效治疗脑胶质瘤。
[0187]
进一步检测了治疗后肿瘤组织中巨噬细胞表型及数量的变化。如图17中f和h所示,图17中g和h表明,治疗后肿瘤组织中m2φ(cd206
tgf-β1
)比例显著下调,其中载药bsa/lf np治疗组数量变为saline治疗组的约60%。同样地,m1φ(cd80
cd86
tnf-α
)比例显著上调,其中载药bsa/lf np治疗组m1φ数量约是生理盐水组的3倍。
[0188]
b.肿瘤组织中乳酸和atp检测
[0189]
按照实验实施例6(1)的治疗方案治疗小鼠,通过三次治疗后,将小鼠安乐死,获取脑组织。称取约100mg脑组织于2ml ep管,加入500μl试剂盒中的裂解液,加入小钢珠,在组织破碎仪上以60hz的频率破碎90s,4℃,2000rpm离心15min,取上清,按照试剂盒说明书操作检测上清中atp含量,结果如图18中a。对于乳酸检测,称取约100mg脑组织于2ml ep管,加1ml生理盐水,加入小钢珠,在组织破碎仪上以60hz的频率破碎90s,4℃,2000rpm离心15min,取上清,按照试剂盒说明书操作检测上清液中的乳酸含量,结果如图18中b。
[0190]
结果显示,载药纳米粒治疗能有效降低肿瘤组织中的atp,其中载药bsa/lf np治疗组肿瘤组织中atp含量约为生理盐水组的30%(图18中a),表明载药纳米粒治疗有效抑制了肿瘤的能量代谢,从而有效延长原位胶质瘤的小鼠生存期。此外,肿瘤组织中的乳酸含量也被显著下调(图18中b)。
[0191]
c.肿瘤代谢和免疫互动调控验证
[0192]
为了进一步验证bsa/lf np的抗肿瘤机制,用免疫缺陷的balb/c-nude裸鼠建立gl261皮下瘤模型,评价代谢调控对肿瘤的治疗效果。具体治疗方案如下:gl261细胞以3.5
×
105接种于balb/c-nude裸鼠和免疫功能健全的c57bl/6小鼠皮下。种瘤后的第6天,肿瘤体积约为100mm3,次日,瘤周注射bsa/lf np(0.5mg/ml,以shk含量计算,25μl/只/次,隔日给药)。共计治疗6个周期,从第6天起,隔日记录瘤径和体重变化。结果如图19中a~e所示。
[0193]
为了进一步排除固有免疫的作用,使用氯磷酸盐(clodronate)脂质体(lipo-clo)耗竭小鼠体内巨噬细胞。具体治疗方案如下:gl261细胞以3.5
×
105接种于balb/c-nude裸鼠皮下。种瘤后的第6天,瘤周注射lipo-clo(2.5mg/ml,以clodronate含量计算,25μl/只/次,隔日给药),次日,瘤周注射载药bsa/lf np(0.5mg/ml,以shk含量计算,25μl/只/次,隔
日给药)。共计治疗6个周期,从第6天起,隔日记录瘤径和体重变化。治疗结束后,小鼠执行安乐死,收集肿瘤组织,匀浆后检测组织中乳酸,atp和nadh的含量。结果如图19所示。
[0194]
结果表明,载药bsa/lf np在免疫缺陷小鼠模型上的抗肿瘤效果(肿瘤抑制率约50%)明显不如免疫系统健全的c57bl/6小鼠模型(肿瘤抑制率约85%)(图19中a~e),进一步说明免疫治疗在载药bsa/lf np抗gl261胶质瘤疗效中起重要作用。同时,两个动物模型经载药bsa/lf np治疗后,肿瘤组织中aldh1l1和pkm2表达水平均下调(图19中f);同时,atp(图19中g)、nadh/nad
水平(图19中h)和乳酸(图19中i)均显著下调,说明载药bsa/lf np能有效抑制肿瘤细胞糖酵解,同时抑制nadh水平,进而抑制atp产生。
[0195]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。