1.本发明属于医药检测技术领域,特别是涉及一种甲状腺球蛋白检测试剂盒、甲状腺球蛋白半定量检测方法、样本穿刺检测针及样本穿刺检测针在甲状腺球蛋白半定量检测中的应用。
背景技术:
2.甲状腺球蛋白(tg)是甲状腺滤泡上皮分泌的大分子糖蛋白,常存在于正常甲状腺组织、分化好的甲状腺癌组织及转移的淋巴结内,且组织液中的浓度远高于血清中的浓度,故分化型甲状腺癌术后随访中,若在甲状腺外组织内检测出高浓度tg,应高度警惕甲状腺癌转移的可能性。
3.现有技术中对于甲状腺球蛋白的检测主要有以下几种方法:
4.一种方法是fna-tg检测技术,其检测过程需要选择细针穿刺,然后取出穿刺物后进行涂片、无水乙醇固定、he染色,且所有穿刺病灶位置需与对应标本明确标记,一一对应后,将其送病理科做细胞学检查;检查时还需要将测定对象反复离心、测试。该方法的检测过程步骤繁多,检测周期较长,对于临床中,尤其是手术中需要即时判定结果的情况无法适用,不能满足现场检测的即时性需求。
5.另一种方法是判断甲状腺癌颈部淋巴结是否转移的黄金标准“术中快速病理切片”法,该方法的常规检查会耗时40分钟左右,同样不能及时获得检测结果;同时,该方法的实现还需要相关病理专业的技术人员、经验丰富的病理医师及非常昂贵的精细设备,昂贵的设备和专业的人才缺口导致该方法难以普及推广;该方法同样无法满足手术的即时性和临场性。
技术实现要素:
6.本发明的主要目的在于,提供一种甲状腺球蛋白检测试剂盒、甲状腺球蛋白半定量检测方法、样本穿刺检测针及样本穿刺检测针在甲状腺球蛋白半定量检测中的应用,所要解决的技术问题是如何实现甲状腺球蛋白中抗体或抗原浓度的现场快速检验,克服现有技术无法满足手术的即时性和临场性的缺陷,从而更加适于实用。
7.本发明的目的及解决其技术问题是采用以下技术方案来实现的。依据本发明提出的一种甲状腺球蛋白检测试剂盒,其包括:
8.样本稀释液,其包含抗体或抗原,以及稀释所述抗体或抗原的免疫反应缓冲溶液;所述抗体或抗原至少标记有彩色微球;
9.样本穿刺检测针,其包括针头、针筒、第一包被载体、第二包被载体和比色卡;所述第一包被载体、第二包被载体沿针筒轴向顺序设置于所述针筒内;所述第一包被载体、第二包被载体与所述针筒间隙配合;所述第一包被载体设置于所述针筒内靠近针头的一端;所述第一包被载体的外侧面包被材料能够特异性结合人种属的抗体或抗原;所述第二包被载
体设置于所述针筒内背离针头的一端;所述第二包被载体的外侧面包被材料能够特异性结合免疫复合物;和
10.比色卡。
11.本发明的目的及解决其技术问题还可采用以下技术措施进一步实现。
12.优选的,前述的甲状腺球蛋白检测试剂盒,其中所述抗体或抗原包括检测抗体或抗原;所述检测抗体或抗原标记有彩色微球;所述彩色微球选自荧光微球、量子点、胶体金和乳胶微球中的任意一种。
13.优选的,前述的甲状腺球蛋白检测试剂盒,其中所述抗体或抗原仅包括检测抗体时,所述第二包被载体的外侧面包被材料为能够与待检测抗原特异性结合的捕获抗体;所述抗体或抗原仅包括检测抗原时,所述第二包被载体的外侧面包被材料为能够与待检测抗体特异性结合的二抗。
14.优选的,前述的甲状腺球蛋白检测试剂盒,其中所述抗体或抗原还包括捕获抗体;所述捕获抗体标记有生物素或荧光素。
15.优选的,前述的甲状腺球蛋白检测试剂盒,其中所述第二包被载体的外侧面包被材料如下:
16.所述捕获抗体标记有生物素时,所述第二包被载体的外侧面包被材料为链霉亲和素;
17.所述捕获抗体标记有荧光素时,所述第二包被载体的外侧面包被材料为荧光素抗体。
18.本发明的目的及解决其技术问题是采用以下技术方案来实现的。依据本发明提出的一种甲状腺球蛋白半定量检测方法,其包括以下步骤:
19.1)穿刺,抽取甲状腺球蛋白检测样本;
20.2)将规定量的检测样本直接注入样本稀释液中,混匀,反应,得到包含免疫复合物的溶液;所述样本稀释液包含抗体或抗原,以及稀释所述抗体或抗原的免疫反应缓冲溶液;所述抗体或抗原至少标记有彩色微球;
21.3)将包含免疫复合物的溶液依次流经第一包被载体和第二包被载体;所述第一包被载体的外侧面包被有能够特异性结合人种属的抗体或抗原的组分;所述第二包被载体的外侧面包被有能够特异性结合免疫复合物的组分;
22.4)通过比色卡读取甲状腺球蛋白的检测结果。
23.优选的,前述的甲状腺球蛋白半定量检测方法,其中所述方法通过前述的甲状腺球蛋白检测试剂盒实现。
24.本发明的目的及解决其技术问题是采用以下技术方案来实现的。依据本发明提出的一种样本穿刺检测针,其包括依次设置的针头、针筒和活塞推杆,所述针头设置于所述针筒的一端;所述活塞推杆设置于所述针筒的另一端,能够沿着所述针筒的内壁轴向移动,其还包括:
25.第一包被载体,设置于所述针筒内靠近针头的一端;所述第一包被载体的外侧面包被材料能够特异性结合人种属的抗体或抗原;所述第一包被载体与所述针筒间隙配合;
26.第二包被载体,设置于所述针筒内背离针头的一端;所述第二包被载体的外侧面包被材料能够特异性结合免疫复合物;所述第二包被载体与所述针筒间隙配合;所述第一
包被载体和所述第二包被载体均设置于所述针头与所述活塞推杆之间。
27.优选的,前述的样本穿刺检测针,其中所述第一包被载体和所述第二包被载体均与所述针筒内壁活动卡接;所述第一包被载体和所述第二包被载体至少平行于针筒内壁的侧壁被包被;所述针筒和所述针头连接处设有过滤网;所述过滤网的孔径为1μm;所述样本穿刺检测针还包括刻度线;所述刻度线设置于所述针筒外壁上靠近所述针头的一端,用于计量检测样本的体积。
28.本发明的目的及解决其技术问题是采用以下技术方案来实现的。依据本发明提出的一种根据前述的样本穿刺检测针在甲状腺球蛋白半定量检测中的应用,所述第二包被载体的外侧面包被材料与待检测样本、样本稀释液的型号匹配;具体包括以下步骤:
29.1)通过所述针头抽取检测样本,将其置于样本稀释液中反应,得到免疫复合物溶液;
30.2)通过所述活塞推杆移动将所述免疫复合物溶液通过所述针头抽取至所述针筒内;所述免疫复合物溶液先流经所述第一包被载体与所述针筒之间的间隙以截留人体自身的抗体或抗原,再流经所述第二包被载体与所述针筒之间的间隙以捕获所述免疫复合物;
31.3)通过比色卡读取甲状腺球蛋白的检测结果。
32.借由上述技术方案,本发明提出的一种甲状腺球蛋白检测试剂盒、甲状腺球蛋白半定量检测方法、样本穿刺检测针及样本穿刺检测针在甲状腺球蛋白半定量检测中的应用至少具有下列优点:
33.本技术提出的甲状腺球蛋白检测试剂盒、甲状腺球蛋白半定量检测方法、样本穿刺检测针及样本穿刺检测针在甲状腺球蛋白半定量检测中的应用,其可以通过针头取样,抽取检测样本后,将其加入样本稀释液中;当需要检测甲状腺球蛋白中抗原浓度时,样本稀释液中包括抗体和免疫反应缓冲溶液;当需要检测甲状腺球蛋白中抗体浓度时,样本稀释液中包括抗原和免疫反应缓冲溶液;样本稀释液中的抗体或抗原至少标记有彩色微球,也可以标记有生物素或荧光素;检测样本在样本稀释液中反应,可能生成包含“生物素或荧光素-捕获抗体-待测抗原-检测抗体-彩色微球”、“待测抗原-检测抗体-彩色微球”或“待测抗体-检测抗原-彩色微球”等的免疫复合物溶液;所述免疫复合物溶液先流经所述第一包被载体,此时第一包被载体上的包被材料可以截留人体自身的抗体或抗原,以避免或减少其对于后期显色效果的影响,从而减少或避免假阴性或假阳性的检测错误;所述免疫复合物溶液再流经所述第二包被载体,此时所述第二包被载体的包被材料与所述免疫复合物特异性结合,使其显色;然后通过比色卡读取甲状腺球蛋白的检测结果。本发明的技术方案无需对检测样本进行步骤繁多的预处理,也无需反复进行离心等操作,其仅需将抽取的检测样本直接注入样本稀释液中进行反应,再将反应得到的免疫复合物溶液依次流经第一包被载体和第二包被载体,即可得到甲状腺球蛋白中抗体或抗原的浓度结果,从而实现即时地对相关病情进行有效推断甚至判断,有效解决了现有技术无法满足手术即时性和临场性的问题。
34.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
35.图1是本发明样本穿刺检测针的示意图;
36.图2是本发明样本穿刺检测针第一包被载体或第二包被载体与针筒配合的结构示意图;
37.图3示出了图2沿a-a的截面示意图。
具体实施方式
38.为更进一步阐述本发明为达成预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明提出的一种甲状腺球蛋白检测试剂盒、甲状腺球蛋白半定量检测方法、样本穿刺检测针及样本穿刺检测针在甲状腺球蛋白半定量检测中的应用,其具体实施方式、结构、特征及其功效,详细说明如后。
39.本发明提出一种甲状腺球蛋白检测试剂盒,其包括样本稀释液和样本穿刺检测针。所述样本稀释液用于使检测样本发生复合反应,以生成免疫复合物;所述样本穿刺检测针一方面可以用于抽取检测样本,将其注入样本稀释液中;另一方面也可以将复合反应生成的免疫复合物溶液吸取至针筒内进行捕获显色,以获得检测结果。
40.所述样本稀释液中包含抗体或抗原,以及稀释所述抗体或抗原的免疫反应缓冲溶液;所述免疫反应缓冲溶液可以选择本领域惯用的任意形式的缓冲溶液,例如,可以选取磷酸盐缓冲液、mes/hepes、碳酸盐缓冲液、或柠檬酸缓冲液等的任意一种或几种,在本发明中不做具体限定。
41.当待检测的指标是甲状腺球蛋白中的抗原浓度时,则所述样本稀释液中包含抗体和稀释所述抗体的免疫反应缓冲溶液;当待检测的指标是甲状腺球蛋白中的抗体浓度时,则所述样本稀释液中包含抗原和稀释所述抗原的免疫反应缓冲溶液。
42.所述样本稀释液中包括抗体或抗原,其可以仅包含用于结合彩色微球的检测抗体或抗原,也可以同时包含结合生物素或荧光素的捕获抗体。所述检测抗体或抗原标记有彩色微球;所述彩色微球选自荧光微球、量子点、胶体金和乳胶微球中的任意一种。
43.当所述抗体或抗原仅包括检测抗体时,所述第二包被载体的外侧面包被材料为能够与待检测抗原特异性结合的捕获抗体;当所述抗体或抗原仅包括检测抗原时,所述第二包被载体的外侧面包被材料为能够与待检测抗体特异性结合的二抗;所述二抗是从其他种属提取的抗来自人源抗体的抗体。
44.所述生物素与所述捕获抗体的摩尔比为1:10~100;优选其摩尔比为1:20;所述荧光素与所述捕获抗体的摩尔比为1:1~100;优选其摩尔比为1:5。
45.所述第二包被载体的外侧面包被材料如下:
46.所述捕获抗体标记有生物素时,则所述第二包被载体的外侧面包被材料对应使用链霉亲和素;当第二包被载体的外侧面包被链霉亲和素时,其包被过程如下:配制0.06mol/l的柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将链霉亲和素稀释至浓度为1μg/ml~50μg/ml,优选10μg/ml;然后向1mg链霉亲和素溶液中加入0.02mg的ch-((ch2)n-nhs)3,n选择5-15,优选10;室温搅拌温育20min,该溶液作为第二包被液。该分子上的n羟基琥珀酰亚胺酯(-nhs)可特异性结合链霉亲和素上的氨基,从而将链霉亲和素改造为多聚链霉亲和素,提升链霉亲和素在聚苯乙烯材质上的吸附能力。然后将第二包被载体的包被区浸泡于第二包
被液浸泡,再将其浸泡于封闭液中进行封闭;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。最后将包被有第二包被液组分的第二包被载体安装于针筒中靠近活塞推杆的一端待用。
47.所述捕获抗体标记有荧光素时,则所述第二包被载体的外侧面包被材料对应使用荧光素抗体;当第二包被载体的外侧面包被荧光素抗体时,其包被过程如下:配制0.06mol/l柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将荧光素抗体稀释至1μg/ml~50μg/ml,优选5μg/ml,该溶液作为第二包被液。然后将第二包被载体的包被区浸泡于第二包被液浸泡,再将其浸泡于封闭液中进行封闭;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。最后将包被有第二包被液组分的第二包被载体安装于针筒中靠近活塞推杆的一端待用。
48.所述样本稀释液中,所述抗体或抗原与免疫反应缓冲溶液的体积比为1:300~3000;一般优先1:300。当同时包含捕获抗体和检测抗体时,二者的摩尔比优选为1:1,以使其能够有效形成免疫复合物,同时不会造成材料成本的浪费。
49.所述甲状腺球蛋白检测试剂盒中,一般每瓶分装样本稀释液为0.05ml~0.5ml;优选为0.2ml。
50.所述甲状腺球蛋白检测试剂盒所包括的样本穿刺检测针,如附图1所示,其包括针头31、针筒32、第一包被载体41和第二包被载体42;所述第一包被载体、第二包被载体沿针筒轴向顺序设置于所述针筒内;所述第一包被载体、第二包被载体与所述针筒间隙配合;所述第一包被载体设置于所述针筒内靠近针头的一端;所述第一包被载体的外侧面包被材料能够特异性结合人种属的抗体或抗原;一般可以包被二抗,例如,驴抗人二抗、鼠抗人二抗或兔抗人二抗;所述第一包被载体的包被液的浓度为1μg/ml~50μg/ml;优选10μg/ml;当捕获抗体为标记荧光素的情形时,所述第一包被载体的外侧面包被材料也可以包被链霉亲和素;包被链霉亲和素的具体过程同前文所述;当免疫复合物溶液流经第一包被载体,第一包被载体可以截留人体自身的抗体或抗原,以避免或减少其对显色结果的影响,从而避免或减少假阳性或假阴性结果。所述第二包被载体设置于所述针筒内背离针头的一端;所述第二包被载体的外侧面包被材料能够特异性结合免疫复合物;当免疫复合物溶液流经第二包被载体,第二包被载体可以捕获免疫复合物,使其链接的彩色微球在此处堆积,从而可以根据显色颜色的深浅来识别第二包被材料所捕获的抗体或抗原数量。
51.所述甲状腺球蛋白检测试剂盒还包括比色卡(图中未示出);所述比色卡可以独立存在;或者,所述比色卡也可以设置于所述针筒的外壁上,以便于其保存和对照比色;通过目测比对第二包被材料处堆积的彩色微球的颜色与比色卡的标准颜色,得出所检测的抗体或抗原的浓度结果。
52.上述技术方案检测甲状腺球蛋白无需进行检测样本预处理等操作,直接将其注入样本稀释液中反应,即可将反应产物抽吸至针筒内进行显色读数,不仅快速,而且可以用于任何场合的检测。
53.本发明还提出一种甲状腺球蛋白半定量检测方法,其包括以下步骤:
54.1)穿刺,抽取甲状腺球蛋白检测样本;
55.2)将规定量的检测样本直接注入样本稀释液中,混匀,反应,得到包含免疫复合物的溶液;所述样本稀释液包含抗体或抗原,以及稀释所述抗体或抗原的免疫反应缓冲溶液;
所述抗体或抗原至少标记有彩色微球;
56.3)将包含免疫复合物的溶液依次流经第一包被载体和第二包被载体;所述第一包被载体的外侧面包被有能够特异性结合人种属的抗体或抗原的组分;所述第二包被载体的外侧面包被有能够特异性结合免疫复合物的组分;
57.4)通过比色卡读取甲状腺球蛋白的检测结果。
58.上述检测方法可以通过前述的甲状腺球蛋白检测试剂盒实现。
59.本发明还提出一种样本穿刺检测针,如附图1所示,其包括依次设置的针头31、针筒32和活塞推杆34,所述针头设置于所述针筒的一端;所述针头可以根据穿刺需要进行规格选择与设计,并且针对于手术的环境要求需保证真空洁净标准;所述针筒为透明状以便于观察第二包被载体出的颜色进行比色读数;所述活塞推杆设置于所述针筒的另一端,能够沿着所述针筒的内壁轴向移动,其还包括:
60.第一包被载体41,设置于所述针筒内靠近针头的一端;所述第一包被载体的外侧面包被材料能够特异性结合人种属的抗体或抗原;所述第一包被载体与所述针筒间隙配合;
61.第二包被载体42,设置于所述针筒内背离针头的一端;所述第二包被载体的外侧面包被材料能够特异性结合免疫复合物;所述第二包被载体与所述针筒间隙配合;所述第一包被载体和所述第二包被载体均设置于所述针头与所述活塞推杆之间。
62.为了准确计量所取的检测样本数量,所述样本穿刺检测针还可以设置有刻度线33;所述刻度线设置于所述针筒外壁上靠近所述针头的一端,用于计量检测样本的体积,以实现对检测样本的定量抽取,提高检测精度;
63.为了便于直观地对照比色,所述样本穿刺检测针还包括比色卡(图中未示出);所述比色卡设置于所述针筒的外壁上背离所述针头的一端,用作读取检测结果的比色标准。所述比色卡可以选择本领域技术人员熟知的标准件,本发明对其不作具体限定。
64.为了避免检测样本中有组织、红细胞、大分子、杂质等进入针筒影响后续的检测,本发明可以在所述针筒和所述针头连接处设置过滤网,以实现有效滤除;一般优选所述过滤网的孔径为1μm。
65.所述刻度线间隔为50μl;使用样本穿刺检测针抽取甲状腺液检测样本时优选样本量为50~300μl,刻度线设置为50μl、100μl、150μl、200μl、300μl;检测甲状腺球蛋白时优选检测样本量为100μl,以有效保证抽取到的指定抗原浓度较为接近真实浓度。
66.所述第一包被载体沿针筒的轴向与刻度线间隔设置,即与最大体积刻度线之间具有一定间隔,以使得在定量抽取检测样本时,如不进行人为摇晃,检测样本不会与第一包被载体产生接触,以避免检测样本与样本稀释液之间的反应造成影响。
67.为了实现所述第一包被载体和第二包被载体的便捷设置,本发明可以将第一包被载体和第二包被载体与针筒内壁设置为活动卡接,如附图2和附图3所示;可以在所述第一包被载体和第二包被载体的任一径向两端的侧壁上设置凸起部,并在针筒内壁上对应所述凸起部设置凹槽,利用凸起部和凹槽实现卡接;当然,凸起部的数量可以根据实际需要进行设计调整,绕所述第一包被载体和第二包被载体的轴向间隔分布即可。
68.为了便于观察显色程度且便于比色,本发明中将除上述凸起部外的所述第一包被载体和第二包被载体的外侧壁与所述针筒的内壁设置为间隙配合,使得免疫复合物溶液能
够通过该间隙流经第一包被载体和第二包被载体,使其与第一包被载体和第二包被载体上的包被组分接触,彩色微球的堆积颜色主要显示在所述第一包被载体和第二包被载体的外侧壁与所述针筒的内壁之间的间隙上,进而能够有效提高显色的清晰度与比色的便捷程度。
69.所述第一包被载体和所述第二包被载体至少平行于针筒内壁的侧壁被包被。
70.所述第一包被载体和第二包被载体为经过特定的包被液浸泡附着的刚性结构体;所述第一包被载体和第二包被载体的形状可以是柱状或饼状,例如,材质可以选用聚苯乙烯,第一包被载体和第二包被载体上至少其外侧面经过钴源γ射线辐照,以使其具有吸附抗体或抗原的能力,进而在免疫复合物溶液流经第一包被载体和第二包被载体时,可以立即将人种属的抗体或抗原吸附在第一包被载体的外侧面上以形成对人体自身抗体或抗原的截留,避免其对检测结果造成影响;同时,可以立即将外源性(非人种属)的抗体或抗原吸附在第二包被载体的外侧面上以形成对彩色微球的捕获和堆积,使其产生不同深度的颜色,从而通过比色卡对其进行比色读数。
71.本发明还提出一种根据前述的样本穿刺检测针在甲状腺球蛋白半定量检测中的应用,所述第二包被载体的外侧面包被材料与待检测样本、样本稀释液的型号匹配,详见前文所述;具体包括以下步骤:
72.1)通过所述针头抽取检测样本,将其置于样本稀释液中反应,得到免疫复合物溶液;
73.2)通过所述活塞推杆移动将所述免疫复合物溶液通过所述针头抽取至所述针筒内;所述免疫复合物溶液先流经所述第一包被载体与所述针筒之间的间隙以截留人体自身的抗体或抗原,再流经所述第二包被载体与所述针筒之间的间隙以捕获所述免疫复合物;
74.3)通过比色卡读取甲状腺球蛋白的检测结果。
75.下面将结合具体实施例对本发明作进一步说明,但不能理解为是对本发明保护范围的限制,该领域的技术人员根据上述本发明的内容对本发明作出的一些非本质的改进和调整,仍属于本发明的保护范围。
76.若无特殊说明,以下所涉及的材料、试剂等均为本领域技术人员熟知的市售商品;若无特殊说明,所述方法均为本领域公知的方法。除非另外定义,所使用的技术术语或者科学术语应当为本发明所属领域内的普通技术人员所理解的通常意义。
77.实施例1
78.甲状腺穿刺合并检测甲状腺球蛋白(tg)中的抗原浓度检测
79.1、样本稀释液配制
80.1.1生物素标记甲状腺球蛋白捕获抗体:
81.1.1.1抗体前处理:
82.选择适当截留的超滤柱,加入200μl的磷酸缓冲盐溶液(pbs,浓度0.1mol/l,ph值7.2,下同),加入1mg浓度为5mg/ml的捕获抗体,混匀;于4℃条件下,以4000rpm的转速离心5min,弃滤液。
83.于超滤柱中再加入200μl的磷酸缓冲盐溶液,混匀;于4℃条件下,以4000rpm的转速离心5min,弃滤液。重复上述步骤1~3次。
84.混匀超滤柱中残留的液体,于室温条件静置1min;将超滤柱反转,倒置于一新的超
滤管中,于4℃条件下,以4000rpm的转速离心5min,收集液体。
85.再取50μl的磷酸缓冲盐溶液于超滤柱中混匀,静置1min。倒置超滤柱,于4℃条件下,以6000rpm的转速离心2min,收集液体。
86.将收集的滤液合并,用磷酸缓冲盐溶液调节捕获抗体的浓度到2mg/ml,于4℃放置备用。
87.1.1.2生物素的标记:
88.将生物素用二甲基亚砜(dmso)溶解,浓度为20mg/ml,按照生物素与捕获抗体分子的摩尔比1:20的比例将其加入前一步骤配制的捕获抗体溶液中,于室温搅拌下避光反应1h。
89.1.1.3通过葡聚糖凝胶分离纯化/透析袋或者超滤管去除游离的生物素及其他试剂。
90.1.1.4将捕获抗体保存于0.02m的磷酸盐缓冲液中。
91.1.2红色乳胶微球标记甲状腺球蛋白检测抗体:
92.1.2.1清洗:
93.取红色乳胶微球(4%固含量)12.5ul,加入487.5μl的2-(n-吗啡啉)乙磺酸缓冲液(mes,浓度为50mmol/l,ph值6.0,下同)中,超声混匀后高速冷冻,离心1~3次,期间注意观察应避免凝集结块现象。
94.1.2.2一次活化:
95.取清洗后的红色乳胶微球,加入500μl的2-(n-吗啡啉)乙磺酸缓冲液中,超声混匀后,加入10μl的1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)的2-(n-吗啡啉)乙磺酸缓冲液溶液,所述溶液是将10mg的edc溶质溶解至1ml的2-(n-吗啡啉)乙磺酸缓冲液中得到;摇匀后室温反应30min。一次活化后微球高速冷冻离心,期间注意观察应避免凝集结块现象。
96.1.2.3连接间隔臂:
97.取一次活化后红色乳胶微球,加入100μl的2-(n-吗啡啉)乙磺酸缓冲液,超声混匀后加入10μg的羧基扩展分子(cooh)
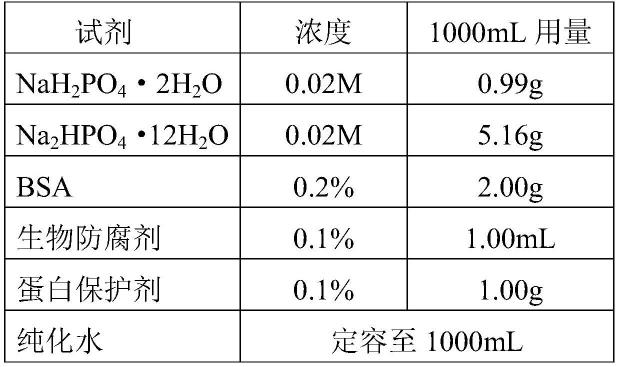
2-ch-(ch2)
12-nh2,摇匀后室温反应30min,偶联后微球高速冷冻离心。
98.1.2.4二次活化:
99.取离心后带有间隔臂的红色乳胶微球,加入500μl的2-(n-吗啡啉)乙磺酸缓冲液,超声混匀后加入20μl的1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)的2-(n-吗啡啉)乙磺酸缓冲液溶液(溶液同1.2.2);摇匀后室温反应30min。二次活化后微球高速冷冻离心。
100.1.2.5抗体偶联:
101.取二次活化后红色乳胶微球,加入100μl的2-(n-吗啡啉)乙磺酸缓冲液,超声混匀后加入20μg浓度为5mg/ml的检测抗体,避光室温搅拌2h,偶联后微球高速冷冻离心,期间注意观察应避免凝集结块现象。
102.1.2.6封闭:
103.取偶联后红色微球,加入500μl的封闭缓冲液,所述封闭缓冲液(下同)是浓度为50mmol/l的4-羟乙基哌嗪乙磺酸的溶液,其中还包括质量百分含量1%的牛血清白蛋白
(bsa),质量百分含量0.1%的防腐剂(p-300),ph值8.0;超声混匀后避光封闭30min,封闭后微球高速冷冻离心,期间注意观察应避免凝集结块现象。
104.1.2.7保存:
105.将标记好的红色微球加入50μl的封闭缓冲液,超声混匀后保存备用。
106.1.3配制缓冲体系:
107.按照下述表1配比配制缓冲体系:
108.表1
[0109][0110]
将上述试剂称量好,放入洁净容器中,加纯化水定容1000ml,溶解混匀,用ph计测定ph值为7.10~7.60。
[0111]
1.4样本稀释液配制:
[0112]
将本实施例前述制备的生物素标记的捕获抗体与缓冲体系稀释液以体积比1:300的比例进行稀释;将本实施例前述制备的彩色微球标记的检测抗体与缓冲体系稀释液以体积比1:300的比例进行稀释;将生物素标记的捕获抗体稀释液与彩色微球标记的检测抗体稀释液混合,使混合液中捕获抗体与检测抗体的摩尔比为1:1。
[0113]
将上述混合液进行分装,每瓶分装0.2ml。
[0114]
2、包被载体的包被和安装:
[0115]
2.1第一包被载体包被:
[0116]
在第一包被载体的外侧面进行二抗包被;包被过程如下:配制0.06mol/l的柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将驴抗人二抗溶解至柠檬酸-柠檬酸钠缓冲液中,控制其浓度为10μg/ml,作为第一包被载体的第一包被液。
[0117]
将第一包被载体的包被区浸泡于第一包被液中,于4℃下过夜,第二天取出后,再将其浸泡于封闭液中于4℃下过夜;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。
[0118]
将包被有第一包被液组分的第一包被载体安装于针筒中靠近针头的一端待用。
[0119]
2.2第二包被载体包被:
[0120]
在第二包被载体的外侧面进行链霉亲和素包被;包被过程如下:配制0.06mol/l的柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将链霉亲和素稀释至浓度为10μg/ml,向1mg链霉亲和素溶液中加入0.02mg的ch-((ch2)n-nhs)3,n为10,室温搅拌温育20min,该溶液作为第二包被液。
[0121]
将第二包被载体的包被区浸泡于第二包被液中,于4℃下过夜,第二天取出后,再将其浸泡于封闭液于4℃下过夜;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。
[0122]
将包被有第二包被液组分的第二包被载体安装于针筒中靠近活塞推杆的一端待用。
[0123]
3检测流程:
[0124]
具体操作步骤如下:
[0125]
1)对甲状腺区域淋巴结组织进行穿刺;
[0126]
2)使用样本穿刺检测针抽取甲状腺液100μl;
[0127]
3)将穿刺抽取的甲状腺液注入一次性稀释液中,混匀,随后再次用样本穿刺检测针将全部的免疫复合物溶液吸取至针筒中,液体经内部空隙流经第一包被载体包被区域和第二包被载体包被区域,随着抽取力度加大,免疫复合物通过生物素-链霉亲和素固定于包被区,随着tg浓度加大颜色加深。与比色卡进行比对,实现甲状腺球蛋白tg半定量检测。
[0128]
4检测数据评价:
[0129]
重复上述检测步骤5次,检测结果如下表2所示,其每次检测结果一致,均为l5,说明本实施例所述方法的重复性符合要求。
[0130]
将检测样本使用现有技术中准确定量的检测方法进行检验,其检测结果如下表2所示:
[0131]
表2
[0132]
标本检测本实施例方法现有技术方法ng/ml1l5240.682l5220.373l5235.374l5242.335l5244.35
[0133]
红色乳胶微球比色卡如下表3;其对应的定量结果标准如下表4。
[0134]
表3
[0135][0136]
表4
[0137] tg(ng/ml)l1<30l230~80l380~140l4140~200
l5200~250l6250~300l7300~350l8350~400l9>400
[0138]
根据上述表2和表4的检测结果可见,本发明的半定量检测方法检测的结果,其浓度范围与现有技术中准确定量的检测结果一致,说明本发明的半定量检测方法得到的检测结果准确可靠。
[0139]
实施例2:
[0140]
同实施例1。区别仅在于:
[0141]
1)甲状腺球蛋白捕获抗体是由荧光素进行标记;在荧光素标记时,荧光素与捕获抗体分子的摩尔比1:5;检测抗体同实施例1一样使用红色乳胶微球标记;
[0142]
2)第一包被载体包被链霉亲和素,链霉亲和素的包被步骤同实施例1;
[0143]
3)第二包被载体包被:
[0144]
在第二包被载体的外侧面进行荧光素抗体包被;包被过程如下:配制0.06mol/l的柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将荧光素抗体溶解至柠檬酸-柠檬酸钠缓冲液中,控制其浓度为5μg/ml,作为第二包被载体的第二包被液。
[0145]
将第二包被载体的包被区浸泡于第二包被液中,于4℃下过夜,第二天取出后,再将其浸泡于封闭液中于4℃下过夜;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。
[0146]
将包被有第二包被液组分的第二包被载体安装于针筒中靠近活塞推杆的一端待用。
[0147]
4)将荧光素标记的捕获抗体稀释液与彩色微球标记的检测抗体稀释液混合,使混合液中捕获抗体与检测抗体的摩尔比为1:1。
[0148]
检测数据评价:
[0149]
重复上述检测步骤5次,检测结果如下表5所示,其每次检测结果一致,均为l5,说明本实施例所述方法的重复性符合要求。
[0150]
将检测样本使用现有技术中准确定量的检测方法进行检验,其检测结果如下表5所示:
[0151]
表5
[0152][0153]
[0154]
与实施例1相同,红色乳胶微球比色卡如表3;其对应的定量结果标准如表4。根据上述表5的检测结果可见,本发明的半定量检测方法检测的结果,其浓度范围与现有技术中准确定量的检测结果一致,说明本发明的半定量检测方法得到的检测结果准确可靠。
[0155]
实施例3
[0156]
甲状腺穿刺合并检测甲状腺球蛋白(tg)的抗体浓度检测
[0157]
同实施例1。区别仅在于:
[0158]
1)样本稀释液中不包括捕获抗原,因此不包括捕获抗原标记的步骤;
[0159]
2)甲状腺球蛋白检测抗原使用荧光微球进行标记,标记步骤同实施例1的红色乳胶微球的标记步骤;
[0160]
3)样本稀释液配制:将本实施例前述制备的荧光微球标记的检测抗原与缓冲体系稀释液以体积比1:300的比例进行稀释,分装,每瓶分装0.2ml。
[0161]
4)第一包被载体包被链霉亲和素,链霉亲和素的包被步骤同实施例1;
[0162]
5)第二包被载体包被鼠抗人二抗,二抗包被步骤同实施例1;
[0163]
检测数据评价:
[0164]
重复上述检测步骤5次,检测结果如下表6所示,其每次检测结果一致,均为l2,说明本实施例所述方法的重复性符合要求。
[0165]
将检测样本使用现有技术中准确定量的检测方法进行检验,其检测结果如下表6所示:
[0166]
表6
[0167]
标本检测本实施例方法现有技术方法(iu/ml)1l2180.332l2167.543l2163.494l2164.585l2166.91
[0168]
荧光微球比色卡如下表7;其对应的定量结果标准如下表8。
[0169]
表7
[0170][0171]
表8
[0172] tg抗体(iu/ml)l1<120l2120~200
l3200~300l4300~400l5400~500l6500~600l7600~700l8700~800l9>800
[0173]
根据上述表6和表8的检测结果可见,本发明的半定量检测方法检测的结果,其浓度范围与现有技术中准确定量的检测结果一致,说明本发明的半定量检测方法得到的检测结果准确可靠。
[0174]
实施例4
[0175]
同实施例1。区别仅在于:
[0176]
1)样本稀释液中不包括捕获抗体,因此不包括捕获抗体标记的步骤;
[0177]
2)样本稀释液配制:将本实施例前述制备的红色乳胶微球标记的检测抗体与缓冲体系稀释液以体积比1:300的比例进行稀释,分装,每瓶分装0.2ml。
[0178]
3)第一包被载体包被兔抗人二抗,二抗包被步骤同实施例1;
[0179]
4)第二包被载体包被:
[0180]
捕获抗体包被在第二包被载体上,具体步骤如下:配制0.06mol/l的柠檬酸-柠檬酸钠缓冲液,其ph值为4.8;然后将捕获抗体溶解至柠檬酸-柠檬酸钠缓冲液中,控制其浓度为2μg/ml,作为第二包被载体的第二包被液。
[0181]
将第二包被载体的包被区浸泡于第二包被液中,于4℃下过夜,第二天取出后,再将其浸泡于封闭液中于4℃下过夜;所述封闭液为0.02mol/l的磷酸缓冲液,其中还包含质量百分含量为1%的bsa,0.1%的生物防腐剂;取出,烘干。
[0182]
将包被有第二包被液组分的第二包被载体安装于针筒中靠近活塞推杆的一端待用。
[0183]
检测数据评价:
[0184]
重复上述检测步骤5次,检测结果如下表9所示,其每次检测结果一致,均为l5,说明本实施例所述方法的重复性符合要求。
[0185]
将检测样本使用现有技术中准确定量的检测方法进行检验,其检测结果如下表9所示:
[0186]
表9
[0187]
标本检测本实施例方法现有技术方法(ng/ml)1l5240.682l5220.253l5235.374l5242.335l5244.35
[0188]
与实施例1相同,红色乳胶微球比色卡如表3;其对应的定量结果标准如表4。根据上述表9的检测结果可见,本发明的半定量检测方法检测的结果,其浓度范围与现有技术中
准确定量的检测结果一致,说明本发明的半定量检测方法得到的检测结果准确可靠。
[0189]
本发明权利要求和/或说明书中的技术特征可以进行组合,其组合方式不限于权利要求中通过引用关系得到的组合。通过权利要求和/或说明书中的技术特征进行组合得到的技术方案,也是本发明的保护范围。
[0190]
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。