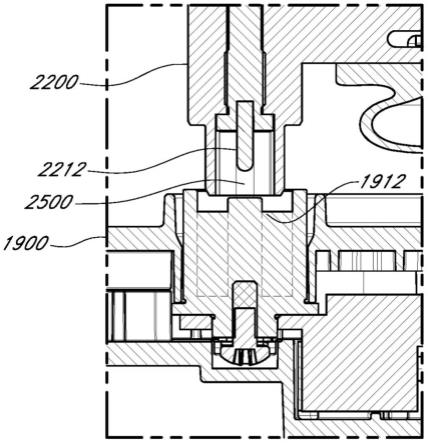
测量卡非佐米的方法
背景技术:
1.在配制前准确评估溶液中活性药物成分(api)的浓度对于确保将正确量的api分配到所得配制品中是重要的。卡非佐米是经批准的用于治疗多发性骨髓瘤的api,并且以名称销售。需要在配制过程中准确测量卡非佐米以确保所得配制品含有所希望量的卡非佐米。因此,对于提供样品中的卡非佐米的准确测量的方法存在需要。
技术实现要素:
2.本文提供了在卡非佐米的配制过程中测量样品中的卡非佐米浓度的方法。用于测量样品中的卡非佐米浓度的方法包括用包含水和按体积计小于50%的乙腈的稀释剂稀释该样品以形成分析样品;以及对该分析样品进行高效液相色谱法(hplc)以获得该样品的卡非佐米浓度。在各种实施例中,样品来自卡非佐米复合药。在一些实施例中,样品来自卡非佐米的散装冻干溶液。在一些实施例中,样品是溶解样品。在一些实施例中,样品是稀释后样品。在各种情况下,稀释剂是水和按体积计0%至45%的乙腈。在一些情况下,稀释剂是水和按体积计25%至40%的乙腈。在一些情况下,稀释剂是水和按体积计30%的乙腈。在一些情况下,稀释剂是水和按体积计40%的乙腈。在各种实施例中,这些方法提供从样品的多个分析样品确定的小于2%的相对标准偏差(rsd)值。在一些情况下,rsd%小于1%。在一些情况下,rsd%小于0.5%。在各种情况下,样品中的卡非佐米的浓度是3mg/ml至8mg/ml。在一些情况下,样品中的卡非佐米的浓度是5mg/ml至6mg/ml。在各种实施例中,在hplc分析之前,分析样品是在2℃至8℃的温度下。在各种实施例中,在hplc分析之前,分析样品是在室温下。在各种实施例中,本文披露的方法进一步包括由散装冻干溶液制备冻干物。在一些情况下,冻干物含有10mg卡非佐米。在一些情况下,冻干物含有30mg卡非佐米。在一些情况下,冻干物含有60mg卡非佐米。
附图说明
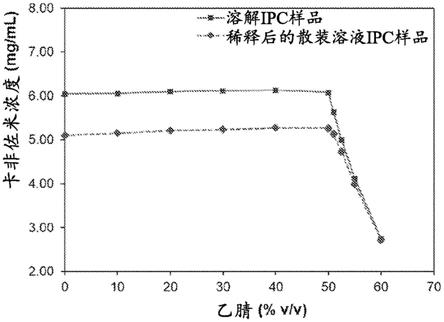
3.图1示出了使用一系列稀释剂分析的样品的卡非佐米浓度结果,这些稀释剂在水中含有按体积计不同百分比的乙腈。
4.图2示出了由浓度为约7.8mg/ml的样品用50%v/v acn稀释剂制备的分析样品溶液的浓度,当分析样品在hplc分析之前处于5℃时,在第1天和第2天进行分析。
5.图3示出了范围从3.7mg/ml至7.8mg/ml的样品溶液的浓度,对应于方法标称浓度的60%至130%的范围,其中分析样品用30%和40%v/v acn稀释剂制备并且分析样品在hplc分析之前是5℃。
具体实施方式
6.卡非佐米经批准用于治疗多发性骨髓瘤并作为冻干物制备用于在单剂量小瓶中重构和注射,包括含有10mg、30mg、或60mg卡非佐米的小瓶。
7.在将卡非佐米配制成冻干物之前,测定卡非佐米的浓度是重要的,使得冻干物含
有适当量的卡非佐米。本文披露了用于测量样品中的卡非佐米的浓度的改进方法,其提供了样品中的卡非佐米的更准确评估。在一些情况下,样品的卡非佐米浓度是3mg/ml至8mg/ml。在一些情况下,卡非佐米浓度是5mg/ml至6mg/ml。
8.注射用卡非佐米散装(冻干)溶液的过程控制(ipc)方法是高效液相色谱法(hplc)测定,用于测定在复配过程中在散装溶液的溶解和稀释后ipc样品中的卡非佐米的浓度。使用乙腈(acn)和水的稀释剂稀释过程中散装溶液,例如,稀释十倍。在一些实施例中,将卡非佐米样品使用稀释剂稀释至少两倍,并且在一些情况下,使用稀释剂稀释八至十五倍、或八至十二倍、或九至十一倍。如本文所用,“分析样品”是使用稀释剂稀释并可使用hplc进行分析的样品。在上下文中,对样品浓度的提及是指如使用由该样品和稀释剂制备的分析样品评估的样品中的卡非佐米的浓度。
9.先前用于测量卡非佐米浓度的方法使用水和acn的50/50体积比体积(v/v)比率的稀释剂。本文已经确定,稀释剂中过量的acn(》50%体积)可能导致样品溶解度受损,这可能潜在地影响ipc测定结果。此外,如本文中详细描述的,考虑了水和acn的50/50(v/v)比率的常规稀释剂对轻微扰动敏感,这可能影响每个相中的卡非佐米的量,并且因此可能影响卡非佐米浓度测量的准确性。
10.为了评估卡非佐米浓度测量对稀释剂中的acn的量的敏感性,来自注射用卡非佐米的过程中散装(冻干)溶液的溶解和稀释后的散装溶液样品的分析样品在一系列稀释剂(其范围为按体积计从0%至60%的acn)中制备,并使用如在实例部分中所述的测定通过hplc进行分析。在一些情况下,样品来自注射用卡非佐米的过程中散装(冻干)溶液的散装溶液。在一些情况下,样品是溶解样品。在一些情况下,样品是稀释后样品。在一些情况下,在hplc分析期间或之前,将分析样品冷藏(例如,温度为2℃至8℃)。卡非佐米样品的不同acn浓度条件的结果在图1中示出。
11.考虑了可以在卡非佐米的制造和配制的各个阶段(例如,在卡非佐米复配过程中)收集样品,并且本文所述的方法可以用于测量来自各个阶段的这些样品中的卡非佐米浓度。例如,制造可包括在配制的散装溶液中溶解卡非佐米,并且随后可包括稀释配制的散装溶液(例如,通过添加注射用水)以获得包含目标浓度的卡非佐米的药物产品以填充到小瓶中。卡非佐米浓度的测量可以在配制的散装溶液中进行(例如,以确定需要多少稀释剂才能达到药物产品中的目标浓度),并且此外可以在配制的散装产品的稀释后进行(例如,以验证药物产品含有目标浓度或卡非佐米)。如本文所用,术语“溶解样品”是指包含尚未稀释至药物产品的目标浓度的溶解卡非佐米的样品。
12.如本文所用,术语“稀释后的散装溶液样品”是指包含卡非佐米散装溶液和稀释剂的样品。卡非佐米可以处于目标浓度,或可以是处于目标浓度的候选物。稀释后的散装溶液可包括用于填充小瓶(例如,单剂量小瓶)的药物产品。
13.如图1中可以看出,当稀释剂中的acn的百分比超过50%时,测得的卡非佐米浓度降低。这些数据突出了稀释剂中的过量acn可能导致ipc测定结果不准确、低的风险。因此,本文披露的方法包括用包含水和按体积计小于50%的acn的稀释剂稀释卡非佐米样品以形成分析样品。在一些实施例中,稀释剂包含按体积计0.1%至49.9%的acn。在一些实施例中,稀释剂包含按体积计0%至45%的acn。在一些实施例中,稀释剂是按体积计25%至40%的acn。在一些情况下,稀释剂是按体积计30%的acn。在一些情况下,稀释剂是按体积计
40%的acn。在一些情况下,稀释剂是按体积计小于50%、49%、45%、40%、或25%的acn。在一些情况下,稀释剂包含acn并且是按体积计小于50%、49%、45%、40%、或25%的acn。
14.进行了一系列实验以确定用于注射用卡非佐米散装(冻干)溶液的ipc方法的替代稀释剂,以便降低ipc测定结果不准确、低的风险。图1中显示的数据表明,具有较低%acn的稀释剂造成ipc测定结果不准确、低的风险较低。评估了两种替代稀释剂,按体积计30% acn和40% acn。每种稀释剂在三个不同的代表性ipc测定样品浓度下进行分析,范围为从大约3.7mg/ml至7.8mg/ml,对应于方法标称浓度的60%至130%的范围。所得数据总结在表1中。在一些情况下,样品的卡非佐米浓度是3mg/ml至8mg/ml。在一些情况下,卡非佐米浓度是5mg/ml至6mg/ml。
15.表1
[0016][0017]1相对于方法标称浓度
[0018]
对于评估的每个条件,所有分析样品溶液均使用具有按体积计30%或40%的acn的稀释剂制备,否则按照以下实例部分中披露的分析方法进行分析。结果显示出良好的精确度,如由低%rsd值证明的。在一些实施例中,本文披露的方法提供小于2%的rsd%。在各种情况下,rsd%小于1%。在各种情况下,rsd%小于0.5%。
[0019]
随后进行了验证性研究,其中使用按体积计40% acn的稀释剂对两个溶解和两个稀释后的散装溶液ipc样品进行分析。分析的所有分析样品均显示出良好的精确度,如由低%rsd值证明的,并且结果中未观察到不利趋势。这些数据总结在表2中。
[0020]
表2
[0021][0022][0023]
进行了一系列对比分析,其中通过ipc方法,分别对于两个不同的批次a和b各自使用具有按体积计50%和40%的acn的稀释剂,对相同的样品进行分析。对来自每个溶解样品和稀释后的散装溶液样品的分析样品进行分析。通过ipc方法测定的卡非佐米浓度在两种稀释剂中是可比较的。这些数据在表3中示出。
[0024]
表3
[0025][0026]
溶解或稀释后的散装溶液样品中的卡非佐米浓度可用于适当分配所希望量的卡非佐米用于所得配制品,例如在单剂量小瓶中的冻干物。在一些情况下,在单剂量小瓶中的冻干物含有10mg卡非佐米。在一些情况下,在单剂量小瓶中的冻干物含有30mg卡非佐米。在一些情况下,在单剂量小瓶中的冻干物含有60mg卡非佐米。
[0027]
实例
[0028]
卡非佐米浓度测定:使用高效液相色谱法(hplc)测定对包含卡非佐米的分析样品进行评估。分析样品一式三份制备。将5.0ml样品溶液转移到50ml容量瓶中,并在包含适当比率(v/v)的acn和水的样品稀释剂中稀释,并充分混合。样品在phenomenex geminitmc18柱(50
×
4.6mm 3μm粒度)上,在30℃
±
2℃的柱温,5℃
±
3℃的自动进样器温度,220nm的检
测波长,1.5ml/min的流速,10μl的进样体积,以及4分钟的总运行时间下运行。
[0029]
使用不同量的水和acn作为稀释剂对两种不同的卡非佐米ipc样品的浓度进行了评估,并且结果在下表4中示出。当稀释剂中的acn的量超过50%时,观察到测得的卡非佐米浓度显著下降。
[0030]
表4
[0031]
稀释剂组成样品1样品240%acn6.005.0450%acn6.035.0451%acn5.725.0152.5%acn5.104.9455%acn4.294.1460%acn2.752.82
[0032]
用在水中不同量的acn的稀释剂对又另一组卡非佐米样品的浓度进行了评估,并且在处于和高于50%的acn下测得的浓度降低,如表5中示出。
[0033]
表5
[0034][0035][0036]
当hplc样品托盘冷却至5℃时,使用50%v/v acn稀释剂的样品溶液
[0037]
对在通过hplc分析之前分析样品的温度是否影响测量的卡非佐米的浓度进行了评估。对于在约7.8mg/ml的卡非佐米浓度下用50%v/v acn稀释剂制备的样品溶液观察到相分离的证据(图2)。在这种情况下,在0mm针偏移处(即,hplc小瓶的底部)检测到最低的卡非佐米浓度,并且在15mm针偏移处(即,hplc小瓶的顶部)检测到最高的卡非佐米浓度。等分后第二天对小瓶进行重新进样时,这种卡非佐米浓度梯度在可比较的程度上仍然存在(图2)。重要的是,在用30%v/v或40%v/v acn稀释剂制备的任何样品溶液中都没有观察到这种浓度梯度,对于用保持在室温下的hplc样品托盘分析的任何样品溶液也没有检测到这种浓度梯度。
[0038]
假设这种差异是由稀释剂的acn与水组分之间发生的相分离以及卡非佐米在这些组分中的溶解度不同引起的。由于其水溶解度差,在上部(较低密度)acn层中会检测到较高的卡非佐米浓度。在不受理论限制的情况下,考虑了卡非佐米药物产品中的糖(如环糊精,
其可用于一些配制品中)有助于“糖析”,其中高于一定浓度阈值的糖导致上部有机相中的acn的浓度增加的现象。
[0039]
当用在5℃下的hplc样品托盘进行分析时,用30%v/v acn和40%v/v acn稀释剂制备的所有分析样品溶液产生具有良好精确度的结果,如由低%rsd值证明的。然而,对于用50%v/v acn稀释剂制备的分析样品溶液,特别是在60%和7.8mg/ml卡非佐米浓度(相对于方法标称浓度为130%)下的样品,观察到相当大的可变性,其中这些条件的大多数具有的%rsd》2.0%(表6)。
[0040]
表6
[0041][0042]a所进行的平均值和%rsd计算包括从同一个hplc小瓶对于不同的hplc针位置(0mm、7.5mm、15mm针偏移)重复进样产生的结果
[0043]b相对于方法标称浓度
[0044]
*%rsd》2.0%
[0045]
当hplc样品托盘冷却至5℃时,使用40%v/v acn稀释剂的样品溶液
[0046]
当用在5℃下的hplc样品托盘进行分析时,用50%v/v acn稀释剂制备的分析样品溶液显示出显著梯度的结果,而当在相同条件下进行分析时用30%和40%v/v acn稀释剂制备的所有分析样品溶液均显示出≤2.0% rsd。对于制备后第二天重新进样的hplc样品小瓶,这一观察结果也是如此。该数据表明,将稀释剂中的acn的百分比降低至少10%在70%至130%的浓度范围内(相对于方法标称浓度)获得更准确的测定结果,并且即使在冷却的hplc样品托盘上在24小时的时间段内长期储存小瓶,这一结果保持准确。图3显示了用30%和40%v/v acn制备的每个样品浓度的平均卡非佐米浓度结果和相应的%rsd值。
[0047]
当稀释剂中的acn的百分比超过50%时,检测到的卡非佐米的浓度降低,但在范围为从50%至0%的%acn水平的情况下,实现了一致的卡非佐米浓度(与用50%v/v acn稀释剂获得的值可比较)。使用40%v/v acn稀释剂和冷却至5℃的hplc样品托盘制备的样品溶液显示出在测试的所有四个ipc样品中,测定结果保持精确且准确。所有条件均实现了%rsd≤2.0%(表7)。
[0048]
表7
[0049][0050]a所进行的平均值和%rsd计算包括从同一个hplc小瓶对于不同的hplc针位置(0mm、7.5mm、15mm针偏移)重复进样产生的结果
[0051]b所进行的平均值和%rsd计算包括所有重复进样(0mm、7.5mm、15mm偏移)和重复样品制备(烧瓶1、2、3)产生的结果
[0052]
当hplc样品托盘是在室温下时,使用30%/40%/50%v/v acn稀释剂的样品溶液
[0053]
当hplc样品托盘在第1天保持在室温下时,所有条件均通过了%rsd样品验收标准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。