1.本发明涉及包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的药物配制品,以及它们在治疗包括炎性疾病、感染性疾病和眼部疾病在内的疾病中的用途。
背景技术:
2.冠状病毒是一组有包膜和非分段的正义rna病毒,其基因组大小非常大,在大约27至34kb的范围内。感染人类的菌株hcov-229e、hcov-oc43、hcov-nl63和hcov-hku1通常会引起轻微的自限性呼吸道感染,诸如普通感冒(fehr等人coronaviruses:methods and protocols[冠状病毒:方法与实验操作],maier,h.j.;bickerton,e.;britton,p.编辑springer new york:new york,ny[纽约施普林格:纽约州纽约],2015;第1-23页2015;以及corman等人,adv.virus res.[病毒研究进展],j.编辑academic press[学术出版社]:2018;第100卷,第163-188页2018)。然而,已经出现某些高致病性冠状病毒。sars-cov、mers-cov和sars-cov-2已经引起与高发病率和死亡率相关的严重人类疾病大流行。
[0003]
缺乏对冠状病毒感染的有效治疗给临床管理带来了巨大挑战,并且凸显了发现对病毒感染(诸如冠状病毒感染)的新治疗的迫切需要。
[0004]
wang等人(remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus(2019-ncov)in vitro.[瑞德西韦和氯喹在体外有效抑制最近出现的新型冠状病毒(2019-ncov)]cell res[细胞研究].2020,https://doi.org/10.1038/s41422-020-0282-0)筛选了抗病毒药物并且确定硝唑尼特、瑞德西韦和氯喹分别以2.12μm、0.77μm和1.13μm的ec50值在vero e6细胞中在低微摩尔浓度下抑制sars-cov-2。
[0005]
wu等人(inhibition of severe acute respiratory syndrome coronavirus replication by niclosamide[氯硝柳胺对严重急性呼吸综合征冠状病毒复制的抑制],antimicrob.agents chemother[抗微生物剂化疗].2004,48,2693-2696)发现氯硝柳胺在1.56μm的浓度下抑制sars-cov复制并完全消除病毒抗原合成。氯硝柳胺在低至1μm的浓度下抑制sars-cov的细胞病变效应(cpe)并在vero e6细胞中以小于0.1μm的ec50值抑制sars-cov复制(wen等人,j.med.chem[药物化学杂志].2007,50,4087-4095)。后来发现氯硝柳胺是一种非常有效的sars-cov2抑制剂,ic50为280nm(joun等人.clinical features of patients infected with 2019novel coronavirus in wuhan,china[中国武汉市2019新型冠状病毒感染患者的临床特征],the lancet[柳叶刀],https://www.thelancet.com/journals/lancet/article/piis0140-6736(20)30183-5/fulltext)。
[0006]
xu等人(acs infect.dis[acs传染病].2020,线上发布于2020年3月3日https://doi.org/10.1021/acsinfecdis.0c00052)披露了氯硝柳胺对某些病毒感染有效。然而,该出版物的结论是水溶性低、吸收差和口服生物利用度低将限制其作为抗病毒剂的临床开发。
[0007]
cabitra等人,jci insight[临床研究杂志子刊机理解析].2019;4(15):e128414披露了使用溶解在玉米油中并通过i.p.注射而施用的氯硝柳胺来治疗小鼠。结果表明,氯
硝柳胺减少了粘液的产生和分泌以及支气管收缩,并且在哮喘小鼠中显示出额外的抗炎作用。
[0008]
氯硝柳胺(商品名是例如)目前被批准和销售用于在成人和儿童(》2岁)中通过施用单次2g方案或每天2g施用7天来口服治疗绦虫感染。pk分析揭示,在口服施用后,在尿液中检测到施用剂量的2%-25%,这可以被认为是最低吸收水平。当用2,000mg氯硝柳胺的单次口服剂量治疗人类志愿者时,氯硝柳胺的最大血清浓度等于0.25-6.0μg/ml(0.76-18.3μm)。较宽的浓度范围是由个体内吸收差异引起的。氯硝柳胺仅部分地从肠道吸收,并且所吸收的部分迅速被肾脏排出。氯硝柳胺具有几种其他弱点,诸如吸收和口服生物利用度低(f=10%),这可能会阻碍其作为全身药剂的广泛临床开发。
[0009]
wo 2017/157997披露了某些用于局部治疗病症诸如特应性皮炎的包含氯硝柳胺的组合物。wo 2020/039073披露的数据显示氯硝柳胺在局部应用到特应性皮炎患者的皮肤时具有抗炎作用。氯硝柳胺的局部应用调节了许多炎性生物标志物。
[0010]
仍然需要确定对病毒感染的有效治疗。
[0011]
除了病毒感染之外,还有许多靶向呼吸系统的炎性疾病,包括诸如哮喘、copd和囊性纤维化的慢性疾病。在许多情况下,此类病症不仅会导致受害者的生活质量下降,而且还会导致受害者感染病毒(诸如由冠状病毒引起的感染,以及继发性细菌和真菌感染)或患有由病毒感染引起的并发症的风险增加。
[0012]
哮喘是儿童中最常见的慢性疾病,也影响着数百万成年人。据估计,全世界约有2.35亿人患有这种疾病。copd是一种高度流行的病症,是全世界发病率和死亡率的主要原因。随着疾病进展,copd患者可能会变得容易频繁加重,从而导致患者焦虑、健康状况恶化、肺功能下降和死亡率增加。这些呼吸功能恶化的发作导致医疗保健利用、住院和花费增加。更糟糕的是,频繁加重与肺功能更快下降相关,从而缩短预期寿命。
[0013]
目前对哮喘和copd的治疗包括类固醇以及短效和长效β拮抗剂。然而,此类治疗与许多副作用相关。此外,它们对其他病症诸如继发性细菌或病毒感染没有活性。
[0014]
囊性纤维化(cf)是一种遗传性疾病,会导致粘稠的粘附粘液在肺部、鼻窦、消化道和胰腺中积聚。这种粘液异常会阻塞气道,并且可能导致危及生命的肺部感染。不粘附到正常粘液或组织上的细菌通过正常的气道清除机制被去除;然而,cf患者的粘性粘液限制了粘膜纤毛清除并促进生物膜形成,从而引发包括炎症失调和最终器官功能障碍在内的级联反应。由于cf患者的粘膜纤毛清除降低,他们的肺经受到细菌感染。局部、吸入和全身抗生素用于治疗cf患者感染,但这些药物的效果通常有限。
[0015]
因此,仍然需要确定对炎性疾病、特别是肺和呼吸系统疾病的进一步治疗。
[0016]
还需要对眼部病症的新治疗,包括与感染诸如细菌感染、异常炎性反应和/或角膜前泪膜功能障碍诸如干眼病(ded)(也称为干眼障碍或干眼综合征)相关的那些眼部病症。
[0017]
干眼病(ded)也称为干燥性角膜结膜炎,是一种常见的炎性眼部疾病。干眼已被证明与角膜前泪膜异常以及随后包括附件、结膜和角膜在内的整个眼表的炎性变化相关(hessen等人,j ophthalmic vis res[眼科和视觉研究杂志],9(2):240-250,2014)。目前的药物包括环孢菌素a、皮质类固醇(例如地塞米松)、他克莫司、四环素衍生物和自体血清。许多这些目前使用的抗炎剂诸如环孢菌素可能会对患者的眼睛造成刺激。
[0018]
感染性眼病诸如结膜炎通常是轻微的,但在一些情况下可能会导致非常严重的眼
睛问题,从而可能导致永久性视力丧失。由病毒或细菌引起的眼睛感染可以用抗生素或抗病毒滴剂、软膏或口服药物治疗。虽然此类治疗可有效地帮助对抗感染,但它们可能不能有效地抗击相关的炎症、不适或干燥。
[0019]
jabs等人,“guidelines for the use of immunosuppressive drugs in patients with ocular inflammatory disorders:recommendations of an expert panel”[眼部炎性障碍患者免疫抑制药物使用指南:专家小组的建议],am j ophthalmol[美国眼科杂志],130(4):492-513,2000为使用免疫抑制药物治疗眼部炎性疾病患者提供了建议。
[0020]
wo 2017/157997 a1披露了包含卤化水杨酰苯胺诸如氯硝柳胺的非水性局部组合物,以及此类组合物在局部治疗或预防由革兰氏阳性细菌引起的感染或疾病中的用途。
[0021]
us 4742083建议使用某些取代的水杨酰胺作为全身镇痛剂以及作为抗炎组合物用于局部应用。
技术实现要素:
[0022]
根据本发明的第一方面,提供了一种包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品。
[0023]
卤化水杨酰苯胺可选自由以下组成的组:氯硝柳胺、氯氰碘柳胺、五氯柳胺和碘醚柳胺或其药学上可接受的盐。优选地,卤化水杨酰苯胺是氯硝柳胺或其药学上可接受的盐。
[0024]
在一些实施例中,氯硝柳胺以游离酸形式存在。替代性地,配制品可包含氯硝柳胺的药学上可接受的盐,优选氯硝柳胺乙醇胺。
[0025]
配制品可以是适于肺部施用的形式。例如,配制品可以是固体(例如粉末)的形式。
[0026]
在一些实施例中,配制品是包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的悬浮液、分散体或溶液在药学上可接受的溶剂中的形式。换句话说,配制品可以是液体配制品。包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液和悬浮液可以是如本文所述的溶液或悬浮液中的任一种。
[0027]
药学上可接受的溶剂可包括水,即溶液或悬浮液可以是水性溶液或水性悬浮液。在一些实施例中,溶剂是水。在一些实施例中,溶剂包含共溶剂。某些共溶剂可用于帮助卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和/或环糊精的溶解和/或帮助稳定溶液。在某些实施例中,共溶剂选自乙醇、丙二醇、甘油、聚乙二醇(例如平均分子量小于600的聚乙二醇(peg),诸如peg200、peg 300或peg 400)。在一些实施例中,共溶剂选自丙二醇和甘油。在一些实施例中,共溶剂不是peg。在一些实施例中,共溶剂不是乙醇。在某些实施例中,共溶剂是dmso。基于溶液或悬浮液的重量,共溶剂可以按重量计约0%至约20%、约0.1%至约15%、约0.2%至约12%、约0.3%至约10%、约0.4%至约8%、约0.5%至约6%、约0.6%至约5%、约0.7%至约4%、约0.8%至约2%、约0.9%至约1%的量存在于配制品中。
[0028]
在某些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以按配制品的重量计约0.01%至约10%的量存在于配制品中。例如,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以按配制品的重量计0.05%至10%、0.1%至9%、0.05%至8%、0.5%至8%、1%至8%、1.5%至8%、2%至8%、2.5%至8%、3%至8%、3.5%至8%、4%至
8%、4.5%至8%、5%至8%、5.5%至8%、6%至8%、3%至7%、3.5%至7.5%、3.5%至7%、3.5%至6.5%、3.5%至6%、3.5%至5.5%、4%至7%、4%至7%、4%至6.5%、4%至6%、4%至5.5%、4.5%至7%、4.5%至6.5%、4.5%至6.5%或4.5%至5.5%的量存在。
[0029]
在一些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以按液体配制品的重量计约0.05%至约5%、约0.5%至约4%、约0.1%至约3%、约0.2%至约2%、约0.5%至约1.8%、约0.5%至约1.5%、约0.8%至约1.5%、约0.8%至约1.2%、约0.9%至1.1%、约1%至约3%或约1.5%至约2%的量存在于配制品中。因此,卤化水杨酰苯胺(例如氯硝柳胺)或药学上可接受的盐可以按液体配制品的重量计约0.1%、约0.2%、约0.3%、约0.4%、约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约1.1%、约1.2%、约1.3%、约1.4%、约1.5%、约1.6%、约1.7%、约1.8%、约1.9%、约2%、约2.1%、约2.2%、约2.3%、约2.4%、约2.5%、约3%、约4%或约5%的量存在于液体配制品中。在一个优选的实施例中,液体配制品包含按重量计约1%的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐。存在于液体配制品中的卤化水杨酰苯胺的量适用于本文所述的任何配制品,例如包含氯硝柳胺或其药学上可接受的盐的溶液;包含氯硝柳胺或其药学上可接受的盐的悬浮液;包含氯硝柳胺或其药学上可接受的盐的溶液的气雾剂;或者包含氯硝柳胺或其药学上可接受的盐的悬浮液的气雾剂。
[0030]
在某些实施例中,本发明的液体配制品提供高浓度的溶解的卤化水杨酰苯胺。在某些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以约0.1至约100mg/ml、约0.2至约90mg/ml、约0.3至约80mg/ml、约0.5至约75mg/ml、约0.6至约70mg/ml、约0.7至约65mg/ml、约0.8至约60mg/ml、约0.9至约60mg/ml或约1至约50mg/ml的浓度存在于液体配制品中。在一些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以约2至约45mg/ml、约3至约40mg/ml、约4至约40mg/ml、约4至约35mg/ml、约5至约30mg/ml、约5至约25mg/ml、约5至约15mg/ml、约7至约20mg/ml、约7至约15mg/ml、约8至约15mg/ml、约9至约12mg/ml或约10至约11mg/ml的浓度存在于液体配制品中。
[0031]
在一些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以按固体配制品的重量计约0.05%至5%的量存在于配制品中。因此,卤化水杨酰苯胺(例如氯硝柳胺)或药学上可接受的盐可以按固体配制品的重量计约0.05%至10%、0.05%至8%、0.5%至8%、1%至8%、1.5%至8%、2%至8%、2.5%至8%、3%至8%、3.5%至8%、4%至8%、4.5%至8%、5%至8%、5.5%至8%、6%至8%、3%至7%、3.5%至7.5%、3.5%至7%、3.5%至6.5%、3.5%至6%、3.5%至5.5%、4%至7%、4%至7%、4%至6.5%、4%至6%、4%至5.5%、4.5%至7%、4.5%至6.5%、4.5%至6.5%、4.5%至6%或5至5.5%的量存在于固体配制品中。存在于固体配制品中的卤化水杨酰苯胺的量适用于本文所述的任何固体配制品,例如包含氯硝柳胺或其药学上可接受的盐的粉末。
[0032]
在一些实施例中,配制品适于气雾剂施用。
[0033]
环糊精可以是α-环糊精、β-环糊精或γ-环糊精或其衍生物。在一些实施例中,环糊精是β-环糊精或其衍生物。在一些实施例中,环糊精是2-羟丙基-β-环糊精(hp-β-cd)。在一些实施例中,环糊精是磺丁基醚-β-cd。在一些实施例中,环糊精不是磺丁基醚-β-cd。
[0034]
在一些实施例中,环糊精以按配制品的重量计约1%至约90%的量存在。例如,基于配制品的重量,环糊精可以按重量计约5%至约85%、约10%至约80%或约20%至约70%
的量存在。
[0035]
在某些实施例中,环糊精以按液体配制品的重量计约1%至约60%的量存在。在某些实施例中,环糊精以按液体配制品的重量计大于约5%、大于约6%、大于约7%、大于约8%、大于约9%、大于约10%、大于约11%、大于约12%、大于约13%、大于约14%或大于约15%的量存在。在某些实施例中,环糊精以按液体配制品的重量计约1%至约25%的量存在。例如,环糊精以按液体配制品的重量计2%至24%、3%至23%、4%至22%、5%至21%、6%至20%、7%至19.5%、8%至19%、9%至18.5%、10%至18%、10.5%至17.5%、11%至17%、11.5%至16.5%、12%至16%、12.5%至15.5%、13%至15%或13.5%至14.5%的量存在。在某些实施例中,环糊精以按液体配制品的重量计约10%、约10.5%、约11%、约11.5%、约12%、约12.5%、约13%、约13.5%、约14%、约14.1%、约14.2%、约14.3%、约14.4%、约14.5%、约14.6%、约14.7%、约14.8%、约14.9%、约15%、约15.1%、约15.2%、约15.3%、约15.4%、约15.5%、约15.6%、约15.7%、约15.8%、约15.9%、约16%、约16.5%、约17%、约17.5%或约18%的量存在。
[0036]
在一个优选的实施例中,环糊精以按液体配制品的重量计约14.5%至15.5%的量存在于液体配制品中。
[0037]
在某些实施例中,环糊精以按固体配制品的重量计约50%至约95%的量存在。例如,基于固体配制品的重量,环糊精可以按重量计约55%至约90%、约60%至约85%、约65%至约80%或约70%至约75%的量存在。
[0038]
在一些实施例中,液体配制品包含按重量计约0.1%至约1.5%的氯硝柳胺乙醇胺和按重量计约10%至约20%的环糊精(例如hp-β-cd)。
[0039]
在一些实施例中,液体配制品包含按重量计约0.1%至约1.5%的氯硝柳胺乙醇胺和按重量计约12%至约20%的环糊精(例如hp-β-cd)。在一个优选的实施例中,液体配制品包含按重量计约1%的氯硝柳胺乙醇胺和按重量计约15%的环糊精(优选hp-β-cd)。
[0040]
卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的至少一部分可与环糊精形成复合物。在一些实施例中,约20%至约100%、约30%至约90%、约40%至约80%或约50%至约70%的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐与环糊精复合。
[0041]
在一些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐与环糊精的比例为1:250至5:1、1:200至4:1、1:150至3:1、1:100至2:1、1:50至1:1、1:30至1:2、1:20至1:3、1:20至1:8、1:20至1:12、1:18至1:12、1:15至1:4或1:10至1:5。
[0042]
在一些实施例中,配制品包含至少一种稳定剂。合适的稳定剂包括聚合物、乳化剂、表面活性剂以及它们的组合。在一些实施例中,稳定剂包含聚合物。合适地,聚合物是水溶性聚合物,优选在本文披露的液体配制品的ph下可溶于水中的聚合物。有利地,聚合物的添加可提高包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液的稳定性。不受理论的束缚,据认为稳定剂(例如聚合物)的存在可有助于卤化水杨酰苯胺与环糊精之间形成复合物,因此也可有助于制备配制品。另外或替代性地,稳定剂(例如聚合物)可有助于抑制溶解的卤化水杨酰苯胺结晶和随后沉淀。因此,包含稳定剂诸如聚合物的配制品可在本发明的配制品中提供高浓度的溶解的卤化水杨酰苯胺。聚合物可选自由以下组成的组:聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、羟丙基纤维素(hpc)、泊洛沙姆、羟丙基甲基纤维素(hpmc)、羟丙基甲基纤维素乙酸琥珀酸酯(hpmc-as)、聚乙烯吡咯烷酮/乙酸
乙烯酯共聚物(pvp/va)以及它们的任何组合。优选地,聚合物包含pvp。如本领域已知的,pvp可以多种粘度等级获得,范围从低分子量到高分子量。可用的pvp等级包括k-12、k-15、k-17、k-30、k-60、k-80、k-85、k-90和k-120。在一些实施例中,配制品包含pvp k-12、k-15、k-17或k-30。k值是指fikentscher k值并且可通过使用ostwald-fenske或cannon-fenske毛细管粘度计测量pvp在水中(1%重量/体积)的粘度并例如使用iso 1628-1:2009中描述的方法计算k值来确定。在一些实施例中,聚合物是pvp/va。如本领域已知的,pvp/va共聚物可以不同比例的乙烯基吡咯烷酮与乙酸乙烯酯获得。pvp:va的重量比可为70:30、60:40、50:50、40:60或30:70。在一些实施例中,该比例为60:40(例如,可以va 64获得)。
[0043]
基于配制品的重量,聚合物可以按重量计约0.01%至约20%、约0.05%至约18%、约0.1%至约15%、约0.5%至约13%、约0.8%至约12%、约1%至约10%、约2%至约8%或约3%至约6%的量存在于配制品中。
[0044]
例如,基于液体配制品的重量,聚合物可以按重量计约0.01%至约10%、约0.05%至约8%、约0.1%至约6%、约0.1%至约5%、约0.1%至约4%、约0.1%至约3%、约0.5%至约5%、约0.5%至约4%、约0.5%至约3%、约0.8%至约3%、约1%至约4%、约1%至约3%、约1%至约2.5%或约1%至约2%的量存在于液体配制品中。因此,基于液体配制品的重量,聚合物可以按重量计约0.5%、约0.6%、约0.7%、约0.8%、约0.9%、约1%、约1.1%、约1.2%、约1.3%、约1.4%、约1.5%、约1.6%、约1.7%、约1.8%、约1.9%、约2%、约2.1%、约2.2%、约2.3%、约2.4%、约2.5%、约2.6%、约2.7%、约2.8%、约2.9%、约3%、约3.5%、约4%、约4.5%或约5%的量存在于液体配制品中。
[0045]
基于固体配制品的重量,聚合物可以按重量计约1%至约20%、约2%至约18%、约3%至约16%、约5%至约14%、约5%至约12%、约6%至约11%、约7%至约10%或约8%至约9%的量存在于固体配制品中。
[0046]
在一些实施例中,配制品进一步包含防腐剂。合适的防腐剂包括苯扎氯铵。
[0047]
基于配制品的重量,防腐剂可以按重量计约0%至约0.2%、约0.002%至约0.15%、约0.004至约0.1%、约0.006%至约0.05%或约0.008%至约0.02%(例如约0.01重量%)的量存在。
[0048]
在一些实施例中,配制品进一步包含缓冲剂和/或稳定剂。合适的缓冲剂和稳定剂包括依地酸二钠、磷酸二钠、聚山梨醇酯80、磷酸二氢钠、柠檬酸钠、磷酸钠、乙酸钠、乙酸、组氨酸、乳酸、天冬氨酸、酒石酸、谷氨酸、琥珀酸、苹果酸、氨丁三醇、乳酸、组氨酸、富马酸和柠檬酸。优选地,稳定剂包含依地酸二钠。
[0049]
基于配制品的重量,稳定剂可以按重量计约0%至约2%例如按重量计约0.02%至约1%、约0.04%至约0.6%、约0.06%至约0.4%或约0.08%至约0.2重量%(例如0.1重量%)的量存在。
[0050]
在一些实施例中,配制品进一步包含电解质。合适的电解质包括氯化钠、氯化钾、磷酸二氢钠或磷酸二氢钾。优选地,电解质是氯化钠。
[0051]
基于配制品的重量,电解质可以按重量计约0%至约10%、约0.1%至约8%、约0.2%至约5%、约0.3%至约2%、约0.4%至约1%或约0.5%至约0.8%的量存在。
[0052]
在一些实施例中,配制品具有1至150cp、1.5至100cp、2至50cp或5至25cp的粘度。
在一些实施例中,配制品具有不大于20cp、不大于15cp或不大于10cp的粘度。例如,粘度可为1至10cp、1.5至9.5cp、2至8cp、2.5至7.5cp、3至7cp、3.5至6.5cp、4至6cp或5.5至6.5cp。
[0053]
在一些实施例中,配制品具有4至9例如5至8.5、7至8.5或6至8(例如4至8、7至8.2、7.5至8.2、7.5至7.8或优选7.6至8)的ph。
[0054]
在一些实施例中,配制品包含ph调节剂。合适的ph调节剂包括酸(例如盐酸、乙酸、乳酸、柠檬酸、酒石酸、苹果酸、甲酸、尿酸)和碱(例如氢氧化钠、氢氧化钾、氢氧化钙、碳酸钠或碳酸钾、碳酸氢钠或碳酸氢钾)。在一些实施例中,配制品包含多种(例如2、3或4种)ph调节剂。例如,配制品可包含两种不同的酸或两种不同的碱或者一种酸和一种碱。在一些实施例中,配制品包含氢氧化钠和盐酸。
[0055]
在一些实施例中,配制品具有5至500mosmol/l、100至400mosmol/l或150至350mosmol/l例如180至320mosmol/l、250至350mosmol/l、280至330mosmol/l、290至320mosmol/l或200至250mosmol/l的摩尔渗透压浓度。
[0056]
在一些实施例中,卤化水杨酰苯胺是氯硝柳胺或其药学上可接受的盐。在一些实施例中,卤化水杨酰苯胺是氯硝柳胺。在一些实施例中,卤化水杨酰苯胺是氯硝柳胺的药学上可接受的盐。在一些实施例中,卤化水杨酰苯胺是氯硝柳胺乙醇胺。
[0057]
根据本发明的第二方面,提供了一种包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品,其用作药物。配制品可以是本文所述的任何配制品。
[0058]
根据本发明的第三方面,提供了一种包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品,其用于治疗或预防有需要的受试者的感染性疾病或炎性疾病。配制品可以是本文所述的任何配制品。
[0059]
根据本发明的第四方面,提供了一种包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品,其用于治疗或预防受试者的眼部病症或疾病。配制品可以是本文所述的任何配制品。
[0060]
还提供了一种治疗或预防受试者的感染性疾病、炎性疾病或眼部疾病或病症的方法,该方法包括向受试者施用治疗有效量的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品。配制品可以是本文所述的任何配制品。
[0061]
配制品可用于局部治疗或预防感染性疾病、炎性疾病或眼部疾病或病症。
[0062]
用作药物或用于治疗或预防感染性、炎性或眼部疾病的配制品可以是如本文定义的任何配制品。
[0063]
在一些实施例中,感染性疾病是病毒、细菌或真菌感染。
[0064]
在一些实施例中,感染性疾病是病毒感染。病毒感染可以是肺部病毒感染。
[0065]
在某些实施例中,病毒感染可由选自以下的病毒引起或与其相关:呼吸道合胞病毒、流感病毒、副流感病毒、人偏肺病毒、严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov)、人冠状病毒oc43、塞姆利基森林病毒、人鼻病毒(hrv)和人腺病毒(hadv)。
[0066]
在某些实施例中,病毒感染由肺病毒科病毒例如人呼吸道合胞病毒(hrsv)(例如hrsv-a2、hrsv-b1或hrsv-s2)引起或与其相关。
[0067]
在某些实施例中,病毒感染由冠状病毒科病毒引起或与其相关。在某些实施例中,病毒感染由选自以下的病毒引起或与其相关:α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状
病毒。优选地,病毒感染是由β冠状病毒引起与其相关。因此,在某些实施例中,病毒感染由选自以下的病毒引起或与其相关:严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒2(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov)、hcov-229e、hcov-nl63、hcov-oc43和hcov-hku1。
[0068]
在一个特定的实施例中,病毒感染由sars-cov-2引起或与其相关。因此,病毒感染可以是covid-19。
[0069]
在一些实施例中,病毒感染由流感病毒引起或与其相关。
[0070]
在一些实施例中,病毒感染可由选自以下的病毒引起或与其相关:黄病毒科(例如寨卡病毒(zikv)、登革热(例如denv 1-4)、西尼罗病毒(wnv)、黄热病病毒(yfv,例如黄热病17d病毒)、日本脑炎病毒(jev)、丙型肝炎病毒(hcv))、丝状病毒科(例如埃博拉病毒)、披膜病毒科(例如甲病毒,诸如基孔肯亚病毒(chikv)、辛德毕斯病毒和罗斯河病毒)、疱疹(例如γ-疱疹病毒、人疱疹病毒8、疱疹病毒1和疱疹病毒2)和腺病毒科(例如人腺病毒(hadv))。
[0071]
在一些实施例中,病毒感染与炎症相关。在此类实施例中,治疗可使得粘液产生和/或分泌减少、支气管收缩减少、促炎细胞因子得到抑制、树突细胞活性得到调节和/或stat3得到抑制。
[0072]
在一些实施例中,病毒感染与继发性细菌感染相关。继发性细菌感染可由选自由以下组成的组的细菌引起:金黄色葡萄球菌(s.aureus)、肺炎链球菌(s.pneumoniae)、流感嗜血杆菌(h.influenzae)、卡他莫拉菌(m.catarrhalis)、化脓性链球菌(s.pyogenes)和淋病奈瑟菌(n.gonorrhoea)。
[0073]
炎性疾病可以是肺部炎性疾病。
[0074]
在一些实施例中,肺部炎性疾病选自由以下组成的组:哮喘、囊性纤维化、慢性阻塞性肺病(copd)、肺纤维化、肺炎、间质性肺病、结节病、闭塞性细支气管炎、局限性肺炎和急性呼吸窘迫综合征(ards)。
[0075]
配制品可通过口内和/或鼻内吸入来施用。在一些实施例中,配制品通过口内吸入来施用。在某些实施例中,配制品以气雾剂的形式施用。
[0076]
在一些实施例中,配制品鼻内施用。应当理解,“鼻内”施用意指施用到鼻腔中,即通过鼻子。鼻内施用包括将配制品施用于鼻粘膜和上呼吸道以及将配制品施用于下呼吸道(例如经由吸入)两种情况。
[0077]
最近的研究已经从鼻组织(高表达)和远端肺内区域(低表达)中确定了被sars-cov-2靶向的人血管紧张素转换酶(ace)-2的表达水平梯度。发现该表达模式由sars-cov-2感染性的梯度反映,该感染性在鼻上皮中较高并且在远端肺(细支气管、肺泡)中明显降低。鉴于这些发现,有人提出鼻表面可能是sars-cov-2感染的主要初始部位(hou等人,“sars-cov-2reverse genetics reveals a variable infection gradient in the respiratory tract”[sars-cov-2反向遗传学揭示了呼吸道内不同的感染梯度],cell[细胞],2020)。因此,鼻内施用可能有益于患有轻度covid-19的受试者或在疾病进展到以肺部炎症为特征的晚期阶段之前处于疾病早期阶段的那些受试者。在一些实施例中,其症状包括味觉和/或嗅觉丧失和/或眼部症状(例如结膜充血、结膜水肿、泪溢或分泌物增加中的一种或多种)的受试者可经由鼻内施用本发明的配制品来治疗。鼻内施用还可有益于治疗无症状受试者、预防性治疗如本文所确定的高风险群体(例如医疗保健专业人员或患有潜在
病症的那些)、治疗怀疑已经感染sars-cov-2的受试者和/或治疗covid-19人员的密切接触者。
[0078]
在一些实施例中,配制品鼻内和口内(例如经由吸入)施用。因此,本文所述的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的第一配制品可通过口内吸入(例如作为气雾剂)与本文所述的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的第二配制品分开、依次或同时施用,其中第二配制品鼻内施用(例如作为喷雾剂)。第一配制品和第二配制品可不同。第一配制品和第二配制品可相同。
[0079]
当通过吸入来施用药物时,肺部病毒感染的受试者可能容易咳嗽。这会使药物的施用变得困难和/或可能会减少递送到气道和肺部的药物剂量。在某些实施例中,在包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的吸入配制品之前或与其同时向受试者施用镇咳剂。因此,可在吸入施用氯硝柳胺或其药学上可接受的盐之前或与其同时从可待因、右美沙芬、氢可酮、美沙酮、布托啡诺、苯佐那酯、乙基吗啡、奥昔拉定、匹哌氮酯、福尔可定、诺司卡品、布他米酯和局部麻醉剂(例如利多卡因)中选择镇咳剂。优选地,在施用包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的配制品之前用镇咳剂治疗受试者,以减少或消除与吸入施用配制品相关的咳嗽。因此,可在吸入施用包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的配制品之前或与其同时用局部麻醉剂治疗受试者。合适地,施用局部麻醉剂以便在口腔和/或气道中提供局部麻醉效果。因此,局部麻醉剂可通过吸入或作为凝胶或液体施用于口腔和/或鼻腔。合适地,局部麻醉剂是利多卡因。
[0080]
在一些实施例中,在包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的配制品之前或与其同时用支气管扩张剂治疗受试者。有利地,这可帮助减少副作用,诸如咳嗽。合适的支气管扩张药包括短效β2-肾上腺素能激动剂(例如沙丁胺醇、左沙丁胺醇、吡布特罗、肾上腺素、特布他林或麻黄碱)、长效β2-肾上腺素能激动剂(例如沙美特罗、克仑特罗、班布特罗、茚达特罗或福莫特罗)、抗胆碱能药(例如噻托溴铵或异丙托溴铵)和茶碱。
[0081]
卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐可以基于卤化水杨酰苯胺或其盐的重量约10mg至约1000mg(例如基于卤化水杨酰苯胺或其盐的重量约100mg至约600mg、优选约150mg至约500mg)的单位剂量施用于受试者。
[0082]
卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐可每天一至五次例如每天1至4次、例如每天2或3次施用于受试者。
[0083]
在一些实施例中,眼部疾病或病症选自由以下组成的组:感染性眼部疾病、干眼病(ded)、过敏性疾病(诸如过敏性结膜炎)、睑炎或炎性眼病(诸如眼部酒渣鼻)。
[0084]
在一些实施例中,感染性眼部疾病选自由以下组成的组:结膜炎(包括细菌、真菌和病毒性结膜炎)、角膜炎(包括病毒、细菌、真菌、阿米巴和寄生性角膜炎)、眼内炎、睑炎、睑腺炎、葡萄膜炎、蜂窝织炎(例如细菌蜂窝织炎)和眼部疱疹。
[0085]
在一些实施例中,眼部病症或疾病是细菌性结膜炎。细菌性结膜炎可由选自由以下组成的组的细菌引起:金黄色葡萄球菌(包括mrsa)、肺炎链球菌、流感嗜血杆菌、铜绿假单胞菌(p.aeruginosa)、卡他莫拉菌和淋病奈瑟菌。
[0086]
在一些实施例中,眼部病症或疾病是病毒性结膜炎。病毒性结膜炎可由腺病毒引起。
[0087]
wu等人(characteristics of ocular findings of patients with coronavirus disease 2019(covid-19)in hubei province,china.[中国湖北省2019年冠状病毒疾病(covid-19)患者的眼部发现特征]jama ophthalmol[jama眼科].2020年5月1日;138(5))已经确定一些感染sars-cov-2的患者表现出眼部症状,并且这些症状通常出现在感染的早期阶段。因此,液体配制品可用于治疗或预防受试者的病毒感染(例如sars-cov-2)的方法中,该方法包括将液体配制品眼部施用于受试者。
[0088]
眼部疾病或病症的治疗或预防可包括将包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的液体配制品(例如如本文所述的配制品)局部施用于一只或两只眼睛。液体配制品可包含眼科可接受的载体。
[0089]
在一些实施例中,液体配制品每天一至五次例如每天1至3次、例如每天2次施用于受试者的一只或两只眼睛。
[0090]
本发明的另一方面提供了一种包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液的气雾剂。因此,气雾剂可以是包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液的气雾剂。气雾剂可以是如本文所述的任何液体配制品或溶液的气雾剂,例如本文披露的包含氯硝柳胺(例如氯硝柳胺乙醇胺)和环糊精(例如hp-β-cd)的任何溶液的气雾剂。合适地,溶液是水性溶液。
[0091]
还提供了一种包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液的单位剂量,其中基于卤化水杨酰苯胺(例如氯硝柳胺)的重量,卤化水杨酰苯胺(例如氯硝柳胺)以约0.1mg至约200mg例如约0.5mg至约100mg或约1mg至约50mg的量存在。溶液可以是如本文所述的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的任何溶液。例如,溶液可以是如本文披露的包含氯硝柳胺乙醇胺和环糊精(例如hp-β-cd)的任何溶液。合适地,溶液是水性溶液。单位剂量合适地存在于容器(例如小瓶、泡罩包装、瓶(例如鼻喷雾剂)、注射器(例如作为鼻内递送装置的一部分)或吸入器装置(例如喷雾器)内的储器)中。在其中配制品是溶液形式的实施例中,施用于受试者的单位剂量体积可为1至10ml、2至9ml、3至8ml或4至6ml。在一些实施例中,施用于受试者的单位剂量体积为10μl至10ml、20μl至8ml、30μl至6ml、40μl至5ml、50μl至2ml、100μl至1ml、120μl至0.8ml、130μl至0.7ml、140μl至0.6ml、150μl至0.5ml或200μl至400μl。在一些实施例中,施用于受试者的单位剂量体积为100至200μl、110至190μl、120至180μl、130至170μl、140至160μl或150至155μl。应当理解,对于给定体积施用的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的质量将取决于溶液的浓度。在一些实施例中,卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐以按重量计约0.01%至约10%的量存在于溶液中。优选地,溶液包含按重量计约1%的氯硝柳胺乙醇胺。可每天施用该体积一次或多次,例如每天一次、每天两次、每天三次或每天四次。可每天施用该体积一次或两次。可每天施用该体积一次。可每天施用该体积两次。
[0092]
在其中本发明的溶液鼻内施用的一些实施例中,施用于受试者的体积可为50至500μl、100至400μl、150至300μl或200至250μl。应当理解,应向每个鼻孔施用大约一半的总体积。在一些实施例中,向每个鼻孔施用约50至约150μl(即总共约100至约300μl)。在一些实施例中,向每个鼻孔施用约130μl-150μl(例如140μl)的体积(即总共约260-300μl,例如280μl)。优选地,鼻内施用的溶液包含按重量计约1%的氯硝柳胺乙醇胺。可每天鼻内施用
该体积一次或多次,例如每天一次、每天两次、每天三次或每天四次。可每天鼻内施用该体积一次或两次。可每天鼻内施用该体积一次。可每天鼻内施用该体积两次。
[0093]
还应当理解,在其中本发明的溶液口内(即经由吸入)和鼻内施用的一些实施例中,施用于受试者的总体积将是口内施用的体积和鼻内施用的体积的总和。总体积可为10μl至10ml、20μl至8ml、30μl至6ml、40μl至5ml、50μl至2ml、100μl至1ml、150μl至0.5ml或200μl至400μl。优选地,鼻内施用的溶液包含按重量计约1%的氯硝柳胺乙醇胺。如将理解,当溶液口内和鼻内施用时,口内施用的体积可与鼻内施用的体积相同或不同。类似地,口内和鼻内施用的频率可相同或不同。例如,口内和鼻内剂量可依次施用(例如口内施用后不久(例如在10分钟内)鼻内施用,反之亦然)。在某些实施例中,口内和鼻内剂量可分开施用(例如在口内剂量与鼻内剂量分开超过10分钟(例如超过一小时)的情况下)。还考虑了基本上同时的口内和鼻内施用。鼻内施用的体积可每天施用一次或两次。口内施用的体积可每天施用一次或两次。
[0094]
如上所述,一些感染sars-cov-2的受试者表现出眼部症状,例如结膜充血、结膜水肿、泪溢或眼部分泌物增加。因此,眼部施用(例如局部)本发明的配制品可有效预防或治疗sars-cov-2。还考虑了与本发明的配制品的口内和/或鼻内施用一起进行眼部施用。因此,在某些实施例中,本发明的配制品通过吸入局部(例如作为局部应用的眼部滴剂)、鼻内和口内施用于受试者。
[0095]
还提供了一种系统,该系统包括:包含含有卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品的容器;以及吸入器装置。配制品可以是如本文定义的配制品。
[0096]
还提供了一种套件,该套件包括:包含含有卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品的容器;以及吸入器装置。
[0097]
在某些实施例中,包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品(例如本文所述的任何配制品)以粉末、溶液、悬浮液的形式存在于系统或套件中。合适地,配制品是水性溶液的形式。
[0098]
在某些实施例中,系统或套件的吸入器装置适于雾化包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液。合适地,吸入器装置适于将雾化的溶液或悬浮液鼻内或口内递送给受试者。
[0099]
在某些实施例中,系统或套件的吸入器装置是选自喷射喷雾器、振动网喷雾器、超声喷雾器或加压计量吸入器(pmdi)的喷雾器。
[0100]
还提供了一种系统,该系统包括:包含含有卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品的容器;以及鼻内递送装置。配制品可以是如本文定义的配制品。
[0101]
还提供了一种套件,该套件包括:包含含有卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品的容器;以及鼻内递送装置。
[0102]
进一步提供了一种容器,该容器含有包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品。配制品可如本文所述。在一些实施例中,配制品包含眼科可接受的载体。
[0103]
配制品可以是液体的形式。方便地,容器可被构造成将配制品的液滴分配到眼睛。
[0104]
在另一个方面,提供了一种制备配制品的方法,该方法包括:
[0105]-将环糊精和/或卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到溶剂中以形成悬浮液;
[0106]-将该悬浮液加热(或继续加热)至低于120℃的温度保持足以使该环糊精和/或卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐溶解在该溶剂中的一段时间,从而形成溶液;以及
[0107]-将该溶液冷却。
[0108]
在一些实施例中,在加热之前将环糊精和卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐两者添加到溶剂中。
[0109]
在一些实施例中,在添加环糊精和卤化水杨酰苯胺之前加热溶剂。在此类实施例中,在将环糊精和/或卤化水杨酰苯胺添加到溶剂中以形成悬浮液之后,可继续加热使得保持悬浮液的温度。
[0110]
在一些实施例中,该方法包括:
[0111]-将环糊精和卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐中的一种添加到溶剂中以形成悬浮液;
[0112]-将悬浮液加热(或继续加热)至低于120℃的温度保持足以使环糊精或卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐溶解在溶剂中的一段时间,从而形成第一溶液;
[0113]-将环糊精和卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐中的另一种以固体形式添加到第一溶液中;
[0114]-将第一溶液加热(或继续加热)至低于120℃的温度保持足以使固体溶解的一段时间,从而形成第二溶液;以及
[0115]-将该溶液冷却。
[0116]
在一些实施例中,该方法包括:
[0117]-将环糊精添加到溶剂中以形成第一悬浮液,并将第一悬浮液加热(或继续加热)至低于120℃(诸如25℃至100℃)的温度保持足以使环糊精溶解在溶剂中的一段时间,从而形成第一溶液;
[0118]-将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到溶剂中以形成第二悬浮液,并将第二悬浮液加热(或继续加热)至低于120℃(诸如25℃至100℃)的温度保持足以使卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐溶解在溶剂中的一段时间,从而形成第二溶液;
[0119]-将该第一溶液添加到该第二溶液中以形成混合物;以及
[0120]-将该混合物冷却。
[0121]
在本文所述的任何方法中的一些实施例中,将溶剂、溶液或悬浮液的ph调节至7或更大(例如8至12)的ph。已经发现高ph有助于环糊精与氯硝柳胺或其药学上可接受的盐之间形成包合复合物。在某些实施例中,将溶剂、溶液或悬浮液的ph调节至8或更大的ph。
[0122]
在一些实施例中,在添加卤化水杨酰苯胺之前将ph调节至7或更大的ph(例如8或更大的ph,诸如8至12的ph)。可通过添加碱(例如naoh)来调节ph。
[0123]
在本文所述的任何方法中的一些实施例中,悬浮液进一步包含水溶性聚合物(例
如pvp)。已经发现聚合物诸如pvp的存在增强了环糊精与氯硝柳胺或其药学上可接受的盐之间的包合复合物,并且使得能够制备氯硝柳胺或其药学上可接受的盐的高浓度水性溶液。因此,在一些实施例中,该方法包括将水溶性聚合物(例如pvp)添加到溶液或悬浮液中。在一些实施例中,将水溶性聚合物添加到第二溶液中。
[0124]
在一些实施例中,该方法包括在将第一溶液添加到第二溶液之后,在冷却之前,在低于120℃的温度下加热(或继续加热)混合物。加热可进行至25℃至约120℃(例如50℃至120℃)的温度。
[0125]
在一些实施例中,冷却进行至10℃至40℃的温度。
[0126]
在一些实施例中,溶剂是水性溶剂。合适地,溶剂基本上不含挥发性有机溶剂(例如乙醇)。优选地,溶剂是水。
[0127]
在本文所述的方法的优选实施例中,卤化水杨酰苯胺是氯硝柳胺乙醇胺。
附图说明
[0128]
现在将通过示例并参考附图来描述本发明的实施例,其中:
[0129]
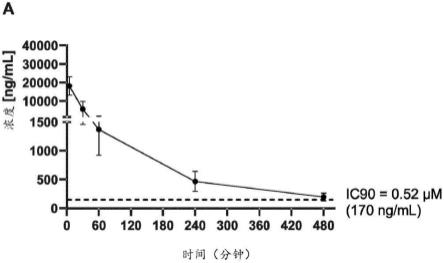
图1示出了显示与最高人类口服剂量的全身暴露相比,在绵羊中肺部施用后相对于抗sars-cov-2的ic90的氯硝柳胺游离碱的上皮衬液(elf)浓度的图。(a)在肺部施用本发明的配制品后,氯硝柳胺随时间推移的平均elf浓度(
±
sem);(b)在肺部施用本发明的配制品后elf中的氯硝柳胺平均cmax水平与在人体中施用2g/天口服剂量后的全身cmax的比较(数据来自andrews等人.1983,pharmacology&therapeutics[药理学与治疗学],19(2),245-295(健康志愿者)以及burock等人.2018,bmc cancer[bmc癌症],18(1):297(结直肠癌患者),合并在“2000mg单次/qd”列中);
[0130]
图2示出了显示在实例13中描述的1期临床试验中每个队列的氯硝柳胺乙醇胺的药代动力学曲线的图;
[0131]
图3是口服施用的氯硝柳胺(如文献中报道的)相对于吸入根据本发明的配制品在人体中的全身暴露(cmax;平均值
±
sem)的比较。生成的“2000mg,单次”列没有平均值,仅作为文献报道的cmax范围。500-1000mg的数据获自schweizer等人,2018,plos one[美国科学公共图书馆];13(6):e0198389。2000mg的数据获自andrews等人.1983和burock等人.2018(如上);
[0132]
图4示出了人相对于绵羊研究的全身暴露(cmax-,平均值
±
)的关联图;
[0133]
图5示出了氯硝柳胺乙醇胺盐对veroe6细胞(图5a)和caco-2细胞(图5b)中sars-cov-2复制的抑制;
[0134]
图6是显示氯硝柳胺乙醇胺盐抑制sars-cov-2的几种变体的复制的图;
[0135]
图7示出了氯硝柳胺乙醇胺盐对跨孔感染系统中sars-cov-2的顶端病毒感染滴度tcid50(图7a)和细胞内rna水平(图7b)的影响。n=2。图7a示出了95%水平的平均值,并且图7b示出了平均值
±
sd。*p《0.05,带有dunetts多重比较检验的普通单因素anova;并且
[0136]
图8示出了感染sars-cov-2的k18-hace2转基因小鼠在感染后第6天用根据本发明的配制品治疗与用盐水治疗相比的临床评分。配制品n=5,盐水n=6。**=p《0.01(曼-惠特尼检验)。
具体实施方式
[0137]
定义
[0138]
除非另有说明,否则说明书和权利要求书中使用的以下术语具有下文陈述的以下含义。
[0139]
提及“本发明的配制品”、“本发明的溶液”是指本文所述的包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的任何配制品。“本发明的溶液”是指其中卤化水杨酰苯胺或其药学上可接受的盐溶解在配制品中的本发明的配制品。
[0140]
术语“治疗”是指成功治疗或改善疾病、病状或病症的任何标志,包括任何客观或主观参数,诸如症状的消除、缓解、减轻或者使病状或病症对受试者更可耐受;减慢退化或衰退的速度;使退化终点不那么虚弱;改善受试者的身体或精神健康。例如,关于本文披露的感染性、炎性和眼部疾病的治疗,治疗可包括以下中的一种或多种:减少或消除病毒;防止或减少病毒复制;减少或消除感染的传播;减少或消除发热;减轻或消除流感样症状、减轻或消除咳嗽、减轻或消除肌肉和/或关节疼痛;改善受试者的呼吸状态(例如增加血氧饱和度;减少或消除对氧疗的需要);改善news2评分;预防或治疗例如与病毒感染相关的急性呼吸窘迫综合征;治疗或预防与病毒感染相关的肺炎;治疗或预防病毒性肺炎;治疗或预防与病毒感染或炎性肺病相关的细菌性肺炎;减轻或消除肺水肿;减少或消除肺部或眼部炎症;预防或减少肺纤维化(例如预防或减少间质成纤维细胞);降低与感染相关的一种或多种炎性生物标志物(例如降低crp、白细胞、il1b、il-6、il-10、il-2、ifnγ、ip10、mcp1、gcsf、ip10、mcp1、mip1a和/或tnfα中的一种或多种,特别是降低血清crp);预防或减少与感染相关的蛋白质性渗出物;预防或减少与感染相关的纤维蛋白渗出物;预防或改善与病毒感染相关的肺部细菌或真菌感染;减少或消除细菌或真菌;减少或消除细菌或真菌复制;减少或消除生物膜形成;减少或消除眼睛发红、酸痛、瘙痒或肿胀;改善或恢复视力,或预防视力丧失或进一步丧失,减少支气管收缩和/或痉挛,减少或抑制粘液分泌。还考虑了预防性治疗,其中用本发明的配制品(例如本发明的吸入配制品)治疗受试者以预防受试者感染疾病(例如病毒感染)或降低其风险或者预防疾病或病症变得有症状。应当理解,本文披露的配制品和方法也可用于治疗无症状受试者。
[0141]
在与疾病(例如病毒感染,诸如sars-cov-2)相关的物质或物质活性或功能的上下文中,术语“相关”或“与
……
相关”意指该疾病是(全部或部分)由该物质或物质活性或功能引起或者该疾病的症状是(全部或部分)由该物质或物质活性或功能引起。
[0142]
当施用本说明书中描述的化合物或盐(例如氯硝柳胺或其药学上可接受的盐)以治疗障碍时,“治疗有效量”是足以实现以下效果的量:减轻或完全缓和该障碍的症状或其他有害影响;治愈该障碍;逆转、完全停止或减缓该障碍的进展;或者降低该障碍恶化的风险。
[0143]
术语“药学上可接受的盐”是指保留本文所述的化合物的生物有效性和特性并且在生物学上或其他方面不是不合需要的盐。氯硝柳胺的药学上可接受的盐是本领域技术人员熟知的。具体的氯硝柳胺盐包括乙醇胺或哌嗪盐。因此,本文提及氯硝柳胺的盐可指氯硝柳胺的药学上可接受的盐,特别是氯硝柳胺的乙醇胺盐(本文也称为氯硝柳胺乙醇胺)(例如氯硝柳胺与2-氨基乙醇的1:1盐)。
[0144]
提及“局部治疗”或“局部施用”是指将配制品施用于皮肤、软组织或粘膜,包括通
过吸入来施用。
[0145]
提及“卤化水杨酰苯胺或其药学上可接受的盐”包括卤化水杨酰苯胺的水合物和溶剂合物(例如氯硝柳胺的水合物),以及卤化水杨酰苯胺的盐的水合物和溶剂合物(例如氯硝柳胺的盐的水合物)。还考虑了卤化水杨酰苯胺或其盐的非溶剂化和非水合形式。
[0146]
提及配制品是“溶液”的形式意指配制品的组分充分溶解,使得配制品对肉眼是透明的(即,配制品不含可见颗粒)。
[0147]
提及“气雾剂”意指包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的固体颗粒或液滴在气体(例如空气或合适的推进剂气体)中的悬浮液。包含液滴的气雾剂合适地通过雾化包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的溶液或悬浮液(例如本文所述的任何溶液或悬浮液)来形成。气雾剂的连续气相可选自药学上可接受的任何气体或气体混合物。优选地,气体可简单地是空气或压缩空气。替代性地,可使用其他气体和气体混合物,诸如富含氧气、二氧化碳或氮气和氧气的混合物的空气。可使用合适的吸入装置例如本文所述的喷雾器来实现雾化。
[0148]
可将气雾剂的颗粒/液滴尺寸测量为气雾剂液滴/颗粒的质量中值直径(mmd)。可使用熟知的方法(例如使用malvern mastersizer x
tm
的激光衍射技术)来测量mmd。合适地,可通过使用合适的喷雾器装置喷雾合适体积的溶液或悬浮液(例如2ml)来测定mmd。通过在23℃(
±
2℃)的温度和50%(
±
5%)的相对湿度下使用20l/min的抽吸流量将气雾剂云引导通过mastersizer x
tm
仪器的激光束来分析所得气雾剂。
[0149]
几何标准偏差(gsd)是气雾剂中颗粒或液滴尺寸分布的量度。可使用已知方法(例如使用熟知的激光衍射方法,例如在与上文针对mmd的测量描述的相同的条件下使用mastersizer x
tm
)来测定gsd。
[0150]
本文提及“受试者”意指人类或动物受试者。优选地,受试者是温血哺乳动物。更优选地,受试者是人。
[0151]
除非另有说明,否则本文提及“按重量计%的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐”旨在是指卤化水杨酰苯胺的游离酸(即非盐形式)的量。例如,提及包含“按重量计5%的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐”的组合物是指包含按重量计5%的卤化水杨酰苯胺作为游离酸的组合物。因此,在这种组合物包含卤化水杨酰苯胺的药学上可接受的盐的情况下,鉴于组合物中还将存在盐抗衡离子,组合物中盐的绝对量将高于按重量计5%。
[0152]
提及“非水性”组合物意指该组合物是无水的并且因此基本上不含水。例如,本文披露的组合物(例如包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的溶液或悬浮液)含有按重量计小于5%、小于1%或合适地小于0.01%、优选小于0.001%的水。优选的非水性组合物是无水且不含可检测水的那些。
[0153]
如技术人员将认识到的,提及通过吸入来施用包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液需要将溶液或悬浮液以适于吸入的形式递送给受试者。通常,将以喷雾剂的形式或者优选地以由溶液或悬浮液形成的气雾剂的形式递送溶液或悬浮液。用于以可吸入形式递送液体或悬浮液的方法和装置是熟知的并且包括喷雾器和pmdi吸入器。
[0154]
在本文提及用于治疗或预防病症(例如病毒感染)的本发明的配制品的情况下,应
被理解为还包括通过向受试者施用有效量的配制品来治疗或预防受试者的该病症的方法;以及配制品在制备用于治疗或预防该病症的药物中的用途。
[0155]
在数字的上下文中,提及“约”旨在包括值 /-10%。例如,约20%包括18%至22%的范围。
[0156]
贯穿本说明书的描述和权利要求,词语“包括”和“包含”以及它们的变型意指“包括但不限于”,并且它们并不旨在(并且并不)排除其他部分、添加剂、组分、整数或步骤。贯穿本说明书的描述和权利要求,除非上下文另有要求,否则单数涵盖复数。特别地,当使用不定冠词时,除非上下文另有要求,否则本说明书应被理解为考虑到复数以及单数。
[0157]
结合本发明的特定方面、实施例或者实例一起描述的特征、整数、特性、化合物、化学部分或基团应被理解为可适用于本文所描述的任何其他方面、实施例或实例,除非与之不相容。在本说明书中所披露的所有特征(包括任何所附权利要求书、摘要以及附图)和/或如此披露的任何方法或过程的所有步骤可以按任何组合的形式组合,这类特征和/或步骤中的至少一些相互排斥的组合除外。本发明并不限于任何前述实施例的细节。本发明扩展到本说明书(包括任何所附权利要求书、摘要以及附图)中所披露的特征的任何新颖特征或任何新颖组合,或扩展到如此披露的任何方法或过程的步骤的任何新颖步骤或任何新颖组合。
[0158]
读者的关注点是针对与本说明书同时或在本说明书之前连同本技术一起提交并且与本说明书一起开放以供公众检验的所有论文和文献,并且所有这类论文和文献的内容通过援引并入本文。
[0159]
卤化水杨酰苯胺
[0160]
卤化水杨酰苯胺也称为2-羟基-n-苯基苯甲酰胺或2-羟基苯酰替苯胺。水杨酰苯胺是弱酸性酚类化合物。卤化水杨酰苯胺是被至少一个卤代基团取代的水杨酰苯胺。许多卤化水杨酰苯胺衍生物是已知的。例如,卤化水杨酰苯胺可以是wo 2008/021088中描述的任何氯硝柳胺类似物,将其通过援引并入本文。
[0161]
卤化水杨酰苯胺可以是式(i)的卤化水杨酰苯胺:
[0162][0163]
其中
[0164]
x是o或s;
[0165]
r1和r2在每次出现时独立地选自卤代;
[0166]
r3和r4在每次出现时独立地选自h、c
1-6
烷基、c
1-6
卤代烷基、-or
a1
、-no2和-cn;
[0167]
r5是h或-l
1-r7;
[0168]
r6是h或-c(o)r
a2
;
[0169]
l1选自键、o、s、或-(cr
a3
rb)
o-,其中o是1或2;
[0170]
r7是未被取代或被1、2或3个选自卤代、c
1-4
烷基、c
1-4
卤代烷基、-or
a4
、-no2和-cn的基团取代的苯基;
[0171]ra1
、r
a2
、r
a3
和r
a4
在每次出现时独立地选自h和c
1-4
烷基;
[0172]
rb在每次出现时选自h、c
1-4
烷基和-cn;
[0173]
n和p各自独立地选自0、1、2、3或4,条件是n p至少为1;
[0174]
t和v独立地选自0、1和2;
[0175]
或其药学上可接受的盐或酯或水合物。
[0176]
以下编号段落中的以下陈述适用于式(i)的化合物。这些陈述是独立且可互换的。换言之,以下陈述中任何一个中描述的任何特征可以(在化学上允许的情况下)与下面一个或多个其他陈述中描述的特征组合。特别地,在本说明书中例举或例示的化合物的情况下,可以将以下以任何一般水平表示的、描述该化合物特征的任何两个或更多个陈述进行组合,以表示预期的在本说明书中形成本发明披露内容的一部分的主题。
[0177]
1.x是o。
[0178]
2.r1和r2在每次出现时独立地选自氟、氯、溴和碘。
[0179]
3.r1和r2在每次出现时独立地选自氯、溴和碘。
[0180]
4.r1是氯。
[0181]
5.r1是溴。
[0182]
6.r1是碘。
[0183]
7.r2是氯。
[0184]
8.r2是溴。
[0185]
9.r2是碘。
[0186]
10.r3和r4在每次出现时独立地选自h、c
1-4
烷基、c
1-4
卤代烷基、-or
a1
、-no2和-cn。
[0187]
11.r3和r4在每次出现时独立地选自h、c
1-4-烷基、-or
a1
和-no2。
[0188]
12.r3和r4在每次出现时独立地选自h、c
1-4-烷基、-cf3、-oh、-ome、-no2和-cn,例如h、c
1-4-烷基、-oh或-no2。
[0189]
13.r4在每次出现时独立地选自-cf3、-no2和-cn。
[0190]
14.r4在每次出现时独立地选自c
1-4-卤代烷基、-no2和-cn。
[0191]
15.r5是h。
[0192]
16.r5是-l
1-r7。
[0193]
17.l1选自-o-、-ch
2-和-ch(cn)-,例如-o-或-ch(cn)-。
[0194]
18.r7是未被取代或被1、2或3个选自卤代、c
1-4
烷基、c
1-4
卤代烷基和-cn的基团取代的苯基。
[0195]
19.r7是未被取代或被1、2或3个选自卤代的基团(例如1或2个基团)取代的苯基。
[0196]
20.r7是未被取代的苯基。
[0197]
21.l1选自-o-和-ch(cn)-;并且r7是未被取代或被1、2或3个选自卤代的基团取代的苯基。
[0198]
22.r6是h。
[0199]
23.r6是-c(o)r
a2
,例如-c(o)ch3。
[0200]
24.t=0或1。
[0201]
25t=0。
[0202]
26.v=0或1。
[0203]
27.v=0。
[0204]
28.o是1。
[0205]
29.v=1,并且r4选自-oh、c
1-4-烷基和-no2。
[0206]
30.v=1,并且r4选自-cn、c
1-4-卤代烷基(例如-cf3)和-no2。
[0207]
31.一种式(i)的化合物或其药学上可接受的盐。
[0208]
特定化合物是式(i)的化合物或其药学上可接受的盐、水合物或酯,其中:x是o;
[0209]
r1和r2在每次出现时独立地选自卤代;
[0210]
r3和r4在每次出现时独立地选自h、c
1-4
烷基、-or
a1
、-no2和cn;
[0211]
r5是h或-l
1-r7;
[0212]
r6是h或-c(o)r
a2
;
[0213]
l1选自o和-ch(cn)-;
[0214]
r7是未被取代或被1、2或3个选自卤代的基团取代的苯基;
[0215]ra1
和r
a2
在每次出现时独立地选自h和c
1-4-烷基;
[0216]
n和p各自独立地选自0、1、2、3或4,条件是n p至少为1;
[0217]
t和v独立地选自0、1和2;
[0218]
或其药学上可接受的盐或酯。
[0219]
卤化水杨酰苯胺可选自:
[0220]
[0221][0222]
或其药学上可接受的盐或溶剂化物(例如水合物)。
[0223]
卤化水杨酰苯胺可以是硫代酰胺衍生物,例如溴替尼特;
[0224][0225]
或其药学上可接受的盐、溶剂化物(例如水合物)。
[0226]
卤化水杨酰苯胺可选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、碘醚柳胺、五氯柳胺、雷琐太尔、氯碘柳苯胺、二溴沙仑(dibromosalan)、三溴沙仑(tribromosalan)、溴替尼特和氯硝柳胺或其药学上可接受的盐或前药或衍生物。
[0227]
卤化水杨酰苯胺可选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、碘醚柳胺、五氯柳胺、雷琐太尔、二溴沙仑、三溴沙仑和氯硝柳胺或其药学上可接受的盐或酯。
[0228]
卤化水杨酰苯胺可选自由以下组成的组:氯碘柳苯胺、氯氰碘柳胺、五氯柳胺、碘醚柳胺、三溴沙仑或其药学上可接受的盐或酯。
[0229]
卤化水杨酰苯胺可选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、碘醚柳胺、五氯柳胺、雷琐太尔、氯碘柳苯胺、二溴沙仑、三溴沙仑、溴替尼特和氯硝柳胺或其药学上可接受的盐或水合物。
[0230]
卤化水杨酰苯胺可选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、碘醚柳胺、五氯柳胺、雷琐太尔、氯碘柳苯胺、二溴沙仑、三溴沙仑和氯硝柳胺或其药学上可接受的盐或水合物。
[0231]
卤化水杨酰苯胺可选自由以下组成的组:氯硝柳胺、氯碘柳苯胺、氯氰碘柳胺、五氯柳胺、碘醚柳胺和三溴沙仑或其药学上可接受的盐或水合物。
[0232]
卤化水杨酰苯胺可选自由以下组成的组:氯碘柳苯胺、氯氰碘柳胺、五氯柳胺、碘醚柳胺和三溴沙仑或其药学上可接受的盐或水合物。
[0233]
卤化水杨酰苯胺可选自由以下组成的组:氯碘柳苯胺、氯氰碘柳胺、碘醚柳胺和三溴沙仑或其药学上可接受的盐或水合物。
[0234]
卤化水杨酰苯胺可选自由以下组成的组:四氯水杨酰苯胺、氯氰碘柳胺、碘醚柳胺、五氯柳胺、雷琐太尔、氯碘柳苯胺、二溴沙仑、三溴沙仑、溴替尼特和氯硝柳胺。
[0235]
卤化水杨酰苯胺可选自由以下组成的组:氯硝柳胺、氯氰碘柳胺、五氯柳胺和碘醚柳胺或其药学上可接受的盐。
[0236]
卤化水杨酰苯胺可选自由以下组成的组:氯硝柳胺和五氯柳胺或其药学上可接受的盐或水合物。
[0237]
卤化水杨酰苯胺可以是氯碘柳苯胺或其药学上可接受的盐或酯,例如卤化水杨酰苯胺是氯碘柳苯胺或其药学上可接受的盐或水合物,合适地卤化水杨酰苯胺是氯碘柳苯胺。
[0238]
卤化水杨酰苯胺可以是氯氰碘柳胺或其药学上可接受的盐或水合物,例如卤化水杨酰苯胺是氯氰碘柳胺或其药学上可接受的盐,合适地卤化水杨酰苯胺是氯氰碘柳胺。
[0239]
卤化水杨酰苯胺可以是五氯柳胺或其药学上可接受的盐或酯,例如卤化水杨酰苯胺是五氯柳胺或其药学上可接受的盐或水合物,合适地卤化水杨酰苯胺是五氯柳胺。
[0240]
卤化水杨酰苯胺可以是碘醚柳胺或其药学上可接受的盐或水合物,例如卤化水杨酰苯胺是碘醚柳胺或其药学上可接受的盐,合适地卤化水杨酰苯胺是碘醚柳胺。
[0241]
卤化水杨酰苯胺可以是三溴沙仑或其药学上可接受的盐或水合物,例如卤化水杨酰苯胺是三溴沙仑或其药学上可接受的盐,特别合适地卤化水杨酰苯胺是三溴沙仑。
[0242]
卤化水杨酰苯胺可以是氯硝柳胺或其药学上可接受的盐或水合物,例如卤化水杨酰苯胺是氯硝柳胺或其药学上可接受的盐。
[0243]
在某些实施例中,卤化水杨酰苯胺是游离酸形式的氯硝柳胺。
[0244]
在某些实施例中,卤化水杨酰苯胺是氯硝柳胺的药学上可接受的盐,例如乙醇胺盐或哌嗪盐。
[0245]
在优选的实施例中,卤化水杨酰苯胺是氯硝柳胺乙醇胺。
[0246]
环糊精
[0247]
环糊精是环状寡糖家族,由通过α-1,4糖苷键连接的五个或更多个葡萄糖亚单元的大环组成。具有六至八个葡萄糖单元的常见环糊精包括:α-环糊精(六个葡萄糖单元)、β-环糊精(七个葡萄糖单元)和γ-环糊精(八个葡萄糖单元)。环糊精的衍生物可通过化学修饰一些或全部羟基基团(例如通过添加烷基(例如甲基、羟丙基或羟乙基)或乙酰基基团)来制备。可对环糊精进行化学修饰以便改善其溶解性。
[0248]
在一些实施例中,环糊精是水溶性的。本发明中优选使用的水溶性环糊精衍生物是指具有至少β-环糊精的水溶性的衍生物。此类水溶性环糊精衍生物的实例是磺丁基环糊精、羟丙基环糊精、麦芽糖基环糊精以及它们的盐。特别地,磺丁基-β-环糊精、羟丙基-β-环糊精、麦芽糖基-β-环糊精以及它们的盐。
[0249]
根据本发明的其他优选的环糊精衍生物是甲基环糊精(环糊精甲基化的产物)、二甲基环糊精(dimeb)(优选在2和6位被取代)、三甲基环糊精(优选在2、3和6位被取代)、“随
机甲基化”环糊精(rameb)(优选在2、3和6位被随机取代,但许多1,7至1,9位甲基被单元葡萄哌喃糖取代)、羟丙基环糊精(hpcd,优选地主要在2和3位被随机取代的羟丙基化环糊精(例如hp-β-cd、hp-γ-cd))、磺丁基醚环糊精(sbecd)、羟乙基-环糊精、羧甲基乙基环糊精、乙基环糊精、通过在羟基基团上接枝烃化链而获得并且能够形成纳米颗粒的环糊精两亲物、通过接枝单胺化(带有间隔臂)的环糊精而获得的胆固醇环糊精和甘油三酯-环糊精。
[0250]
环糊精可以是α-环糊精或其衍生物,诸如甲基化、乙酰化或羟丙基化α-环糊精。环糊精可以是β-环糊精或其衍生物,诸如甲基化、乙酰化和/或羟丙基化β-环糊精。环糊精可以是γ-环糊精或其衍生物,诸如甲基化、乙酰化和/或羟丙基化γ-环糊精。在一些实施例中,环糊精选自由以下组成的组:β-环糊精及其合成衍生物,诸如hp-β-cd、sbe-β-cd、rm-β-cd、dime-β-cd、trime-β-cd、羟丁基-β-cd、葡糖基-β-cd和麦芽糖基-β-cd。在一些实施例中,环糊精选自由以下组成的组:γ-环糊精及其合成衍生物,诸如hp-γ-cd、sbe-γ-cd、rm-γ-cd、dime-γ-cd、trime-γ-cd、羟丁基-γ-cd、葡糖基-γ-cd和麦芽糖基-γ-cd。
[0251]
优选地,环糊精是hp-β-cd。
[0252]
包含卤化水杨酰苯胺和环糊精的可吸入配制品
[0253]
卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精可存在于任何药物配制品中。特别地,配制品可适于通过吸入来施用。包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的优选可吸入配制品包括例如如本文更详细描述的溶液、悬浮液、粉末、溶液的气雾剂或悬浮液的气雾剂形式的组合物。
[0254]
还考虑了包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的其他可吸入配制品,例如:包含溶解或分散在其中的氯硝柳胺或其药学上可接受的盐和环糊精的固体脂质颗粒;包含氯硝柳胺或其药学上可接受的盐和环糊精的乳剂(例如水包油乳剂,其中氯硝柳胺或其药学上可接受的盐和环糊精溶解或分散在乳剂的水相中);或者包含氯硝柳胺或其药学上可接受的盐和环糊精的脂质体。
[0255]
许多患者对各种化学味道(包括苦味、盐味、甜味、金属味)的敏感性增加。为了产生耐受性良好的药物产品,通过非限制性实例,可通过向配制品中添加掩味赋形剂、调节的克分子渗透压浓度和/或甜味剂来实现掩味。通过非限制性实例,配制品可进一步包括调味剂、掩味剂、无机盐(例如氯化钠)、抗微生物剂(例如苯扎氯铵)、甜味剂、抗氧化剂、抗静电剂、表面活性剂(例如聚山梨醇酯,诸如“tween 20”和“tween 80”)、脱水山梨糖醇酯、糖精、脂质(例如磷脂,诸如卵磷脂和其他磷脂酰胆碱、磷脂酰乙醇胺)、脂肪酸和脂肪酯、类固醇(例如胆固醇)和螯合剂(例如edta、锌和其他此类合适的阳离子)。适用于根据本发明的组合物的其他药物赋形剂和/或添加剂列于“remington:the science&practice of pharmacy[雷明顿:药学科学和实践]”,第19版增刊,williams&williams[威廉姆斯和威廉姆斯],(1995)和“physician's desk reference[医师案头参考]”,第52版增刊,medical economics,montvale,n.j.[医学经济学,新泽西州蒙特维尔](1998)。
[0256]
包含卤化水杨酰苯胺和环糊精的溶液和悬浮液
[0257]
在某些实施例中,包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的配制品是溶液或悬浮液。优选地,溶液或悬浮液是液体,更优选适于使用例如喷雾器吸入器雾化的液体。因此,本文提及包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的任何溶液或悬浮液优选地是包含卤化水杨酰苯胺(例如氯硝柳胺)或
其药学上可接受的盐和环糊精的液体溶液或液体悬浮液。
[0258]
在某些实施例中,将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精溶解或分散在液体介质中以提供适于吸入的溶液或悬浮液。在某些实施例中,将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精溶解或分散在包含水或由水组成的溶剂中,从而形成水性溶液或悬浮液。在一些实施例中,将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精溶解或分散在包含水和共溶剂(诸如dmso)的溶剂中。
[0259]
已经发现根据本发明的一些配制品能够形成基本上澄清的溶液,即无可见沉淀。因此,在一些实施例中,根据本发明的溶液是基本上澄清的。在一些实施例中,溶液在储存(例如在密闭容器中)至少1天、至少2天、至少4天、至少7天、至少14天、至少21天或至少28天时是物理稳定的(即无可见沉淀形成)。溶液在5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃下储存(例如在密闭容器中)时可以是物理稳定的。在一些实施例中,溶液在25℃下储存(例如在密闭容器中)至少7、14或28天后是物理稳定的。在一些实施例中,溶液在40℃下储存(例如在密闭容器中)至少7、14或28天后是物理稳定的。
[0260]
在实施例中,其中卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精作为液体介质中的悬浮液存在。
[0261]
卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐可以本文所述的任何量存在于液体介质中的溶液或悬浮液中。当卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐作为溶液存在时,溶液通常含有按重量计约0.1%至约5%(例如约1%)的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐。
[0262]
环糊精可以本文所述的任何量存在于液体介质中的溶液或悬浮液中。当环糊精作为溶液存在时,溶液通常含有按重量计约1%至约60%例如按重量计约1%至约25%(例如约15%)的环糊精。
[0263]
已知一些卤化水杨酰苯胺诸如氯硝柳胺难溶于水。不受理论的约束,据认为卤化水杨酰苯胺的至少一部分将在本发明的配制品中与环糊精形成复合物,从而改善其溶解性。特别地,与环糊精的复合被认为有益于治疗肺部疾病,因为当配制品接触肺组织时,复合物可有助于防止卤化水杨酰苯胺沉淀。应当理解,在溶液或悬浮液中,卤化水杨酰苯胺和环糊精可在结合(即复合)和非结合(即非复合)状态之间连续波动。因此,基于卤化水杨酰苯胺的重量,按重量计约20%至约100%的卤化水杨酰苯胺可与环糊精形成复合物。在液体配制品中,任何非复合组分(卤化水杨酰苯胺和/或环糊精)可存在于溶液和/或悬浮液中。
[0264]
根据本发明的液体配制品可具有约100mosmol/kg至约1000mosmol/kg的克分子渗透压浓度。在一些实施例中,克分子渗透压浓度为约150mosmol/kg至约750mosmol/kg、约200mosmol/kg和约500mosmol/kg、优选约230至约350mosmol/kg、更优选约280至约330mosmol/kg(例如约290至约320mosmol/kg)。
[0265]
在一些实施例中,基于液体配制品的重量,液体配制品包含按重量计约1%至约25%的环糊精和按重量计约0.1%至约5%的氯硝柳胺或其药学上可接受的盐(例如氯硝柳胺乙醇胺)。
[0266]
在一些实施例中,液体配制品包含:
[0267]
0.1%-5%卤化水杨酰苯胺或其药学上可接受的盐,例如0.5%-2%或1%-1.5%
氯硝柳胺乙醇胺;
[0268]
1%-25%环糊精,例如3%-15%或5%-10%hp-β-cd;
[0269]
0.1%-10%聚合物,例如0.5%-5%或1%-2%pvp;
[0270]
0%-0.2%稳定剂,例如0.05%至0.1%依地酸二钠;
[0271]
0%-0.02%防腐剂,例如0.005%-0.01%苯扎氯铵;
[0272]
0%-0.9%电解质,例如0.1%-0.5%氯化钠;
[0273]
0%-10%共溶剂,例如0.5%-5%或1%dmso;
[0274]
余量为水,
[0275]
其中这些百分比基于该液体配制品的重量按重量计。
[0276]
合适地,液体配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[0277]
在一些实施例中,液体配制品包含:
[0278]
0.1%-5%卤化水杨酰苯胺或其药学上可接受的盐,例如0.5%-2%或1%-1.5%氯硝柳胺乙醇胺;
[0279]
1%-25%环糊精,例如3%-15%或5%-10%hp-β-cd;
[0280]
0.1%-10%聚合物,例如0.5%-5%或1%-2%pvp;
[0281]
0%-3%一种或多种ph调节剂(合适地,ph调节剂(例如naoh和/或hcl)以提供7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph的量(例如0.1%-0.5%naoh(例如作为固体或1m溶液添加)和0.5%-3.0%2n hcl)存在);
[0282]
余量为水,
[0283]
其中这些百分比基于该液体配制品的重量按重量计。
[0284]
在一些实施例中,液体配制品包含:
[0285]
0.5%-1.5%氯硝柳胺乙醇胺;
[0286]
5%-20%环糊精,优选β-环糊精,更优选hp-β-cd;
[0287]
0.5%-5%pvp(例如pvp 30);
[0288]
余量为水,
[0289]
其中这些百分比基于该液体配制品的重量按重量计;并且
[0290]
其中该配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[0291]
在一些实施例中,液体配制品包含:
[0292]
约1%氯硝柳胺乙醇胺;
[0293]
约15%环糊精,优选β-环糊精,更优选hp-β-cd;
[0294]
约2%pvp(例如pvp 30);
[0295]
余量为水,
[0296]
其中这些百分比基于该液体配制品的重量按重量计;并且
[0297]
其中该配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[0298]
在一些实施例中,液体配制品包含:
[0299]
约1%氯硝柳胺乙醇胺;
[0300]
约10%环糊精,优选β-环糊精,更优选hp-β-cd;
[0301]
约2%pvp(例如pvp 30);
[0302]
余量为水,
[0303]
其中这些百分比基于该液体配制品的重量按重量计;并且
[0304]
其中该配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[0305]
气雾剂
[0306]
包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液可以适于吸入的形式施用于受试者。例如,溶液或悬浮液可作为喷雾剂、优选地作为包含氯硝柳胺或其药学上可接受的盐的溶液或悬浮液的气雾剂施用。
[0307]
本文披露的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液和分散体的气雾剂形成本发明的另一个方面。
[0308]
本发明的可吸入组合物(例如包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或分散体的气雾剂)的吸入将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐递送到受试者的气道。在某些实施例中,气雾剂的吸入将卤化水杨酰苯胺(例如氯硝柳胺)递送到上呼吸道,例如鼻和鼻道、鼻旁窦、咽、声带上方的喉部分中的一个或多个。优选地,气雾剂的吸入将卤化水杨酰苯胺(例如氯硝柳胺)递送到下呼吸道,例如气管、肺、支气管、细支气管、肺泡管或肺泡中的一个或多个。
[0309]
在某些实施例中,包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液的气雾剂具有小于约5μm的质量中值直径。mmd可小于约2μm。气雾剂的mmd可为约0.5μm至约5.5μm。优选地,气雾剂的mmd为约1μm至约5μm。合适地,气雾剂具有小于约2.2例如小于2.0或小于1.8的几何标准偏差(gsd)。优选地,气雾剂的gsd小于1.6。
[0310]
在一些实施例中,包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液的气雾剂具有小于约100μm、小于约90μm、小于约80μm、小于约70μm、小于约60μm或小于约50μm的质量中值直径。在一些实施例中,气雾剂的mmd为约5至约150μm、约10μm至约120μm、约20至约100μm、约30μm至约90μm、约40μm至约80μm或约50μm至约70μm,例如约65μm。
[0311]
如本领域已知的,液滴或颗粒尺寸分布也可通过参考d10和d90值来定义。10%的颗粒或液滴小于d10值。90%的颗粒或液滴小于d90值。在一些实施例中,本发明的配制品的气雾剂具有1至100μm、5至80μm、10至60μm、15至50μm或20至40μm(例如约30μm)的d10。在一些实施例中,本发明的配制品的气雾剂具有50至500μm、80至400μm、100至300μm或150至250μm的d90。可使用熟知的方法(例如使用来自马尔文(malvern)的spraytec设备通过激光衍射诸如低角激光散射(lalls))来测量颗粒尺寸分布。
[0312]
可使用已知方法(例如经由合适的吸入器装置,特别是如本文所述的喷雾器)来形成包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液的气雾剂。
[0313]
包含氯硝柳胺的粉末
[0314]
在某些实施例中,可吸入组合物是包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的粉末。
[0315]
合适地,粉末包括具有可呼吸尺寸的颗粒。在某些实施例中,粉末具有小于10μm例如小于5μm的颗粒尺寸(mmd)。例如,粉末颗粒的mmd为约1μm至约5μm。合适地,施用于受试者的颗粒(例如作为粉末的气雾剂)具有小于约2.2例如小于2.0或小于1.8的gsd。
[0316]
可使用熟知的方法(例如通过微沉淀、冻干或喷雾干燥或喷雾冷冻干燥包含卤化
水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的本发明的溶液)来制备适于吸入的粉末。
[0317]
在某些实施例中,可通过沉淀、冻干或喷雾干燥或喷雾冷冻干燥包含卤化水杨酰苯胺、环糊精和合适的载体的溶液以提供包含卤化水杨酰苯胺、环糊精和载体的可呼吸粉末颗粒作为复合颗粒来制备包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的可呼吸颗粒。合适的载体包括惰性载体诸如淀粉、糖(例如甘露醇、乳糖或海藻糖)。
[0318]
在某些实施例中,包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的可呼吸颗粒的粉末可与载体颗粒一起配制。载体颗粒可大于卤化水杨酰苯胺和环糊精的颗粒,并且载体与可呼吸卤化水杨酰苯胺/环糊精粉末的混合形成“有序混合物”。此类有序混合物可以用于干粉吸入器。卤化水杨酰苯胺/环糊精粉末的细颗粒可与较大的载体颗粒(例如,大约100μm)松散缔合,以促进粉末在单位剂量的吸入器储器(例如小瓶、胶囊或泡罩包装)中的填充和储存。在从吸入器施用时,粉末所经历的湍流和/或机械冲击从较大的载体颗粒中释放药物的细颗粒,以提供被吸入到受试者呼吸道中的药物的可呼吸细颗粒级分。适于制备有序混合物的载体包括例如乳糖、甘露醇和微晶纤维素。
[0319]
可使用合适的干粉吸入器将包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的粉末施用于受试者。替代性地,可在施用(例如经由喷雾或施用液滴)之前将如本文所述的包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的粉末溶解或悬浮在合适的溶剂(优选水)中。
[0320]
可吸入药物组合物中的其他组分
[0321]
本文所述的配制品任选地进一步包含一种或多种粘度调节剂、乳化剂、表面活性剂、保湿剂、油、蜡、聚合物、防腐剂、ph调节剂(例如合适的酸或碱,例如有机酸或有机胺碱)、缓冲剂、稳定剂、电解质、抗氧化剂(例如丁基羟基茴香醚或丁基羟基甲苯)、结晶抑制剂(例如纤维素衍生物,诸如羟丙基甲基纤维素或聚乙烯吡咯烷酮)、着色剂、香料和掩味剂。此类赋形剂是熟知的,例如如在handbook of pharmaceutical excipients[药物赋形剂手册],第7版,rowe等人中列出。
[0322]
系统和装置
[0323]
吸入器
[0324]
可通过吸入将配制品施用于受试者。在一些实施例中,使用合适的吸入器以可吸入形式将配制品合适地递送给受试者。吸入器是熟知的并且包括干粉吸入器(dpi)、计量吸入器(mdi)、加压计量吸入器(pmdi)和喷雾器。
[0325]
喷雾器
[0326]
喷雾器适于形成配制品的气雾剂。喷雾器特别适于形成包含卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液的气雾剂,例如如本文所述的包含氯硝柳胺或其药学上可接受的盐和环糊精的液体溶液和悬浮液。合适的喷雾器产生可吸入药物组合物的可呼吸气雾剂。
[0327]
喷雾器可包含含有配制品(例如溶液或悬浮液)的储器,其中喷雾器的致动递送单剂量的配制品,其作为气雾剂被受试者吸入。替代性地,喷雾器可以是多剂量喷雾器,其中将单位剂量的配制品装载到喷雾器中(例如经由小瓶、注射器、胶囊、泡罩包装或其他合适
的容器)并且作为单位剂量的配制品的气雾剂施用于受试者。
[0328]
在某些实施例中,喷雾器选自喷射喷雾器、振动网喷雾器、超声喷雾器。喷射喷雾器利用空气压力将溶液或悬浮液破碎成气雾剂液滴。超声喷雾器使用压电晶体对溶液或悬浮液的剪切来产生气雾剂。振动网喷雾器包括溶液或悬浮液与振动隔膜网流体接触。网的振动用于产生溶液或悬浮液的气雾剂。
[0329]
喷雾器是可商购获得的并且包括由爱尔真公司(aerogen)生产的respirgardpro和go;由阿拉迪姆公司(aradigm)生产的和aerx essence
tm
;由伟康公司(respironics,inc.)生产的freeway freedom
tm
、sidestream、ventstream和i-neb;以及由帕瑞公司(pari,gmbh)生产的和e-flow
tm
。
[0330]
优选地,喷雾器是振动网喷雾器,例如e-flow
tm
喷雾器。喷雾器进一步披露于wo 2001032246、wo 01/34232、wo 2001056639、wo 2001085241、wo 2002013896、wo 2002064265、wo 2003035153、wo 2003035152、wo 2004004813、wo 2004014569、wo 2004020029、wo 2004028606、wo 2004039442、wo 2004041336、wo 2004041335、wo 2004052436、wo 2004098689、wo 2005032630、wo 2005037246、wo 2005042075、wo 2006108556、wo 2006084543、wo 2006084546、wo 2006128567、wo 2007020073、wo 2007118557、wo 2010097119、wo 2016015889、wo 2008113651、wo 2009135871、wo 2010066714、wo 2010094767、wo 2010097119、wo 2010097119、wo 2010139730、wo 2011134940、wo 2012069531、wo 2013013852、wo 2012168181、wo 2014040947、wo 2014082818、wo 2015091356、wo 2015128375、wo 2015193432、wo 2016026802,wo 2016102308、wo 2017021441、wo 2018167278、wo 2019115771和wo 2019202085;将它们通过援引并入本文。
[0331]
计量吸入器(mdi)
[0332]
推进剂驱动或加压的计量吸入器(pmdi)在致动吸入器时释放计量的溶液或悬浮液的气雾剂。合适地,将包含卤化水杨酰苯胺(例如,氯硝柳胺)或其药学上可接受的盐和环糊精的溶液或悬浮液配制为包含合适的推进剂诸如卤化烃的悬浮液或溶液。
[0333]
与mdi一起使用的推进剂可以是本领域已知的任何推进剂。推进剂的实例包括氯氟烃(cfc),诸如二氯二氟甲烷、三氯氟甲烷或二氯四氟乙烷;氢氟烷烃(hfa);氮气和二氧化碳。合适地,推进剂是hfa,例如氢氟烷烃134a(hfa134a)、hfa-152a或氢氟烷烃227ea(hfa 227ea)。
[0334]
mdi可用触发器致动以释放用于吸入的气雾剂。替代性地,mdi可以是呼吸致动的,其中当使用者吸气时,使用者的吸入触发气雾剂的释放。
[0335]
干粉吸入器
[0336]
干粉吸入器(dpi)适于吸入包含氯硝柳胺或其药学上可接受的盐的粉末。dpi可以是储器装置,其中药物包含在该装置的贮器中,并且该装置从药物储器递送单位剂量的药物。替代性地,dpi可以是计量装置,其中单位剂量的药物装载到该装置中并作为粉末的气雾剂吸入。dpi的实例包括描述于a.h.de boer等人,expert opinion on drug delivery[药物递送专家意见],2017,14:4,499-512中的那些。
[0337]
dpi是可商购获得的并且包括dpi是可商购获得的并且包括dpi是可商购获得的并且包括taper dpi、和吸入器。
[0338]
鼻内递送装置
[0339]
鼻内递送装置可适于将溶液或悬浮液递送到鼻粘膜。鼻内递送装置可以是滴管、计量喷雾泵(例如多剂量或双向多剂量喷雾泵)、挤压瓶、单剂量或双剂量喷雾装置、鼻加压计量吸入器(pmdi)、脉动膜喷雾器、鼻声波/脉动喷射喷雾器、振动网喷雾器、鼻雾化器或气体或电动雾化器。
[0340]
挤压瓶通常用于递送非处方药,诸如减充血剂。通过手动挤压可变形(例如塑料)充气瓶,溶液在通过喷射出口递送时被雾化。
[0341]
计量喷雾泵通常用于鼻药物递送。传统的喷雾泵使用防腐剂来防止当射出的液体被空气取代时的污染。然而,最近的装置通过使用可收缩袋、可移动活塞或压缩气体来取代射出的液体或替代性地使用过滤器来净化空气而避免了对防腐剂的需求。可商购获得的鼻喷雾泵由阿普塔集团(aptar group)销售。
[0342]
单剂量或双剂量喷雾装置旨在用于一次性或零星使用和/或准确给药很重要的情况,例如用于昂贵药物和疫苗的施用。可商购获得的装置包括mad nasal
tm
鼻内粘膜雾化装置和由贝迪技术公司(becton dickinson technologies)销售的accuspray
tm
。
[0343]
已经开发了使用氢氟烷烃(hfa)作为推进剂的鼻加压计量吸入器(pmdi)。此类装置已被批准用于治疗过敏性鼻炎。
[0344]
脉动膜喷雾器经由穿孔振动膜产生气雾剂。可商购获得的装置包括帕瑞制药公司(pari pharma gmbh)销售的vibrent装置。其他类型的可商购获得的喷雾器和雾化器包括atomisor声波喷雾器(鼻声波/脉动喷射喷雾器,法国dtf医疗公司(dtf-medical))、aeroneb(网喷雾器,爱尔真公司)、包括bi-directional
tm
技术的装置、vianase
tm
电子雾化器(库尔夫技术公司(kurve technology inc.))和氮气驱动的雾化器(例如由英派尔公司(impel inc.)销售)。
[0345]
在一些实施例中,鼻内递送装置适于将粉末递送到鼻粘膜。鼻内递送装置可以是鼻粉末吸入器(例如,其适于鼻递送)、鼻粉末喷雾器或鼻粉末吹入器。可商购获得的装置包括rhinocorttwin-lizer
tm
、fit-lizer
tm
(snbl)、unidose
tm xtra(贝斯派克公司(bespak))、monopowder(阿普塔集团)和由销售的粉末呼气递送系统(eds)。
[0346]
容器
[0347]
在一些实施例中,使用滴瓶施用如本文所述的液体配制品。在一些实施例中,包括可挤压容器的滴瓶设置有终止于排出孔的锥形分配器。在一些实施例中,为了施用液体配制品,将排出孔口在目标眼睛上方对准并且挤压瓶以挤出一滴或一剂液体。
[0348]
替代性地,已经开发了液体分配器,其中配制品通过滴管(例如滴瓶或edo-ophthiols)从储存瓶中供应。在一些实施例中,由于向可压缩储存瓶施加手动压力,水性配
制品从滴管开口流出。
[0349]
在一些实施例中,如本文所述的配制品储存在塑料或玻璃瓶中。在一些实施例中,塑料瓶是低密度聚乙烯瓶。在一些实施例中,本文所述的配制品储存在具有或不具有液体分配器的玻璃瓶中。在一些实施例中,塑料或玻璃瓶是不透明的。
[0350]
感染性疾病
[0351]
合适地,本发明的配制品可用于治疗感染性疾病,诸如肺部感染。感染性疾病可以是病毒、细菌或真菌感染。病毒感染可以是对用卤化水杨酰苯胺诸如氯硝柳胺进行治疗或预防有反应的任何病毒感染。
[0352]
病毒感染
[0353]
例如,病毒感染可以由选自以下的病毒引起或与其相关:冠状病毒科(例如α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状病毒)、微小核糖核酸病毒科(例如肠道病毒,诸如鼻病毒、合适的人鼻病毒(hrv))、黄病毒科(例如寨卡病毒(zikv)、登革热(例如denv 1-4)、西尼罗病毒(wnv)、黄热病病毒(yfv,例如黄热病17d病毒)、日本脑炎病毒(jev)、丙型肝炎病毒(hcv))、丝状病毒科(例如埃博拉病毒)、披膜病毒科(例如甲病毒,诸如基孔肯亚病毒(chikv)、辛德毕斯病毒和罗斯河病毒)、疱疹(例如γ-疱疹病毒、人疱疹病毒8、疱疹病毒1和疱疹病毒2)和腺病毒科(例如人腺病毒(hadv))。
[0354]
感染或进行其生命周期的至少一个阶段或在呼吸道中致病的病毒在本发明中是最感兴趣的。在一些情况下,此类病毒可以经由呼吸道进入受试者体内(例如,它们能够通过吸入传播,例如经由空气传播或液滴传播),并且/或者它们可在呼吸道(例如上呼吸道或下呼吸道)中进行复制的初始阶段或另外的阶段。通过空气传播或液滴传播而传播的病毒的一些熟知的实例包括冠状病毒、流感病毒、副流感病毒、腺病毒、呼吸道合胞病毒、人偏肺病毒。不考虑经典的空气传播或液滴传播的病毒,其他病毒在一些情况下可通过空气传播,例如含有病毒的体液被雾化。此外,不通过空气传播的其他病毒可在呼吸道中复制或致病,因此可以使用本发明的可吸入组合物来治疗。
[0355]
通过空气传播或液滴传播而传播和/或引起病毒性呼吸道疾病的病毒在本发明中是特别感兴趣的。
[0356]
本发明的配制品可通过吸入来施用以提供对病毒感染的治疗或预防。在实施例中,病毒感染由呼吸病毒引起或与其相关。因此,病毒感染可以是呼吸道感染。病毒感染可以是上呼吸道感染。病毒感染可以是下呼吸道感染,例如影响肺的病毒感染。
[0357]
在一些实施例中,病毒感染由选自以下的病毒引起或与其相关:呼吸道合胞病毒、流感病毒、副流感病毒、人偏肺病毒、冠状病毒(例如严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov))、埃博拉病毒(ebov)、黄病毒、人鼻病毒(hrv)、人腺病毒(hadv)和eb病毒(ebv)。
[0358]
在一些实施例中,病毒感染是呼吸道感染(rti)。呼吸道感染(rti)是涉及呼吸道的感染性疾病。这种类型的感染通常进一步分类为上呼吸道感染(uri或urti)或下呼吸道感染(lri或lrti)。rti可以是上或下rti。下呼吸道感染诸如肺炎往往是比上呼吸道感染诸如普通感冒严重得多的病症。上呼吸道通常被认为是声门或声带上方的气道,有时被认为是环状软骨上方的气道。这部分呼吸道包括鼻、鼻窦、咽和喉。uri的症状可以包括咳嗽、喉咙痛、流涕、鼻塞、头痛、低烧、面部压力和打喷嚏。下呼吸道由气管(风管)、支气管、细支气
管和肺组成。下呼吸道感染通常比上呼吸道感染更严重。lri是所有感染性疾病中发生死亡的主要原因。两种最常见的lri是支气管炎和肺炎。
[0359]
病毒可以是rna病毒或dna病毒。在某些实施例中,病毒感染由rna病毒引起或与其相关。在某些实施例中,病毒感染由dna病毒引起或与其相关。在某些实施例中,病毒感染由正义链rna病毒引起或与其相关。
[0360]
在某些实施例中,病毒感染由选自以下的病毒引起或与其相关:呼吸道合胞病毒、流感病毒、副流感病毒、肺炎病毒(例如人偏肺病毒)、冠状病毒(例如严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov))、人鼻病毒(hrv)、人腺病毒(hadv)。
[0361]
在一些实施例中,病毒是引起rti或与其相关的rna病毒。
[0362]
在一些实施例中,病毒感染可以引起急性呼吸综合征(例如严重急性呼吸综合征(sars))或可与其相关。已知引起严重急性呼吸综合征(sars)的病毒包括冠状病毒诸如sars病毒或mers病毒,例如sars-cov、sars-cov-2或mers-cov。在一个实施例中,病毒感染引起sars。
[0363]
肺病毒科的病毒是负义单链rna病毒。肺病毒科中的两个属是偏肺病毒和正肺病毒。偏肺病毒的具体种类是禽偏肺病毒(ampv)和人偏肺病毒(hmpv)。正肺病毒的具体种类是牛呼吸道合胞病毒(brsv)、人呼吸道合胞病毒(hrsv)和鼠肺炎病毒(mpv)。肺病毒科中的病毒通常通过呼吸道分泌物传播,并且通常与呼吸道感染相关。在某些实施例中,病毒感染由人呼吸道合胞病毒(hrsv)引起或与其相关。因此,病毒感染可由选自以下的病毒引起或与其相关:hrsv-a2、hrsv-b1和hrsv-s2。
[0364]
冠状病毒科病毒是一类有包膜的正链单链球形rna病毒。冠状病毒科包括两个亚科即冠状病毒和环曲病毒。冠状病毒属具有螺旋状核衣壳,而环曲病毒属具有管状核衣壳。冠状病毒亚科中有以下属:α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状病毒。环曲病毒亚科中的属是鳊鱼病毒和环曲病毒。在某些实施例中,病毒感染由冠状病毒引起或与其相关。因此,病毒感染可由选自以下的病毒引起或与其相关:α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状病毒。在一个优选的实施例中,病毒感染由β冠状病毒引起与其相关。
[0365]
人冠状病毒通常引起持续很短时间的轻度至中度上呼吸道疾病,如普通感冒(但是一些冠状病毒可能是致命的)。症状可包括流涕、咳嗽、喉咙痛和发热。这些病毒有时可能引起下呼吸道疾病,诸如肺炎。这在患有心肺疾病或免疫系统受损的人或老年人中更为常见。
[0366]
在一些实施例中,病毒感染是普通感冒。普通感冒可由选自以下的病毒引起或与其相关:呼吸道合胞病毒(rsv)、副流感病毒、肺炎病毒(例如人偏肺病毒)、冠状病毒、鼻病毒(例如人鼻病毒,hrv)、腺病毒(例如人腺病毒,hadv)和肠道病毒。
[0367]
中东呼吸综合征冠状病毒(mers-cov)是β冠状病毒属的一个成员,并且引起中东呼吸综合征(mers)。mers是一种急性呼吸道疾病。大约一半确认感染mers的人死亡。目前没有针对mers的治疗或疫苗。
[0368]
β冠状病毒属的另一个成员是sars冠状病毒(sars-cov)。sars-co-v是引起严重急性呼吸综合征(sars)的病毒。sars于2003年2月在亚洲首次报道。sars是空气传播病毒,并且可以通过吸入被感染的个体释放到空气中的小水滴(例如,通过咳嗽和/或打喷嚏)、接触
被污染的表面和/或通过与被感染个体密切接触而传播。
[0369]
在某些实施例中,病毒感染由严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒2(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov)、hcov-229e、hcov-nl63、hcov-oc43和hku1引起或与其相关。
[0370]
在某些实施例中,病毒感染由引起严重急性呼吸综合征(sars)的冠状病毒(诸如sars病毒或mers病毒,例如sars-cov、sars-cov-2或mers-cov)引起或与其相关。优选地,病毒感染由sars-cov-2引起或与其相关。
[0371]
致病性呼吸道病毒感染可能引起与病毒感染相关的疾病和症状。在某些实施例中,可吸入药物组合物用于预防或治疗与呼吸道病毒感染相关的疾病或病症。因此,吸入组合物可用于治疗或预防由呼吸道病毒感染引起或与其相关的呼吸综合征。例如治疗或预防严重急性呼吸综合征(sars)。因此,本发明的吸入组合物可用于预防或治疗由sars-cov、sars-cov-2或mers-cov引起的严重急性呼吸综合征,优选地用于治疗或预防由sars-cov-2引起的严重急性呼吸综合征。在某些实施例中,本发明的吸入组合物用于治疗选自以下的呼吸综合征:肺炎、流感和哮吼。因此,吸入组合物可用于治疗或预防由呼吸道病毒感染引起的肺炎。
[0372]
在一个优选的实施例中,配制品用于治疗covid-19。
[0373]
covid-19可以通过本领域技术人员已知的任何方法来诊断。可以获得来自受试者的样品(例如痰液、粘液、血清、鼻抽吸物、咽拭子、支气管肺泡灌洗液或其他类型的体液)并测试sars-cov-2的存在。用于诊断sars-cov-2感染的示例性方法包括但不限于检测sars-cov-2病毒的核苷酸序列(例如使用pcr)、检测sars-cov-2相关冠状病毒抗原以及与sars-cov-2相关冠状病毒抗原免疫特异性结合的抗体或其片段。
[0374]
wu等人描述了sars-cov-2病毒的核苷酸序列的实例(nature[自然]579,265-269(2020)(genbank登记号mn908947.3,分离株wuhan-hu-1)。受试者可感染具有与mn908947.3至少90%、至少93%、至少95%、至少96%、至少97%、至少98%、至少99%、至少99.5%、至少99.6%、至少99.7%、至少99.8%、至少99.9%、至少99.91%、至少99.92%、至少99.93%、至少99.94%、至少99.93%、至少99.95%、至少99.96%、至少99.97%、至少99.98%或至少99.99%相同的基因组序列的sars-cov-2病毒。本发明包括治疗或预防sars-cov-2的任何变体。尽管已经提出了许多命名法,但目前没有针对sars-cov-2菌株的单一一致命名法。在一些实施例中,sars-cov-2变体属于进化枝s、o、l、v、g、gh、gr或gv中的一种(如gisaid“global phylogeny[全球系统发育],由nextstrain更新”所定义)。在一些实施例中,sars-cov-2变体属于进化枝19a、19b、20a、20b、20c、20d、20e、20f、20g、20h或20i中的一种(clades.nextstrain.org,2021年1月19日在wayback machine[网站时光机]中存档)。在一些实施例中,sars-cov-2变体属于谱系a、b、b.1、b1.1、b1.177或b.1.1.7中的一种(如rambaut等人,nature microbiology[自然微生物学]第5卷,第1403-1407页(2020)提出的)。在一些实施例中,sars-cov-2变体选自由以下组成的组:501.v2变体(也称为501.v2、20h/501y.v2(以前称为20c/501y.v2);voc-202012/02(phe);谱系细胞b.1.351或“南非变体”);簇5(丹麦国家血清研究所(ssi)也将其称为δfvi-spike,据信是从貂中传播的);谱系b.1.1.207;谱系b.1.1.7或“受关注的变体202012/01”或“uk变体”(参见chand等人,“investigation of novel sars-cov-2variant,variant of concern202012/01[调查新
的sars-cov-2变体,受关注的变体202012/01],public health england[英国公共卫生部]);谱系b.1.429/cal.20c;谱系b.1.525(英国公共卫生部(phe)也将其称为vui-202102/03,以前称为uk1188);谱系p.1(英国公共卫生部也将其称为受关注的变体202101/02,并且nextstrain也将其称为20j/501y.v3);谱系b.1.1.317;谱系b.1.1.318和谱系p.3。在一些实施例中,sars-cov-2变体是携带以下突变中的一个或多个的变体:d614g;e484k;n501y;s477g/n;p681h。
[0375]
患有病毒感染的受试者可能出现与病毒感染相关的严重病症。使用本发明的吸入组合物治疗患有呼吸道病毒感染的受试者可预防或治疗选自以下的病症:与呼吸道病毒感染相关的脓毒症、肺炎或器官衰竭。在一些实施例中,吸入组合物用于治疗或预防由呼吸道病毒感染引起或与其相关的脓毒症。在一些实施例中,吸入组合物用于治疗或预防由呼吸道病毒感染引起或与其相关的肺炎。肺炎可以是病毒性肺炎或细菌性肺炎(例如,由受试者的肺中的继发性细菌感染引起或与其相关的细菌性肺炎)。因此,本发明的吸入组合物可用于治疗或预防病毒性肺炎。
[0376]
在某些实施例中,病毒感染由流感病毒引起或与其相关。流感病毒可以是a型、b型、c型或d型。a型和b型病毒在人类中引起季节性流行病,而a型病毒已经引起几种流行病。c型病毒通常引起轻度疾病,并且通常与流行病不相关。d型病毒主要影响牛。可以基于表面蛋白血凝素(h)和神经氨酸酶(n)将a型病毒分为亚型。有18种不同的血凝素蛋白(命名为h1至h18)和11种不同的神经氨酸酶蛋白(命名为n1至n11)。这给出了198种潜在的a型流感组合,但迄今为止仅检测到131种亚型。病毒感染可由选自h1n1、h1n2、h2n2、h3n2、h5n1、h7n7、h9n2、h7n2、h7n3、h10n7、h7n9和h6n1的a型流感病毒引起或与其相关。b型病毒不分类为亚型,但可以分类为谱系。b型病毒可属于b/yamagata或b/victoria谱系。
[0377]
在某些实施例中,本发明的配制品用于治疗或预防由呼吸道病毒感染引起或与其相关的细菌性肺炎(即治疗继发于病毒感染的细菌性肺炎)。因此,本发明的吸入组合物可用于治疗或预防肺炎链球菌(streptococcus pneumoniae)。在一个特定的实施例中,本发明的吸入组合物用于治疗或预防葡萄球菌(staphylococcal)肺炎。
[0378]
卤化水杨酰苯胺诸如氯硝柳胺的抗菌作用可提供特别有效的治疗继发性感染诸如细菌性肺炎。本发明的配制品具有抗病毒和抗菌作用,因此可以用于治疗肺中的病毒和细菌病原体。因此,还提供了本发明的配制品用作抗菌剂以靶向继发于呼吸道病毒感染的细菌感染(例如革兰氏阳性细菌)。因此,本发明的配制品可用于治疗患有呼吸道病毒感染的受试者的继发性细菌感染,其中继发性细菌感染由革兰氏阳性细菌、优选选自以下中的一种或多种的细菌引起或与其相关:金黄色葡萄球菌(例如mrsa)、肺炎链球菌、流感嗜血杆菌和卡他莫拉菌。
[0379]
某些实施例提供了本发明的配制品用作抗细菌剂以靶向可以引起或导致肺炎的一种或多种细菌。在这些实施例中,所靶向的细菌可以是革兰氏阳性细菌,例如金黄色葡萄球菌(例如mrsa)、肺炎链球菌、流感嗜血杆菌和卡他莫拉菌中的一种或多种。因此,吸入组合物根除或减少可以引起或导致肺炎的细菌。
[0380]
在某些实施例中,本发明的配制品用于治疗或预防选自发热(例如38℃以上的发热)、咳嗽、喉咙痛、呼吸短促、呼吸窘迫和肺炎的病毒感染(例如sars-cov-2)的症状。合适地,吸入组合物用于治疗严重急性呼吸综合征(sars)。
[0381]
在某些实施例中,本发明的配制品可用于减少由呼吸道病毒感染引起或与其相关的粘液产生和/或分泌。
[0382]
在某些实施例中,本发明的配制品可用于减少由呼吸道病毒感染引起或与其相关的支气管收缩。
[0383]
患有病毒感染、特别是呼吸道病毒感染的受试者容易出现肺部真菌感染。已知氯硝柳胺具有抗真菌特性(garcia等人,sci rep.[科学报告]2018;8(1):11559,发布于2018年8月1日,doi:10.1038/s41598-018-29973-8)。因此,本发明的配制品可提供对与病毒感染相关的机会性肺部真菌感染的有效治疗。在某些实施例中,提供了用于治疗由病毒感染(例如呼吸道病毒感染)引起或与其相关的肺部真菌感染的本发明的配制品。真菌感染可以是机会性肺部真菌感染。在某些实施例中,肺部真菌感染是念珠菌属(candida spp.)感染,例如白色念珠菌(candida albicans)。在某些实施例中,本发明的配制品用于治疗或预防肺念珠菌病。特别地,本发明的配制品用于治疗或预防患有病毒感染、优选呼吸道病毒感染的受试者的肺念珠菌病。
[0384]
卤化水杨酰苯胺诸如氯硝柳胺具有抗炎特性。因此,本发明的配制品可有益于减轻、改善或治疗与呼吸道病毒感染相关的肺部炎症,因为卤化水杨酰苯胺诸如氯硝柳胺具有抗病毒和抗炎特性。
[0385]
在某些实施例中,提供了用于治疗或预防由呼吸道病毒感染引起或与其相关的肺部炎症的本发明的配制品。例如,吸入组合物可减少或消除呼吸道中的组织的炎症。
[0386]
在某些实施例中,配制品用于预防或抑制由病毒感染引起或与其相关的促炎细胞因子。因此,吸入的药物组合物可降低crp、白细胞、il1b、il-6、il-10、il-2、ifnγ、ip10、mcp1、gcsf、ip10、mcp1、mip1a和/或tnfα中的一种或多种,特别是降低血清crp。在一些实施例中,配制品降低患有呼吸道病毒感染的受试者的il-6水平。
[0387]
病毒感染(包括但不限于sars cov-2)可以诱导细胞因子释放综合征(crs)(也称为细胞因子风暴综合征(css))。crs是由病毒感染触发的全身炎性反应,并且导致大量促炎细胞因子突然释放,这会损害器官,特别是可能导致呼吸衰竭。最近的出版物表明在一些患有严重形式的covid-19的患者中观察到细胞因子风暴(zhang等人,international journal of antimicrobial agents[国际抗微生物剂杂志]https://doi.org/10.1016/j.ijantimicag.2020.105954,2020年3月29日可在线获得)。在一些实施例中,提供了用于预防、抑制或治疗患有呼吸道病毒感染的受试者(例如感染sars-cov2、sars或mers的受试者)的细胞因子释放综合征的本发明的配制品。
[0388]
在某些实施例中,配制品例如通过防止或抑制病毒复制而对病毒具有抗病毒作用。不希望受理论束缚,据信配制品可以通过抑制或预防至少患者呼吸道中的病毒复制而充当抗病毒剂。因此,在一些实施例中,本发明的配制品用于预防或抑制患有病毒感染(例如呼吸道病毒感染)的受试者的病毒复制。在一些实施例中,配制品可减少或消除受试者的病毒载量。
[0389]
应当理解,使用本发明的配制品联合治疗多种病症提供了优于使用多种疗法的显著优点。
[0390]
在本发明的一些实施例中,气雾剂或溶液用作抗病毒剂和抗炎剂和/或抗菌剂。因此,在一些实施例中,气雾剂或溶液用作至少双重疗法或三重疗法。因此,在一些实施例中,
气雾剂或溶液可以用于靶向病毒感染和炎症和/或细菌感染以治疗例如冠状病毒感染诸如sars中的rti。在一些实施例中,气雾剂或溶液用作抗病毒剂、抗炎剂和抗菌剂以治疗例如冠状病毒感染诸如sars中的rti。
[0391]
在本发明的一些实施例中,配制品作为抗病毒剂用于治疗病毒感染(例如预防病毒复制)并且进一步提供以下另外的治疗效果中的一种或多种:
[0392]
抗菌;
[0393]
抗炎;
[0394]
减少或预防支气管收缩/引起支气管扩张;以及/或者
[0395]
减少粘液产生和/或分泌。
[0396]
感染呼吸道病毒感染的受试者在病毒感染的早期阶段可能是无症状的。对无症状受试者的治疗可预防病毒感染变成有症状的和/或发展为与呼吸道病毒感染相关的疾病或医学病症。因此,还提供了用于治疗感染病毒的无症状受试者的本发明的配制品。在一些实施例中,病毒是呼吸道病毒(例如sars病毒,诸如sars-cov-2)。
[0397]
卤化水杨酰苯胺诸如氯硝柳胺可提供特别有效的抗病毒感染诸如sars-cov-2的治疗。有证据表明,氯硝柳胺具有广谱抗病毒特性,包括抗sars-cov-2(xu等人,j acs infect dis[acs传染病杂志]2020;wu等人,antimicrob agents chemother[抗微生物剂化疗]2004:48:2693-6)。有人提出,氯硝柳胺的作用方式可包括抑制自噬作用、病毒复制和受体介导的sars-cov2内吞作用(pindiprolu等人,medical hypotheses[医学假说]140(2020)109765)。
[0398]
一些病毒感染在感染病毒的受试者出现症状之前就具有传染性,例如sars-cov-2就是这种情况。这可导致病毒在群体中的传播率高,因为被感染的宿主不知道他们具有传染性,并且会无意中通过社会接触等传播病毒。在群体中包含初始感染后,无症状受试者传播病毒可能特别危险,因为无症状但具有传染性的受试者可能会引发感染复发和“第二波”病毒感染。使用本发明的配制品来治疗患有病毒感染的无症状受试者可通过例如减少或消除受试者的病毒和/或加速受试者的血清转化(即受试者的免疫系统产生针对病毒的抗体)来减少受试者具有传染性的时间。使用本发明的配制品进行治疗可减少病毒从受试者脱落,从而使受试者的传染性降低。病毒脱落是指以例如由咳嗽或打喷嚏产生的粘液液滴形式离开受试者身体或存在于其他排泄物中的病毒的数量。
[0399]
因此,在一些实施例中,提供了用于治疗无症状受试者的病毒感染的本发明的配制品,其中该治疗减少或消除受试者的病毒载量。在一些实施例中,提供了用于治疗无症状受试者的病毒感染的本发明的配制品,其中该治疗加速受试者的血清转化。在一些实施例中,提供了用于治疗无症状受试者的病毒感染的本发明的配制品,其中该治疗减少病毒的受试者间传播。在一些实施例中,提供了用于治疗无症状受试者的病毒感染的本发明的配制品,其中该治疗减少病毒脱落。病毒感染可以是sars-cov-2。
[0400]
在一些实施例中,提供了用于治疗无症状或轻度症状受试者的sars-cov2的本发明的配制品。受试者的sars-cov-2检测结果可能呈阳性(例如经由pcr测试)。治疗可在检测结果呈阳性后0-5天内或1-3天内开始(第0天是受试者接受检测结果的那天)。在一些实施例中,受试者未服用或最近未服用(例如在前30或60天内)免疫抑制药物。受试者可能不出于较高sars-cov-2风险。向无症状受试者或轻度症状受试者施用配制品可预防或降低受试
者发生轻度、中度或重度covid-19的症状、特别是中度至重度covid-19的症状的风险。对无症状或轻度症状受试者的治疗也可减少受试者家庭中感染sars-cov-2的人数。在一些实施例中,向无症状或轻度症状受试者施用配制品可减少从基线到第10天的时间加权变化(减少)。换句话说,配制品可降低疾病进展的风险或预防疾病进展。在无症状受试者中,“基线”是指受试者没有症状。
[0401]
可使用已知的测试方法(例如检测唾液样品中病毒的存在的测试,诸如实时逆转录聚合酶链式反应(rrt-pcr)或pcr方法)来检测无症状受试者的病毒感染。在一些实施例中,提供了用于治疗或预防已经接受病毒感染诸如covid-19(sars-cov-2)的阳性诊断的受试者的本发明的配制品。受试者可能患有轻度、中度或重度covid-19,或者他们可能是无症状的。还设想了对没有接受sars-cov-2感染存在的阳性测试或没有进行测试的受试者的预防性治疗。
[0402]
covid-19的症状是非特异性的,并且该疾病表现可以从没有症状(无症状)到严重肺炎和死亡。covid-19的临床进展显示出双阶段模式。第一阶段以发热、咳嗽、疲劳和其他全身症状如头晕和头痛、呼吸短促、鼻溢、喉咙痛、腹泻和食欲不振为特征。在大多数患者中观察到发热,估计中位持续时间为10天(症状发作后95置信区间)(chen等人.clinical progression of patients with covid-19in shanghai,china.[中国上海covid-19患者的临床进展]j infect[感染杂志].2020;80(5):e1-e6.)。
[0403]
随着疾病进展到第二阶段,大多数患者的症状开始缓解,并且放射学改善并行发生。随着体温降低,患者的上呼吸道样品也变为pcr阴性(病毒清除的平均时间为约11天)。然而,有一小部分患者(约5%)出现呼吸衰竭、感染性休克和多器官功能障碍,从而导致病死率更高。持续发热、肺损伤和疾病进展可以部分地由不受控制的病毒复制来解释。covid-19的持续存在也可能诱导与细胞因子风暴相关的过度但异常的非有效反应。
[0404]
如本文所用的患有“轻度”covid-19的患者是在下述改良who量表上评分为2、3或4的受试者。受试者可走动或住院。他们表现出covid-19症状可以包括发热、咳嗽、喉咙痛、不适、头痛、呼吸短促、肌肉疼痛、味觉和/或嗅觉丧失、眼部症状(例如结膜充血、结膜水肿、泪溢或分泌物增加中的一种或多种)和/或不同强度的胃肠道症状(例如腹泻),并且他们可能没有病毒性肺炎体征或有轻微的病毒性肺炎体征。他们可表现出日常活动受限。他们不需要氧治疗。
[0405]
如本文所用的患有“中度”covid-19的患者是在下述改良who量表上评分为5的受试者。受试者因covid-19住院,需要通过面罩或鼻塞吸氧进行治疗。他们表现出的症状可以包括发热、咳嗽、喉咙痛、不适、头痛、肌肉疼痛和/或不同强度的胃肠道症状。他们患有中度肺炎。
[0406]
如本文所用的患有“重度”covid-19的患者是在下述改良who量表上评分为6、7或8的受试者。这些受试者需要重症监护和/或机械通气或体外膜氧合。此类患者可能表现出血氧不足、肺外过度炎症、严重肺炎、血管麻痹、呼吸衰竭、心肺溃堤和/或全身器官受累。全身炎症的标志物(例如il-2、il-6、il-7、粒细胞集落刺激因子、巨噬细胞炎性蛋白1-α、肿瘤坏死因子-α、c-反应蛋白、铁蛋白和/或d-二聚体)可能升高。
[0407]
在本文所述的任何实施例中,受试者可住院。
[0408]
通过在病毒复制高但尚未导致严重组织损伤的阶段靶向患者,该治疗可减少症状
的持续时间、使传染性最小化并且防止严重程度和不良结局的进展。因此,在一些实施例中,提供了用于治疗患有轻度或中度covid-19的受试者的病毒感染的本发明的配制品。在一些实施例中,患有轻度或中度covid-19的受试者住院。在一些实施例中,受试者患有中度covid-19并住院。在一些实施例中,受试者患有轻度covid-19,并且鼻内施用配制品。在一些实施例中,受试者患有轻度covid-19,并且鼻内和经眼部施用(例如作为滴部眼剂)配制品。在一些实施例中,受试者患有中度covid-19,并且鼻内施用配制品。在一些实施例中,受试者患有中度covid-19,并且通过吸入口内施用配制品。在一些实施例中,受试者患有中度covid-19,并且通过吸入鼻内和口内施用配制品。在一些实施例中,受试者患有中度covid-19,并且通过吸入鼻内、口内和经眼部(例如作为滴部眼剂)施用配制品。在一些实施例中,受试者患有轻度或中度covid-19并住院,其中通过吸入鼻内和口内施用配制品。配制品的施用可用于预防疾病例如从轻度进展到中度或从中度进展到重度covid-19或者降低其可能性。在一些实施例中,将受试者识别为处于疾病进展的风险中。例如,可将受试者识别为处于covid-19从轻度进展到中度或从中度进展到重度的风险中。在一些实施例中,可将受试者识别为处于受试者在改良who量表上的评分增加的风险中,如下所述。熟练的医生或护士将能够识别处于风险中的受试者。例如,可基于一种或多种因素来识别处于疾病进展的风险中的受试者,这些因素可包括临床参数(诸如受试者的呼吸状态、血氧饱和度、温度、流感样症状的严重程度、胸部x射线或其他扫描、炎性生物标志物水平、病毒载量和潜在病症的存在)和任选的非临床参数(诸如受试者的年龄和性别)。
[0409]
治疗可减少或消除受试者的病毒载量(例如痰液或血液中的病毒载量),例如,治疗可减少鼻腔中的病毒载量。治疗可减少受试者的肺中的病毒载量。在一些实施例中,相对于未用本发明的配制品治疗的患者,治疗减少了治愈疾病所花的时间。治疗可避免患有轻度covid-19的患者需要住院治疗,或减少患有中度covid-19的患者的住院时间。治疗可防止疾病进展。例如,治疗可防止covid-19从轻度进展到中度或从中度进展到重度。治疗可防止受试者在改良who量表上的评分增加,如下所述。治疗可减少或消除对氧疗的需要。治疗可增加血氧水平。治疗可预防呼吸衰竭或降低其风险。治疗可减少从受试者清除病毒的时间。治疗可减少或消除病毒定植。例如,治疗可减少或消除鼻腔中的病毒定植。治疗可减少或消除肺中的病毒定植。
[0410]
在一些实施例中,提供了用于治疗患有中度covid-19的受试者的病毒感染的本发明的配制品。
[0411]
相对于未用本发明的配制品治疗的患者,治疗可减少患者在重症监护中所花的时间。在一些实施例中,治疗改善了共同施用的药物诸如抗炎剂的功效。治疗可减轻症状的严重程度、减少恢复时间和/或疾病的长期影响。
[0412]
在一些实施例中,提供了用于治疗病毒感染(例如covid-19)的本发明的配制品,其中所述治疗包括以下中的一种或多种:减轻流感样体征和症状(例如体温)的严重程度;改善受试者的呼吸状态(血氧饱和度),如通过血氧定量评估的;改善news2评分;改善改良who顺序量表、fda covid-19问卷(表14)和/或who 11分顺序量表(表15)上的评分,如本文所述;减轻或消除肺部炎症和/或水肿;改善呼吸功能;改善呼吸短促;减少病毒清除的时间;减少出院时间;减少病毒载量;降低炎性血清标志物(例如crp、原降钙素)。在一些实施例中,治疗使得受试者在改良who顺序量表上的评分具有1至6级、2至5级或3至4级的改善。
在一些实施例中,治疗使得受试者的news2评分具有1至6分、2至5分或3至4分的改善。
[0413]
还提供了预防性治疗,其中将本发明的配制品施用于受试者以预防感染病毒或降低其风险。在某些实施例中,提供了用于降低受试者感染病毒的风险或预防受试者感染病毒的本发明的配制品。此类预防性治疗可特别有益于可能暴露于高水平病毒的受试者,例如:医生、护士、社会工作者和正在照顾病毒感染者或可能更有可能与病毒感染者接触的其他医疗保健工作者;以及例如大量暴露于一般群体的工作者,诸如教师、幼儿园工作人员、运输工作者和营业员。
[0414]
在一些实施例中,预防性地施用本发明的配制品。在一些实施例中,将配制品预防性地施用于已经或怀疑已经与被诊断为感染sars-cov-2的人的密切接触的受试者。例如,被识别为已经处于暴露于病毒的风险中的被感染个体的家人、同事和/或其他密切接触者可施用本发明的配制品作为预防性治疗。被感染个体的密切接触者可经由跟踪和追踪程序(诸如政府运营的程序)来识别。在怀疑暴露于被感染人之后对受试者的预防性治疗可有益于防止病毒的进一步传播。在一些实施例中,受试者在暴露于或怀疑暴露于被感染个体后不超过7天、不超过6天、不超过5天、不超过4天、不超过3天、不超过2天或不超过24小时开始预防性治疗。密切接触者可以是被识别为已经与被感染个体密切接触的受试者,并且包括例如与被感染个体共用家、办公室、学校或交通工具的受试者、已经与被感染个体一起参加运动或其他社交活动的受试者以及可能在公共空间(诸如餐厅、酒吧、咖啡馆、交通枢纽、图书馆、医院或其他医疗设施或商店)与被感染个体密切接触的受试者。优选地,预防性治疗可鼻内施用。预防性治疗可施用于一般公众,例如在流行病的情况下。
[0415]
本文所述的治疗和预防性治疗还可特别有益于处于较高covid-19风险的受试者。这些受试者包括:患有现有疾病或病症的受试者,诸如糖尿病(i型或ii型糖尿病,特别是控制不良的糖尿病)、癌症、心脏病(诸如心力衰竭、冠状动脉疾病和心肌病)、高血压(特别是控制不良的高血压)、脑血管疾病、血管炎、scid、镰状细胞病(包括镰状细胞贫血)、地中海贫血、肺纤维化、间质性肺病、慢性肺病(诸如copd、哮喘(特别是中度至重度哮喘)和囊性纤维化)、肺气肿、支气管炎、肾病(包括慢性肾病、糖尿病性肾病、膜性肾病和肾小球疾病,诸如肾小球性肾炎、微小病变性肾病、局灶性节段性肾小球硬化、iga肾病、原发性膜性肾病、膜性增生性肾小球性肾炎和狼疮性肾炎)、慢性肝病、肝炎、基因免疫性疾病、自身免疫性疾病(包括系统性红斑狼疮(sle)、抗gbm、类风湿性关节炎、银屑病性关节炎、结缔组织疾病、脊柱关节炎、风湿性多肌痛)、炎性肠病(包括克罗恩病和溃疡性结肠炎、乳糜泻、再生障碍性贫血、艾迪生氏病、格雷夫斯氏病、桥本甲状腺炎、重症肌无力、自身免疫性血管炎、恶性贫血和舍格伦氏综合征)、影响脑或神经的病症(诸如帕金森病、运动神经元病、多发性硬化、痴呆、精神疾病或大脑性麻痹;以及患有中风、肌肉萎缩病症或严重或深度学习障碍的受试者。处于高或中covid-19风险的受试者还包括例如由于疾病、病症或治疗而具有减弱的免疫系统的受试者。这些受试者包括:接受过身体组织移植诸如器官移植的受试者(包括肾脏、肝脏、肺和/或心脏移植接受者);切除了器官(例如他们的脾脏)的受试者;正在接受(或接受过)化学疗法、免疫疗法、抗体疗法或放射疗法的受试者;正在接受(或接受过)癌症治疗的受试者;正在接受(或接受过)蛋白激酶抑制剂或parp抑制剂的受试者;接受过血液、骨髓或干细胞移植(例如在最近6-12个月内)的受试者;免疫功能受损的受试者,包括服用免疫抑制剂(例如环孢菌素、他克莫司、硫唑嘌呤、吗替麦考酚酯或麦考酚酸、贝拉西普、甲
氨蝶呤、托珠单抗、阿巴西普、来氟米特、泼尼松龙、抗tnf(例如英夫利昔单抗、阿达木单抗、依那西普)、环磷酰胺、利妥昔单抗或阿仑单抗)或类固醇)的受试者;患有hiv或aids的受试者;进行透析(包括血液透析和腹膜透析)的受试者;非常肥胖(bmi为至少30、至少40或更高)的受试者;以及怀孕的受试者。还包括吸烟的受试者;疗养院居住者;在疗养院为年龄50、60、65、70、75或80岁以上的成人工作的工作人员;一线医疗保健和/或社会护理工作者;黑人和少数民族(bame)群体;以及年龄超过50、60或70岁的受试者,特别是年龄超过75、80、85或90岁的受试者。
[0416]
因此,在一些实施例中,提供了用于降低受试者感染病毒(例如covid-19)的风险或预防受试者感染病毒的本发明的配制品,其中受试者处于较高covid-19风险,例如其中受试者选自以上定义的组。在一些实施例中,提供了用于预防处于较高covid-19风险的未感染受试者(诸如选自以上定义的组的受试者)的配制品。预防可用于降低受试者发生有症状或无症状covid-19感染的风险。预防可用于降低死亡的风险和/或减轻症状的严重程度(如果受试者感染covid-19)。预防可用于降低受试者感染中度或重度covid-19的风险。
[0417]
在一些实施例中,预防降低了受试者发生继发性感染(例如继发性细菌感染)的风险,其中受试者处于较高covid-19风险,例如其中受试者选自以上定义的组。预防可降低继发性感染的死亡风险或减轻继发性感染的严重程度。
[0418]
因此,本发明的配制品特别适合于预防性治疗较高风险组,即处于较高感染诸如covid-19风险的受试者。“处于较高covid-19风险的受试者”也称为“较高风险受试者”或“较高风险患者”,包括具有减弱的免疫系统(即他们的免疫功能受损)(这降低了身体对抗感染和其他疾病的能力)的受试者。它还降低了受试者从感染中恢复的能力。较高风险受试者可能具有较高感染covid-19的风险和/或较高患上更严重和/或更长持续时间感染的风险。较高风险受试者也可能更易遭受不同类型的感染,例如继发性感染。
[0419]
在一些人中,covid-19可能会在感染已经消失后引起持续数周或数月的症状。这被称为“长covid”或“covid-19后综合征”。患有长covid的受试者可能在感染已经消失后经历症状至少4、6、8、10、12、16、20或24周或者至少3、4、6、8、10、12个月。受试者可能经历症状至少8周或至少12周。长covid的症状可包括以下中的一种或多种:极端疲惫(疲劳);呼吸短促;胸痛或胸闷;记忆力和/或注意力问题(“脑雾”);入睡困难(失眠);头晕;手和/或脚有刺痛感(“钉刺和针刺”);关节疼痛;抑郁;焦虑;耳鸣;耳朵痛;恶心;腹泻;胃痛;没有食欲;温度升高;心悸;胸痛;关节和/或肌肉疼痛;咳嗽;头痛;喉咙痛;味觉和/或嗅觉改变;皮疹;或者脱发。
[0420]
在一些实施例中,提供了用于治疗、预防或减少长covid发病率的本发明的配制品。用本发明的配制品治疗可减少长covid的持续时间和/或减少长covid的症状的数量和/或减轻其严重程度。
[0421]
在某些实施例中,提供了用于治疗受试者的病毒感染(例如covid-19)的本发明的配制品,其中受试者选自以上定义的组。在一些实施例中,配制品鼻内施用。
[0422]
在一些实施例中,所述治疗包括与另外的治疗剂或预防剂组合施用本发明的配制品。另外的治疗剂或预防剂可以是抗病毒剂(例如瑞德西韦)、抗炎剂(例如类固醇,诸如地塞米松)、免疫抑制剂、中和抗体或抗血栓剂。组合疗法可特别有益于患有严重病毒感染(例如严重covid-19)的受试者。
[0423]
细菌感染
[0424]
在一些实施例中,本文所述的配制品和方法用于治疗细菌感染,例如肺部细菌感染。细菌感染可以是原发性感染(即受试者患有的原发性或唯一疾病),或者细菌感染可以是与另一种(原发性)感染(例如病毒感染)或炎性疾病相关的继发性感染。
[0425]
在一些实施例中,本文所述的配制品和方法用于治疗或预防患有慢性肺部病症(诸如囊性纤维化(cf)、非囊性纤维化支气管扩张(非cfbe)、慢性阻塞性肺病(copd)或非结核分枝杆菌(ntm)肺部感染)的受试者的肺中的细菌感染。
[0426]
在一些实施例中,细菌感染由革兰氏阳性细菌引起,诸如:白喉棒状杆菌(corynebacterium diphtheriae)、溃疡棒状杆菌(corynebacterium ulcerans)、肺炎链球菌(streptococcus pneumoniae)、无乳链球菌(streptococcus agalactiae)、酿脓链球菌(streptococcus pyogenes)、米勒链球菌(streptococcus milleri);链球菌属(g组);链球菌属(c/f组);粪肠球菌(enterococcus faecalis)、屎肠球菌(enterococcus faecium)、金黄色葡萄球菌(staphylococcus aureus)、表皮葡萄球菌(staphylococcus epidermidis)、腐生葡萄球菌(staphylococcus saprophyticus)、中间葡萄球菌(staphylococcus intermedius)、猪葡萄球菌(staphylococcus hyicus)猪亚种、溶血葡萄球菌(staphylococcus haemolyticus)、人葡萄球菌(staphylococcus hominis)和解糖葡萄球菌(staphylococcus saccharolyticus)。在一些实施例中,细菌是革兰氏阳性厌氧细菌,非限制性实例包括艰难梭菌(clostridium difficile)、产气荚膜梭菌(clostridium perfringens)、破伤风梭菌(clostridium tetini)和肉毒梭菌(clostridium botulinum)。在一些实施例中,细菌感染由耐酸细菌引起,非限制性实例包括结核分枝杆菌(mycobacterium tuberculosis)、鸟分枝杆菌(mycobacterium avium)、胞内分枝杆菌(mycobacterium intracellulare)和麻风分枝杆菌(mycobacterium leprae)。在一些实施例中,细菌感染由非典型细菌引起,非限制性实例包括肺炎衣原体(chlamydia pneumoniae)和肺炎支原体(mycoplasma pneumoniae)。
[0427]
在一些实施例中,细菌感染由选自以下的细菌引起:金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌和化脓性链球菌。
[0428]
细菌性皮肤感染
[0429]
在一些实施例中,提供了用于治疗(优选地局部治疗)由革兰氏阳性细菌引起或与其相关的皮肤感染的本发明的配制品。
[0430]
在一些实施例中,本发明的配制品用于治疗脓疱疮、须疮、浅表性毛囊炎、甲沟炎、红癣、痤疮、继发感染的皮肤病、痈、疖、臁疮、蜂窝组织炎、丹毒、伤口的坏死性筋膜炎和继发性细菌性皮肤感染、皮炎、疥疮、糖尿病溃疡、酒渣鼻或银屑病。例如,本发明的组合物可用于局部治疗特应性皮炎损伤,其中所述损伤被革兰氏阳性细菌感染。
[0431]
在一些实施例中,本发明的配制品用于局部预防或治疗由革兰氏阳性细菌引起或与其相关的外耳感染。
[0432]
革兰氏阳性细菌可以是葡萄球菌属(staphylococcus spp.)、链球菌属(streptococcus spp.)或丙酸杆菌属(propionibacterium spp.)。革兰氏阳性细菌可以是葡萄球菌属或链球菌属。革兰氏阳性细菌可选自金黄色葡萄球菌或酿脓链球菌。革兰氏阳性细菌可以是丙酸杆菌属,例如痤疮丙酸杆菌(propionibacterium acnes)。革兰氏阳性细
菌可能不是丙酸杆菌,例如它不是痤疮丙酸杆菌。
[0433]
在一些实施例中,革兰氏阳性细菌群体包括球菌革兰氏阳性细菌。在一些实施例中,革兰氏阳性细菌来自链球菌属或葡萄球菌属。
[0434]
在一些实施例中,革兰氏阳性细菌来自链球菌属。革兰氏阳性细菌可以是选自肺炎链球菌、酿脓链球菌、猪链球菌(streptococcus suis)、无乳链球菌或草绿色链球菌(streptococcus viridans)的链球菌。
[0435]
在一些实施例中,革兰氏阳性细菌是酿脓链球菌。
[0436]
在一些实施例中,革兰氏阳性细菌来自葡萄球菌属。革兰氏阳性细菌可以是选自表皮葡萄球菌、金黄色葡萄球菌、腐生葡萄球菌或路邓葡萄球菌(staphylococcus lugdunensis)的葡萄球菌。在一些实施例中,球菌革兰氏阳性细菌是金黄色葡萄球菌(例如耐甲氧西林金黄色葡萄球菌)。
[0437]
革兰氏阳性细菌群体可包括耐抗生素革兰氏阳性细菌。革兰氏阳性细菌可以是耐抗生素菌株。例如,本文所述的革兰氏阳性细菌可耐受除卤化水杨酰苯胺以外的抗生素(例如,细菌耐受除氯氰碘柳胺、碘醚柳胺、五氯柳胺或氯硝柳胺或其药学上可接受的盐或溶剂化物以外的药物)。
[0438]
革兰氏阳性细菌可耐受选自以下的药物:夫西地酸、莫匹罗星、瑞他莫林、红霉素、克林霉素和四环素(例如四环素、米诺环素或多西环素)。
[0439]
革兰氏阳性细菌可耐受选自以下的药物:红霉素、克林霉素或四环素(例如四环素、米诺环素或多西环素)。
[0440]
革兰氏阳性细菌可耐受选自以下的药物:夫西地酸、莫匹罗星和瑞他莫林。
[0441]
细菌可耐受选自以下的药物:夫西地酸、莫匹罗星、瑞他莫林、红霉素和克林霉素。
[0442]
本发明的配制品可用于使携带革兰氏阳性细菌(包括本文所述的任何革兰氏阳性细菌,例如mrsa)的受试者脱定植。这种脱定植可有效预防或减少感染向其他受试者传播,尤其是在医院环境中。脱定植还可防止由于对患者或在医疗装置诸如导管或iv管线或套管的部位进行的外科或医疗手术而引起的手术部位感染或降低其风险。因此,本发明的配制品可用于在对受试者进行外科手术之前使受试者脱定植,其中将配制品局部应用于受试者。此类外科手术包括例如选择性外科手术,例如髋关节或膝关节置换术。在一个实施例中,本发明的组合物可用于在透析之前使受试者脱定植。透析前脱定植可预防与透析相关的感染(诸如血管线感染或导管相关血流感染(crbsi)感染)或降低其风险。可通过将包含卤化水杨酰苯胺的凝胶组合物局部施用于受试者身体上被革兰氏阳性细菌定植的部位来实现脱定植。已知细菌定植诸如mrsa的常见部位是鼻子。因此,可将本发明的配制品局部应用到鼻子。特别地,可将本发明的配制品应用到前鼻孔(鼻孔的内表面)。
[0443]
真菌感染
[0444]
在某些实施例中,本发明的配制品用于治疗肺部真菌感染。合适地,在该实施例中,本发明的配制品通过吸入来施用。
[0445]
在某些实施例中,本发明的配制品用于治疗肺部真菌皮肤感染。合适地,本发明的配制品局部应用。
[0446]
真菌肺和/或皮肤感染可由念珠菌属(candida sp.)、曲霉属(aspergillus sp.)和/或耶氏肺孢子菌(pneumocystis jirovecii)引起。在一些实施例中,本文所述的配制品
和方法用于治疗由白色念珠菌(candida albicans)、热带念珠菌(candida tropicalis)、克鲁斯念珠菌(candida krusei)、光滑念珠菌(candida glabrata)、烟曲霉菌(aspergillus fumigatus)、黄曲霉菌(aspergillus flavus)、黑曲霉菌(aspergillus niger)和/或耶氏肺孢子菌引起的真菌感染。
[0447]
眼部疾病
[0448]
本发明的配制品还可用于治疗眼部疾病和病症的一种或多种临床体征或症状,包括但不限于眼部感染和炎性眼疾(本文也称为“炎性眼部病症”)。
[0449]
在一些实施例中,眼部疾病或病症是炎性眼病,诸如干眼障碍(ded),其中一种或多种临床体征或症状与异常炎性反应相关。局部抗炎治疗可调节(诸如降低/下调)选自促炎介质和眼表上皮屏障分子的一种或多种免疫效应物的表达。炎性眼部病症可与角膜前泪膜和/或眼表上皮屏障的功能障碍相关。局部抗炎治疗可调节(诸如降低/下调)选自促炎介质和眼表上皮屏障分子的一种或多种免疫效应物在眼部和眼部相关组织(诸如附件、结膜和角膜)中和/或在角膜前泪膜中的表达。局部抗炎治疗可增加经历与炎性眼部疾病相关的角膜前泪膜功能障碍的患者的泪液产生。
[0450]
在实施例中,炎性眼病选自干眼障碍(ded)、眼部酒渣鼻、葡萄膜炎(例如鸟枪弹样视网膜脉络膜病变)、严重结膜炎、糖尿病视网膜病变、伴有泛葡萄膜炎的多灶性脉络膜炎、匍行性脉络膜病变、巩膜炎、与过敏相关的眼部炎症(诸如过敏性结膜炎)和与自身免疫障碍相关的眼部炎症(例如粘膜类天疱疮、与感染相关的眼部炎症、色素性视网膜炎、强直性脊柱炎、白塞氏(behcet's)综合征、皮肌炎、格雷夫斯氏(graves')病、幼年型类风湿性关节炎、多发性硬化、银屑病性关节炎、睑炎、莱特氏(reiter's)综合征、类风湿性关节炎、舍格伦氏(sjogren's)综合征、系统性红斑狼疮和韦格纳氏肉芽肿)。
[0451]
在实施例中,局部抗炎治疗降低了一种或多种促炎介质在眼部和眼部相关组织(例如角膜)中和/或在角膜前泪膜中的表达。
[0452]
在实施例中,局部抗炎治疗增加了一种或多种眼表上皮屏障分子在眼部和眼部相关组织(例如角膜)中的表达。
[0453]
在实施例中,一种或多种临床体征或症状与一种或多种促炎介质的水平异常(诸如升高)相关,并且局部抗炎治疗降低了所述一种或多种促炎介质在眼部和眼部相关组织(例如角膜)中和/或在角膜前泪膜中的异常水平。
[0454]
在实施例中,一种或多种临床体征或症状与一种或多种眼表上皮屏障分子的缺乏相关,并且局部抗炎治疗增加了一种或多种眼表上皮屏障分子在眼部和眼部相关组织(例如角膜)中的表达。
[0455]
在实施例中,炎性眼病是干眼病(ded)。
[0456]
在实施例中,一种或多种免疫效应物选自促炎症介质。
[0457]
在实施例中,促炎介质选自促炎细胞因子、促炎酶、抗菌蛋白和肽以及免疫细胞。
[0458]
在实施例中,促炎介质选自促炎细胞因子、促炎酶和免疫细胞。
[0459]
在实施例中,眼表上皮屏障分子选自结构性眼表上皮屏障蛋白(例如lor和flg)和眼表上皮屏障脂质。结构性眼表面上皮屏障蛋白诸如lor和flg由角膜上皮细胞表达(tong等人,invest ophthalmol vis sci[眼科学研究和视觉科学],47(5):1938-1946,2006)。
[0460]
在实施例中,异常炎性反应涉及th1、th2、th17和/或th22型炎性反应。
allergy and clinical immunology[过敏和临床免疫学的最新观点],12(5):523-533,2012)。
[0475]
在一些实施例中,眼部疾病是感染性疾病。感染性疾病可由病毒、细菌或真菌引起。在一些实施例中,感染性眼部疾病选自由以下组成的组:结膜炎(包括细菌、真菌和病毒性结膜炎)、角膜炎(包括病毒、细菌、真菌和阿米巴性角膜炎)、眼内炎、睑炎、睑腺炎、葡萄膜炎、蜂窝织炎(例如细菌蜂窝织炎)、眼部淋病和眼部疱疹。
[0476]
病毒性眼部感染包括但不限于由以下引起的感染:单纯性疱疹病毒(hsv),尤其是1型或2型hsv;人疱疹病毒6;腺病毒;传染性软疣病毒;水痘-带状疱疹病毒;eb病毒;巨细胞病毒;小核糖核酸病毒;乙型肝炎病毒;腮腺炎病毒;麻疹病毒;以及流感病毒;例如1型或2型hsv;最特别是1型hsv。
[0477]
细菌性眼部感染包括但不限于由以下引起的感染:奈瑟菌属(neisseria),诸如淋病奈瑟菌和脑膜炎奈瑟菌(n.meningitides);葡萄球菌属,包括金黄色葡萄球菌、表皮葡萄球菌和化脓性链球菌;链球菌属,包括肺炎链球菌;流感嗜血杆菌(haemophilus influenza);莫拉菌属(moraxella),包括腔隙莫拉菌(m.lacunata)、非液化莫拉菌(m.nonliquefaciens)、液化莫拉菌(m.liquefaciens)和卡他莫拉菌;沙眼衣原体(chlamydia trachomatis);肺炎球菌属(pneumococcus spp.);拟杆菌属(bacteroides spp.);消化链球菌属(peptostreptococcus spp.);痤疮丙酸杆菌;蜡样芽孢杆菌(bacillus cereus);铜绿假单胞菌(pseudomonas aeruginosa);梅毒密螺旋体(treponema pallidum);结核分枝杆菌;麻风分枝杆菌;以及伯氏疏螺旋体(borrelia burgdorferi)。在一些实施例中,眼部感染(例如细菌性结膜炎)由选自由以下组成的组的细菌引起:金黄色葡萄球菌(包括mrsa)、肺炎链球菌、流感嗜血杆菌、铜绿假单胞菌、卡他莫拉菌和淋病奈瑟菌。
[0478]
真菌性眼部感染包括但不限于由以下引起的感染:念珠菌属(candida spp.),包括白色念珠菌(c.albicans)、无名念珠菌(c.famata)、近平滑念珠菌(c.parapsilosis)、解脂念珠菌(c.lipolytica)、土生念珠菌(c.humicola)、高里念珠菌(c.guilliermondii)和光滑念珠菌(c.glabrata);曲霉属(aspergillus spp.),包括黄曲霉菌(a.flavus)、黑曲霉菌(a.niger)、烟曲霉菌(a.fumigatus)、土曲霉菌(a.terreus)、灰绿曲霉菌(a.glaucus)和构巢曲霉菌(a.nidulans);镰孢菌属(fusarium spp.),包括腐皮镰孢菌(f.solani)和串珠镰孢菌(f.moniliforme);隐球菌属(cryptococcus spp.),包括新型隐球菌(c.neoformans);肺囊虫属(pneumocystis spp.)包括卡氏肺囊虫(p.carinii);组织胞浆菌属(histoplasma spp.),包括荚膜组织胞浆菌(h.capsulatum);双极霉属(bipolaris spp.);接合菌属(zygomycetes spp.);粗球孢子菌(coccidioides immitis);皮炎芽生菌(blastomyces dermatitidis);可可球二孢菌(lasiodiplodia theobromae);链格孢属(alternaria spp.);申克孢子丝菌(sporothrix schenckii);淡紫拟青霉(paecilomyces lilacin us);毡状枝顶孢霉(acremonium kiliense);甄氏外瓶霉(exophiala jeanselmei);波氏假阿利什菌(pseudallescheria boydii);双间柱顶孢霉(scytalidium dimidiatum);长蠕孢霉属(helminthosporium spp.);产黄青霉(penicillium chrysogenum);犁头霉属(absidia spp.);根霉属(rhizopus spp.);弯孢属(curvularia spp.);瓶霉属(phialophora spp.);巴西副球孢子菌(paracoccidioides brasiliensis);
马拉色菌属(malassezia spp.),包括秕糠马拉色菌(m.furfur)和厚皮马拉色菌(m.pachydermatis);冠耳霉(conidiobolus coronatus);红酵母属(rhodotorula spp.);内脐蠕孢属(drechslera spp.);弯孢属(curvularia spp.);毛霉属(mucor spp.);以及犁头霉属(absidia spp.)。
[0479]
在一些实施例中,以眼用组合物的形式(诸如眼用乳膏、软膏、凝胶、糊剂、洗剂、泡沫、悬浮液或溶液)局部施用配制品。
[0480]
炎性疾病
[0481]
在某些实施例中,炎性疾病是肺部炎性疾病。肺部炎性疾病包括但不限于选自以下的肺部炎性疾病:哮喘、慢性阻塞性肺病(copd)、肺纤维化、肺炎、间质性肺病、结节病、闭塞性细支气管炎、局限性肺炎、急性呼吸窘迫综合征(ards)、支气管扩张、囊性纤维化、特发性肺纤维化、辐射诱导的纤维化、硅肺病、石棉诱导的肺或胸膜纤维化、急性肺损伤、寻常型间质性肺炎(uip)、慢性淋巴细胞性白血病(cll)相关的纤维化、哈曼-里奇综合征、卡普兰综合征、煤工尘肺、隐原性纤维化肺泡炎、闭塞性细支气管炎、慢性支气管炎、肺气肿、韦格纳氏肉芽肿病、肺硬皮病、硅肺病、石棉诱导的肺和/或胸膜纤维化。
[0482]
术语“肺纤维化”包括与纤维化相关的所有间质性肺病。在一些实施例中,肺纤维化包括术语“特发性肺纤维化”或“ipf”。在一些实施例中,作为非限制性实例,肺纤维化可由于吸入无机和有机粉尘、气体、烟雾和蒸汽、使用药物、暴露于放射或放射疗法以及出现诸如过敏性肺炎、煤工尘肺、化学疗法、移植排斥、硅肺病、棉屑沉着病和遗传因素等障碍造成。使用本文所述的配制品和方法来治疗或预防的示例性肺部炎性疾病包括但不限于特发性肺纤维化、继发于全身炎性疾病诸如类风湿性关节炎的肺纤维化、硬皮病、狼疮、隐原性纤维化肺泡炎、辐射诱导的纤维化、慢性阻塞性肺病(copd)、结节病、硬皮病、慢性哮喘、硅肺病、石棉诱导的肺或胸膜纤维化、急性肺损伤和急性呼吸窘迫(包括细菌肺炎诱导的、创伤诱导的、病毒性肺炎诱导的、呼吸机诱导的、非肺脓毒症诱导的和吸入诱导的)。在一些实施例中,本发明的配制品和方法可用于治疗或预防与肺部炎性疾病相关的继发性细菌或病毒感染(例如与copd相关的继发性细菌感染)。
[0483]
在一些实施例中,本文所述的配制品和方法用于治疗或减缓哮喘的进展或预防哮喘。哮喘可与环境和遗传因素相关或由其引起。哮喘是一种常见的气道慢性炎性疾病,其以症状多变且反复出现、气流阻塞可逆和支气管痉挛为特征。症状包括喘息、咳嗽、胸闷和呼吸短促。哮喘的非限制性实例包括但不限于过敏性哮喘、非过敏性哮喘、急性重度哮喘、慢性哮喘、临床哮喘、夜间哮喘、过敏原诱导的哮喘、阿司匹林敏感性哮喘、运动诱导的哮喘、儿童发作的哮喘、成人发作的哮喘、咳嗽变异性哮喘、职业性哮喘、类固醇抵抗性哮喘或季节性哮喘。
[0484]
在一些实施例中,本文所述的配制品和方法可以治疗或减缓肺部炎症的进展或预防肺部炎症。肺部炎症可与支气管炎、哮喘、肺纤维化、慢性阻塞性肺病(copd)和肺炎的症状相关或导致这些症状。卤化水杨酰苯胺氯硝柳胺已被证明在哮喘小鼠模型中可以减少粘液产生和分泌以及支气管收缩。另外,发现氯硝柳胺是cl-通道tmem16a和tmem16f的有效抑制剂,这有助于粘液和炎性介质的释放。因此,氯硝柳胺可适于治疗炎性气道疾病,诸如囊性纤维化、哮喘和copd(cabrita等人,jci insight[临床研究杂志子刊机理解析]2019;4(15):e128414)。
[0485]
在一些实施例中,本文所述的配制品和方法用于治疗或预防囊性纤维化的临床体征和症状或与囊性纤维化相关的感染。囊性纤维化(cf)是一种遗传障碍,主要影响肺部并且涉及频繁的细菌感染。大约85%的cf患者患有慢性复发性铜绿假单胞菌感染,这显著导致肺功能下降和死亡。长期问题包括由于这些频繁的肺部感染导致的呼吸困难和咳出粘液。因此,在一些实施例中,这些配制品和方法用于治疗与囊性纤维化相关的细菌感染,诸如铜绿假单胞菌感染。在一些实施例中,这些配制品和方法用于治疗与囊性纤维化相关的细菌感染,其中该细菌感染由革兰氏阳性细菌(例如选自金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌和化脓性链球菌的细菌)引起或与其相关。
[0486]
在优选的实施例中,通过吸入本发明的配制品(例如通过吸入本发明的配制品的气雾剂)来治疗肺部炎性疾病。
[0487]
炎症性皮肤病
[0488]
在一些实施例中,本文所述的配制品和方法可以治疗或减缓炎性皮肤病的进展或预防炎性皮肤病。优选地,在这些实施例中,将本发明的配制品局部应用于受试者。例如,可以喷雾剂、洗剂、乳膏、泡沫或液滴的形式局部应用本发明的配制品。合适地,可将本发明的配制品局部应用到受炎性皮肤病影响的部位处的皮肤,例如通过将配制品直接局部应用到特应性皮炎损伤。
[0489]
在某些实施例中,炎性皮肤病选自:银屑病、皮炎(例如特应性皮炎)、硬皮病、毛囊和皮脂腺障碍、痤疮、酒渣鼻、鼻赘、皮肤狼疮、炎症反应(例如药疹、多形性红斑、结节性红斑和环状肉芽肿)、与真菌或酵母感染相关的炎症(例如皮真菌病)、荨麻疹、疱疹样皮炎、扁平苔癣、化脓性汗腺炎、玫瑰皮疹、慢性窦炎、慢性鼻窦炎、狼疮、白癜风和毛发角化病。
[0490]
在某些实施例中,炎性皮肤病症是皮炎,例如特应性皮炎。
[0491]
在某些实施例中,炎性皮肤病症是选自以下的皮炎(或湿疹):接触性皮炎、过敏性接触性皮炎、刺激性接触性皮炎、特应性皮炎、脂溢性皮炎、光化性皮炎、手足性皮炎、汗疱性皮炎、慢性单纯性苔藓(神经性皮炎)、剥脱性皮炎(红皮病)、乏脂性皮炎、癌性皮炎、钱币状皮炎、新生儿皮炎、小儿皮炎、尿布皮炎、淤积性皮炎、口周皮炎、皮肌炎、湿疹性皮炎、光敏性皮炎、光毒性皮炎、植物日光性皮炎和放射诱发的皮炎。
[0492]
在某些实施例中,本发明的配制品用于治疗或预防皮炎的一种或多种症状,例如选自以下的症状:红斑、表皮脱落、苔藓样硬化、水肿、丘疹形成和干燥,特别是红斑、苔藓样硬化、水肿和丘疹形成。
[0493]
鼻和鼻窦病症
[0494]
在一些实施例中,本发明的配制品用于治疗或预防鼻炎、鼻窦炎或鼻组织和鼻窦的炎症。合适地,例如以喷雾剂、液滴、粉末或气雾剂的形式鼻内应用本发明的配制品。
[0495]
在一些实施例中,本发明的配制品用于治疗或预防鼻炎。因此,鼻炎可以是慢性鼻炎。鼻炎可以是急性鼻炎。
[0496]
在一些实施例中,本发明的配制品用于治疗或预防鼻窦炎。因此,鼻窦炎可以是慢性鼻窦炎。鼻窦炎可以是急性鼻窦炎。
[0497]
耳炎和耳感染
[0498]
在一些实施例中,本发明的配制品用于治疗或预防耳炎。在一些实施例中,耳炎是外耳炎。在一些实施例中,耳炎是中耳炎。耳炎可以是慢性耳炎。耳炎可以是急性耳炎。
[0499]
在某些实施例中,耳炎由细菌感染(例如革兰氏阳性细菌感染)引起或与其相关。
[0500]
可以通过局部应用本发明的配制品来治疗耳炎。例如,以液滴、液体或喷雾剂的形式局部应用。
[0501]
抗炎作用
[0502]
在一些实施例中,本发明的配制品降低了与炎性疾病(例如本文所述的任何炎性疾病和病症(例如本文所述的肺部炎性疾病))相关的一种或多种促炎介质的异常水平。例如,通过减弱选自th1、th2、th17和th22型炎性反应的一种或多种反应。本发明的配制品可减弱上文关于治疗炎性眼部疾病所披露的促炎介质中的一种或多种。
[0503]
在一些实施例中,本发明的配制品降低了与本文披露的炎性疾病(例如肺部炎性疾病)相关的crp、白细胞、il1b、il-6、il-10、il-2、ifnγ、ip10、mcp1、gcsf、ip10、mcp1、mip1a和/或tnfα中的一种或多种。
[0504]
头皮病症
[0505]
头皮容易发生多种炎性、细菌和/或真菌感染。然而,头发的存在会使局部治疗头皮病症变得困难,因为头发会抑制局部治疗接近头皮。本发明的液体配制品可特别适于局部治疗头皮病症。
[0506]
因此,提供了用于局部治疗或预防炎性、真菌性或细菌性头皮病症的本发明的液体配制品。在某些实施例中,头皮病症选自:脂溢性皮炎(头皮屑)、头癣、头皮银屑病、鳞屑性瘙痒、头皮红斑、头皮接触性皮炎、扁平苔藓、盘状红斑性狼疮、斑秃和毛囊炎。
[0507]
剂量和给药方案
[0508]
本发明的配制品的剂量和给药方案将取决于医师可容易确定的许多因素,例如病毒感染的严重程度、对初始治疗的反应性、施用方式和被治疗的特定感染。合适剂量、给药体积和频率的实例在上述披露内容的发明内容中阐述。
[0509]
合适的施用方式包括口服、鼻内、肠胃外(例如静脉内、肌内、动脉内、皮下或皮内)、局部、吸入(口内或鼻内)或它们的组合。
[0510]
施用于受试者的卤化水杨酰苯胺的总日剂量可包括一个或多个单位剂量。总日剂量可为5至1000mg、6至800mg、8至700mg、10至500mg、15至400mg、30至300mg、50至250mg、100至200mg或120至250mg卤化水杨酰苯胺或其盐。
[0511]
在一些实施例中,总日剂量为1至50mg、1.5至40mg、2至30mg、2.5至20mg、3至15mg、3.5至12mg、4至10mg、4.5至9mg、5至8.5mg、5.5至8mg、6至7.5mg或6.5至7mg卤化水杨酰苯胺或其盐(例如氯硝柳胺或氯硝柳胺乙醇胺)。在一些实施例中,总日剂量为5.6mg氯硝柳胺乙醇胺,对应于4.7mg氯硝柳胺游离碱。
[0512]
当使用吸入器(例如喷雾器)将本发明的配制品施用于受试者时,并非所有装载到吸入器中的剂量都将到达肺,因为例如一些药物将夹带在装置中,一些药物可能不进入受试者的口或鼻,并且一些药物被夹带在口腔或鼻腔中且不渗透到气道(例如肺)中。提及本文所述的可吸入组合物的剂量是指装载到吸入器中或在吸入器被致动之前由吸入器计量的卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐的剂量。受治疗者吸入的剂量可比致动前剂量低例如10%、15%、20%或25%。
[0513]
可经由多种施用方式将剂量递送给受试者。在一些实施例中,可鼻内施用(例如使用鼻喷雾装置)第一剂量,并且可口内施用(例如使用喷雾器)第二剂量。应当理解,可在第
二剂量之后施用第一剂量,反之亦然。例如,在其中配制品是溶液的形式的实施例中,可鼻内施用每个鼻孔50至250μl或100至200μl(例如130-150μl)的体积,并且可口内施用1至10ml、2至8ml或3至7ml(例如4-6ml)的体积(例如经由喷雾器)。在一些实施例中,鼻内施用每个鼻孔140μl的体积,并且口内施用3ml的体积(例如经由喷雾器)。两种溶液可每天给药两次。
[0514]
配制品可每天施用一次或每天施用多次(例如2、3或4次)。在一些实施例中,配制品每天施用两次。
[0515]
施用于受试者的每日总体积可为200μl至20ml、300μl至19ml、500μl至18ml、1ml至17ml、2ml至16ml、3至15ml、4至14ml、5ml至12ml或8ml至10ml本发明的溶液。在一些实施例中,配制品是含有0.1%至5%、0.5%至5%、1%至4%、1.5%至3%(例如约1%至2%)卤化水杨酰苯胺或其药学上可接受的盐的溶液。
[0516]
可在连续数天或数周内将配制品施用于受试者。例如,可在3天至6周、7天至4周、10天至3周或14至18天的时段内每天施用配制品一次或多次。在一些实施例中,在1周至1年、2周至9个月、4周至6个月、6周至4个月或2至3个月的时间段内施用配制品。例如,可施用治疗长达6至9个月。在一些实施例中,将配制品每天两次施用于受试者持续长达10、14或28天。应当理解,给药周期将由被治疗的疾病的类型和严重程度或是否预防性施用配制品来确定。例如,对于慢性病症(例如copd、哮喘和与囊性纤维化相关的感染)或covid-19的中度或重度病例的治疗,治疗持续时间可更长(例如至少4周、至少6周、至少8周或至少12周)。可继续治疗直到受试者恢复。
[0517]
在一些实施例中,受试者每个鼻孔鼻内施用100-200μl(例如120-180μl或130-160μl)的1%氯硝柳胺乙醇胺溶液,每天两次。在一个优选的实施例中,受试者每个鼻孔鼻内施用140μl的1%氯硝柳胺乙醇胺溶液,每天两次。另外或替代性地,受试者可施用1至10ml、2至8ml、3至6ml或4至5ml的1%氯硝柳胺乙醇胺的雾化溶液,每天两次。
[0518]
应当理解,配制品的剂量和/或给药方案可由技术人员根据多种因素来选择,诸如但不限于疾病的严重程度、受试者的年龄和/或任何潜在病症的存在。
[0519]
在一些实施例中,将配制品施用于受试者用于治疗或预防covid-19。在其中受试者患有轻度covid-19、受试者是无症状的或受试者被预防性治疗(例如高风险组中的受试者或被感染个体的密切接触者)的一些实施例中,可每天施用配制品一次或多次,持续不超过21天、不超过18天、不超过16天、不超过14天、不超过12天或不超过10天的时间段。在其中受试者患有中度或重度covid-19的一些实施例中,可每天施用配制品一次或多次,持续至少7天、至少10天、至少14天、至少21天或至少28天的时间段。
[0520]
如将理解,本节中列出的剂量和给药方案可与本发明的任何配制品一起使用。在一个优选的实施例中,在本文所述的任何剂量和给药方案中以及在该“剂量和给药方案”中使用的本发明的配制品是液体配制品,该液体配制品包含:
[0521]
约1%氯硝柳胺乙醇胺;
[0522]
约15%环糊精,优选β-环糊精,更优选hp-β-cd;
[0523]
约2%pvp(例如pvp 30);
[0524]
余量为水,
[0525]
其中这些百分比基于该液体配制品的重量按重量计;并且任选地其中该配制品具
有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[0526]
组合疗法
[0527]
本发明的配制品可单独使用以提供治疗效果。本发明的配制品也可与一种或多种另外的治疗剂组合使用。
[0528]
在一些实施例中,另外的治疗剂选自以下中的一种或多种:
[0529]
·
抗病毒剂(例如瑞德西韦、hiv蛋白酶抑制剂(例如洛匹那韦或利托那韦)或3cl蛋白酶抑制剂(例如pf-07304814);
[0530]
·
疫苗(例如covid-19疫苗),疫苗的实例包括减毒或灭活病毒疫苗、复制或非复制病毒载体疫苗、核酸疫苗(rna或dna疫苗)、蛋白亚单位疫苗或病毒样颗粒疫苗;
[0531]
·
支气管扩张药,例如短效β激动剂(例如沙丁胺醇、肾上腺素或左沙丁胺醇)或长效β激动剂(例如福莫特罗、沙美特罗或维兰特罗);
[0532]
·
抗胆碱能药(例如异丙托铵);
[0533]
·
白三烯调节剂(例如孟鲁司特、扎鲁司特或齐留通);
[0534]
·
长效支气管扩张药(例如噻托铵);
[0535]
·
抗炎剂(例如类固醇,其可以是静脉注射、口服或吸入类固醇(例如地塞米松、布地奈德));非甾体抗炎剂(例如布洛芬、萘普生、酮洛芬或卡洛芬、cox-2抑制剂诸如塞来昔布)、抗炎抗体(例如贝那利珠单抗、度普利尤单抗、美泊利单抗、奥马珠单抗、瑞替珠单抗);
[0536]
·
抗菌剂,例如革兰氏阳性或革兰氏阴性抗生素;
[0537]
·
抗病毒抗体(例如对冠状病毒诸如sars-cov-2的刺突蛋白起作用的抗体(例如ly-cov555、ly-cov016、azd7442、regn10933或regn10987));以及来自之前感染过病毒的受试者的抗体(例如恢复期血浆疗法);
[0538]
或者它们中任何两种或更多种的组合。
[0539]
这样的组合治疗可通过同时、依次或分开给药该治疗的各个组分的方式来实现。此类组合产品采用在上文所述的治疗有效剂量范围内的本发明的配制品以及在其批准剂量范围内的其他药物活性剂。
[0540]
在本文中,在使用术语“组合”的情况下,应当理解,这是指同时、分开或依次施用。在本发明的一个方面,“组合”是指同时施用。在本发明的另一个方面,“组合”是指分开施用。在本发明的另一个方面,“组合”是指依次施用。在依次或分开施用的情况下,延迟施用第二组分不应导致组合的有益作用丧失。
[0541]
在其中使用组合治疗的一些实施例中,当组合时,本发明的配制品的量和其他药物活性剂的量在治疗上有效地治疗患者的靶向障碍。在这种背景下,组合量是“治疗有效量”,如果将它们组合,则足以减轻或完全缓和该障碍的症状或其他有害影响;治愈该障碍;逆转、完全停止或减缓该障碍的进展;或者降低该障碍恶化的风险。通常,此类量可由本领域技术人员通过例如从本说明书中针对本发明的配制品中存在的卤化水杨酰苯胺(例如氯硝柳胺或其药学上可接受的盐)描述的剂量范围和其他药物活性剂的批准或以其他方式公开的剂量范围开始来确定。
[0542]
配制品的制备
[0543]
根据本发明的配制品可通过以下方法来制备:
[0544]-将环糊精和/或卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到
溶剂中以形成悬浮液;
[0545]-将该悬浮液加热足以使该环糊精和/或卤化水杨酰苯胺或其药学上可接受的盐溶解在该溶剂中的一段时间,从而形成溶液;
[0546]-将该溶液冷却。
[0547]
在一些实施例中,该方法包括在加热之前将环糊精和卤化水杨酰苯胺或其药学上可接受的盐两者添加到溶剂中。
[0548]
在一些实施例中,该方法包括:
[0549]-将环糊精和卤化水杨酰苯胺或其药学上可接受的盐中的一种添加到该溶剂中以形成悬浮液;
[0550]-将悬浮液加热(或继续加热)足以使环糊精或氯硝柳胺或其药学上可接受的盐溶解在溶剂中的一段时间,从而形成第一溶液;
[0551]-将该环糊精和该卤化水杨酰苯胺或其药学上可接受的盐中的另一种以固体形式添加到该第一溶液中;
[0552]-将第一溶液加热(或继续加热)足以使固体溶解的一段时间,从而形成第二溶液;以及
[0553]-将该溶液冷却。
[0554]
在一些实施例中,该方法包括:
[0555]-将环糊精加入到溶剂中以形成第一悬浮液,并将该第一悬浮液加热足以使该环糊精溶解在该溶剂中的一段时间,从而形成第一溶液;
[0556]-将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到溶剂中以形成第二悬浮液,并将第二悬浮液加热至足以使卤化水杨酰苯胺或其药学上可接受的盐溶解在溶剂中的温度一段时间,从而形成第二溶液;
[0557]-将该第一溶液添加到该第二溶液中以形成混合物;以及
[0558]-将该混合物冷却。
[0559]
该方法可包括在将第一溶液添加到第二溶液之后,在冷却之前,加热(或继续加热)混合物。
[0560]
可以固体(例如粉末)、分散体、悬浮液或浆料的形式添加环糊精和/或卤化水杨酰苯胺。
[0561]
在一些实施例中,加热进行至120℃或更低(例如50℃至120℃、60℃至95℃或70℃至80℃,例如约65℃)的温度。
[0562]
可在添加环糊精和/或卤化水杨酰苯胺之前预热溶剂。因此,在一些实施例中,“加热悬浮液”将被理解为意指在添加环糊精和/或卤化水杨酰苯胺之后保持溶剂/悬浮液的温度。
[0563]
在一些实施例中,冷却进行至10℃至40℃的温度。
[0564]
在一些实施例中,在加热步骤之前和/或期间将环糊精和/或卤化水杨酰苯胺与溶剂混合。混合可通过任何合适的方式进行,例如通过搅拌、摇动、旋转或通过使用旋涡混合器。
[0565]
混合可进行总共30秒至1小时、1分钟至30分钟或5分钟至20分钟的时段。
[0566]
在一些实施例中,该方法进一步包括对环糊精和/或卤化水杨酰苯胺与溶剂的混
合物进行声波处理。声波处理(例如超声处理)可在混合步骤之前和/或之后进行。
[0567]
例如,在将环糊精和/或卤化水杨酰苯胺添加到溶剂中以形成悬浮液之后,可通过涡旋1-10分钟来混合悬浮液。任选地,然后在加热(例如在65℃下)的同时对混合物进行声波处理。任选地,然后通过再涡旋1-5分钟来混合混合物。任选地,然后在加热(例如在65℃下)的同时再次对混合物进行声波处理。然后通过涡旋的最终混合步骤可进行30秒至2分钟。
[0568]
在一些实施例中,该方法包括将溶剂、溶液或悬浮液的ph升高至约7或更大的ph。例如,可将ph升高至8或更大的ph,例如8-13、9-12或10-11的ph,例如ph 8-9.5。可通过添加碱诸如氢氧化钠来升高ph。可在混合之前、期间或之后添加碱。可在添加卤化水杨酰苯胺、环糊精和/或聚合物之前或之后添加碱。
[0569]
在一些实施例中,该方法包括在添加卤化水杨酰苯胺之前将ph升高至7或更大的ph。例如将ph升高至8或更大。
[0570]
在一些实施例中,该方法包括将溶液的ph降低至4-8的ph。可通过添加酸诸如盐酸来降低ph。可在混合和/或声波处理完成后(即当所有固体溶解并且配制品澄清而无任何可见颗粒时)降低ph。可在添加酸之后例如通过涡旋1分钟进一步混合溶液。
[0571]
在一些实施例中,该方法包括在卤化水杨酰苯胺已经溶解在溶剂中之后将溶液的ph降低至4-8的ph。在一些实施例中,在卤化水杨酰苯胺和环糊精两者都已经溶解在溶剂中之后降低ph。
[0572]
在一些实施例中,该方法包括将溶液的ph调节至7-8(例如7.5-7.8)的ph。可在冷却溶液之后调节ph。可通过适当地添加碱(例如naoh)或酸(例如hcl)来调节ph。
[0573]
在一些实施例中,溶剂是水或包含水。溶剂可进一步包含共溶剂,诸如dmso。可在配制品的任何或所有组分之前或之后添加共溶剂。例如,在一些实施例中,在冷却期间或之后添加共溶剂。
[0574]
在一些实施例中,该方法进一步包括添加一种或多种聚合物。聚合物可以是本文关于本发明的配制品描述的任何聚合物,优选水溶性聚合物,更优选pvp。可在环糊精和/或卤化水杨酰苯胺之前、之后或与其同时将聚合物添加到溶剂中。例如,在一些实施例中,可在添加到溶剂中之前混合所有干组分(即环糊精、卤化水杨酰苯胺(例如氯硝柳胺)或其盐和聚合物)。替代性地,可将每个组分分开添加到溶剂中并在添加下一个组分之前溶解。
[0575]
在一些实施例中,该方法包括在环糊精和卤化水杨酰苯胺已经溶解在溶剂中之后添加聚合物。在一些实施例中,在溶液的ph已经降低至ph 4-8之后添加聚合物。
[0576]
在一些实施例中,该方法进一步包括将一种或多种另外的组分(诸如一种或多种电解质、稳定剂或防腐剂)添加到溶剂中。
[0577]
在一些实施例中,该方法包括:
[0578]-将环糊精(例如hp-β-cd)、卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐和任选的聚合物(例如pvp)添加到包含水和助溶剂(例如dmso)的溶剂中以形成悬浮液;
[0579]-通过添加碱(例如naoh)将悬浮液的ph升高至7-8的ph;
[0580]-将悬浮液混合;
[0581]-将悬浮液加热至低于120℃(例如65℃)的温度保持足以使环糊精、卤化水杨酰苯胺或其药学上可接受的盐和聚合物(如果存在)溶解在溶剂中的一段时间,从而形成溶液;
[0582]-通过添加酸(例如hcl)将溶液的ph降低至4-8的ph;
[0583]-将溶液冷却(例如至室温);
[0584]-将溶液的ph调节至7-8的ph。
[0585]
在一些实施例中,该方法包括:
[0586]-任选地,将溶剂(例如水)预热至期望的温度,诸如65℃-90℃;
[0587]-将环糊精添加到该溶剂中以形成第一悬浮液;
[0588]-加热该第一悬浮液,或将该第一悬浮液的温度保持在该期望的温度,同时混合足以使该环糊精溶解在该溶剂中的一段时间,从而形成第一溶液;
[0589]-将聚合物(例如pvp)添加到该第一溶液中;
[0590]-将该第一溶液的ph升高(例如至9-10的ph);
[0591]-将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到该第一溶液中以形成第二悬浮液,任选地其中以浆料的形式添加该卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐;
[0592]-将该第二悬浮液的温度保持在该期望的温度,同时混合足以使该卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐溶解的一段时间,从而形成第二溶液;
[0593]-将该第二溶液冷却(例如至约20℃至约30℃的温度);
[0594]-任选地,在冷却期间或之后将共溶剂(例如dmso)添加到该第二溶液中;以及
[0595]-调节该第二溶液的ph,例如调节至约7.5至约8.5的ph。
[0596]
在一些实施例中,该方法包括:
[0597]-任选地,将溶剂(例如水)预热至期望的温度,诸如65℃-90℃;
[0598]-将环糊精和碱添加到该溶剂中以形成第一悬浮液;
[0599]-加热该第一悬浮液,或将该第一悬浮液的温度保持在该期望的温度,同时混合足以使该环糊精溶解在该溶剂中的一段时间,从而形成具有至少8的ph的第一溶液;
[0600]-将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到该第一溶液中以形成第二悬浮液,任选地其中以浆料的形式添加该卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐;
[0601]-将该第二悬浮液的温度保持在该期望的温度,同时混合足以使该卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐溶解的一段时间,从而形成第二溶液;
[0602]-将该第二溶液的ph降低至4-8的ph(例如通过添加酸);
[0603]-将聚合物(例如pvp)添加到该第二溶液中,并混合足以使该聚合物溶解在该第二溶液中的一段时间;
[0604]-将该第二溶液冷却(例如至约20℃至约30℃的温度);
[0605]-调节该第二溶液的ph,例如调节至约7.5至约8.5的ph。
[0606]
任选地,可将其中溶解有环糊精和卤化水杨酰苯胺的溶液(例如第二溶液)稀释(例如用溶剂诸如水)以获得期望的卤化水杨酰苯胺浓度。然后可将溶液排放到合适的容器中用于储存或施用。
[0607]
配制品可在任何合适的反应容器中制备。方便地,容器可带有夹套(例如带有水夹套)以在制备配制品期间保持容器的温度。
[0608]
在一些实施例中,该方法进一步包括由溶液形成固体,例如粉末。固体可使用熟知
的方法制备,例如通过微沉淀、冻干或喷雾干燥或者喷雾冷冻干燥溶液。
[0609]
实例
[0610]
通过以下实例进一步说明本发明。
[0611]
缩写
[0612]
cd环糊精
[0613]
dmso二甲亚砜
[0614]
nen氯硝柳胺乙醇胺
[0615]
oxy五氯柳胺
[0616]
pvp聚乙烯吡咯烷酮
[0617]
实例1:包含氯硝柳胺乙醇胺的水性配制品
[0618]
如下所述制备表1中所示的配制品:
[0619]
表1:
[0620][0621][0622]
将氯硝柳胺乙醇胺(100mg)、pvpk30(200mg)和羟丙基β-环糊精(1500mg)称量到20ml玻璃小瓶中。
[0623]
向该粉末混合物中添加milliq水(8.5ml)、2滴5mnaoh和100μldmso。混合物的ph为至少8。
[0624]
将小瓶置于65℃的超声浴中并根据以下方案混合:
[0625]
涡旋1至10分钟;在65℃下超声处理;涡旋1至5分钟;在65℃下超声处理;以及涡旋1分钟;
[0626]
以提供没有任何可见颗粒的透明红色组合物。
[0627]
将2滴5mhcl添加到组合物中,然后涡旋1分钟。将所得配制品冷却至室温,并使用1mnaoh/hcl将ph调节至7.80
±
0.1,得到标题配制品。标题组合物的摩尔渗透压浓度为180mosm/kg。
[0628]
使用类似方法制备表2中所示的配制品b至e。
[0629]
表2:
[0630][0631][0632]
实例2:包含五氯柳胺的水性配制品
[0633]
使用与实例1中所述类似的方法制备表3中所示的配制品:
[0634]
表3
[0635][0636]
实例3:水性氯硝柳胺乙醇胺配制品的储存稳定性
[0637]
将实例1中所述的配制品a的样品在黑暗中在5℃的冷藏条件下储存。将另一个样品在室温下暴露于环境光照中储存。储存74天后,使用以下hplc-uv方法分析两个样品的氯硝柳胺降解:
[0638]
柱:来自飞诺美(phenomenex)的kinetex c18lc柱(4.6
×
100mm,5μm)
[0639]
流动相a:调至ph 4.0的0.1m乙酸盐缓冲液
[0640]
流动相b:甲醇
[0641]
进样体积:5μl
[0642]
流速:1.0ml/min
[0643]
检测波长:310nm
[0644]
测量时间:10min
[0645]
梯度条件:
[0646][0647]
结果
[0648]
在黑暗中在冷藏条件下储存的样品显示出0.6%的氯硝柳胺降解。在室温下储存的样品显示出0.7%的氯硝柳胺降解。
[0649]
实例4:氯硝柳胺对与肺部细菌感染诸如肺炎相关的细菌的抗菌作用
[0650]
微生物
[0651]
针对与肺部感染诸如肺炎的相关性选择细菌菌株:金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌(mrsa)、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌和酿脓链球菌。金黄色葡萄球菌和酿脓链球菌菌株如wo 2016/038035中所定义。
[0652]
将菌株在-80℃下保存在补充有15%甘油(v/v)的luria bertani(lb)肉汤(金黄色葡萄球菌)或脑心浸液(bhi)(酿脓链球菌)中,并且通过在lb(金黄色葡萄球菌)或bhi(酿脓链球菌)琼脂板上分离来重新活化。将菌株在阳离子调节的mueller hinton(mh)肉汤(金黄色葡萄球菌)或bhi(酿脓链球菌)中培养。所有菌株均在37℃下有氧培养(对于酿脓链球菌菌株为微需氧)。
[0653]
进行以下测试以体外评估氯硝柳胺的抗菌活性:
[0654]
最小抑制浓度(mic)测定
[0655]
根据wo 2016/038035中描述的方法测定mic。
[0656]
结果
[0657]
表4:-使用上文描述的测定得到的氯硝柳胺的mic值(以μg/ml计)。
[0658]
[0659][0660]
氯硝柳胺对所有靶向菌株的mic均≤0.5μg/ml。
[0661]
表4中的结果表明,氯硝柳胺对一系列细菌(包括通常与肺部感染相关的细菌)有效。因此,包含氯硝柳胺的可吸入组合物可有效治疗或预防细菌性肺部感染,包括与囊性纤维化、copd和呼吸道病毒感染相关的继发性细菌性肺部感染。
[0662]
实例5:包含氯硝柳胺或五氯柳胺的环糊精配制品的抗菌作用
[0663]
从lb琼脂板上挑取大约五个至十个菌株atcc 29213(a)、mrsa434844(b)和金黄色葡萄球菌newman(c)的菌落,将其悬浮于pbs中并将od600设定为约0.1。将10μl每种细菌悬浮液吸移到lb琼脂板上并在室温下干燥。将10μl每种配制品吸移到与细菌悬浮液相同的斑点(在板底部标记)处并干燥,然后在37℃下孵育过夜。孵育后,将每个斑点重新铺在lb琼脂板上并孵育过夜。孵育后,对形成的菌落进行计数。如果菌落不可计数(》ql),则将计数报告为估计值(~)。如果检测到涂片,则将细菌载量记录为 。进行了重复试验。
[0664]
阳性对照是溶解在dmso中的api,其浓度等于相应菌株的mic。
[0665]
配制品的编码
[0666]
[0667][0668]
结果
[0669]
1.od测量—细菌载量接种物
[0670]
abc0.10050.1140.1035
[0671]
2.平均cfu计数
[0672][0673]
所有对照(5至9)均为 (即检测到涂片)。
[0674]
由于两个阳性对照均为阴性,因此在使用上述相同方法的斑点测试中使用不同浓度重复实验。
[0675]
针对每种相应菌株,在100μg/ml、10μg/ml和1μg/ml的浓度下测试氯硝柳胺的dmso溶液;在40μg/ml、4μg/ml和0.4μg/ml的浓度下测试五氯柳胺的dmso溶液。在该实验中,阴性对照仅为细菌悬浮液。
[0676]
只有最高浓度的氯硝柳胺和五氯柳胺显著降低了细菌载量(200x-400x mic niclo,180x mic oxy)。
[0677]
结论
[0678]
与媒剂相比,包含氯硝柳胺或五氯柳胺和环糊精的所有测试配制品均降低了细菌载量。
[0679]
五氯柳胺在降低金黄色葡萄球菌的细菌载量方面具有最高的效率。
[0680]
实例4和5中的抗菌数据以及显示氯硝柳胺对诸如sars cov-2的病毒具有活性的数据(wu等人2004以及xu等人2020下文)和wo 2020/039073中的炎性生物标志物数据证明氯硝柳胺具有抗菌、抗炎和抗病毒特性。综合这些数据,有理由认为本文所述的可吸入配制品可有效治疗或预防呼吸道病毒感染(诸如sars cov-2)和与呼吸道病毒感染相关的疾病(诸如covid-19)。
[0681]
实例6:氯硝柳胺乙醇胺喷雾器溶液的批量制造
[0682]
如下所述制备表5中所示的配制品:
[0683]
表5
[0684][0685]
*根据需要提供约7.8的ph
[0686]
1%的喷雾器溶液是等渗和含水的水性配制品。将溶液填充到10ml透明i型模制玻璃小瓶中,每个小瓶含有7ml溶液。1%的喷雾器溶液含有10mg/ml氯硝柳胺乙醇胺,相当于8.4mg/ml氯硝柳胺游离碱。
[0687]
10kg 1%的喷雾器溶液的批次配方在表6中示出:
[0688]
表6
[0689][0690]
*根据需要提供约7.8的最终ph
[0691]
根据以下方案在c类环境中制备本体溶液:
[0692]
1.向罐中加入注射用热水(例如65℃-90℃)(总量的80%)并开始搅拌;
[0693]
2.向罐中加入环糊精和naoh并搅拌混合物,直至固体组分完全溶解,得到约ph 12的溶液;
[0694]
3.将固体氯硝柳胺乙醇胺添加到罐中并继续搅拌,直至氯硝柳胺乙醇胺完全溶解,得到大约ph 8-9的溶液;
[0695]
4.添加总量的75%的2n hcl;
[0696]
5.添加pvp并继续搅拌,直至pvp完全溶解;
[0697]
6.将溶液冷却至约室温;
[0698]
7.通过添加剩余的2n hcl将溶液的ph调节至7.8,并记录ph;
[0699]
8.添加注射用水至最终重量;
[0700]
9.将溶液排放到10ml玻璃小瓶中(每个小瓶7ml溶液);
[0701]
10.将小瓶用橡胶塞封闭并用铝盖密封。
[0702]
根据上述方案制造的批次的分析结果在下表7中示出:
[0703]
表7
[0704][0705]
实例7:氯硝柳胺乙醇胺水性溶液的物理稳定性
[0706]
评价包含氯硝柳胺乙醇胺、环糊精和聚合物的不同配制品的稳定性。
[0707]
使用的材料
[0708]
[0709][0710]
方法
[0711]
样品制备
[0712]
表8示出了所制备的18种不同配制品的组成。将环糊精、聚合物和nen称重到20ml玻璃小瓶中。向其中添加100μl 5m naoh以及注射用水(wfi),得到10g配制品,并将混合物涡旋1分钟。然后将悬浮液在70℃下超声处理5分钟并涡旋1分钟。重复该程序两次或直至获得澄清溶液。然后将所得溶液冷却至室温,并使用1m或5m hcl将ph调节至7.8-8.0。调节ph后,将配制品涡旋1分钟。
[0713]
稳定性研究
[0714]
制备后,将配制品分成三个4ml黑色加盖的棕色玻璃小瓶,并在环境湿度下在5℃(黑暗)、25℃(光照)和40℃(黑暗)下储存。在储存1、2、7、14和28天后,目测评价样品的沉淀。
[0715]
表8:不同配制品的组成。剩余部分构成wfi。
[0716]
[0717][0718]
结果
[0719]
配制品12、13、14、16、17和18在制备时从未形成澄清溶液。配制品4和15在最终ph调节时沉淀。将剩余样品储存在5℃(黑暗)、25℃(光照)和40℃(黑暗)下。
[0720]
在5℃下(黑暗)储存后观察到的沉淀
[0721]
第1天:无
[0722]
第2天:配制品1、7、11
[0723]
第7天:配制品1、7、11
[0724]
第14天:配制品1、3、7、11
[0725]
第28天:配制品1、3、7、11
[0726]
在25℃下(光照)储存后观察到的沉淀
[0727]
第1天:配制品1、7、11
[0728]
第2天:配制品1、3、7、11
[0729]
第7天:配制品1、3、7、11
[0730]
第14天:配制品1、2、3、6、7、11
[0731]
第28天:配制品1、2、3、6、7、11
[0732]
在40℃下(黑暗)储存后观察到的沉淀
[0733]
第1天:配制品1、3、7、11
[0734]
第2天:配制品1、2、3、6、7、11
[0735]
第7天:配制品1、2、3、5、6、7、11
[0736]
第14天:配制品1、2、3、5、6、7、8、11
[0737]
第28天:配制品1、2、3、5、6、7、8、9、11
[0738]
结论
[0739]
含有kleptose的配制品明显比含有captisol的配制品更稳定。此外,含有15%kleptose的配制品(配制品5-8)通常比含有10%kleptose的配制品(配制品1-4)更稳定,并且含有1%nen和pvp k30的配制品(配制品9和10)通常比含有2%nen和pvp k30的配制品(配制品2和6)更稳定。在较低温度下储存增加了物理稳定性。配制品10(1%nen、2%pvp k30和15%kleptose)在5℃和25℃下储存12周后未显示任何沉淀迹象。此外,它在40℃下储存后比配制品5更晚沉淀,因此,配制品10在本研究中测试的18种不同配制品中表现出最好的物理稳定性。
[0740]
实例8:水性氯硝柳胺乙醇胺配制品的雾化
[0741]
实例1、2、6或7的配制品可通过电子喷雾器(例如,电子喷雾器(购自帕瑞公司(pari gmbh)))雾化,以提供可以经由吸入来施用于患者的气雾剂。
[0742]
雾化配制品的药物递送效率可通过呼吸模拟来评估,并且液滴尺寸和分布模式可通过激光衍射来确定(如us 2009/0304604 a1中所述)。
[0743]
实例9:用氯硝柳胺溶液测试鼻雾化装置
[0744]
进行测试以确定鼻应用器装置对于施用实例7的配制品10的适用性。所测试的装置是mad nasal
tm
鼻内粘膜雾化装置(目录号mad130),具有1.0ml的注射器。
[0745]
方法
[0746]-利用4位天平进行差分称量。
[0747]-以15l/min操作来自马尔文的spraytec(lalls,低角激光散射)。
[0748]
测试描述和结果
[0749]
初始测试:通过将蓝色塑料针头插入具有活性配制品的小瓶中,将配制品吸入注射器中。然后移出蓝色针头并附接mad nasal装置。不需要太大的手力。
[0750]
与水一起喷雾:将约0.5ml吸入新的注射器中。然后移出蓝色针头并附接mad nasal装置。然后应用两个可替代的喷雾方向,即mad nasal装置向下和mad nasal装置向上。
[0751]
表9.使用后注射器中剩余的配制品量
[0752][0753]
lalls测试:两次评估液滴尺寸分布,结果相似,如表10所示。
[0754]
表10.两次lalls测试的d10、d50和d90(以μm计)。
[0755][0756]
剂量变化测试:使用以下程序用配制品对六个新的(直接从袋中取出的)mad nasal装置进行测试:
[0757]
1)从塑料袋中取出注射器并称重。
[0758]
2)用配制品填充注射器直至注射器上显示0.35ml配制品并称重。
[0759]
3)将针头更换为mad nasal装置并称重。
[0760]
4)将注射器尖端朝下排空并称重。
[0761]
结果在下表11中示出。
[0762]
表11:六个装置的差分称重结果。
[0763][0764][0765]
结论
[0766]
发现mad nasal装置与本发明的配制品配合良好。将装置填充至0.35ml使得剂量为大约0.15ml,由于手动操作而存在一些变化。
[0767]
实例10:非临床研究
[0768]
研究a:大鼠中的剂量范围发现和2周glp吸入毒性研究
[0769]
本研究的目标是确定实例6的表5中所示的配制品(1%氯硝柳胺乙醇胺、2%pvp k30和15%kleptose hpb)在以下情况下的潜在毒性:通过吸入施用以递增剂量水平给予大鼠以确定最大耐受剂量(mtd阶段),随后是2周重复剂量阶段(固定剂量阶段)并评价任何发现的潜在可逆性。另外,确定配制品a的毒代动力学特征。
[0770]
使用15(与人30mg qd剂量相比,高5倍[全身mg/kg]和高18倍[局部mg/g])和50mg/kg(与人30mg qd剂量相比,高15倍[全身mg/kg]和高52倍[局部mg/g])的日剂量水平评估大鼠的关键2周安全性研究(对于主要研究评价,10只大鼠/性别/组);还包括媒剂和空气对照组。该关键阶段之前是范围发现阶段,该范围发现阶段选择50mg/kg的高剂量水平用于关键2周阶段。每日给药2周后对大鼠鼻腔的显微镜评价揭示,在15和50mg/kg剂量下,鼻中隔/鼻咽中的杯状(粘蛋白分泌)细胞出现非不利的轻微肥大,这与剂量无关;在媒剂或空气对照组中没有观察到这些变化,并且这些变化被认为是对重复施用氯硝柳胺乙醇胺的适应性变化。在肺中,在媒剂以及15和50mg/kg剂量组中给药2周后观察到肺泡巨噬细胞出现最小至轻度增加;这些变化不被认为是不利的,而是对媒剂清除的适应性反应。迄今为止,尚未报告其他值得注意的组织病理学发现。
[0771]
研究b:比格犬中的剂量范围发现和2周glp吸入毒性研究
[0772]
本研究的目标是确定实例6的表5中所示的配制品在以下情况下的潜在毒性:通过吸入施用以递增剂量水平给予狗以确定最大耐受剂量(mtd阶段),随后是2周重复剂量阶段
(固定剂量阶段)并评价任何发现的潜在可逆性。另外,确定配制品的毒代动力学特征。
[0773]
使用2.5(与人30mg qd剂量相比,高2倍[全身mg/kg]和4倍[局部mg/g])和4.37/4.14mg/kg(与人30mg qd剂量相比,高3倍[全身mg/kg]和高6倍[局部mg/g])的日剂量水平评估狗的关键2周安全性研究(对于主要研究评价,3只/性别/组);还包括媒剂和空气对照组。在每日给药2周后,在施用媒剂或2.5mg/kg的雄性和雌性狗中以及在给药4.14mg/kg的雌性狗中的显微镜评价揭示,鼻腔没有变化并且肺中仅有最小的变化,包括肺泡巨噬细胞和混合/单核细胞浸润最小增加、最小的支气管渗出物和轻度的中性粒细胞浸润或继发于最小肺部发现的气管支气管淋巴结中的细胞构成最小增加。给药2周后观察到的组织学变化较小并且不被认为是不良的。
[0774]
研究c:喷雾氯硝柳胺在绵羊中肺部施用后的肺部药代动力学(非glp)
[0775]
本研究的目标是确定实例6的表5中所示的配制品在以下情况下的药代动力学曲线:通过肺部施用以类似于临床递增方案的递增剂量水平给予绵羊,并结合使用肺功能测试进行安全性评估。
[0776]
治疗后绵羊的pk分析证明氯硝柳胺大量暴露于上皮衬液(elf)。峰值浓度超过氯硝柳胺抗sars-cov-2的ic90值的100倍。尽管从elf中大量清除,但在单次施用配制品a后的8小时取样期内,氯硝柳胺浓度保持在ic90以上(图1a)。这些数据支持每天两次施用配制品。
[0777]
另外,与氯硝柳胺的口服剂型相比,本研究中氯硝柳胺的elf浓度大大超过从使用口服氯硝柳胺的研究中公开的血浆药代动力学,并且提供了使用根据本发明的配制品来治疗covid-19的药理学原理。由于病毒消除最可能是由肺部而不是全身暴露驱动的,因此在肺部施用后配制品a所达到的功效界限在病毒复制的相关区域比口服途径所达到的功效界限大得多(elf中平均cmax对ic90的功效界限》100倍)(人口服剂量对ic90的功效界限平均全身暴露仅存在于2g/天剂量,其为8倍),尽管口服施用氯硝柳胺后的明确肺部水平仍然未知(图1b)。
[0778]
氯硝柳胺施用后的全身暴露在人体中口服暴露后所报告的数值范围内,其中cmax为577ng/ml(平均值)[范围:217-803ng/ml]。另外,发现该治疗在绵羊中具有良好的耐受性,如通过给药前和给药后的肺功能分析所确定。
[0779]
实例11:临床试验
[0780]
可使用本文所述的氯硝柳胺乙醇胺或五氯柳胺配制品(诸如实例1中所述的配制品a)进行以下临床试验。
[0781]
临床试验方案—1期
[0782]
研究设计
[0783]
在成年健康志愿者(hv)中进行递增剂量缩放研究以评估本发明的配制品的三个增加剂量的安全性。
[0784]
27名健康志愿者将入组三个连续队列:
[0785]
·
队列1:9名健康志愿者,7名接受单剂量的0.75%的本发明的配制品(4ml),并且2名接受安慰剂。
[0786]
·
队列2:9名健康志愿者,7名接受单剂量的2.0%的本发明的配制品(4ml),并且2名接受安慰剂。
[0787]
·
队列3:9名健康志愿者,7名接受单剂量的5.0%的本发明的配制品(4ml),并且2名接受安慰剂。
[0788]
队列的筛选和入组将并行开始,而给药将顺序进行。给药将从队列1开始。一旦从队列1中至少有8名受试者(即至少有6名接受积极治疗的受试者)中获得数据,安全性监测委员会(smc)就将在队列2中的受试者开始给药前评估安全性参数。类似地,smc将在队列3开始给药前审查队列2中至少8名受试者的数据。基于本研究的结果,smc将对随后的2期研究中covid19感染和住院患者的给药提出建议,以便在本方案(1期)后立即开始。对于所有三个队列,一名受试者将在第一天用本发明的配制品(开放标签)给药并跟踪24小时,同时在诊所入院以确认新剂量的安全性,然后对队列中的剩余受试者进行给药。如果观察到安全性问题,smc将参与裁定;如果没有观察到安全性问题或smc判断继续给药是安全的,则每个队列中剩余的8名受试者将被随机分配并且间隔至少一小时给药(双盲)。一旦从所有队列中获得安全性和pk数据,smc将评估安全性参数并审查pk数据以确认三个剂量的安全性。基于此,smc将推荐在下一个发展阶段在covid-19患者中施用的剂量。
[0789]
如果受试者经历与喷雾研究产品(ip)的吸入相关的咳嗽、不适和/或疼痛(达到研究者评估它对于施用将存在问题的程度),则研究者可决定可以在吸入ip之前施用吸入利多卡因。队列1中的第一名受试者应在没有利多卡因的情况下给药,如果在队列1或后续队列中观察到问题,则研究者可以自行决定对某些或所有剩余受试者施用利多卡因。
[0790]
筛选可在开始研究治疗前进行长达21天(在给药前1至3天收集口咽拭子以确认hv受试者未感染covid-19)。
[0791]
对于有资格入组本研究的受试者,他们不能是吸烟者,一般健康状况应良好并且具有正常的病史(通过研究者的判断不包括任何慢性疾病),以及预测肺功能为最低80%(包括β2-激动剂后1秒用力呼气量(fev1)、总肺活量(tlc)、一氧化碳扩散容量(dco)、呼出一氧化氮分数(feno)和用脉搏血氧定量的6分钟步行测试(6-mwt))。最后,生命体征、ecg和胸部x射线不得有临床显著异常(详见排除标准)。
[0792]
研究产品(ip)将是由合格的研究人员施用的单一递增剂量或安慰剂,之后受试者将在诊所跟踪24小时并在给药后48小时返回进行最终检查。
[0793]
将在筛选时、给药后24和48小时进行一般身体检查、血清化学和血液学取样以及尿分析。如果第一次筛选访视在给药前超过3天进行,则受试者必须在给药前1至3天来到诊所取口咽拭子(以确认没有感染sars-cov2)并取样进行血清化学、血液学和尿分析。在呼吸功能方面,将基于给药前以及给药后1、3、6、12和24小时进行的呼吸量测定法(肺活量和fev1)以及脉搏血氧定量来评估安全性。将在筛选期(icf签署和给药之间)和给药后第2天(给药当天指定为第0天)测量fev1(包括可逆性)、tlc、dco和feno并用脉搏血氧定量进行6-mwt。将在筛选时、给药前、给药后3、6和24小时捕获ecg,同时将在筛选时、给药前、给药后1、3、6、12、24和48小时测量生命体征(全身血压、脉搏、呼吸率(rr)和体温)。将在整个研究期间收集ae。最后,将在给药前和给药后48小时采集用于检测病毒和细菌的口咽拭子,用于对微生物组的潜在变化进行事后探索性分析。
[0794]
将在给药前、给药后1/2、1、11/2、2、3、6、12和24小时收集用于pk分析的血样。
[0795]
纳入标准
[0796]
只有满足以下所有纳入标准的受试者才有资格:
[0797]
(1)签署知情同意书(icf)。
[0798]
(2)在整个研究过程中禁欲或同意使用有效避孕方法的男性或未怀孕且非泌乳的女性。女性在给药前的尿β-人绒毛膜促性腺激素(hcg)妊娠测试必须呈阴性(绝经后(绝经被定义为连续12个月没有月经期且没有其他生物学或生理学原因可以被鉴定)或输卵管结扎/子宫切除术的妇女不需要进行妊娠测试且不需要同意使用避孕)。
[0799]
可接受的节育方法如下:
[0800]
·
宫内避孕器放置至少3个月。
[0801]
·
在给药前至少3个月且一直持续到研究完成使用稳定激素避孕药。
[0802]
(3)ecg无临床显著异常(包括qtcf《450ms)。
[0803]
(4)签署icf时年龄≥18岁且《65岁。
[0804]
(5)通常活跃,并且根据病史和身体检查来看健康状况良好。
[0805]
(6)预测肺功能为最低80%,包括β2-激动剂后的fev1、tlc、dco、feno和用脉搏血氧定量的6-mwt。
[0806]
(7)胸部x射线无临床显著异常。
[0807]
排除标准
[0808]
满足以下任一标准的受试者没有资格参与本研究:
[0809]
(1)在前6个月内入组氯硝柳胺研究。
[0810]
(2)临床显著过敏(如由研究者判断)或者对氯硝柳胺或相关化合物、所用任何赋形剂或利多卡因有显著不良反应史。
[0811]
(3)可能干扰吸入ip的潜在病症。
[0812]
(4)目前有急性或慢性病症(包括copd、哮喘或其他严重呼吸疾病、cv疾病、糖尿病、肥胖症、恶性和自身免疫性疾病),除非研究者认为临床上不相关且稳定。
[0813]
(5)肾损伤(egfr(通过cpk-epi估计的egfr)《60ml/min/1.73m2)或肝损伤(如由研究者判断)。
[0814]
(6)存在使受试者“易受伤害”(如由gcp定义)的病症或者研究者认为将干扰提供知情同意或遵守研究程序/指令的能力或可能混淆对研究结果的解释或使受试者处于不当风险中的病症。
[0815]
(7)在前6个月吸烟或经常使用任何形式的尼古丁产品,包括电子烟、鼻烟、嚼烟、尼古丁胶等。
[0816]
(8)已知静脉穿刺困难或静脉通路不良。
[0817]
(9)ip给药前90天内的捐献或损失全血(》400ml)。
[0818]
(10)任何恶性肿瘤史,患有充分治疗的皮肤基底细胞/鳞状细胞癌的受试者除外。
[0819]
(11)给药前24小时内饮酒。
[0820]
既往或伴随疗法
[0821]
(12)给药前5个半衰期的任何全身和吸入疗法(允许绝经后妇女的激素替代疗法和激素避孕)。
[0822]
(13)在给药本发明的配制品或安慰剂之前90天参与任何临床试验。
[0823]
施用
[0824]
合格的工作人员将每天一次施用4ml 0.75%、2.0%或5.0%本发明的配制品或安
慰剂。
[0825]
使用en 13544-1认证的喷雾器进行吸入。
[0826]
研究持续时间
[0827]
受试者参与研究(不包括筛选期)大约3天,不包括正在进行的(s)ae或妊娠的潜在随访。
[0828]
评价的终点和标准
[0829]
主要终点
[0830]
·
用单剂量的本发明的配制品治疗的受试者的安全性评估。
[0831]
探索性终点(以进行事后分析):
[0832]
·
口咽微生物组变化。
[0833]
关键pk参数:
[0834]
·
血液中活性药物分子的最大数量(c
max
)。
[0835]
·
达到最大水平的时间(t
max
)。
[0836]
·
血液中药物浓度随时间变化的曲线下面积(auc)。
[0837]
临床试验方案—2期
[0838]
研究设计
[0839]
在患有中度covid-19的成人患者中评估用选定剂量(在上述健康志愿者中的前述1期研究中确定)的本发明的配制品进行qid(最终给药频率可以由smc基于队列1数据来调整)治疗的安全性并探索其功效的临床研究。
[0840]
44名covid-19受试者将入组两个连续队列:
[0841]
·
队列1:4名covid-19患者用本发明的配制品以选定浓度bid(2名受试者)或qid(2名受试者)治疗15天。
[0842]
·
队列2:40名covid-19患者,20名用本发明的配制品以选定浓度治疗,并且20名接受安慰剂,qid持续15天。
[0843]
这是一项适应性研究设计,其中安全性监测委员会(smc)负责裁定安全性信号并负责在队列2开始入组之前评估安全性。
[0844]
研究将从队列1中的患者筛选和入组开始。队列1的目的是确认给药在患者中的安全性和耐受性。为此,该队列中的所有四名受试者均将用本发明的配制品(开放标记,无安慰剂)进行治疗并入组一个中心,以确保在该中心内收集经验,并且负责的研究者与smc一起可以评估该队列的安全性。治疗将从bid治疗两名患者开始,他们将被跟踪48小时。如果观察到与研究产品(ip)存在可能、很可能或明确关系的安全性问题,则将召集smc进行裁定。如果未观察到安全性问题,或smc判断继续是安全的,则队列中的最后两名受试者可以开始qid治疗。一旦获得队列1中受试者的4天治疗的安全性数据,smc就将对其进行评估,以在队列2受试者开始入组之前确认安全性。队列2中的受试者将入组随机、双盲、平行组队列中的多个中心,以确保对安全性和功效进行公正评估。
[0845]
如果任一队列中的受试者经历与喷雾ip的吸入相关的咳嗽、不适和/或疼痛(达到研究者评估它对于施用将存在问题的程度),则研究者可决定可以在吸入ip之前施用吸入利多卡因。队列1中的第一名受试者应在没有利多卡因的情况下给药(除非本发明的配制品在健康志愿者中的前述1期研究已确定在给药前施用利多卡因应适于所有受试者),如果在
队列1或后续队列中观察到问题,则研究者可以决定对当前正在给药的队列中的剩余受试者施用利多卡因,并且smc应随后决定是否对研究中的所有剩余ip施用实施这一措施。
[0846]
对于有资格参加本研究的受试者,他们必须因sars-cov2检测呈阳性而确认的covid-19住院(可以在当地实验室根据标准进行分析。应收集备用样品以对病毒载量进行集中分析和半定量)。有资格的患者将患有中度疾病,其被定义为需要住院但需要不超过5l氧气(o2)/分钟,不需要通气,并且不需要收治到重症监护室(icu)。最后,有资格的受试者目前不能用其他探索性抗病毒治疗或其他研究产品进行治疗。
[0847]
ip或安慰剂将由医院的合格工作人员bid或qid施用十五天。
[0848]
将在筛选时、给药前、第7天和第14天(第一次给药当天指定为第0天)进行一般身体检查、血清化学和血液学取样以及尿分析。另外,将基于每日血氧定量测量结果和对临床呼吸状态的每日评估来评估安全性。将在筛选时、给药前、给药后24和48小时以及第7、14天收集ecg,并且将在整个研究期间收集ae。最后,将在给药前和第14天采集用于检测病毒和细菌的口咽拭子,用于对微生物组的潜在变化进行事后探索性分析。
[0849]
将在给药前、第一次给药后1/2、1、11/2、2、3、6、12、24和48小时以及第7天和第14天收集用于pk分析的血样。
[0850]
将基于对临床呼吸状态的每日评估、脉搏血氧定量(也收集用于安全性)和体温及其他流感症状描述来探索功效。在给药前(如果可行)、在第7天和第14天进行6分钟步行试验(6-mwt)和摄氧量测量。另外,每隔一天收集鼻咽拭子(并通过pt-pcr集中分析以实现病毒载量的半定量测量),并且在给药前、第7天和第14天收集鼻咽拭子(通过集中分析以检测病毒和细菌)。将在给药前、第7天和第14天收集血样以分析血清转化(igm到igg)的时间,并且将在给药前、给药后48小时以及第7天和第14天收集用于血清炎性生物标志物分析的样品(主要标志物:crp、白细胞;用于事后分析的探索性标志物:il1b、ifnγ、ip10、mcp1、gcsf、mip1a、tnfα(huang等人,“clinical features of patients infected with 2019novel coronavirus in wuhan,china”[中国武汉市2019新型冠状病毒感染患者的临床特征],the lancet[柳叶刀],第395卷,第102223期,第497-506页,2020年2月15日))。最后,如果在住院期间已收集胸部x射线或ct扫描,则应在第14天捕获类似图像。
[0851]
如果满足以下标准72小时,则认为受试者的covid-19被治愈:
[0852]
·
临床呼吸状态:正常(无症状,无需氧疗)。
[0853]
·
无发热。
[0854]
·
氧饱和度正常。
[0855]
·
连续2次鼻咽拭子的sars-cov-2检测呈阴性。
[0856]
如果患者被治愈,应停止ip(或安慰剂)治疗(并且如果研究者作出这样的决定,则受试者可出院)。受试者仍应按照事件时间表中所概述的来医院进行第14天检测(为了避免在复发的情况下传播病毒,受试者必须在第13天进行sars-cov2鼻咽拭子检测,并且如果确认呈阴性,才能进行第14天访视)。
[0857]
纳入标准
[0858]
只有满足以下所有纳入标准的受试者才有资格:
[0859]
1.签署知情同意书(icf)。
[0860]
2.在整个研究过程中禁欲或同意使用有效避孕方法的男性或未怀孕且非泌乳的
女性。女性在(第一次)给药前的尿β-人绒毛膜促性腺激素(hcg)妊娠测试必须呈阴性(绝经后(绝经被定义为连续12个月没有月经期且没有其他生物学或生理学原因可以被鉴定)或输卵管结扎/子宫切除术的妇女不需要进行妊娠测试且不需要同意使用避孕)。
[0861]
可接受的节育方法如下:
[0862]
·
宫内避孕器放置至少3个月。
[0863]
·
在(第一次)给药前至少3个月且一直持续到研究完成使用稳定激素避孕药。
[0864]
3.ecg无临床显著异常(包括qtcf《450ms)。
[0865]
4.签署icf时年龄≥18岁且《80岁。
[0866]
5.因sars-cov2检测呈阳性而确认的covid-19住院。
[0867]
6.患有中度疾病,其被定义为需要不超过5l氧气(o2)/分钟,不需要通气,并且不需要收治到重症监护室(icu)。
[0868]
7.在感染sars-cov-2之前,通常活跃,并且在其他方面根据病史和身体检查来看健康状况良好,如通过研究者的判断确定的。
[0869]
排除标准
[0870]
满足以下任一标准的受试者没有资格参与本研究:
[0871]
1.在前6个月内入组nen研究。
[0872]
2.临床显著过敏(如由研究者判断)或者对氯硝柳胺或相关化合物、所用任何赋形剂或利多卡因有显著不良反应史。
[0873]
3.可能干扰吸入ip的潜在病症。
[0874]
4.目前有急性或慢性病症(包括copd、哮喘或其他严重呼吸疾病、cv疾病、糖尿病、肥胖症、恶性和自身免疫性疾病),除非研究者认为临床上不相关且稳定。
[0875]
5.肾损伤(egfr《60ml/min/1.73m2)或肝损伤(如由研究者判断)。
[0876]
6.存在使受试者“易受伤害”(如由gcp定义)的病症或者研究者认为将干扰提供知情同意或遵守研究程序/指令的能力或可能混淆对研究结果的解释或使受试者处于不当风险中的病症。
[0877]
7.鼻区中有活动性或急性病毒感染(除sars-cov-2以外)和/或细菌感染。
[0878]
8.严重covid-19,其被定义为需要超过5l氧气/分钟、通气和/或收治到icu。
[0879]
既往或伴随疗法
[0880]
9.目前或既往(covid-19诊断后)暴露于探索性抗病毒治疗或其他ip。
[0881]
施用
[0882]
合格的工作人员将施用4ml选定剂量的本发明的配制品(在健康志愿者中的前述1期研究中确定)或安慰剂bid或qid(队列1)和qid(队列2)持续15天。
[0883]
可能被测试的最大剂量为5%的本发明的配制品qid。
[0884]
在吸入ip的受试者经历咳嗽、不适或疼痛的情况下,可在给药ip之前施用吸入利多卡因。
[0885]
通过使用en 13544-1认证的喷雾器进行吸入,并且将采取充分的措施以防止用喷雾器对被感染受试者给药导致sars-cov2扩散,例如通过使用具有间隔件或其他装置的喷雾器以确保来自受试者的呼出空气和痰液不能被雾化或通过在气密面罩内给药吸入。
[0886]
研究持续时间
[0887]
受试者参与研究(不包括筛选期)长达15天(不包括正在进行的(s)ae或妊娠的潜在随访)。
[0888]
功效变量
[0889]
功效将基于以下进行评估:
[0890]
·
临床呼吸状态的变化(包括需要氧疗)(每天)。
[0891]
·
sars-cov-2的根除(在鼻咽中)(每隔一天)。
[0892]
·
血氧饱和度的变化(每天)。
[0893]
·
体温和其他流感症状的变化(每天)。
[0894]
·
6-mwt的摄氧量(第7天和第14天)。
[0895]
·
胸部x射线或ct扫描(任选)(第14天)。
[0896]
·
血清炎性生物标志物(主要标志物:crp、白细胞;探索性标志物(用于事后分析):il1b、ifnγ、ip10、mcp1、gcsf、mip1a和tnfα(huang等人))的变化(第2、7和14天)。
[0897]
评价的终点和标准
[0898]
主要终点—第14天:
[0899]
·
qid治疗covid-19患者14天的安全性评估。
[0900]
次要终点:
[0901]
·
基于每日观察以及在第2天和第7天对qid治疗的covid-19患者的安全性评估。
[0902]
·
基于每日观察以及在第2天、第7天和第14天对bid治疗的covid-19患者的安全性评估。
[0903]
·
治疗结束时临床呼吸状态的变化(在量表上从0即无体征/症状到4即非常严重、需要插管)(每天)。
[0904]
·
临床呼吸状态之间的转换率(每天)。
[0905]
·
呼吸症状缓解的时间(每天)。
[0906]
·
脱离氧疗的时间(每天)。
[0907]
·
静息血氧饱和度的变化(每天)。
[0908]
·
序贯器官衰竭评估(sofa)评分(从0到24)(每天)。
[0909]
·
收治到icu的受试者比例(每天)。
[0910]
·
发热或其他流感症状减轻的时间(每天)。
[0911]
·
sars-cov-2根除时间(在鼻咽中测量)(每隔一天)。
[0912]
·
sars-cov-2病毒载量的变化(在鼻咽中测量)(每隔一天)。
[0913]
·
如通过胸部x射线或ct扫描(任选)评估的肺水肿/炎症减轻(第15天)。
[0914]
·
炎性血清生物标志物(crp、白细胞)正常化(第2、7和14天)。
[0915]
·
6-mwt的摄氧量变化(第7天和第14天)。
[0916]
探索性终点(以进行事后分析):
[0917]
·
口咽微生物组变化(第14天)。
[0918]
·
covid-19相关炎症的探索性血清生物标志物(il1b、ifnγ、ip10、mcp1、gcsf、mip1a和tnfα)。
[0919]
pk参数:
[0920]
·
血液中活性药物分子的最大数量(c
max
)。
[0921]
·
达到最大水平的时间(t
max
)。
[0922]
·
血液中药物浓度随时间变化的曲线下面积(auc)。
[0923]
功效分析
[0924]
探索性功效终点包括临床呼吸状态的变化、呼吸症状缓解的时间、脱离氧疗的时间、sofa评分、发热或其他流感症状的减轻、肺水肿/炎症的减轻、sars-cov-2根除时间、主要炎性血清生物标志物(crp、白细胞)的变化、血氧饱和度的变化,这些将呈现在表中以及用locf从基线到第14天随时间变化以图形方式呈现。另外,将在基线与分类变量的每个时间点之间提供变迁表。将绘制临床呼吸状态相对于基线的变化的累积分布函数(cdf),以确定治疗与安慰剂之间发生最佳分离的位置。
[0925]
将在符合方案(pp)分析集中针对所有上述主要和次要终点仅使用观察到的病例来重复上述相同分析。pp分析集将包括来自队列2受试者的数据,这些受试者被随机分组并且在整个ip施用期间没有影响功效评估的重要方案偏离(不包括健康志愿者)。
[0926]
实例12:2期临床试验
[0927]
可使用本文所述的氯硝柳胺乙醇胺或五氯柳胺配制品(诸如实例1中所述的配制品a)进行以下临床试验。
[0928]
临床试验方案
[0929]
本研究将要评估本发明的1%配制品在患有轻度至中度covid-19的受试者中的安全性和功效。其主要终点是至临床改善的时间(被定义为改良who顺序量表改善至少2级)。本试验具有适应性设计并且包括两个中间分析:1.基于在入组和住院的前20名患者中收集的数据进行安全性分析;2.基于在治疗的前80名受试者中通过病毒载量测量的抗病毒活性进行机制证明。这些分析将由smc进行,smc将建议作出以下两个决定:授权在家中治疗患者和决定完成研究。
[0930]
ii期研究将集中于主要作用方式是防止病毒复制的有可能对药物有反应的群体:因中度covid-19住院的患者以及不需要住院的具有流感样体征和症状的受试者(轻度covid-19)。
[0931]
所有入组的受试者将以每天两次的程序接受本发明的1%配制品或安慰剂,包括在每个鼻孔中喷雾150μl的研究产品,随后喷雾6ml的研究产品。所有受试者的治疗持续时间为14天,即使在临床治愈的情况下也是如此。在表现出covid-19的体征和症状恶化的患者中,除非满足排除标准,例如需要在重症监护室机械通气或住院,否则治疗应保持不变。
[0932]
为了证实本发明的1%配制品的安全性,本研究中包括的前20名受试者将在治疗的第一天住院(由研究者决定并根据呼吸或医学状态可以延长住院)。smc将分析在这些受试者中生成的所有安全性数据,并就不需要住院的受试者在家中由护士施用治疗的安全性提出建议。
[0933]
在80名受试者完成研究后(该数量在统计输入后进行修订),将对这些受试者进行软数据库锁定,并且将进行分析以通过基于病毒清除的时间(经由咽拭子或唾液取样测量,将确认最敏感和最特异的测试)确认对本发明的1%配制品的抗病毒终点的功效来提供机制证明。dmc将审查该分析的数据,如果没有发现抗病毒作用,则dmc可能会建议停止该研究,因为该研究是徒劳的。虽然机制分析的证明正在进行中,但其余受试者的招募将继续进行。
[0934]
研究群体
[0935]
有资格参加本研究的受试者的确认感染sars-cov-2的检测必须呈阳性,并且出现covid-19的体征和症状。他们目前不能用其他抗病毒治疗或其他研究产品进行治疗。允许标准护理治疗,并且应记录为伴随治疗。患有严重且不稳定的伴随病状的患者、需要有创机械通气或体外膜氧合的患者以及在重症监护室住院的患者不能入组。
[0936]
产品施用
[0937]
在本研究中,研究产品将由合格的人员在家中或在受试者被隔离收治的中心或在医院进行施用。合格的人员是专门接受过产品及其潜在风险培训的医师、医学生或护士。
[0938]
功效评估
[0939]
抗病毒功效将通过sars-cov-2滴度来评估,这些滴度通过pt-pcr从在基线处和每天直到d14收集的唾液或鼻咽样品中确定(最敏感和最特异的测试仍有待确认)。
[0940]
所有受试者的临床功效将基于流感样症状评分(由研究者和患者进行)、血氧定量、news2评分和covid-19严重程度(基于顺序量表)的评估进行。
[0941]
顺序量表源自who委员会定义的用于临床改善的量表,并且用于瑞德西韦研究。然而,该量表必须适于捕获更轻的严重程度。
[0942]
news2评分基于简单的累积评分系统,其中当患者在医院就诊或被监测时,将评分分配给常规实践中已经记录的生理测量结果。六个简单的生理参数构成了评分系统的基础:呼吸率、氧饱和度、收缩压、脉搏率、意识水平、体温(参见下文)。
[0943]
另外,将使用fda指南中定义的指标:
[0944]-全因死亡率
[0945]-呼吸衰竭(即需要机械通气、ecmo、无创通气或高流量鼻插管氧递送)
[0946]-基于明确定义和特定临床标准需要重症监护室(icu)级护理
[0947]-需要住院
[0948]-持续临床恢复(例如症状消退)—胸部x射线(或其他成像,例如ct扫描)和血清炎性生物标志物(主要标志物:crp)将被视为探索性量度。
[0949]
在病毒感染的活跃期不能进行急性呼吸功能测试。然而,如果患者情况允许,这些测试将在专门的呼吸单元中在病毒清除后、在治疗停止后两周和一个月进行。
[0950]
受试者的数量
[0951]
本研究将入选大约350名受试者(确切数量可在统计输入后确定),以确保能够很好地代表轻度至中度covid-19的不同水平的疾病严重程度。将通过仔细选择研究中心和参与医院单位来确保招募足够数量的患有轻度或中度covid-19的受试者。
[0952]
中期分析所需的样本量基于这样的假设,即与安慰剂相比,临床相关和医学上有意义的益处被定义为病毒清除的平均时间(被定义为连续2次阴性检测的第一天)有至少4天的差异。
[0953]
纳入标准
[0954]
只有满足以下所有纳入标准的受试者才有资格:
[0955]
1.年龄≥18岁且《80岁
[0956]
2.在整个研究过程中禁欲的男性或未怀孕且非泌乳的女性。女性在第1天的尿β-人绒毛膜促性腺激素(hcg)妊娠测试必须呈阴性。(绝经后或输卵管结扎/子宫切除术的妇
女不需要进行尿或血清妊娠测试且不需要同意使用避孕。)
[0957]
3.能够理解并提供签署的知情同意书。
[0958]
4.通过鼻咽拭子或唾液测试确认感染了sars-cov-2并且表现出covid-19的轻度至中度体征和症状。
[0959]
排除标准
[0960]
满足以下任一标准的受试者没有资格参与本研究:
[0961]
1.在前6个月内入组氯硝柳胺研究
[0962]
2.对氯硝柳胺过敏或者对氯硝柳胺或相关化合物或所用任何赋形剂有显著不良反应史。
[0963]
3.可能干扰吸入ip的潜在病症。
[0964]
4.目前有急性或慢性不稳定病症(包括呼吸疾病、cv疾病、糖尿病、肥胖症),除非研究者认为临床上不相关。
[0965]
5.存在研究者认为将干扰提供同意或遵守研究指令的能力或可能混淆对研究结果的解释或使受试者处于不当风险中的病症。
[0966]
6.除sars-cov-2以外的活动性或急性感染,包括细菌重复感染。
[0967]
7.重度covid-19,需要机械通气或收治到重症监护室。
[0968]
既往或伴随疗法
[0969]
8.第1天前一个月接受全身抗病毒治疗或其他研究产品。
[0970]
9.在第1天前三个月接受抗癌或免疫抑制药物。
[0971]
测试产品、剂量、施用方式和治疗持续时间
[0972]
护士、专门的医学学生或研究者将在每个鼻孔中施用150μl的1%本发明的配制品或安慰剂,随后喷雾6ml的1%本发明的配制品或安慰剂,每天两次,持续最多14天。
[0973]
研究持续时间
[0974]
受试者参与研究(不包括筛选期)14天,如果呼吸功能仍异常,则另外14天随访期延长至28天。
[0975]
功效变量
[0976]
抗病毒功效将基于以下进行评估:
[0977]
·
sars-cov-2的根除(在鼻咽中)
[0978]
·
病毒载量
[0979]
临床功效将基于以下进行评估:
[0980]
·
改良who顺序量表的变化
[0981]
·
流感样体征和症状的严重程度(包括发热)
[0982]
·
通过血氧定量评估的呼吸状态的变化(血氧饱和度)
[0983]
·
news2评分的变化
[0984]
·
胸部x射线(或其他成像,例如ct扫描)异常
[0985]
·
血清炎性生物标志物(主要标志物:crp)的变化
[0986]
·
随访期结束时的呼吸功能状态
[0987]
·
呼吸短促问卷与圣乔治呼吸问卷
[0988]
·
将进行特定的呼吸测试以评估肺功能的状态。
[0989]
pk变量
[0990]
将在第7天和第14天收集血样以测量研究产品施用前的谷浓度。
[0991]
评价的终点和标准
[0992]
主要终点
[0993]
至临床改善的时间(改良who顺序量表改善至少2级)
[0994]
次要终点
[0995]
·
基于经改良who顺序量表
[0996]
οd7和d14清除的受试者百分比(0分)
[0997]
οd7、d14和fu访视时出院的活体受试者百分比
[0998]
οd7、d14和fu访视时评分为≥6的受试者百分比
[0999]
οd7、d14和fu访视时不同评分内的分布
[1000]
ο恶化1级、2级、3级或以上的受试者百分比
[1001]
·
基于病毒采样
[1002]
ο病毒清除时间,其被定义为连续两次sars-cov-2阴性检测中第一次的时间
[1003]
ο每次访视时实现病毒清除的受试者百分比
[1004]
ο14天期间的平均病毒载量(病毒颗粒滴度的auc)
[1005]
ο14天期间的平均峰值病毒载量
[1006]
·
基于流感样评分
[1007]
ο流感样体征和症状的平均和最差严重度评分
[1008]
ο流感样体征和症状消失的时间
[1009]
·
基于血氧定量
[1010]
οd7和d14需要供氧的受试者百分比
[1011]
ο平均和最差血氧定量测量
[1012]
ο脱离氧疗的时间
[1013]
·
基于news2评分
[1014]
ο平均和最差news2评分
[1015]
·
基于sgrq
[1016]
ο平均评分和最差评分
[1017]
·
基于呼吸测试(vo2max,dco)
[1018]
οfu访视时具有正常功能的受试者比例
[1019]
οfu访视时与预测正常功能相比的平均降低
[1020]
·
如通过胸部x射线(或其他成像,例如ct扫描)评估的患有肺水肿/炎症的受试者百分比
[1021]
·
炎性血清生物标志物(crp、原降钙素)的平均变化
[1022]
将计算总群体以及2个亚群体(如在基线处评估的轻度和中度covid-19)的这些终点。
[1023]
量表和评分
[1024]
流感样症状量表
[1025]
医师或护士评估包括14个主要体征和症状,以0分(无)至3分(严重)的4分量表评
分,总分范围为0至42:
[1026]
发冷
[1027]
发热
[1028]
肌肉疼痛
[1029]
疲劳
[1030]
咳嗽
[1031]
呼吸短促
[1032]
打喷嚏
[1033]
没有食欲
[1034]
头痛
[1035]
鼻塞
[1036]
耳朵痛
[1037]
恶心、呕吐
[1038]
嗅觉或味觉丧失
[1039]
喘息。
[1040]
使用flu-pro(powers等人,performance of the influenza patient-reported outcome(flu-pro)diary in patients with influenza-like illness(ili).[流感患者自述结局(flu-pro)日记在流感样疾病(ili)患者中的表现]plos one[美国科学公共图书馆].2018;13(3):e0194180)或fluiiq(osborne等人,development and validation of the influenza intensity and impact questionnaire(fluiiq
tm
).[流感强度和影响调查问卷(fluiiq
tm
)的开发和验证]value health[健康价值].2011;14(5):687-699)完成患者自我评估。
[1041]
改良who顺序量表
[1042][1043][1044]
news2评分
[1045][1046]
news阈值和触发
[1047]
new评分临床风险响应累积评分为0-4低基于病房的响应任何单个参数的评分为3低-中基于病房的紧急响应累积评分为5-6中紧急响应的关键阈值累积评分为7或更多高紧急或应急响应
[1048]
实例13:吸入氯硝柳胺的i期试验
[1049]
进行一项随机、安慰剂对照、双盲、多剂量1期试验以评估实例6的表5中所示的配制品(或包含1.0%w/w氯硝柳胺的等效配制品,余量为水)在健康志愿者中的安全性。
[1050]
方法
[1051]
试验设计和监督
[1052]
这是一项评估氯硝柳胺乙醇胺在健康志愿者(hv)中的安全性并探索其pk参数的单中心、介入性、双盲(每个队列中第一名前哨受试者为开放标签)、安慰剂对照、1期研究。本研究由五个队列组成,每个队列都在咨询安全性监测委员会(smc)后一个接一个地开始。只有在先前收集的数据没有引起安全性问题时,每个队列才开始。44名有资格的hv将入组五个连续队列用于剂量发现,每个队列通常要经过筛选,然后在给药前一天或两天进行延长呼吸锻炼。如果满足所有纳入和不排除标准,则完成给药,然后进行24小时监测。48小时后,所有参与者都进行与研究纳入之前相同的延长呼吸锻炼。这44名健康对照中有34名接受研究产品(ip),10名接受安慰剂。本研究部分以开放标签设计进行(队列1-4中的第一名受试者作为哨点受试者)并且部分以双盲设计进行(队列1-4中的后续受试者和队列5中的所有受试者)。不同队列的剂量在表12中显示。
[1053]
表12:队列及其剂量和治疗持续时间总结
[1054][1055][1056]
对于队列1-4,一名受试者在第一天(周一)给药ip,并在诊所入院时跟踪24小时以评估新剂量的安全性。接下来的周三至周五,在cfas进行延长肺功能测量的安全性访视。对于队列5,患者总共接受5次施用并在试验地点停留3天(周一或周二至周四或周五),包括过夜。在队列5中,由于剂量与队列4相同,因此所有患者均被设盲并随机分组。在接下来的周四至周六,在cfas进行延长肺功能测量的安全性访视。
[1057]
在整个研究过程中,两种ip均由合格的研究人员施用。按照随机化编号将每种治疗分配给特定的受试者。一个队列接另一个队列依次进行筛选和入组。根据队列的随机化列表,在第0天为每名有资格的受试者按升序分配随机化编号。队列1、2、3和4中的第一编号始终是活动性的(开放标签),剩余的由6名活动性和2名安慰剂组成(n=9)。对于队列5,编号由6名活动性和2名安慰剂组成(n=8)。
[1058]
资格
[1059]
以下受试者有资格参与本研究:签署知情同意书(icf),在整个研究过程中禁欲或同意使用有效避孕方法的男性或未怀孕且非泌乳的女性,在给药之前的尿β-人绒毛膜促性腺激素(hcg)妊娠测试呈阴性和不需要同意使用避孕的女性,心电图(ecg)无临床显著异常(包括qtcf《450ms),签署icf时年龄为≥18岁且《65岁,通常活跃,并且根据病史来看健康状况良好,当前无慢性疾病且身体检查正常,预测肺功能为最低80%(包括β2-激动剂后呼气量(fev1)、静态容积(tlc)、扩散容量(dco)和用脉搏血氧定量的正常心肺运动测试(cpet)),以及ecg的健康评分》20mlo2/kg*min(对于女性)和》25mlo2/kg*min且在运动期间
没有临床上重要的心律失常或减饱和,此外胸部x射线无临床显著异常。排除以下受试者:具有临床显著过敏,当前有急性或慢性病症,肾损伤,可能干扰吸入ip的潜在病症,以及在给药前24小时内饮酒。
[1060]
安全性评估和结局测量
[1061]
通过以下参数评估安全性:不良事件(ae)报告、一般安全性评估、一般身体检查、生命体征、临床实验室分析(包括尿分析、血液学和血清化学)、ecg、肺活量、tlc、dco、fev1、可逆性、呼气一氧化氮分数(feno)测试、静息脉搏血氧定量以及用ecg和脉搏血氧定量的cpet。
[1062]
主要终点被定义为每个队列和治疗组中的ae频率以及测量的所有安全性变量相对于基线的变化和超出范围值的频率。此外,通过测定血液中活性药物分子的最大浓度(cmax)、达到最大水平的时间(tmax)、血液中药物水平随时间变化的曲线下面积(auc)和半衰期(t1/2)来评价施用后的药代动力学。
[1063]
主要终点
[1064]
·
每个队列和治疗组中的ae频率
[1065]
·
测量的所有安全变量相对于基线的变化和超出范围值的频率
[1066]
·
除了在整个研究期间收集ae/sae外,还将经由临床检查、生命体征评估、ecg和实验室分析(血清化学、血液学和尿分析)来评估一般安全性。
[1067]
·
通过测量肺活量、呼气量(一秒用力呼气量,fev1)、静态容积(总肺活量,tlc)、扩散容量(dco)、呼出一氧化氮(feno)和静息脉搏血氧定量监测肺功能。
[1068]
次要终点—pk
[1069]
·
血液中活性药物分子的最大浓度(c
max
)
[1070]
·
达到最大水平的时间(t
max
)
[1071]
·
血液中药物浓度随时间变化的曲线下面积(auc)
[1072]
·
半衰期
[1073]
统计分析
[1074]
样本量被认为足以满足研究目标和评估治疗安全性,但不是基于统计功效考虑。区分两组用于分析的群体,即安全组和pk组。安全性分析组包括来自接受任何量的ip的所有入组受试者的数据。报告连续变量和度量值的描述性统计,包括受试者数量、平均值(μ)、标准偏差(sd)、中值、最小值(min)和最大值(max)。分类变量报告为频率和百分比。对于度量值,报告自基线的绝对变化,但示出fev1百分比变化。以探索性方式测试差异的显著性。未对缺失数据进行插补。来自接受安慰剂的患者的数据在各队列中组合。对于所有分析,统计软件(版本16)用于数据库锁定时可用的最新子版本。
[1075]
pk分析集包括来自被治疗且没有影响pk评估的缺失数据的受试者的数据。具有至少一种可量化药物浓度的受试者包括在pk分析中。未对缺失数据进行插补。所有药代动力学参数均使用非隔室分析(nca)通过验证安装软件版本8.1来计算。
[1076]
结果
[1077]
试验群体
[1078]
四十四名受试者被随机分组,其中34名被分配为治疗组,10名被分配为安慰剂组。
[1079]
安全性结局
[1080]
本研究中未报告严重ae或提前终止。总共有32名受试者在研究期间经历了一起或多起ae。大部分ae属于“呼吸、胸部和纵隔疾病”类别,其中“上呼吸道刺激”是最常见的ae描述(26名受试者中发生45起事件,59%)并且对应于雾化期间和雾化后的喉咙刺激。此外,鼻应用没有得到关于局部耐受性的任何发现。对于雾化程序,在耐受性方面存在剂量依赖性差异。
[1081]
然而,报告的所有ae均为轻度,并且在没有治疗的情况下在一至两个小时内自发地完全消失。对于大多数受试者,在吸入程序的前5-10分钟期间症状更为明显。值得注意的是,在多次施用组中,大多数受试者报告在重复给药的情况下症状随时间推移减轻。在施用药物期间,一些受试者显示无症状,但fev1显著降低(》200ml和》12%),这在用β2激动剂的情况下是可逆的,而没有受试者经历fvc降低,也没有受试者经历dco降低。
[1082]
在4名受试者中显示出无症状气道阻塞(fev1下降),在最高剂量(6ml)组中4名受试者中有3名发生。这些事件均对吸入β2模拟物治疗有反应。
[1083]
在队列5中,平均(sd)摄氧量在药物施用前未改变(3401(551)和3359(516)(ns)),并且在两次测量时平均工作载量相似(309(56)和300(54)(ns))。同样,施用β2-激动剂后的fev1为116(16)药物前值和药物施用后111(17)(ns),fvc分别为117(14)和114(13)(ns),并且tlc分别为104(11)和104(10)(ns)。发现dco显著降低(102(10)和90(6),p=0.01),但都没有显示超过20%的临床显著变化。药物后安全性后肺功能测量显示,1名参与者在施用β2-激动剂后的fev1测量结果有无症状降低(从124%pred到108%pred),两名出现显著的可逆性(18%和12%),并且4名具有气道炎症增加的迹象(被识别为呼气中一氧化氮浓度分数[feno]的变化)(变化为11ppb、37ppb、37ppb、28ppb)(其中一名在药物施用前具有升高的feno),这些参与者均在队列5中。队列1至5中没有显示出tlc或vo2max的临床显著变化。队列3中的一名(15%)和队列5中的3名(19%、18%、16%)显示出dco降低,但在所有情况下,kco在临床可接受的限度内均未变化。
[1084]
所有(但只有一起)与异常测试值相关的ae均在队列4或队列5中以最高剂量报告,所有这些事件均在活动性组中报告并且研究者认为这些事件可能、很可能或明确与测试产品或程序相关。
[1085]
药代动力学
[1086]
药代动力学分析证明了氯硝柳胺乙醇胺的剂量比例特征(图2)。单次剂量应用后的最大血浆浓度(c
max
)和曲线下面积(auc
0-8
)水平为238.9ng/ml(平均值)和509.0hr*ng/ml(平均值)。在队列5中重复给药后,报告了c
max
和auc
0-8
水平为337.3ng/ml和401.2hr*ng/ml,表明在重复给药后氯硝柳胺乙醇胺没有累积。
[1087]
原始数据表明在重复吸入剂量后血液中的峰值浓度为337ng/ml(平均值)[范围:29-506ng/ml]。半衰期在队列4中显示为2小时(平均值),并且在队列5中显示为2.7小时(平均值)。这在口服给药氯硝柳胺后报告的全身暴露范围内(参见图3)。来自人的全身pk数据(包括剂量反应)与来自绵羊pk研究的数据非常一致(参见图4)。
[1088]
作为初步结论,本发明的配制品似乎在用批准的2g氯硝柳胺口服剂型(yomessan)观察到的范围内提供全身暴露。另外,给定施用途径和绵羊elf pk数据,肺中的浓度显著高于口服氯硝柳胺,因此与氯硝柳胺的口服剂型相比,该配制品将代表covid19的优选治疗。
[1089]
实例14:3期临床试验
[1090]
这是一项评估1%氯硝柳胺乙醇胺溶液(经由喷雾器作为鼻喷雾剂施用)在患有轻度和中度covid-19的住院参与者中的安全性和有效性的随机、平行组、安慰剂对照、设盲、多中心、3期治疗研究。本研究选择的剂量是每天两次吸入3ml 1%氯硝柳胺乙醇胺(相当于27.4mg氯硝柳胺)和150μl 1%鼻喷雾剂(每个鼻孔一次,总计2.6mg氯硝柳胺)。
[1091]
研究群体
[1092]
在本研究的背景下,轻度和中度covid-19感染由fda指南如下定义:
[1093]
轻度:
[1094]
·
通过标准rt-pcr测定或等效测试进行的检测呈阳性
[1095]
·
轻度疾病的症状可以包括发热、咳嗽、喉咙痛、不适、头痛、肌肉疼痛、gi症状,没有呼吸短促或呼吸困难
[1096]
·
没有指示中度、重度或危重严重程度的临床体征
[1097]
中度:
[1098]
·
通过标准rt-pcr测定或等效测试进行的检测呈阳性
[1099]
·
中度疾病的症状可以包括轻度疾病的任何症状或劳累性呼吸短促
[1100]
·
有提示covid-19中度疾病的临床体征,诸如呼吸率≥20次呼吸/分钟、海平面的室内空气中spo2》93%、心率≥90次/分钟
[1101]
·
没有指示重度或危重严重程度的临床体征
[1102]
纳入标准
[1103]
只有以下所有标准均适用时,参与者才有资格纳入本研究:
[1104]
1.参与者在签署知情同意书(icf)时必须≥18岁。
[1105]
2.满足如由fda指南定义的covid-19的轻度至中度体征和症状标准
[1106]
3.入组前covid-19的症状或体征不超过4天
[1107]
4.进行了检测确认感染sars-cov-2
[1108]
5.目前在住院
[1109]
6.在整个研究过程中禁欲或使用避孕的男性或未怀孕且非泌乳的女性。女性在第1天的尿β-人绒毛膜促性腺激素妊娠测试必须呈阴性。(绝经后或输卵管结扎/子宫切除术的妇女不需要进行妊娠测试且不需要同意使用避孕。)
[1110]
7.能够签署知情同意书并愿意遵守知情同意书和本方案中列出的要求和限制
[1111]
排除标准
[1112]
如果以下任何标准适用,则将参与者从研究中排除:
[1113]
1.除sars-cov-2以外的活动性或急性感染,包括继发性细菌性肺炎
[1114]
2.存在如研究者判断将危及参与者的安全的急性或慢性病症
[1115]
3.alt或ast水平》正常上限的5倍
[1116]
4.重度或危重covid-19疾病,即需要无创或有创机械通气、使用高流量氧气装置或ecmo
[1117]
5.可能干扰吸入imp的潜在病症
[1118]
6.对氯硝柳胺过敏或者对氯硝柳胺或相关化合物或所用任何赋形剂有显著不良反应史
[1119]
7.在第1天前一个月内和在整个研究期间使用其他研究产品
[1120]
8.在前6个月内入组配制品的另一项研究
[1121]
9.存在研究者认为将干扰提供同意或遵守研究指令的能力或可能混淆对研究结果的解释的病症。
[1122]
施用
[1123]
所有入组的参与者将在住院期间以每天两次的程序接受1%氯硝柳胺乙醇胺喷雾器溶液或安慰剂和1%氯硝柳胺乙醇胺鼻喷雾溶液或安慰剂,持续长达10天。该治疗包括在每个鼻孔中以一次喷射130μl溶液的形式施用1%鼻喷雾溶液或安慰剂,随后雾化3ml 1%溶液或安慰剂。出院时停止治疗。
[1124]
功效评估
[1125]
用于临床改善的改良顺序量表将由研究者完成。量表在下表13中提供。将在住院期间每天测定spo2值,并由诊所工作人员在第28天测定该值。将为在出院当天spo2异常(《95%)的受试者提供带有说明的脉搏血氧仪。参与者将在家中测量spo2,并在每天治疗后访视时报告该值。将在住院期间每天收集痰液或鼻咽拭子以检测sars-cov-2的滴度,并由诊所工作人员在第28天进行该过程。将在筛选时、第10天(或出院当天)和第28天访视时收集样品以用于炎性生物标志物的实验室分析。
[1126]
表13:用于临床改善的改良顺序量表
[1127]
[1128][1129]a可能存在持续疲劳、努力呼吸困难、关节或胸痛、咳嗽或持续嗅觉或味觉功能障碍。
[1130]b存在休息时疲劳或呼吸困难,妨碍一些日常活动。如果参与者出院,但仍需要在家中进行密切医学监测或氧疗,则应将他们归类为3分。
[1131]c需要住院进行医疗监督;可以包括处于高并发症风险(例如,由于并存病)的参与者或从疾病中恢复但在出院前需要医疗监督的参与者。
[1132]d需要以下中的至少一项:气管插管和机械通气、通过高流量鼻插管递送氧气(经由加强型鼻插管以》20l/min的流速递送加热、加湿氧气,递送的氧气分数≥0.5)、无创正压通气、ecmo或临床诊断呼吸衰竭(即,临床需要前述疗法中的一种,但在资源限制的情况下
不能施用前述疗法)。
[1133]
e收缩压《90mmhg或舒张压《60mmhg或者需要血管加压药。
[1134]
药代动力学和生物标志物
[1135]
将收集血浆、血清或全血样品以测量氯硝柳胺浓度。
[1136]
将测试样品的c反应蛋白和原降钙素,以评价它们与观察到的临床反应的关联。
[1137]
统计考虑
[1138]
主要功效结局(至临床改善的时间)的无效假设和替代假设如下:
[1139]
h0:h1(t)=h2(t)
[1140]
h1:h1(t)≠h2(t)
[1141]
其中:
[1142]
h1(t)是吸入组中的危险函数
[1143]
h2(t)是安慰剂组中的危险函数
[1144]
对中度和重度covid-19受试者的瑞德西韦研究发现,接受瑞德西韦和安慰剂的受试者的中位恢复时间(在顺序量表上被定义为1(未住院,活动不受限)、2(未住院,活动受限,在家中有氧气需要或两者)或3(住院,不需要补充氧并且不再需要正在进行的医疗护理))分别为11天和15天,危害比为1.32。由于本研究将招募患有轻度和中度covid-19的参与者,结局是改善而不是恢复,并且一些参与者可能正在接受伴随瑞德西韦,因此预计至临床改善的时间将比瑞德西韦研究中的更短。假设中位至临床改善的时间在吸入1%组中为9.7天并且在安慰剂组中为13.55天(危害比为1.40),功效为80%,双侧α=0.05,随机化比例为2:1,则总共需要328起事件。假设事件率为90%并且失访率为5%,则需要大约387名受试者入组。
[1145]
主要终点
[1146]
主要功效结局是itt分析集中的至临床改善的时间(改良顺序量表改善至少2级)。对估计目标的描述包括四个属性:群体、要针对每名参与者获得的变量(或终点)、如何解释伴发事件(ice)的规范以及变量的群体级别总结。至临床改善的时间的估计目标属性将在sap中详细提供。
[1147]
卡普兰-梅尔(kaplan-meier,km)分析将用于评估吸入组和安慰剂组中的至临床改善的时间。未改善(包括死亡)或失访的参与者将在最后一次评估当天或死亡当天被删失。接受瑞德西韦抢救疗法的参与者将在开始瑞德西韦治疗当天被删失。将在每个治疗组中确定至临床改善的时间的第25百分位数、中位数和第75百分位数以及95%置信区间(ci)。也将使用具有治疗协变量即covid-19严重程度(轻度和中度)、国家/地理区域和年龄(《75岁和≥75岁)的cox回归模型来确定临床改善的危害比和95%ci。将提供km生存曲线。
[1148]
将对covid-19严重程度(轻度和中度)、国家/地理区域和年龄(《75岁和≥75岁)的随机化因素进行分层对数秩检验,以检验两个治疗组之间的存活曲线差异。如果p值《0.05(即,双侧α水平为0.05),则无效假设将被拒绝。
[1149]
还将在由covid-19严重程度(轻度和中度)、国家/地理区域、年龄(《75岁和≥75岁)和伴随瑞德西韦的接收(是和否)定义的亚组中以及在m-itt和pp分析集中进行主要功效结局(至临床改善的时间)的分析。其他亚组分析将在sap中定义。
[1150]
次要终点
[1151]
以下关键次要分析将在itt分析集中完成。为了控制总体i类错误率的膨胀,将使用分层测试程序。如果宣布主要功效结局具统计显著性,则将按以下列出的顺序对关键次要功效结局进行测试。只有宣布正在测试的前一次要结局具有统计显著性(双侧α=0.05)时,测试才会继续进行到下一个次要结局。
[1152]
·
治疗组将在第14天呈现来自改良顺序量表的评分的频率分布。将使用具有治疗协变量和每个随机分层因素的比例优势逻辑回归来测试治疗组之间的差异的统计显著性。将呈现治疗的比值比和95%ci。
[1153]
·
治疗组将呈现被定义为需要高流量氧气、机械通气、ecmo或无创通气的呼吸衰竭受试者的数量和百分比。针对随机分层因素进行分层的cochran-mantel-haenzsel检验将用于确定治疗组之间的统计显著性。
[1154]
·
km方法将用于分析不需要氧疗或恢复到covid-19疾病之前所需的氧水平的时间,其中未恢复到covid-19之前的氧水平、死亡或失访的参与者在最后评估的当天或已知活着的最后一天被删失。接受瑞德西韦抢救疗法的参与者将在开始瑞德西韦治疗当天被删失。将提供卡普兰-梅尔曲线。将确定第25、第75百分位数和不需要氧疗或恢复到covid-19之前所需的氧水平的中位时间以及95%ci。也将使用具有治疗协变量即covid-19严重程度(轻度和中度)、国家/地理区域和年龄(《75岁和≥75岁)的cox回归模型来确定危害比和95%ci。将提供km生存曲线。将使用按随机分层因素分层的对数秩检验来检验存活曲线之间的差异的统计显著性。
[1155]
·
卡普兰-梅尔方法将用于分析存活时间,其中仍然活着或失访的参与者在已知活着的最后一天被删失。将提供卡普兰-梅尔生存曲线。治疗组将确定第25、75百分位数和中位存活时间以及在第28天存活的概率。将使用z统计和标准偏差的greenwoods公式来确定治疗组之间在第28天存活的概率方面的统计学显著差异。
[1156]
将对关键次要终点进行额外分析。这些包括在由随机分层因素定义的亚群体中以及在m-itt和pp分析集中的分析。还将对其他次要终点进行总结,包括:
[1157]
·
将使用km方法总结病毒清除时间,其被定义为连续2次sars-cov-2阴性检测中第一次的时间。没有病毒清除(包括死亡)或失访的参与者将在最后一次病毒检测当天或死亡当天被删失。接受瑞德西韦抢救疗法的参与者将在开始瑞德西韦治疗当天被删失。将在每个治疗组中确定病毒清除时间的第25百分位数、中位数和第75百分位数以及95%ci。也将使用具有治疗协变量即covid-19严重程度(轻度和中度)、国家/地理区域和年龄(《75岁和≥75岁)的cox回归模型来确定病毒清除的危害比和95%ci。将提供km生存曲线。
[1158]
·
将由km分析确定在测量病毒清除的每个时间点具有病毒清除的概率。
[1159]
·
将提供对10天治疗期间平均病毒负荷(病毒颗粒滴度的auc)的描述性统计。
[1160]
·
将提供对10天治疗期间峰值病毒载量的描述性统计。
[1161]
三级/探索性终点
[1162]
将在itt分析集中对治疗组的如下其他功效结局进行总结,以支持主要和次要功效结局的发现:
[1163]
·
治疗结束/出院时和第28天来自改良顺序量表的评分的频率分布。
[1164]
·
第14天、治疗结束/出院时和第28天清除(改良顺序量表=0)或几乎清除(改良顺序量表=1)的参与者的数量和百分比。
[1165]
·
将使用km方法总结清除/几乎清除时间。没有清除/几乎清除(包括死亡)或失访的参与者将在最后一次评估当天或死亡当天被删失。接受瑞德西韦抢救疗法的参与者将在开始瑞德西韦治疗当天被删失。将在每个治疗组中确定清除/几乎清除时间的第25百分位数、中位数和第75百分位数以及95%ci。也将使用具有治疗协变量即covid-19严重程度(轻度和中度)、地理区域(美国和非美国)和年龄(《75岁和≥75岁)的cox回归模型来确定清除/几乎清除的危害比和95%ci。将提供km生存曲线。
[1166]
·
第14天和第28天改良顺序量表改善至少1级(低于基线=0)的参与者的数量和百分比。
[1167]
·
第14天和第28天恶化(被定义为改良顺序量表评分高于基线)的参与者的数量和百分比。
[1168]
·
住院期间任何时间在icu住院的参与者的数量和百分比。
[1169]
·
住院期间任何时间需要氧疗的参与者的数量和百分比。
[1170]
·
住院期间任何时间接受机械通气的参与者的数量和百分比。
[1171]
·
改良顺序量表改善至少2级的出院参与者的数量和百分比。
[1172]
·
改良顺序量表改善至少2级的出院时间。未出院(包括死亡)或失访的参与者将在最后一次评估当天或死亡当天被删失。接受瑞德西韦抢救疗法的参与者将在开始瑞德西韦治疗当天被删失。将在每个治疗组中确定出院时间的第25百分位数、中位数和第75百分位数以及95%ci。也将使用具有治疗协变量即covid-19严重程度(轻度和中度)、地理区域(美国和非美国)和年龄(《75岁和≥75岁)的cox回归模型来确定出院的危害比和95%ci。将提供km生存曲线。
[1173]
·
对于需要氧疗的参与者,对持续恢复到基础氧气需求的时间的描述性统计。
[1174]
·
对于显示出临床改善的参与者,被定义为到第28天因covid-19再次住院的复发的数量和百分比。
[1175]
·
第14天、治疗结束/出院时和第28天spo2值为≤91%、92-93%、94-95%和≥95%的参与者的数量和百分比。
[1176]
·
第14天、治疗结束/出院时和第28天呼吸率(bpm)为≤8、9-11、12-20、21-24个≥25的参与者的数量和百分比。
[1177]
·
在c反应蛋白和原降钙素中测量的从基线到每个时间点的平均变化。
[1178]
·
使用亚基因组rna测定测量的在每个时间点具有病毒清除的参与者的数量和百分比。
[1179]
实例15:covid-19无症状或轻度症状患者的治疗
[1180]
可使用本文所述的配制品(诸如实例1中所述的配制品a)进行以下临床试验。
[1181]
该2期研究的总体目标是证明治疗最近证实感染sars-cov-2的无症状或轻度症状患者的益处,针对主要累及上呼吸道的早期疾病患者。
[1182]
主要目标是评估:
[1183]
·
covid-19症状的发展和进展
[1184]
·
施用配制品的安全性
[1185]
·
在第5天和第10天通过鼻咽(np)sars-cov-2rt-pcr测试评估病毒脱落
[1186]
·
对长期covid症状的影响
[1187]
·
施用后谷氯硝柳胺值的测定
[1188]
主要目标:
[1189]
·
评估预防疾病进展的治疗功效
[1190]
·
评估治疗的安全性
[1191]
次要目标:
[1192]
·
评估治疗对covid-19症状的功效
[1193]
·
评估治疗对sars-cov-2病毒载量的影响
[1194]
·
评估治疗对covid-19从索引病例传播的影响
[1195]
主要终点:
[1196]
·
到第10天症状相对于基线的变化,其被定义为从基线到第10天比较配制品与安慰剂的累积食品和药物管理局(fda)covid-19问卷评分。
[1197]
·
如通过不良事件、生命体征、血液学和临床化学评估的配制品鼻喷雾剂的安全性。
[1198]
次要终点:
[1199]
·
改良fda covid-19问卷中症状的最大强度
[1200]
·
如fda covid-19问卷所定义的无covid-19症状的天数
[1201]
·
患者报告的整体印象项目评估a)恢复到平时的健康状况;b)恢复日常活动;以及c)第10天的总体covid-19相关症状:如fda covid-19问卷中所概述的患者报告的整体印象项目的实例
[1202]
·
第10天保持无症状的患者比例
[1203]
·
需要到急救(uc)或急诊科(ed)设施就诊或者因covid-19的体征或症状住院的患者比例
[1204]
·
收治到重症监护室(icu)的患者比例
[1205]
·
第10天sars-cov-2病毒载量相对于基线的变化,如通过定量逆转录聚合酶链式反应(qrt-pcr)评估的。
[1206]
·
第5天sars-cov-2病毒载量相对于基线的变化,如通过qrt-pcr评估的。
[1207]
·
如fda covid-19问卷所定义的长期covid-19症状的存在。
[1208]
探索性终点:
[1209]
·
在who 11分顺序量表中达到评分≥2的时间
[1210]
·
在11分who顺序量表中达到评分≥2的患者比例
[1211]
·
直至第30天向家庭接触者传播sars-cov-2的患者百分比
[1212]
·
通过阳性或阴性np sars-cov-2逆转录聚合酶链式反应(rt-pcr)测试的结果评估的病毒脱落
[1213]
·
10天后症状持续/出现(长covid-19)
[1214]
·
患者报告的整体印象项目评估a)恢复到平时的健康状况;b)恢复日常活动;以及c)第10天和第30天的总体covid-19相关症状。
[1215]
总体研究设计
[1216]
鉴于鼻用化合物不太可能根除已经到达呼吸树下部或以其他方式已经全身传播的病毒,本研究将集中于患有主要涉及上呼吸道的无症状或轻度症状疾病的sars-cov-2阳
性患者。患者群体被定义为包括没有症状或具有诸如鼻塞、流涕、结膜炎、喉咙痛、味觉丧失、嗅觉丧失、头痛等症状的患者。具有提示下呼吸道参与或全身参与的症状(诸如咳嗽、感觉发热、发冷、发抖、感觉热、精力不足、疲惫、身体疼痛、疲劳、呼吸短促、没有食欲、恶心、呕吐或腹泻)的个体被排除。最多50%的参与者将患有轻度症状的covid-19疾病,其余参与者将没有症状。
[1217]
将在fda covid-19问卷上收集一组复合症状的发生,由患者每天在同一时间(
±
1小时)填写。时间应方便患者,但不能在醒来后2小时内完成。应在每天服用研究药品(imp)之前完成问卷。在治疗期间,将由hcp每隔一天通过电话直接收集反应。将对所有患者进行随访,直至第30天。在第30天,hcp将询问患者以评价他们在过去一周内的症状,并记录该周内的最高严重度以评价长期covid-19的存在。
[1218]
在第10天和第30天,通过以下问题评价患者报告的整体印象项目,该患者报告的整体印象项目评估a)恢复到平时的健康状况;b)恢复日常活动;以及c)总体covid-19相关症状(如fda covid-19问卷中概述的患者报告的整体印象项目的实例):
[1219]
·
您是否已恢复到平时的健康状况(在您感染covid-19之前)?是或否
[1220]
·
您是否已恢复日常活动(在您感染covid-19之前)?是或否
[1221]
·
在过去24小时里,总体covid-19相关症状在最严重时的严重程度如何?无、轻度、中度或重度。
[1222]
将由hcp在筛选时、第1天和每隔一天直到第10天和第30天使用who顺序11分量表进行临床状态的评估。
[1223]
将通过使用hcp询问的一组问题来评估防止向家庭接触者传播sars-cov-2的治疗的能力。在治疗和随访期间(第1、3、5、7、9、10和30天),将每隔一天通过电话从hcp收集反应。在第30天进行随访电话访视时,将收集关于向家庭接触者传播的ae和信息。在显示covid-19的体征和症状恶化的参与者中,治疗应持续至第10天,除非研究者出于安全原因决定停止治疗。由于参与者的呼吸状态,研究者还可决定继续治疗是不可行的。
[1224]
在第1-10天期间,将通过以下问题每天评估施用治疗后不适的存在和持续时间:服用鼻喷雾剂后,您是否有任何不适?如果有,症状是什么?持续多久?反应可能是ae报告的原因。
[1225]
个体患者的研究持续时间将如下:
[1226]
·
筛选期:长达2天
[1227]
·
治疗期:连续10天(即第1天至第10天)
[1228]
·
随访期:患者首次接受研究药物治疗后30天(即第30天)
[1229]
纳入标准
[1230]
1.患者为≥45岁的男性或女性。
[1231]
2.患者能够理解并提供签署的知情同意书。
[1232]
3.通过对在随机分组前3天内采集的样品进行侧流抗原检测或rt-pcr对患者进行检测,以确认感染sars-cov-2。
[1233]
4.患者没有症状或具有以下症状中的一种或多种:鼻塞或流涕、结膜炎、喉咙痛、味觉丧失、嗅觉丧失或头痛(在fda covid-19问卷中输入)。流涕和结膜炎也是可接受的。
[1234]
5.性伴侣为有生育能力的妇女(wocbp)的男性必须同意从第一剂量的筛选时间开
始到最后剂量的研究药物后至少30天遵守以下避孕要求中的一项:
[1235]
a.输精管结扎并记录有无精子症。
[1236]
b.性禁欲(被定义为从筛选时间至最后剂量的剂研究药物后至少30天不与异性性交)
[1237]
c.男性使用避孕套加上伴侣使用以下避孕选项中的一种:避孕皮下植入物;宫内避孕器或宫内节育器;口服避孕药、联合或单独使用孕激素;注射孕激素;阴道避孕环;经皮避孕贴片。
[1238]
以上是满足以下高效定义的那些方法的全部列表:当始终正确地使用时并且在适当的时候根据产品标签使用时,失败率低于每年1%。对于非产品方法(例如,男性不育),研究者将确定什么是始终正确使用。研究者负责确保患者理解如何正确使用这些避孕方法。
[1239]
6.wocbp必须同意从筛选时间开始到最后剂量的研究药物后至少30天遵守以下避孕要求中的一项:
[1240]
a.性禁欲(被定义为从筛选时间至最后剂量的剂研究药物后至少30天不与异性性交)
[1241]
b.使用以下避孕选项中的一种加上男性伴侣使用避孕套:避孕皮下植入物;宫内避孕器或宫内节育器;口服避孕药、联合或单独使用孕激素;注射孕激素;阴道避孕环;经皮避孕贴片。
[1242]
c.男性伴侣的输精管结扎并记录有无精子症。
[1243]
以上是满足以下高效定义的那些方法的全部列表:当始终正确地使用时并且在适当的时候根据产品标签使用时,失败率低于每年1%。研究者负责确保患者理解如何正确使用这些避孕方法。
[1244]
7.没有生殖潜能的妇女被定义为:a)具有以下情况中的一种的绝经前女性:记录有输卵管结扎;记录有宫腔镜下输卵管阻塞手术,随访确认双侧输卵管阻塞;子宫切除术;记录有双侧卵巢切除术;b)被定义为自发闭经12个月的绝经后妇女(在有问题的情况下,将需要血液样品在当地同时检测促卵泡激素和雌二醇水平并与绝经期一致[请参考当地实验室参考范围的确认水平])。如果接受激素替代疗法(hrt)且绝经后状态存在疑问的妇女希望在研究期间继续hrt,则要求她们使用上面列出的高效避孕方法中的一种。
[1245]
排除标准
[1246]
1.患者在前6个月内入组氯硝柳胺研究。
[1247]
2.患者对氯硝柳胺过敏或者对氯硝柳胺或相关化合物或所用任何赋形剂有显著不良反应史。
[1248]
3.患者患有可能干扰鼻内施用imp的潜在病症,例如鼻内慢性溃疡。
[1249]
4.患者患有如研究者判断将危及参与者的安全的急性或慢性病症。
[1250]
5.患者患有研究者认为将干扰提供同意或遵守研究指令的能力或可能混淆对研究结果的解释的病症。
[1251]
6.患者具有提示下呼吸道参与或全身参与的症状(诸如咳嗽、感觉发热、发冷、发抖、感觉热、精力不足、疲惫、身体疼痛、疲劳、呼吸短促、没有食欲、恶心、呕吐或腹泻(将输入fda covid-19问卷))或未在纳入标准5中提及的其他症状。
[1252]
6.患者患有除sars-cov-2以外的活动性或急性感染。
[1253]
7.患者在第1天前一个月使用过其他研究产品。
[1254]
8.抗病毒药物和靶向covid-19的批准或实验药物。
[1255]
9.同一家庭的另一成员被招募到该研究。
[1256]
治疗
[1257]
治疗是具有包括抗病毒、抗菌和抗炎特性在内的新型三重作用机制的鼻喷雾剂。将在安装有鼻喷雾泵的20ml琥珀色玻璃小瓶中提供治疗和匹配的安慰剂,这些小瓶含有8.5ml相应溶液,每次喷射递送140μl。两者都是黄色/红色的等渗和含水的水性溶液。imp和匹配的安慰剂将由独立于试验的制造商提供,并将储存在2℃-8℃之间,然后在分配给患者后储存在15℃-25℃之间。
[1258]
所有随机化患者将从第1天(至少间隔6小时服用2个剂量)到第10天的最后一次剂量在每个鼻孔中接受bid施用的140μl的1%配制品或安慰剂(2.4mg氯硝柳胺),其中根据他们的指定治疗和根据随机化方案在第10天早晨仅服用一个剂量。
[1259]
该研究是双盲的。
[1260]
功效评估
[1261]
将使用如表14所示的fda covid-19问卷对患者进行评估,在第1-9天回答问题1-16;在第10天回答问题1-19;并且在第30天回答问题1-18(评估过去7天)。将在第10天(评估过去10天)和在第30天(评估过去20天)回答问题20-22。在第10天和第30天,患者报告的总体印象项目(问题17-19)评估a)恢复到平时的健康状况;b)恢复日常活动;以及c)总体covid-19相关症状也将作为上述covid-19症状问卷的一部分收集。
[1262]
将用who 11分顺序量表(表15)来评估医疗保健利用率。
[1263]
将使用医疗保健专业人员(hcp)询问的一组问题(表16)来评估防止向家庭接触者传播sars-cov-2的治疗的能力。在治疗和随访期间,将每隔一天通过电话从hcp收集反应。在第30天进行随访电话访视时,将收集关于向家庭接触者传播的信息。
[1264]
将使用hcp在远程访视/电话中询问的fda covid-19问卷中表2的问题1-18来评估第30天剩余症状的存在。将在第30天询问患者以评价他们在过去一周内的症状并在fda covid-19问卷上记录该周内的最高严重度。
[1265]
在第1-10天,将通过以下问题每天评估施用配制品后不适的存在和持续时间:
[1266]
·
服用鼻喷雾剂后,您是否有任何不适?如果有,症状是什么?持续多久?
[1267]
表14:fda covid-19问卷
[1268]
[1269][1270]
[1271]
表15:who 11分顺序量表
[1272][1273]
表16:防止向家庭接触者传播
[1274]
[1275][1276]
实例16:氯硝柳胺乙醇胺盐对几种sars-cov-2变体(包括谱系b.1.1.7(uk)和b.1.351(南非)的相关变体)有效
[1277]
方法
[1278]
氯硝柳胺乙醇胺盐(nen)对sars-cov-2的几种变体的复制的影响如先前所述那样
确定,具有以下概述的偏差(touret等人,2020,preclinical evaluation of imatinib does not support its use as an antiviral drug against sars-cov-2.[伊马替尼的临床前评估并不支持其作为针对sars-cov-2的抗病毒药物使用]biorxiv)。
[1279]
类似于veroe6细胞培养caco-2细胞,如touret等人,2020所述。veroe6tmprss2细胞(id 100978)从cfar获得并使其在添加g-418(生命技术公司(life technologies))的相同培养基中生长。sars-cov-2菌株bavpat1通过eva global从pr.c.drosten获得(https://www.european-virus-archive.com/)。从18岁的患者分离sars-cov-2 201/501yv.1。全基因组序列已保藏在gisaid:epi_isl_918165。该菌株可通过eva global:uve/sars-cov-2/2021/fr/7b(谱系b1.1.7,购自uk)在https://www.european-virus-archive.com/virus/sars-cov-2-uvesars-cov-22021fr7b-lineage-b-1-1-7-ex-uk获得。sars-cov-2wuhan d614菌株通过isa方法生成。它含有刺突蛋白上的原始d614残基。该菌株可通过eva global uve/sars-cov2/2020/fr/isa_d614在https://www.european-virus-archive.com/virus/sars-cov-2-virus-strain-uvesars-cov22020frisad614获得。sars cov-2sa(谱系b 1.351)于2021年在法国分离。该菌株可通过eva global:uve/sars-cov-2/2021/fr/1299-ex sa(谱系b1.351)在https://www.european-virus-archive.com/virus/sars-cov-2-uvesars-cov-22021fr1299-ex-sa-lineage-b-1351获得。在veroe6细胞中使用浓度从10μm到0.078μm的半对数稀释方案用于氯硝柳胺乙醇胺盐(溶解在dmso中),并且在veroe6tmprss2细胞中使用浓度从5μm到0.039μm的半对数稀释方案用于氯硝柳胺乙醇胺盐。如touret等人,2020中所述进行ec
50
和cc
50
测定。
[1280]
结果
[1281]
发现nen以0.1μm的ec
50
和》10μm的cc
50
抑制sars-cov-2(d614g菌株)在veroe6细胞中的复制,从而产生100的选择性指数(图5a)。nen的强效抗病毒功效caco-2细胞中得到证实,ec
50
为0.08μm且cc
50
》10μm(图5b)。
[1282]
为了确保sars-cov-2变体的适当复制,使用了细胞系veroe6 tmprss2。用nen处理以相似的效力阻断所有四种sars-cov-2变体的复制(图6)。更准确地说,针对d614g、d614、b.1.1.7和b1.351菌株的ec
50
分别为0.06μm、0.13μm、0.08μm和0.07μm。
[1283]
实例17:氯硝柳胺在使用人支气管上皮细胞的跨孔感染模型中阻断sars-cov-2的复制
[1284]
方法
[1285]
在使用人支气管上皮细胞的跨孔感染模型中评价氯硝柳胺乙醇胺盐(nen)对sars-cov-2复制的影响,如前所述(touret等人,2020)。
[1286]
简言之,用sars-cov-2的欧洲d614g菌株(bavpat1/2020;从eva global获得)以0.1的moi顶端感染人支气管上皮细胞,并将它们在含有不同浓度的溶解在dmso中的nen(一式两份)或不含药物(病毒对照)的基底外侧培养基中培养长达4天。每天更换含有新鲜nen的培养基。在顶侧收集样品并用于进行tcid
50
测定。在第4天,裂解细胞以使用qrt-pcr量化细胞内病毒rna。通过对反应进行归一化来计算病毒抑制,最低值为100%,最高值为0%。在graphpad prims 7中使用对数插值法(y=100/(1 10^(logec50-x)*hillslope))来测定ec
50
。使用带有dunnett校正的普通单因素anova进行统计检验以进行多重比较。
[1287]
结果
[1288]
当通过人支气管上皮细胞中的感染滴度和细胞内rna水平测量时,发现nen表现出强抗sars-cov-2作用。
[1289]
用1.25-10μm nen处理使得sars-cov-2的感染滴度在第4天显著下降到低于检测限的水平,产生0.96μm的ec50(图7a)。此外,与未处理的对照相比,用1μm nen处理使得细胞内病毒rna水平在第4天显著降低3倍(图7b)。
[1290]
实例18:鼻内应用本发明的配制品使得感染sars-cov-2的hace2小鼠模型的临床评分改善
[1291]
方法
[1292]
根据本发明的液体氯硝柳胺乙醇胺配制品(如实例6的表5所示)在鼻内(in)sars-cov-2病毒攻击之前鼻内(in)给予一次,并且在研究过程中在接种后每天给予一次。本研究使用在sujan shresta实验室的拉霍亚免疫学研究所建立的hace2转基因sars-cov-2小鼠感染模型(oladunni等人,2020,nature communications[自然通讯],11(1),第1-17页),其中用sars-cov-2接种导致严重的sars-cov-2相关疾病并且到第5-8天发生早期死亡。在异氟烷镇静后,用1.0x 105pfu剂量的sars-cov-2wt(bei resources,在pbs 10%fcs中稀释)以30μl的最终体积鼻内进行病毒感染。以30μl的体积施用配制品和盐水。病毒感染后,每天监测小鼠的发病率(体重)、临床评分和死亡率(存活)。显示其初始体重减轻》20%和/或临床评分≥5的小鼠被定义为达到实验终点并进行人道终结。
[1293]
结果
[1294]
与盐水处理的sars-cov-2感染的k18hace2转基因小鼠相比,用本发明的配制品鼻内处理导致临床评分在感染后第6天显著更低(图8)。下表17描述了与临床评分相关的症状。
[1295]
表17:临床评分和症状
[1296][1297]
条款
[1298]
另外的实施例在以下编号的条款中阐述:
[1299]
1.一种配制品,该配制品包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精。
[1300]
2.根据条款1所述的配制品,其中该卤化水杨酰苯胺选自由以下组成的组:氯硝柳
胺、氯氰碘柳胺、五氯柳胺和碘醚柳胺或其药学上可接受的盐。
[1301]
3.根据条款1或条款2所述的配制品,其中该卤化水杨酰苯胺是氯硝柳胺或其药学上可接受的盐。
[1302]
4.根据条款3所述的配制品,其中该配制品包含游离酸形式的氯硝柳胺。
[1303]
5.根据条款3所述的配制品,其中该配制品包含氯硝柳胺的药学上可接受的盐。
[1304]
6.根据条款5所述的配制品,其中该药学上可接受的盐是氯硝柳胺乙醇胺。
[1305]
7.根据条款1至6中任一项所述的配制品,其中该配制品是固体的形式,任选地是粉末的形式。
[1306]
8.根据条款1至6中任一项所述的配制品,其中该配制品是该卤化水杨酰苯胺或其药学上可接受的盐和该环糊精在药学上可接受的溶剂中的溶液、悬浮液(包括纳米悬浮液)或分散体的形式。
[1307]
9.根据条款8所述的配制品,其中该溶剂包括水。
[1308]
10.根据条款8或条款9所述的配制品,其中该溶剂进一步包含共溶剂,任选地其中该共溶剂包括dmso、乙醇、丙二醇、甘油、平均分子量为600或更小的聚乙二醇或它们的任何组合。
[1309]
11.根据条款10所述的配制品,其中基于该配制品的重量,该共溶剂以按重量计0%至20%例如按重量计0%至10%(例如1重量%)的量存在。
[1310]
12.根据任一前述条款所述的配制品,其中该配制品适于气雾剂施用。
[1311]
13.根据任一前述条款所述的配制品,其中该环糊精包括β-环糊精或其衍生物,任选地其中该环糊精是羟丙基-β-环糊精(hp-β-cd)。
[1312]
14.根据任一前述条款所述的配制品,其中基于该配制品的重量,该卤化水杨酰苯胺或其药学上可接受的盐以按重量计0.05%至10%的量存在于该配制品中。
[1313]
15.根据条款14所述的配制品,其中该配制品是液体配制品,并且基于该液体配制品的重量,该卤化水杨酰苯胺或其药学上可接受的盐以按重量计0.1%至5%例如0.5%至2%的量存在于该配制品中,任选地其中该卤化水杨酰苯胺或其药学上可接受的盐以按重量计约1%的量存在于该配制品中。
[1314]
16.根据任一前述条款所述的配制品,其中该卤化水杨酰苯胺或其药学上可接受的盐以1至50mg/ml的浓度存在于该配制品中。
[1315]
17.根据任一前述条款所述的配制品,其中基于该配制品的重量,该环糊精以按重量计1%至90%的量存在于该配制品中。
[1316]
18.根据条款17所述的配制品,其中该配制品是液体配制品,并且基于该配制品的重量,该环糊精以按重量计1%至25%例如按重量计10%至20%、优选按重量计10%至15%、更优选按重量计约15%的量存在于该配制品中。
[1317]
19.根据任一前述条款所述的配制品,其中该卤化水杨酰苯胺或其药学上可接受的盐的至少一部分与该环糊精形成复合物,任选地其中约20%至约100%的该卤化水杨酰苯胺或其药学上可接受的盐与该环糊精形成复合物。
[1318]
20.根据任一前述条款所述的配制品,其中该卤化水杨酰苯胺或其药学上可接受的盐与环糊精的比例为1:250至5:1,诸如约1:50至1:5,优选1:20至1:10,例如约1:10或例如约1:15。
[1319]
21.根据任一前述条款所述的配制品,该配制品进一步包含至少一种聚合物,任选地其中该聚合物选自由以下组成的组:聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物(pvp/va)、羟丙基纤维素(hpc)、泊洛沙姆、羟丙基甲基纤维素(hpmc)、羟丙基甲基纤维素乙酸琥珀酸酯(hpmc-as)以及它们的任何组合,任选地其中该聚合物包含pvp。
[1320]
22.根据条款21所述的配制品,其中基于该配制品的重量,该聚合物以按重量计0.05%至20%例如按重量计0.1%至15%(例如约2重量%)的量存在于该配制品中。
[1321]
23.根据任一前述条款所述的配制品,该配制品进一步包含防腐剂,任选地其中该防腐剂包括苯扎氯铵。
[1322]
24.根据条款23所述的配制品,其中基于该配制品的重量,该防腐剂按重量计以0%至0.2%例如按重量计0%至0.1%(例如0.01重量%)的量存在。
[1323]
25.根据任一前述条款所述的配制品,该配制品进一步包含稳定剂,任选地其中该稳定剂包括依地酸二钠、磷酸二钠、聚山梨醇酯80、磷酸二氢钠、柠檬酸钠、磷酸钠、乙酸钠、乙酸、组氨酸、乳酸、天冬氨酸、酒石酸、谷氨酸、琥珀酸、苹果酸、氨丁三醇、乳酸、组氨酸、富马酸、柠檬酸或它们的任何组合。
[1324]
26.根据条款25所述的配制品,其中基于该配制品的重量,该稳定剂以按重量计0%至2%例如按重量计0.05%至1%(例如0.1重量%)的量存在。
[1325]
27.根据任一前述条款所述的配制品,该配制品进一步包含电解质,任选地其中该电解质包括氯化钠、氯化钾、磷酸二氢钠、磷酸二氢钾或它们的任何组合。
[1326]
28.根据条款27所述的配制品,其中基于该配制品的重量,该电解质以按重量计0%至10%例如按重量计0.1%至0.9%(例如0.5重量%)的量存在。
[1327]
29.根据任一前述条款所述的配制品,其中该配制品具有1至150cp、任选地1.5至100cp、2至50或5至25cp的粘度。
[1328]
30.根据任一前述条款所述的配制品,其中该配制品具有4至9、6至8或7.6至8.0(例如约7.8)的ph。
[1329]
31.根据条款1所述的液体配制品,该液体配制品包含:
[1330]
0.5%-1.5%氯硝柳胺乙醇胺;
[1331]
5%-20%环糊精,优选β-环糊精,更优选hp-β-cd;
[1332]
0.5%-5%pvp(例如pvp 30);
[1333]
余量为水,
[1334]
其中这些百分比基于该液体配制品的重量按重量计;并且
[1335]
其中该配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[1336]
32.根据条款1所述的液体配制品,该液体配制品包含:
[1337]
约1%氯硝柳胺乙醇胺;
[1338]
约15%环糊精,优选β-环糊精,更优选hp-β-cd;
[1339]
约2%pvp(例如pvp 30);
[1340]
余量为水,
[1341]
其中这些百分比基于该液体配制品的重量按重量计;并且
[1342]
其中该配制品具有7.0至8.5例如7.5至7.8或7.6至8.0、优选约7.8的ph。
[1343]
33.根据任一前述条款所述的配制品,其中该配制品具有100至500mosmol/l例如150至350mosmol/l、优选290至320mosmol/l的摩尔渗透压浓度。
[1344]
34.一种包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品,其用作药物。
[1345]
35.一种包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品,其用于在治疗或预防有需要的受试者的感染性疾病或炎性疾病中使用。
[1346]
36.一种治疗或预防受试者的感染性疾病或炎性疾病的方法,该方法包括向该受试者施用治疗有效量的包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品。
[1347]
37.根据条款35或条款36所述使用的配制品或方法,其中该配制品如条款1至33中任一项所定义。
[1348]
38.根据条款35至37中任一项所述使用的配制品或方法,其中该感染性疾病是肺部感染。
[1349]
39.根据条款35至38中任一项所述使用的配制品或方法,其中该感染性疾病是病毒、细菌或真菌感染。
[1350]
40.根据条款35至39中任一项所述使用的配制品或方法,其中该感染性疾病是病毒感染。
[1351]
41.根据条款35至40中任一项所述使用的配制品或方法,其中该病毒感染由选自以下的病毒引起或与其相关:呼吸道合胞病毒、流感病毒、副流感病毒、人偏肺病毒、严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov)、人鼻病毒(hrv)和人腺病毒(hadv)。
[1352]
42.根据条款41所述使用的配制品或方法,其中该病毒感染由肺病毒科病毒例如人呼吸道合胞病毒(hrsv)(例如hrsv-a2、hrsv-b1或hrsv-s2)引起或与其相关。
[1353]
43.根据条款41所述使用的配制品或方法,其中该病毒感染由冠状病毒科病毒引起或与其相关。
[1354]
44.根据条款43所述使用的配制品或方法,其中该病毒选自α冠状病毒、β冠状病毒、γ冠状病毒和δ冠状病毒。
[1355]
45.根据条款44所述使用的配制品,其中该病毒是β冠状病毒。
[1356]
46.根据条款45所述使用的配制品或方法,其中该病毒选自严重急性呼吸综合征冠状病毒(sars-cov)、严重急性呼吸综合征冠状病毒2(sars-cov-2)、中东呼吸综合征冠状病毒(mers-cov)、hcov-229e、hcov-nl63、hcov-oc43和hku1。
[1357]
47.根据条款45所述使用的配制品或方法,其中该病毒感染由sars-cov-2引起或与其相关。
[1358]
48.根据条款47所述使用的配制品或方法,其中该病毒感染是covid-19。
[1359]
49.根据条款48所述使用的配制品或方法,其中该病毒感染是中度或轻度covid-19。
[1360]
50.根据条款35至49中任一项所述使用的配制品或方法,其中该受试者在住院。
[1361]
51.根据条款35至50中任一项所述使用的配制品或方法,其中该配制品用于预防该疾病例如从轻度进展到中度或从中度进展到重度covid-19或者降低其可能性。
[1362]
52.根据条款35至51中任一项所述使用的配制品或方法,其中该配制品预防性施
用。
[1363]
53.根据条款52所述使用的配制品或方法,其中将该配制品预防性施用于已经或怀疑已经暴露于被诊断为感染了病毒的人的受试者。
[1364]
54.根据条款53所述使用的配制品或方法,其中该病毒感染是sars-cov-2。
[1365]
55.根据条款52所述使用的配制品或方法,其中将该配制品预防性施用于处于较高covid-19风险的未感染受试者。
[1366]
56.根据条款52至55中任一项所述使用的配制品或方法,其中该预防性施用用于:
[1367]-降低该受试者发生有症状或无症状covid-19感染的风险;
[1368]-降低因covid-19死亡的风险;
[1369]-减轻covid-19的症状严重程度;
[1370]-降低该受试者感染中度或重度covid-19的风险。
[1371]
57.根据条款52至55中任一项所述使用的配制品或方法,其中该预防性施用用于:
[1372]-降低该受试者发生继发性感染(例如继发性细菌感染)的风险;
[1373]-降低因继发性感染死亡的风险;以及/或者
[1374]-减轻继发性感染的严重程度。
[1375]
58.根据条款55所述使用的配制品或方法,其中该受试者具有现有病症或疾病,诸如:诸如糖尿病、癌症、心脏病、高血压、脑血管疾病、scid、镰状细胞病、地中海贫血、肺纤维化、间质性肺病、慢性肺病诸如copd、哮喘和囊性纤维化、肺气肿、支气管炎、慢性肾病、慢性肝病、肝炎、自身免疫性疾病、影响脑或神经的病症、肌肉萎缩病症或者严重或深度学习障碍。
[1376]
59.根据条款55所述使用的配制品或方法,其中该受试者选自:接受过身体组织(例如器官)移植的受试者;切除了器官(例如脾脏)的受试者;正在接受(或接受过)化学疗法、免疫疗法、抗体疗法或放射疗法的受试者;正在接受(或接受过)癌症治疗的受试者;正在接受(或接受过)蛋白激酶抑制剂或parp抑制剂的受试者;接受过血液、骨髓或干细胞移植的受试者;正在服用免疫抑制剂的受试者;患有hiv或aids的受试者;以及进行血液透析的受试者。
[1377]
60.根据条款40至48中任一项所述使用的配制品或方法,其中该配制品用于在治疗无症状受试者的病毒感染中使用,任选地其中该病毒感染是sars-cov-2。
[1378]
61.根据条款60所述使用的配制品或方法,其中该治疗用于:
[1379]-减少或消除该受试者的病毒载量;
[1380]-加速该受试者的血清转化;
[1381]-减少受试者间的病毒传播;
[1382]-减少病毒脱落;
[1383]-预防该受试者出现症状或降低其风险;以及/或者
[1384]-预防疾病进展或降低其风险。
[1385]
62.根据条款40至61中任一项所述使用的配制品或方法,其中该配制品鼻内施用。
[1386]
63.根据条款41所述使用的配制品或方法,其中该病毒感染由流感病毒引起或与其相关。
[1387]
64.根据条款35或36所述使用的配制品或方法,其中该炎性疾病是肺部炎性疾病,
任选地其中该肺部炎性疾病选自由以下组成的组:哮喘、慢性阻塞性肺病(copd)、肺纤维化、肺炎、间质性肺病、结节病、闭塞性细支气管炎、局限性肺炎、急性呼吸窘迫综合征(ards)、支气管扩张、囊性纤维化、特发性肺纤维化、辐射诱导的纤维化、硅肺病、石棉诱导的肺或胸膜纤维化、急性肺损伤、寻常型间质性肺炎(uip)、慢性淋巴细胞性白血病(cll)相关的纤维化、哈曼-里奇综合征、卡普兰综合征、煤工尘肺、隐原性纤维化肺泡炎、闭塞性细支气管炎、慢性支气管炎、肺气肿、韦格纳氏肉芽肿病、肺硬皮病、硅肺病、石棉诱导的肺和/或胸膜纤维化。
[1388]
65.根据条款35至64中任一项所述使用的配制品或方法,其中所述使用包括通过口内和/或鼻内吸入来施用该配制品。
[1389]
66.根据条款35至65中任一项所述使用的配制品或方法,其中该配制品通过口内吸入来施用。
[1390]
67.根据条款35至65中任一项所述使用的配制品或方法,其中该配制品通过鼻内和口内吸入来施用。
[1391]
68.根据条款35至65中任一项所述使用的配制品或方法,其中所述使用包括鼻内施用该配制品。
[1392]
69.根据条款65、67或68所述使用的配制品或方法,其中所述使用包括每个鼻孔施用50至500μl、100至200μl或130至150μl的液体配制品。
[1393]
70.根据条款65至67中任一项所述使用的配制品或方法,其中所述使用包括口内(例如经由喷雾器)施用1至10ml、2至8ml或3至6ml的液体配制品。
[1394]
71.根据条款35至70中任一项所述使用的配制品或方法,其中所述使用包括以气雾剂的形式施用该配制品。
[1395]
72.根据条款35至71中任一项所述使用的配制品或方法,其中基于氯硝柳胺的重量,该卤化水杨酰苯胺或其药学上可接受的盐以约10mg至约1000mg(例如基于氯硝柳胺的重量,约100mg至约600mg、优选约150mg至约500mg)的单位剂量施用于该受试者。
[1396]
73.根据条款35至72中任一项所述使用的配制品或方法,其中该液体配制品每天一至五次例如每天1至4次、例如每天2或3次施用于该受试者。
[1397]
74.根据条款35至73中任一项所述使用的配制品或方法,其中所述使用进一步包括在该配制品之前或与其同时施用镇咳剂。
[1398]
75.根据条款74所述使用的配制品或方法,其中该镇咳剂选自可待因、右美沙芬、氢可酮、美沙酮、布托啡诺、苯佐那酯、乙基吗啡、奥昔拉定、匹哌氮酯、福尔可定、诺司卡品、布他米酯和局部麻醉剂。
[1399]
76.根据条款74所述使用的配制品或方法,其中该镇咳剂是局部麻醉剂,任选地利多卡因。
[1400]
77.根据条款39至63或65至76中任一项所述使用的配制品或方法,其中该病毒感染与炎症相关。
[1401]
78.根据条款35至77中任一项所述使用的配制品或方法,其中该治疗使得粘液产生和/或分泌减少、支气管收缩减少、促炎细胞因子得到抑制、树突细胞活性得到调节和/或stat3得到抑制。
[1402]
79.根据条款39至63或65至77中任一项所述使用的配制品或方法,其中该病毒感
染与继发性细菌感染相关。
[1403]
80.根据条款79所述使用的配制品或方法,其中该继发性细菌感染由选自由以下组成的组的细菌引起:金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌、卡他莫拉菌和化脓性链球菌。
[1404]
81.一种包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品,其用于在治疗或预防受试者的眼部病症或疾病中使用。
[1405]
82.一种治疗或预防受试者的眼部病症或疾病的方法,该方法包括向该受试者施用治疗有效量的包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品。
[1406]
83.根据条款81或条款82所述使用的配制品或方法,其中该眼部病症或疾病是感染性眼部疾病或炎性眼病。
[1407]
84.根据条款83所述使用的配制品或方法,其中该感染性眼部疾病选自由以下组成的组:结膜炎(包括细菌、真菌和病毒性结膜炎)、角膜炎(包括病毒、细菌、真菌和阿米巴性角膜炎)、眼内炎、睑炎、睑腺炎、葡萄膜炎、蜂窝织炎(例如细菌蜂窝织炎)、眼部淋病和眼部疱疹。
[1408]
85.根据条款84所述使用的配制品或方法,其中该炎性眼病选自干眼障碍(ded)、眼部酒渣鼻、葡萄膜炎(例如鸟枪弹样视网膜脉络膜病变)、严重结膜炎、糖尿病视网膜病变、伴有泛葡萄膜炎的多灶性脉络膜炎、匍行性脉络膜病变、巩膜炎、与过敏相关的眼部炎症(诸如过敏性结膜炎)和与自身免疫障碍相关的眼部炎症(例如粘膜类天疱疮、与感染相关的眼部炎症、色素性视网膜炎、强直性脊柱炎、白塞氏综合征、皮肌炎、格雷夫斯氏病、幼年型类风湿性关节炎、多发性硬化、银屑病性关节炎、睑炎、莱特氏综合征、类风湿性关节炎、舍格伦氏综合征、系统性红斑狼疮和韦格纳氏肉芽肿)。
[1409]
86.根据条款83所述使用的配制品或方法,其中该眼部病症或疾病是细菌性结膜炎,任选地其中该细菌性结膜炎由选自由以下组成的组的细菌引起:金黄色葡萄球菌(包括mrsa)、肺炎链球菌、流感嗜血杆菌、铜绿假单胞菌、卡他莫拉菌和淋病奈瑟菌。
[1410]
87.根据条款83所述使用的配制品或方法,其中该眼部病症或疾病是病毒性结膜炎,任选地其中该病毒性结膜炎由以下引起:单纯性疱疹病毒(hsv),尤其是1型或2型hsv;人疱疹病毒6;腺病毒;传染性软疣病毒;水痘-带状疱疹病毒;eb病毒;巨细胞病毒;小核糖核酸病毒;乙型肝炎病毒;腮腺炎病毒;麻疹病毒;以及流感病毒;例如1型或2型hsv。
[1411]
88.根据条款81至87中任一项所述使用的配制品或方法,其中该配制品是液体配制品并且局部施用于一只或两只眼睛。
[1412]
89.根据条款81至88中任一项所述使用的配制品或方法,其中该配制品是液体配制品并且包含眼科可接受的载体。
[1413]
90.根据条款81至89中任一项所述使用的配制品或方法,其中该配制品如条款1至33中任一项所定义。
[1414]
91.根据条款81至90中任一项所述使用的配制品或方法,其中该液体配制品每天一至五次例如每天1至4次、例如每天2次施用于该受试者的一只或两只眼睛。
[1415]
92.一种溶液的气雾剂,该溶液包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精。
[1416]
93.根据条款92所述的气雾剂,其中该溶液包含氯硝柳胺乙醇胺。
[1417]
94.根据条款92或条款93所述的气雾剂,其中该溶液包含溶剂,任选地其中该溶剂包含水。
[1418]
95.根据条款94所述的气雾剂,其中该溶剂进一步包含共溶剂,任选地其中该共溶剂包括dmso。
[1419]
96.根据条款92至95中任一项所述的气雾剂,其中该环糊精是β-环糊精或其衍生物,任选地其中该环糊精包括羟丙基-β-环糊精(hp-β-cd)。
[1420]
97.根据条款92至96中任一项所述的气雾剂,其中基于该溶液的重量,该卤化水杨酰苯胺或其药学上可接受的盐以按重量计0.1%至5.0%的量存在。
[1421]
98.根据条款92至97中任一项所述的气雾剂,其中基于该溶液的重量,该环糊精以按重量计1%至25%的量存在。
[1422]
99.根据条款92至98中任一项所述的气雾剂,其中该卤化水杨酰苯胺或其药学上可接受的盐的至少一部分与该环糊精形成复合物,任选地其中20重量%至约100重量%的该卤化水杨酰苯胺或其药学上可接受的盐与该环糊精复合。
[1423]
100.根据条款92至99中任一项所述的气雾剂,其中该溶液进一步包含至少一种聚合物,任选地其中该聚合物选自由以下组成的组:聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物(pvp/va)、羟丙基纤维素(hpc)、泊洛沙姆、羟丙基甲基纤维素(hpmc)、羟丙基甲基纤维素乙酸琥珀酸酯(hpmc-as)以及它们的任何组合,任选地其中该聚合物包含pvp。
[1424]
101.根据条款100所述的气雾剂,其中该至少一种聚合物以按该溶液的重量计0.05%至50%例如按该溶液的重量计0.01%至10%(例如2重量%)的量存在于该溶液中。
[1425]
102.根据条款92至101中任一项所述的气雾剂,其中该溶液进一步包含防腐剂,任选地其中该防腐剂包含苯扎氯铵,任选地其中该防腐剂以按该溶液的重量计0%至0.05%例如按重量计0%至0.02%(例如0.01重量%)的量存在。
[1426]
103.根据条款92至102中任一项所述的气雾剂,其中该溶液进一步包含稳定剂,任选地其中该稳定剂包含依地酸二钠,任选地其中该稳定剂以按该溶液的重量计0%至0.5%例如按重量计0%至0.2%(例如0.1重量%)的量存在。
[1427]
104.根据条款92至103中任一项所述的气雾剂,其中该溶液进一步包含电解质,任选地其中该电解质包含氯化钠,任选地其中该电解质以按该溶液的重量计0%至1.5%例如按重量计0%至0.9%(例如0.5重量%)的量存在。
[1428]
105.根据条款92至104中任一项所述的气雾剂,其中该气雾剂的质量中值直径(mmd)小于约5μm。
[1429]
106.根据条款92至104中任一项所述的气雾剂,其中该气雾剂的质量中值直径(mmd)为约10至约150μm、约20至约100μm、约40μm至约80μm或约50μm至约70μm。
[1430]
107.根据条款92至106中任一项所述的气雾剂,其用于在治疗或预防受试者的感染性疾病或炎性疾病,任选地肺部感染性或炎性疾病中使用,其中所述使用包括通过吸入向该受试者施用该气雾剂。
[1431]
108.根据条款107所述使用的气雾剂,其中该感染性疾病是病毒感染。
[1432]
109.一种单位剂量,该单位剂量包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的溶液,其中该卤化水杨酰苯胺以0.1至200mg例如0.5至100mg/ml或1至50mg/ml的量
存在。
[1433]
110.根据条款109所述的单位剂量,其中该单位剂量存在于容器(例如小瓶、泡罩包装、瓶、注射器或吸入器装置(例如喷雾器)内的药物储器)中。
[1434]
111.一种系统,该系统包括:
[1435]-包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品;以及
[1436]-吸入器装置和/或鼻内递送装置。
[1437]
112.根据条款111所述的系统,其中该配制品如条款1至33中任一项所定义。
[1438]
113.根据条款111或条款112所述的系统,其中该吸入器装置适于雾化该配制品。
[1439]
114.一种容器,该容器含有包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精的配制品。
[1440]
115.根据条款111至114中任一项所述的系统或容器,其中该配制品如条款1至33中任一项所定义。
[1441]
116.根据条款114或条款115所述的容器,其中该配制品是液体的形式,并且该容器被构造成将该配制品的液滴分配到眼睛。
[1442]
117.根据条款114至115中任一项所述的容器,其中该配制品包含眼科可接受的载体。
[1443]
118.一种制备配制品的方法,该方法包括:
[1444]-将环糊精和/或卤化水杨酰苯胺或其药学上可接受的盐添加到溶剂中以形成悬浮液;
[1445]-将该悬浮液加热足以使该环糊精和/或卤化水杨酰苯胺或其药学上可接受的盐溶解在该溶剂中的一段时间,从而形成溶液;
[1446]-将该溶液冷却。
[1447]
119.根据条款118所述的方法,其中该方法包括在加热之前将该环糊精和该卤化水杨酰苯胺或其药学上可接受的盐两者添加到该溶剂中。
[1448]
120.根据条款118所述的方法,其中该方法包括在添加该环糊精和该卤化水杨酰苯胺或其药学上可接受的盐之前预热该溶剂。
[1449]
121.根据条款118所述的方法,其中该方法包括:
[1450]-将环糊精和卤化水杨酰苯胺或其药学上可接受的盐中的一种添加到该溶剂中以形成悬浮液;
[1451]-将该悬浮液加热足以使该环糊精或该卤化水杨酰苯胺或其药学上可接受的盐溶解在该溶剂中的一段时间,从而形成第一溶液;
[1452]-将该环糊精和该卤化水杨酰苯胺或其药学上可接受的盐中的另一种以固体形式添加到该第一溶液中;
[1453]-将该第一溶液加热足以使该固体溶解的一段时间,从而形成第二溶液;以及
[1454]-将该溶液冷却。
[1455]
122.根据条款118所述的方法,其中该方法包括:
[1456]-将环糊精加入到溶剂中以形成第一悬浮液,并将该第一悬浮液加热足以使该环糊精溶解在该溶剂中的一段时间,从而形成第一溶液;
[1457]-将卤化水杨酰苯胺或其药学上可接受的盐添加到溶剂中以形成第二悬浮液,并
将该第二悬浮液加热足以使该卤化水杨酰苯胺或其药学上可接受的盐溶解在该溶剂中的一段时间,从而形成第二溶液;
[1458]-将该第一溶液添加到该第二溶液中以形成混合物;以及
[1459]-将该混合物冷却。
[1460]
123.根据条款122所述的方法,其中该方法包括在将该第一溶液添加到该第二溶液之后,在冷却之前,将该溶液加热(或继续加热)至低于120℃的温度。
[1461]
124.根据条款122至123中任一项所述的方法,其中加热进行至低于120℃的温度,任选地50℃至120℃的温度。
[1462]
125.根据条款122至124中任一项所述的方法,其中冷却进行至10℃-40℃的温度。
[1463]
126.根据条款122至125中任一项所述的方法,其中在该加热步骤之前和/或期间将该环糊精和/或该卤化水杨酰苯胺与该溶剂混合。
[1464]
127.根据条款122至126中任一项所述的方法,进一步包括将该溶剂、悬浮液或溶液的ph升高至至少8的ph,任选地其中将ph升高至8-9.5的ph。
[1465]
128.根据条款127所述的方法,其中在添加该卤化水杨酰苯胺或其药学上可接受的盐之前升高ph。
[1466]
129.根据条款122至128中任一项所述的方法,进一步包括降低该溶液的ph,任选地其中将ph降低至4-8的ph。
[1467]
130.根据条款129所述的方法,其中在该卤化水杨酰苯胺或其药学上可接受的盐溶解在该溶剂中后降低该溶液的ph。
[1468]
131.根据条款122至130中任一项所述的方法,进一步包括例如在冷却该溶液之后调节该溶液的ph,任选地其中将ph调节至7-8的ph。
[1469]
132.根据条款122至131中任一项所述的方法,其中该溶剂包含水,任选地其中该溶剂包含共溶剂(例如dmso),优选地其中该溶剂是水。
[1470]
133.根据条款122至132中任一项所述的方法,进一步包括添加一种或多种聚合物,任选地其中该聚合物包含或是pvp。
[1471]
134.根据条款133所述的方法,其中在该环糊精和该卤化水杨酰苯胺已经溶解在该溶剂中之后添加该聚合物。
[1472]
135.根据条款133或条款134所述的方法,其中在该溶液的ph已经降低至ph 4-8之后添加该聚合物。
[1473]
136.根据条款121或从属于条款121时的条款124-135中任一项所述的方法,其中该方法包括:
[1474]-任选地,将溶剂(例如水)预热至期望的温度,诸如65℃-70℃;
[1475]-将环糊精和碱添加到该溶剂中以形成第一悬浮液;
[1476]-加热该第一悬浮液,或将该第一悬浮液的温度保持在该期望的温度,同时混合足以使该环糊精溶解在该溶剂中的一段时间,从而形成具有至少8的ph的第一溶液;
[1477]-将卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐添加到该第一溶液中以形成第二悬浮液,任选地其中以浆料的形式添加该卤化水杨酰苯胺(例如氯硝柳胺)或其药学上可接受的盐;
[1478]-将该第二悬浮液的温度保持在该期望的温度,同时混合足以使该卤化水杨酰苯
胺(例如氯硝柳胺)或其药学上可接受的盐溶解的一段时间,从而形成第二溶液;
[1479]-将该第二溶液的ph降低至4-8的ph(例如通过添加酸);
[1480]-将聚合物(例如pvp)添加到该第二溶液中,并混合足以使该聚合物溶解在该第二溶液中的一段时间;
[1481]-将该第二溶液冷却(例如至约20℃至约30℃的温度);
[1482]-调节该第二溶液的ph,例如调节至约7.5至约8.5的ph。
[1483]
137.根据条款122至136中任一项所述的方法,进一步包括将选自以下的一种或多种组分添加到该溶剂中:一种或多种电解质;一种或多种稳定剂;一种或多种防腐剂;一种或多种缓冲剂;或它们的任何组合。
[1484]
138.根据条款122至137中任一项所述的方法,进一步包括由该溶液形成固体,任选地其中通过微沉淀、冻干、喷雾干燥或喷雾冷冻干燥该溶液形成该固体。
[1485]
139.根据条款122至138中任一项所述的方法,进一步包括稀释该溶液以获得期望浓度的该卤化水杨酰苯胺。
[1486]
140.一种配制品,该配制品包含卤化水杨酰苯胺或其药学上可接受的盐和环糊精,其中该配制品通过根据条款122-139中任一项所述的方法获得。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。