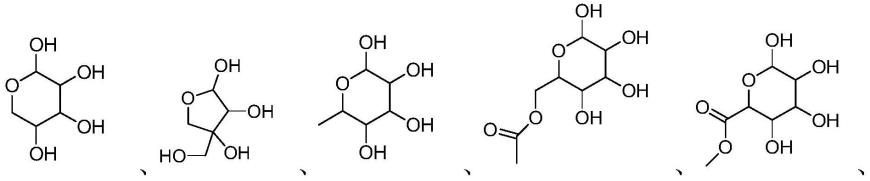
1.本发明涉及医药领域,具体涉及一种异黄酮类化合物在制备预防或治疗酒精性肝损伤或解酒保肝的药物中的用途。
背景技术:
2.酒精性肝损伤,即酒精性肝病(alcoholic liver disease,ald),是长期大量饮酒后酒精对肝脏产生毒性损伤并导致相关健康问题的疾病,在世界范围内ald发病率呈逐年上升趋势,因此备受关注。临床上将ald分为酒精性脂肪肝(alcoholic fatty liver,afl)、酒精性肝炎(alcoholic hepatitis,ah)、酒精性肝纤维化(alcoholic liver fibrosis,alf)和酒精性肝硬化(alcoholic cirrhosis,ac)。
3.酒精是亲神经物质,对中枢及周围神经可造成不可逆损害,饮酒对公共卫生的负担占全球疾病负担的5.1%。酒精使用障碍包括酒精滥用和酒精依赖,是过早死亡的主要危险因素之一,它可引起200多种疾病,包括神经精神类疾病、慢性疾病、癌症和致残性外伤。酒精使用障碍是导致酒精性肝损伤的最常见原因,可引起一系列肝脏疾病,如脂肪肝、脂肪性肝炎、肝纤维化、肝硬化和肝癌等。
4.多种黄酮类化合物被报道具有一定的解酒保肝效果,如菊花来源的黄酮、绿豆来源的黄酮以及杨梅来源的黄酮等。研究显示葛花来源的异黄酮如鸢尾苷和鸢尾苷元(鸢尾黄素)具有较好的保肝活性,并且鸢尾苷元的乙醇脱氢酶的激活效果优于鸢尾苷。
[0005][0006]
中国专利文献(cn1986556a)公开了一种6,7位成环的异黄酮化合物(5,3’,5
’‑
三甲氧基-6,7-亚甲二氧基异黄酮-4
’‑
o-β-d-葡萄糖),并公开了这种异黄酮类化合物在防治雌激素水平低下、妇女更年期综合征中的应用。关于这种6,7位成环的异黄酮类化合物,目前未见其在治疗酒精性肝损伤或解酒保肝方面的报道。
技术实现要素:
[0007]
因此,本发明要解决的技术问题在于提供6,7位成环的异黄酮类化合物的新用途。
[0008]
本发明提供式(i)所示的异黄酮类化合物及其药学上可接受的盐在制备预防或治疗酒精性肝损伤或解酒保肝的药物中的用途,
[0009][0010]
其中:
[0011]
r1选自氢、c
1-c8的烷基或c
3-c
10
的环烷基;
[0012]
r2、r3彼此独立地选自氢、c
1-c8的烷基、c
3-c
10
的环烷基、c
4-c
10
的芳基或c
3-c
10
的杂芳基;
[0013]
r4、r7、r8彼此独立地选自氢、羟基、c
1-c8的烷基、c
3-c
10
的环烷基、c
1-c8的烷氧基或c
4-c
20
的糖基残基;
[0014]
r5、r6彼此独立地选自氢、羟基、c
1-c8的烷基、c
3-c
10
的环烷基、c
1-c8的烷氧基、c
4-c
20
的糖基残基、-oc(o)nhr,或者,r5和r6彼此相连形成环a,
[0015]
所述环a选自c
3-c7的碳环、c
3-c7的杂环、c
4-c
10
的芳基、c
3-c
10
的杂芳基;
[0016]
r选自c
1-c
10
的烷基。
[0017]
进一步地,
[0018]
r1选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基或环己基;
[0019]
r2、r3彼此独立地选自氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、苯基;
[0020]
r4、r7、r8彼此独立地选自氢、羟基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、甲氧基、乙氧基、正丙氧基、异丙氧基或者选自由丁基、环丙基、环丁基、环戊基、环己基、甲氧基、乙氧基、正丙氧基、异丙氧基或者选自由
中至少一种所形成的糖基残基;
[0021]
r5、r6彼此独立地选自氢、羟基、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、甲氧基、乙氧基、正丙氧基、异丙氧基、-oc(o)nhr,或者选自由选自由选自由中至少一种所形成的糖基残基,或者,r5和r6彼此相连形成1,3-二氧戊环,
[0022]
r选自甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基。
[0023]
进一步地,
[0024]
r1选自氢或者甲基;
[0025]
r2、r3彼此独立地选自氢或者苯基;
[0026]
r4选自氢、羟基、甲氧基或者由中的至少一种所形成的糖基残基;
[0027]
r5、r6彼此独立地选自氢、羟基、甲氧基、-oc(o)nhr,或者,r5和r6彼此相连形成1,3-二氧戊环;
[0028]
r7、r8彼此独立地选自氢、羟基、甲氧基、或者由彼此独立地选自氢、羟基、甲氧基、或者由中的至少一种所形成的糖基残基;
[0029]
r选自甲基、乙基、正丙基、异丙基、正丁基、异丁基或叔丁基。
[0030]
进一步地,
[0031]
r1选自氢或者甲基;
[0032]
r2、r3彼此独立地选自氢或者苯基;
[0033]
r4选自氢、羟基或者甲氧基;
[0034]
r5选自氢、羟基或者-oc(o)nhr;
[0035]
r6选自氢、羟基或者甲氧基;
[0036]
或者,r5和r6彼此相连形成1,3-二氧戊环;
[0037]
r7选自氢、羟基或者甲氧基;
[0038]
r8选自氢、羟基、甲氧基、或者由中的一种所形成的糖基残基;
[0039]
r选自正丙基。
[0040]
进一步地,
[0041]
所述异黄酮类化合物具有如式(a)、(b)或(c)所示的结构:
[0042][0043][0044]
进一步地,
[0045]
所述异黄酮类化合物具有如下所示的结构:
[0046][0047][0048]
进一步地,所述药物还包括药学上可接受的载体。
[0049]
进一步地,所述药物添加常规辅料,按照常规工艺制成临床上可接受的片剂、胶囊剂、口服液剂、散剂、滴丸剂、颗粒剂或注射剂。
[0050]
进一步地,所述酒精性肝损伤包括:酒精性脂肪肝、酒精性肝纤维化、酒精性肝炎、酒精性肝硬化。
[0051]
本发明技术方案,具有如下优点:
[0052]
本发明首次提出了式(i)所示的6,7位成环的异黄酮类化合物在制备预防或治疗酒精性肝损伤或解酒保肝的药物中的用途。通过动物实验对6,7位成环的异黄酮类化合物(化合物1-15)的治疗酒精性肝损伤和解酒保肝活性进行验证,对实验大鼠酒精灌胃构建酒精大鼠模型,并分别以化合物1-15和鸢尾黄素给药,发现与鸢尾黄素相比,6,7位成环异黄酮类化合物对于酒精性肝损伤具有更佳的修复效果,并且通过对给药前后酒精大鼠的行为进行观察,发现6,7位成环异黄酮类化合物具有明显的解酒作用。由此本发明拓展了6,7位成环的异黄酮类化合物的应用领域。
具体实施方式
[0053]
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
[0054]
制备色谱柱:c
18
色谱柱,柱直径2.6cm,长度20cm,填料粒径10μm。
[0055]
实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用原料或仪器,均为可以通过市购获得的常规产品,包括但不限于本技术实施例中采用的原料或仪器。
[0056]
实施例及实验例中溶液的百分比均代表体积分数(v/v)。
[0057]
实施例1化合物1-6的制备
[0058]
称取鸢尾全草15kg,切碎,加6倍量70%乙醇,加热,在65℃下提取4次,每次2h,合并提取液,减压浓缩至无醇味,得到的浸膏(1020g)依次用乙酸乙酯、正丁醇萃取(每种溶剂萃取3次,每次萃取溶剂1.5l),分别将每种萃取液合并,减压浓缩,得到乙酸乙酯部位640g,正丁醇部位220g,纯水部位160g。
[0059]
纯水部位经硅胶柱(柱直径4cm
×
高50cm,柱体积650ml)分离,氯仿-甲醇(50∶1、20∶1、10∶1、1∶1)梯度洗脱,得到4个组分fr.ho1~fr.ho4。其中,fr.ho2经制备色谱分离(60%甲醇水溶液、70%甲醇水溶液、80%甲醇水溶液洗脱),70%甲醇水溶液部分得到化合物1(268mg)和化合物2(294mg)。
[0060]
乙酸乙酯部位经硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,石油醚-乙酸乙酯(100∶0、50∶1、20∶1、10∶1、5∶1、0∶100)梯度洗脱,得到6个组分fr.eac1~fr.eac6。其中,fr.eac3经硅胶柱色谱(石油醚-乙酸乙酯50:1、45:1、40:1、35:1、30:1、25:1、20:1、15:1、10:1、8:1、6:1、4:1、2:1)分离,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得15个流分fr.eac3-1~fr.eac3-15,fr.eac3-5经制备色谱分离(85%甲醇水溶液洗脱)得到化合物3(520mg)和化合物5(266mg);fr.eac5经硅胶柱色谱(石油醚-乙酸乙酯20:1、17:1、15:1、12:1、10:1、8:1、6:1、4:1、2:1、1:1)分离,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得10个流分fr.eac5-1~fr.eac5-10,fr.eac5-5经制备色谱分离(75%甲醇水溶液洗脱)得到化合物4(587mg)。
[0061]
正丁醇部位经硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,氯仿-甲醇(100∶0、50∶1、20∶1、10∶1、5∶1、0∶100)梯度洗脱,得到6个组分fr.nba1~fr.nba6。其中,fr.nba2经硅胶柱色谱(氯仿-甲醇80:1、70:1、60:1、50:1、40:1、30:1、20:1、15:1、10:1、5:1)分离,根
据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得11个流分fr.nba2-1~fr.nba2-11,fr.nba2-8经制备色谱分离(70%甲醇水溶液洗脱)得到化合物6(614mg)。
[0062]
将上述制备得到的化合物分别通过hplc-ms以及1h-nmr、
13
c-nmr进行结构确认,结构确认数据参考如下文献:
[0063]
化合物1-5:elliger c a ,halloin j m.phenolics induced in beta vulgaris by rhizoctonia solani infection[j].phytochemistry(oxford),1994,37(3):691-693.
[0064]
化合物6:choudhary m i,hareem s,siddiqui h,et al.a benzil and isoflavone from iris tenuifolia[j].phytochemistry,2008,69(9):1880-1885.
[0065][0066]
实施例2化合物7-9的制备
[0067]
称取新鲜ateleia herbert-smithii pittier树叶15kg,切成小块,加3倍量乙醚浸泡提取3次,每次24h,合并提取液浓缩,浓缩液加甲醇溶解后硅胶拌样,硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,用氯仿-甲醇梯度洗脱(20:1、10:1、2:1),每个梯度3个柱体积,收集10:1部位,浓缩干燥(10g),用中压色谱分离(硅胶柱,柱直径4.6cm
×
高60cm,柱体积1l),环己烷-乙酸乙酯(1:1)洗脱,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液(254nm),得到六个流份:fr.a~fr.f。其中,fr.c经制备色谱分离(75%甲醇水溶液洗脱)得到化合物7(671mg);fr.d经制备色谱分离(75%甲醇水溶液洗脱)得到化合物8(264mg);fr.e经制备色谱分离(80%甲醇水溶液洗脱)得到化合物9(289mg)。
[0068]
将上述制备得到的化合物分别通过hplc-ms以及1h-nmr、
13
c-nmr进行结构确认,结构确认数据参考如下文献:
[0069]
化合物7-9结构:veitch nc,sutton ps,kite gc,ireland he.six new isoflavones and a 5-deoxyflavonol glycoside from the leaves of ateleia herbert-smithii.j nat prod.2003;66(2):210
–
216.
[0070][0071]
实施例3化合物10-11的制备
[0072]
印度长叶紫荆木(madhuca latifolia)的果实35kg切成小块,用搅拌机将等分试样切碎,用6倍90%乙醇提取3次(40℃),每次2h,提取物浓缩成浸膏,依次用乙酸乙酯、正丁醇萃取(每种溶剂萃取3次,每次萃取溶剂1.5l),分别将每种萃取液合并,乙酸乙酯萃取液先用无水na2so4除去水分并浓缩(79g),经硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,依次用石油醚、石油醚:乙酸乙酯(9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1)、氯仿、氯仿-甲醇(9:1、8:1、7:1、6:1、5:1、4:1、2:1、1:1)、甲醇梯度洗脱,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得到20个流份fr.1~fr.20。其中,fr.11(1.35g)经硅胶柱分离,石油醚:乙酸乙酯(90∶1、50∶1、20∶1、1∶1)洗脱,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得到13个流份fr.11-1~fr.11-13,fr.11-5经制备色谱分离(85%甲醇水溶液洗脱)得到化合物10(167mg);fr.11-8经制备色谱分离(70%甲醇水溶液洗脱)得到化合物11(108mg)。
[0073]
将上述制备得到的化合物分别通过hplc-ms以及1h-nmr、
13
c-nmr进行结构确认,结构确认数据参考如下文献:
[0074]
化合物10:siddiqui b,khan s,kardar m n,et al.chemical constituents from the fruits of madhuca latifolia[j].helvetica chimica acta,2004,87(5).
[0075]
化合物11:siddiqui,b.s.,khan,s.,&nadeem kardar,m.(2010).a new isoflavone from the fruits ofmadhuca latifolia.natural product research,24(1),76
–
80.
[0076][0077]
实施例4化合物12-13的制备
[0078]
猪毛菜干燥全草25kg,切碎,用95%乙醇回流提取3次,每次2h,合并提取液,减压浓缩得浸膏1.97kg,将浸膏分散于水中,依次用石油醚、氯仿、正丁醇萃取(每种溶剂萃取3次,每次萃取溶剂1.5l),分别将每种萃取液合并,减压浓缩,得石油醚部位650g、氯仿部位773g、正丁醇部位434g。氯仿部位经硅胶柱(柱直径6cm
×
高60cm,柱体积1.7l)分离,石油醚-乙酸乙酯(100∶0、50∶1、20∶1、10∶1、5∶1、0∶100)梯度洗脱,得到6个组分fr.1~fr.6,其中,fr3经硅胶柱色谱(二氯甲烷-乙酸乙酯100:1、70:1、50:1、40:1、30:1、20:1、15:1、10:1、8:1、6:1、4:1、2:1)分离,根据薄层色谱(tlc)检测结果合并相同斑点位置的洗脱液,得13个
流分(fr3-1~fr3-13),fr3-3经制备色谱分离(85%甲醇水溶液洗脱)得到化合物12(166mg);fr3-8经制备色谱分离(75%甲醇水溶液洗脱)得到化合物13(357mg)。
[0079]
将上述制备得到的化合物分别通过hplc-ms以及1h-nmr、
13
c-nmr进行结构确认,结构确认数据参考如下文献:
[0080]
化合物12-13:woldu y,abegaz b.isoflavonoids from salsola somalensis[j].phytochemistry,1990,29(6):2013-2015.
[0081][0082]
实施例5化合物14-15的制备
[0083][0084]
步骤1:称取87.07g原料1及8ml的dmf(二甲基甲酰胺)加入到ccl4(500ml)溶液中,室温搅拌30min后,逐滴加入含120g二(三氯甲基)碳酸酯的ccl4(200ml)溶液,将该混合物缓慢回流6小时(75℃),自然冷却至室温,反应液减压浓缩后,粗残余物通过真空蒸馏纯化,收集馏出物,即亚氨基氯化物(中间体1);
[0085]
步骤2:称取1g原料5,6,7,3'-tetrahydroxy-4'-methoxyisoflavone、二氯二苯甲烷0.93g加入到50ml二苯醚中,180℃加热搅拌反应30分钟,冷却至室温,逐滴添加石油醚(150ml),过滤出固体,固体用乙酸乙酯溶解后硅胶拌样(干法上样),用硅胶柱纯化(φ2cm
×
60cm),用石油醚:乙酸乙酯10:1、3:1、1:1洗脱,根据tlc结果收集洗脱液(3:1部分),得到黄色固体状化合物14(1.12g,产率73.5%);
[0086]
步骤3:称取500mg化合物14加入无水dmf(100ml)中,依次加入205mg碳酸钾和52mg
碘化钾,混合物在冰水浴(0℃)搅拌10min,再加入265mg中间体1,冰水浴(0℃)搅拌2h,将反应混合物取出,室温放置12小时,将混合物溶于水(150ml)中,用乙酸乙酯萃取3次,每次80ml,收集有机层用饱和食盐水(200ml)洗涤,经硫酸钠干燥,并在减压下浓缩以得到粗固体,固体用乙酸乙酯溶解后硅胶拌样(干法上样),然后通过硅胶柱纯化(φ2cm
×
50cm),使用石油醚:乙酸乙酯10:1、5:1、1:1、0:1溶液作为洗脱剂,根据tlc结果收集洗脱液(1:1部分),得到化合物15(389mg,产率66.1%)。
[0087]
化合物14:
[0088]1hnmr(300mhz,dmso-d6):
[0089]
3.87(s,3h),7.04(s,1h),7.47-7.59(m,10h),7.61(d,j=6.69hz,1h),7.65(s,1h),7.74(d,j=6.69hz,1h),7.96(s,1h)
[0090]
13
c-nmr(75mhz,dmso-d6):
[0091]
56.23,94.52,103.31,104.95,119.15,124.35,126.21,126.30,126.49(2c),128.79,129.04(4c),129.13(4c),139.27(2c),141.95,145.62,152.76,152.94,154.41,155.77,164.01,182.44
[0092]
化合物15:
[0093]1hnmr(300mhz,dmso-d6):
[0094]
1.12(t,3h),1.59(m,2h),2.96(m,2h),3.87(s,3h),7.04(s,1h),7.47-7.59(m,10h),7.61(d,j=6.69hz,1h),7.65(s,1h),7.74(d,j=6.69hz,1h),7.96(s,1h),8.01(s,1h)
[0095]
13
c-nmr(75mhz,dmso-d6):
[0096]
11.23,23.16,44.20,56.23,94.52,103.31,104.95,119.15,124.35,126.21,126.30,126.49(2c),128.79,129.04(4c),129.13(4c),139.27(2c),141.95,145.62,152.76,152.94,154.41,155.77,164.01,182.44
[0097][0098]
实验例
[0099]
1.主要试剂
[0100]
实施例1-5制备的化合物1-15;
[0101]
复方甘草酸苷片(乐普药业股份有限公司,国药准字h20073723);
[0102]
alt、ast、tc、tg试剂盒(美国贝克曼库尔特有限公司);
[0103]
mda试剂盒(南京建成生物工程研究所),采用硫巴比妥酸比色法(tba),按试剂盒要求检测。
[0104]
2.药物配制
[0105]
受试药物溶液:采用质量百分数为0.5%的羧甲基纤维素钠(cmc-na)的水溶液分别将化合物1-15配制成药物浓度为50mg/ml的受试药物溶液;
[0106]
鸢尾黄素溶液:采用质量百分数为0.5%的cmc-na的水溶液将鸢尾黄素配制成浓度为50mg/ml的鸢尾黄素溶液;
[0107]
复方甘草酸苷溶液:采用质量百分数为0.5%的cmc-na的水溶液将复方甘草酸苷配制成浓度为6mg/ml的复方甘草酸苷溶液。
[0108]
3.实验动物及饲养
[0109]
8周龄spf级雄性sd大鼠190只,体重180~220g,动物实验室温度为22℃~25℃,相对湿度为55%~70%。
[0110]
4.动物分组、造模及给药
[0111]
sd大鼠适应性喂养7天后,按体重随机分成19组,每组10只,分别为空白对照组,酒精模型组,实验组(包含本发明实施例1-5制备的化合物1-15),鸢尾黄素对照组及复方甘草酸苷阳性对照组。其中空白对照组10只,每天上午给予生理盐水,前2周给药剂量8ml/kg,后4周给药剂量为12ml/kg;剩余18组(180只)为造模小鼠,每天上午给予50%酒精,前2周给药剂量8ml/kg,后4周给药剂量为12ml/kg。
[0112]
造模2周后(即后4周)每天下午给予治疗药物,给药剂量10ml/kg,其中空白对照组和酒精模型组给予生理盐水,实验组(化合物组1-15)、鸢尾黄素对照组及复方甘草酸苷阳性对照组,分别给予受试药物溶液(化合物1-15)、鸢尾黄素溶液及复方甘草酸苷溶液,具体给药方式采用灌胃给药,各组处理方式如表1所示:
[0113]
表1实验各组处理方式
[0114][0115]
注:上午和下午的灌胃时间间隔约6h。
[0116]
5.指标检测和方法
[0117]
5.1给药后观察
[0118]
每天给药前进行观察,精神状态、运动清理、毛色、大便等情况。
[0119]
5.2生化指标
[0120]
末次灌胃后,禁食不禁水12h,称重后异氟烷麻醉,腹主动脉取血,分离全血,全自动生化分析仪(au480)进行检测血清谷草转氨酶(ast)、丙氨酸转氨酶(alt)、甘油三酯(tg)、总胆固醇(tc);10%肝组织匀浆测定丙二醛(mda)。
[0121]
5.3脏器系数
[0122]
取血结束后,迅速解剖分离肝脏,冷生理盐水漂洗,滤纸拭干后称重,计算肝脏系数。
[0123]
6.实验结果
[0124]
6.1实验各组的生化指标和脏器系数的检测结果如表2所示。
[0125]
表2生化指标和脏器系数的检测结果(n=10,平均值
±
标准差)
[0126]
组别astalttgtcmda肝脏系数空白对照组96.5
±
13.4947.3
±
11.750.5
±
0.132.0
±
0.41.8
±
0.213.7
±
0.17酒精模型组198.2
±
40.294.4
±
19.431.3
±
0.274.1
±
0.93.2
±
0.594.5
±
0.21化合物1102.5
±
20.51
***
53.2
±
10.87
***
0.7
±
0.14
***
2.1
±
0.46
***
1.9
±
0.33
***
3.8
±
0.21
***
化合物2126.6
±
24.02
***
61.4
±
12.75
***
0.8
±
0.15
***
2.6
±
0.58
***
2.0
±
0.43
***
4.0
±
0.26
***
化合物3134.3
±
28.1
***
62.0
±
13.83
***
0.8
±
0.16
***
2.8
±
0.64
**
2.1
±
0.41
***
4.0
±
0.27
***
化合物4147.4
±
29.69
***
63.6
±
14.23
***
0.8
±
0.17
***
2.8
±
0.54
***
2.1
±
0.49
***
3.9
±
0.32
***
化合物5151.2
±
32.22
**
72.3
±
14.23
**
1.0
±
0.19
*
3.3
±
0.57
*
2.6
±
0.56
*
4.2
±
0.34
*
化合物6153.9
±
30.82
**
73.2
±
14.74
*
0.9
±
0.2
**
3.1
±
0.65
**
2.4
±
0.5
**
4.1
±
0.22
**
化合物7157.9
±
31.8
**
71.1
±
15.79
**
1.0
±
0.18
*
3.1
±
0.84
*
2.4
±
0.45
**
4.1
±
0.3
**
化合物8141.7
±
30.14
***
66.7
±
14.05
**
0.9
±
0.21
**
2.9
±
0.6
**
2.3
±
0.45
**
4.0
±
0.21
***
化合物9149.5
±
31.6
**
71.3
±
14.64
**
0.9
±
0.2
**
3.1
±
0.53
**
2.4
±
0.43
**
4.1
±
0.25
**
化合物10148.5
±
28.91
**
69.9
±
14.81
**
0.9
±
0.19
**
3.0
±
0.73
**
2.5
±
0.46
**
4.2
±
0.26
*
化合物11171.0
±
36.67
*
72.8
±
15.31
**
0.8
±
0.19
**
3.2
±
0.65
**
2.5
±
0.58
**
4.0
±
0.27
**
化合物12122.5
±
24.29
***
51.6
±
12.18
***
0.6
±
0.13
***
2.3
±
0.45
***
1.9
±
0.38
***
3.8
±
0.22
***
化合物13127.2
±
31.06
***
51.5
±
12.55
***
0.6
±
0.16
***
2.3
±
0.46
***
1.8
±
0.36
***
3.8
±
0.25
***
化合物14176.5
±
36.26
*
77.7
±
17.88
*
0.9
±
0.21
*
3.5
±
0.69
*
2.7
±
0.48
*
4.2
±
0.19
*
化合物15167.8
±
32.73
**
72.0
±
11.31
**
0.8
±
0.23
**
3.4
±
0.7
*
2.5
±
0.56
**
4.1
±
0.2
**
鸢尾黄素181.0
±
41.83
*
78.8
±
14.93
*
0.9
±
0.2
*
3.5
±
0.71
*
2.7
±
0.51
*
4.1
±
0.2
*
阳性对照组131.7
±
32.73
***
55.8
±
11.73
***
0.6
±
0.16
***
2.4
±
0.35
***
1.9
±
0.38
***
3.8
±
0.33
***
[0127]
注:*表示与模型对照组相比,p《0.05(t-test检验);
[0128]
**表示与模型对照组相比,p《0.01(t-test检验);
[0129]
***表示与模型对照组相比,p《0.001(t-test检验)。
[0130]
如表2所示,酒精模型组大鼠的各生化指标观察:血清谷草转氨酶(ast)、丙氨酸转氨酶(alt)、甘油三酯(tg)、总胆固醇(tc)、丙二醛(mda)相较于空白对照组均明显升高,肝脏指数也明显增加。本发明化合物1-15组大鼠的血清谷草转氨酶(ast)、丙氨酸转氨酶(alt)、甘油三酯(tg)、总胆固醇(tc),丙二醛(mda)以及肝脏指数和酒精模型组相比,存在显著差异,均得到不同程度的改善,且改善效果优于类似化合物鸢尾黄素(鸢尾黄素组各项指标与模型对照组相比,均为p《0.05);尤其是化合物1、2、12、13组大鼠和酒精模型组相比p《0.01或p《0.001,具有较好的改善效果。此外,化合物12、13对各指标的改善程度优于复方甘草酸苷阳性对照组。以上均证明本发明提供的6,7位成环异黄酮类化合物具有良好的治疗酒精性肝损伤的活性,具有很好的保肝效果。
[0131]
6.2给药后观察结果
[0132]
6.2.1观察酒精模型组大鼠结果
[0133]
酒精模型组大鼠出现不同程度的精神萎靡;摄食、饮水量减少,大便稀溏;大鼠毛色不光泽,稍有竖立情况出现,并且普遍出现用前爪挠嘴表现,醉酒表现:轻者走路不稳、动作呆板,重者翻倒,反射消失,个别大鼠出现呼吸急促。
[0134]
6.2.2观察实验组大鼠结果
[0135]
和酒精模型组相比,精神萎靡程度均有缓解,摄食饮水量和模型组相比减小幅度
得到缓和,大便稀溏亦有改善;部分有毛色不光泽情况,前爪挠嘴频率和模型组相比大幅降低,几乎没有翻倒情况的醉酒重者。
[0136]
通过对酒精模型组和实验组大鼠的行为进行观察对比,证明本发明提供的6,7位成环异黄酮类化合物具有明显的解酒作用。
[0137]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。