黄曲霉毒素标准物质及其制备方法和应用和花生油黄曲霉毒素b1标准物质
技术领域
1.本发明涉及黄曲霉毒素检测领域,具体涉及黄曲霉毒素标准物质及其制备方法和应用和花生油黄曲霉毒素b1标准物质。
背景技术:
2.黄曲霉毒素是二氢呋喃氧杂萘邻酮的衍生物,20多种结构均为多环芳烃化合物,其中呋喃香豆素环戊烯酮类:afb1、afb2、afb2a、afm1、afm2、afl、afq1;呋喃香豆素内酯类:afg1、afg2、afg2a。其中,afm1和afm2是afb1和afb2的代谢产物。其中afb1毒性最强,远远高于氰化物、鹤顶红、三聚氰胺和有机农药,被世界卫生组织认定为1a级危险物。花生是最易受到黄曲霉毒素污染的粮油作物之一。准确检测食品中黄曲霉毒素一直是食品安全、食品质量管理的重点。食品基体标准物质是保障检测数据准确性的重要计量溯源量具,既可以用来校准检测方法、快检仪器,也可以作为实验室质量控制样品,建立内外部质量控制评价系统。
3.现有市场上食品基体标准物质种类数量稀缺,最重要的原因是食品基体本身保质期短、污染物稳定性差,很难保证特性量值的均匀性、稳定性,以达到国家标准物质的要求。为了实现食用油基体中黄曲霉毒素的准确测定,需要有均匀、稳定的标准物质,而目前国内外未见相应的标准物质。因此,制备含有黄曲霉毒素的食用油基体标准物质对仪器状态的监测、检测实验室的质量控制以及检测方法的开发等具有重要的意义。
技术实现要素:
4.本发明的目的是为了克服现有技术存在的上述问题,提供一种黄曲霉毒素标准物质及其制备方法和应用和花生油黄曲霉毒素b1标准物质。本发明制备的黄曲霉毒素标准物质具有较好的均匀性和长期稳定性,能够在6个月保质期内良好保证样品中黄曲霉毒素检测量值的准确。
5.为了实现上述目的,本发明第一方面提供一种黄曲霉毒素标准物质的制备方法,选择天然条件下被黄曲霉毒素污染的油料作物样品,然后依次对其进行干燥、翻炒、榨油,然后将物料进行分离,得到榨出的油脂,并杀菌,得到所述黄曲霉毒素标准物质。
6.本发明第二方面提供如上所述的方法制备得到的黄曲霉毒素标准物质。
7.本发明第三方面提供一种花生油黄曲霉毒素b1标准物质,该标准物质中黄曲霉毒素b1的含量为5-50μg/kg。
8.本发明第四方面提供一种如上所述的方法在校准仪器或评价检测方法准确性中的应用。
9.本发明经对比发现天然污染黄曲霉毒素特别是黄曲霉毒素b1的样品比人工添加黄曲霉毒素得到的样品有较好的特性量值稳定性,因此采用天然污染油料作物作为原料,提供一种黄曲霉毒素标准物质的制备方法。本发明通过对油料作物产品采样、筛查,得到天
然污染黄曲霉毒素的油料作物样品,然后经过干燥、翻炒、榨油,然后将物料进行分离,得到榨出的油脂,并杀菌,得到所述黄曲霉毒素标准物质。本发明制备的黄曲霉毒素标准物质具有较好的均匀性和长期稳定性,能够在6个月保质期内良好保证样品中黄曲霉毒素检测量值的准确。
附图说明
10.图1是实施例1的花生油黄曲霉毒素b1标准物质的长期稳定性趋势分析图;
11.图2是实施例1的花生油黄曲霉毒素b1标准物质的短期稳定性趋势分析图;
12.图3是不同的提取液对回收率结果的影响;
13.图4是不同的超声时间对回收率结果的影响;
14.图5是不同的净化方式对回收率结果的影响;
15.图6是黄曲霉毒素b1的激发光谱图;
16.图7是黄曲霉毒素b1的发射光谱图;
17.图8是实施例1的花生油黄曲霉毒素b1标准物质的色谱图。
具体实施方式
18.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
19.第一方面,本发明提供了一种黄曲霉毒素标准物质的制备方法,该方法包括:选择天然条件下被黄曲霉毒素污染的油料作物样品,然后依次对其进行干燥、翻炒、榨油,然后将物料进行分离,得到榨出的油脂,并杀菌,得到所述黄曲霉毒素标准物质。
20.相比于人工在空白油料作物中添加黄曲霉毒素制备的标准物质,本发明提供的黄曲霉毒素标准物质的制备采取天然条件下被黄曲霉毒素污染的油料作物样品,不仅具有更好的量值稳定性,且均匀性更好。
21.根据本发明,优选的,所述被黄曲霉毒素污染的油料作物样品中黄曲霉毒素的含量与国标限量值相当或高于国标限量值。
22.根据本发明,为了使得制备的标准物质更有利于实际应用,优选的,所述被黄曲霉毒素污染的油料作物样品中黄曲霉毒素的含量为国标gb 2761限量的1-3倍。
23.其中,所述相当是指为国标gb 2761限量值的1-1.5倍。
24.需要说明的是,所述国标是指gb 5009.22-2016食品安全国家标准食品中黄曲霉毒素b族和g族的测定。
25.本发明的发明人在研究中还发现,相比于其他黄曲霉毒素,本发明特别适用于黄曲霉毒素b1标准物质的制备,当所述黄曲霉毒素为黄曲霉毒素b1时,所制备的黄曲霉毒素b1标准物质具有更好的量值稳定性和均匀性。
26.本发明的发明人在研究中发现,相比于其他油料作物样品,本发明特别适用于花生中黄曲霉毒素标准物质的制备,当所述油料作物样品为花生时,所制备的黄曲霉毒素标准物质具有更好的量值稳定性和均匀性。
27.根据本发明,为了进一步提高所制备的黄曲霉毒素标准物质的量值稳定性和均匀性,优选的,所述干燥的条件包括:采用100-140℃,更优选110-130℃的热风烘干,时间为0.5-2h,更优选为0.8-1.2h。
28.根据本发明,为了进一步提高所制备的黄曲霉毒素标准物质的量值稳定性和均匀性,优选的,所述翻炒的条件包括:温度为120-160℃,更优选为135-145℃,时间为0.5-2h,更优选为0.8-1.2h。其中,翻炒所用的工具没有特别的限制,例如可以为常用的家用炒锅。
29.根据本发明,优选的,所述翻炒的温度比干燥的温度高15-25℃。
30.根据本发明,为了进一步提高所制备的黄曲霉毒素标准物质的量值稳定性和均匀性,优选的,翻炒结束后,在物料温度仍然较高的情况下,将物料直接投入榨油机,并收集榨出的油脂。其中,所述榨油机没有特别的限制,例如可以为机械榨油机。
31.根据本发明,优选的,所述将物料进行分离的方法包括:先对物料进行物理沉降,再过滤。能够理解的是,在物理沉降过程中,对物料进行密封、静置,在此过程中物料不断冷却,其中所述物料沉降的时间不受特别的限制,以使得大颗粒残渣尽量都沉降,并使得物料冷却至室温为准。并且,能够理解的是,对物料进行物料沉降后,去除大颗粒残渣,然后对油脂过袋式过滤机以进一步过滤掉残渣,所述袋式过滤机的目数不受特别的限制,例如,可以为200-400目。
32.根据本发明,为了进一步提高所制备的黄曲霉毒素标准物质的量值稳定性和均匀性,优选的,所述杀菌的条件包括:温度为110-140℃,更优选为115-130℃,时间为0.5-2h,更优选为0.8-1.2h。
33.根据本发明,为了进一步提高所制备的黄曲霉毒素标准物质的量值稳定性和均匀性,优选的,该方法还包括:对杀菌后的物料分装,并充氩气密闭保存。能够理解的是,将所述黄曲霉毒素标准物质冷却至室温后即可进行分装。分装所用的容器不受特别的限制,例如可以为不透明塑料瓶,规格可以为50g/瓶。分装后向所述容器中充氩气,并密闭保存。
34.根据本发明,为了确保所制备的标准物质的均匀性,该方法还包括:在杀菌并包装后检测样品的均匀性。
35.均匀性是标准物质的基本属性,用于描述标准物质特性的空间分布特征。在标准物质的研制(生产)过程中必须进行均匀性评估,以证明其具有良好的均匀性。优选的,根据《一级标准物质技术规范》(jjf 1006-1994)和《标准物质定值的通用原则及统计学原理的要求》(jjf 1343-2012),对标准物质进行均匀性检验。
36.以花生油黄曲霉毒素b1标准物质的制备为例,具体的,对杀菌后的样品在不同的位置进行20-30个取样,然后采用液相色谱法进行黄曲霉毒素b1含量的测定,并依据jjf1343-2012《标准物质定值的通用原则及统计学原理》对测试结果进行统计。若各检测项目均匀性检验的统计量f值均小于f临界值,表明样品内和样品间无显著性差异,样品是均匀的。
37.根据本发明,优选的,该方法还包括对所述黄曲霉毒素标准物质进行定值。
38.其中,所述定值的方法可以为常规的方法,根据jjf 1343-2012《标准物质定值的通用原则及统计学原理》的要求,针对标准物质定值可采用两种不同原理的方法同时定值,或者采用一种方法多家实验室联合定值的方式。然而,对于基质相对复杂的植物油基质,例如花生油基质,标准物质难以采用两种不同原理方法同时定值,通常都采用一种准确的测
量方法、多家实验室联合定值的方式。本研究标准物质选择了采用一种准确测量方法8家实验室联合定值的方式。因此,优选的,所述定值的方法为采用一种检测方法并联合多方检测。
39.优选的,所述检测方法为高效液相色谱法,更优选的,所述检测方法包括:
40.(1)将所述黄曲霉毒素标准物质样品加入至甲醇-水溶液,混匀后进行超声处理,然后固液分离获得上清液;
41.其中,相对于1g所述黄曲霉毒素标准物质,甲醇-水溶液的用量为1-8ml,更优选为3-5ml;
42.和/或,甲醇-水溶液中甲醇的含量为60-80体积%,优选为65-75体积%;
43.和/或,所述超声的条件包括:温度为15-45℃,优选为25-35℃,时间为15-40min,优选为18-30min;
44.优选的,所述混匀的方式为涡旋混匀。
45.其中,所述固液分离的方式可以为常规的各种方式,例如,离心、过滤、静置等。优选的,在4000-10000rpm下进行离心5-15min以获得所述上清液。
46.(2)将所述上清液加入含有tritonx-100的pbs缓冲液中,得到上样液,然后采用spe固相萃取柱或免疫亲和柱(优选免疫亲和柱)进行黄曲霉毒素的提纯,得到含有黄曲霉毒素的纯化液;
47.优选的,相对于1ml所述上清液,所述pbs缓冲液的用量为5-15ml,优选为10-13ml。
48.优选的,在所述pbs缓冲液中,tritonx-100的含量为0.5-1.5体积%,更优选为0.8-1.2体积%。
49.根据本发明,优选的,将所述上样液加入至用spe固相萃取柱或免疫亲和柱中的速度为1-3ml/min。
50.根据本发明一种优选的实施方式,采用免疫亲和柱进行黄曲霉毒素的提纯,在加入上样液之前,还包括将免疫亲和柱内的液体排掉,然后将上样液移至注射器中,调节下滴速度,进行加样。
51.优选的,待加样完成后,使用水对免疫亲和柱进行清洗,并真空抽干亲和柱。
52.优选的,采用甲醇作为洗脱液对结合到亲和柱上的黄曲霉毒素进行洗脱,甲醇的流加速度优选为1-3ml/min。优选的,待甲醇流加完成后,真空抽干亲和柱。优选的,收集全部洗脱液,包括甲醇洗脱液以及真空抽出的液相。
53.优选的,还包括在40-60℃下用氮气将洗脱液吹干,用初始流动相(水:乙腈:甲醇=(6-8):(1-2):(1-2),优选7:1.5:1.5)定容,溶解残留物,然后进行滤膜过滤,收集滤液以备进样。
54.(3)采用液相色谱法测定所述纯化液中黄曲霉毒素的含量。
55.其中,所述液相色谱法的条件可以包括:
56.a)流动相:a相为水;b相为乙腈-甲醇,乙腈和甲醇的体积比为1:1;
57.b)等梯度洗脱条件:a相68%;b相32%;
58.c)色谱柱:c18柱(柱长150mm,柱内径4.6mm,填料粒径5μm);
59.d)流速:1.0ml/min;
60.e)柱温:40℃;
61.f)进样量:50μl;
62.g)光化学柱后衍生器;
63.h)激发波长:360nm;发射波长:440nm。
64.根据本发明,优选的,采用外标法进行定值,例如,用初始流动相为溶质配制一系列浓度的黄曲霉毒素标准工作溶液,以如上的液相色谱法进行检测(例如,配制黄曲霉毒素b1含量0.1mg/l、0.5mg/l、2.0mg/l、5.0mg/l、10.0mg/l、20.0mg/l、40.0mg/l系列标准工作溶液,由低到高浓度依次进样检测),然后以峰面积为纵坐标、浓度为横坐标作图,得到标准曲线回归方程。
65.根据本发明,可以通过如下的公式进行黄曲霉毒素b1含量计算。
[0066][0067]
式中:
[0068]
x——试样中黄曲霉毒素的含量,单位为微克每千克(μg/kg);
[0069]
ρ——进样溶液中黄曲霉毒素按照外标法在标准曲线中对应的浓度,单位为纳克每毫升(ng/ml);
[0070]v1
——试样提取液体积单位为毫升(ml);
[0071]v3
——样品经免疫亲和柱净化洗脱后的最终定容体积,单位为毫升(ml);
[0072]v2
——用于免疫亲和柱的分取样品体积,单位为毫升(ml);
[0073]
1000——换算系数;
[0074]
m——试样的称样量,单位为克(g)。
[0075]
根据本发明一种特别优选的实施方式,选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量与国标限量值相当或高于国标限量值。然后将物料放置于烘箱,采用115-125℃的热风烘干,时间为0.9-1.1h。烘干后,采用家用炒锅,在137-143℃,翻炒0.9-1.1h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收集至不锈钢桶中。将收集的花生油密封、静置20-30h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经280-320目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至118-125℃保持0.9-1.1h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0076]
第二方面,本发明还提供了如上所述的方法制备得到的黄曲霉毒素标准物质。
[0077]
第三方面,本发明还提供了一种花生油黄曲霉毒素b1标准物质,该标准物质中黄曲霉毒素b1的含量为5-50μg/kg。
[0078]
第四方面,本发明还提供了一种如上所述的方法在校准仪器或评价检测方法准确性中的应用。
[0079]
能够理解的是,如上所述的方法可以制备出具有较好的稳定性和均匀性的黄曲霉毒素标准物质,因此其中黄曲霉毒素的含量是已知的。因此,采用如上所述的方法制备黄曲霉毒素标准物质,并采用待校准的仪器或待评价准确性的检测方法测定黄曲霉毒素标准物质中的黄曲霉毒素的含量,可以对比测定得到的值和真实值,来判断待校准的仪器是否需要校准,或待评价准确性的检测方法的准确性高低,从而校准仪器或评价检测方法的准确
性。
[0080]
以下将通过实施例对本发明进行详细描述。以下实施例中,花生来自于山东花生主产区。
[0081]
实施例1
[0082]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0083]
1、黄曲霉毒素标准物质的制备
[0084]
选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量与国标限量值相当。然后将物料放置于烘箱,采用120℃的热风烘干,时间为1h。烘干后,采用家用炒锅,在140℃,翻炒1h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收集至不锈钢桶中。将收集的花生油密封、静置24h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经300目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至120℃保持1h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0085]
均匀性检测:
[0086]
在不同位置抽取杀菌后的花生油,获得25个样品,依据jjf 1343-2012《标准物质定值的通用原则及统计学原理》,以进行均匀性检验,依据植物油中黄曲霉毒素b1检测方法gb 5009.22-2016对黄曲霉毒素b1进行测定,每个样品测定3次。
[0087]
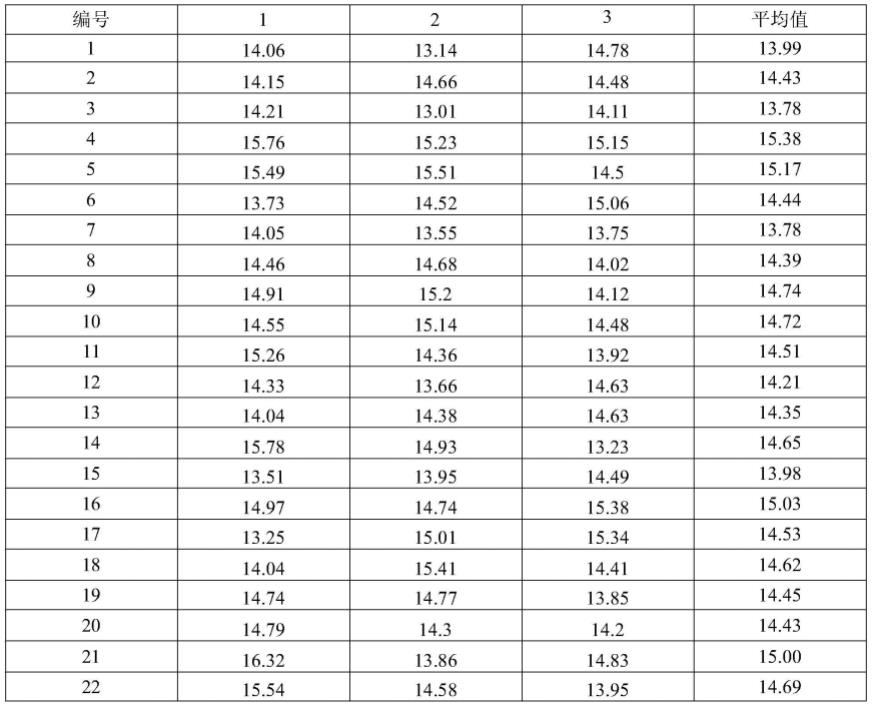
依据jjf 1343-2012《标准物质定值的通用原则及统计学原理》4.3对测试结果进行统计,数据统计结果见表1。其中各检测项目均匀性检验的统计量f值均小于f临界值,表明样品内和样品间无显著性差异,样品是均匀的。
[0088]
表1植物油标准物质均匀性检验数据汇总(单位:μg//kg)
[0089][0090][0091]
正态检验:依据夏皮罗-威尔克法检验数据w=0.9737w(25,0.95)=0.918,接受该组数据为正态分布。
[0092]
可疑数据取舍:
[0093]
依据dixon准则
[0094]
f(0.05,25)=0.443
[0095]
数据由小到大排列,r1=0.1606;rn=0.2291。较大者为:0.2291
[0096]
因为:0.2291《0.443,无可疑值。
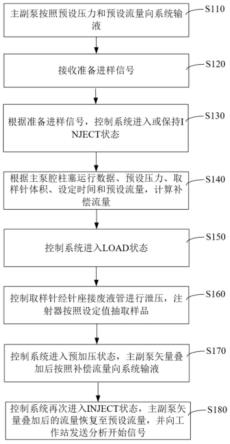
[0097]
依据grubbs准则
[0098]
λ(0.05,25)=2.822;均值为:14.52;标准偏差为:0.412
[0099]
无异常值
[0100]
均匀性数据计算如下:
[0101]
平均值为:14.52
[0102]
组间ss:12.23组间自由度df:24,组间ms:0.5095
[0103]
组内ss:21.36组内自由度df:50,组内ms:0.4272
[0104]
f0.05(24,50)=1.74经计算f=1.19,因此f值小于临界值表明组间与组内无明显差异,样品均匀。
[0105]
组间标准偏差sbb:0.1656重复性标准偏差sr:0.6536
[0106]
sbb《sr,重复性影响的不确定度ubb=0.1461。
[0107]
2、稳定性检验
[0108]
2.1长期稳定性
[0109]
根据《标准物质定值的通用原则及统计学原理》(jjf1343-2012)的要求,长期稳定性考察按先密后疏原则进行。因此,本项目分别在第0、1、2、4、6个月开展长期稳定性监测研究。每次随机取3个包装单元,每个单元取两个子样测定,测量方法与定值、均匀性检验采用的方法相同,结果如图1和表2所示。
[0110]
表2植物油标准物质长期稳定性数据汇总(单位:μg//kg)
[0111][0112][0113]
经计算结果如下:
[0114]
夏皮罗-威尔克法检验数据正态性,w=0.9584,w(30,0.95)=0.927,接受该组数据为正态分布。
[0115]
可疑数据取舍grubbs准则:
[0116]
λ(0.05,30)=2.908473;
[0117]
均值为:14.47;标准偏差为:0.2372,无异常值。
[0118]
稳定性检验-》趋势分析:线性拟合
[0119]
斜率b1=-0.00524
[0120]
截距b0=14.49
[0121]
s=0.2411
[0122]
斜率的标准偏差s(b1)=0.0204
[0123]
t分布临界值=2.05
[0124]
t*s(b1)=0.0419
[0125]
|b1|《t*s(b1):0.00524《0.0419
[0126]
不确定度u=s(b1)*时间间隔=0.0204*6=0.123
[0127]
因此,样品是稳定的。
[0128]
2.2短期稳定性
[0129]
根据jjg 1006-1994《一级标准物质技术规范》和jjf 1343-2012《标准物质定值的通用原则及统计学原理》的要求,标准物质短期稳定性评价标准物质在运输过程中特性值受环境温度变化而产生的影响。随机抽取两个包装单元置于60℃温度环境下保存,分别在第0、1、3、5、7天进行稳定性监测,测定方法与长期稳定性监测一致,每个单元平行测定两次,采用趋势分析对监测数据进行统计分析,结果如图2和表3所示。
[0130]
表3植物油标准物质短期稳定性数据汇总(单位:μg//kg)
[0131][0132][0133]
夏皮罗-威尔克法检验数据正态性:
[0134]
w=0.968,w(10,0.95)=0.842,接受该组数据为正态分布。
[0135]
可疑数据取舍:
[0136]
dixon准则:f(0.05,10)=0.53,r1=0.3182;rn=0.2969,较大者为:0.3182。因为0.3182《0.53;因此无可疑值。
[0137]
grubbs准则:λ(0.05,10)=2.29;均值为:14.41;标准偏差为:0.257,无异常值。
[0138]
稳定性检验-》趋势分析:线性拟合法,斜率b1=-0.0229,截距b0=14.48,s=0.2649,斜率的标准偏差s(b1)=0.0327,t分布临界值=2.3,t*s(b1)=0.0752,|b1|《t*s(b1):0.0229《0.0752。短期稳定性引入的不确定度u=s(b1)*时间间隔=0.0327*7=0.229
[0139]
因此,样品是稳定的。
[0140]
3.标准物质定值
[0141]
3.1定值方式确定
[0142]
根据jjf 1343-2012《标准物质定值的通用原则及统计学原理》的要求,本研究标准物质选择了采用一种准确测量方法8家实验室联合定值的方式。
[0143]
3.2定值方法描述
[0144]
方法原理
[0145]
样品中的黄曲霉毒素b1经甲醇-水溶液的混合溶液提取,提取液经免疫亲和柱净化和富集,净化液浓缩、定容和过滤后经液相色谱分离,柱后光化学衍生,经荧光检测器检测,外标法定量。
[0146]
试剂材料
[0147]
甲醇(ch3oh):色谱纯;乙腈(ch3cn):色谱纯;氯化钠(nacl);磷酸氢二钠(na2hpo4);磷酸二氢钾(kh2po4);氯化钾(kcl);盐酸(hcl);tritonx-100[c
14h22
o(c2h4o)n];浓硝酸(hno3);标准品:gbw(e)100302甲醇中黄曲霉毒素b1溶液标准物质。
[0148]
仪器和设备
[0149]
匀浆机;天平:感量0.00001g;涡旋混合器;离心机:转速≥6000r/min;玻璃纤维滤纸:快速、高载量、液体中颗粒保留1.6μm;固相萃取装置(带真空泵);氮吹仪;液相色谱仪:配荧光检测器;液相色谱柱:c18柱(柱长150mm,柱内径4.6mm,填料粒径5μm);光化学柱后衍生器(适用于光化学柱后衍生法);免疫亲和柱:aftb1柱容量≥200ng,aftb1柱回收率≥80%,aftg2的交叉反应率≥80%;黄曲霉毒素固相净化柱;一次性微孔滤头:带0.22μm微孔滤膜(所选用滤膜应采用标准溶液检验确认无吸附现象,方可使用);筛网:1mm~2mm试验筛孔径。
[0150]
样品前处理
[0151]
称取5g试样(精确至0.01g)于50ml离心管中,加入20.0ml甲醇-水溶液(70 30),涡旋混匀,室温条件超声波震荡20min,在6000r/min下离心10min,取上清液备用。准确移取4ml上述上清液,加入46ml1%tritonx-100的pbs,混匀。免疫亲和柱内的液体放弃后,将上
述样液移至50ml注射器筒中,调节下滴速度,控制样液以1-3ml/min的速度稳定下滴。待样液滴完后,往注射器筒内加入2
×
10ml水,以稳定流速淋洗免疫亲和柱。待水滴完后,用真空泵抽干亲和柱。脱离真空系统,在亲和柱下部放置10ml刻度试管,取下50ml的注射器筒,2
×
1ml甲醇洗脱亲和柱,控制1-3ml/min的速度下滴,再用真空泵抽干亲和柱,收集全部洗脱液至试管中。在50℃下用氮气缓缓地将洗脱液吹至近干,用初始流动相定容至1.0ml,涡旋30s溶解残留物,0.22μm滤膜过滤,收集滤液于进样瓶中以备进样。
[0152]
液相色谱参考条件
[0153]
a)流动相:a相,水;b相,乙腈-甲醇(50 50);
[0154]
b)等梯度洗脱条件:a,68%;b,32%;
[0155]
c)色谱柱:c18柱(柱长150mm,柱内径4.6mm,填料粒径5μm);
[0156]
d)流速:1.0ml/min;
[0157]
e)柱温:40℃;
[0158]
f)进样量:50μl;
[0159]
g)光化学柱后衍生器;
[0160]
h)激发波长:360nm;发射波长:440nm;
[0161]
样品测定
[0162]
外标法配制以初始流动相为溶质的黄曲霉毒素b1含量0.1mg/l、0.5mg/l、2.0mg/l、5.0mg/l、10.0mg/l、20.0mg/l、40.0mg/l系列标准工作溶液由低到高浓度依次进样检测,以峰面积为纵坐标、浓度为横坐标作图,得到标准曲线回归方程。
[0163]
待测样液中待测化合物的响应值应在标准曲线线性范围内,测定待测溶液浓度。
[0164]
结果计算
[0165]
试样中黄曲霉毒素b1含量计算公式如下:
[0166][0167]
式中:
[0168]
x——试样中黄曲霉毒素的含量,单位为微克每千克(μg/kg);
[0169]
ρ——进样溶液中黄曲霉毒素按照外标法在标准曲线中对应的浓度,单位为纳克每毫升(ng/ml);
[0170]v1
——试样提取液体积单位为毫升(ml);
[0171]v3
——样品经免疫亲和柱净化洗脱后的最终定容体积,单位为毫升(ml);
[0172]v2
——用于免疫亲和柱的分取样品体积,单位为毫升(ml);
[0173]
1000——换算系数;
[0174]
m——试样的称样量,单位为克(g)。
[0175]
计算结果保留三位有效数字。
[0176]
3.3定值方法的优化
[0177]
样品前处理参数的优化
[0178]
1)样品提取液对提取效率的影响
[0179]
前处理操作中使用提取液将样品中aft b1(黄曲霉毒素b1)萃取至溶液中,其中提取液的配比起到了非常重要的作用,分别采用甲醇:水(70:30;60:40;80:20)和乙腈:水
(80:20;60:40)测试样品的回收率,其余条件均与“3.2”中相同。
[0180]
分别取六只三角瓶,编号
①
、
②
、
③
、
④
、
⑤
、
⑥
。准确称取样品于三角瓶中,分别加入甲醇:水(70:30);甲醇:水(60:40);甲醇:水(80:20);乙腈:水(80:20);乙腈:水(60:40)至六个不同的三角瓶,室温超声20min,离心取上清液,过免疫亲和柱、氮吹后定容,液相色谱仪平行测定三次,确定最佳提取剂。结果如表4和图3所示。
[0181]
表4提取液组成优化数据汇总
[0182][0183][0184]
对比不同提取液测得样品的回收率,其中甲醇:水(70:30)的配比提取效率最高,达到99.5%。因此选择甲醇:水(70:30)作为提取剂。
[0185]
2)提取时间的确定
[0186]
前处理中提取时间将影响到提取效率,因此针对超声波提取时间分别采用10min、20min、30min对比样品回收率,重复实验三次确定最佳的超声提取时间,其余条件均与“3.2”中相同。结果如表5和图4所示。
[0187]
表5超声时间优化数据汇总
[0188][0189]
对比不同振荡时间得到样品的回收率,其中超声10min回收率偏低,仅为90.2%,20min与30min振荡结果差距不大,因此选择20min振荡时间。
[0190]
3)不同净化方式对结果的影响
[0191]
在毒素测定中常用的净化方式通常有液液萃取、spe固相萃取柱和免疫亲和柱等方法,分别对比三种净化方法对结果的影响。液液萃取采用三氯甲烷两次萃取,合并萃取液。固相萃取柱采用waters oasis hlb固相萃取柱。免疫亲和柱采用romer starline黄曲霉毒素b1小柱。其余条件均与“3.2”中相同,结果如表6和图5中所示。
[0192]
表6净化方式验证数据汇总
[0193][0194]
色谱条件的优化
[0195]
色谱条件中不同种类的液相色谱柱、不同荧光检测波长及不同流动相组成均会对样品中黄曲霉毒素b1的信号峰分离造成影响,分别选用waters c18柱(4.6mm i.dx 150mm,5μm)、agilent c18(4.6mm i.dx 150mm,5μm),实验发现,两种色谱柱分离效果和灵敏度略有差别,均能基线分离。
[0196]
流动相的组成和洗脱程序将直接影响分析物峰型、分离效果以及方法灵敏度等。本实验以分析物的分离程度为考察标准,比较了有机溶剂乙腈、甲醇等流动相条件,不同的流动相均能得到分离度较好的谱图,依据实验结果最终确定甲醇/乙腈混合相(1:1,v/v)为有机相,使用纯水为水相。优化后的荧光检测波长:激发波长360nm(如图6所示),发射波长440nm(如图7所示)。样品中黄曲霉毒素b1色谱图如图8所示。
[0197]
3.4定值方法的验证
[0198]
标准曲线线性、检出限、定量限
[0199]
称取经检测黄曲霉毒素b1含量低于检出限的空白花生油样品,依据定值方法进行前处理,制备空白基质提取液。向空白基质提取液中加入适量的混合标准液配制标准工作液,按照前述检测方法中的条件进行测定。以目标物的质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制工作曲线。分别计算毒素在3倍信噪比和10倍信噪比响应时对应的质量浓度,确定方法对于各目标物的检出限(lod)和定量限(loq),结果见表7。从结果可以看出,各毒素目标物在其对应的浓度范围内线性关系良好。相关系数均大于0.999,线性范围满足风险监控的需求。
[0200]
表7标准曲线线性及检出限、定量限
[0201][0202][0203]
3.5回收率及精密度
[0204]
验证方法回收率及精密度。平行称取6个经检测黄曲霉毒素b1低于检出限的花生油样品,分别向样品中添加高、中、低水平含量的黄曲霉毒素b1标准品,每个水平重复测定两次。回收率结果见表8。回收率的计算方法见下式。
[0205][0206]
表8黄曲霉毒素b1检测方法回收率
[0207][0208]
结果表明该实验回收率符合方法要求:方法线性范围内,回收率满足90%~110%。
[0209]
精密度:
[0210]
对高、中、低水平加标的三种样品进行测定,每种样品分别进行6次重复实验。按步骤3.1处理样品,取6次含量结果进行精密度计算,结果见表9。
[0211]
表9黄曲霉毒素b1检测方法精密度
[0212][0213]
结果表明该方法精密度符合测试要求:被测组分含量在1~20μg/kg时,rsd值满足<10%。
[0214]
3.6多家实验室联合定值
[0215]
3.6参与联合定值的实验室
[0216]
本基体标准物质采用8家实验室联合定值。由标准物质研制单位“中粮营养健康研究院”统一组织与实施联合定值。联合定值单位的遴选基于我国具有相关检测资质的、专业的、权威的实验室,并对参加单位的定值能力充分调研与考查。参加联合定值实验室单位名称具体如下:
[0217]
1.国家副食品质量监督检验中心
[0218]
2.中国检验检疫科学研究院综合检测中心
[0219]
3.国家粮食和物资储备局粮油质量检验测试中心
[0220]
4.北京市理化分析测试中心
[0221]
5.大连出入境检疫局检验检疫技术中心
[0222]
6.吉林省产品质量监督检验院
[0223]
7.上海市食品研究所
[0224]
8.河北省食品检验研究院
[0225]
参加联合定值的8家实验室,均是cnas认可的全国食品检测权威实验室,常年承担市场监管总局国家食品安全抽检项目,其中五家检测机构具备国家市场监管总局、国家卫健委、农业农村部联合发布的食品复检机构资质。对本研究植物油中黄曲霉毒素b1的定值检测提供了可靠保证。联合定值的实施方案主要包括:组织召开联合定值研讨会;由标准物质研制单位开展定值方法的研究,提供《定值作业指导书》、定值方法,统一分发定值所需要的标准物质样品。各参加实验室参照定值方法结合各自仪器型号进一步优化定值方法,并完成标准物质候选物样品定值,同时提供实验设备、仪器型号以及具体操作过程等文件材料。
[0226]
定值结果及分析
[0227]
本研究的定值方式参照jjf 1343-2012《标准物质定值的通用原则及统计学原理》,定值结果见表10。
[0228]
表10植物油中黄曲霉毒素b1标准物质定值统计结果
[0229][0230][0231]
1)组内数据可疑值判定:对每一组独立测量结果,采用格拉布斯(grubbs)法和狄克逊(dixon)法检验是否存在可疑值:
[0232]
grubbs准则:计算残差若|νi|
max
/s值小于λ(α,n),则无异常值,所有数据保留。给定的显著性水平α=0.05,测量次数n为8时,其临界值分别为λ(0.05,8)=2.274。
[0233]
dixon准则:计算r1值和rn值,若r1及rn值均小于f(α,n)值,则无异常值,所有数据保留。给定的显著性水平α=0.05,测量次数n分别为8时,其临界值分别为f(0.05,4)=0.926。
[0234]
8家单位定值数据计算结果均通过grubbs检验及dixon检验无异常值。
[0235]
2)组间数据等精度检验:对各组数据的标准偏差采用科克伦(cochran)法进行等精度检验:
[0236]
计算若c值小于c(α,m,n),则组间数据等精度。给定的显著性水平α=0.05,临界值c(0.05,8,8)=0.3043。
[0237]
3)当各组数据处于等精度时,采用格拉布斯(grubbs)法检验各组数据的平均值是否存在显著性差异。给定的显著性水平α=0.05,8组数据的临界值λ(0.05,8)=2.126。如平均值无显著性差异,求出总平均值,即为标准值。
[0238]
总平均值
[0239]
总平均值的标准不确定度,即不确定度a类分量ua用下式表示:
[0240][0241]
4)当各组数据不等精度时,采用不等精度加权方式处理。其权重用各自测量方法的不确定度计算,加权总平均值即为标准值。
[0242]
加权总平均值
[0243]
加权总平均值的标准不确定度,即不确定度a类分量ua用下式表示:
[0244][0245]
其中:
[0246]
5)不确定度分析
[0247]
不确定度来源
[0248]
标准物质定值结果的不确定度由三部分组成,分别为:标准物质的均匀性引入的不确定度;标准物质的稳定性引入的不确定度;标准物质的定值过程带来的不确定度。以下分别对不确定度评定过程进行详细说明。
[0249]
均匀性引入的不确定度
[0250]
根据均匀性检验数据,样品不均匀引入的不确定度为0.1461μg/kg,计算样品均匀性引入的相对标准不确定度为:瓶间均匀性不确定度除以标准值,即0.1461/14.39=1.02%。
[0251]
稳定性引入的不确定度
[0252]
根据长期稳定性检验数据,样品不稳定引入的不确定度分析如下,长期稳定性引入的不确定度为0.123μg/kg,短期稳定性引入的不确定度为0.229μg/kg,计算样品稳定性引入的相对标准不确定度为:合成长期稳定性与短期稳定性引入的不确定度,最终结果为1.81%。
[0253]
定值不确定度评定
[0254]
定值结果不确定度由测量重复性引入的不确定度ua(a类标准不确定度)和称量等过程引入的不确定度ub两部分组成。
[0255]
a类不确定度
[0256]
对于多个实验室合作定值,组间数据经等精度检验后,计算相应不确定度,为0.697μg/kg,计算样品定值引入的相对标准不确定度为:0.697/14.39=4.84%。
[0257]
b类标准不确定度
[0258]
按照结果计算公式,b类不确定度主要由以下几个部分引入:
①
黄曲霉毒素b1标准溶液浓度;
②
试样提取液;
③
样品经免疫亲和柱净化洗脱后的最终定容溶液;
④
用于免疫亲和柱的分取样品溶液;
⑤
样品称样量。
[0259]
(1)黄曲霉毒素b1标准溶液不确定度
[0260]
黄曲霉毒素b1标准溶液是采用gbw(e)100302浓度为(1.96μg/ml,不确定度0.09μg/ml)经过两次稀释后得到工作溶液,其不确定度分析过程如下:
[0261]
黄曲霉毒素b1标准溶液(1.96μg/ml)引入的不确定度0.09μg/ml,相对标准不确定度为4.59%。
[0262]
称量用电子天平检定证书中天平称量不确定度0.15mg,假定为矩形分布换算成标准不确定度为:
[0263][0264]
储备液通过两次稀释得到工作校准溶液用于样品测定,所用天平为万分之一天平,由天平称量引入的合成不确定度为0.09mg。
[0265]
a、第一次稀释到100ng/kg引入的不确定度
[0266]
①
储备溶液约1g,相对标准不确定度:urel称量=0.09mg/1000mg=0.009%;
[0267]
②
称量溶剂约20g,相对标准不确定度:urel称量=0.09mg/20000mg=0.00045%;
[0268]
b、第二次稀释稀释到40ng/kg引入的不确定度
[0269]
①
称量上述溶液约0.4g,相对标准不确定度:urel称量=0.09mg/400mg=0.0225%;
[0270]
②
称量溶剂约1g,相对标准不确定度:urel称量=0.09mg/1000mg=0.009%。
[0271]
合成工作校准溶液浓度相对不确定度
[0272][0273]
(2)试样提取液引入的不确定度
[0274]
由万分之一天平称量引入的合成不确定度为0.09mg。称量溶剂约20g,相对标准不确定度:urel称量=0.09mg/20000mg=0.00045%;
[0275]
(3)样品经免疫亲和柱净化洗脱后的最终溶液引入的不确定度
[0276]
本实验所用万分之一天平,同上,合成称量不确定度为:为0.09mg。洗脱后溶液采用称重法,称重溶剂约20g,由天平称量引入的相对标准不确定度为0.09mg/20000mg=0.00045%。
[0277]
(4)用于免疫亲和柱的分取样品溶液引入的不确定度
[0278]
本实验所用万分之一天平,同上,合成称量不确定度为:为0.09mg。洗脱后溶液采用称重法,称重溶剂约4g,由天平称量引入的相对标准不确定度为0.09mg/4000mg=0.0022%。
[0279]
(5)样品称量引入的不确定度
[0280]
样品称重引入的不确定度,样品称重量为5g,本实验所用万分之一天平,由样品称量引入的不确定度为:
[0281]
同上,合成称量不确定度:us=0.09mg
[0282]
相对标准不确定度:us=0.09mg/5000mg=0.0018%
[0283]
(6)合成b类不确定度
[0284]
b类不确定度合成:
[0285][0286]
合成标准物质定值不确定度
[0287]
合成标准物质定值不确定度:
[0288][0289][0290]
合成不确定度
[0291]
合成不确定度等于定值过程中引入的不确定度、均匀性引入的不确定度和稳定性引入的不确定度的平方和的开方,即样品中黄曲霉毒素b1的合成不确定度为
[0292][0293][0294]
相对扩展不确定度:u
rel
=k
×urel
[0295]urel
=2
×
6.99%=13.98%
[0296]
扩展不确定度=相对扩展不确定度
×
标准值
[0297]
u=14.39
×
13.98%=2.01μg/kg
[0298]
结果表达
[0299]
本标准物质以通过国家标准验证程序,并经过定值实验室全面方法学验证的高效液相色谱-柱后衍生法高准确度方法作为定值方法。标准物质研制技术路线、样品制备及定值方法的选择充分考虑了目前国内外相关限量要求和检测方法特点。均匀性和稳定性良好,标准值确定及不确定度评定合理,符合国家标准物质相关技术规范要求。本标准物质可用于植物油中黄曲霉毒素b1分析方法的评价、分析过程的质量控制及实验室能力考核。本标准物质定值结果及不确定度等相关信息见表11。
[0300]
表11标准物质量值表
[0301]
名称质量分数(μg/kg)扩展不确定度(μg/kg)植物油中黄曲霉毒素b114.392.28
[0302]
实施例2
[0303]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0304]
选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量为国标限量值的3倍。然后将物料放置于烘箱,采用110℃的热风烘干,时间为0.8h。烘干后,采用家用炒锅,在135℃,翻炒0.8h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收
集至不锈钢桶中。将收集的花生油密封、静置20h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经200目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至115℃保持0.8h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0305]
按照实施例1的方法进行样品长期稳定性、短期稳定性的测试,以及黄曲霉毒素b1的定值,结果如表12所示。
[0306]
实施例3
[0307]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0308]
选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量为国标限量值的2倍。然后将物料放置于烘箱,采用130℃的热风烘干,时间为1.2h。烘干后,采用家用炒锅,在145℃,翻炒1.2h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收集至不锈钢桶中。将收集的花生油密封、静置30h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经400目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至130℃保持1.2h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0309]
按照实施例1的方法进行样品长期稳定性、短期稳定性的测试,以及黄曲霉毒素b1的定值,结果如表12所示。
[0310]
实施例4
[0311]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0312]
选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量接近国标限量值。然后将物料放置于烘箱,采用100℃的热风烘干,时间为0.5h。烘干后,采用家用炒锅,在120℃,翻炒0.5h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收集至不锈钢桶中。将收集的花生油密封、静置20h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经200目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至110℃保持0.5h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0313]
按照实施例1的方法进行样品长期稳定性、短期稳定性的测试,以及黄曲霉毒素b1的定值,结果如表12所示。
[0314]
实施例5
[0315]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0316]
选择天然条件下被黄曲霉毒素b1污染的花生样品,其中,所述被黄曲霉毒素b1污染的油料作物样品中黄曲霉毒素的含量接近国标限量值。然后将物料放置于烘箱,采用140℃的热风烘干,时间为2h。烘干后,采用家用炒锅,在160℃,翻炒2h。翻炒后,保持物料温度较高的情况下,直接放入机械榨油机,通过螺杆挤压使花生中的油脂挤压流出,并收集至不锈钢桶中。将收集的花生油密封、静置30h,使物料冷却至室温,且将大颗粒残渣沉降分离,然后将上层油脂经400目袋式过滤机进一步过滤除去残渣。过滤后的澄清花生油加热至140℃保持2h,通过高温杀灭物料中残留的细菌。杀菌后的物料冷却至室温即可分装。包装采用
不透明塑料瓶,充氩气密闭封装,规格50g/瓶。
[0317]
按照实施例1的方法进行样品长期稳定性、短期稳定性的测试,以及黄曲霉毒素b1的定值,结果如表12所示。
[0318]
实施例6
[0319]
用于说明本发明提供的黄曲霉毒素标准物质的制备
[0320]
按照实施例1的方法进行黄曲霉毒素b1标准物质的制备,不同的是,天然条件下被黄曲霉毒素污染的花生样品的黄曲霉毒素b1的含量为国标限量值的10倍。结果如表12所示。
[0321]
对比例1
[0322]
本实施例用于说明参比黄曲霉毒素标准物质的制备
[0323]
按照实施例1的方法进行黄曲霉毒素b1标准物质的制备,不同的是,向所述花生样品中人工添加黄曲霉毒素b1,得到黄曲霉毒素b1的含量为国标的2倍的花生原料。结果如表12所示。
[0324]
表12
[0325][0326][0327]
其中,由于扩展不确定度与油料作物样品中黄曲霉毒素含量有关,因此对比不同
黄曲霉毒素含量的油料作物样品时,需要参考相对扩展不确定度。并且相对扩展不确定度是稳定性和均匀性的综合情况的反映,因此对于实施例1-6和对比例1的黄曲霉毒素标准物质的均匀性和稳定性的反映,以相对扩展不确定度为准。
[0328]
通过表12的结果可以看出,实施例1-6具有较好的的效果,其中实施例1-3的效果更好。对比例1不具备长期稳定性和短期稳定性。
[0329]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。