1.本发明涉及一种疫苗及其制备方法,更具体一点说,涉及一种猪圆环病毒2型和猪支原体肺炎二联腺病毒活载体疫苗及其制备方法,属于疫苗制备领域。
背景技术:
2.猪圆环病毒2型(porcine circovirus type 2,pcv2)是引起断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome,pmws)的主要病原体。猪肺炎支原体(mycoplasma hyopneumoniae,mhp)是引起猪支原体肺炎(mycoplasma pneumonia of swine,mps)的主要病原体。研究发现pcv2和mhp感染不仅会引起猪的原发性感染,更重要的是对感染猪的免疫系统造成伤害,致使mhp经常会与pcv2等其他病原并发或继发感染,从而使得预防和控制猪呼吸道传染病的难度增加,猪群饲料报酬降低,死亡率上升,给养猪业造成了重大经济损失。目前,我国防控mhp和pcv2感染的主要手段是进行疫苗接种。为减少疫苗接种频次,降低因疫苗接种应激等因素对养猪业的影响,研发联合疫苗已成为动物疫苗行业发展的趋势。
3.目前,可同时预防mhp和pcv2两种病原体的二联疫苗已有产品获批上市,但大多是以灭活的mhp和杆状病毒表达的pcv2 cap蛋白混合制备而成,关于mhp和pcv2基因工程亚单位二联疫苗产品仍未见上市。
技术实现要素:
4.为了解决上述现有技术问题,本发明提供具有能够诱导产生特异性体液免疫和细胞免疫效应以及能够实现基于腺病毒载体的mhp和pcv2二联基因工程亚单位疫苗制备等技术特点的一种猪圆环病毒2型和猪支原体肺炎二联腺病毒活载体疫苗及其制备方法。
5.为了实现上述目的,本发明是通过以下技术方案实现的:
6.本发明一种猪圆环病毒2型和猪支原体肺炎二联腺病毒活载体疫苗,将具有免疫原性的mhp的p97r1、p46、p42蛋白与pcv2的cap蛋白分别克隆到人5型复制缺陷型腺病毒载体上,包装出的重组腺病毒radv-p97r1、radv-p46、radv-p42、radv-cap,能够按照比例混合后作为活载体疫苗,该活载体疫苗能够免疫实验对象,并且通过分析其诱导机体产生免疫应答的效应。
7.本发明一种猪圆环病毒2型和猪支原体肺炎二联腺病毒活载体疫苗的制备方法,该制备方法包括:在真核细胞中表达猪肺炎支原体和猪圆环病毒2型的抗原蛋白,按照腺病毒表达系统进行抗原基因的密码子优化,通过分子生物学技术将其亚克隆到pshuttle-cmv载体的多克隆位点,分别得到腺病毒穿梭载体pshuttle-cmv-p97r1、pshuttle-cmv-p46、pshuttle-cmv-p42和pshuttle-cmv-cap;同时为了验证重组腺病毒表达外源蛋白的可行性,构建了可表达绿色荧光蛋白的腺病毒穿梭载体pshuttle-cmv-egfp;利用bj5183菌株中含有sbcbc和recbc两种突变,有利于转入目的基因与腺病毒骨架质粒的重组的特性构建了
重组腺病毒骨架载体adv-p97r1、adv-p46、adv-p42、adv-cap和adv-egfp;将构建成功的重组腺病毒质粒的itr通过酶切的形式暴露出来,并转染hek293细胞,缺失的病毒组装基因在细胞内得到补充,从而在hek293细胞中完成重组腺病毒的包装,对转染重组腺病毒骨架载体的hek293细胞反复冻融使细胞破裂,释放出p0代病毒;将所得的重组病毒大量扩增并通过rt-pcr及western blot检测,对鉴定正确的重组腺病毒进行纯化,分装后储存至-80℃备用。
8.优选的,该制备方法包括:线性化载体的制备;p97r1、p46、p42、cap基因的pcr扩增;电转化e.coli bj5183感受态细胞制备;骨架质粒padeasy-1电转化e.coli bj5183;转染hek293细胞;重组腺病毒的鉴定。
9.优选的,线性化载体的制备步骤为:取pshuttle-cmv质粒1.0μg用kpnⅰ和hindⅲ进行双酶切,双酶切体系总体积为50μl,双酶切体系包括5μl的10
×
q.cut buffer、1μl的q.cut kpn i、1μl的q.cut hindⅲ、小于或等于1μg的dna、小于50μl无rna酶的ddh2o,将上述成份混合均匀后,置于37℃水浴锅中酶切过夜。
10.优选的,p97r1、p46、p42、cap基因的pcr扩增过程:以密码子优化后合成的携带有p97r1、p46、p42和cap基因重组质粒puc57-mini-p97r1-p46-p42和实验室保存的pcdna3.1( )-cap为模板,用特定引物以及反应体系分别对p97r1、p46、p42和cap基因进行pcr扩增,反应结束后用1.0%琼脂糖凝胶电泳鉴定并用axygen试剂盒按照产品说明书进行清洁回收。
11.优选的,扩增基因p97r1的引物为p97r1-f、p97r1-r,p97r1-f的碱基序列为ctagagatctggtaccatggaaggaaaaagagaggaag,p97r1-rf的碱基序列为ggatatcttatctagttacagctccaggaacacgtt,扩增长度为393bp;扩增基因p46的引物为p46-f、p46-r,p46-f的碱基序列为atccgctagagatctatgcaagactacaacgacaaag,p46-r的碱基序列为ggatatcttatctagttaagcatctgggttgtccacac,扩增长度为291bp;扩增基因p42的引物为p42-f、p42-r,p42-f的碱基序列为atccgctagagatctatgatcgaggccgctcctaga,p42-r的碱基序列为ggatatcttatctagttagtcctgtttgatttcagca,扩增长度为501bp;扩增基因cap的引物为cap-f、cap-r,cap-f的碱基序列为atccgctagagatctatgacatatcccaggcgg,cap-r的碱基序列为ggatatcttatctagttatggattcaggggtgggtcc,扩增长度为702bp。
12.优选的,pcr反应体系,其包括25μl prime starmax premix、1μlprimer 1、1μl primer 2、小于200ng template、小于50μl ddh2o,pcr反应程序:按照顺序,98℃反应10s,55℃反应30s,72℃反应10s,72℃反应2min,4℃保存。
13.优选的,包括无缝克隆体系,无缝克隆体系总使用量为10μl,其包括5~50ng的纯化的pcr片段;25~50ng线性化载体;5μl 2
×
seamless cloning mix;小于10μl ddh2o(无rna酶),制备过程为:将含有上述无缝克隆体系样品的pcr管立即放入pcr仪中,50℃孵育25min,反应结束后,取5μl上述反应溶液加入到50~100μl dh5α感受态细胞中,涡旋震荡混匀,冰上放置30min;42℃水浴90s,从水浴锅中拿出后立即冰浴,静置5min;加无抗生素的lb,37℃,220rpm培养1h;涂布至含有kan的固体lb培养基平板上,培养12~16h,培养结束后,挑单克隆至lb液体培养基,220rpm,37℃震荡培养12h。
14.优选的,电转化e.coli bj5183感受态细胞制备:1)以1:100的比例将-80℃保存的e.coli bj5183菌种接入5ml lb培养液,其中含50μg/ml链霉素,37℃振荡过夜;2)接菌到
200ml lb培养基中,37℃培养到od
600
为0.6为止;3)将菌液分装到50ml离心管中,冰水浴2~4h;4)4℃,2600
×
g离心10min,收集菌体;5)用提前预冷的200ml的10%甘油重悬沉淀;6)4℃,2500
×
g离心30min;7)重复步骤4)、5);8)用20ml上清重悬菌体,弃剩余上清液,转移菌液至50ml离心管中;9)4℃,2600
×
g离心10min。弃上清,留400μl重悬,分装并保存至-80℃冰箱备用。
15.优选的,骨架质粒padeasy-1电转化e.coli bj5183:将提前在4℃预冷的电转杯置于冰水浴中以维持低温;将e.coli bj5183从-80℃冰箱中取出,置于冰水浴中以较慢的速度解冻;取2μl经axygen小提试剂盒抽提并以ddh2o洗脱的腺病毒骨架质粒padeasy-1加入已解冻的e.coli bj5183中,混匀后转移至预冷的电转杯中;擦去电转杯上的冷凝水,将电转杯放置于电转仪中,电转条件设置为:2500v,200ohms,25mfd;电转完成后,立即用lb培养基重悬电转杯中的液体混合物,取菌液200μl用涂布器均匀涂在固体lb培养基中,于37℃培养箱中培养16~20h。
16.优选的,重组腺病毒的同源重组:将酶切产物转入ad-bj5183感受态细胞里,涂平板后于37℃培养箱培养20~24h,挑取单克隆至5ml含有50μg/ml链霉素的液体lb培养基,220rpm,37℃震荡培养12h;按照质粒抽提试剂盒的说明书进行质粒的抽提,并对所抽提的质粒浓度及纯度进行测定;取转化后的重组质粒1μg进行酶切验证;将酶切体系混合均匀后,置于37℃水浴锅孵育1~2h。酶切结束后进行0.6%琼脂糖凝胶电泳;将鉴定正确的重组质粒转入e.coli stbl3感受态细胞中以大量扩增。
17.优选的,转染hek293细胞:去内毒素试剂盒抽提鉴定正确的骨架质粒,取1μg进行酶切将其线性化;37℃酶切过夜后,将酶切产物置于pcr仪中65℃,孵育20min使pac i灭活;往酶切产物的pcr管中加入10
×
reaction buffer2μl,alp 1μl。37℃10min,75℃5mim;转染前一天按照每孔5
×
105细胞接种到12孔板内进行培养,转染时密度需达到70-90%;转染前4h,把12孔板中培液换成不含血清和抗生素的高糖dmem;于超净台中取一个洁净无菌的1.5ml ep管;按十字形逐滴加入每个孔,轻轻晃动12孔板,4h后更换含2% fbs培养基;置于37℃,5% co2培养箱中培养8~12d,待细胞出现病变后收集。
18.有益效果:用重组腺病毒载体制备的mhp和pcv2二联候选疫苗免疫,能够诱导产生特异性的体液免疫和细胞免疫效应,能够成功建立了一种基于腺病毒载体的mhp和pcv2二联基因工程亚单位疫苗的方法体系。
附图说明
19.图1mhp 168株p97r1基因针对hek 293细胞优化序列。
20.图2mhp 168株p46基因针对hek 293细胞优化序列。
21.图3mhp 168株p42基因针对hek 293细胞优化序列。
22.图4pcv2山东株cap基因针对hek 293细胞优化序列。
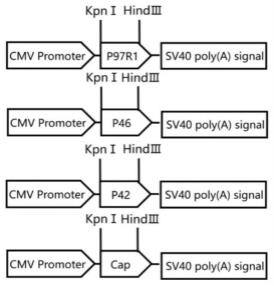
23.图5重组腺病毒穿梭载体示意图。
24.图6pcr扩增目的基因电泳结果图。
25.图7菌液pcr扩增电泳图a。
26.图8菌液pcr扩增电泳图b。
27.图9菌液pcr扩增电泳图c。
28.图10nde i和ecor i单酶切padeasy-1质粒电泳图。
29.图11mlu i单酶切验证骨架质粒。
30.图12pac i酶切重组质粒padeasy-1电泳图a。
31.图13pac i酶切重组质粒padeasy-1电泳图b。
32.图14pcr扩增目的基因电泳结果图。
33.图15同源重组后的骨架质粒转染后hek293后形态观察图a。
34.图16同源重组后的骨架质粒转染后hek293后形态观察图b。
35.图17同源重组后的骨架质粒转染后hek293后形态观察图c。
36.图18同源重组后的骨架质粒转染后hek293后形态观察图d。
37.图19同源重组后的骨架质粒转染后hek293后形态观察图e。
38.图20同源重组后的骨架质粒转染后hek293后形态观察图f。
39.图21radv感染hek293细胞图a。
40.图22radv感染hek293细胞图b。
41.图23radv感染hek293细胞图c。
42.图24radv感染hek293细胞图d。
43.图25radv感染hek293细胞图e。
44.图26radv感染hek293细胞图f。
45.图27radv感染hek293细胞图g。
46.图28radv感染hek293细胞图h。
47.图29western blot检测目的蛋白结果a。
48.图30western blot检测目的蛋白结果b。
49.图31western blot检测目的蛋白结果c。
50.图32western blot检测目的蛋白结果d。
51.图33间接elisa法检测免疫小鼠血清中的igg水平统计结果图a。
52.图34间接elisa法检测免疫小鼠血清中的igg水平统计结果图b。
53.图35间接elisa法检测免疫小鼠血清中的igg水平统计结果图c。
54.图36间接elisa法检测免疫小鼠血清中的igg水平统计结果图d。
55.图37间接elisa法检测免疫小鼠血清中的igg1水平图a。
56.图38间接elisa法检测免疫小鼠血清中的igg1水平图b。
57.图39间接elisa法检测免疫小鼠血清中的igg1水平图c。
58.图40间接elisa法检测免疫小鼠血清中的igg1水平图d。
59.图41间接elisa法检测免疫小鼠血清中的igg2a统计结果图a。
60.图42间接elisa法检测免疫小鼠血清中的igg2a统计结果图b。
61.图43间接elisa法检测免疫小鼠血清中的igg2a统计结果图c。
62.图44间接elisa法检测免疫小鼠血清中的igg2a统计结果图d。
63.图45间接elisa法对免疫小鼠血清中il-4水平测定的统计结果图。
64.图46间接elisa法对免疫小鼠血清中ifn-γ水平测定的统计结果图。
65.图47免疫小鼠脾淋巴细胞增殖实验结果统计图。
66.其中,图6中:m:dl 2000dna marker;1:p97r1;2:p46;3:p42;4:cap;图7-9中:a:m:
dl 1000dna marker;1,2:p97r1;3,4:p46;5,6:p42;b:m:dl 2000dna marker;1,2,3:cap;c:dl 2000dna marker;1,2:egfp;图10中:m1:dl 15000dna marker;m2:dl 10000dna marker;1:ecor i酶切后的padeasy-1;2:nde i酶切后的padeasy-1;图11中:m:dl 15000dna marker;1,2:mlu i单酶切后的ad-p97r1;3:mlu i单酶切后的c;4,5:mlu i单酶切后的ad-p42;6:mlu i单酶切后的ad-cap;7:mlu i单酶切后的ad-egfp;8:mlu i单酶切后的ad-wild;图12-13中:a:m1:dl 15000dna marker;1:pac i酶切后ad-97;2:pac i酶切后ad-46;3:pac i酶切后ad-42;4:pac i酶切后ad-cap;m2:dl 10000dna marker;b:m1:dl 15000dna marker;1,2:pac i酶切后ad-egfp;3:pac i酶切后ad-wild;m2:dl 10000dna marker;
67.图14中:m:dl 2000dna marker;1-4:p97r1;5-10:p46;11-16:p42;17-20:cap图15-20中:a:radv-p97r1;b:radv-p46;c:radv-p42;d:radv-cap;e:radv-wild;f:未转染质粒的hek293细胞;图21-28中:a:24h未感染细胞;b:48h未感染细胞;c:radv-p97r1感染细胞;d:radv-p46感染细胞;e:radv-p42感染细胞;f:radv-cap感染细胞;g:radv-egfp感染细胞(明场);h:radv-egfp感染细胞(荧光);图29-32中:a:1:radv-p97r1感染后蛋白检测;b:1:radv-p46感染后蛋白检测;c:2:radv-p42感染后蛋白检测;d:1:radv-cap感染后蛋白检测重组腺病毒载体疫苗的免疫原性分析;图33-36中:two-way anova(*p《0.05,**p《0.01,***p《0.001,****p《0.0001);图37-40中:two-way anova(*p《0.05,**p《0.01,***p《0.001,****p《0.0001);图41-44中:two-way anova(*p《0.05,**p《0.01,***p《0.001,****p《0.0001);
68.图45-46中:two-way anova(*p《0.05,**p《0.01,***p《0.001,****p《0.0001);图47中:two-way anova(*p《0.05,**p《0.01,***p《0.001,****p《0.0001)。
具体实施方式
69.以下结合说明书附图,对本发明作进一步说明,但本发明并不局限于以下实施例。
70.本发明一种猪圆环病毒2型和猪支原体肺炎二联腺病毒活载体疫苗及其制备方法:包括重组腺病毒载体构建及重组病毒的包装,为了实现在真核细胞中表达猪肺炎支原体和猪圆环病毒2型的抗原蛋白,本研究按照腺病毒表达系统进行抗原基因的密码子优化,通过分子生物学技术将其亚克隆到pshuttle-cmv载体的多克隆位点,分别得到腺病毒穿梭载体pshuttle-cmv-p97、pshuttle-cmv-p46、pshuttle-cmv-p42和pshuttle-cmv-cap;同时为了验证重组腺病毒表达外源蛋白的可行性,构建了可表达绿色荧光蛋白的腺病毒穿梭载体pshuttle-cmv-egfp。利用bj5183菌株中含有sbcbc和recbc两种突变,有利于转入目的基因与腺病毒骨架质粒的重组的特性构建了重组腺病毒骨架载体adv-p97r1、adv-p46、adv-p42、adv-cap和adv-egfp。将构建成功的重组腺病毒质粒的itr通过酶切的形式暴露出来,并转染hek293细胞,缺失的病毒组装基因在细胞内得到补充,从而在hek293细胞中完成重组腺病毒的包装。对转染重组腺病毒骨架载体的hek293细胞反复冻融使细胞破裂,释放出病毒(p0代)。将所得的重组病毒大量扩增并通过rt-pcr及western blot检测,来验证目的蛋白p97r1、p46、p42和cap蛋白的表达。对鉴定正确的重组腺病毒进行纯化,分装后储存至-80℃备用。
71.具体包括如下步骤:
72.1.1线性化载体的制备
73.取pshuttle-cmv质粒1.0μg用kpnⅰ和hindⅲ进行双酶切。双酶切体系如下表:
74.表1双酶切体系
[0075][0076]
将上述液体混合均匀后,置于37℃水浴锅中酶切过夜。
[0077]
1.2p97r1、p46、p42、cap基因的pcr扩增
[0078]
以密码子优化后合成的携带有p97r1、p46、p42和cap基因重组质粒puc57-mini-p97r1-p46-p42和实验室保存的pcdna3.1( )-cap为模板,用表2中的引物分别对p97r1、p46、p42和cap基因进行pcr扩增。引物及反应体系如表3。反应结束后用1.0%琼脂糖凝胶电泳鉴定并用axygen试剂盒按照产品说明书进行清洁回收。
[0079]
表2 pcr引物序列
[0080][0081]
表3 pcr反应体系
[0082][0083]
pcr反应程序如下:按照顺序,98℃反应10s,55℃反应30s,72℃反应10s,72℃反应2min,4℃保存。
[0084]
无缝克隆体系如下表:
[0085]
表4无缝克隆体系
[0086][0087]
1)将含有上述体系样品的pcr管立即放入pcr仪中,50℃孵育25min。反应结束后,取5μl上述反应溶液加入到50~100μl dh5α感受态细胞中。涡旋震荡混匀,冰上放置30min。
[0088]
2)42℃水浴90s,从水浴锅中拿出后立即冰浴,静置5min。
[0089]
3)加无抗生素的lb,37℃,220rpm培养1h。
[0090]
4)涂布至kan平板上,培养12~16h。培养结束后,挑单克隆至lb液体培养基,220rpm,37℃震荡培养12h。
[0091]
1.3电转化e.coli bj5183感受态细胞制备
[0092]
1)以1:100的比例将-80℃保存的e.coli bj5183菌种接入5ml lb培养液,其中含50μg/ml链霉素,37℃振荡过夜;
[0093]
2)接菌到200ml lb培养基中,37℃培养到od
600
为0.6为止。
[0094]
3)将菌液分装到50ml离心管中,冰水浴2~4h。
[0095]
4)4℃,2600
×
g离心10min,收集菌体。
[0096]
5)用提前预冷的200ml的10%甘油重悬沉淀。
[0097]
6)4℃,2500
×
g离心30min。
[0098]
7)重复步骤4)、5)。
[0099]
8)用20ml上清重悬菌体,弃剩余上清液,转移菌液至50ml离心管中。
[0100]
9)4℃,2600
×
g离心10min。弃上清,留400μl重悬,分装并保存至-80℃冰箱备用。
[0101]
1.4骨架质粒padeasy-1电转化e.coli bj5183
[0102]
1)将提前在4℃预冷的电转杯置于冰水浴中以维持低温。
[0103]
2)将e.coli bj5183从-80℃冰箱中取出,置于冰水浴中以较慢的速度解冻。
[0104]
3)取2μl经axygen小提试剂盒抽提并以ddh2o洗脱的腺病毒骨架质粒padeasy-1加入已解冻的e.coli bj5183中,混匀后转移至预冷的电转杯中。
[0105]
4)擦去电转杯上的冷凝水。将电转杯放置于电转仪中,电转条件设置为:2500v,200ohms,25mfd。
[0106]
5)电转完成后,立即用lb培养基重悬电转杯中的液体混合物。取菌液200μl用涂布器均匀涂在固体lb培养基中,于37℃培养箱中培养16~20h。
[0107]
1.5重组腺病毒的同源重组
[0108]
1)将上述酶切产物转入ad-bj5183感受态细胞里,涂平板后于37℃培养箱培养20~24h。挑取单克隆至5ml含有50μg/ml链霉素的液体lb培养基,220rpm,37℃震荡培养12h。
[0109]
2)按照质粒抽提试剂盒的说明书进行质粒的抽提,并对所抽提的质粒浓度及纯度
进行测定。
[0110]
3)取转化后的重组质粒1μg进行酶切验证,酶切体系如下表:
[0111]
表5单酶切体系
[0112][0113]
4)将上述酶切体系混合均匀后,置于37℃水浴锅孵育1~2h。酶切结束后进行0.6%琼脂糖凝胶电泳。
[0114]
5)将鉴定正确的重组质粒转入e.coli stbl3感受态细胞中,制备感受态的方法同上。
[0115]
1.6转染hek293细胞
[0116]
1)去内毒素试剂盒抽提鉴定正确的骨架质粒,取1μg进行酶切将其线性化,酶切体系如下表:
[0117]
表6单酶切体系
[0118][0119][0120]
2)37℃酶切过夜后,将酶切产物置于pcr仪中65℃,孵育20min使pac i灭活。
[0121]
3)往上述酶切产物的pcr管中加入10
×
reaction buffer 2μl,alp 1μl。37℃10min,75℃5mim。
[0122]
4)转染前一天(12~16h,不宜超过16h)按照每孔5
×
105细胞接种到12孔板内进行培养,转染时密度需达到70-90%。
[0123]
5)转染前4h,把12孔板中培液换成不含血清和抗生素的高糖dmem。
[0124]
6)于超净台中取一个洁净无菌的1.5ml ep管,按下表所示进行操作。
[0125]
表7转染体系
[0126][0127]
7)按“十”字形逐滴加入每个孔,轻轻晃动12孔板。4h后更换含2% fbs培液。
[0128]
8)置于37℃,5% co2培养箱中培养8~12d,待细胞出现病变后收集。1.7重组腺病毒的鉴定:包括rt-pcr鉴定、western blot鉴定其中,rt-pcr鉴定:
[0129]
1)取病毒液500μl与500μl trizol混匀。
[0130]
2)加入200μl氯仿,涡旋15s,室温静置3min。
[0131]
3)4℃12000rpm离心15min,取上层液相移入另一管。
[0132]
4)加等体积的异丙醇,颠倒混匀。冰上静置15min。
[0133]
5)4℃12000rpm离心15min,弃上清。
[0134]
6)用depc水溶解rna。
[0135]
7)根据逆转录试剂盒说明书,配置第一步混合液,轻轻吹打混匀,在42℃孵育2min,去除残留基因组dna。
[0136]
8)根据产品说明书加进行逆转录,制备cdna。
[0137]
9)以上述制备的cdna为模板,按说明书配置反应体系,进行pcr扩增反应,引物序列见表2。
[0138]
western blot鉴定:
[0139]
1)将薄板和厚板清洗干净,并用ddh2o冲洗干净。将玻璃板放置于制胶架中,检漏结束后,按照page凝胶快速制备试剂盒(雅酶)配胶试剂盒说明书配制分离胶和浓缩胶,并快速插入梳子。待浓缩胶凝固后,制好的胶从制胶架上取出,放入电泳槽,小心地将梳子拔出,放入电泳槽即可上样电泳。
[0140]
2)电泳结束后,拆胶并将其泡在转膜缓冲液中。取转印滤纸3张,用玻璃棒赶出气泡后放置在三明治夹的黑色面,并依次放上电泳凝胶、经甲醇活化好的pvdf膜和另3张转印滤纸。保证三明治夹夹紧时各层之间不产生气泡。
[0141]
放入转膜槽进行转膜,取出pvdf膜。经封闭、一抗、二抗孵育后,显影。
[0142]
为了对重组腺病毒载体疫苗的免疫原性分析,本技术进行了如下实验:
[0143]
将54只spf级balb/c小鼠(6~8周龄)随机分配成6组,每组9只小鼠,隔离饲养。所有小鼠免疫方案均为皮下多点注射。
[0144]
表8实验动物分组情况
20,显微镜下可观察到细胞变圆、呈岛屿状、脱落等病变现象。
[0155]
将上述已病变的细胞及上清于-80℃/37℃反复冻融3次后,接种至新的hek293中,每天观察细胞状态,直至细胞完全病变。如图21-28所示,病毒能连续感染hek293细胞,确定加入适合的病毒量后,对其进行大量扩增。
[0156]
用western blot的方法检测重组腺病毒radv-p97r1、radv-p46、radv-p42和radv-cap感染hek293细胞后蛋白的表达。结果如图29-32所示,radv-p97r1、radv-p46、radv-p42和radv-cap感染细胞后,可检测到p97r1、p46、p42、cap蛋白的表达。进一步确定重组腺病毒radv-p97r1、radv-p46、radv-p42和radv-cap制备成功。
[0157]
如图33-36所示,pbs组、商业疫苗组(cv)和radv-wild组免疫后未产生抗p97r1、p46、p42、cap的抗体。以radv-mhp作为免疫原的实验组能产生抗p97r1、p46、p42的抗体;一免后第7d,开始产生抗p97r1、p46、p42的抗体,且随着免疫时间的持续,抗体水平逐渐升高。以radv-pcv2作免疫原的实验组能产生抗cap的抗体,一免后第7d radv-pcv2组抗cap的igg未呈现显著升高水平(p>0.05),在第14d时,抗cap的igg显著高于对照组(p<0.0001),直至免疫期结束;以radv-mhp radv-pcv2混合免疫的实验组则能产生抗p97r1、p46、p42、cap的抗体,且随着免疫时间的持续,抗体水平逐渐升高。
[0158]
如图37-40所示,一免后第7d至免疫周期结束,radv-mhp组和radv-mhp radv-pcv2混合注射组的抗p97r1、抗p46、抗p42和抗cap的igg1显著高于pbs组、商业疫苗组(cv)和radv-wild组(p<0.0001)。radv-pcv2组抗cap的igg1则在第14d时,显著高于pbs组、商业疫苗组(cv)和radv-wild组(p<0.0001)。图37-40中c所示,在第21d和42d时,radv-wild组的抗p42的igg1显著高于pbs组。
[0159]
如图41-44所示,一免后第7d,radv-mhp组和radv-mhp radv-pcv2混合免疫组的抗p46的igg2a显著高于pbs组、商业疫苗组(cv)和radv-wild组(p<0.0001)。第14d时,radv-mhp组、radv-pcv2组和radv-mhp radv-pcv2混合免疫组的抗p97r1、抗p42以及抗cap的igg2a显著高于pbs组、商业疫苗组(cv)和radv-wild组(p<0.0001)。
[0160]
根据试剂盒说明书对免疫后小鼠血清中细胞因子含量进行测定,结果显示radv-pcv2组、radv-mhp组和radv-pcv2 radv-mhp混合免疫组的il-4含量显著高于pbs组(p<0.0001),且第28d,radv-pcv2组与radv-pcv2 radv-mhp混合免疫组相比,差异显著(p<0.05)。图45-46中,b结果显示,radv-pcv2组、radv-mhp组和radv-pcv2 radv-mhp混合免疫组的ifn-γ含量显著高于pbs组(p<0.0001),且各实验组之间未出现显著性差异(p>0.05)。
[0161]
为了评估本研究所制备的候选疫苗免疫小鼠后引起的细胞免疫水平,在免疫周期第35d和第42d时对免疫小鼠脾淋巴细胞进行分离,并以原核表达的重组蛋白作为刺激原刺激细胞增殖以计算抗原对脾淋巴细胞的刺激指数(si)。结果如图47所示,免疫第35d时,radv-cap组、radv-mhp组和radv-cap radv-mhp混合组的si值均显著高于商业疫苗组(cv)(p<0.0001);第42d时,radv-wild组和商业疫苗组(cv)的si值显著高于pbs组(p<0.005;p<0.005),radv-cap组、radv-mhp组和radv-cap radv-mhp混合免疫组显著高于商业疫苗组(cv)(p<0.001;p<0.0001)。
[0162]
因此,本发明实现利用重组腺病毒载体制备的mhp和pcv2二联候选疫苗免疫后能够诱导产生特异性的体液免疫和细胞免疫效应,说明成功建立了一种基于腺病毒载体的
mhp和pcv2二联基因工程亚单位疫苗的方法体系。
[0163]
最后,需要注意的是,本发明不限于以上实施例,还可以有很多变形。本领域的普通技术人员能从本发明公开的内容中直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。