1.本发明涉及医学检验技术领域,尤其涉及一种纤维蛋白和/或纤维蛋白原降解产物的检测试剂盒及其制备方法。
背景技术:
2.纤维蛋白溶解系统,简称纤溶系统,是人体最重要的抗凝系统,对保持血管壁的正常通透性,维持血液的流动状态和组织修复起着重要作用,由4种主要部分组成:纤溶酶原、纤溶酶原激活剂(如t-pa、u-pa)、纤溶酶、纤溶酶抑制物。纤维蛋白(原)降解产物是纤溶系统被激活后,在纤溶酶的作用下,人体内的纤维蛋白原和纤维蛋白被降解,所产生的各种二聚体、多聚体及复合物的统称,能够反映机体纤溶活性的总水平。血液中的fdp浓度上升可证明有纤溶亢进,在恶性肿瘤、产科疾病、血管病变、弥散性血管内综合症(dic)等各种疾病时显示高值。尤其在凝固及纤溶亢进显著时会引发dic。因此,fdp检测是dic诊断及观察治疗过程中的重要指标之一。
3.近几年来,fdp含量的检测在临床诊断、筛查上应用广泛,其含量升高可证明有纤溶亢进,如恶性肿瘤、弥散性血管内凝血、深静脉血栓形成、肺栓塞、严重细菌感染、慢性肝病、器官移植的排斥反应、妊娠高血压综合症等疾病所致的继发性及原发性纤溶亢进,fdp含量均出现升高。在溶栓药物的治疗过程中,大量纤溶酶的生成,加速血栓的溶解,血液中fdp升高,对血清或血浆fdp浓度的检测,可以监控溶栓药物的治疗效果。另由于血管内凝血,纤溶异常,大量fdp经肾脏排出或由于肾炎导致纤维蛋白在肾小管沉积同时继发激活纤维蛋白降解系统生成fdp从尿中排出,因此尿液中出现fdp也意味着体内或肾脏有血管内凝血和纤溶现象。动态地观察尿fdp的变化,对肾移植后排斥反应的诊断有重要意义。因此,检测样本中血清、血浆、尿液中fdp的含量对纤溶系统疾病的早期、快速、准确诊断及对溶栓药物治疗的疗程监测和疗效考核具有重要的应用价值。
4.胶乳免疫比浊法具有操作简便、快速、检测灵敏度高、特异、定量准确等优点,在临床应用上得到广泛认可。但现有市场上采用该法测定纤维蛋白(原)降解产物(fdp)含量的试剂盒常低值检测时分析灵敏度欠佳,且稳定性通常表现较差。
技术实现要素:
5.有鉴于此,本发明提供了一种纤维蛋白和/或纤维蛋白原降解产物的检测试剂盒及其制备方法。该试剂盒具有较高的分析灵敏度、精密度,且稳定性好。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.一种纤维蛋白和/或纤维蛋白原降解产物的检测试剂盒,由试剂r1和试剂r2组成;
8.所述试剂r1包括缓冲液、增敏剂、无机盐、表面活性剂、蛋白保护剂和防腐剂;
9.所述试剂r2包括缓冲液、抗人fdp抗体胶乳悬浊液、稳定剂和蛋白保护剂和防腐剂;
10.所述抗人fdp抗体胶乳悬浊液由以下方法制得:
11.取聚苯乙烯羧基胶乳溶液,加入nhs/edc活化;然后加入蛋白交联剂,20-25℃搅拌0.5-2小时,离心,超声分散;
12.向超声分散后的溶液中缓慢加入抗人fdp单克隆抗体,20-25℃搅拌3小时,加入封闭剂封闭,洗脱;
13.所述洗脱采用的表面活性剂为吐温系列;
14.其中,蛋白交联剂为bsa、精氨酸、甘氨酸中的至少一种。
15.本发明中,所述试剂r1包括:ph6.5~8.5的缓冲液0.02~0.15mol/l,增敏剂1~20g/l,无机盐1~50g/l,表面活性剂0.1~5g/l,蛋白保护剂bsa 0.1~5g/l,防腐剂1.0~2.0ml/l;
16.所述试剂r2包括:ph7.0~9.0的缓冲液0.02-0.15mol/l,稳定剂0.1%~10%,抗人fdp抗体胶乳悬浊液0.1%-1%,蛋白保护剂bsa 0.05%~1%,防腐剂1.0~2.0ml/l。
17.本发明中,所述试剂r1中,缓冲液为mes、mops、pb、hepes中的至少一种。一些实施方案中,缓冲液优选为mops;所述缓冲液的ph优选为7.0-7.5。
18.本发明中,所述试剂r1中,增敏剂为peg6000、peg8000、peg10000中的一种或几种,一些实施例中具体为peg6000。
19.本发明中,所述试剂r1中,无机盐为nacl、kcl、cacl2、mgcl2中的一种或几种,一些实施例中具体为nacl。
20.本发明中,所述试剂r1中,表面活性剂为吐温系列、triton x系列、胆酸钠、脱氧胆酸钠、异十三醇聚乙二醇醚等中的一种或几种;一些实施方案中具体为吐温系列,具体地,所述表面活性剂包括但不仅限于吐温80。
21.本发明中,所述试剂r2中,缓冲液为mops、mopso、hepes、taps、甘氨酸中的一种或几种;一些实施例中具体为ph7.9、20mm mops缓冲液。
22.本发明中,所述试剂r2中,稳定剂为蔗糖、海藻糖、甘油、甘露醇等中的一种或几种;在一些实施例中具体为蔗糖。
23.本发明中,所述试剂r1和试剂r2中,蛋白保护剂独立地选自bsa、鸡卵清蛋白、酪蛋白、鱼皮明胶中的一种或几种,所述蛋白保护剂包括以上种类但不仅限于此。
24.本发明中,所述试剂r2中,抗人fdp抗体胶乳悬浊液中,所述抗体为鼠源单克隆抗体、兔源单抗隆抗体、羊源单抗隆抗体中的一种;在一些实施例中具体为鼠源单克隆抗体。
25.本发明中,所述试剂r1和试剂r2中,防腐剂独立地选自叠氮化钠、proclin系列、卡松、bnd、硫柳汞等中的一种或几种;在一些实施例中具体为proclin300。
26.本发明还提供了检测试剂盒的制备方法,其特征在于,包括:
27.步骤1:向缓冲液中加入增敏剂、无机盐、表面活性剂、蛋白保护剂和防腐剂,混匀,调节ph至6.5-8.5,获得试剂r1。
28.步骤2:在ph值为4.0-6.0的缓冲液中,将聚苯乙烯羧基胶乳溶液与nhs/edc溶液混合,活化0.5-1.0小时;
29.步骤3:将步骤2所得溶液中加入缓冲溶液调节ph至7.0-8.0,加入蛋白交联剂,在20-25℃搅拌0.5-2小时;离心加入ph值为4.0-6.0的缓冲液,超声分散;
30.步骤4:将步骤3所得溶液离心,去除上清液加入ph值为4.0-6.0的缓冲液,并超声
分散均匀;加入适量nhs/edc的溶液中进行活化0.5-1.0小时;
31.步骤5:将步骤4所得溶液用缓冲溶液调节ph至7.0-8.0,加入抗人fdp单克隆抗体,在20-25℃搅拌2.0-4.0小时;
32.步骤6:将步骤5所得溶液加入bsa封闭0.5-1.0小时;然后再加入表面活性剂洗脱0.5-1.0小时;
33.步骤7:将步骤6所得溶液经离心去除上清液后,用含有稳定剂和防腐剂的缓冲液经超声分散,获得试剂r2。
34.本发明所述步骤2中,所述活化在ph值为4.0-6.0的缓冲液中进行,所述缓冲液选自mes、柠檬酸/柠檬酸钠、pb缓冲液中的至少一种;优选mes溶液。所述活化的条件为:20-25℃活化0.5-1.0小时,优选为20-25℃活化30-40min。
35.本发明所述步骤,步骤6中加入bsa封闭0.5-1.0小时;然后再加入表面活性剂洗脱0.5-1.0小时。其中,所述表面活性剂为吐温系列,在具体实施方式中,选择吐温20;所述表面活性剂的浓度为0.001~0.003g/ml;所述bsa浓度为0.001~0.003g/ml。
36.本发明提供的一种纤维蛋白和/或纤维蛋白原降解产物的检测试剂盒,由试剂r1和试剂r2组成;所述试剂r1包括缓冲液、增敏剂、无机盐、表面活性剂、蛋白保护剂和防腐剂;所述试剂r2包括缓冲液、抗人fdp抗体胶乳悬浊液、稳定剂和蛋白保护剂和防腐剂;所述抗人fdp抗体胶乳悬浊液由以下方法制得:向活化后的聚苯乙烯羧基胶乳溶液中缓慢加入抗人fdp单克隆抗体,20-25℃搅拌3小时;然后加入含10%bsa的pbs缓冲液,搅拌封闭;再加入表面活性剂洗脱;所述表面活性剂为吐温系列。与现有技术相比,本发明存在如下优势:
37.1)通过偶联工艺中增加偶联bsa的过程,改善了胶乳试剂表面链长与空间构象,从而使试剂分析灵敏度、重复性得到提升。
38.2)通过偶联工艺中使用表面活性剂吐温20进行洗脱,改善胶乳颗粒表面电荷,洗掉不稳定吸附的抗体或其他吸附物,从而提升试剂的稳定性。
附图说明
39.图1示样条函数拟合定标曲线。
具体实施方式
40.本发明提供了一种纤维蛋白和/或纤维蛋白原降解产物的检测试剂盒及其制备方法。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
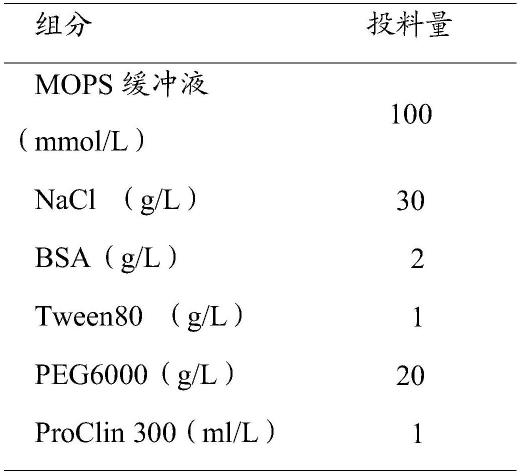
41.本发明采用的试材皆为普通市售品,皆可于市场购得。
42.下面结合实施例,进一步阐述本发明:
43.实施例1
44.按以下配方制备根据本发明的试剂盒:
45.表1试剂r1的组分:
[0046][0047]
试剂r1的配制步骤,按照表1中组分浓度,按照上述试剂r1的组分含量,使用纯化水配制mops缓冲液,调节ph至6.8,作为r1缓冲液;然后加入相应量的其他组分,混匀并用氢氧化钠/盐酸调节ph至6.8得到。
[0048]
试剂r2的制备:
[0049]
步骤1:称取适量的nhs、edc,使用10mm ph6.0的mes缓冲液将nhs溶解至浓度为0.5g/l,将edc溶解至浓度为4g/l(30min内使用),取nhs溶液1.2ml,添加100ul 200nm的聚苯乙烯羧基胶乳,加入60ul edc溶液活化30min;
[0050]
步骤2:使用50mmph7.0的mops缓冲液,将牛血清白蛋白(bsa)稀释至5g/l,获得bsa溶液,向步骤1活化后的溶液加入bsa溶液100ul,在20-25℃搅拌1小时;
[0051]
步骤3:将步骤2所得溶液1000g离心力离心20min,除去上清液,加入步骤1中的nhs溶液1.5ml进行超声分散;加入60ul edc的溶液(4g/l)中进行活化30min;
[0052]
步骤4:使用50mmph7.0的mops缓冲液,将抗人fdp单克隆抗体稀释至0.3g/l,向步骤3活化后的溶液缓慢加入抗人fdp单克隆抗体溶液1ml,在20-25℃搅拌3小时;
[0053]
步骤5:将步骤4所得溶液加入10%bsa(10mm ph7.2 pbs缓冲液稀释)50ul,搅拌封闭30min;然后再加入表面活性剂吐温20洗脱30min;
[0054]
步骤6:将步骤5所得溶液1000g离心力离心20min,除去上清液,加入含有稳定剂和防腐剂的保存液(配方见下表)8ml,超声分散后放置42℃恒温干燥箱老化处理16小时即得r2试剂。
[0055]
表2r2保存液配方:
[0056][0057][0058]
r2试剂保存液的配制步骤:按照表2中组分浓度,先使用纯化水配制mops缓冲液,调节ph至7.9,然后加入相应量的其他组分,混匀并用氢氧化钠/盐酸调节ph至7.9得到。
[0059]
实施例2
[0060]
r1的制备方法如实施例1所述。r2的制备方法如实施例1所述,不同在于:步骤2中的牛血清白蛋白(bsa)更换为精氨酸,从而得到新的纤维蛋白/纤维蛋白原降解产物检测试剂盒。
[0061]
实施例3
[0062]
r1的制备方法如实施例1所述。
[0063]
试剂r2的制备:
[0064]
步骤1:称取适量的nhs、edc,使用10mm ph6.0的mes缓冲液将nhs溶解至浓度为0.5g/l,将edc溶解至浓度为4g/l(30min内使用),取nhs溶液1.2ml,添加100ul 200nm的聚苯乙烯羧基胶乳,加入60ul edc溶液活化30min;
[0065]
步骤2:使用50mm ph7.0的mops缓冲液,将抗人fdp单克隆抗体稀释至0.3g/l,向步骤1活化后的溶液缓慢加入抗人fdp单克隆抗体溶液1ml,在20-25℃搅拌3小时;
[0066]
步骤3:将步骤4所得溶液加入10%bsa(10mm ph7.2 pbs缓冲液稀释)50ul,搅拌封闭30min;然后再加入表面活性剂吐温20搅拌洗脱30min;
[0067]
步骤4:将步骤3所得溶液1000g离心力离心20min,除去上清液,加入含有稳定剂和防腐剂的保存液(保存液配方与实施例1一致)8ml,超声分散后放置42℃恒温干燥箱老化处理16小时即得r2试剂。
[0068]
对比例1
[0069]
试剂r1的制备方法如实施例1所述。
[0070]
试剂r2的制备方法:
[0071]
步骤1:称取适量的nhs、edc,使用10mm ph6.0的mes缓冲液将nhs溶解至浓度为0.5g/l,将edc溶解至浓度为4g/l(30min内使用),取nhs溶液1.2ml,添加100ul 200nm的聚苯乙烯羧基胶乳,加入60ul edc溶液活化30min;
[0072]
步骤2:使用50mm ph7.0的mops缓冲液,将抗人fdp单克隆抗体稀释至0.3g/l,向步骤1活化后的溶液缓慢加入抗人fdp单克隆抗体溶液1ml,在20-25℃搅拌3小时;
[0073]
步骤3:将步骤2所得溶液加入10%bsa(10mm ph7.2 pbs缓冲液稀释)50ul,搅拌封闭30min;
[0074]
步骤4:将步骤3所得溶液1000g离心力离心20min,除去上清液,加入含有稳定剂和防腐剂的保存液(r2保存液配方与实施例1一致)8ml,超声分散后放置42℃恒温干燥箱老化处理16小时即得r2试剂。
[0075]
对比例2
[0076]
r1的制备方法如实施例1所述。r2的制备方法如实施例3所述,不同在于将步骤3中的吐温20更换为曲拉通100(triton x-100),从而得到新的纤维蛋白/纤维蛋白原降解产物检测试剂盒。
[0077]
对比例3
[0078]
r1的制备方法如实施例1所述。r2的制备方法如实施例3所述,不同在于将步骤3中的吐温20更换为聚乙烯醇(pva),从而得到新的纤维蛋白/纤维蛋白原降解产物检测试剂盒。
[0079]
对比例4
[0080]
r1的制备方法如实施例1所述。r2的制备方法如实施例1所述,不同在于:步骤2中的牛血清白蛋白(bsa)更换为甘氨酸,从而得到新的纤维蛋白/纤维蛋白原降解产物检测试剂盒。
[0081]
测试例
[0082]
(1)标准曲线制定
[0083]
以上实施例实施办法的试剂用东芝toshiba-120fr全自动生化仪进行测试,测试主波长为604nm,取样本或校准品5ul,再加入180ul的试剂r1,37℃恒温5min后读取吸光度a1,然后加入60ul试剂r2,37℃孵育5min后读取吸光度a2,则反应吸光度δa=a2-a1;首先使用标准品进行多点定标,并用样条函数进行计算得到定标曲线,如图1所示。
[0084]
对照组试剂按其说明书实施办法使用。
[0085]
(2)分析灵敏度检测
[0086]
分别使用实施例1、2、3的试剂盒与对比例1、2、3、4的试剂盒,选择已知fdp浓度在10mg/l左右的校准点定标反应度结果,换算为10mg/l的吸光度差值
△
a。检测结果如表3所示。由分析灵敏度计算结果可知,本发明实施例1、2试剂分析灵敏度较对比例1、2、3、4均有所提升,且实施例1分析灵敏度更高。
[0087]
表3各试剂盒分析灵敏度检测结果
[0088]
理论浓度(mg/l)10实施例1检测结果
△
a0.0873实施例2检测结果
△
a0.0626实施例3检测结果
△
a0.0464对比例1检测结果
△
a0.0388对比例2检测结果
△
a0.0354对比例3检测结果
△
a0.0376对比例4检测结果
△
a0.0423
[0089]
(3)重复性检测
[0090]
选择比对例中分析灵敏度较好的1、4进行重复性检测,选用fdp商品化质控品以及与质控品靶值相当的血清样本,分别连续测试10次,结果见表4、表5。本发明实施例1、2、3较
对比例1、4均有显著提升,变异系数cv均在2%以内,且测值偏差较小可以控制在1%以内,其中实施例1表现更优。
[0091]
表4实施例1、2、3、对比例1、4对质控品的重复性检测结果
[0092][0093][0094]
表5实施例1、2、3,对比例1、4对血清样本的重复性检测结果
[0095][0096]
(4)稳定性检测-37℃热稳定性
[0097]
对实施例1、2、3,对比例1~3进行37℃热稳定性考核,具体操作为:将r1、r2试剂分装封口保存在37℃恒温生化培养箱中(倒序分别在第0、3、5、7、10、13、16天时放入,最后一天同时检测,检测同一份质控品、高、低值血清样本,检测3次取平均值,比较不同加速时间的试剂检测结果,监测其变化趋势;结果见表6。
[0098]
表6实施例1试剂37℃热稳定性检测结果
[0099][0100][0101]
表7实施例2试剂37℃热稳定性检测结果
[0102][0103]
表8实施例3试剂37℃热稳定性检测结果
[0104][0105]
表9对比例1试剂37℃热稳定性检测结果
[0106][0107]
表10对比例2试剂37℃热稳定性检测结果
[0108][0109]
表11对比例3试剂37℃热稳定性检测结果
[0110][0111]
37℃热稳定性测试数据结果可看出,实施例1、2、3较对比例1、2、3,在热稳定方面有显著提升,测值偏差可以控制在3%以内,说明吐温20的洗脱作用对于试剂热稳定性改善明显,而且同时搭配使用bsa、精氨酸偶联工艺时试剂的热稳定性依旧表现较好。
[0112]
(5)稳定性检测-4℃长期稳定性
[0113]
将试剂装入试剂瓶做27个月4℃实时稳定性测试。将试剂封闭放置在4℃冰箱中(每次仅在检测的时候取出,检测结束后,依然封口放回4℃冰箱中,在第0、3、6、9、12、18、24、27月时测定质控品与高、低值血清样本,作为24个月4℃实时稳定性测试;分别取质控品和高、低值血清样本,并将其平均分成8份,放入-80℃低温冰箱储存,每次检测时高、低值样本、质控品各取一套,检测三次取平均值,跟踪检测结果,监测其变化趋势。结果见下表。
[0114]
表12实施例1试剂4℃实时性检测结果
[0115][0116]
表13实施例2试剂4℃实时性检测结果
[0117][0118]
表14实施例3试剂4℃实时性检测结果
[0119][0120]
表15对比例1试剂4℃实时性检测结果
[0121][0122]
表16对比例2试剂4℃实时性检测结果
[0123][0124]
表17对比例3试剂4℃实时性检测结果
[0125][0126]
由4℃实时稳定性数据看出,实施例1、2、3试剂相较对比例1、2、3在4℃保存时稳定性有显著改善,测值偏差在3%以内,说明吐温20的洗脱有利于试剂稳定,且同时使用bsa、精氨酸偶联工艺时试剂依旧稳定。
[0127]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。