1.本发明属于生物技术领域,具体地,涉及一种移植瘤组织的制备方法及其应用。
背景技术:
2.由基因融合突变引起的肿瘤突变率低,质控材料获取的难度相当大,以间变性淋巴瘤激酶(alk)融合基因为例,该融合基因突变在非小细胞肺癌中的突变率大约在4%左右,常见的融合形式是alk-eml4。针对akl融合突变阳性的非小细胞肺癌靶向药治疗可以有效地抵抗耐药性而延长患者的生存期,最重要的靶向治疗指标之一。但由于较低的融合突变率,阳性病理样本并不容易获得,且不同批次的阳性组织间性状非常不稳定,很难作为一个可供长期使用的稳定的质控品。细胞系质控品材料的培养则需要消耗大量培养基、血清、培养容器、培养箱空间,成本高,获取周期长,产量低,整个细胞生长周期内都需要技术人员进行扩大、维护操作(通常2~3周收获一批,批产量约200m细胞,可形成5mm3左右细胞团),细胞类型单一,无形态学特征,在病理判读方面价值不高。各类融合基因突变类型的肿瘤病理检测质控品都面临的类似的问题。
技术实现要素:
3.为了解决上述技术问题中的至少一个,本发明通过从alk-eml4融合基因突变的非小细胞肺癌中分离并建立的阳性细胞株nci-h2228以及alk基因不相关的t淋巴细胞瘤阴性细胞株jurkat培养经过诱导处理后注射裸鼠并在体内形成瘤体。收获鉴定后,将瘤体切割成小块重新埋入裸鼠体内成瘤,并通过这样的二次移植操作获取生长速度更快,性状更稳定的移植瘤。该移植瘤在瘤细胞胞浆内的生物标记物蛋白表达,与病理组织样本中待检的alk-eml4融合基因突变标记物具有高度相似性,且表达丰度稳定,从而完成本发明。具体地,本发明的技术方案如下:
4.本发明第一方面提供一种用于制备移植瘤组织的试剂组合,包括pma和白介素,其中,所述白介素包括白介素2、白介素10和白介素12。
5.pma也称tpa,全称为phorbol-12-myristate-13-acetate(pma),或12-o-tetradecanoylphorbol 13-acetate(tpa),是一种最常用的佛波酯(phorbol ester),可以用于刺激体外淋巴细胞增值和细胞因子表达。白细胞介素,简称白介素,是指在白细胞或免疫细胞间相互作用的淋巴因子,是一种细胞因子。在本发明中,发明人意外地发现,将pma和三种白介素复配能够显著促进成瘤,是本领域技术人员无法预料的。
6.在本发明的一些优选实施方案中,所述白介素2、白介素10和白介素12的混合比例为1:1:1。
7.本发明第二方面提供一种制备移植瘤组织的方法,包括以下步骤:
8.s1,将用于成瘤的细胞在对应的完全培养基中进行培养,传代2~3次,每次传代时细胞密度控制在80%-90%之间,传代比率控制在1:3,根据细胞状态大约每隔3天进行1次传代或更换培养基;
9.s2,在所述完全培养基中加入pma、白介素2、白介素10和白介素12后,重悬细胞得到细胞悬液,恢复培养1~3h,将细胞悬液注射裸鼠腋下;
10.s3,正常饲养裸鼠并观察成瘤情况,切下皮下肿块并修整去除多余结缔组织后获取得到的即为移植瘤组织。
11.在本发明中,所述对应的完全培养基是指能够满足相应的细胞株生长和繁殖的培养基。通常情况下,在基础培养基添加血清、抗生素等物质后得到完全培养基。
12.在本发明的一些实施方案中,所述用于成瘤的细胞包括目标阳性细胞和/或目标阴性细胞。在本发明的一些具体实施方案中,对于靶标为alk-eml4融合基因突变的免疫组化检测,目标阳性细胞选择alk-eml4融合基因突变的非小细胞肺癌中分离并建立的阳性细胞株nci-h2228;目标阴性细胞选择alk基因不相关的t淋巴细胞瘤阴性细胞株jurkat。将两类细胞分别按照上述制备移植瘤质控品,即得到alk-eml4融合基因突变检测的阳性质控品和阴性质控品,能够显著提高利用免疫组织化学检测alk-eml4融合基因突变的准确性和特异性。
13.在本发明中,步骤s1传代2~3代后,当镜下细胞呈现大小均匀的多边形外形,光滑饱满的细胞膜边缘,均匀无空泡的细胞质且培养基内不存在漂浮的细胞碎片时表明细胞已完全恢复状态,可扩大使用。
14.在本发明的一些实施方案中,步骤s2和s3之间,进一步包括对细胞进行同步化处理的步骤:将细胞转移至不含胎牛血清及其替代物的基础培养基中进行饥饿处理16~24h,然后将细胞转移至完全培养基中进行培养,收集处于分裂期的细胞。进行饥饿处理,能够控制所有细胞处于同一细胞周期内,所以也称同步化处理,再次转移至含完全培养基中进行培养时,会刺激细胞快速生长,2小时后即可处于旺盛分裂期,此时的细胞成瘤性高于普通不进行任何处理的细胞。
15.在本发明的一些实施方案中,步骤s2中,pma的终浓度为50~500ng/ml;白介素2、白介素10和白介素12的终浓度分别为50~100ng/ml。在本发明的一些优选实施方案中,在所述完全培养基中加入pma、白介素2、白介素10和白介素12后,pma的浓度为100ng/ml;白介素2、白介素10和白介素12的浓度分别为80ng/ml。。
16.在本发明的一些实施方案中,步骤s3后,进一步包括将获得的移植瘤组织切块洗净移植至另一只裸鼠身上的步骤,再次饲养并获取移植瘤组织,重复至少一次。重复接种在一定次数范围内获得满意的成瘤率和成瘤速度,在本发明中,再接种一次已经有了显著的效果。
17.本发明第三方面提供本发明第一方面所述的试剂组合在移植瘤组织中的用途。
18.进一步地,所述试剂组合基于本发明第二方面任一所述的方法制备所述移植瘤组织。
19.进一步地,利用获得的移植瘤组织制备质控品,所述质控品的制备方法包括:
20.a)获得的移植瘤修剪去除外周血管、脂肪、结缔组织后切成约150mm3规则块状,流水清洗5min后浸入50ml 10%中性福尔马林缓冲液室温固定48h;
21.b)48h后流水清洗5min,用50%乙醇脱水4h,75%乙醇脱水4h,95%乙醇脱水16h,无水乙醇脱水4h。脱水完成后浸入50ml二甲苯透明1h;1h后,组织块浸入65℃蜡缸处理16h;16h后组织块包埋入蜡块盒中,放入-20℃冷却脱模后,将蜡块置于4℃避光暂存。
22.c)将移植瘤蜡块取出后放入-20℃硬化1h,硬化后的蜡块在切片机上妥善固定后,先将切片厚度设置为5μm对蜡块进行切片修整直至移植瘤组织完全暴露于表面,然后将切片厚度设置为2μm进行连续切片。
23.任选地,所述质控品为载片质控品,进一步地,将切片置于摊片机水面完全展开后捞至载玻片中心位置,放置于切片架上在67℃烤箱烘烤2h确保移植瘤组织牢固地附着与载玻片上。
24.任选地,所述移植瘤组织质控品为悬液质控品,进一步地,悬液的制备方法包括:将200张切片分别收集至50ml规格离心管,将离心管放入-80℃超低温冷冻2h后用玻棒迅速捣碎蜡片,加入30ml二甲苯室温震荡溶解蜡片;溶液3000rpm离心7min,弃上清加入30ml无水乙醇重悬细胞沉淀,2000rpm离心5min清洗1次,弃上清重复使用无水乙醇清洗1次后,用20ml95%乙醇重悬细胞;将细胞悬液过200目筛网,除去未完全溶解的石蜡和较大的细胞团块后暂存-20℃。
25.本发明第四方面提供利用本发明第二方面所述的方法制备得到的移植瘤组织。
26.本发明的第五方面提供本发明第四方面所述的移植瘤组织在制备用于免疫组织化学检测的质控品中的用途。
27.本发明第六方面提供利用本发明第四方面所述的移植瘤组织制备得到的质控品。
28.本发明第七方面提供一种免疫组织化学检测试剂盒,其特征在于,包括本发明第六方面所述的质控品。
29.本发明的有益效果
30.相对于现有技术,本发明具有以下有益效果:
31.利用本发明的试剂组合、试剂盒及方法制备得到的移植瘤质控品,与样本待检的靶标具有高度相似性,且表达丰度稳定。
32.利用本发明的试剂组合、试剂盒及方法制备移植瘤质控品,裸鼠接种后除喂养外,不需要人工进行任何复杂操作,不需要大量耗材、培养设备和培养空间(接种性状稳定的瘤体后生长周期仅1周,每只裸鼠可产生1约个400mm3左右瘤体),十分方便进行规模化生产。
33.本发明的移植瘤质控品不但来源和性状稳定,而且移植瘤拥有类组织形态,在病理判读方面可以提供更多的信息,不仅可用于监控免疫组化实验过程,还可以辅助判读病理结果,具有十分重要的临床应用价值。
34.本发明的切片移植瘤质控品,切片中还包含间质、淋巴细胞、结缔组织,与实际病理切片的形态类似。此切片作为质控品可根据染色强度和定位判断免疫组织化学实验流程中是否出现失误导致染色结果不可信,同时还拥有形态学特征,将对最终结果的判读有积极的参考和对比意义。
附图说明
35.图1示出了nci-h2228细胞和jurkat细胞的生长曲线,
①
第一次传代;
②
第二次传代。
36.图2示出了nci-h2228细胞同步化处理前和同步化处理24h细胞形态。
37.图3示出了阴性细胞jurkat移植瘤与jurkat细胞株免疫组化实验染色结果。
38.图4示出了阳性细胞nci-h2228移植瘤与nci-h2228细胞株免疫组化实验染色结
果。
39.图5示出了阳性细胞nci-h2228移植瘤悬液和阴性细胞jurkat移植瘤悬液免疫组化实验染色结果。
具体实施方式
40.除非另有说明、从上下文暗示或属于现有技术的惯例,否则本技术中所有的份数和百分比都基于重量,且所用的测试和表征方法都是与本技术的提交日期同步的。在适用的情况下,本技术中涉及的任何专利、专利申请或公开的内容全部结合于此作为参考,且其等价的同族专利也引入作为参考,特别这些文献所披露的关于本领域中的相关术语的定义。如果现有技术中披露的具体术语的定义与本技术中提供的任何定义不一致,则以本技术中提供的术语定义为准。
41.本技术中的数字范围是近似值,因此除非另有说明,否则其可包括范围以外的数值。数值范围包括以1个单位增加的从下限值到上限值的所有数值,条件是在任意较低值与任意较高值之间存在至少2个单位的间隔。对于包含小于1的数值或者包含大于1的分数(例如1.1,1.5等)的范围,则适当地将1个单位看作0.0001,0.001,0.01或者0.1。对于包含小于10(例如1到5)的个位数的范围,通常将1个单位看作0.1。这些仅仅是想要表达的内容的具体示例,并且所列举的最低值与最高值之间的数值的所有可能的组合都被认为清楚记载在本技术中。
42.术语“包含”,“包括”,“具有”以及它们的派生词不排除任何其它的组分、步骤或过程的存在,且与这些其它的组分、步骤或过程是否在本技术中披露无关。为消除任何疑问,除非明确说明,否则本技术中所有使用术语“包含”,“包括”,或“具有”的组合物可以包含任何附加的添加剂、辅料或化合物。相反,出来对操作性能所必要的那些,术语“基本上由
……
组成”将任何其他组分、步骤或过程排除在任何该术语下文叙述的范围之外。术语“由
……
组成”不包括未具体描述或列出的任何组分、步骤或过程。除非明确说明,否则术语“或”指列出的单独成员或其任何组合。
43.为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。
44.实施例
45.以下例子在此用于示范本发明的优选实施方案。本领域内的技术人员会明白,下述例子中披露的技术代表发明人发现的可以用于实施本发明的技术,因此可以视为实施本发明的优选方案。但是本领域内的技术人员根据本说明书应该明白,这里所公开的特定实施例可以做很多修改,仍然能得到相同的或者类似的结果,而非背离本发明的精神或范围。
46.除非另有定义,所有在此使用的技术和科学的术语,和本发明所属领域内的技术人员所通常理解的意思相同,在此公开引用及他们引用的材料都将以引用的方式被并入。
47.那些本领域内的技术人员将意识到或者通过常规试验就能了解许多这里所描述的发明的特定实施方案的许多等同技术。这些等同将被包含在权利要求书中。
48.下述实施例中未作具体说明的分子生物学实验方法,均按照《分子克隆实验指南》(第四版)(j.萨姆布鲁克、m.r.格林,2017)一书中所列的具体方法进行,或者按照试剂盒和产品说明书进行。其他实验方法,如无特殊说明,均为常规方法。下述实施例中所用的仪器
设备,如无特殊说明,均为实验室常规仪器设备;下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
49.实施例1细胞培养和注射部位选择
50.a)预热含有10%终浓度胎牛血清的rpmi 1640培养基(完全培养基),在15ml规格离心管中加入9ml完全培养基。
51.b)准备2l 39℃温水,将1管1ml在液氮中保存的nci-h2228细胞(广州赛库生物,cc0244)和jurkat细胞(广州赛库生物,cc1902)取出并放入温水中持续匀速搅拌,在1min融化细胞,并将细胞液加入步骤a)中准备好的离心管中,900rpm离心5min。
52.c)弃上清,加入15ml完全培养基均匀重悬后取1
×
106个细胞分别接种入1个规格为75cm2的细胞培养瓶放入细胞培养箱开始培养。同时另取共5
×
104个细胞混匀分别接种入3孔24孔板中准备计数绘制细胞生长曲线。
53.d)24h后记录24孔板中nci-h2228细胞数量为1.2
×
105个,jurkat细胞数量为1.8
×
105;
54.48h后记录24孔板中nci-h2228细胞数量为3
×
105个,jurkat细胞数量为6.3
×
105;
55.72h后记录24孔板中nci-h2228细胞数量为1.4
×
106个,jurkat细胞数量为2.8
×
106,
56.绘制细胞生长曲线。细胞培养瓶中细胞密度为80%,可以进行传代。
57.e)nci-h2228弃去培养瓶中的原培养基,加入5ml pbs缓冲液清洗1次。加入1ml
58.edta-胰酶对细胞进行消化。2min后细胞从培养瓶底部脱落,消化完成。再加入5ml完全培养基终止反应,并重悬细胞至15ml规格离心管中,900rpm离心5min,弃上清,加入5ml新鲜培养基重悬细胞;jurkat收集细胞至50ml规格离心管中,900rpm离心5min弃上清,加入5ml新鲜培养基重悬细胞。
59.f)nci-h2228细胞和jurkat细胞各取1
×
106个细胞接种入1个新的75cm2含有完全培养基的细胞培养瓶放入细胞培养箱开始培养。同时另取5
×
104个细胞混匀后分别接种入3孔24孔板中准备第2次绘制细胞生长曲线。
60.g)24h后记录24孔板中nci-h2228细胞数量为1.3
×
105个,jurkat细胞数量为1.8
×
105;
61.48h后记录24孔板中nci-h2228细胞数量为3.2
×
105个,jurkat细胞数量为6.4
×
105;
62.72h后记录24孔板中nci-h2228细胞数量为1.4
×
106个,jurkat细胞数量为2.7
×
106,根据2次细胞生长曲线数据绘制的曲线图高度重合(图1)。显微镜下观察,
63.nci-h2228细胞呈现大小均匀的多边形,细胞膜边缘光滑饱满,细胞质均匀无空泡,jurkat细胞呈现聚团生长,细胞膜边缘光滑饱满,细胞密度接近85%,可以进行扩大。
64.h)nci-h2228弃去培养瓶中的原培养基,加入5ml pbs缓冲液清洗1次。加入1ml
65.edta-胰酶对细胞进行消化。2min后细胞从培养瓶底部脱落,消化完成。再加入5ml完全培养基终止反应,并重悬细胞至15ml规格离心管中,900rpm离心5min,弃上清,加入5ml新鲜培养基重悬细胞;jurkat收集细胞至50ml规格离心管中,900rpm离心5min弃上清,加入5ml新鲜培养基重悬细胞。
66.i)两种细胞按照取2
×
106个细胞每瓶分别接种入8个规格175cm2含有完全培养基
的细胞培养瓶放入细胞培养箱开始培养。
67.j)72h后显微镜下观察,nci-h2228细胞呈现大小均匀的多边形,细胞膜边缘光滑饱满,细胞质均匀无空泡,jurkat细胞呈现聚团生长,细胞膜边缘光滑饱满,细胞密度接近90%,准备进行收集。
68.k)nci-h2228细胞弃去培养瓶中的原培养基,每瓶细胞加入5ml pbs缓冲液清洗1次,加入2ml edta-胰酶对细胞进行消化,2min后细胞从培养瓶底部脱落消化完成,加入5ml完全培养基终止反应,吹打收集所有培养瓶中细胞至一50ml规格离心管中,900rpm离心5min;jurkat细胞收集至50ml规格离心管中,900rpm离心5min。
69.l)nci-h2228和jurkat细胞弃上清,加入2ml pbs缓冲液重悬并计数,将细胞稀释至1
×
109/ml,各取1ml细胞悬液置于4℃暂存准备注射裸鼠。
70.准备16只6周龄balb/c雌性裸鼠逐一从无菌包中取出,用单手无名指和小拇指夹住裸鼠尾,食指和中指夹住鼠颈,将裸鼠腹部朝下放置于网格架上,让裸鼠四肢自然扒住网格架,背部完全展开暴露后用注射器挑入裸鼠左侧前肢腋皮下缓慢注射200μl细胞,等待3~4sec后将注射器缓慢从皮下抽出,防止细胞从注射口流出。完成后将裸鼠重新放回无菌包,共注射4只。更换位置至左侧后肢腹股沟处皮下同样注射200μl细胞。共注射4只。注射nci-h2228细胞的裸鼠标记为ma1 、
71.ma2 、ma3 、ma4 (腋下),mg1 、mg2 、mg3 、mg4 (腹股沟);注射jurkat细胞的小鼠标记为ma1-、ma2-、ma3-、ma4-(腋下),mg1-、mg2-、mg3-、
72.mg4-(腹股沟)。
73.m)裸鼠进行正常饲养,注射5天后开始观察成瘤情况。
74.10天后ma3 、mg2 、ma1-、ma4-形成皮下肿块,每天观察测量,14天时,ma1-、ma4-切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma1-:10mm
×
8mm
×
5mm、ma4-:11mm
×
7mm
×
7mm;18天时,ma3 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为9mm
×
6mm
×
5mm;mg2 皮下肿块在24天时依然未达到10mm标准,切除后发现肿块为炎症囊肿,未形成肿瘤。成瘤结果如表1所示:
75.表1细胞接种位置对成瘤的影响
76.注射细胞株注射位置成瘤数量(个)成瘤时间(天)nci-h2228腋下1/418jurkat腋下2/414nci-h2228腹股沟0/4n/ajurkat腹股沟0/4n/a
77.由此可见,通过腋下注射细胞的方式在成瘤率上明显优于通过腹股沟注射的方式。
78.实施例2细胞同步化处理
79.a)参照实施例1步骤a)至步骤h)。
80.b)两种细胞按照取2
×
106个细胞每瓶分别接种入12个规格175cm2的细胞培养瓶放入细胞培养箱开始培养。
81.c)56h后显微镜下观察,nci-h2228细胞呈现大小均匀的多边形,细胞膜边缘光滑饱满,细胞质均匀无空泡,jurkat细胞呈现聚团生长,细胞膜边缘光滑饱满,细胞密度接近
65%,准备进行同步化处理。
82.d)nci-h2228细胞弃去培养瓶中的原培养基,每瓶细胞加入30ml不添加胎牛血清的rpmi 1640培养基(基础培养基);jurkat细胞收集至50ml规格离心管中900rpm离心5min,弃上清加入12ml基础培养基重悬细胞平均分入原培养瓶中,每瓶加入29ml基础培养基。nci-h2228细胞和jurkat细胞放入培养箱中同步化处理16h、20h和24h(nci-h2228细胞同步化处理前后细胞状态见图2)。
83.e)分别经过16h、20h和24h后nci-h2228和jurkat细胞弃上清,每瓶加入新鲜的完全培养基20ml放入培养箱中恢复培养2h。
84.f)恢复后的nci-h2228弃去培养瓶中的原培养基,加入5ml pbs缓冲液清洗1次。加入1ml edta-胰酶对细胞进行消化。2min后细胞从培养瓶底部脱落,消化完成。再加入5ml完全培养基终止反应,并重悬细胞至15ml规格离心管中,900rpm离心5min,弃上清,加入5ml新鲜培养基重悬细胞;恢复后的jurkat收集细胞至50ml规格离心管中900rpm离心5min弃上清,加入5ml新鲜培养基重悬细胞。
85.g)nci-h2228和jurkat细胞弃上清,加入2ml pbs缓冲液重悬并计数,将细胞稀释至1000m/ml,各取1ml细胞悬液置于4℃暂存准备注射裸鼠。
86.h)共准备24只6周龄balb/c雌性裸鼠从无菌包中取出,用单手无名指和小拇指夹住裸鼠尾,食指和中指夹住鼠颈,将裸鼠腹部朝下放置于网格架上,让裸鼠四肢自然扒住网格架,背部完全展开暴露后用注射器挑入裸鼠左侧前肢腋皮下缓慢注射200μl细胞,等待3~4sec后将注射器缓慢从皮下抽出,防止细胞从注射口流出。完成后将裸鼠重新放回无菌包,共注射4只。注射nci-h2228细胞的裸鼠标记为16h:
87.ma5 、ma6 、ma7 、ma8 ;20h:ma9 、ma10 、ma11 、ma12 ;24h:ma13 、ma14 、ma15 、ma16 ;注射jurkat细胞的裸鼠标记为16:ma5-、ma6-、ma7-、ma8-;20h:ma9-、ma10-、ma11-、ma12-;24h:ma13-、ma14-、ma15-、ma16-。
88.i)裸鼠进行正常饲养,注射5天后开始观察成瘤情况。
89.9天后ma6 、ma7 、ma9 、ma12 、ma13 、ma15 、ma5-、ma6-、ma10-、ma11-、ma14-、ma15-形成皮下肿块,每天观察测量。12天时,ma5-、ma6-、ma10-、ma11-、ma14-、ma15-切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma5:11mm
×
7mm
×
7mm、ma6-:10mm
×
5mm
×
6mm、ma10-:9mm
×
6mm
×
7mm、ma11-:10mm
×
6mm
×
7mm、ma14-:11mm
×
5mm
×
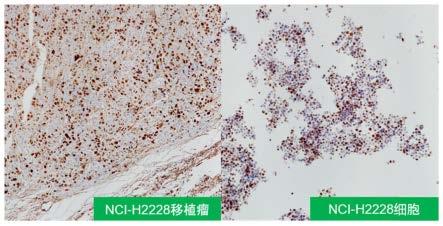
7mm、ma15-:8mm
×
9mm
×
7mm。14天时,ma6 、ma7 、ma9 、ma12 、ma13 、ma15 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma6 :12mm
×
8mm
×
7mm、ma7 :10mm
×
7mm
×
7mm、ma9 :9mm
×
7mm
×
7mm、ma12 :11mm
×
5mm
×
7mm、ma13 :10mm
×
6mm
×
8mm、ma15 :12mm
×
5mm
×
5mm。如表2所示:
90.表2细胞同步化处理对成瘤的影响
91.注射细胞株注射位置同步时间(h)成瘤数量(个)成瘤时间(天)nci-h2228腋下162/414nci-h2228腋下202/414nci-h2228腋下242/414jurkat腋下162/412jurkat腋下202/412
jurkat腋下242/412
92.由表2可知,经过同步化处理的细胞在成瘤时间上更稳定一致并略微提高了成瘤率。不同的同步化时间对于最终的成瘤数量和成瘤时间没有影响。
93.实施例3细胞pma活化处理
94.a)参照实施例1步骤a)至步骤h)。
95.b)参照实施例2步骤b)至步骤c)。
96.c)nci-h2228细胞弃去培养瓶中的原培养基,每瓶细胞加入30ml不添加胎牛血清的rpmi 1640培养基(基础培养基);jurkat细胞收集至50ml规格离心管中900rpm离心5min,弃上清加入12ml基础培养基重悬细胞平均分入原培养瓶中,每瓶加入29ml基础培养基。nci-h2228细胞和jurkat细胞放入培养箱中同步化处理24h(为了合理安排时间处理)。
97.d)24h后nci-h2228和jurkat细胞弃上清,每瓶加入新鲜的完全培养基和不同浓度的pma(50ng/ml、100ng/ml、500ng/ml)20ml放入培养箱中恢复培养2h。
98.e)参照实施例2步骤f)至h)。注射nci-h2228细胞的裸鼠标记为:
99.50ng/ml pma:ma17 、ma18 、ma19 、ma20 ;
100.100ng/ml pma:ma21 、ma22 、ma23 、ma24 ;
101.500ng/ml pma:ma25 、ma26 、ma27 、ma28 ;
102.注射jurkat细胞的裸鼠标记为:
103.50ng/ml pma:ma17-、ma18-、ma19-、ma20-;
104.100ng/ml pma:ma21-、ma22-、ma23-、ma24-;
105.500ng/ml pma:ma25-、ma26-、ma27-、ma28-。
106.f)裸鼠进行正常饲养,注射5天后开始观察成瘤情况。
107.ma17 、ma19 、ma21 、ma22 、ma24 、ma17-、ma18-、ma19-、ma21-、ma22-、ma23-、ma24-和ma26-均在7天后形成皮下肿块,每天观察测量。11天时,ma17-、ma18-、ma19-、ma21-、ma22-、ma23-、ma24-、ma26-切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma17-:12mm
×
8mm
×
9mm、ma18-:10mm
×
8mm
×
8mm、ma19-:9mm
×
8mm
×
7mm、ma21-:11mm
×
6mm
×
8mm、ma22-:11mm
×
8mm
×
7mm、ma23-:10mm
×
9mm
×
7mm、ma24-:12mm
×
8mm
×
9mm、ma26-:9mm
×
8mm
×
10mm。13天时,ma6 、ma7 、ma9 、ma12 、ma13 、ma15 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma17 :9mm
×
8mm
×
11mm、ma19 :12mm
×
9mm
×
9mm、ma21 :10mm
×
8mm
×
8mm、ma22 :12mm
×
9mm
×
7mm、ma24 :10mm
×
9mm
×
11mm。如表3所示:
108.表3pma处理对成瘤的影响
109.注射细胞株注射方式同步时间(h)pma浓度成瘤数量(个)成瘤时间(天)nci-h2228腋下24502/413nci-h2228腋下241003/413nci-h2228腋下245000/413jurkat腋下24503/411jurkat腋下241004/411jurkat腋下245001/411
110.由表3可知,细胞在合适浓度的pma活化后成瘤率显著提高,并能加速成瘤时间。
111.实施例4细胞混合白介素活化处理
112.a)参照实施例1步骤a)至步骤h)。
113.b)两种细胞按照取2
×
106个细胞每瓶分别接种入16个规格175cm2的细胞培养瓶放入细胞培养箱开始培养。
114.c)56h后显微镜下观察,nci-h2228细胞呈现大小均匀的多边形,细胞膜边缘光滑饱满,细胞质均匀无空泡,jurkat细胞呈现聚团生长,细胞膜边缘光滑饱满,细胞密度接近65%,准备进行同步化处理。
115.d)nci-h2228细胞弃去培养瓶中的原培养基,每瓶细胞加入30ml不添加胎牛血清的rpmi 1640培养基(基础培养基);jurkat细胞收集至50ml规格离心管中900rpm离心5min,弃上清加入16ml基础培养基重悬细胞平均分入原培养瓶中,每瓶加入29ml基础培养基。nci-h2228细胞和jurkat细胞放入培养箱中同步化处理24h。
116.e)24h后nci-h2228和jurkat细胞弃上清,各16瓶细胞分成4组分别加入含80ng/ml
117.il-2(白介素2)、含80ng/ml il-10(白介素10)、含80ng/ml il-12(白介素12)
118.以及含80ng/ml il-2、80ng/ml il-10、80ng/ml il-12混合物的完全培养基20ml放入培养箱中培养2h。
119.f)参照实施例2步骤f)至g)
120.g)共准备32只6周龄balb/c雌性裸鼠从无菌包中取出,用单手无名指和小拇指夹住裸鼠尾,食指和中指夹住鼠颈,将裸鼠腹部朝下放置于网格架上,让裸鼠四肢自然扒住网格架,背部完全展开暴露后用注射器挑入裸鼠左侧前肢腋皮下缓慢注射200μl细胞,等待3~4sec后将注射器缓慢从皮下抽出,防止细胞从注射口流出。
121.完成后将裸鼠重新放回无菌包,共注射4只。注射nci-h2228细胞的裸鼠标记为:
122.80ng/ml il-2:ma28 、ma29 、ma30 、ma31 ;
123.80ng/ml il-10:ma32 、ma33 、ma34 、ma35 ;
124.80ng/ml il-12:ma36 、ma37 、ma38 、ma39 ;
125.80ng/ml il-2,il-10,il-12混合:ma40 、ma41 、ma42 、ma43 ;
126.注射jurkat细胞的裸鼠标记为:
127.80ng/ml il-2:ma28-、ma29-、ma30-、ma31-;
128.80ng/ml il-10:ma32-、ma33-、ma34-、ma35-;
129.80ng/ml il-12:ma36-、ma37-、ma38-、ma39-;
130.80ng/ml il-2,il-10,il-12混合:ma40-、ma41-、ma42-、ma43-;
131.h)裸鼠进行正常饲养,注射5天后开始观察成瘤情况。
132.9天后ma28 、ma31 、ma32 、ma33 、ma36 、ma39 、ma40 、ma41 、mma43 、ma28-、ma29-、ma32-、ma36-、ma39-、ma41-、ma42-和ma43-形成皮下肿块,每天观察测量,12天后切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma28-:10mm
×
8mm
×
6mm、ma29-:9mm
×
5mm
×
6mm、ma32-:9mm
×
8mm
×
7mm、ma36-:9mm
×
10mm
×
7mm、ma39-:11mm
×
6mm
×
6mm、ma41-:8mm
×
9mm
×
7mm、ma42-:9mm
×
6mm
×
7mm、ma43-:12mm
×
8mm
×
5mm。14天时,ma6 、ma7 、ma9 、ma12 、ma13 、ma15 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma28 :10mm
×
8mm
×
7mm、ma31 :11mm
×
7mm
×
7mm、ma32 :9mm
×
8mm
×
8mm、ma33 :10mm
×
5mm
×
6mm、ma36 :11mm
×
6mm
×
6mm、ma36 :
10mm
×
5mm
×
5mm、ma39 :10mm
×
6mm
×
6mm、ma40 :11mm
×
9mm
×
5mm、ma41 :8mm
×
9mm
×
8mm、mma43 :8mm
×
8mm
×
7mm。如表4所示:
133.表4混合白介素对成瘤的影响
[0134][0135][0136]
由表4可知,单一白介素的应用对于成瘤率和成瘤时间无显著影响;白介素的混合使用能提高成瘤率。
[0137]
实施例5细胞同步化处理、pma联合混合白介素活化
[0138]
a)参照实施例1步骤a)至步骤h)。
[0139]
b)两种细胞按照取2
×
106个细胞每瓶分别接种入8个规格175cm2的细胞培养瓶放入细胞培养箱开始培养。
[0140]
c)56h后显微镜下观察,nci-h2228细胞呈现大小均匀的多边形,细胞膜边缘光滑饱满,细胞质均匀无空泡,jurkat细胞呈现聚团生长,细胞膜边缘光滑饱满,细胞密度接近65%,准备进行同步化处理。
[0141]
d)nci-h2228细胞弃去培养瓶中的原培养基,每瓶细胞加入30ml不添加胎牛血清的rpmi 1640培养基(基础培养基);jurkat细胞收集至50ml规格离心管中900rpm离心5min,弃上清加入16ml基础培养基重悬细胞平均分入原培养瓶中,每瓶加入29ml基础培养基。nci-h2228细胞和jurkat细胞放入培养箱中同步化处理24h。
[0142]
e)24h后nci-h2228和jurkat细胞弃上清,每瓶加入含有100ng/mlpma以及80ng/ml的混合白介素新鲜的完全培养基和20ml放入培养箱中恢复培养2h。
[0143]
f)参照实施例2步骤f)至g)。
[0144]
g)共准备8只6周龄balb/c雌性裸鼠从无菌包中取出,用单手无名指和小拇指夹住裸鼠尾,食指和中指夹住鼠颈,将裸鼠腹部朝下放置于网格架上,让裸鼠四肢自然扒住网格架,背部完全展开暴露后用注射器挑入裸鼠左侧前肢腋皮下缓慢注射200μl细胞,等待3~4sec后将注射器缓慢从皮下抽出,防止细胞从注射口流出。完成后将裸鼠重新放回无菌包,共注射4只。注射nci-h2228细胞的裸鼠标记为ma44 、ma45 、ma46 、ma47 ;注射jurkat细胞的裸鼠标记为ma44-、ma45-、ma46-、ma47-。
[0145]
h)裸鼠进行正常饲养,注射5天后开始观察成瘤情况。
[0146]
7天后ma44 、ma45 、ma46 、ma47 、ma44-、ma45-、ma46-、ma47-、形成皮下肿块,每天观察测量,11天时,ma44-、ma45-、ma46-、ma47-切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma44-:9mm
×
7mm
×
9mm、ma45-:10mm
×
5mm
×
5mm、
ma46-:9mm
×
8mm
×
8mm、ma47-:8mm
×
10mm
×
7mm。13天时,ma44 、ma45 、ma46 、ma47 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为ma44 :9mm
×
10mm
×
6mm、ma45 :10mm
×
5mm
×
5mm、ma46 :10mm
×
8mm
×
5mm、ma47 :8mm
×
9mm
×
9mm。如表5所示:
[0147]
表5细胞同步化处理、pma联合混合白介素活化对成瘤影响
[0148]
注射细胞株注射方式同步时间(h)活化剂成瘤数量(个)成瘤时间(天)nci-h2228腋下24pma、白介素4/411jurkat腋下24pma、白介素4/413
[0149]
由细胞同步化处理和活化后会显著提高成瘤率,缩短成瘤时间,如表6所示。
[0150]
表6同步化处理、pma处理、混合白介素处理、以及联合使用对成瘤影响
[0151]
注射细胞株注射方式同步时间(h)活化剂成瘤率成瘤时间(天)nci-h2228腋下未处理无25%18jurkat腋下未处理无50%14nci-h2228腋下24无50%14jurkat腋下24无50%12nci-h2228腋下24pma75%13jurkat腋下24pma100%11nci-h2228腋下24混合白介75%14jurkat腋下24混合白介75%12nci-h2228腋下24联合使用75%11jurkat腋下24联合使用100%13
[0152]
可见联合使用多种优化方法显著缩短了成瘤时间,提高了成瘤率。
[0153]
实施例6肿瘤组织再接种
[0154]
a)实施例5中获得的nci-h2228阳性肿瘤和jurkat阴性肿瘤在冰盒中进行修剪去除结缔组织后,切成1mm3左右小块并用10ml无菌pbs清洗10次,准备对裸鼠进行瘤块皮下接种操作。
[0155]
b)准备8只6周龄balb/c雌性裸鼠逐一从无菌包中取出,用水合氯醛麻醉后平卧解剖架,固定四肢、尾椎和颈椎,充分暴露胸腹部。用75%乙醇充分对待接种裸鼠胸腹部进行灭菌,用眼科剪在左侧腋下切开5mm左右切口,尖头镊小心剥开切口处的皮肤与筋膜,将3块瘤块埋入后缝合切口,再次消毒创口并将裸鼠放回无菌包中,每隔0.5h确认小鼠已苏醒,并状态正常。阳性nci-h2228瘤块接种4只裸鼠,标记为mx1 、mx2 、mx3 、mx4 ;阴性jurkat瘤块接种4只裸鼠,标记为mx1-、mx2-、mx3-、mx4-。
[0156]
c)裸鼠进行正常饲养,接种5天后开始观察成瘤情况。
[0157]
5天后8只裸鼠均形成皮下肿块,每天观察测量,9天时,mx1-、mx2-、mx3-、mx4-切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为mx1-:9mm
×
6mm
×
6mm、mx2-:9mm
×
8mm
×
5mm、mx3-:10mm
×
6mm
×
7mm、mx4-:11mm
×
6mm
×
7mm;11天时,mx1 、mx2 、mx3 、mx4 切除约10mm皮下肿块pbs缓冲液清洗10次,修整去除多余结缔组织后测量肿瘤体积为mx1-:10mm
×
8mm
×
6mm、mx2-:9mm
×
5mm
×
5mm、mx3-:10mm
×
7mm
×
7mm、mx4-:10mm
×
6mm
×
8mm。如表7所示:
[0158]
表7再接种成瘤情况
[0159]
接种瘤块接种方式成瘤数量(个)成瘤时间(天)nci-h2228腋下4/411jurkat腋下4/49
[0160]
由表7可以看出,瘤块的重复接种成瘤率和成瘤速度均高于细胞接种。再接种得到的瘤块也可再多次重复接种,在一定次数范围内获得满意的成瘤率和成瘤速度,在本实施例中,再接种一次已经有了显著的效果。
[0161]
实施例7移植瘤切片与细胞系对比
[0162]
a)实施例5中获得的移植瘤修剪去除外周血管、脂肪、结缔组织后切成约150mm3规则块状,流水清洗5min后浸入50ml 10%中性福尔马林缓冲液室温固定48h。
[0163]
b)48h后流水清洗5min,用50%乙醇脱水4h,75%乙醇脱水4h,95%乙醇脱水16h,无水乙醇脱水4h。脱水完成后浸入50ml二甲苯透明1h。1h后,组织块浸入65℃蜡缸处理16h。16h后组织块包埋入蜡块盒中,放入-20℃冷却脱模后,将蜡块置于4℃避光暂存。
[0164]
c)将阳性细胞移植瘤蜡块和阴性细胞移植瘤蜡块取出后放入-20℃硬化1h,硬化后的蜡块在切片机上妥善固定后,先将切片厚度设置为5μm对蜡块进行切片修整直至移植瘤组织完全暴露于表面,然后将切片厚度设置为2μm进行连续切片,将切片置于摊片机水面完全展开后捞至载玻片中心位置。
[0165]
d)将切片放置于切片架上在67℃烤箱烘烤2h确保移植瘤组织牢固地附着与载玻片上,同时石蜡从切片上融化并滴落。
[0166]
e)2h后将烘烤完毕的切片放入脱蜡液缸中洗去剩余残留的石蜡后梯度浸入无水乙醇、95%乙醇、75%乙醇、50%乙醇、纯水中各5min逐步水化。
[0167]
f)将水化完成的切片浸没在ph 9.0的碱性修复液中,并煮沸在高温中修复30min,自然冷却至室温。
[0168]
g)切片用清水流动冲洗1min,放入3%过氧化氢中处理10min去除内源性过氧化物酶的活性。
[0169]
h)封闭完成的切片用清水流动冲洗1min后,甩干水分平铺在加样架上,滴加alk单克隆抗体(杭州百凌生物科技有限公司,cat#bx50187 bp6165)100μl,使抗体覆盖整个移植瘤切片范围,室温孵育30min。
[0170]
i)孵育完成后,用清水流动冲洗1min,甩干水分平铺在加样架上,滴加二抗(杭州百凌生物科技有限公司,cat#bx10001)100μl,使二抗覆盖整个移植瘤切片范围,室温孵育30min。
[0171]
j)清水流动冲洗1min,甩干水分平铺在加样架上滴加显色液(杭州百凌生物科技有限公司,cat#bx10002)100μl,使显色液覆盖整个移植瘤切片范围,室温孵育2min
[0172]
k)清水流动冲洗1min,将染色完毕的切片梯度浸入50%乙醇、75%乙醇、95%乙醇、无水乙醇中各5min逐步脱水。
[0173]
l)晾干切片,滴加中性树胶后,封盖玻片即可在显微镜下观察染色结果。
[0174]
免疫组化实验结果显示,阴性细胞jurkat移植瘤与jurkat细胞株同样呈现出无阳性(褐色)着色的状态(图3);阳性细胞nci-h2228移植瘤与nci-h2228细胞株对照相比,具有相同的染色强度和细胞定位,同时还有细胞所不具备的紧密组织形态(图4),除肿瘤细胞
外,还有间质细胞和各类上皮细胞,丰富的细胞种类和组织形态不但能作为免疫组化实验过程的质控品,还可以直接对比病理组织样本作为诊断结果判读的参照。
[0175]
在显微镜下观察,肿瘤组织切片中,中等到强的肿瘤组织胞浆染色符合akl的亚细胞定位。同时切片中还包含间质、淋巴细胞、结缔组织,与实际病理切片的形态类似。此切片作为质控品可根据染色强度和定位判断免疫组织化学实验流程中是否出现失误导致染色结果不可信,同时还拥有形态学特征,将对最终结果的判读有积极的参考和对比意义。
[0176]
实施例8移植瘤的悬液应用
[0177]
a)实施例5中获得的移植瘤修剪去除外周血管、脂肪、结缔组织后切成约150mm3规则块状,流水清洗5min后浸入50ml 10%中性福尔马林缓冲液室温固定48h。
[0178]
b)48h后流水清洗5min,用50%乙醇脱水4h,75%乙醇脱水4h,95%乙醇脱水16h,无水乙醇脱水4h。脱水完成后浸入50ml二甲苯透明1h。1h后,将组织块浸入65℃蜡缸处理16h。16h后将组织块包埋入蜡块盒中,放入-20℃冷却脱模后,将蜡块置于4℃避光暂存。
[0179]
c)将阳性细胞移植瘤蜡块和阴性细胞移植瘤蜡块取出后放入-20℃硬化1h,硬化后的蜡块在切片机上妥善固定后,先将切片厚度设置为5μm对蜡块进行切片修整直至移植瘤组织完全暴露于表面,然后将切片厚度设置为1μm进行连续切片,将200张切片分别收集至50ml规格离心管。
[0180]
d)将离心管放入-80℃超低温冷冻2h后用玻棒迅速捣碎蜡片,加入30ml二甲苯室温震荡溶解蜡片。溶液3000rpm离心7min,弃上清加入30ml无水乙醇重悬细胞沉淀,2000rpm离心5min清洗1次,弃上清重复使用无水乙醇清洗1次后,用20ml95%乙醇重悬细胞。将细胞悬液过200目筛网,除去未完全溶解的石蜡和较大的细胞团块后暂存-20℃
[0181]
e)参照专利cn202210394699.9制备阳性移植瘤悬液和阴性移植瘤悬液。
[0182]
f)充分混匀悬液后,分别取1μl滴加在待检样品切片的左右两侧,并放入67℃烘箱烤片1h。
[0183]
g)1h后将烘烤完毕的切片放入脱蜡液缸中洗去剩余残留的石蜡后梯度浸入无水乙醇、95%乙醇、75%乙醇、50%乙醇、纯水中各5min逐步水化。
[0184]
h)将水化完成的切片浸没在ph9.0的碱性修复液中,并煮沸在高温中修复30min,自然冷却至室温。
[0185]
i)切片用清水流动冲洗1min,放入3%过氧化氢中处理10min去除内源性过氧化物酶的活性。
[0186]
j)封闭完成的切片用清水流动冲洗1min后,甩干水分平铺在加样架上,滴加alk单克隆抗体(杭州百凌生物科技有限公司cat#bx50187 bp6165)100μl,使抗体覆盖整个待检样品和移植瘤悬液的范围,室温孵育30min。
[0187]
k)孵育完成后,用清水流动冲洗1min,甩干水分平铺在加样架上,滴加二抗(杭州百凌生物科技有限公司cat#bx10001)100μl,使二抗覆盖整个待检样品和移植瘤悬液的范围,室温孵育30min。
[0188]
l)清水流动冲洗1min,甩干水分平铺在加样架上滴加显色液(杭州百凌生物科技有限公司,cat#bx10002)100μl,使显色液覆盖整个待检样品和移植瘤悬液的范围,室温孵育2min
[0189]
m)清水流动冲洗1min,将染色完毕的切片梯度浸入50%乙醇、75%乙醇、95%乙
醇、无水乙醇中各5min逐步脱水。
[0190]
n)晾干切片,滴加中性树胶后,封盖玻片即可在显微镜下观察染色结果。
[0191]
免疫组化实验结果显示,阴性细胞jurkat移植瘤悬液呈现出无阳性着色的状态;阳性细胞nci-h2228移植瘤悬液呈现中等胞浆染色,阴性悬液和阳性悬液的表现与预期表现一致(图5),可说明该次免疫组化实验过程无误,实验结果可信。
[0192]
移植瘤的悬液形式对于病理结果判读的参考价值有限。但由于其与待检样品存在于同一切片上,作为片内的实验过程监控更为精准和严谨。同时由于其液体的形态可以实现快速高效的施加方式,让其在大通量批量检测时具有无法替代的优势。
[0193]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。