1.本发明属于医疗器械领域,尤其涉及一种水凝胶复合修复补片及其制备方法与应用。
背景技术:
2.外科补片是在多种外科手术中用于修复缺损组织的植入材料,如可用于腹壁疝修复、乳房重建、盆底修复、尿道悬吊、阴道修补等方面。其中常见的腹壁疝是指腹腔内脏器或组织离开原来的部位,通过腹壁薄弱处或缺陷、孔隙向外膨出。腹壁疝是外科常见并发症,其中因接受腹腔切开术引起的腹壁缺损最常见。由于腹壁疝不能自愈,病情呈进行性加重特点,使用材料植入进行无张力修补是目前最好的治愈方式。合成高分子网片由于具有力学强度极佳以及质量可控的性能,已得到外科领域的一致认可,其中聚丙烯网片是目前临床上使用最广泛的腹壁修复材料,然而聚丙烯网片植入体内会存在异物刺激引起的慢性炎症、肠道粘发生率极高等问题。目前将聚丙烯补片进行表面化学改性(专利us20110218559a1,文献biomater.sci.7,1323-1334(2019).)或者生物高分子修饰(专利cn101195043a,文献j.mater.chem.b5,575-585(2017).),可以提高相容性减少炎症反应。使用水凝胶对聚丙烯补片进行涂覆或者包埋可以显著降低内脏粘连程度(biomater.sci.6,3030-3041(2018).),水凝胶复合修复补片具有极大优势,然而目前报道的大部分水凝胶复合修复补片制备复杂,需要额外加工和处理,无法直接应用于临床手术现场按需制备,限制了其临床应用前景。
3.此外对于补片植入修补手术,局部感染的风险也较高,如感染需要二次手术取出补片,增大患者痛苦,对于高感染风险患者,需长时间使用高剂量抗生素以预防术后感染。在水凝胶复合修复补片中,可以通过加入化学偶联抗生素的生物高分子层,来达到防粘连和长效抗感染效果。现有技术中报道了一种含有棉花纤维的双层聚丙烯补片(acs biomater.sci.eng.6,3868-3877(2020).),其中棉花纤维素通过烯胺键化学偶联庆大霉素达到抗感染效果,然而由于棉花纤维素生物相容性不够理想,未能完全解决组织粘连问题,并且庆大霉素缓释动力学不详。
4.通过化学偶联进行抗生素缓释的水凝胶用于制备水凝胶复合修复补片的报道较少,对于潜在可以应用到含有水凝胶层的水凝胶复合修复补片的水凝胶体系,往往是使用和凝胶交联同一类化学交联方式来进行对抗生素分子的化学偶联。然而,如使用同一类化学反应,水凝胶交联网络的水解稳定性和抗生素药物分子的可逆释放性往往难以平衡,为了达到抗生素可缓慢释放的目的,水凝胶交联网络通常稳定性不够、降解时间过快,进一步影响了抗生素的长效应用。如基于常见席夫碱键(包括常规酰腙键和亚胺键)的原位交联水凝胶抗水解稳定性不佳;基于水凝胶层的防粘连复合修复补片难以长效缓释抗生素达到抗感染目的。如现有技术中氧化多糖(葡聚糖)的双醛基可以和抗真菌药物两性霉素上的伯氨基形成亚胺键进行化学偶联,并且氧化多糖剩余的醛基可以和己二酰肼修饰的多糖(羧甲基纤维素)通过酰腙键交联原位形成凝胶,从而得到一种具备抗真菌能力的可注射凝胶
(biomaterials 31,1444-1452,2010),然而所述氧化的多糖是直接通过氧化剂氧化多糖主链得到含双醛基的高分子,氧化度高,多糖主链的糖环被打断,多糖主链容易水解断裂,并且氧化多糖和己二酰肼形成的酰腙键会有较高的逆反应速率,导致水解稳定性不高,此外此种氧化多糖的醛基和药物的氨基形成的亚胺键稳定性不佳,导致药物释放速率较快,难以达到稳定长效药物释放目的,不适合用于制备基于水凝胶层的防粘连抗感染水凝胶复合修复补片。现有技术还公开了一种可控释放的抗生素水凝胶及其制备方法和应用(cn106822911a),由氧化的多糖高分子与氨基糖苷类抗生素通亚胺键交联而成,同样因为所述氧化的多糖是直接通过氧化剂氧化多糖主链得到含双醛基的高分子,多糖主链容易水解断裂,导致水解稳定性差,并且氨基糖苷类抗生素是充当了交联剂的作用,此种氧化多糖的醛基和药物的氨基形成的亚胺键高度可逆,稳定性不佳,其得到的水凝胶不但力学性能较差,并且随着药物释放凝胶失去了交联结构导致加速降解,药物释放速率仍然不够平缓可控,也不适合用于制备基于水凝胶层的防粘连抗感染水凝胶复合修复补片。
5.所以,对于通过水凝胶层进行防粘连和抗生素缓释的水凝胶复合修复补片,其合适的化学反应类型需要精巧地进行设计和选择,需要凝胶交联网络具备高稳定性,同时偶联的抗生素药物具有长效缓释能力,此外修复补片的水凝胶复合层需要制备简单,便于手术现场操作。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明第一个方面提出一种水凝胶复合修复补片。
7.本发明的第二个方面提出了一种水凝胶复合修复补片的制备方法。
8.本发明的第三个方面提出了一种水凝胶复合修复补片在感染性组织缺损修补材料中的应用。
9.根据本发明的第一个方面,提出了一种水凝胶复合修复补片,包括水凝胶层,所述水凝胶层的原料包括糖环侧链修饰有碳酰肼基的羧基多糖衍生物、糖环侧链修饰有脂肪醛基的羧基多糖衍生物和氨基糖苷类抗生素;所述脂肪醛基分别与所述碳酰肼基、所述氨基加成对应形成耐降解的稳定酰腙键、平稳水解动态亚胺键。
10.在本发明的一些实施方式中,所述水凝胶复合修复补片还包括临床用外科补片或网片材料,所述水凝胶层包裹所述临床用外科补片或网片材料。
11.在本发明的一些优选的实施方式中,所述临床用外科补片或网片材料包括但不限于医用聚丙烯补片、医用聚胺酯、医用膨化聚四氟乙烯、医用聚对苯二甲酸乙二酸酯补片等临床适用补片或网片材料。
12.在本发明中,水凝胶层基于稳定酰腙键的网络交联方式和动态可逆的亚胺键药物偶联方式,稳定性高,生物相容性优异,抗组织粘附,同时可以长效缓释氨基糖苷类抗生素,具备长效抗感染能力,有利于腹壁缺损修复及功能恢复。所述稳定酰腙键为所述羧基多糖的糖环侧链上酰胺化的碳酰肼基团和所述羧基多糖的糖环侧链上酰胺化的脂肪醛基团加成形成的耐降解的稳定酰腙键;加成反应在生理条件或室温中性ph下进行,稳定酰腙键为含有重复-conhnh-结构的酰腙键,其均为分别修饰在羧基多糖侧链的基团反应其加成反应后的整个结构含有离域电子,形成的共轭π键结构提高了整体化学稳定性,抗水解能力强,
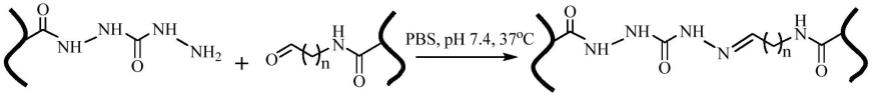
性质稳定。通过稳定酰腙键交联形成的水凝胶层,其在模拟生理条件(pbs,ph 7.4,37℃)下,体外降解时间可达到4~8周。而目前报道的其他用于制备水凝胶复合补片的酰腙键水凝胶大多为前体大分子侧链修饰的己二酰肼基团和多糖大分子通过糖环氧化打断形成的二醛基团形成的酰腙键得到的,此结构的酰腙键自身为一种可逆动态化学键,此外被打断的多糖糖环也比较容易进行多糖主链降解,所以此类酰腙键具有较快的水解速率导致形成的水凝胶会逐渐溶胀和降解,不适合用于制备水凝胶复合补片。
13.在本发明中,氨基糖苷类抗生素是通过可逆亚胺键与水凝胶内部的大分子形成偶联,通过化学键的水解来平稳缓慢释放抗生素,其首先因为凝胶交联网络的高度稳定性保证了凝胶载体不会过快降解,其次偶联药物是通过和修饰在羧基多糖侧链的脂肪醛基和药物上的伯氨基反应形成的,所以其药物释放速率只受到动态亚胺键的水解常数调控,从而能精确平稳的进行长效缓释。水凝胶层内部通过动态亚胺键偶联的抗生素可以通过动态亚胺键地缓慢水解而平稳并长效地缓释,缓释时间达到1~4周,达到长效抗感染效果。而目前报道的其他通过氨基糖苷类抗生素和醛基之间亚胺键反应的凝胶体系中,其均为和多糖大分子通过糖环氧化打断形成的二醛基团反应,此类亚胺键稳定性过低释放速率快,且释放不可控同时受到凝胶主体分子降解的影响,缓释时间普遍小于24小时且初期爆释严重,不适合用于制备抗感染水凝胶复合补片。
14.在本发明的一些优选的实施方式中,所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物的单体结构如下:
[0015][0016]
在本发明的一些优选的实施方式中,所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的单体结构如下:
[0017][0018]
在本发明的一些优选的实施方式中,所述羧基多糖的糖环侧链上酰胺化的碳酰肼基团和所述羧基多糖的糖环侧链上酰胺化的脂肪醛基团加成形成耐降解的稳定酰腙键,示意如下:
[0019][0020]
在本发明中,区别于现有的用于制备水凝胶复合补片的酰腙键凝胶交联结构,上述结构含有至少7~9个碳原子的共轭π键提高了整体化学稳定。
[0021]
在本发明的一些优选的实施方式中,所述动态亚胺键为所述含有氨基糖苷类抗生素分子上的伯氨基和所述羧基多糖的糖环侧链修饰的脂肪醛基加成形成的平衡水解动态亚胺键,示意如下:
[0022][0023]
区别于现有的氨基糖苷抗生素分子通过和使用氧化打断多糖糖环的到的醛基形成的亚胺键偶联结构,在本发明中氨基糖苷类抗生素是通过可逆亚胺键与水凝胶内部的大分子形成偶联,通过化学键的水解来平稳缓慢释放抗生素,最终达达到防粘连抗感染效果。
[0024]
在本发明的一些优选的实施方式中,所述水凝胶层中所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物的修饰度和所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的修饰度均为0.05~0.6,所述修饰度按重复单元计,也即上面所述单体结构。
[0025]
更优选的,所述水凝胶层中所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物的修饰度和所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的修饰度均为0.05~0.4,所述修饰度按重复单元计。
[0026]
在本发明的一些优选的实施方式中,所述水凝胶层的厚度为2mm~10mm。
[0027]
更优选的,所述水凝胶层的厚度为2mm~6mm。
[0028]
在本发明的一些优选的实施方式中,所述水凝胶中所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物与所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的质量浓度均为3%~8%。
[0029]
更优选的,所述水凝胶中所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物与所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的质量浓度均为3%~6%。
[0030]
在本发明的一些优选的实施方式中,所述水凝胶层中所述氨基糖苷类抗生素的浓度为0.2mg/ml~8.0mg/ml,优选为0.22mg/ml~6.5mg/ml。
[0031]
更优选的,所述水凝胶层中所述氨基糖苷类抗生素的浓度为0.25mg/ml~3.5mg/ml。
[0032]
在本发明的一些优选的实施方式中,所述氨基糖苷类抗生素的结构特点是2~3个氨基糖或氨基环醇通过氧桥连接而成的苷类,并且其结构上具有多个伯氨基,其代表性的药物结构如下所示:
[0033][0034]
在本发明的一些优选的实施方式中,所述氨基糖苷类抗生素选自庆大霉素、链霉
素、卡纳霉素、新霉素、妥布霉素中的至少一种。
[0035]
在本发明的一些优选的实施方式中,所述羧基多糖选自含有羧基的天然多糖或羧基改性多糖。
[0036]
在本发明的一些更优选的实施方式中,所述羧基多糖包括但不限于透明质酸(hyaluronic acid,ha)、肝素(heparin,hep)、硫酸软骨素(chondroitin sulfate,cs)、海藻酸(alginate,alg)、羧甲基纤维素(carboxymethyl cellulose,cmc)、羧基化普兰多糖(carboxylated pullulan,pul),其结构单元为六元糖环、乙酰氨基糖环、糖醛酸、糖硫酸酯、氨基糖硫酸酰胺、羧基取代糖,以α-1,4,α-1,6,β-1,4,β-1,3糖苷键连接,其结构特点为多糖聚合物侧链含有多个羧基,其结构通式如下所示:
[0037][0038]
进一步地,所述羧基多糖选自透明质酸、海藻酸、羧甲基纤维素中的至少一种。
[0039]
根据本发明的第二个方面,提出了一种水凝胶复合修复补片的制备方法,其特征在于,包括如下步骤:
[0040]
s1:将氨基糖苷类抗生素溶液与糖环侧链修饰有碳酰肼基的羧基多糖衍生物溶液和糖环侧链修饰有脂肪醛基的羧基多糖衍生物溶液三者混合,得混合物溶液;
[0041]
s2:将s1所述混合物溶液浇注在临床用外科补片或网片材料上,交联,反应,得到所述水凝胶复合修复补片;
[0042]
在本发明的一些实施方式中,s1所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物溶液的质量浓度为3%~6%;
[0043]
在本发明的一些实施方式中,s1所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物溶液的质量浓度为3%~6%。
[0044]
在本发明的一些实施方式中,s1所述氨基糖苷类抗生素溶液与糖环侧链修饰有碳酰肼基的羧基多糖衍生物溶液和糖环侧链修饰有脂肪醛基的羧基多糖衍生物溶液三者用量的官能团摩尔比为(0.05~0.5):1:(1.05~1.5)。
[0045]
在本发明的一些优选的实施方式中,s1所述氨基糖苷类抗生素溶液与糖环侧链修饰有碳酰肼基的羧基多糖衍生物溶液和糖环侧链修饰有脂肪醛基的羧基多糖衍生物溶液三者用量的官能团摩尔比为(0.05~0.2):1:(1.05~1.2)。
[0046]
在本发明中,上述两种羧基多糖衍生物溶液的质量浓度为3%~6%时交联速度合适,适合手术操作,而且具有合适的力学强度和合适的降解时间。其中所述糖环侧链修饰有
脂肪醛基的羧基多糖衍生物溶液略微过量,比所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物过量的官能团用于偶联氨基糖苷,一般使用的氨基糖苷类抗生素的摩尔浓度低于所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物上的脂肪醛基摩尔浓度的0.2倍,此浓度下动态偶联氨基糖苷类抗生素不会显著影响凝胶整体力学性能和稳定性。
[0047]
在本发明的一些优选的实施方式中,所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物与所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物的官能团修饰度均为0.05~0.6。
[0048]
优选的,所述官能团修饰度为0.08~0.4。
[0049]
在本发明中,所述官能团修饰度可以通过调节反应单体间的投料比和选择不同的所述偶联剂和所述助剂的组合物来实现,在适当范围内,所述反应单体投料量越多,使用的偶联剂越多,得到产物的修饰度越高。
[0050]
在本发明的一些实施方式中,s2所述交联的时间为2s~10min,可根据上述两种多糖衍生物的浓度以及官能团修饰度来调节,溶液越高,修饰度越高,交联时间越短。
[0051]
在本发明的一些实施方式中,所述糖环侧链修饰有碳酰肼基的羧基多糖衍生物使用酰胺偶联法制备,具体为:
[0052]
将质量百分比为0.5%~4%的羧基多糖水溶液与碳酰肼混合,加入偶联剂和助剂,使用酰胺偶联法进行偶联,提纯,透析,冻干,得糖环侧链修饰有碳酰肼的羧基多糖衍生物。
[0053]
在本发明的一些实施方式中,所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物使用邻二醇氧化法制备,具体为:
[0054]
将质量百分比为0.5%~4%的羧基多糖水溶液与前体分子a混合,加入偶联剂和助剂,使用酰胺偶联法进行偶联,提纯,透析,冻干,得到中间产物;
[0055]
在质量百分比为0.5%~2%的中间产物水溶液中加入高碘酸钠溶液,反应5分钟,乙二醇终止未反应的高碘酸钠避免多糖主链氧化,提纯,透析,冻干,得糖环侧链修饰有脂肪醛基的羧基多糖衍生物;
[0056]
所述前体分子a选自3-氨基-1,2-丙二醇,4-氨基-1,2-丁二醇中的至少一种。
[0057]
在本发明的一些优选的实施方式中,所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物使用酒石酸二酰肼氧化法制备,具体为:
[0058]
将质量百分比为0.5%~4%的羧基多糖水溶液与酒石酸二酰肼混合,加入偶联剂和助剂,使用酰胺偶联法进行偶联,提纯,透析,冻干,得到中间产物;
[0059]
在质量百分比为0.5%~2%的中间产物水溶液中加入高碘酸钠溶液,反应5分钟,乙二醇终止未反应的高碘酸钠避免多糖主链氧化,提纯,透析,冻干,得糖环侧链修饰有脂肪醛基的羧基多糖衍生物。
[0060]
在本发明的一些优选的实施方式中,所述糖环侧链修饰有脂肪醛基的羧基多糖衍生物使用半缩醛脱保护法制备,具体为:
[0061]
将质量百分比为0.5%~4%的羧基多糖水溶液与前体分子b混合,加入偶联剂和助剂,使用酰胺偶联法进行偶联,提纯,透析,冻干,得到中间产物;
[0062]
将中间产物重新在稀盐酸溶液中溶解,酸性条件下脱去保护基团,加碱中和,丙酮沉淀,提纯,透析,冻干,得糖环侧链修饰有脂肪醛基的羧基多糖衍生物;
[0063]
所述前体分子b选自氨基乙醛缩二甲醇,氨基乙醛缩二乙醇,1-氨基-3,3-二乙氧
基丙烷,4-氨基丁缩醛二乙醇中的至少一种。
[0064]
在本发明的一些更优选的实施方式中,上述偶联剂选自1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc),苯并三氮唑-1-基氧基三(二甲氨基)磷鎓六氟磷酸盐(bop),o-(7-氮杂苯并三唑-1-基)-n,n,n,n
′‑
四甲基脲六氟磷酸酯(hatu)中的至少一种。
[0065]
在本发明的一些更优选的实施方式中,上述助剂选自n-羟基琥珀酰亚胺(nhs),n-羟基硫代琥珀酰亚胺(sulfo-nhs),1-羟基苯并三唑(hobt),二异丙基乙基胺(dipea)中的至少一种。
[0066]
根据本发明的第三个方面,提出了一种水凝胶复合修复补片在感染性组织缺损修补中的应用。
[0067]
在本发明的一些实施方式中,所述水凝胶复合修复补片为第一方面所述的水凝胶复合修复补片或第二方面所述的制备方法制备的水凝胶复合修复补片。
[0068]
在本发明的一些实施方式中,所述感染性组织缺损修补包括但不限于腹壁疝修复、乳房重建、盆底修复、尿道悬吊、阴道修补。
[0069]
本发明的有益效果为:
[0070]
(1)本发明的水凝胶复合修复补片减少了聚丙烯补片的异物刺激和炎症,避免了内脏粘连;
[0071]
(2)本发明的水凝胶复合修复补片通过引入共轭π键结构,提高了酰腙键的稳定性和水凝胶的水解稳定性;
[0072]
(3)本发明的水凝胶复合修复补片中抗生素缓释能力强,从而达到长效抗感染目的。
[0073]
(4)本发明的材料安全,制备方法简单,可直接手术现场混合临床使用抗生素并进行使用,具有较高的实用性。
附图说明
[0074]
下面结合附图和实施例对本发明做进一步的说明,其中:
[0075]
图1为本发明制备的水凝胶复合修复补片中水凝胶的结构示意图。
[0076]
图2为本发明的水凝胶复合修复补片的实体图以及制备过程的示意图。
[0077]
图3为本发明实施例1、对比例1和对比例2制备的水凝胶复合修复补片体外降解实验示意图。
[0078]
图4中a为实施例1、对比例3制备的水凝胶复合修复补片中水凝胶层的体外药物释放时间示意图,b为经过每天更换缓释液不同时间药物缓释取样后,凝胶本体和凝胶释放液的抗菌结果展示图,每个细菌培养皿左上为实施例1,右上为对比例1,下方为不含药物的凝胶对照组。
[0079]
图5为聚丙烯网片和实施例1制备的水凝胶复合修复补片抗细胞粘附性结果展示图。
[0080]
图6为大鼠腹壁缺损造模后植入聚丙烯网片和实施例1制备的水凝胶复合修复补片术后的内脏粘连情况结果示意图。
[0081]
图7为聚丙烯网片和实施例1制备的水凝胶复合修复补片在植入大鼠腹壁缺损模型一周后补片部位的组织切片he染色结果。
具体实施方式
[0082]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0083]
以下实施例1~6和对比例1~3制备了不同类型的水凝胶复合修复补片。其中,合成的侧链酰胺键修饰碳酰肼基团的多糖衍生物的接枝度(修饰度)通过三硝基苯磺酸(tnbs)法测定伯氨基含量来测定;合成的侧链酰胺键修饰脂肪醛基基团的多糖衍生物的接枝度(修饰度)通过和肼基甲酸叔丁酯(tert-butyl carbazate)反应并通过氰基硼氢化钠还原后使用核磁共振氢谱(1h-nmr)来测定。
[0084]
实施例1
[0085]
本实施例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为含有氨基糖苷类抗生素的水凝胶层,外层水凝胶层由碳酰肼基团修饰的透明质酸、脂肪醛基团修饰的透明质酸,以及通过侧链脂肪醛基团以亚胺键偶联有庆大霉素的透明质酸构成。水凝胶层的厚度为5mm,水凝胶层中聚合物的质量浓度为6%,水凝胶层中偶联的庆大霉素浓度为0.6mg/ml。
[0086]
具体过程为:
[0087]
(1)将透明质酸钠用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),加入碳酰肼(5.41g,60mmol,6eq),加入1-羟基苯并三唑(0.92g,6mmol,0.6eq),调节ph至4.7,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.383g,2mmol,0.2eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到糖环侧链通过酰胺键修饰碳酰肼基的多糖衍生物(ha-chz),碳酰肼基团修饰度经测定为0.12;
[0088]
(2)将透明质酸钠用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),加入(s)-3-氨基-1,2-丙二醇(1.82g,20mmol,2eq),加入n-羟基琥珀酰亚胺(nhs)(0.345g,3mmol,0.3eq),调节ph至6.0,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.575g,3mmol,0.3eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到中间产物,将中间产物将重新在水溶液中溶解,得到质量百分比为1%的高分子溶液,在剧烈搅拌下加入高碘酸钠溶液(2.14g,10mmol,1eq),反应5分钟后立即用过量的乙二醇(18.6g,300mmol,30eq)终止未反应的高碘酸钠以避免多糖主链氧化,经提纯,透析,冻干后,得到糖环侧链通过酰胺键修饰脂肪醛基的多糖衍生物(ha-acet-ald),脂肪醛基团修饰度经测定为0.12;
[0089]
(3)分别将ha-chz使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的水溶液(官能团密度0.015mmol/ml),将ha-acet-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的水溶液(官能团密度0.015mmol/ml),将临床用庆大霉素使用pbs配成储备溶液(7.2mg/ml,0.015mmol/ml),将500μl的上述ha-chz溶液和100μl的上述庆大霉素溶液摇振混合,得到600μl ha-chz(质量分数5%)/庆大霉素溶液,再和600μl等体积的ha-acet-ald(6%)溶液混合,并迅速浇注在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补片,最终复合修复补片凝胶层中庆大霉素的含量为0.60mg/ml(0.00125mmol/
ml)。
[0090]
图1为本发明制备的水凝胶复合修复补片中水凝胶的结构示意图。
[0091]
图2为水凝胶复合修复补片的实体图以及制备过程的示意图,将氨基糖苷类抗生素药物直接加入到水凝胶前驱体溶液中的一种,再将其和另外一种水凝胶前驱体溶液混合涂覆在聚丙烯网片上,即可原位形成凝胶层,得到水凝胶复合修复补片。所述前驱体溶液为碳酰肼基团修饰的多糖前驱体溶液(即糖环侧链修饰有碳酰肼基的羧基多糖衍生物溶液)和脂肪醛基团修饰的多糖前驱体溶液(即糖环侧链修饰有脂肪醛基的羧基多糖衍生物溶液)。
[0092]
实施例2
[0093]
本实施例制备了一种水凝胶复合修复补片,与实施例1中制备的水凝胶复合修复补片大体相同,不同之处在于,本实施例中所使用的抗生素为卡纳霉素,最终复合补片凝胶层中卡纳霉素的含量为0.61mg/ml。
[0094]
实施例3
[0095]
本实施例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为含有氨基糖苷类抗生素的水凝胶层,外层水凝胶层由碳酰肼基团修饰的海藻酸、脂肪醛基团修饰的透明质酸,以及通过侧链脂肪醛基团以亚胺键偶联有链霉素的透明质酸构成。水凝胶层的厚度为2mm,水凝胶层中聚合物的质量浓度为4%,水凝胶层中偶联的链霉素浓度为1.2mg/ml。
[0096]
具体过程为:
[0097]
(1)将海藻酸钠用水溶液溶解得到质量百分比为1%的高分子溶液(3.96g,10mmol,1eq),加入碳酰肼(5.41g,60mmol,6eq),加入n-羟基琥珀酰亚胺(nhs)(0.23g,2mmol,0.2eq),调节ph至6.0,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.383g,2mmol,0.2eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到海藻酸侧链通过酰胺键修饰碳酰肼基的衍生物(alg-chz),碳酰肼基团修饰度经测定为0.16;
[0098]
(2)将海藻酸钠用水溶液溶解得到质量百分比为1%的高分子溶液(3.96g,10mmol,1eq),加入4-氨基-1,2-丁二醇(2.1g,20mmol,2eq),加入1-羟基苯并三唑(0.61g,4mmol,0.4eq),调节ph至6.0,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.77g,4mmol,0.4eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到中间产物,将中间产物将重新在水溶液中溶解,得到质量百分比为1%的高分子溶液,在剧烈搅拌下加入高碘酸钠溶液(2.14g,10mmol,1eq),反应5分钟后立即用过量的乙二醇(18.6g,300mmol,30eq)终止未反应的高碘酸钠以避免多糖主链氧化,经提纯,透析,冻干后,得到糖环侧链通过酰胺键修饰脂肪醛基的多糖衍生物(alg-acet-ald),脂肪醛基团修饰度经测定为0.16;
[0099]
(3)分别将alg-chz使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度4%的水溶液,将alg-acet-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度4%的水溶液,将临床用链霉素溶液以实施例1类似的方法在水凝胶前驱体溶液混合反应成胶之前加入到溶液中,并迅速浇注在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补
片,最终复合补片凝胶层中链霉素的含量为1.2mg/ml(0.002mmol/ml)。
[0100]
实施例4
[0101]
本实施例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为含有氨基糖苷类抗生素的水凝胶层,外层水凝胶层由碳酰肼基团修饰的硫酸软骨素、脂肪醛基团修饰的羧甲基纤维素,以及通过侧链脂肪醛基团以亚胺键偶联有妥布霉素的羧甲基纤维素构成。水凝胶层的厚度为8mm,水凝胶层中聚合物的质量浓度为3%,水凝胶层中偶联的链霉素浓度为0.28mg/ml。
[0102]
具体过程为:
[0103]
(1)将硫酸软骨素用水溶液溶解得到质量百分比为1%的高分子溶液(4.98g,10mmol,1eq),加入碳酰肼(1.62g,18mmol,1.8eq),加入二异丙基乙基胺(dipea)(0.078g,0.6mml,0.06eq),调节ph至5.0,加入o-(7-氮杂苯并三唑-1-基)-n,n,n,n
′‑
四甲基脲六氟磷酸酯(hatu)(0.228g,0.6mml,0.06eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到硫酸软骨素侧链通过酰胺键修饰碳酰肼基的衍生物(cs-chz),碳酰肼基团修饰度经测定为0.05;
[0104]
(2)将羧甲基纤维素用水溶液溶解得到质量百分比为1%的高分子溶液(3.94g,10mmol,1eq),加入酒石酸二酰肼(0.89g,1mmol,0.5eq),加入1-羟基苯并三唑(0.153g,1mmol,0.1eq),调节ph至7.0,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.192g,1mmol,0.1eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到中间产物,将中间产物将重新在水溶液中溶解,得到质量百分比为1%的高分子溶液,在剧烈搅拌下加入高碘酸钠溶液(2.14g,10mmol,1eq),反应10分钟后立即用过量的乙二醇(18.6g,300mmol,30eq)终止未反应的高碘酸钠以避免多糖主链氧化,经提纯,透析,冻干后,得到糖环侧链通过酰胺键修饰脂肪醛基的多糖衍生物(cmc-acet-ald),脂肪醛基团修饰度经测定为0.05;
[0105]
(3)分别将cs-chz使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度3%的水溶液,将cmc-acet-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度3%的水溶液,将临床用妥布霉素溶液以实施例1类似的方法在水凝胶前驱体溶液混合反应成胶之前加入到溶液中,并迅速浇注在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补片,最终复合补片凝胶层中妥布霉素的含量为0.28mg/ml(0.0006mmol/ml)。
[0106]
实施例5
[0107]
本实施例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为含有氨基糖苷类抗生素的水凝胶层,外层水凝胶层由碳酰肼基团修饰的羧基化普兰多糖、脂肪醛基团修饰的肝素,以及通过侧链脂肪醛基团以亚胺键偶联有卡纳霉素的透明质酸构成。水凝胶层的厚度为8mm,水凝胶层中聚合物的质量浓度为8%,水凝胶层中偶联的卡纳霉素浓度为0.48mg/ml。
[0108]
具体过程为:
[0109]
(1)将羧基化普兰多糖用水溶液溶解得到质量百分比为1%的高分子溶液(4.56g,10mmol,1eq),加入碳酰肼(3.60g,4mmol,4eq),加入1-羟基苯并三唑(0.92g,6mmol,0.6eq),调节ph至4.7,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.383g,
2mmol,0.2eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到透明质酸侧链通过酰胺键修饰碳酰肼基的衍生物(pul-chz),碳酰肼基团修饰度经测定为0.14;
[0110]
(2)将肝素用水溶液溶解得到质量百分比为1%的高分子溶液(6.37g,10mmol,1eq),加入氨基乙醛缩二甲醇(1.05g,10mmol,1eq),加入n-羟基硫代琥珀酰亚胺(sulfo-nhs)(0.65g,3mmol,0.3eq),调节ph至6.8,加入苯并三氮唑-1-基氧基三(二甲氨基)磷鎓六氟磷酸盐(bop)(1.33g,3mmol,0.3eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到中间产物,将中间产物重新在稀盐酸溶液中溶解,在酸性条件下脱去保护基团,使用氢氧化钠溶液中和,使用过量丙酮沉淀,提纯,透析,冻干,得到糖环侧链通过酰胺键修饰脂肪醛基的多糖衍生物(hep-acet-ald),脂肪醛基团修饰度经测定为0.14;
[0111]
(3)分别将pul-chz使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度8%的水溶液,将hep-acet-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度8%的水溶液,将临床用卡那霉素溶液以实施例1类似的方法在水凝胶前驱体溶液混合反应成胶之前加入到溶液中,并迅速浇注在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补片,最终复合补片凝胶层中卡那霉素的含量为0.48mg/ml(0.001mmol/ml)。
[0112]
实施例6
[0113]
本实施例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为含有氨基糖苷类抗生素的水凝胶层,外层水凝胶层由碳酰肼基团修饰的海藻酸、脂肪醛基团修饰的透明质酸,以及通过侧链脂肪醛基团以亚胺键偶联有新霉素的透明质酸构成。水凝胶层的厚度为10mm,水凝胶层中聚合物的质量浓度为6%,水凝胶层中偶联的新霉素浓度为6.1mg/ml。
[0114]
具体过程为:
[0115]
(1)将海藻酸用水溶液溶解得到质量百分比为1%的高分子溶液(3.96g,10mmol,1eq),加入碳酰肼(16.2g,180mmol,18eq),加入n-羟基硫代琥珀酰亚胺(sulfo-nhs)(1.30g,6mmol,0.6eq),调节ph至7.0,加入o-(7-氮杂苯并三唑-1-基)-n,n,n,n
’‑
四甲基脲六氟磷酸酯(hatu)(2.28g,6mmol,0.6eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到海藻酸侧链通过酰胺键修饰碳酰肼基的衍生物(alg-chz),碳酰肼基团修饰度经测定为0.30;
[0116]
(2)将透明质酸用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),加入4-氨基丁缩醛二乙醇(4.84g,30mmol,3eq),加入n-羟基琥珀酰亚胺(nhs)(3.45g,30mmol,,3eq),调节ph至6.0,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(5.75g,30mmol,3eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到中间产物,将中间产物重新在稀盐酸溶液中溶解,在酸性条件下脱去保护基团,使用氢氧化钠溶液中和,使用过量丙酮沉淀,提纯,透析,冻干,得到糖环侧链通过酰胺键修饰脂肪醛基的多糖衍生物(ha-acet-ald),脂肪醛基团修饰度经测定为0.60;
[0117]
(3)分别将alg-chz使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度8%的水溶液,将ha-acet-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度8%的水溶液(两者官能团摩尔量近似相等),将临床用新霉素溶液以实施例1类似的方法在水凝胶前驱体溶液混合反应成胶之前加入到溶液中,并迅速浇注在临床用聚丙烯补片上,同时
进行交联和药物偶联反应,在10秒内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补片,最终复合补片凝胶层中新霉素的含量为6.1mg/ml(0.01mmol/ml)。
[0118]
对比例1
[0119]
本对比例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为水凝胶层,外层水凝胶层由己二酰肼基团修饰的透明质酸、氧化的透明质酸,以及通过亚胺键偶联有庆大霉素的氧化透明质酸构成。水凝胶层的厚度为5mm,水凝胶层中聚合物的质量浓度为6%,水凝胶层中偶联的庆大霉素浓度为0.60mg/ml(0.00125mmol/ml)。
[0120]
具体过程为:
[0121]
(1)将透明质酸用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),加入己二酸二酰肼(7.84g,45mmol,4.5eq),加入1-羟基苯并三唑(0.69g,4.5mmol,0.45eq),调节ph至4.7,加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(0.288g,1.5mmol,0.15eq),使用酰胺偶联法进行偶联,反应6小时后,经提纯,透析,冻干后,得到透明质酸侧链通过酰胺键修饰碳酰肼基的衍生物(ha-adh),己二酰肼基团修饰度经测定为0.12;
[0122]
(2)将透明质酸使用高碘酸钠进行氧化,用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),在剧烈搅拌下加入高碘酸钠溶液(0.43g,2mmol,0.2eq),避光反应4小时后,用过量的乙二醇(3.72g,60mmol,6eq)终止未反应的高碘酸钠,经提纯,透析,冻干后,得到氧化透明质酸(oxi-ha-ald),氧化多醛基团修饰度经测定为0.12;
[0123]
(3)分别将ha-adh使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的水溶液,将oxi-ha-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的水溶液,将临床用庆大霉素硫酸盐使用pbs配成6.2mg/ml储备溶液,将500μl的上述ha-adh溶液和100μl的硫酸庆大霉素溶液摇振混合,得到600μl的ha-adh(质量分数5%)/抗生素溶液,再和600μl的上述oxi-ha-ald溶液混合,并迅速浇注在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得水凝胶复合修复补片,最终复合补片凝胶层中庆大霉素的含量为0.60mg/ml(0.00125mmol/ml)。
[0124]
对比例2
[0125]
本对比例制备了一种水凝胶复合修复补片,其内层为聚丙烯补片,外层为水凝胶层,外层水凝胶层由羧甲基壳聚糖、氧化的海藻酸,以及通过亚胺键偶联有链霉素的氧化海藻酸构成。水凝胶层的厚度为8mm,水凝胶层中聚合物的质量浓度为8%,水凝胶层中偶联的链霉素浓度为5.2mg/ml。
[0126]
具体过程为:
[0127]
(1)选用脱乙酰度90%,羧基修饰率50%的羧甲基壳聚糖(cm-chit);
[0128]
(2)将海藻酸使用高碘酸钠进行氧化,用水溶液溶解得到质量百分比为1%的高分子溶液(4.01g,10mmol,1eq),在剧烈搅拌下加入高碘酸钠溶液(2.13g,10mmol,1eq),避光反应4小时后,用过量的乙二醇(18.6g,300mmol,30eq)终止未反应的高碘酸钠,经提纯,透析,冻干后,得到氧化海藻酸(oxi-alg-ald),氧化多醛基团修饰度经测定为0.45;
[0129]
(3)分别将cm-chit使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的水溶液,将oxi-alg-ald使用磷酸盐缓冲溶液(pbs,ph=7.4)配成质量百分比浓度6%的
水溶液,将临床用链霉素硫酸盐使用pbs配成6.2mg/ml储备溶液,将500μl的上述cm-chit溶液和100μl的链霉素溶液摇振混合,得到600μl的cm-chit/抗生素溶液,再和600μl的上述oxi-alg-ald溶液混合,并迅速浇铸在临床用聚丙烯补片上,同时进行交联和药物偶联反应,在1分钟内即可交联,继续静置10分钟充分反应后,即得所述防粘连抗感染水凝胶复合修复补片。
[0130]
对比例3
[0131]
本对比例制备了一种水凝胶复合修复补片,本对比例与实施例1中制备的防粘连抗感染水凝胶复合修复补片不同之处在于,水凝胶层使用相同浓度的透明质酸甲基丙烯酸酯(meha)通过紫外交联而成,而非使用酰腙键交联,其和氨基糖苷类抗生素没有化学偶联作用,通过调整双键修饰度使交联密度和实施例1中一致。所制备的复合补片中,所含的庆大霉素的浓度0.60mg/ml(0.00125mmol/ml)。
[0132]
试验例
[0133]
采用体外降解实验、抗生素缓释实验、抑菌实验、细胞实验及体内动物实验对本发明实施例1~6及对比例1~3所制备获得的复合补片的理化特性、防粘连效果、抗感染效果、体内植入后腹壁恢复效果与以评价。
[0134]
(1)体外水凝胶稳定性及降解时间测试
[0135]
复合修复补片的水凝胶层的体外降解时间通过在ph=7.4的磷酸盐缓冲溶液(pbs)中于37℃下进行降解实验并清洗冻干称量干重损失来测定,最长降解试验取样时间为28天;
[0136]
代表性结果如图3所示,全部试验结果如下表1所示:
[0137]
表1实施例1~6和对比例1~3制备的水凝胶复合修补片的体外水凝胶稳定性及降解时间测试
[0138][0139]
试验结果表明,对比例1和对比例2中的水凝胶层降解时间短,无法作为复合修复补片的水凝胶层使用。本发明实施例1~6中的水凝胶层降解时间长,性质稳定,适合作为复合修复补片的水凝胶层使用。
[0140]
图3为实施例1、对比例1和对比例2制备的水凝胶复合修复补片体外降解实验示意图。从图3可看出,通过稳定酰腙键交联的水凝胶具有极高的水解稳定性(实施例1),而通过常规酰腙键交联的水凝胶(对比例1)或者亚胺键交联的水凝胶(对比例2)稳定性差,降解时间过短。
[0141]
(2)抗生素药物缓释时间测定及抑菌效果的检测
[0142]
抗生素的体外缓释通过在ph=7.4的磷酸盐缓冲溶液(pbs)中于37℃下,并在固定时间点取一定量的缓释液,并通过国家药典规定的测试方法进行药物浓度测试并绘制累积缓释曲线;复合修复补片中的水凝胶对抗生素的缓释能力和长效抗菌性通过抑菌实验来测
定,将200μl的负载有抗生素的凝胶浸泡在4ml pbs(ph=7.4)溶液中,于37℃摇床进行缓释,每日将缓释液全部取出,冷冻保存待用,并补充新鲜pbs,使用预定时间取出的水凝胶本体和当日的缓释液(60μl),放置于培养有金黄色葡萄球菌(s.aures)和大肠杆菌(e.coli)的培养皿表面或加入到牛津杯中,继续培养24小时,观察菌落生长情况并测量抑菌环尺寸。
[0143]
代表性结果如图4所示,具体试验结果如下表2:
[0144]
表2实施例1~6和对比例1~3制备的水凝胶复合修补片的抗生素药物缓释时间测定及抑菌效果的检测
[0145][0146]
试验结果表明,对比例1和对比例2中的水凝胶层因自身降解太块,偶联的抗生素释放时间过短,无法达到长效缓释;对比例3中的水凝胶层虽然自身性质稳定但因无法化学偶联抗生素,也无法达到长效缓释。对比例1~3的水凝胶层或缓释液抑菌性能交差,均不适合作为抗感染复合修复补片的水凝胶层使用。本发明实施例1~6中的水凝胶层自身性质稳定,且可以通过化学键偶联抗生素,缓释时间长,水凝胶自身或者缓释液抑菌性能强,适合作为抗感染复合修复补片的水凝胶层使用。
[0147]
图4中a为实施例1、对比例3制备的水凝胶复合修复补片中水凝胶层的体外药物释放时间示意图,b为经过不同时间药物缓释后,凝胶本体和释放液的抗菌结果展示图。从图4的a可看出,抗生素不通过化学偶联而仅仅通过自由扩散会导致极快的释放速率(对比例3),而通过可逆酰腙键偶联的抗生素,表现出平稳的释放速率,缓释时间可达14天(实施例1)。图4的b中,每个细菌培养皿左上角为稳定酰腙键交联并负载庆大霉素的水凝胶(实施例1),右上角为其他类型交联透明质酸并负载庆大霉素的水凝胶(对比例3),下方为不负载庆大霉素的稳定酰腙键交联的水凝胶。实验发现,由于稳定酰腙键交联并负载庆大霉素的水凝胶可以通过可逆亚胺键化学偶联庆大霉素,无论对革兰氏阴性菌大肠杆菌或阳性菌金葡菌均表现出优异的长效缓释抗菌性能,可长效缓释抗生素的水凝胶本体,即使经过不断的更换pbs浸泡冲洗后,一直到14天均有明显的抑菌效果,抑菌环尺寸和初始值相当或仅有降低;水凝胶每日洗脱的缓释液,一直到14天也均有明显的抑菌效果,抑菌环尺寸和初始值相当。对于不具有药物偶联能力,而仅仅是物理负载抗生素的透明质酸水凝胶,其抗生素分子会快速的扩散到缓释液中而损失,凝胶本体在第一天具有明显的抑菌效果,而在第三天几乎没有抑菌能力,水凝胶每日洗脱的缓释液,在第一天具有明显的抑菌效果,在第三天抑菌
效果显著降低,第三天以后也几乎观察不到抑菌效果。对于不负载抗生素的水凝胶对照组,凝胶本体和缓释液没有观察到抑菌效果。此结果表明本发明中提出的通过动态可逆亚胺键偶联抗生素的可以有效负载和平稳缓释抗生素,达到长效抑菌效果。
[0148]
(3)体外试验防细胞粘连性能检测
[0149]
在复合补片的水凝胶层表面接种3t3成纤维细胞,培养3天、7天后进行细胞活死染色观察细胞生长情况。
[0150]
代表性结果如图5所示,具体试验结果如下表3所示:
[0151]
表3实施例1~6和对比例1~3制备的水凝胶复合修补片的抗生素药物缓释时间测定及抑菌效果的检测
[0152][0153][0154]
试验结果表明,本发明实施例1~6中的水凝胶层可以抑制体外成纤维细胞黏附,对比例1中的水凝胶层在第七天有部分未降解,仍然可以抑制细胞黏附,对比例2中的水凝胶层因为降解时间过快,产生部分细胞黏附,而聚丙烯补片上可以引起成纤维细胞黏附。
[0155]
图5为聚丙烯网片和实施例1制备的水凝胶复合修复补片抗细胞粘附性结果展示图,3t3成纤维细胞分别在聚丙烯网片以及水凝胶复合修复补片上培养3天和7天后,进行活死染色并叠加明场照片观察细胞在补片上的粘附和生长情况;图中绿色表示染色的活细胞,第3天,观察到成纤维细胞在聚丙烯网片上可黏附,而在水凝胶复合修复补片上基本无细胞黏附,没有观察到细胞;第7天,观察到在单纯聚丙烯网片组黏附聚丙烯网片支架正常生长且增殖,在水凝胶复合修复补片上基本没有细胞黏附生长,没有观察到细胞。表明水凝胶复合修复补片可以显著抑制细胞粘附。
[0156]
(4)体内植入后炎症反应,抑制内脏粘连,组织再生效果评价
[0157]
在大鼠腹壁缺损模型中,使用修复补片植入后,4周后取材,进行组织切片和染色,对水凝胶层降解情况、炎症情况、内脏粘连情况及组织再生情况进行评价。
[0158]
代表性结果如图6图7所示,具体试验结果如下表4所示:
[0159]
表4实施例1~6和对比例1~3制备的水凝胶复合修补片体内植入后炎症反应、抑
制内脏粘连、组织再生效果
[0160][0161]
试验结果表明,聚丙烯网片植入体内后,产生明显炎症和大量巨噬细胞浸润,和盲肠部位严重粘连,并发炎症和纤维化。含有水凝胶层的复合补片均可减轻植入体内后的炎症反应,然而对比例1和对比例2中的水凝胶层因为降解速率过快,后期会产生轻微炎症和部分粘联,也有少量纤维化产生。对比例3和实施例1~6性质稳定,降解时间长,在组织自身修复完成之前均起到防粘连的作用,促进了腹壁修复。
[0162]
图6为大鼠腹壁缺损造模后植入聚丙烯网片和实施例1制备的水凝胶复合修复补片术后的内脏粘连情况结果示意图。聚丙烯网片有明显的腹腔内肠道粘连情况,而实施例1制备的水凝胶复合修复补片完全没有粘连情况发生。
[0163]
图7为聚丙烯网片和实施例1制备的水凝胶复合修复补片在植入大鼠腹壁缺损模型一周后补片部位的组织切片h&e染色结果。从图中可看出聚丙烯网片(pp,网孔处)周围产生了细胞核被染成蓝色的大量的炎症细胞,并有染成浅红色的纤维组织生成,并且和盲肠发生了严重的粘连,形成了包含炎症细胞和纤维组织的粘连层;实施例1制备的水凝胶复合修复补片周围炎症非常轻微,聚丙烯网片被包裹在凝胶内部,周边无纤维组织生成,和盲肠之间完全没有粘连发生,并且缺损部位修复情况优于聚丙烯网片植入组。
[0164]
上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。