花青素在制备保护bmscs生物学稳定性药物中的应用
技术领域
1.本发明属于化学药物技术领域,具体涉及花青素在制备保护bmscs生物学稳定性药物中的应用。
背景技术:
2.花青素(花青素mucronulatol,花青素)是天然黄酮类化合物,存在沙棘等植物中。
3.bmscs是来源于骨髓基质的一种多能成体细胞。近年来,在组织工程、细胞和基因治疗等乃至生命科学领域应用广泛,已经受到越来越多研究者的关注。因为其快速增殖、易于体外分离、易于导入外源基因、低免疫原性、向多种成熟细胞分化、自我更新能力等潜能。但目前也有大量研究结果表明,bmscs受理化因素诱导也具有促瘤或致瘤性。
4.bmscs在受到外界刺激下,遗传稳定性也会受到影响,如bmscs在与肺癌细胞a549共培养的环境下,以及在氯化镉的干预下,bmscs自身的遗传稳定性会发生改变,如染色体畸变率增加,微核数增多等,同时形态上伴有类肿瘤样细胞转化的表现。故bmscs可因肿瘤细胞类型、微环境、理化致癌因素的不同对肿瘤发挥抑制或促进的作用。这种安全性的问题为bmscs临床治疗的推广产生重要影响。
技术实现要素:
5.本发明的目的是提供花青素在制备保护bmscs生物学稳定性药物中的新应用,对验证花青素保护bmscs生物学稳定性提供了重要理论依据,具有广阔的应用前景。
6.为了达到上述目的,本发明采用的技术方案为:本发明提供花青素在制备保护bmscs生物学稳定性药物中的应用。
7.为了进一步实现本发明,本发明提供了通过筛选得到的花青素的制药作用浓度;本发明还提供了花青素在制备保护bmscs形态药物中的应用;本发明还提供了花青素在制备抑制bmscs增殖药物中的应用;本发明还提供了花青素在制备抑制bmscs凋亡药物中的应用。
8.本发明还提供了花青素在制备维护bmscs在炎性微环境下成骨分化潜能药物中的应用。
9.本发明相较于现有技术的有益效果为:1、花青素及其制备的药物对tnf-α微环境中bmscs形态具有保护作用,与模型组相比可显著缩短胞体的长度;2、花青素及其制备的药物在诱导干预后,可有效降低tnf-α微环境中细胞微核数量,较模型组相比,花青素组微丝排列较整齐,由此可见,花青素及其制备的药物能够有效保护bmscs形态;3、花青素及其制备的药物对tnf-α微环境中bmscs增殖、凋亡均具有显著的抑制作用;4、花青素及其制备的药物能够维护bmscs在炎性微环境中的成骨分化潜能,由此
可见花青素及其制备的药物能够维持定向分化功能。
10.花青素及其制备的药物在体外可以通过改善细胞形态(维持细胞形态,骨架以及减低微核数量)、抑制细胞增殖和凋亡、维护细胞的成骨分化能力等途径,发挥维护tnf-α模拟炎性环境中的bmscs生物学特性稳定的作用。
11.通过本发明的发现和验证,挖掘了花青素的新功能,并对使用其制备药物的浓度进行了筛选,为进一步用药和制备药物提供了重要理论依据,具有广阔的应用前景。
附图说明
12.图1示不同浓度花青素对bmscs增殖的影响;图2示不同浓度花青素对a549增殖的影响;图3示诱导干预21天后各组bmscs的形态变化(40
×
):a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图4示诱导干预21天后各组bmscs的形态(20
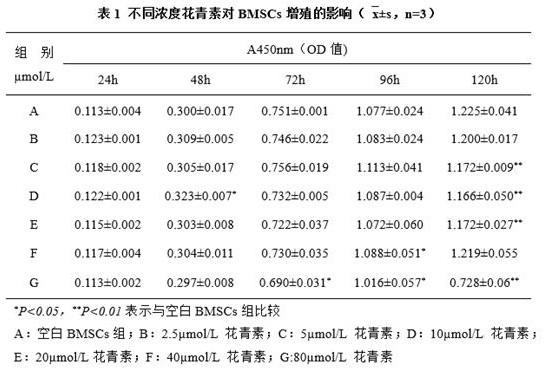
×
):a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图5示诱导干预21天后各组bmscs的形态(40
×
):a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图6示诱导干预21天后各组bmscs微核率的变化(20
×
):a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图7示诱导干预21天后各组骨架变化:a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图8示诱导干预21天后各组bmscs的总凋亡的变化:a:空白bmscs组;b:tnf-α 50ng/ml诱导bmscs组;c:40
µ
mol/l花青素干预组;图9示成骨诱导14d后bmscs茜素红染色结果:a:bmscs组;b:tnf-α组;c:7,2'-二羟基-3',4'-二甲氧基异黄烷 tnf-α组;d:花青素 tnf-α组;图10示各组细胞成骨诱导14d后细胞计数和矿化结节面积;图11示各组细胞干预42天后runx2蛋白表达情况;图12示各组细胞干预42天后akt1蛋白表达情况;图13示各组细胞干预42天后runx2、osterixmrna的表达情况;图14示各组细胞干预42天后akt1mrna的表达情况。
具体实施方式
13.下面结合附图和具体实施方式对本发明做进一步说明。
14.运用tnf-α干预bmscs并观察其生物学特性的变化,基于以下几种生物学实验方法对花青素在bmscs的生物学稳定性方面具有保护作用进行验证。
15.1、材料:1.1 实验材料与主要试剂:1.1.1 细胞株:人肺癌a549细胞株、人骨髓间充质干bmscs细胞株。
16.1.1.2 药物和试剂:
(1)花青素(花青素mucronulatol,花青素)(cfn99741)(纯度》98%)购自购自武汉中标科技有限公司,用dmso溶解,过滤除菌,于-20℃冰箱避光保存备用,实验前稀释至所需浓度;(2)0.25%胰蛋白酶(25200-056),gibco公司,-20℃冰箱保存;(3)青链霉素混合液(p1400),solarbio公司,4℃冰箱保存;(4)fbs(fb15011),clark公司,-20℃冰箱保存;(5)rpmi 1640,hyclone公司,4℃冰箱保存;(6)bmsc专用培养基,7501(sciencell)培养基(7)tnf-α(041525a0818),pepro tech公司,-20℃冰箱保存;(8)细胞增殖与活性检测试剂盒(kr675),dojindo公司,4℃冰箱保存;(9)annexin v-fitc/pi细胞凋亡检测试剂盒(ba00101),bioss公司,4℃冰箱保存;(10)细胞松弛素b(14930-96-2),solarbio公司,4℃冰箱保存;(11)吖啶橙染料(a8120),solarbio公司,4℃冰箱保存;(12)he染色试剂盒(g1120),solarbio公司,4℃冰箱保存;2、细胞复苏、培养、传代及冻存:2.1 细胞复苏:-80℃冰箱取冻存的bmscs和a549细胞,放入37℃的水浴锅中迅速摇晃,用1ml的移液器缓慢的将细胞冻存液移入到提前准备好的25cm2(含3ml的完全培养基)的细胞培养瓶中,标记名称,放入co2培养箱中进行培养4h,即细胞贴壁后,用pbs洗1次,加入4ml完全培养基后放入培养箱中继续培养。
17.2.2 细胞培养:镜下观测当漂浮的细胞或细胞碎片较多时,用pbs洗1遍,在换用新鲜的细胞培养基4ml,骨髓间充质干细胞每三天换液一次,a549细胞每两天换液一次。
18.2.3 细胞传代:显微镜下观察,bmscs和a549细胞的融合度达到90%时,对细胞进行传代。弃掉培养瓶中的细胞上清液,25cm2的培养瓶每次用2ml的pbs洗1次,用1ml的0.25%的胰酶消化细胞,用移液器吸取1ml的细胞悬液到新的细胞培养瓶(含3ml的细胞完全培养基),消毒后放入co2培养箱中继续培养。
19.2.4 细胞冻存:用pbs冲洗细胞1次,胰酶消化1min后加入细胞冻存液(a549细胞:dmem/f12:dmso=9:1;骨髓间充质干细胞:bmscs专用培养基:血清:dmso=6:3:1)2ml,吸取1ml加入到冻存管中,标记,于-80℃冰箱冻存。
20.实验例1、花青素的作用浓度筛选:1、实验设计:利用cck8法检测花青素对bmscs及a549增殖的影响。将花青素浓度和观察时间分别设为0μmol/l、2.5μmol/l、5μmol/l、10μmol/l、20
µ
mol/l、40μmol/l和80μmol/l及24h、48h、72h、96h及120h五个时间段。
21.2、实验方法和结果分析:
2.1 cck8法检测不同浓度花青素对bmscs增殖的影响:取第3代处于对数生长期的bmscs,胰酶消化后制成单细胞悬液,用细胞计数仪进行计数并调整细胞浓度,种植于96孔板(2
×
103个/孔),每孔接种量为100μl,边缘36孔用200μl 无菌pbs填充,培养24h后,弃掉培养基,设置调零孔、空白孔(不加花青素的bmscs培养基)、不同浓度的的花青素干预孔,每组分别设置6个复孔,分别在培养24h、48h、72h、96h和120h。中途第72h进行半数换液,以保证细胞基本生存状态。检测前每孔加入cck8溶液10μl,放培养箱中孵育2h后,用酶标仪在450nm的波长处检测各组细胞的吸光度值。
22.cck8结果显示不同浓度的花青素对bmscs增殖的影响见表1和图1:与空白组比较,80
µ
mol/l 花青素在72h-96h抑制bmscs的增殖(p《0.05),在120h显著抑制bmscs的增殖(p《0.01);40
µ
mol/l 花青素在96h促进bmscs的增殖(p《0.05);20
µ
mol/l 花青素在120h显著抑制bmscs的增殖(p《0.01);10
µ
mol/l 花青素在48h促进bmscs的增殖(p《0.05),在120h显著抑制bmscs的增殖(p《0.01);5
µ
mol/l 花青素在120h显著抑制bmscs的增殖(p《0.01);2.5
µ
mol/l 花青素在24h-120h对bmscs增殖的影响无统计学差异(p》0.05)。
23.2.2 cck8法检测不同浓度花青素对a549增殖的影响:取第4代处于对数生长期的a549,胰酶消化后制成单细胞悬液,用细胞计数仪进行计数并调整细胞浓度,种植于96孔板(2
×
103个/孔),每孔接种量为100μl,边缘36孔用200μl 无菌pbs填充,培养24h后,弃掉培养基,设置调零孔、空白孔(不加花青素的a549培养基)、不同浓度的花青素干预孔,每组分别设置6个复孔,分别在培养24h、48h、72h、96h和120h后。中途第72h进行半数换液,以保证细胞基本生存状态。检测前每孔加入cck8溶液10μl,放培养箱中孵育1.5h后,用酶标仪在450nm的波长处检测各组细胞的吸光度值。
24.cck8结果显示不同浓度的花青素对a549增殖的影响见表2和图2:与空白组比较,80
µ
mol/l、40
µ
mol/l 花青素在48h-120h显著抑制a549的增殖(p《0.01);20
µ
mol/l、10
µ
mol/l 花青素在72h-120h显著抑制a549的增殖(p《0.01);5
µ
mol/l 花青素在48h促进a549的增殖(p《0.05);2.5
µ
mol/l 花青素在48h显著促进a549的增殖(p《0.01)。
25.综上,实验结果显示,与空白组比较,80
µ
mol/l花青素在48h-120h显著抑制a549的增殖(p《0.01),同时80
µ
mol/l花青素在96-120h抑制bmscs增殖(p《0.05或p《0.01);而40
µ
mol/l花青素在48h-120h显著抑制a549的增殖(p《0.01),同时40
µ
mol/l花青素在48h-72h对bmscs增殖的影响无统计学差异(p》0.05),仅在96h促进bmscs的增殖(p《0.05);20
µ
mol/l花青素在72h-120h显著抑制a549的增殖(p《0.01),同时20
µ
mol/l花青素在48h-96h对bmscs增殖的影响无统计学差异(p》0.05),仅在120h显著抑制bmscs的增殖(p《0.01);低浓度的10
µ
mol/l花青素在72h-120h显著抑制a549的增殖(p《0.01),同时10
µ
mol/l花青素在48h-96h对bmscs增殖的影响无统计学差异(p》0.05),在120h显著抑制bmscs的增殖(p《0.01);低浓度的5
µ
mol/l花青素在48h促进a549的增殖(p《0.05),同时在48h-96h对bmscs增殖的影响无统计学差异(p》0.05),在120h抑制bmscs的增殖(p《0.05);2.5
µ
mol/l 花青素在48h显著促进a549的增殖(p《0.01),同时在48h-120h对bmscs增殖的影响无统计学差异(p》0.05),故考虑10-40
µ
mol/l花青素为干预tnf-α诱导后bmscs的最佳浓度。
26.实验例2、花青素保护bmscs形态的生物学功能验证:1、炎性微环境细胞模型的建立和实验分组:1.1 实验方法:取第3代生长状态良好的细胞,胰酶消化取20μl细胞混悬液于细胞计数仪计数后,再用bmscs培养基调成浓度为1
×
104个/ml的单细胞悬液,按2ml/孔接种于六孔板中。实验分为空白bmscs组(a组)、tnf-α50ng/ml诱导组(b组)、40
µ
mol/l花青素干预组(c组)各组细胞每72h换液一次,每次按以上组别更换补充新的tnf-α、花青素,每1周传代一次,连续诱导21天后用于后续实验。诱导过程中,倒置相差显微镜密切观察细胞生长状态,并做好照片记录。
27.1.2 实验结果和分析:倒置显微镜40倍镜下观察显示:空白bmscs组细胞呈梭形;tnf-α 50ng/ml诱导bmscs组、40
µ
mol/l 花青素干预组细胞呈梭形,变亮,突触变长明显。见图3。
28.2、he染色观察各组bmscs的形态变化:2.1 实验方法:取诱导21天后各组处于对数生长期的bmscs,胰酶消化,调整细胞浓度约1
×
105/
ml,滴于盖玻片上(置于6孔板中),培养7天后,取出细胞爬片,用pbs洗涤2次,无水乙醇固定20min,pbs洗涤2次,每次1min,苏木素染液染色15min,pbs洗涤3次,伊红染液染色15min,pbs洗涤3次,自然晾干,中性树胶封片,光学显微镜下观察细胞形态变化。
29.2.2 实验结果和分析:倒置显微镜20、40倍镜下观察显示:空白bmscs组细胞排列有序,旋涡状生长,呈梭形;tnf-α 50ng/ml诱导bmscs组40
µ
mol/l 花青素干预组细胞排列较整齐,分布较均匀,聚集性生长,呈梭形,变亮,突触变长,见图4-5。
30.通过倒置显微镜20倍镜下观察并运用image j计算各组胞体的长度发现:tnf-α 50ng/ml诱导bmscs组、40
µ
mol/l 花青素干预组胞体长度值较空白bmscs组相比显著性增高(p《0.01),有统计学差异;40
µ
mol/l 花青素干预组与tnf-α 50ng/ml诱导bmscs组胞体长度值相比显著性降低(p《0.01),有统计学差异。见表3。
31.3、cb法检测各组bmscs的微核形成率:3.1 实验方法:取诱导21天后各组处于对数生长期的bmscs,胰酶消化,调整细胞浓度约1
×
105/ml,滴于盖玻片上(置于6孔板中),放入培养箱中培养3天,使细胞的融合度达到70%时,进行细胞换液,转入培养基后加入细胞松弛素b (终浓度1mg/ml)1μl,轻轻晃动六孔板,使其充分混匀,继续培养48h后弃去培养基,pbs洗2次,放入通风橱中用卡诺固定液固定30min,弃去固定液,倒扣六孔板,通风橱中干燥30min,吖啶橙染料染色15s。用荧光显微镜计数1000个双核细胞中的微核数,计算结果以千分率(
‰
)表示。
32.3.2 实验结果和分析:由图6和表4可知:诱导干预21天后,与空白bmscs组相比,tnf-α 50ng/ml诱导bmscs组细胞微核形成率明显增加(p《0.01),差异有统计学意义;与tnf-α 50ng/ml诱导bmscs组相比,40
µ
mol/l花青素干预组微核形成率明显减少(p《0.01),差异有统计学意义。
33.4、激光共聚焦观察各组bmscs的骨架变化:4.1 实验方法:制备每组1
×
104/ml细胞悬液,共6组。按照每孔1ml接种在6孔培养板中载玻片上,放置在培养箱24小时。待贴壁后,取出各组的载玻片,用pbs洗涤两次,室温放置10min于
3.7%甲醛溶液中。弃掉甲醛溶液,用pbs(含0.1%triton x-100)冲洗,每次5min放置于摇床洗涤,共3次。按照1:100的比例,用pbs(含0.1%triton x-100,5%bsa)稀释actin-tracker green。每个载玻片上滴200μlactin-tracker green,室温避光20-60min。用pbs(含0.1%triton x-100)冲洗,每次5min放置于摇床洗涤,共3次。将染色后的细胞爬片,观察骨架变化,最大激发波长设置为496nm,最大发射波长516nm。
34.4.2 实验结果和分析:通过激光共聚焦显微镜下观察发现,较模型组相比,空白bmscs组的骨架中微丝均匀分布于胞浆内、有方向性,排列整齐,而40
µ
mol/l 花青素干预组微丝排列较整齐。见图7。
35.综上所述,从实验结果可见,花青素可以从形态包括的不同方面发挥作用,进而改善bmsc细胞在tnf-α干预下发生的胞体长度增加,微核数增多以及骨架中微丝排序紊乱等变化,保护bmscs的形态。
36.实验例3、花青素抑制bmscs增殖的生物学功能验证:1、实验方法:cck8法检测各组bmscs增殖的变化,取诱导21天后各组处于对数生长期的bmscs,胰酶消化后种于96孔板(2
×
103个/孔),每孔接种量为100
µ
l,边缘36孔用200
µ
l无菌pbs填充,每组分别设置6个复孔,分别在培养24h、48h、72h和96h。中途第72h进行半数换液,以保证细胞基本生存状态。检测前每孔加入cck8溶液10
µ
l,放培养箱中孵育1.5h后,用酶标仪在450nm的波长处检测各组细胞的吸光度值。
37.2、实验结果和分析:由表5可见:诱导干预21天后,与空白bmscs组相比,tnf-α 50ng/ml诱导bmscs组细胞在第2、3、4天增殖增加(p《0.05),差异有统计学意义;与tnf-α 50ng/ml诱导bmscs组相比,40
µ
mol/l花青素干预组第3、4天时增殖明显减少(p《0.01),差异有统计学意义;由上可见,诱导干预21天后,模型组细胞在第2、3、4天增殖增加显著,而花青素在第3-4天可明显改善这一过度增殖的表现。
38.实验例4、花青素抑制bmscs凋亡的生物学功能验证:1、实验方法:采用流式检测各组bmscs的细胞凋亡情况,每组细胞用预冷pbs-1ml冰浴洗涤两次,收集1份由1
×
结合缓冲液制成的细胞悬液,悬浮在结合缓冲液中,并在室温下用annexin-v/pi染色15分钟。每组试管加入1
×
结合缓冲液400μl,1h内流式细胞仪分析。
39.2、实验结果和分析:诱导干预21天后各组bmscs晚期(q2)凋亡的变化,与空白bmscs组相比,tnf-α50ng/ml诱导bmscs组比例显著增加(p《0.01),差异有统计学意义;与tnf-α50ng/ml诱导
bmscs组相比,40
µ
mol/l花青素干预组q2比例显著降低(p《0.01),差异有统计学意义。
40.诱导干预21天后各组bmscs早期(q4)凋亡的变化,与空白bmscs组相比,tnf-α50ng/ml诱导bmscs组、40
µ
mol/l花青素干预组比例变化不明显(p>0.05),差异无统计学意义;诱导干预21天后各组bmscs总(z)凋亡的变化。与空白bmscs组相比,tnf-α50ng/ml诱导bmscs组比例显著增加(p《0.01),差异有统计学意义;与tnf-α50ng/ml诱导bmscs组相比,40
µ
mol/l花青素干预组显著降低(p《0.01),差异有统计学意义。见图8和表6。
41.由上可见,通过诱导干预21天后各组bmscs总凋亡的变化可以发现,与模型组相比,经花青素干预后,总凋亡比例显著降低。
42.实验例5、花青素维护bmscs在炎性微环境下成骨分化潜能验证:1、炎性微环境细胞模型的建立和实验分组:取第2代状态良好的bmscs,将细胞调整为1
×
104个/ml浓度的单细胞悬液,每孔2ml细胞悬液种于六孔板,分别以筛选出的最佳浓度100ng/ml的il-6和50ng/ml的tnf-α进行干预。实验分为空白组(bmscs完全培养基培养的bmscs)、模型组(tnf-α50ng/ml干预组)和药物组(7,2'-二羟基-3',4-二甲氧基异黄烷20μmol/l tnf-α50ng/ml和花青素40μmol/l tnf-α 50ng/ml)。连续诱导42d后,每3d换液1次,同时添加相应炎性因子及小分子药物以维持浓度。42d后,进行成骨方向诱导分化,以及检测其相关指标。
43.2、诱导成骨方向分化:六孔板每孔加入1.5ml 0.1%明胶,使底面充分覆盖;轻轻摇匀后在超净工作台内静置30min;30min后弃明胶,自然晾干;将细胞融合度达到80-90%的bmscs,用胰酶消化,并将bmscs悬液接种在事先明胶包被的六孔板中(2
×
104个/ml),每孔2ml,将细胞放入37℃,5% co2培养箱中继续培养;当细胞贴壁后融合度达到60-70%时,弃旧培养基,每孔加入2ml oricell tm成人骨髓间充质干细胞成骨诱导分化完全培养基进行培养;每3d换液1次,换用新鲜成骨分化诱导培养基;每天镜下观察细胞诱导分化情况,于诱导14d后,进行茜素红染色。
44.3、形态学观察:在bmscs成骨诱导分化的过程中,每天在倒置相差显微镜下观察各组细胞形态变化并采集典型图像。
45.4、茜素红染色:4.1 实验方法:成骨诱导分化14d后,弃孔内成骨分化诱导液,用pbs清洗残留诱导液;每孔用2ml细胞固定液固定30min;然后弃细胞固定液,用pbs清洗残留细胞固定液。每孔加入2ml茜素红染液停留3-5min。弃掉茜素红染液后,用pbs清洗掉孔内多余杂质,于显微镜下观察并采
集图像。
46.4.2 实验结果和分析:分别诱导各组细胞向成骨方向分化14d后,空白bmscs组经茜素红染色后成鲜红色,着色较深;tnf-α 50ng/ml组茜素红染色后着色程度较空白组低;7,2'-二羟基
‑ꢀ
3',4'-二甲氧基异黄烷 tnf-α组、花青素 tnf-α组较tnf-α 50ng/ml组着色深;镜下观察,空白 bmscs 组染色矿化结节呈片状紧密连接,分布均匀,tnf-α 50ng/ml组染色后矿化结节分布明显分散,且单个结节较小,而7,2'-二羟基-3',4'-二甲氧基异黄烷 tnf-α组、花青素 tnf-α组较tnf-α 50ng/ml组矿化结节面积均有所增加(图9)。
47.使用image pro plus 6.0 软件对各组细胞成骨诱导14d后的细胞计数和矿化结节面积进行统计计算, tnf-α组细胞计数和矿化结节面积均低于空白bmscs组,7,2'-二羟基-3',4'-二甲氧基异黄烷 tnf-α组和花青素 tnf-α组细胞计数和矿化结节面积均有所增加(表7,图10),差异具有统计学意义(p《0.01)。
48.5、western blot 技术检测炎性微环境中bmscs成骨标记分子runx2和akt1表达的影响验证:5.1 实验方法:5.1.1细胞总蛋白的提取和蛋白样品制备将融合度达80-90%的bmscs用4℃预冷的pbs清洗2次,在培养瓶中加入1ml pbs缓冲液,用细胞刮刀仔细刮取细胞,并将细胞悬液转移至1.5ml离心管中,在4℃预冷的离心机中以12000 rpm离心15min,弃上清;再加入300μl含有蛋白酶抑制剂的ripa裂解液,重悬细胞;并用细胞超声破碎仪碎裂细胞,离心15min(12000 rpm,4℃),将上清转移至新的离心管,使用pultton超微量分光光度计进行蛋白浓度检测。根据测定后的蛋白浓度加入相应的4
×
蛋白上样缓冲液,对样品进行稀释,并用封口膜包好后,沸水煮10min,-20℃冻存备用。
49.5.1.2 蛋白质印迹法(western blot)(1)sds-page电泳1)蒸馏水冲洗干净玻璃板后风干,将玻璃板分别安装到制胶架上。
50.2)按照抗体分子量所需分离胶浓度运用去离子水、30%丙烯酰胺、10%sds、tris-hcl(ph 8.8)、10%过硫酸铵、temed进行配比制胶,摇匀灌胶,再用无水乙醇液封满,待胶完全凝固后,倒掉无水乙醇用滤纸小心吸干剩余液体。
51.3)用去离子水、30%丙烯酰胺、10%sds、tris-hcl(ph6.8)、10%过硫酸铵、temed按比例配制5%浓缩胶,摇匀灌胶,并立即垂直插入梳子。
52.4)放置20min左右待浓缩胶凝固,安装放入电泳槽(区分正负极),向槽内及玻璃板内倒满1
×
电泳液,垂直拔出梳子,并用移液枪吹开上样孔的碎胶。
53.5)根据各组蛋白浓度,按照每孔20μg蛋白量算出每孔的上样体积,用微量进样器将marker加入各玻璃板的一侧位置,再加入各组蛋白样品。
54.6)电泳:p1模式:恒压80v,电泳30min,待溴酚兰到达浓缩胶与分离胶的分界部位切换至恒压120v,电泳1h左右的p2模式,直到溴酚蓝大约跑至玻璃板下沿1.5cm处终止。
55.(2)蛋白转膜1)提前裁剪适合凝胶的大小的pvdf膜,并将其全部浸于甲醇中激活5min。
56.2)将预冷的1
×
转膜液倒入托盘,将转膜用的海绵垫、滤纸放入浸湿。用刮板撬开玻璃板,裁掉浓缩胶。
57.3)将夹子黑色面上依次放上海绵、滤纸、胶、pvdf 膜、滤纸和海绵,小心对齐合住夹子固定。
58.4)将夹子按照正负极安装进转膜槽中,向转膜槽中倒满1
×
转膜液至浸过转膜夹子。采用恒压90v,转膜时间2 h。放入冰盒,并冰浴转膜槽使转膜全过程低温进行。
59.(3)封闭及孵育抗体1)封闭:将转膜完成的pvdf膜标记好并置于装有封闭液的孵育盒中,恒温摇床封闭2h。
60.2)裁膜:根据条带 marker 的位置,用剪刀裁取目的蛋白的相对位置。
61.3)一抗孵育:将膜放入各自相应的一抗抗体孵育,4℃恒温摇床上孵育过夜,第二日,回收一抗,1
×
tbst洗膜,每次5min,洗3次。
62.4)二抗孵育:用一抗对应种属的二抗,4℃恒温摇床孵育2h。1
×
tbst洗膜,每次5min,洗3次。
63.(4)显色及图像分析1)将ecl 发光液等体积1:1混匀后滴加在置于干净玻璃板的pvdf膜上,注意避免气泡生成,在暗室中用凝胶成像仪(bio-rad)进行曝光并采集图像。
64.2)图像分析:运用image j软件算出条带灰度值,结果以目的蛋白条带与gapdh内参条带灰度值的比值表示。实验重复3次。
65.5.2 实验结果和分析:western blot法检测各组runx2的表达结果显示(图11),与正常bmscs组比较,tnf-α干预组的runx2表达降低(p《0.01),与tnf-α干预组相比,7,2'-二羟基-3',4'-二甲氧基异黄烷和花青素组的runx2表达均有显著差异(p《0.01)。
66.western blot法检测各组akt1的表达结果显示(图12),与正常 bmscs 组比较,tnf-α组的akt1表达降低(p《0.01),与tnf-α组相比,7,2'-二羟基-3',4'-二甲氧基异黄烷组和花青素组的akt1表达均有所上升,具有统计学差异(p《0.01)。
67.6、rt-pcr技术检测炎性微环境中bmscs成骨相关转录因子runx2、osterix和akt1表达的影响验证:6.1 实验方法:6.1.1细胞rna的提取和制备(1)提取细胞rna1)取生长状态良好的各组细胞,用1mlpbs/瓶清洗细胞3次,用无酶枪头吸取残余pbs,加入trizol 1ml/瓶,冰上静置8min。
68.2)用无酶枪头反复吹打细胞,待细胞脱落后,将细胞悬液移至1.5 ml无酶ep管中,加入200μl氯仿,摇匀15s,冰上静置10min,在4℃预冷的离心机中12000rpm,离心15min。
69.3)无酶枪头吸取上清上层水相至新的无酶ep管中,加入500μl的异丙醇,摇匀,冰上静置10min,在4℃预冷的离心机中12000rpm,离心15min。
70.4)离心后,可见底部有白色沉淀,弃去上清,加入1ml预冷的75%乙醇,轻弹管壁至沉淀漂浮,在4℃预冷的离心机中7500rpm,离心10min。
71.5)弃上清,离心管反扣自然风干10min,加入20μl free water,重悬沉淀,备用。
72.(2)rna浓度测定运用pultton超微量分光光度仪,通过p100.v1.0.0软件检测rna纯度与浓度,重复3次,取平均值。
73.(3)rna逆转录1)残留基因组dna去除在1.5ml无酶ep管中分别加入表8中体积组分,42℃孵育2min。
74.2)逆转录在1)的反应管中加入4
×
hifair
ꢀⅲꢀ
supermix plus,见表9用移液器轻轻吹打混匀。
75.3)逆转录程序设置(表10)使用55℃逆转录合成cdna,分装后置于-80℃保存备用。
76.6.1.2 实时荧光定量pcr1)本发明使用由生工公司设计并合成的引物序列,如表11所示:
2)real-time pcr反应液的配制(见表12,20μl体系)3)real-time pcr 扩增程序(见表13,两步法)6.2 实验结果和分析:rt-pcr法检测各组runx2、osterix的表达结果显示(表14,图13),与正常 bmscs 组比较,tnf-α干预组的runx2、osterix表达降低(p《0.05),与tnf-α组比较,7,2'-二羟基-3',4'-二甲氧基异黄烷组和花青素组的runx2、osterix表达均有显著差异(p《0.05或p《0.01),其中,7,2'-二羟基-3',4'-二甲氧基异黄烷组差异更显著(p《0.01)。
77.rt-pcr法检测各组akt1的表达结果显示(表15,图14),与正常bmscs组比较,tnf-α
组的akt1表达降低(p《0.01),与tnf-α组比较,7,2'-二羟基-3',4'-二甲氧基异黄烷组和花青素组的akt1表达均有上升,差异具有统计学意义(p《0.05或p《0.01),其中7,2'-二羟基-3',4'-二甲氧基异黄烷组上升更为明显(p《0.01)。
78.。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。