1.本发明属于药物制剂技术领域,具体的,涉及一种用于高浓度纤维蛋白溶酶原制剂的冻干保护剂。
背景技术:
2.纤维蛋白溶解酶原(plasminogen,pg)由肝脏合成,在血液中循环,血浆中含量约为0.18g/l。活化的pg称为纤维蛋白溶解酶(plasmin,pm),是纤溶系统的重要组成成分,pg激活后也参与伤口愈合、细胞转移,组织修复,血管生产、胚胎发育等过程[1]。
[0003]
基因突变或天冬酰胺酶等影响会引起pg缺乏症,包括ⅰ、ⅱ型pg缺乏症。ⅰ型pg缺乏症是常染色体异常引起,属于隐性遗传,可导致严重的临床症状,主要造成全身黏膜纤维蛋白沉积(schott,1998)[2],最常见的表现为眼部木质化结膜炎。这种症状早在1847年就被bouisson发现,1933年,borel[3]将其命名为木质化结膜炎(ligneous conjunctivitis)。目前这种疾病只能采用外科手术的方式切除,但由于根本病因没有解决,症状仍会复发。ⅰ型pg缺乏发病率约1.6/1,000,000([4]tefs k,gueorguieva m,klammt j,allen cm,aktas d,anlar fy,aydogdu sd,brown d,ciftci e,contaurni p,dempfee ce,dostalek m,eisert s,gokbuget a,gunham o,hidayat aa,hugle b,isikoglu m,irkec m,joss sk,keble s,kneppo c,kurtulus i,mehta pp,ormek k,schneppenheim r,slregard s,swerney e,turtschis,veres g,zeilee p,zieplu m,schusterv v.(2006)m olecular and clinical spectrum of type i plasminogen deficiency:a series of 50patients.blood,108,3021-3026.),80%患者会出现木质化结膜炎[5](schuster v,1999)。大多pg缺乏患者为婴儿和儿童,首次临床症状大约出现在10月龄(schuster,2007;bateman 1986)。ⅰ型pg缺乏还会引起耳朵、鼻窦、气管支气管、泌尿系统、牙龈等器官组织,气管支气管部位的损伤加上高粘度分泌物可能造成呼吸衰竭。
[0004]
mingers,et.al.(1994)[6]首次采用lys-pg浓缩物治疗pg先天缺乏,但是由于剂量过低没有显著治疗效果。schott et al(1998)[2]将剂量提高2-10倍后,木质化结膜炎消失,并且呼吸道高粘度分泌物和伤口损伤均得到治愈。
[0005]
局部注射新鲜血浆(含pg)或其他含pg的滴眼液能有效治疗眼部木质化结膜炎(heidemann et al.2003;watts et al.2002;pergantou et al.2011,and tabbara et al.2004)。
[0006]
有文献评估了pg全身用药的效果。kraft et.al.(2000)[7]给一名患有严重pg缺乏症的儿童每天注射lys-pg,结果发现眼结膜上假膜溶解。schott etal.(1998)[2]给6月龄婴儿每日单次注射lys-pg,发现4周内木质化结膜炎完全消退。
[0007]
pg缺乏症患者体内pg抗原含量约《0.1~0.9g/l,pg活性《1%~50%[8](schuster et al.,2007)。大多数患者体内仍残留pg活性,所以pg替代疗法或许能有效治疗pg缺乏症。pg属于内源性蛋白,理论上不会产生免疫原性。
[0008]
多项研究均表明pg浓缩物能有效治疗或抑制病变复发[2](watts etal.2002,
heidemann et al.2003,and schott et al.1998),但由于目前没有可局部或全身治疗用的纯化的pg产品,所以pg先天缺乏症仍未解决。
[0009]
本科室研发一种高浓度pg冻干制剂用于局部注射,已有的配方中含有蔗糖,由于蔗糖是二糖,不可以被细胞直接利用,容易引起血液和体液渗透压的改变,
[0010]
基于此,提出本发明。
[0011]
[1]castellino,francis j.,and victoria a.ploplis."structure and function of the plasminogen/plasmin system."thrombosis and haemostasis93.04(2005):647-654.
[0012]
[2]schott,dorothee,et al."therapy with a purified plasminogen concentrate in an infant with ligneous conjunctivitis and homozygous plasminogen deficiency."new england journal of medicine 339.23(1998):1679-1686.
[0013]
[3]borel mg.(1933)un nouveau syndrome palpebral.bull socfr ophthalmol,46,168-180.
[0014]
[4]tefs k,gueorguieva m,klammt j,allen cm,aktas d,anlar fy,aydogdu sd,brown d,ciftci e,contaurni p,dempfee ce,dostalek m,eisert s,gokbuget a,gunham o,hidayat aa,hugle b,isikoglu m,irkec m,joss sk,keble s,kneppo c,kurtulus i,mehta pp,ormek k,schneppenheim r,slregard s,swerney e,turtschis,veres g,zeilee p,zieplu m,schusterv v.(2006)m olecular and clinical spectrum of type i plasminogen deficiency:a series of 50patients.blood,108,3021-3026.
[0015]
[5]schuster v,seidenspinner s,zeitler p,escher c,pleyer u,beznauer w,stiehrn er,isenberg s,olsson t,mingers am,schambeck c,kreth hw.(1999)compound-heterozygous mutations in the plasminogen gene predispose to the development of ligneous conjunctivitis.blood,93,3457-3466.
[0016]
[6]mingers am,philapitsch a,zeitler p,schuster v,schwarz hp,kreth hw.(1999)homozigous type i plasminogen deficiency and ligneous conjunctivitis.apmis,107,62-72.
[0017]
[7]kraft j,lieb w,zeitler p,schuster v.(2000)ligneous conjunctivitis in a girl with severe type i plasminogen deficiency.graefes arch clin exp ophthalmol,238,797-800.
[0018]
[8]schuster,v.,b.h
ü
gle,and k.tefs."plasminogen deficiency."journal of thrombosis and haemostasis 5.12(2007):2315-2322.
技术实现要素:
[0019]
本发明首先涉及一种用于高浓度纤维蛋白溶酶原制剂(pg)冻干制品的保护剂;所述的保护剂由如下成分组成:
[0020]
(1)质量浓度为1-9%的精氨酸,优选的浓度为3-9%,最优选为4%;
[0021]
或(2)质量浓度为0.4-3%甘氨酸,优选的浓度为2-3%,最优选为2.5%;
[0022]
(3)浓度为2-30mmol/l的醋酸钠缓冲液,优选的,醋酸钠含量为2mmol/l;
[0023]
(4)溶剂及必要的ph调节剂。
[0024]
进一步的,所述溶剂为水,所述ph调节剂为盐酸。
[0025]
进一步的,保护剂组分为精氨酸时,醋酸钠缓冲液ph5.2;保护剂组分为甘氨酸时,醋酸钠缓冲液ph6.5;
[0026]
进一步的,含有保护剂纤维蛋白溶酶原制剂(pg)冻干制品中的蛋白含量约为:15-20g/l,优选约为20g/l。
[0027]
本发明还涉及一种高浓度纤维蛋白溶酶原制剂(pg)冻干制品的制备过程,包括如下步骤:
[0028]
(1)冻干前的人纤维蛋白溶酶原样品,用含有醋酸钠的缓冲液进行超滤透析至预设蛋白浓度;
[0029]
(2)添加冻干保护剂;
[0030]
(3)用0.2μm除菌滤膜过滤后进行冻干,冻干程序为;
[0031]
1)1min预冻至-45℃,维持120min,压力达13pa后,开始升温;
[0032]
2)30min升温至-15℃,压力设置为15pa,维持900min;
[0033]
3)60min升温至25℃,压力设置为20pa,维持270min后压塞、放气、出柜;
[0034]
其中,步骤(2)中的冻干保护剂选自:
[0035]
1)质量浓度为1-9%的精氨酸,优选的浓度为3-9%,最优选为4%;
[0036]
或2)质量浓度为0.4-3%甘氨酸,优选的浓度为2-3%,最优选为2.5%;
[0037]
其中,步骤(1)中的醋酸钠的缓冲液为:
[0038]
1)醋酸钠含量为2-30mmol/l,优选的,醋酸钠含量为2mmol/l;
[0039]
2)保护剂组分为精氨酸时,醋酸钠缓冲液ph5.2;保护剂组分为甘氨酸时,醋酸钠缓冲液ph6.5。
[0040]
其中,步骤(3)中崩解温度优选温度较高的组别,玻璃化温度优选组分单一的组别。
[0041]
本发明的有益效果在于,
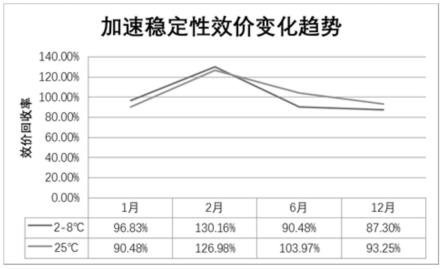
[0042]
提供一种新的保护配方用以pg冻干制品的保护剂;该冻干保护剂特点是:不含动物源性的物质,能够有效的保护pg在冻干过程中的活性,并能使其外观、复溶后各项检测指标符合药典要求。
附图说明
[0043]
图1、甘氨酸处方的稳定性实验结果。
[0044]
图2、盐酸精氨酸处方的稳定性实验结果。
[0045]
图3、应用本发明保护剂(盐酸精氨酸)冻干人纤维蛋白溶酶原制品,冻干后为乳白色疏松体。
[0046]
图4、应用本发明保护剂冻干人纤维蛋白溶酶原制品时的玻璃化温度测试曲线图,4a:盐酸精氨酸组别玻璃化温度测试曲线图;4b:氨基酸组别玻璃化温度测试曲线图。
[0047]
图5、以配方优化后的保护剂(精氨酸组)制备的人纤维蛋白溶酶原冻干制剂复溶后的分子大小分布检测结果。
具体实施方式
[0048]
试剂及材料
[0049]
纯化后的人纤维蛋白溶酶原样品,自制,p201811002蛋白含量6g/l,p201903002蛋白含量15g/l,p201903003蛋白含量20g/l,p201906007分成三份,蛋白含量分别为6g/l、15g/l、20g/l,p201907008蛋白含量为20g/l。
[0050]
醋酸钠,20171113,药用
[0051]
甘氨酸,134004,药用
[0052]
盐酸精氨酸,17ah02m021,药用
[0053]
ph6.5的缓冲液的配置:称量醋酸钠及甘氨酸,注射用水定容后搅匀,测ph,并用1m hcl或6m醋酸钠调节配制好的溶液至ph6.5。
[0054]
ph5.2的缓冲液的配置,称量醋酸钠及盐酸精氨酸,注射用水定容后搅匀,测ph,并用1m hcl或6m醋酸钠调节配制好的溶液至ph5.2。
[0055]
实施例1、冻干保护剂处方的初步优化(甘氨酸)
[0056]
取纯化后的人纤维蛋白溶酶原样品,用含有醋酸钠,ph6.0-6.5的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成四组,按照下表分别添加甘氨酸至目标浓度范围,用除菌滤膜过滤后,进行冻干。考察人纤维蛋白溶酶原冻干前后效价回收率,结果如下表所示,
[0057]
甘氨酸浓度0.4%1.4%2%3%ph6.296.136.116.08渗透压(mosmol/kg)222345432522人纤维蛋白溶酶原冻干前后效价回收率85.66%88.81%97%98.25%
[0058]
可见,冻干保护剂处方中,甘氨酸的最优浓度为2-3%
[0059]
实施例2、冻干保护剂处方的初步优化(盐酸精氨酸)
[0060]
取纯化后的人纤维蛋白溶酶原样品,用含有醋酸钠,ph6.0-6.5的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成四组,按照下表分别加盐酸精氨酸至目标浓度范围,用除菌滤膜过滤后,进行冻干。考察人纤维蛋白溶酶原冻干前后效价回收率,结果如下表所示,
[0061][0062][0063]
可见,冻干保护剂处方中,盐酸精氨酸的最优浓度为3-9%。
[0064]
实施例3、冻干保护剂处方的初步优化(醋酸钠)
[0065]
取纯化后的人纤维蛋白溶酶原样品,用含有2-30mmol/l醋酸钠的缓冲液(ph7.0)进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成六组,按照下表分别加甘氨酸、盐酸精氨酸至目标浓度2.5%、4%,用除菌滤膜过滤后,进行冻干。考察人纤维蛋白溶酶原冻干前后的渗透压(不低于240mosmol/kg)、效价回收率,结果如下表所示,
[0066][0067]
可见,冻干保护剂处方中,醋酸钠最优含量为2mmol/l。
[0068]
实验例4、冻干保护剂处方的进一步优化(盐酸精氨酸)
[0069]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、ph5.2的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成三组,按照下表分别加盐酸精氨酸至目标浓度范围,用除菌滤膜过滤后,进行冻干。考察人纤维蛋白溶酶原冻干前后效价回收率、水分(冻干后吸湿,水分在3%以内合格)、复溶时间,结果如下表所示,
[0070][0071]
可见,冻干保护剂处方中,盐酸精氨酸的最优浓度为3-6%。
[0072]
实施例5、冻干保护剂处方的进一步优化(甘氨酸)
[0073]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、ph6.5的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成三组,按照下表分别加甘氨酸至目标浓度范围,用除菌滤膜过滤后,进行冻干。考察人纤维蛋白溶酶原冻干前后效价回收率、水分(冻干后吸湿,水分在3%以内合格)、复溶时间,结果如下表所示,
[0074]
甘氨酸浓度2%2.5%3%复溶时间<30s<30s<30s水分2.75%2.61%2.71%冻干前后效价回收率98.25%97.06%92.54%
[0075]
可见,冻干保护剂处方中,甘氨酸的最优浓度为2-3%。
[0076]
实施例6、冻干保护剂处方的进一步优化(蛋白含量)
[0077]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、4%盐酸精氨酸、ph5.2的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为5-20g/l,分成四组,按照下表分别加人纤维蛋白溶酶原样品至目标浓度范围,用除菌滤膜过滤后,进行冻干。考察蛋白浓度范围。
[0078][0079][0080]
可见,使用本发明冻干保护剂处方,蛋白含量浓缩至20g/l时,效价回收率更佳。
[0081]
实施例7、加速稳定性试验对比
[0082]
7.1、甘氨酸处方
[0083]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、2.5%甘氨酸、ph6.5的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为20g/l,用除菌滤膜过滤后,冻干得到的制品进行加速稳定性试验。结果见图1。
[0084]
7.2、精氨酸处方
[0085]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、4%盐酸精氨酸、ph5.2的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为20g/l,用除菌滤膜过滤后,冻干得到的制品进行加速稳定性试验。结果见图2。
[0086]
可见,相比于甘氨酸为主要成分的冻干保护剂,盐酸精氨酸作为主要成分的冻干保护剂的(时间/温度)稳定性效果更优。
[0087]
实施例8、冻干工艺优化
[0088]
取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、4%盐酸精氨酸、ph5.2的缓冲液进行超滤分装,然后进行崩解温度、玻璃转化温度测试,测试后根据测试结果设定冻干参数进行冻干。冻干后制品状态见图3
[0089]
8.1、崩解温度测试
[0090]
在保证制品冻干后质量的条件下,崩解温度测试结果如下表所示,根据结果优选
崩解温度偏高的组别的配方。具体为:醋酸钠2mmol/l、盐酸精氨酸4%、pg蛋白含量20g/l。
[0091][0092][0093]
另取纯化后的人纤维蛋白溶酶原样品,用含有2mmol/l醋酸钠、ph6.5的缓冲液进行超滤透析,浓缩至人纤维蛋白溶酶原浓度为设定浓度,进行崩解温度测试,测试后根据测试结果设定冻干参数进行冻干,结果如下表所示,根据结果优选崩解温度偏高的组别的配方。具体为:醋酸钠2mmol/l、甘氨酸2~2.5%、pg蛋白含量20g/l。
[0094]
甘氨酸蛋白含量崩解温度(℃)冻干外观水分2%20-34.5完整饼状1.800%2.50%20-39.7完整饼状1.300%3%20-44.8完整饼状1.400%2%15-49.6完整饼状,表面平整,轻磕会碎/2.50%15-50完整饼状,表面平整,轻磕会碎3.200%3%15低于-60完整饼状,轻微萎缩/2%6低于-65完整饼状,轻微萎缩/2.50%6低于-65蜂窝状,底部微熔/3%6低于-65完整饼状,轻微萎缩/
[0095]
8.2、玻璃化温度测试
[0096]
取盐酸精氨酸组别和甘氨酸组别优化后的最终配方,分别选一组进行玻璃化温度测试,结果如下表所示。
[0097]
玻璃化温度检测用差示扫描量热分析,分析测试制品在降温升温过程中结晶、玻璃化、融化的温度值,初步判断制品中所含物质的种类。
[0098]
[0099][0100]
以上两组进行玻璃化温度测试,根据图形显示(图4)可知,两组保护剂配方下,玻璃化温度差别不大,但盐酸精氨酸组别成分更单一。
[0101]
上述结果冻干工艺优化的结果表明,
[0102]
(1)甘氨酸组在蛋白含量20g/l时冻干结果较为理想;
[0103]
(2)盐酸精氨酸组冻干效果受蛋白浓度的影响相对甘氨酸低。
[0104]
使用本发明优化后的保护剂(配方同玻璃化检测的制剂配方),制备的人纤维蛋白溶酶原冻干制剂复溶后的免疫比浊法检测结果如下表所示:
[0105][0106]
由检测结果可知,本发明制备的人纤维蛋白溶酶原仅含有极微量的白蛋白、igg、iga、igm,其它杂质均低于检测范围。
[0107]
使用本发明优化后的保护剂(精氨酸组),制备的人纤维蛋白溶酶原冻干制剂复溶后的分子大小分布检测结果如图5所示:
[0108]
供试品人纤维蛋白溶酶原经hplc分析,以峰面积归一法计算样品纯度为99.709%。
[0109]
最后需要说明的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。