1.本发明涉及抗病毒药物技术领域,具体地,涉及一种用于治疗或预防病毒性肝炎的药物组合物及其应用。
背景技术:
2.人乙型肝炎病毒(hbv)感染是世界范围内的重要公共健康问题。急性乙肝病毒感染后,仍有8%左右发展为慢性乙型肝炎感染,持续性hbv感染将导致肝硬化,甚至肝癌。乙肝传播途径主要通过垂直传播与水平传播。垂直传播是指母婴传播;水平传播主要通过血液传播。
3.乙型肝炎的治疗也是一个长期的过程,治疗目标就是最大限度地抑制或消除hbv,减轻肝细胞炎症坏死及肝纤维素化,延缓和阻止疾病进展,减少和防止肝脏失代偿、肝硬化、hcc及其并发症的发生,从而改善生活质量和延长存活时间。
4.目前市场上有很多乙型肝炎治疗药物,主要通过使用干扰素或者核苷类似物进行抗病毒治疗。对于干扰素而言,重组dna白细胞干扰素(ifn-α)可抑制hbv的复制。但是干扰素在治疗乙肝时,往往伴随着较强的不良反应,包括骨髓抑制,影响甲状腺功能和抑郁等。
5.核苷类似物主要通过抑制hbv复制过程中的逆转录酶活性从而抑制hbv产生,临床可用药物包括以下类别:拉米夫定、泛昔洛韦、如阿昔洛韦、阿德福韦、恩替卡韦、替诺福韦、膦甲酸钠等,这些药物均有一定抑制hbv效果。
6.这些逆转录酶抑制剂虽然可以有效降低hbv dna水平,使患者控制乙肝病毒水平,但是由于其作用靶点为rna逆转录为dna的过程,对于hbeag和hbsag的清除无直接作用。因此核苷类似物单药治疗发生hbeag和hbsag血清学转化的概率极低,并不能真正治愈乙肝,患者需要长期甚至终身服用药物。
7.上述逆转录酶抑制剂虽然可以使患者控制乙肝病毒水平,但是随之产生的耐药性、巨额的医药费用、药物严重的副作用等问题也不容小觑。关键是,目前仍然没有一种药物能够完全清除病毒达到功能性治愈乙肝。因此,本领域迫切需要提供一种新的治疗乙型肝炎、能够清除hbsag、达到功能性治愈的药物。
8.ns-398(n-(2-cyclohexyloxy-4-nitrophenyl)methane sulfonamide)是一种选择性的cox(环氧化酶)-2抑制剂,选择性cox-2抑制剂是一类新型非甾体抗炎药,因其选择性地抑制cox-2活性,对cox-1影响较小,不良反应较少较轻,目前广泛用于类风湿关节炎和骨关节炎的抗炎、镇痛治疗。
技术实现要素:
9.本发明通过将cox-2抑制剂或其药学上可接受的盐应用于治疗或预防病毒性肝炎而提供了一种新颖的病毒性肝炎治疗选项。
10.在一个方面中,本发明提供了cox-2抑制剂或其药学上可接受的盐在制备用于治疗或预防病毒性肝炎的药物中的用途。
11.在一个优选实施方式中,所述cox-2抑制剂为ns-398。
12.在一个优选实施方式中,所述病毒性肝炎为乙型肝炎。
13.在一个优选实施方式中,所述药物能够降低乙型肝炎病毒(hbv)载量。
14.在一个优选实施方式中,所述药物还包含一种或多种另外的治疗剂或预防剂。
15.在一个优选实施方式中,所述另外的治疗剂或预防剂选自干扰素、peg化的干扰素或者核苷类似物中的至少一种。
16.在一个优选实施方式中,所述核苷类似物选自恩替卡韦、富马酸替诺福韦二吡呋酯和替诺福韦艾拉酚胺。
17.在一个优选实施方式中,所述药物经配制通过选自以下的途径施用:口服、直肠、经鼻、经肺、局部、口腔和舌下、阴道、肠胃外、皮下、肌肉内、静脉内、皮内、鞘内和硬膜外。
18.在一个优选实施方式中,所述药物经配制通过口服施用,优选为片剂或胶囊的形式。
19.在另一个方面中,本发明提供了一种用于治疗或预防病毒性肝炎的药物组合物,其包含治疗有效量的ns-398或其药学上可接受的盐以及任选的一种或多种另外的治疗剂或预防剂,以及药学上可接受的载体。
20.本发明的技术方案具有以下有益效果:
21.1.将ns-398或其药学上可接受的盐应用于治疗或预防病毒性肝炎,从而提供了一种新颖的病毒性肝炎治疗选项。
22.2.ns-398或其药学上可接受的盐具有优异的临床安全性和药代动力学性质,具有较好的成药性。
23.3.ns-398或其药学上可接受的盐能够任选地与一种或多种另外的治疗剂或预防剂进行组合从不同方面清除乙肝病毒,并具有协同增效的可能性。
附图说明:
24.图1:不同浓度的ns-398、0.1nm的恩替卡韦、10μmns-398和0.1nm的恩替卡韦共同作用,对乙型肝炎病毒(hbv)载量的抑制作用。
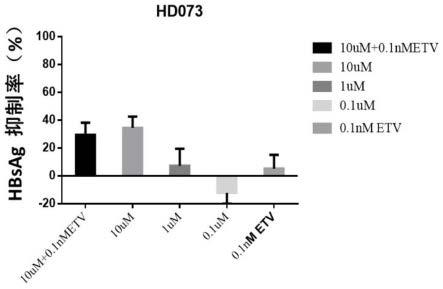
25.图2:不同浓度的ns-398、0.1nm的恩替卡韦、10μmns-398和0.1nm的恩替卡韦共同作用,对hbsag的抑制作用。
26.图3:不同浓度的ns-398、0.1nm的恩替卡韦、10μmns-398和0.1nm的恩替卡韦共同作用,对hbeag的抑制作用。
27.图4:ns-398的细胞毒性检测。
具体实施方式
28.本发明的发明人意外发现了具有乙肝治疗效果的hd073(即ns-398),进一步通过生物学实验的验证,证明其能有效降低乙型肝炎病毒(hbv)。
29.在一个方面中,本发明提供了ns-398、其衍生物或其药学上可接受的盐在制备用于治疗或预防病毒性肝炎的药物中的用途。
30.在一个优选实施方式中,所述ns-398的衍生物包括氘代的ns-398。对于本领域技术人员来说,氘代的化合物不改变化合物原有的性质,但是能够减缓代谢的过程,从而延长
半衰期。能够更加有效地发挥药物的作用。
31.在一个优选实施方式中,所述病毒性肝炎为乙型肝炎。在一个优选实施方式中,所述药物能够降低乙型肝炎病毒(hbv)载量、hbsag和/或hbeag水平。
32.ns-398(n-(2-cyclohexyloxy-4-nitrophenyl)methane sulfonamide)是一种选择性的cox(环氧化酶)-2抑制剂,选择性cox-2抑制剂是一类新型非甾体抗炎药,因其选择性地抑制cox-2活性,对cox-1影响较小,不良反应较少较轻,目前广泛用于类风湿关节炎和骨关节炎的抗炎、镇痛治疗。
33.病毒性肝炎的病原学分型,目前已被公认的有甲、乙、丙、丁、戊五种肝炎病毒,分别写作hav、hbv、hcv、hdv、hev,除乙型肝炎病毒为dna病毒外,其余均为rna病毒。
34.乙型肝炎是由乙型肝炎病毒引起的以肝脏病变为主的一种传染病。临床上以食欲减退、恶心、上腹部不适、肝区痛、乏力为主要表现。部分患者可有黄疸发热和肝大伴有肝功能损害。有些患者可慢性化,甚至发展成肝硬化,少数可发展为肝癌。
35.乙型病毒性肝炎的病原为乙型肝炎病毒,缩写为hbv,乙型肝炎病毒为dna病毒。基因组是双链、环形、不完全闭合dna。病毒最外层是病毒的外膜或称衣膜,其内层为核心部分,核蛋白即是核心抗原(hbcag),不能在血清中检出。hbsag阳性者的血清在电子显微镜下可见3种颗粒,直径为22nm的圆形和丝状颗粒,还有较少的直径为42。的球形颗粒,又称为dane氏颗粒,是完整的hbv颗粒。
36.乙型肝炎的标志检测如下:
①
hbsag与抗-hbs:hbsag阳性示hbv目前处于感染阶段,抗-hbs为免疫保护性抗体阳性示已产生对hbv的免疫力。慢性hbsag携带者的诊断依据为无任何临床症状和体征、肝功能正常,hbsag持续阳性6个月以上者。
②
hbeag与抗-hbe:hbeag阳性为hbv活跃复制及传染性强的指标,被检血清从hbeag阳性转变为抗-hbe阳性表示疾病有缓解感染性减弱。
③
hbcag与抗-hbc:hbcag阳性提示存在完整的hbv颗粒直接反应,hbv活跃复制由于检测方法复杂临床少用。抗-hbc为hbv感染的标志,抗-hbc igm阳性提示处于感染早期,体内有病毒复制。在慢性轻度乙型肝炎和hbsag携带者中hbsag、hbeag和抗-hbc三项均阳性具有高度传染性指标难以阴转。
37.在一个优选实施方式中,所述药物还包含一种或多种另外的治疗剂或预防剂。在一个优选实施方式中,所述另外的治疗剂或预防剂选自干扰素或者核苷类似物。在一个优选实施方式中,所述核苷类似物选自恩替卡韦、富马酸替诺福韦二吡呋酯和替诺福韦艾拉酚胺。
38.另外的治疗剂或预防剂
39.在一些实施方式中,所述另外的治疗剂或预防剂选自恩替卡韦、富马酸替诺福韦二吡呋酯和替诺福韦艾拉酚胺中的一种或多种,例如选自恩替卡韦、富马酸替诺福韦二吡呋酯和替诺福韦艾拉酚胺中的一种或选自恩替卡韦、富马酸替诺福韦二吡呋酯和替诺福韦艾拉酚胺中的至少两种。
40.恩替卡韦(entecavir)的化学名为2-氨基-1,9-二氢-9-[(1s,3r,4s)-4-羟基-3-(羟甲基)-2-亚甲基环戊烷]-6h-嘌呤-6-酮。
[0041]
美国专利us5206244公开了恩替卡韦及其治疗乙肝病毒的用途;wo9809964中公开了新的恩替卡韦合成方法;wo0164421公开了低剂量的恩替卡韦固体制剂。
[0042]
恩替卡韦是一种高效的抗病毒剂,由美国施贵宝公司在20世纪90年代研发,具有
较强的抗hbv作用。它能够通过磷酸化成为具有活性的三磷酸盐,三磷酸盐在细胞内的半衰期为15h。通过与hbv多聚酶的天然底物三磷酸脱氧鸟嘌呤核苷竞争,恩替卡韦三磷酸盐能抑制病毒多聚酶(逆转录酶)的所有三种活性:(1)hbv多聚酶的启动;(2)前基因组mrna逆转录负链的形成;(3)hbv dna正链的合成。
[0043]
富马酸替诺福韦二吡呋酯(英文名:tenofovir disoproxil fumarate,tdf;化学名为(r)-[[2-(6-氨基-9h-嘌呤-9-基)-1-甲基乙氧基]甲基]膦酸二异丙氧羰基甲酯富马酸盐)是替诺福韦的酯类前体,属于新型核苷酸类逆转录酶抑制剂,具有抑制hbv病毒活性。
[0044]
tdf是美国吉利德公司继阿德福韦酯后成功开发的另一个新型开环膦酸核苷类化合物于2001年10月首次在美国上市,目前已经在欧洲、澳大利亚和加拿大等国家上市。
[0045]
tdf在体内可通过竞争性地结合于天然脱氧核糖底物来抑制病毒聚合酶,并通过插入dna中终止dna链的合成。其主要作用机制为口服后水解为替诺福韦,替诺福韦被细胞激酶磷酸化,生成具有药理活性的代谢产物替诺福韦二磷酸,后者与5
’‑
三磷酸脱氧腺苷酸竞争,参与病毒dna的合成,进入病毒dna后,由于缺乏3
’‑
oh基团,导致dna延长受阻,进而阻断病毒的复制。临床应用表明,tdf具有显著的抗hbv病毒疗效,并且毒副作用较小,因而具有较大的临床应用前景。
[0046]
替诺福韦艾拉酚胺(tenofovir alafenamide),是由美国吉利德科学公司开发的一种新核苷类逆转录酶抑制剂(nrti)替诺福韦(tenofovir)的前体药物。与上一代的抗乙肝类似药物替诺福韦二吡呋酯tdf相比,替诺福韦艾拉酚胺的抗病毒活性为其10倍,在血浆中的稳定性为其200倍,半衰期较其提高了225倍。与tdf相比,替诺福韦艾拉酚胺只需要十分之一的tdf给药剂量,即可实现与tdf相同的抗病毒疗效。因此替诺福韦艾拉酚胺用于乙型肝炎病毒(hbv)感染的预防或/和治疗,具有更好的疗效、更高的安全性和更低的耐药性。
[0047]
除了上述活性药物外,本文所述的药物或药物组合物还可任选地包含一种或多种另外的用于治疗hbv的其他药物,其例如但不限于3-双加氧酶(ido)抑制剂,靶向病毒mrna的反义寡核苷酸,载脂蛋白a1调节剂,精氨酸酶抑制剂,b-和t-淋巴细胞减毒剂抑制剂,bruton酪氨酸激酶(btk)抑制剂,ccr2趋化因子拮抗剂,cd137抑制剂,cd160抑制剂,cd305抑制剂,cd4激动剂和调节剂,靶向hbcag的化合物,靶向乙型肝炎核心抗原(hbcag)的化合物,共价闭合环状dna(cccdna)抑制剂,亲环蛋白抑制剂,细胞因子,细胞毒性t淋巴细胞相关蛋白4(ipi4)抑制剂,dna聚合酶抑制剂,核酸内切酶调节剂,表观遗传修饰剂,法尼醇x受体激动剂,基因修饰剂或编辑物,hbsag抑制剂,hbsag分泌或组装抑制剂,hbv抗体,hbv dna聚合酶抑制剂,hbv复制抑制剂,hbv rna酶抑制剂,hbv疫苗,hbv病毒进入抑制剂,hbx抑制剂,乙型肝炎大包膜蛋白调节剂,乙型肝炎大包膜蛋白刺激剂,乙型肝炎结构蛋白调节剂,乙型肝炎表面抗原(hbsag)抑制剂,乙型肝炎表面抗原(hbsag)分泌或组装抑制剂,乙型肝炎病毒e抗原抑制剂,乙型肝炎病毒复制抑制剂,肝炎病毒结构蛋白抑制剂,hiv-1逆转录酶抑制剂,透明质酸酶抑制剂,iap抑制剂,il-2激动剂,il-7激动剂,免疫球蛋白激动剂,免疫球蛋白g调节剂,免疫调节剂,吲哚胺-2,核糖核苷酸还原酶抑制剂,干扰素激动剂,干扰素α1配体,干扰素α2配体,干扰素α5配体调节剂,干扰素α配体,干扰素α配体调节剂,干扰素α受体配体,干扰素β配体,干扰素配体,干扰素受体调节剂,白介素-2配体,ipi4抑制剂,赖氨酸脱甲酶抑制剂,组蛋白脱甲酶抑制剂,kdm5抑制剂,kdm1抑制剂,杀伤细胞凝集素样受体亚家族g成员1抑制剂,淋巴细胞活化基因3抑制剂,淋巴毒素β受体激活剂,微rna(mirna)基因
治疗剂,axl调节剂,b7-h3调节剂,b7-h4调节剂,cd160调节剂,cd161调节剂,cd27调节剂,cd47调节剂,cd70调节剂,gitr调节剂,hevem调节剂,icos调节剂,mer调节剂,nkg2a调节剂,nkg2d调节剂,ox40调节剂,sirpα调节剂,tigit调节剂,tim-4调节剂,tyro调节剂,na -牛磺酸盐协同转运多肽(ntcp)抑制剂,天然杀伤细胞受体2b4抑制剂,nod2基因刺激剂,核蛋白抑制剂,核蛋白调节剂,pd-1抑制剂,pd-l1抑制剂,peg-干扰素λ,肽基脯氨酰异构酶抑制剂,磷脂酰肌醇-3激酶(pi3k)抑制剂,重组清道夫受体a(sra)蛋白,重组胸腺素α-1,维甲酸诱导基因1刺激物,逆转录酶抑制剂,核糖核酸酶抑制剂,rna dna聚合酶抑制剂,短干扰rna(sirna),短合成发夹rna(sshrna)),slc10a1基因抑制剂,smac模拟物,src酪氨酸激酶抑制剂,干扰素基因刺激物(sting)激动剂,nod1刺激物,t细胞表面糖蛋白cd28抑制剂,t细胞表面糖蛋白cd8调节剂,胸腺素激动剂,胸腺素α1配体,tim-3抑制剂,tlr-3激动剂,tlr-7激动剂,tlr-9激动剂,tlr9基因刺激剂,toll样受体(tlr)调节剂,病毒核糖核苷酸还原酶抑制剂,锌指核酸酶或合成核酸酶(talen)及其组合。
[0048]
如本文中所使用,“治疗有效量”或“有效量”是指在剂量下有效并且持续所需时间周期以实现期望的治疗结果的量。乙肝治疗剂的治疗有效量将取决于障碍或症状的性质并取决于特定的试剂,且可以通过本领域技术人员已知的标准临床技术确定。
[0049]
治疗结果可以是,如,减轻症状、延长存活、提高移动性等。治疗结果不需要是“治愈”。治疗结果也可以是预防性的。
[0050]
在一个优选实施方式中,所述药物经配制通过选自以下的途径施用:口服、直肠、经鼻、经肺、局部、口腔和舌下、阴道、肠胃外、皮下、肌肉内、静脉内、皮内、鞘内和硬膜外。
[0051]
在一个优选实施方式中,所述药物经配制通过口服施用,优选为片剂或胶囊的形式。
[0052]
给药途径
[0053]
本公开的药物或药物组合物通过适合于待治疗病症的任何途径施用。合适的途径包括口服、直肠、鼻、肺、局部(包括口腔和舌下)、阴道和肠胃外(包括皮下、肌肉内、静脉内、皮内、鞘内和硬膜外)等。在某些实施方式中,本文公开的药物或药物组合物通过静脉内注射施用。将会理解,优选途径可根据例如接受者的状况而变化。本公开药物或药物组合物的一个优点在于,它们是口服生物可利用的并且可以口服施用。
[0054]
药物组合物
[0055]
在某些实施方式中,在药物组合物中施用ns-398药物、其衍生物或其药学上可接受的盐。本公开的药物组合物可以用常规载体和赋形剂(其将根据通常的实践选择)配制。片剂将含有赋形剂、助流剂、填充剂、粘合剂等。水性制剂以无菌形式制备,并且当用于通过非口服施用递送时,通常是等渗的。所有制剂将任选地含有赋形剂,例如“handbook of pharmaceutical excipients”(1986)中所述的赋形剂。赋形剂包括抗坏血酸和其它抗氧化剂,螯合剂如edta,碳水化合物如葡聚糖,羟基烷基纤维素,羟基烷基甲基纤维素,硬脂酸等。制剂的ph范围为约3至约11,但通常为约7至10。在一些实施方式中,制剂的ph范围为约2至约5,但通常为约3至4。
[0056]
制剂包括适用于前述施用途径的制剂。制剂可以方便地以单位剂型存在,并且可以通过药学领域熟知的任何方法制备。技术和制剂通常在remington’s pharmaceutical sciences(mack publishing co.,easton,pa)中找到。这样的方法包括使活性成分与由一
种或多种辅助成分构成的载体结合的步骤。通常,通过将活性成分与液体载体或细分的固体载体或两者均匀地和紧密地结合在一起,然后根据需要使产品成形,来制备制剂。
[0057]
适用于口服施用的本发明的制剂可以作为以下形式存在:各自含有预定量活性成分的离散单元,如胶囊剂或片剂;粉末或颗粒;水性或非水性液体中的溶液或悬浮液;或者水包油液体乳剂或油包水液体乳剂。
[0058]
片剂通过任选地与一种或多种辅助成分一起压制或模制而制成。压制片剂可以通过以下来制备:在合适的机器中压制自由流动形式如粉末或颗粒的活性成分,其任选地与粘合剂、润滑剂、惰性稀释剂、防腐剂、表面活性剂或分散剂混合。模制片剂可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉末状活性成分的混合物来制备。片剂可任选地包衣或刻痕,并任选地配制,以便自其提供活性成分的缓释或控释。
[0059]
用于口服使用的制剂也可以呈现为硬明胶胶囊,其中活性成分与惰性固体稀释剂例如磷酸钙或高岭土混合,或呈现为软明胶胶囊,其中活性成分与水或油介质例如花生油、液体石蜡或橄榄油混合。
[0060]
本公开的药物组合物也可以是无菌可注射制剂的形式,例如无菌可注射水性或油性悬浮液。该悬浮液可以根据已知技术使用上面提到的那些合适的分散剂或润湿剂和悬浮剂配制。无菌可注射制剂还可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如在1,3-丁二醇中的溶液,或制备成冻干粉末。可以使用的可接受的载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。另外,无菌固定油通常可用作溶剂或悬浮介质。为此目的,可以使用任何温和的固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸如油酸同样可用于制备注射剂。可以使用的可接受的载体和溶剂包括水、林格氏溶液、等渗氯化钠溶液和高渗氯化钠溶液。
[0061]
在查阅了下面的实施例之后,本发明的另外的目的、优势和新特征对本领域普通技术人员将变得显而易见。
[0062]
实施例
[0063]
实施例1-应用hepg2-ntcp细胞评价受试化合物ns-398(hd073)的体外抗hbv活性
[0064]
化合物配制方法如下:
[0065]
以配制20mm浓度为例,溶剂dmso的体积(μl)=样品质量(mg)
×
纯度
÷
分子量
÷
20
×
106[0066]
对照化合物包括etv(批号:p1214012;99.0%纯度),购自上海泰坦科技股份有限公司;和hbv dna。批号:et25747-14-p1;99.5%纯度),获自上海药明康德新药开发有限公司。以上对照化合物的母液浓度均为20mm,并在-20℃下保存。
[0067]
表1:主要试剂和细胞病毒
[0068][0069]
实验方案
[0070]
铺细胞和化合物处理
[0071]
hepg2-ntcp铺板
[0072]
第0天,hepg2-ntcp细胞接种到48孔细胞板中(7.5
×
104细胞/孔)。
[0073]
感染病毒和化合物处理
[0074]
第2天,先加入化合物预处理细胞2小时,然后加入d型hbv感染hepg2-ntcp细胞(感染同时加入化合物)。受试化合物设置3个单药浓度和1个联合用药浓度,ns-398、氘代ns-398药物的三个单药浓度分别为1、10和20μm,联合用药的浓度为ns-398 20μm etv 0.1nm;对照化合物为etv,同时设置仅含dmso不含化合物的孔以及etv单药浓度0.1nm,2复孔测试。化合物浓度见表2。
[0075]
第3天、第5天和第7天更换一次含化合物的培养液。第9天,收集细胞上清用于检测hbv dna(qpcr)、hbeag和hbsag(elisa)。待收集细胞上清后,加入celltiter-glo检测细胞活力,实验具体流程见表3。
[0076]
表2:化合物浓度
[0077][0078]
表3:实验流程
[0079][0080]
样品检测
[0081]
1)qpcr法检测细胞培养上清中hbv dna的含量
[0082]
参照qiaamp 96dna blood kit说明书,提取细胞培养上清中的dna。样品体积为120μl,dna洗脱体积为120μl上清。qpcr检测hbv dna的含量。
[0083]
如表4所示,配制qpcr反应混合液。
[0084]
表4.qpcr反应成份表
[0085]
pcr反应液成分1个反应体系所需体积faststart universal probe master(2
×
)5μl正向引物(10μm)0.4μl反向引物(10μm)0.4μl探针(10μm)0.2μlae2μl
[0086]
将qpcr反应混合液加入到384孔反应板中,再加入2μl样品或标准品到相应的孔中,每个反应孔总体积为10μl。pcr反应:95℃,10分钟;95℃,15秒,60℃,1分钟,40个循环。
[0087]
2)elisa法检测细胞培养上清中hbsag和hbeag的含量
[0088]
方法参照试剂盒说明书,方法简述如下:分别取50μl的标准品,样品和对照品加入到检测板中,然后每孔加入50μl酶结合物,37℃孵育60分钟,用洗液洗板后吸干,然后加入50μl预混发光底物,室温避光孵育10分钟,最后酶标仪测定发光值。
[0089]
3)细胞活力检测
[0090]
待收集完上清后,将等体积的培养基和celltiter-glo混匀后,每孔加入50μl到细胞板,室温避光震荡10分钟后测试发光值。
[0091]
4)数据计算
[0092]
hbv dna抑制率(%)=(1-化合物组样品的hbv dna拷贝数/dmso组的hbv dna拷贝数)
×
100
[0093]
hbsag抑制率(%)=(1-样品的hbsag值/dmso对照组hbsag值)
×
100
[0094]
hbeag抑制率(%)=(1-样品的hbeag值/dmso对照组hbeag值)
×
100
[0095]
细胞毒性%=100-[(样品发光值-培养基对照发光值)/(dmso对照发光值-培养基对照发光值)]
×
100%
[0096]
数据分析
[0097]
如图1-3所示,ns-398药物组对hbeag有轻微的抑制作用,对hbsag、hbv dna的抑制作用较为明显,其中10μm的ns-398对hbv的抑制效果最好。而ns-398和etv一起作用,能够轻微提高对hbv dna的抑制作用,显示了联合用药的可能性。
[0098]
如图4所示,ns-398几乎没有细胞毒性,为潜在的临床应用提供了可靠的安全性。
[0099]
本发明提供了一种新的可以抑制hbv的化合物,为乙肝的治疗提供一种新的方案。
[0100]
虽然已参照特定实施方式对本发明进行了说明,但本领域技术人员应认识到的是,在不偏离本发明主旨和范围的情况下,可对所述实施方案进行改变或改进,本发明范围通过所附权利要求书限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。