1.本发明属于生物医药领域,具体地,涉及双特异性抗体及其应用,更具体地,涉及重组抗体、核酸分子、表达载体、重组细胞、组合物、所述重组抗体或抗原结合片段或核酸分子或表达载体或重组细胞或组合物在制备药物中的用途、药物、所述重组抗体在制备试剂盒中的用途和试剂盒。
背景技术:
2.癌症是一种严重威胁人民群众的生命健康的疾病,近年来全球癌症的发生率、死亡率不断上升。目前已有的癌症治疗手段,包括手术切除、放疗、化疗、小分子靶向治疗、抗体靶向治疗、大分子免疫治疗等治疗方法,但上述方法仅在部分癌症患者中发挥有限的作用,癌症仍是困扰人类生命健康的难题。
3.急性髓系细胞白血病是髓系前体细胞不受控增殖造成的癌症。急髓发病率与年龄正相关,其中60-70岁人群发病率最高。急髓的标准疗法为化疗后进行骨髓移植,但是由于高龄患者无法耐受化疗带来的副作用,因此60岁以上患者的五年生产率只有10%。由于急髓患者肿瘤细胞的基因突变具有异质性,小分子靶向药只能适用于含有相应基因突变的少数患者,严重限制了该类药物的适用性。
4.cd33是种i型跨膜蛋白,其表达在髓系细胞、急髓患者的髓系前体细胞(肿瘤细胞)表面,但不表达在正常干细胞表面,因而靶向cd33的疗法是一种潜在的急髓患者通用的疗法。例如,mylotarg是一款抗体偶联药物,由靶向cd33的单克隆抗体和与之连接的细胞毒素卡其霉素组成,本质上是利用抗体靶向肿瘤细胞递送化疗药物。临床上发现该药物会引发严重不良反应包括肝毒性(包括静脉闭塞性疾病)、输注相关反应(包括过敏反应)和出血等。
5.因此,仍需进一步开发低免疫原性、低毒性以及强亲和力的双特异性抗体。
技术实现要素:
6.本技术是基于发明人对以下事实和问题的发现和认识作出的:
7.cd33是种i型跨膜蛋白,其表达在髓系细胞、急髓患者的髓系前体细胞(肿瘤细胞)表面,但不表达在正常干细胞表面,因而靶向cd33的疗法是一种潜在用于髓系细胞白血病的的疗法。
8.cd27抗体单链可变片段(scfv)能够结合t细胞,发明人设计了靶向cd27和cd33的双特异抗体,经过大量实验筛选后,获得了优势双特异性抗体cd27
×
cd33,该双特异抗体能够同时与cd33阳性肿瘤细胞以及t细胞进行结合,有效介导t细胞对肿瘤细胞的杀伤,具有较强的抗癌能力。
9.因此,在本发明的第一方面,本发明提出了一种重组抗体。根据本发明的实施例,包括:第一抗原结合区,所述第一抗原结合区具有cd27分子结合活性;和第二抗原结合区,所述第二抗原结合区具有cd33分子结合活性。根据本发明实施例的重组抗体可以同时与
cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
10.在本发明的第二方面,本发明提出了一种核酸分子。根据本发明的实施例,所述核酸分子编码第一方面所述的重组抗体。根据本发明实施例的核酸编码的重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
11.在本发明的第三方面,本发明提出了一种表达载体。根据本发明的实施例,携带第二方面所述的核酸分子。所述表达载体可包括可选的控制序列,所述控制序列与所述核酸分子进行可操作地连接。其中,所述控制序列为可指导所述核酸分子在宿主中表达的一个或多个控制序列。本发明实施例所提出的表达载体可在适合的宿主细胞中高效表达所述重组抗体,所述重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
12.在本发明的第四方面,本发明提出了一种制备第一方面所述的重组抗体的方法。根据本发明的实施例,包括:将第三方面所述的表达载体引入到细胞中;将所述细胞在适于蛋白表达和分泌的条件下进行培养,以便获得所述重组抗体。根据本发明实施例所提出的方法可以有效获得所述重组抗体,所述重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
13.在本发明的第五方面,本发明提出了一种重组细胞。根据本发明的实施例,所述重组细胞携带第二方面所述的核酸,或第三方面所述的表达载体,或能够表达第一方面所述的重组抗体。所述重组细胞是通过转染或者转化所述表达载体获得的。根据本发明的一些具体实施例,所述重组细胞在合适条件下可高效并大量表达上述重组抗体,所述重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
14.在本发明的第六方面,本发明提出了一种组合物。根据本发明的实施例,包括:第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体或第五方面所述的重组细胞。如前所述,本发明实施例的重组抗体可以有效与cd27和cd33蛋白分子结合,有效介导t细胞对肿瘤细胞的杀伤作用,包含所述重组抗体或能够表达所述重组抗体的核酸分子、表达载体或重组细胞的组合物,如食品组合物、药物组合物等,同样具有显著的治疗或预防肿瘤的作用。
15.在本发明的第七方面,本发明提出了第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体、第五方面所述的重组细胞或第六方面所述的组合物在制备药物中的用途,所述药物用于治疗或者预防髓系细胞白血病和cd33阳性癌症。如前所述,本发明实施例的重组抗体可以有效与cd27和cd33蛋白分子结合,有效介导t细胞对肿瘤细胞的杀伤作用,包含所述重组抗体的一系列物质的药物同样具有显著的治疗或预防髓系细胞白血病和cd33阳性癌症癌症的作用。
16.在本发明的第八方面,本发明提出了一种药物。根据本发明的实施例,所述药物包括:第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体、第五方面所述的重组细胞或第六方面所述的组合物。根据本发明的实施例,所述药物用于治疗癌症。如前所述,本发明实施例的重组抗体可以有效与免疫细胞表面的cd27和肿瘤细胞表面的cd33蛋白分子结合,有效介导t细胞对肿瘤细胞的杀伤作用,因此,包含所述重组抗体
或能够表达所述重组抗体的一系列物质的药物同样具有显著的治疗或预防癌症的作用。
17.在本发明的第九方面,本发明提出了前面所述的重组抗体、核酸分子、表达载体或重组细胞在制备试剂盒中的用途,所述试剂盒用于检测cd27和/或cd33。所述重组抗体可与cd27和/或cd33蛋白进行结合,在合适条件下,所述核酸分子、表达载体或重组细胞均能够表达所述重组抗体,能够以其制备试剂盒,因此,包含所述重组抗体或能够表达所述重组抗体的核酸分子、表达载体或重组细胞的试剂盒可用于有效检测cd27和/或cd33。所述试剂盒可用于科学研究,如定性或定量检测生物样本中的cd27和/或cd33蛋白。
18.在本发明的第十方面,本发明提出了一种试剂盒。根据本发明的实施例,所述试剂盒包含前面所述的重组抗体。根据本发明实施例提供的所述重组抗体可与cd27和/或cd33蛋白进行结合,在合适条件下,所述核酸分子、表达载体或重组细胞均能够表达所述重组抗体,能够以其制备试剂盒,因此,包含所述重组抗体或能够表达所述重组抗体的核酸分子、表达载体或重组细胞的试剂盒可用于有效检测cd27和/或cd33。所述试剂盒可用于科学研究,如定性或定量检测生物样本中的cd27和/或cd33蛋白,也可以用于对个体状态进行判断,如获得所述个体的cd33水平后,判断其cd33水平是否过高于或低于正常水平。
19.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
20.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
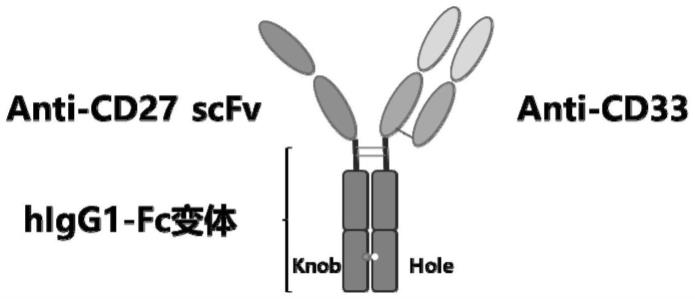
21.图1是根据本发明实施例的cd27
×
cd33重组双特异抗体的结构示意图,其中,并未给出连接肽的连接位置,重组双特异性抗体的第一重链恒定区(左侧)和第二重链恒定区(右侧)通过knob-into-hole结构进行连接;
22.图2是根据本发明实施例的cd27
×
cd33重组双特异抗体与cho-k1-cd27细胞结合能力的检测结果图;
23.图3是根据本发明实施例的cd27
×
cd33重组双特异抗体与人外周血cd8 t细胞结合能力的检测结果图;
24.图4是根据本发明实施例的cd27
×
cd33重组双特异抗体与cho-k1-cd33细胞结合能力的检测结果图;
25.图5是根据本发明实施例的cd27
×
cd33重组双特异抗体与人急性髓系细胞白血病hl-60肿瘤细胞结合能力的检测结果图;
26.图6是根据本发明实施例的cd27
×
cd33重组双特异抗体活化jurkat-nfat-lucia-cd27报告细胞的检测结果图;
27.图7是根据本发明实施例的cd27
×
cd33重组双特异抗体促进pbmc杀伤a375-cd33肿瘤细胞的检测结果图。
具体实施方式
28.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
29.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本发明的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
30.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
31.为了更容易理解本发明,以下具体定义了某些技术和科学术语。除显而易见在本文件中的它处另有明确定义,否则本文中使用的所有其它技术和科学术语都具有本发明所属领域的一般技术人员通常理解的含义。氨基酸残基的缩写是本领域中所用的指代20个常用l-氨基酸之一的标准3字母和/或1字母代码。
32.本文中,“双特异抗体”是指由可特异性识别不同蛋白分子的肽链分别与重链恒定区和/或轻链恒定区的肽链进行连接而获得的,其中,所述重链恒定区的两条链通过knob into hole结构进行连接。
33.本文中“knob into hole结构”为在抗体重链恒定区的ch3区形成钮(knob)扣(hole)突变,便于重链咬合,形成异二聚体,例如,本技术中,通过突变人igg1重链恒定区ch3结构域中氨基酸(一条链中为t366s、l368a、y407v、y349c突变,即“hole”;另一链中为t366w、s354c突变,即“knob”)实现。
34.本文中“可操作地连接”是指将外源基因连接到载体上,使得载体内的控制元件,例如转录控制序列和翻译控制序列等等,能够发挥其预期的调节外源基因的转录和翻译的功能。
35.在本发明的第一方面,本发明提出了一种重组抗体,包括:第一抗原结合区,所述第一抗原结合区具有cd27分子结合活性;和第二抗原结合区,所述第二抗原结合区具有cd33分子结合活性。根据本发明实施例的重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
36.根据本发明的一些具体实施例,上述重组抗体还可进一步包括下列附加技术特征中的至少之一:
37.根据本发明的一些具体实施例,所述第一抗原结合区包括cd27单链抗体,所述cd27单链抗体包括cd27抗体重链可变区和cd27抗体轻链可变区,所述cd27抗体重链可变区的c端与所述cd27抗体轻链可变区的n端相连;或所述cd27抗体轻链可变区的c端与所述cd27抗体重链可变区的n端相连。
38.根据本发明的一些具体实施例,所述cd27抗体重链可变区包括:seq id no:1-3任一项所示的重链cdr。
39.根据本发明的一些具体实施例,所述cd27抗体轻链可变区包括:seq id no:4-6任一项所示的轻链cdr。
40.根据本发明的一些具体实施例,所述cd27抗体重链可变区包括分别如seq id no:1、seq id no:2、seq id no:3所示的cdr1、cdr2、cdr3序列。
41.gftfssyd(seq id no:1)。
42.iwydgsnk(seq id no:2)。
43.argsgnwgffdy(seq id no:3)。
44.根据本发明的一些具体实施例,所述cd27抗体重链可变区包括分别如seq id no:1、seq id no:2、seq id no:3所示的cdr1、cdr2、cdr3序列;
45.根据本发明的一些具体实施例,所述cd27抗体轻链可变区包括分别如seq id no:4、seq id no:5、seq id no:6所示的cdr1、cdr2、cdr3序列;
46.qgisrw(seq id no:4)。
47.aas(seq id no:5)。
48.qqyntyprt(seq id no:6)。
49.根据本发明的一些具体实施例,所述cd27抗体重链可变区包括:seq id no:30所示的氨基酸序列
50.evqlvqsgaevkkpgssvkvsckasgytitdsnihwvrqapgqslewigyiypynggtdynqkfknratltvdnptntaymelsslrsedtafyycvngnpwlaywgqgtlvtvss(seq id no:30)。
51.根据本发明的一些具体实施例,所述cd27抗体轻链可变区包括:seq id no:31所示的氨基酸序列
52.diqltqspstlsasvgdrvtitcrasesldnygirfltwfqqkpgkapkllmyaasnqgsgvpsrfsgsgsgteftltisslqpddfatyycqqtkevpwsfgqgtkvevk(seq id no:31)。
53.根据本发明的一些具体实施例,所述cd27单链抗体进一步包括连接肽1,其中,所述连接肽1的n端与所述cd27抗体重链可变区的c端相连,所述连接肽1的c端与所述cd27抗体轻链可变区的n端相连;或所述连接肽1的n端与所述cd27抗体轻链可变区的c端相连,所述连接肽1的c端与所述cd27抗体重链可变区的n端相连。
54.根据本发明的一些具体实施例,所述连接肽1包括seq id no:16所示的氨基酸序列。
55.ggggsggggsggggs(seq id no:16)。
56.根据本发明的一些具体实施例,所述cd27单链抗体包括seq id no:13所示的氨基酸序列。
57.qvqlvesgggvvqpgrslrlscaasgftfssydmhwvrqapgkglewvaviwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycargsgnwgffdywgqgtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqgisrwlawyqqkpekapksliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqyntyprtfgqgtkveik(seq id no:13)。
58.根据本发明的一些具体实施例,所述第一抗原结合区进一步包括第一重链恒定区,其中,所述cd27单链抗体的c端与所述第一重链恒定区的n端相连。
59.根据本发明的一些具体实施例,所述第一重链恒定区包括第一铰链区和第一fc肽段。
60.根据本发明的一些具体实施例,所述第一fc肽段包括第一ch2区和第一ch3区,所述第一ch2区的c端与所述第一ch3区的n端相连。
61.根据本发明的一些具体实施例,所述第一铰链区的c端与所述第一fc肽段的n端相连。
62.根据本发明的一些具体实施例,所述第一铰链区为人源、灵长目源或鼠源野生型
igg1的铰链区片段。
63.根据本发明的一些具体实施例,所述第一ch2区为人源、灵长目源或鼠源野生型igg1的ch2区片段。
64.根据本发明的一些具体实施例,所述第一ch3区相比于人源野生型igg1的ch3区片段,具有t366w和/或s354c突变。
65.所述人源野生型igg1(l234a/l235a)抗体的氨基酸序列为:
66.pkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:33)。
67.根据本发明的一些具体实施例,所述第一抗原结合区进一步包括连接肽2,所述连接肽2的n端与所述cd27单链抗体的c端相连,所述连接肽2的c端与所述第一重链恒定区的n端相连。
68.根据本发明的一些具体实施例,所述连接肽2包括seq id no:17所示的氨基酸序列。
69.ggggs(seq id no:17)。
70.根据本发明的一些具体实施例,所述第一重链恒定区包括seq id no:18所示的氨基酸序列。
71.pkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:18)。
72.根据本发明的一些具体实施例,第二抗原结合区包括第一肽链和第二肽链,所述第一肽链包括:cd33抗体重链可变区。
73.根据本发明的一些具体实施例,所述cd33抗体重链可变区包括:seq id no:7-9任一项所示的重链cdr。
74.根据本发明的一些具体实施例,所述cd27抗体重链可变区包括分别如seq id no:7、seq id no:8、seq id no:9所示的cdr1、cdr2、cdr3序列。
75.gytitdsn(seq id no:7)。
76.iypynggt(seq id no:8)。
77.vngnpwlay(seq id no:9)。
78.根据本发明的一些具体实施例,所述cd33抗体重链可变区包括:seq id no:14所示的氨基酸序列。
79.evqlvqsgaevkkpgssvkvsckasgytitdsnihwvrqapgqslewigyiypynggtdynqkfknratltvdnptntaymelsslrsedtafyycvngnpwlaywgqgtlvtvss(seq id no:14)。
80.根据本发明的一些具体实施例,所述第一肽链进一步包括第二重链恒定区,其中,所述cd33抗体重链可变区的c端与所述第二重链恒定区的n端相连。
81.根据本发明的一些具体实施例,所述第二重链恒定区包括:ch1区、第二铰链区和第二fc肽段。
82.根据本发明的一些具体实施例,所述ch1区的c端与所述第二铰链区的n端相连,所述第二铰链区的c端与所述第二fc肽段的n端相连。
83.根据本发明的一些具体实施例,所述第二fc肽段包括:第二ch2和第二ch3区,其中,所述第二ch2区的c端与所述第二ch3区的n端相连。
84.根据本发明的一些具体实施例,所述ch1区为人源、灵长目源或鼠源野生型igg1的ch1区。
85.根据本发明的一些具体实施例,所述第二铰链区为人源、灵长目源或鼠源野生型igg1的铰链区片段。
86.根据本发明的一些具体实施例,所述第二ch2区为人源、灵长目源或鼠源野生型igg1的ch2区片段。
87.根据本发明的一些具体实施例,所述第二ch3区为人源、灵长目源或鼠源野生型igg1的ch3区片段。
88.根据本发明的一些具体实施例,所述第二ch3区相比于人源野生型igg1的ch3区片段,具有t366s、l368a、y407v、y349c突变中的至少之一。
89.根据本发明的一些具体实施例,所述第二重链恒定区包括seq id no:19所示的氨基酸序列。
90.astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:19)。
91.根据本发明的一些具体实施例,所述第二肽链包括:cd33抗体轻链可变区。
92.根据本发明的一些具体实施例,所述cd33抗体轻链可变区包括:seq id no:10-12任一项所示的重链cdr。
93.根据本发明的一些具体实施例,所述cd33抗体轻链可变区包括分别如seq id no:10、seq id no:11、seq id no:12所示的cdr1、cdr2、cdr3序列。
94.esldnygir(seq id no:10)。
95.aas(seq id no:11)。
96.qqtkevpws(seq id no:12)。
97.根据本发明的一些具体实施例,所述cd33抗体轻链可变区包括:seq id no:15所示的氨基酸序列,或与seq id no15所示的氨基酸序列。
98.diqltqspstlsasvgdrvtitcrasesldnygirfltwfqqkpgkapkllmyaasnqgsgvpsrfsgsgsgteftltisslqpddfatyycqqtkevpwsfgqgtkvevk(seq id no:15)。
99.根据本发明的一些具体实施例,所述第二肽链进一步包括轻链恒定区,其中,所述cd33抗体轻链可变区的c端与所述轻链恒定区的n端相连。
100.根据本发明的一些具体实施例,所述轻链恒定区为人源、灵长目源或鼠源野生型轻链恒定区。
101.根据本发明的一些具体实施例,所述抗体轻链恒定区为人源的kappa轻链恒定区。
102.根据本发明的一些具体实施例,所述轻链恒定区为人源野生型igg1的轻链恒定
区。
103.根据本发明的一些具体实施例,所述轻链恒定区包括seq id no:32所示的氨基酸序列。
104.rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:32)。
105.根据本发明的一些具体实施例,所述第一抗原结合区和第二抗原结合区通过knob-into-hole结构进行连接。
106.根据本发明的一些具体实施例,所述knob-into-hole结构是由所述第一ch3区的t366w和/或s354c突变和所述第二ch3区的t366s、l368a、y407v、y349c至少之一的突变形成的。
107.根据本发明的一些具体实施例,所述第一肽链与所述第二肽链通过键间二硫键连接。
108.根据本发明的一些具体实施例,所述重组抗体包括seq id no:20-22所示的氨基酸序列。
109.第一抗原结合区包括如下氨基酸序列:
110.qvqlvesgggvvqpgrslrlscaasgftfssydmhwvrqapgkglewvaviwydgsnkyyadsvkgrftisrdnskntlylqmnslraedtavyycargsgnwgffdywgqgtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqgisrwlawyqqkpekapksliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqyntyprtfgqgtkveikggggspkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppcreemtknqvslwclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:20)。
111.第二抗原结合区-第一肽链具有如下所示的氨基酸序列:
112.evqlvqsgaevkkpgssvkvsckasgytitdsnihwvrqapgqslewigyiypynggtdynqkfknratltvdnptntaymelsslrsedtafyycvngnpwlaywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvctlppsreemtknqvslscavkgfypsdiavewesngqpennykttppvldsdgsfflvskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:21)。
113.第二抗原结合区-第二肽链具有如下所示的氨基酸序列:
114.diqltqspstlsasvgdrvtitcrasesldnygirfltwfqqkpgkapkllmyaasnqgsgvpsrfsgsgsgteftltisslqpddfatyycqqtkevpwsfgqgtkvevkrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:22)。
115.在本发明的第二方面,本发明提出了一种核酸分子,所述核酸分子编码第一方面所述的重组抗体。根据本发明实施例的核酸分子编码的重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
116.根据本发明的一些具体实施例,所述核酸具有seq id no:23,seq id no:24,和
seq id no:25所示的核苷酸序列。
117.编码第一抗原结合区的核酸分子包括如下核苷酸序列:
118.caagtgcaattggttgaatctggcggaggcgttgttcagccaggaaggtcccttcgtttgagttgtgctgcttccggtttcacttttagttcttatgatatgcactgggtcaggcaggctcctggaaagggactggaatgggtggcagtgatctggtatgatggatctaacaaatattatgccgattccgtcaaggggagatttaccatcagtagggataattccaagaataccctgtatctgcagatgaacagcctgagagccgaagacactgcagtgtattattgcgctcgcggtagcgggaactggggtttctttgactactgggggcagggtactctggtgaccgtctctagtggaggaggtggctcaggaggaggtggatctggtggcggtggttccgatattcagatgactcaaagtccatcctccttgtctgcttccgtgggtgaccgggttaccataacctgccgggcaagtcaggggatttctagatggttggcttggtaccagcagaagcctgagaaggcccctaaatccttgatatacgccgcttcttccttgcaaagcggagtcccttcccggttttctgggtccggttccggcaccgactttaccctgaccattagctccctgcagcctgaggacttcgcaacctattattgccaacagtacaacacataccctagaactttcggacaaggcaccaaggtcgagatcaaggggggaggaggatcccctaagagttgcgataagacacatacatgtcctccatgccctgcccctgaagctgctggaggaccatccgtcttcctttttccccccaagccaaaggatactttgatgatcagtcgtactcccgaggtgacttgtgtcgtcgtcgatgtcagccacgaggatccagaggttaagttcaattggtatgtggacggcgtggaggtacataatgccaagaccaagcctcgggaggaacagtacaactctacttatcgggtggtgtctgtgcttaccgtgttgcatcaagactggctgaacggcaaggagtacaaatgtaaagtcagcaataaagctctgccagcacccatcgaaaagaccatttccaaggctaaaggccagccacgagagccccaagtgtacacactgccaccatgtagggaggaaatgaccaagaatcaggtgtctctctggtgtttggtgaagggcttttacccttccgacatcgctgtcgagtgggaaagtaatggccaaccagagaacaactacaaaacaacccctccagtgctcgactccgatggatccttcttcctgtattcaaaactgacagtggataagtcacggtggcagcagggtaatgtcttctcctgcagtgttatgcatgaggccctgcacaaccactatacccaaaaaagtctgtccctgagccctggtaag(seq id no:23)。
119.编码第二抗原结合区-第一肽链的核酸分子包括如下核苷酸序列:
120.gaagtccaactggtacagagtggcgctgaagtgaagaaacccggatcttctgtcaaggtgtcctgcaaggcatccggatacaccatcactgactccaacattcattgggtgagacaagcaccaggccagtctctcgagtggatcggctacatatacccctacaacggaggtacagactacaaccagaagttcaagaatagggccacactgacagtggacaaccctactaacactgcttatatggagctgtccagtctgcgtagcgaggataccgccttttactattgtgtgaatggcaatccttggcttgcctactggggccagggaaccttggtaaccgtgagctccgcaagtaccaagggtccctccgtctttccattggccccatcttctaagtcaacatcaggcggtactgcagcactcgggtgtctggtgaaggactactttccagagcctgtcacagtcagctggaacagcggtgctctgacaagtggggtacacactttcccagctgtgcttcagagttccgggctctattcactgagcagtgtggtgactgtccccagcagtagcctgggtactcagacctacatctgtaacgtgaatcataaaccttcaaacacaaaggtcgataagaaggttgaaccaaagagctgcgacaaaactcacacttgtcctccatgtcccgcaccagaagctgctggtggaccctcagtctttctgtttccccccaaacccaaagataccctgatgatttccaggacccctgaggtaacctgcgtggtggtggacgtttctcacgaagaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcataacgccaagaccaagcctcgcgaagagcaatataactccacatacagagtggtgagcgttttgaccgtgttgcaccaggactggctcaacgggaaggagtacaaatgtaaagtttcaaataaagccttgcctgctccaatcgagaaaaccatctccaaggccaaaggccaaccccgagaaccacaggtgtgcaccttgcctcccagtcgagaggaaatgacaaagaatcaggtgtctttgagctgtgctgtgaaaggcttctatccatccgacatcgcagtggagtgggaaagtaacggtcagccagagaacaattataagaccaccccacccgtgttggattctgacggctcttt
tttcctggttagcaaattgactgtggacaagtcccgctggcagcaggggaacgtgttttcttgtagtgtcatgcatgaagctctgcataatcactatactcagaagagcctgagcctgtctccagggaag(seq id no:24)。
121.编码第二抗原结合区-第一肽链的基因具有如下所示的核苷酸序列:
122.gacattcagctgactcagagcccttccacactgagtgcttctgttggcgacagggtgaccataacttgccgagcttccgagtccttggataactacggcattaggtttctcacttggtttcaacagaagccaggcaaggctccaaagctcctgatgtacgccgctagcaaccagggttctggtgtgccttctcggttctctggcagcgggagcgggacagaattcacactgacaatatcatccttgcagccagatgacttcgccacttattactgtcagcagaccaaggaggtgccctggagcttcggccaggggaccaaagtggaggtcaagcgcaccgtggctgctccaagcgttttcatttttccaccaagtgatgagcaactgaagtcaggaacagccagcgtggtgtgtctcttgaacaatttctatccaagagaggcaaaagtgcagtggaaggtggataatgctcttcagagcggtaactcacaggagtctgtaaccgaacaggactccaaagactccacttactccctctcctccaccctcactctgagtaaagccgactacgagaaacacaaagtttacgcctgcgaggtcacccatcagggcttgtccagccctgtgaccaagtcctttaacagaggcgagtgc(seq id no:25)。
123.需要说明的是,对于本发明说明书和权利要求书中所提及的核酸,本领域技术人员应当理解,实际包括互补双链的任意一条,或者两条。为了方便,在本说明书和权利要求书中,虽然多数情况下只给出了一条链,但实际上也公开了与之互补的另一条链。另外,本技术中的核酸序列包括dna形式或rna形式,公开其中一种,意味着另一种也被公开
124.在本发明的第三方面,本发明提出了一种表达载体,携带第二方面所述的核酸分子。所述表达载体可包括可选的控制序列,所述控制序列与所述核酸分子可操作地连接。其中,所述控制序列为可指导所述核酸分子在宿主中表达的一个或多个控制序列。本发明实施例所提出的表达载体可在适合的宿主细胞中高效表达所述重组抗体,所述重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的精准高效灭杀,具有较强的肿瘤抑制能力。
125.在本发明的第四方面,本发明提出了一种制备第一方面所述的重组抗体的方法,包括:将第三方面所述的表达载体引入到细胞中;将所述细胞在适于蛋白表达和分泌的条件下进行培养,以便获得所述重组抗体。根据本发明的一些具体的实施例所提出的方法可以有效获得所述重组抗体,所述重组抗体可以同时与cd27和cd33进行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。根据本发明的一些具体实施例,所述细胞不受特别限制,原核细胞或真核细胞均可使用,当所述细胞为真核细胞,如哺乳动物细胞时所述重组抗体的表达效率较高。
126.根据本发明的一些具体实施例,所述细胞为真核细胞。
127.根据本发明的一些具体实施例,所述真核细胞为哺乳动物细胞。根据本发明的一些具体实施例,所当所述细胞为真核细胞,如哺乳动物细胞时所述重组抗体的表达效率较高。
128.根据本发明的一些具体实施例,所述真核细胞不包括动物生殖细胞、受精卵或胚胎干细胞。
129.在本发明的第五方面,本发明提出了一种重组细胞,所述重组细胞携带第二方面所述的核酸分子,或第三方面所述的表达载体,或表达第一方面所述的重组抗体。所述重组细胞是通过转染或者转化所述表达载体获得的。根据本发明的一些具体实施例,所述重组细胞在合适条件下可高效大量表达上述重组抗体,所述重组抗体可以同时与cd27和cd33进
行结合,有效介导t细胞对肿瘤细胞的杀伤作用,具有较强的肿瘤抑制能力。
130.需要注意的是,本发明所述重组细胞不受特别限制,可以为原核细胞、真核细胞或噬菌体。所述原核细胞可以为大肠杆菌、枯草杆菌、链霉菌或奇异变形菌等。所述真核细胞可以为包括巴斯德毕赤酵母、酿酒酵母、裂殖酵母、木霉等真菌,草地粘虫等昆虫细胞,烟草等植物细胞,bhk细胞、cho细胞、cos细胞、骨髓瘤细胞等哺乳动物细胞。在一些实施例中,本发明所述重组细胞优选为哺乳动物细胞,包括bhk细胞、cho细胞、nso细胞或cos细胞,且不包括动物生殖细胞、受精卵或胚胎干细胞。
131.需要说明的是,本技术说明书中所述的“适合条件”,是指适合本技术所述重组抗体表达的条件。本领域技术人员容易理解的是,适合重组抗体表达的条件包括但不限于合适的转化或转染方式、合适的转化或转条件、健康的宿主细胞状态、合适的宿主细胞密度、适宜的细胞培养环境、适宜的细胞培养时间。“适合条件”不受特别限制,本领域技术人员可根据实验室的具体环境,优化最适的所述重组抗体表达的条件。
132.在本发明的第六方面,本发明提出了一种组合物,包括:第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体或第五方面所述的重组细胞。如前所述,本发明实施例的重组抗体可以有效与cd27和cd33蛋白分子结合,并促使t细胞精准高效灭杀肿瘤细胞,包含所述重组抗体的组合物,如食品组合物、药物组合物等,同样具有显著的治疗或预防肿瘤的作用。
133.需要注意的是,所述组合物包括在时间和/或空间上分开的组合,只要其能够共同作用以实现本发明的目的。例如,所述组合物中所含的成分可以以整体施用于受试者,或者分开施用于受试者。当所述组合物中所含的成分分开地施用于受试者时,各个成分可以同时或依次施用于受试者。
134.在本发明的第七方面,本发明提出了第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体、第五方面所述的重组细胞或第六方面所述的组合物在制备药物中的用途,所述药物用于治疗或者预防髓系细胞白血病和cd33阳性癌症。如前所述,本发明实施例的重组抗体可以有效与cd27和cd33蛋白分子结合,促使t细胞精准高效灭杀肿瘤细胞,因此,包含所述重组抗体的一系列物质的药物同样具有显著的治疗或预防肿瘤的作用。
135.根据本发明的一些具体实施例,上述用途还可以进一步包括如下附加技术特征至少之一:
136.所述cd33阳性癌症包括下列中的至少之一:肺癌、肝癌、卵巢癌、宫颈癌、皮肤癌、膀胱癌、结肠癌、乳腺癌、神经胶质瘤、肾癌、胃癌、食道癌、口腔鳞状细胞癌和头颈癌。
137.在本发明的第八方面,本发明提出了一种药物,所述药物包括:第一方面所述的重组抗体、第二方面所述的核酸分子、第三方面所述的表达载体、第五方面所述的重组细胞或第六方面所述的组合物。如前所述,本发明实施例的重组抗体可以有效与cd27和cd33蛋白分子结合,促使t细胞精准高效灭杀肿瘤细胞,因此,包含所述重组抗体的一系列物质的药物同样具有显著的治疗或预防癌症的作用。
138.根据本发明的一些具体实施例,上述药物还可以进一步包括如下附加技术特征至少之一:
139.根据本发明的一些具体实施例,包括药学上可接受的载体和有效量的所述抗体活
性成分。
140.如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
141.如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
142.本发明的药物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物宜在无菌条件下制造。
143.本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
144.本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。
145.根据本发明的一些具体实施例,所述药物用于治疗或预防髓系细胞白血病和cd33阳性癌症。
146.根据本发明的一些具体实施例,所述cd33阳性癌症包括下列中的至少之一:肺癌、肝癌、卵巢癌、宫颈癌、皮肤癌、膀胱癌、结肠癌、乳腺癌、神经胶质瘤、肾癌、胃癌、食道癌、口腔鳞状细胞癌和头颈癌。
147.在本发明的第九方面,本发明提出了前面所述的重组抗体、核酸分子、表达载体或重组细胞在制备试剂盒中的用途,所述试剂盒用于检测cd27和/或cd33。所述重组抗体可与cd27和/或cd33蛋白进行结合,在合适条件下,所述核酸分子、表达载体或重组细胞均能够表达所述重组抗体,能够以其制备试剂盒,因此,包含所述重组抗体或能够表达所述重组抗体的核酸分子、表达载体或重组细胞的试剂盒可用于有效检测cd27和/或cd33。所述试剂盒可用于科学研究,如定性或定量检测生物样本中的cd27和/或cd33蛋白。
148.在本发明的第十方面,本发明提出了一种试剂盒,所述试剂盒包含前面所述的重组抗体、核酸分子、表达载体或重组细胞。根据本发明实施例提供的所述重组抗体可与cd27和/或cd33蛋白进行结合,在合适条件下,所述核酸分子、表达载体或重组细胞均能够表达所述重组抗体,能够以其制备试剂盒,因此,包含所述重组抗体或能够表达所述重组抗体的核酸分子、表达载体或重组细胞的试剂盒可用于有效检测cd27和/或cd33。所述试剂盒可用于科学研究,如定性或定量检测生物样本中的cd27和/或cd33蛋白,也可以用于对个体状态进行判断,如获得所述个体的cd33水平后,判断其cd33水平是否过高于或低于正常水平。
149.根据本发明的一些具体实施例,所述试剂盒用于检测cd27和/或cd33。
150.下面将对实施例作具体介绍。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
151.实施例1 cd27
×
cd33双特异性抗体的制备
152.本实施例进行双特异性抗体的生产,具体实验操作如下:利用expicho expression medium培养基(购自thermo fisher,a2910001)培养expicho细胞(购自thermo fisher),调整细胞浓度为6
×
106/ml,获得expicho细胞溶液。将含有编码第一抗原结合区和第二抗原结合区的三条链编码基因(分别如seq id no:23、24、25所示)的ptt5载体(由苏州金唯智公司合成)加入2ml optisfm培养基(thermo fisher,12309019)中,获得溶液a。其中,第一抗原结合区编码基因包括编码cd27单链抗体(seq id no:13)、连接肽1(seq id no:16)、连接肽2(seq id no:17)和第一重链恒定区(seq id no:18)的核苷酸序列,第二抗原结合区-第一肽链编码基因包括编码cd33抗体重链可变区(seq id no:14)和第二重链恒定区(seq id no:19)的核苷酸序列,第二抗原结合区-第二肽链编码基因包括cd33抗体轻链可变区和轻链恒定区。将160μlexpifectaminecho转染试剂(thermofisher,a29130)加入2ml optisfm培养基中,获得溶液b。然后将溶液a和溶液b混合,获得转染混合物,并在5分钟内将转染混合物全部加入50ml expicho细胞溶液中。在37℃、5%co2条件下培养1天后,加入8ml feed(thermo fisher,a29130)、300μl enhancer(thermo fisher,a29130),并转入32℃、5%co2条件下培养9天后收获培养上清,其中第5天添加8ml feed。利用protein a纯化柱(ge)从培养上清中亲和纯化双特异抗体,获得抗体cd27
×
cd33。抗体cd27
×
cd33具有如seq id no:20(第一抗原结合区),seq id no:21(第二抗原结合区-第一肽链)和seq id no:22(第二抗原结合区-第二肽链)所示的氨基酸序列。
153.第一抗原结合区编码基因包括如下所示的核苷酸序列:
154.caagtgcaattggttgaatctggcggaggcgttgttcagccaggaaggtcccttcgtttgagttgtgctgcttccggtttcacttttagttcttatgatatgcactgggtcaggcaggctcctggaaagggactggaatgggtggcagtgatctggtatgatggatctaacaaatattatgccgattccgtcaaggggagatttaccatcagtagggataattccaagaataccctgtatctgcagatgaacagcctgagagccgaagacactgcagtgtattattgcgctcgcggtagcgggaactggggtttctttgactactgggggcagggtactctggtgaccgtctctagtggaggaggtggctcaggaggaggtggatctggtggcggtggttccgatattcagatgactcaaagtccatcctccttgtctgcttccgtgggtgaccgggttaccataacctgccgggcaagtcaggggatttctagatggttggcttggtaccagcagaagcctgagaaggcccctaaatccttgatatacgccgcttcttccttgcaaagcggagtcccttcccggttttctgggtccggttccggcaccgactttaccctgaccattagctccctgcagcctgaggacttcgcaacctattattgccaacagtacaacacataccctagaactttcggacaaggcaccaaggtcgagatcaaggggggaggaggatcccctaagagttgcgataagacacatacatgtcctccatgccctgcccctgaagctgctggaggaccatccgtcttcctttttccccccaagccaaaggatactttgatgatcagtcgtactcccgaggtgacttgtgtcgtcgtcgatgtcagccacgaggatccagaggttaagttcaattggtatgtggacggcgtggaggtacataatgccaagaccaagcctcgggaggaacagtacaactctacttatcgggtggtgtctgtgcttaccgtgttgcatcaagactggctgaacggcaaggagtacaaatgtaaagtcagcaataaagctctgccagcacccatcgaaaagaccatttccaaggctaaaggccagccacgagagccccaagtgtacacactgccaccatgtagggaggaaatgaccaagaatcaggtgtctctctggtgtttggtgaagggcttttacccttccgacatcgctgtcgagtgggaaagtaatggccaaccagagaacaactacaaaacaacccctccagtgctc
gactccgatggatccttcttcctgtattcaaaactgacagtggataagtcacggtggcagcagggtaatgtcttctcctgcagtgttatgcatgaggccctgcacaaccactatacccaaaaaagtctgtccctgagccctggtaag(seq id no:23)。
155.第一抗原结合区-第一肽链编码基因包括如下所示的核苷酸序列:
156.gaagtccaactggtacagagtggcgctgaagtgaagaaacccggatcttctgtcaaggtgtcctgcaaggcatccggatacaccatcactgactccaacattcattgggtgagacaagcaccaggccagtctctcgagtggatcggctacatatacccctacaacggaggtacagactacaaccagaagttcaagaatagggccacactgacagtggacaaccctactaacactgcttatatggagctgtccagtctgcgtagcgaggataccgccttttactattgtgtgaatggcaatccttggcttgcctactggggccagggaaccttggtaaccgtgagctccgcaagtaccaagggtccctccgtctttccattggccccatcttctaagtcaacatcaggcggtactgcagcactcgggtgtctggtgaaggactactttccagagcctgtcacagtcagctggaacagcggtgctctgacaagtggggtacacactttcccagctgtgcttcagagttccgggctctattcactgagcagtgtggtgactgtccccagcagtagcctgggtactcagacctacatctgtaacgtgaatcataaaccttcaaacacaaaggtcgataagaaggttgaaccaaagagctgcgacaaaactcacacttgtcctccatgtcccgcaccagaagctgctggtggaccctcagtctttctgtttccccccaaacccaaagataccctgatgatttccaggacccctgaggtaacctgcgtggtggtggacgtttctcacgaagaccccgaggtgaagttcaactggtacgtggacggcgtggaggtgcataacgccaagaccaagcctcgcgaagagcaatataactccacatacagagtggtgagcgttttgaccgtgttgcaccaggactggctcaacgggaaggagtacaaatgtaaagtttcaaataaagccttgcctgctccaatcgagaaaaccatctccaaggccaaaggccaaccccgagaaccacaggtgtgcaccttgcctcccagtcgagaggaaatgacaaagaatcaggtgtctttgagctgtgctgtgaaaggcttctatccatccgacatcgcagtggagtgggaaagtaacggtcagccagagaacaattataagaccaccccacccgtgttggattctgacggctcttttttcctggttagcaaattgactgtggacaagtcccgctggcagcaggggaacgtgttttcttgtagtgtcatgcatgaagctctgcataatcactatactcagaagagcctgagcctgtctccagggaag(seq id no:24)。
157.第一抗原结合区-第二肽链编码基因包括如下所示的核苷酸序列:
158.gacattcagctgactcagagcccttccacactgagtgcttctgttggcgacagggtgaccataacttgccgagcttccgagtccttggataactacggcattaggtttctcacttggtttcaacagaagccaggcaaggctccaaagctcctgatgtacgccgctagcaaccagggttctggtgtgccttctcggttctctggcagcgggagcgggacagaattcacactgacaatatcatccttgcagccagatgacttcgccacttattactgtcagcagaccaaggaggtgccctggagcttcggccaggggaccaaagtggaggtcaagcgcaccgtggctgctccaagcgttttcatttttccaccaagtgatgagcaactgaagtcaggaacagccagcgtggtgtgtctcttgaacaatttctatccaagagaggcaaaagtgcagtggaaggtggataatgctcttcagagcggtaactcacaggagtctgtaaccgaacaggactccaaagactccacttactccctctcctccaccctcactctgagtaaagccgactacgagaaacacaaagtttacgcctgcgaggtcacccatcagggcttgtccagccctgtgaccaagtcctttaacagaggcgagtgc(seq id no:25)。
159.实施例2双特异抗体与cho-k1-cd27细胞的结合能力鉴定
160.本实施例使用流式细胞术检测双特异抗体的结合特性,并基于双特异抗体加入后信号的强弱用于判断双特异抗体和cho-k1-cd27细胞的结合特性。具体的实验操作如下:
161.hek293t细胞按照5
×
105细胞/孔铺六孔板,用不含双抗的dmem培养基培养过夜。转染前弃去培养基,加入1ml新鲜的不含双抗的dmem培养基。将plvx-ef1a-cd27-ires-puro(plvx-ef1a-ires-puro载体的酶切位点ecori与bamhi之间插入有cd27蛋白(seq id no:26)的编码序列、pmd2g、pspax2载体(共3μg)按照2:1:1的比例加入200μl无血清dmem培养基
中,然后加入12μg聚醚酰亚胺(pei,polysciences有限公司),获得的cd27蛋白具有如seq id no:27所示的氨基酸序列;混匀后静置16min,然后将全部液体加入上述铺有hek293t细胞的六孔板中。培养6h后,弃去培养基,加入新鲜的完全dmem培养基培养。转染48h后,收细胞培养上清,过0.45μm滤器(millipore),即为病毒上清。将病毒上清全部加入含有1
×
104cho-k1细胞的6孔板中,加入终浓度4μg/ml的聚凝胺(sigma),培养12h。随后弃尽上清,加入新鲜的完全dmem培养基。所得细胞即为cho-k1-cd27细胞。
162.atggccagacctcacccttggtggctttgtgtcttgggtactttggtgggcctctctgcaacacctgctccaaagtcctgccccgagagacattattgggcacaaggcaagctttgttgtcagatgtgcgaacctggaacatttctggtgaaagattgcgaccaacacaggaaagctgctcagtgcgacccatgtatcccaggagtatctttctctccagaccatcatacccgacctcattgcgagagctgcaggcactgtaacagtgggctgttggtgcggaactgtacaataacagctaacgccgagtgtgcctgtcgaaacggatggcagtgccgggacaaagagtgcacagaatgcgaccctctgcccaatccttctctgactgcacgttcctcccaggcattgtctccccacccacagccaacacatctcccctatgtgtctgagatgctggaagccaggaccgctggtcatatgcaaaccctggcagactttcgccagctgcctgctaggactctgtctacccattggcctcctcaaaggagcctttgctccagcgatttcattcgcatattggtgatcttttccggcatgtttcttgtctttacattggccggggctctctttctgcatcagcgtaggaaatatcggtccaacaagggcgaaagtcccgttgagccagctgaaccatgccactatagctgtccaagagaggaagagggatcaaccatacccattcaggaggattacaggaagcccgagcctgcctgttcccct(seq id no:26)。
163.marphpwwlcvlgtlvglsatpapkscperhywaqgklccqmcepgtflvkdcdqhrkaaqcdpcipgvsfspdhhtrphcescrhcnsgllvrnctitanaecacrngwqcrdkectecdplpnpsltarssqalsphpqpthlpyvsemleartaghmqtladfrqlpartlsthwppqrslcssdfirilvifsgmflvftlagalflhqrrkyrsnkgespvepaepchyscpreeegstipiqedyrkpepacsp(seq id no:27)。
164.用pbs将cho-k1-cd27细胞稀释为1
×
106/ml,以90μl/管的体积加于1.5ml ep管中,向其中加入10μl/管大鼠血清,于4℃封闭30min。分别加入一系列浓度梯度(0.1、1、10、30、100、300μg/ml)的cd27
×
cd33双特异抗体、higg(对照igg1,biolegend、qa16a12)10μl/管,于4℃孵育30min。孵育结束后向ep管中加入1ml pbs,于4℃、100g条件下离心5min,弃尽上清,再用pbs洗一遍沉淀。离心后弃尽上清,用100μl/管pbs重悬细胞,重悬后向其中加入体积为1μl/管alexa-647标记的大鼠抗人fc抗体二抗(biolegend,m1310g05),4℃、避光孵育30min。用pbs洗两遍,离心后弃尽上清。用200μl/管pbs重悬细胞,用流式细胞仪进行检测,具体的实验结果如图2所示,进一步显示本发明的双特异抗体cd27
×
cd33能够结合cho-k1-cd27细胞。
165.实施例3双特异抗体与人外周血t细胞的结合能力鉴定
166.本实施例使用流式细胞术检测上述实施例1和2cd27
×
cd33双特异抗体的结合特性,并基于双特异抗体加入后信号的强弱用于判断双特异抗体和人外周血cd8
t细胞的结合特性。具体的实验操作如下:
167.用pbs将人外周血单个核细胞(赛笠生物)稀释为5
×
106/ml,以90μl/管的体积加于1.5ml ep管中,向其中加入10μl/管大鼠血清,于4℃封闭30min;封闭结束后分别加入一系列浓度梯度(0.1、1、10、30、100、300μg/ml)的cd27
×
cd33双特异抗体、higg(对照igg1,biolegend、qa16a12)10μl/管,于4℃孵育30min后,向ep管中加入1ml pbs,于4℃、100g条件下离心5min,弃尽上清,再用pbs洗一遍沉淀,离心后弃尽上清,用100μl/管pbs重悬细胞,向
其中加入1μl/管alexa-647标记的大鼠抗人fc抗体二抗(biolegend,m1310g05)以及1μl/管fitc标记的小鼠抗人cd8抗体(invitrogen,okt8),4℃避光孵育30min。用pbs洗两遍,离心后弃尽上清。用200μl/管pbs重悬细胞,用流式细胞仪进行检测,具体的实验结果如图3所示,说明本发明cd27
×
cd33双特异抗体能够结合人外周血t细胞。
168.实施例4双特异抗体与cho-k1-cd33细胞的结合能力鉴定
169.本实施例使用流式细胞术检测上述实施例所用cd27
×
cd33双特异抗体的结合特性,并基于双特异抗体加入后信号的强弱用于判断双特异抗体和cho-k1-cd33细胞的结合特性。具体的实验操作如下:
170.hek293t细胞按照5
×
105个细胞/孔铺六孔板,用不含双抗的dmem培养基培养过夜。转染前弃去培养基,加入1ml新鲜的不含双抗的dmem培养基。将plvx-ef1a-cd33-ires-puro(plvx-ef1a-ires-puro载体的酶切位点ecori与bamhi之间插入有cd33蛋白(seq id no:28)的编码序列)、pmd2g、pspax2载体(共3μg)按照2:1:1的比例加入200μl无血清dmem培养基中,然后加入12μg聚醚酰亚胺(pei,polysciences有限公司),获得的cd33蛋白具有如seq id no:29所示的氨基酸序列;混匀后静置16min,然后将全部液体加入上述铺有hek293t细胞的六孔板中。培养6h后,弃去培养基,加入新鲜的完全dmem培养基培养。转染48h后,收细胞培养上清,过0.45μm滤器(millipore),即为病毒上清。将病毒上清全部加入含有1
×
104cho-k1细胞的6孔板中,加入终浓度4μg/ml的聚凝胺(sigma),培养12h。随后弃尽上清,加入新鲜的完全dmem培养基。所得细胞即为cho-k1-cd33细胞。
171.atgcctttgcttctgcttttgcctttgctttgggcaggagcccttgccatggacccaaacttttggctccaggtgcaggaatcagtgaccgtccaggaaggtctgtgcgtgctggtgccctgcacctttttccatcctatcccatattacgacaaaaatagcccagtacacggatattggtttagggagggggctattatctcacgagatagccccgtggctaccaataagctggaccaggaggtacaagaagagacccagggccgctttagattgttgggtgacccttccaggaacaactgttctttgagtattgttgacgcccgaaggcgcgacaacggtagctacttcttccgcatggagcgcggatccaccaaatactcctataagagccctcaattgagtgtccatgtgacagacctgacccacaggccaaaaatacttatcccaggcaccctggagccagggcactcaaagaatctgacttgctctgtctcttgggcctgtgaacagggtacaccccctatctttagctggttgtcagctgcccctacctccctgggacctagaaccacacattccagcgtacttattattactcccaggccccaggatcatggcaccaacctgacttgccaggttaaattcgccggggctggggtaacaacagagagaaccatccagttgaatgtgacttatgtgccacagaatcctaccaccggaatctttcctggagacggatctggcaagcaagagaccagggcaggagtagtacatggcgctattggcggtgctggagtgacagctctgttggccctgtgtttgtgtctgattttcttcatcgtcaaaactcaccgtaggaaggctgcacgaactgccgtcggccgtaacgatactcatccaactaccggtagcgctagtcctaagcatcagaagaagagcaagttgcatggaccaacagagactagcagttgtagcggggctgcacctactgtcgaaatggatgaggaacttcactatgcctcactgaacttccacggcatgaacccctctaaggacacctcaactgaatactcagaagtccgaactcag(seq id no:28)。
172.mplllllpllwagalamdpnfwlqvqesvtvqeglcvlvpctffhpipyydknspvhgywfregaiisrdspvatnkldqevqeetqgrfrllgdpsrnncslsivdarrrdngsyffrmergstkysykspqlsvhvtdlthrpkilipgtlepghsknltcsvswaceqgtppifswlsaaptslgprtthssvliitprpqdhgtnltcqvkfagagvttertiqlnvtyvpqnpttgifpgdgsgkqetragvvhgaiggagvtallalclcliffivkthrrkaartavgrndthpttgsaspkhqkksklhgptetsscsgaaptvemdeelhyaslnfhgmnpskdtsteysevrtq(seq id no:29)。
173.用pbs将cho-k1-cd33细胞稀释为1
×
106/ml,以90μl/管的体积加于1.5ml ep管中,向其中加入10μl/管大鼠血清,于4℃封闭30min。分别加入一系列浓度梯度(0.1、1、10、30、100、300μg/ml)的cd27
×
cd33双特异抗体、人源igg(对照igg1,biolegend、qa16a12)10μl/管,于4℃孵育30min。孵育结束后向ep管中加入1ml pbs,于4℃、100g条件下离心5min,弃尽上清,再用pbs洗一遍沉淀。离心后弃尽上清,用100μl/管pbs重悬细胞,重悬后向其中加入体积为1μl/管alexa-647标记的大鼠抗人fc抗体二抗(biolegend,m1310g05),4℃、避光孵育30min。用pbs洗两遍,离心后弃尽上清。用200μl/管pbs重悬细胞,用流式细胞仪进行检测,具体的实验结果如图4所示,进一步显示本发明的双特异抗体cd27
×
cd33能够结合cho-k1-cd33细胞。
174.实施例5双特异抗体与人急性髓系细胞白血病hl-60肿瘤细胞的结合能力鉴定
175.本实施例使用流式细胞术检测上述实施例所述的cd27
×
cd33双特异抗体的结合特性,并基于双特异抗体加入后信号的强弱用于判断双特异抗体和人急性髓系细胞白血病hl-60肿瘤细胞的结合特性。具体的实验操作如下:
176.用pbs将hl-60细胞稀释为1
×
106/ml,以90μl/管的体积加于1.5ml ep管中,向其中加入10μl/管大鼠血清,于4℃封闭30min。分别加入一系列浓度梯度(0.1、1、10、30、100、300μg/ml)的cd27
×
cd33双特异抗体、人源igg抗体(igg1,biolegend、qa16a12)10μl/管,于4℃孵育30min。孵育结束后向ep管中加入1ml pbs,于4℃、100g条件下离心5min,弃尽上清,再用pbs洗一遍沉淀。离心后弃尽上清,用100μl/管pbs重悬细胞,重悬后向其中加入体积为1μl/管alexa-647标记的大鼠抗人fc抗体二抗(biolegend,m1310g05),4℃、避光孵育30min。用pbs洗两遍,离心后弃尽上清。用200μl/管pbs重悬细胞,用流式细胞仪进行检测,具体的实验结果如图5所示,进一步显示本发明的双特异抗体cd27
×
cd33能够结合人急性髓系细胞白血病hl-60细胞。
177.实施例6:双特异抗体促进jurkat-nfat-lucia-cd27报告细胞活化的鉴定
178.本实施例利用jurkat-nfat-lucia-cd27报告体系方法,鉴定所述cd27
×
cd33双特异抗体交联靶细胞表面cd33和效应细胞表面cd27,进而活化t细胞的能力。相对化学发光信号(rlu)的强弱用于判断双特异抗体通过桥联cd33阳性靶细胞和t细胞,进而活化t细胞的能力。
179.hek293t细胞按照5
×
105细胞/孔铺六孔板,用不含双抗的dmem培养基培养过夜。转染前弃去培养基,加入1ml新鲜的不含双抗的dmem培养基。将plvx-ef1a-cd27-ires-puro(plvx-ef1a-ires-puro载体的酶切位点ecori与bamhi之间插入有cd27蛋白(seq id no:26)的编码序列、pmd2g、pspax2载体(共3μg)按照2:1:1的比例加入200μl无血清dmem培养基中,然后加入12μg聚醚酰亚胺(pei,polysciences有限公司),获得的cd27蛋白具有如seq id no:27所示的氨基酸序列;混匀后静置16min,然后将全部液体加入上述铺有hek293t细胞的六孔板中。培养6h后,弃去培养基,加入新鲜的完全dmem培养基培养。转染48h后,收细胞培养上清,过0.45μm滤器(millipore),即为病毒上清。将病毒上清全部加入含有1
×
104jurkat-nfat-lucia细胞的6孔板中,加入终浓度4μg/ml的聚凝胺(sigma),培养12h。随后弃尽上清,加入新鲜的完全dmem培养基。所得细胞即为jurkat-nfat-lucia-cd27细胞。
180.(1)用完全rpmi-1640培养基将实施例4中所述的cho-k1-cd33细胞稀释为1
×
105/ml,加入96孔板中,添加体积为100μl/孔。
181.(2)用完全rpmi-1640培养基将上述cd27
×
cd33双特异抗体以及阴性对照组人源igg抗体(igg1,biolegend、qa16a12)分别稀释为500μg/ml、100μg/ml、20μg/ml,4μg/ml、0.8μg/ml、160ng/ml、32ng/ml、6.4ng/ml,并加入96孔板中,添加体积为20μl/孔。
182.(3)用完全rpmi-1640培养基将jurkat-nfat-lucia-cd27细胞稀释为1.25
×
105/ml,加入96孔板中,添加体积为80μl/孔。
183.(4)将步骤(3)获得的反应体系于37℃、5%co2培养箱中培养24h。
184.(5)吸取50μl培养上清,加入96孔板中,然后向板中加入荧光素酶底物(invivogen),添加体积为50μl/孔。
185.(6)利用多功能酶标仪检测化学发光。
186.具体的实验结果如图6所示,进一步显示本发明的双特异抗体cd27
×
cd33能够桥联cd33阳性靶细胞和t细胞,促进t细胞活化。
187.实施例7双特异抗体促进pbmc灭杀cd33阳性肿瘤细胞
188.本实施例检测实施例1获得的所述cd27
×
cd33双特异性抗体对pbmc杀伤a375-cd33肿瘤细胞的影响,通过构建所述肿瘤细胞 pbmc 不同浓度双特异性抗体的反应体系进行检测,具体实验操作如下:
189.hek293t细胞按照5
×
105细胞/孔铺六孔板,用不含双抗的dmem培养基培养过夜。转染前弃去培养基,加入1ml新鲜的不含双抗的dmem培养基。将plvx-ef1a-cd33-ires-puro(plvx-ef1a-ires-puro载体的酶切位点ecori与bamhi之间插入有cd33蛋白(seq id no:28)的编码序列)、pmd2g、pspax2载体(共3μg)按照2:1:1的比例加入200μl无血清dmem培养基中,然后加入12μg聚醚酰亚胺(pei,polysciences有限公司),获得的cd33蛋白具有如seq id no:29所示的氨基酸序列;混匀后静置16min,然后将全部液体加入上述铺有hek293t细胞的六孔板中。培养6h后,弃去培养基,加入新鲜的完全dmem培养基培养。转染48h后,收细胞培养上清,过0.45μm滤器(millipore),即为病毒上清。将病毒上清全部加入含有1
×
104a375细胞(购自普诺赛,cl-0014)的6孔板中,加入终浓度4μg/ml的聚凝胺(sigma),培养12h。随后弃尽上清,加入新鲜的完全dmem培养基。所得细胞即为a375-cd33细胞。
190.(1)按照50μl/孔的体积向16孔rtca板中加入完全rpmi-1640培养基,上机校准;
191.(2)用完全rpmi-1640培养基将a375-cd33细胞稀释为2
×
105/ml,按照50μl/孔的体积分别添加至步骤(1)获得的rtca板中,然后于37℃、5%co2条件下使用xcelligence rtca tp设备检测细胞系数24h;
192.(3)用完全rpmi-1640培养基将cd27
×
cd33双特异抗体及对照4-1bb
×
cd33双特异抗体(本实验室生产)稀释为一系列浓度梯度(0.32、1.6、8、40、200、1000ng/ml),加入步骤(2)获得的rtca板中,添加体积为20μl/孔;
193.(4)用完全rpmi-1640培养基将pbmc(赛笠生物)稀释为1.25
×
106个/ml,加入步骤(3)获得的rtca板中,添加体积为80μl/孔;
194.(5)将步骤(4)获得的反应体系于37℃、5%co2使用xcelligence rtca tp设备检测细胞系数48h。
195.具体的实验结果如图7所示,进一步显示本发明的cd27
×
cd33双特异抗体能够促进pbmc杀伤表达cd33阳性肿瘤细胞。
196.由以上实验结果可以看出,本发明得到的双特异抗体能够与t细胞、肿瘤细胞进行
结合,桥联t细胞与肿瘤细胞,并促进t细胞活化并肿瘤细胞。
197.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
198.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。