包含pkc-β
抑制剂的组合物及其制备方法
相关申请的交叉引用
1.本技术要求于2019年12月6日提交的美国临时专利申请号62/944,699的权益,其在此通过引用整体并入本文。发明背景
2.治疗和医学领域需要有效治疗癌症的组合物和使用所述有效治疗癌症的组合物的方法。
技术实现要素:
3.在一些实施方案中,本发明涉及蛋白激酶抑制剂化合物及其药学上可接受的盐、溶剂化物和水合物的使用方法以及包含其的组合物。在一些实施方案中,本发明涉及控释(modified release)或缓释(extended release)药物组合物,其优选呈颗粒形式,以片剂、胶囊剂,或颗粒剂形式使用以在至少8至12小时的时间段内缓慢释放蛋白激酶抑制剂或其药学上可接受的盐、溶剂化物或水合物。在一些实施方案中,控释或缓释药物制剂既包含速释(immediate release)制剂,也包含缓释制剂。在其他实施方案中,控释药物制剂仅包含缓释制剂。本发明还涉及制备缓释制剂的方法。在一些实施方案中,蛋白激酶抑制剂化合物是蛋白激酶cβ抑制剂。在一些实施方案中,蛋白激酶抑制剂化合物是5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a),或其药学上可接受的盐、溶剂化物或水合物。
[0004]
本发明的组合物可用于治疗例如:癌症,诸如包括cll或sll的β细胞恶性肿瘤;自身免疫性病症,如类风湿性关节炎、多发性硬化症、炎性肠病、克罗恩病或脑炎;或炎症,如由炎性肠病、克罗恩病或溃疡性结肠炎引起的炎症。
附图说明
[0005]
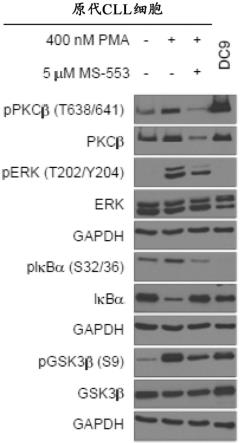
图1a和图1b显示了化合物a抑制pkcβ和下游靶标的磷酸化。证明了用化合物a处理的原代cll细胞中bcr信号传导的抑制。在图1a中,代表性免疫印迹显示使用化合物a使pkcβ及其下游靶标的磷酸化降低。在图1b中,使用alphaview sa软件对免疫印迹进行量化(ppkcβ:n=5,perk:n=4,piκbα:n=5,pgsk3β:n=5),结果报告为与媒介物对照相比表达的倍数变化。
[0006]
图2显示了用化合物a处理的原代cll细胞对促炎细胞因子表达的抑制。在存在或不存在抗igm连接的情况下,用5μm化合物a处理原代cll细胞24小时。通过elisa测定ccl3和ccl4分泌。
[0007]
图3a和图3b显示了化合物a降低具有wt和c481sbtk的原代cll细胞的活化。观察到在依鲁替尼(ibrutinib)前后用化合物a处理的原代cll细胞的活化。对冷冻保存的基线样品和来自经依鲁替尼治疗的患者(n=2)的复发后样品进行解冻,并用高达10μm的化合物a进行处理,并用3.2μm cpg进行刺激。cd86(图3a)和hla-dr(图3b)的表达在48小时通过流式
细胞术测定。报告平均荧光强度(mfi)。误差条代表标准偏差。
[0008]
图4显示了化合物a对健康t细胞的作用。用1μm化合物a(n=9)处理健康供体t细胞,并用10μg结合板的抗cd3和1μg可溶性抗cd28刺激24小时。通过elisa测定tnfα表达。
[0009]
图5显示了化合物a体内抑制pkcβ功能并体内抑制serbp1的磷酸化。采用磷流动测定法(phosphor-flow assay)测定serbp1的磷酸化,serbp1是一种新型的pkcβ底物。作为1期研究的一部分,在适当的时间点从接受化合物a的cll患者身上采集全血样品,并连夜运送,并在第二天进行处理以进行测试。用pma 离子霉素刺激全血,使细胞透性化,并测定serbp1磷酸化的量。报告的数据是cd19 pserbp1 群体,在相应时间点相对于每个患者自己的未受刺激样品进行归一化。
[0010]
图6显示了提供化合物a生物活性的总结。
[0011]
图7显示了被给药化合物a的患者的pk/pd数据相关表,并量化了pma刺激后serbp1磷酸化相对于化合物a药物浓度的增加。援引并入
[0012]
本说明书中提及的所有出版物和专利申请都通过引用并入本文,其程度犹如具体地且单独地指出每个单独的出版物或专利申请通过引用并入。
具体实施方式
[0013]
尽管本文已经示出和描述了本发明的优选实施方案,但是对于本领域技术人员来说显而易见的是,这些实施方案仅作为示例提供。本领域技术人员现在将想到许多变化、改变和替换而不背离本发明。应理解,在实施本发明时可采用对本文描述的本发明实施方案的各种替代方案。所附权利要求旨在定义本发明的范围,并且由此覆盖这些权利要求及其等同物范围内的方法和结构。定义
[0014]
为了清楚和一致,将在本专利文件全文使用以下定义。
[0015]
如本文所用,术语“抑制剂”是指与蛋白激酶相互作用并使其失活的部分(例如pkcβ),并且因此可启动该酶的生理学或药理学反应特征。
[0016]
术语“需要治疗”和术语“有需要”在提及治疗时可互换使用,并且是指在人的情况下由护理人员(例如,医生、护士、执业护士等)、在动物(包括非人哺乳动物)的情况下由兽医做出的判断,即个体或动物需要治疗或将从治疗中受益。该判断是基于护理人员专业知识范围内的各种因素做出的,这些因素包括认识到个体或动物因可由本发明的化合物治疗的疾病、病况或病症而导致生病或将会生病。因此,本发明的化合物可以以保护或预防方式使用;本发明的化合物可用于减轻、抑制或改善所述疾病、病况或病症。
[0017]
术语“个体”是指任何动物,包括哺乳动物,优选小鼠、大鼠、其他啮齿动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,且最优选人类。
[0018]
术语“调节”是指特定活性、功能或分子的量、质量、反应或作用的增加或减少。
[0019]
术语“组合物”是指化合物,包括但不限于本发明化合物的盐、溶剂化物和水合物,连同至少一种附加组分。
[0020]
术语“药物组合物”是指包含至少一种活性成分、例如本文所述的化合物的组合物;包括但不限于本发明化合物的盐、溶剂化物和水合物,其中该组合物可以在哺乳动物
(例如但不限于人)中研究特定的有效结果。本领域普通技术人员将理解和领会适用于根据技术人员的需要确定活性成分是否具有期望的有效结果的技术。
[0021]
术语“羟丙基甲基纤维素”(hpmc),也可称为“羟丙甲纤维素”,是指甲基纤维素的丙二醇醚。羟丙基甲基纤维素具有不同的黏度。例如,羟丙基甲基纤维素可以是在20℃水中以约2%的量存在时其黏度为约2300mpa
·
s至约3800mpa
·
s的羟丙基甲基纤维素。例如,羟丙基甲基纤维素可以是methocel
tm k4m premium cr。例如,羟丙基甲基纤维素可以是在20℃水中以约2%的量存在时,其黏度为约75mpa
·
s至约120mpa
·
s的羟丙基甲基纤维素。例如,羟丙基甲基纤维素可以是methocel
tm k100 premium lvcr。作为另一个示例,羟丙基甲基纤维素可以是methocel
tm k100m。
[0022]
术语是指靶向药物释放包衣聚合物家族。这些聚合物可以将药物配制成肠溶、保护性或持续释放制剂以防止药物分解,直到药物到达胃肠道(gi)中ph足够的区域。一旦药物到达胃肠道的目标区域(即十二指肠、胃),就会从聚合物基质中释放出来并被吸收。靶向药物释放通常用于防止药物在ph不足以吸收的区域溶解,或帮助尽量减少胃肠道刺激。rlpo是丙烯酸乙酯、甲基丙烯酸甲酯和甲基丙烯酸三甲基氨基乙酯氯化物的共聚物,比例为1:2:0.2。该共聚物是不溶的,具有高渗透性和ph依赖性溶胀性,这使其成持续释放片剂的优良候选者。
[0023]
术语“乙基纤维素”是指乙基纤维素的聚合物。ethocel
tm
产品是非水溶性聚合物,被批准可进行全球制药应用,并用于缓释固体制剂。ethocel
tm
无色、无臭、无味且无热量。ethocel
tm
已在制药行业作为片剂包衣、受控释放的包衣、微胶囊化和掩味来使用。
[0024]
术语是指聚丙烯酸的聚合物家族。聚合物通常是高分子量的交联聚丙烯酸聚合物。71g nf聚合物设计用于口服固体剂量应用。carbopol 71g nf聚合物是一种自由流动的颗粒状聚丙烯酸均聚物。根据药物特性和辅助赋形剂,在通过直接压片制备的片剂中实现缓释特性的代表性用量为10wt.%-30wt.%。
[0025]
术语“羟丙基纤维素”(hpc)是指纤维素的丙二醇醚。hpc是一种由纤维素和环氧丙烷形成的非离子水溶性纤维素醚。它结合了在水溶剂和极性有机溶剂中的溶解性、热塑性和表面活性以及其他水溶性纤维素聚合物的增稠和稳定性能。klucel
tm hf pharma是一种高分子量(1,150,000)药用级羟丙基纤维素,黏度范围为1,500-3,000cps。klucel
tm hxf pharma是细粒度的klucel
tm hf pharma。
[0026]
术语“methocel
tm
纤维素醚”是指甲基纤维素和羟丙基甲基纤维素的共聚物家族。methocel
tm
纤维素醚是水溶性聚合物。methocel
tm
聚合物包括甲基纤维素和羟丙基甲基纤维素(羟丙甲纤维素)-每种的等级、物理形式都不同并且黏度范围广。它们使配方设计师能够为片剂包衣、制粒、受控释放、挤出、成型和液体制剂的受控黏度制定可靠的配方。methocel
tm e(羟丙甲纤维素2910 usp)和k(羟丙甲纤维素2208,usp)是基质制剂中使用最广泛的等级。usp代码基于纤维素的替代物。前两位数字代表平均甲氧基取代%,后两位代表平均羟丙基取代%。hpmc具有高度亲水性,与水接触迅速水合。由于羟丙基是亲水的,而甲氧基是疏水的,羟丙基与甲氧基的含量之比影响药物释放。
[0027]
如本文所用,术语“固化组合物”是指包含固化在一起的5-{[(2s,5r)-2,5-二甲
基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺或其药学上可接受的盐、溶剂化物和水合物、第一赋形剂和第二赋形剂的药物组合物。
[0028]
术语“治疗有效量”是指在研究人员、兽医、医生或其他临床医生或护理人员或个人所寻求的组织、系统、动物、个体或人中引起生物学或医学反应的活性化合物或药剂的量,包括以下一项或多项:(1)预防疾病,例如,预防个体的疾病、病况或病症,所述个体可易患所述疾病、病况或病症但尚未经历或表现出疾病的病理或症状;(2)抑制疾病,例如,抑制个体的疾病、病况或病症,所述个体正在经历或表现出所述疾病、病况或病症的病理或症状(即,阻止病理和/或症状的进一步发展);和(3)改善疾病,例如,改善个体的疾病、病况或病症,所述个体正在经历或表现出所述疾病、病况或病症的病理或症状(即,逆转病理和/或症状)。
[0029]
在化合物a的量的陈述(例如0.01mg化合物a)之前使用的术语“等同于
……
的量”是指5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐、溶剂化物和水合物的量,其等同于所陈述的化合物a的量。
[0030]
参考存在于组合物中的组分(如化合物a,或者如赋形剂)的量时所用术语“重量%”是指该组分的量以组合物的重量百分比计。
[0031]
就化合物而言,术语“释放速率”,在本文中也称为“溶解速率”,是指在特定时间段内在水性介质中释放的该化合物的百分比量。例如,陈述“化合物在水性介质中的重量释放速率是释放速率(a),其中(a)约15重量%至约35重量%的化合物在前两个小时内释放”意指在前两个小时内释放的化合物的重量百分比为化合物初始量的约15重量%至约35重量%。就化合物而言,术语“释放谱”,在本文中也称为“溶解谱”,是指显示该化合物在水性介质中释放的百分比量随时间变化的图。水性介质可以是如本文所述的水性介质。蛋白激酶抑制剂
[0032]
作为激酶抑制剂的化合物具有提供治疗有效的药物组合物的潜力,这些药物组合物预期具有用于治疗激酶相关病况或病症(如癌症和其他增生病症)的有益和改进的药学性质。
[0033]
本文描述了5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺并且在本文中称为化合物a或ms-553。化合物a先前已在wo2008/096260和相关专利和专利申请例如us8,183,255和美国专利申请号14/506,470中有描述,各自通过引用整体并入。
5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺
[0034]
表1中提供了化合物a对蛋白激酶c(pkc)抑制的总结。这些测定方法已有描述(grant等人,2010,eur.j.pharmacol.627:16-25)。化合物a是一种有效的、atp竞争性且可逆的常规pkc酶抑制剂,其中针对重组pkcβ的ki=5.3nm,针对重组pkcα的ki=10.4nm。它还是新型同工型pkcθ的有效抑制剂,ic
50
=25.6nm。此外,它对常规同工型pkcγ具有一定的效力,ic
50
=57.5nm。另外,它对pkc的常规、新型和非典型同工型的其他成员表现出高度的选择性,如针对这些同工型的较低效力所示(表1)。化合物a不显著抑制pkcδ。表1
[0035]
作为pkc的选择性抑制剂,化合物a可通过抑制pkcβ信号传导用于治疗其中pkc已被证明在病理学中起作用的病况,如癌症、免疫病症和炎症。然而,btk抑制剂的临床试验表明,b细胞受体(bcr)对nfκb信号传导通路的近100%抑制对于肿瘤适应症、尤其是b细胞介导的疾病的功效至关重要。因此,将化合物a开发为此类疾病和病症的有用疗法的一个关键方面是开发控释或缓释制剂,其设计成保持100%的通路抑制(例如,通过100%抑制pkcβ信号传导),同时保持c
max
值尽可能低以限制可能的不良事件。
[0036]
本文提供了化合物a的缓释(er)制剂,其被开发用于控制化合物a的释放。延迟释放允许血浆药物浓度维持在足够高的水平以与瞬释或速释(ir)制剂相比抑制pkcβ信号传导的时间更长。因此,er制剂需要较少的给药频率以维持治疗药物浓度。
[0037]
如实施例1所示,对来自患有cll或sll的患者的全血样品进行的pkcβ信号传导测定的生物标志物数据表明,血浆中500-600ng/ml范围内的化合物a浓度可完全抑制pkcβ信号传导。在cll和其他试图破坏通过b细胞受体(bcr)到nfκb信号通路的信号传导的肿瘤病况中维持高水平抑制的能力非常重要。
[0038]
此外,化合物a的临床试验数据表明,当化合物与食物一起服用时,血浆c
max
值为约2000ng/ml,耐受性良好。此外,食物对化合物a的pk特征没有显著影响。
[0039]
对于肿瘤适应症,尤其是b细胞介导的疾病(其中btk抑制剂的临床试验表明,该通
路的近100%抑制对疗效至关重要),优选其c
min
血浆值在单次给药后24小时保持在至少500-600ng/ml以及c
max
保持在至多2500-3000ng/ml的缓释制剂。具有这些特性的制剂将允许该药物化合物每天给药一次。缓释制剂
[0040]
将药物配制为可以以最少的每日剂量施用,从而在所需的延长时间内均匀地释放药物,这对患者和临床医生都显著有利。针对此目的已经开发了各种技术,包括包含具有包衣层的含药物颗粒的药物制剂,和包含药物分散于其中的连续基质(如嵌入树脂材料的刚性晶格中)的药物制剂。
[0041]
各种赋形剂、基质和制剂已用于实现药物物质的缓释。如本文所公开的,可以使用三种主要方法来配制化合物a以延长药物的释放谱:(1)具有侵蚀控制的疏水基质片剂;(2)具有扩散控制的亲水基质片剂;和(3)受控释放包衣技术。
[0042]
通过使用这样的缓释制剂,有效的血浆水平维持超过至少8-12小时,且最长达24小时。在一些实施方案中,化合物a的有效血浆水平为约500-600ng/ml。在一些实施方案中,化合物a的有效血浆水平为至少500ng/ml。在一些实施方案中,化合物a的有效血浆水平为至少600ng/ml。在一些实施方案中,化合物a的有效血浆水平为至少700ng/ml。在一些实施方案中,化合物a的有效血浆水平为约800ng/ml。在一些实施方案中,化合物a的有效血浆水平为至少800ng/ml。在一些实施方案中,有效血浆水平维持至少8小时。在一些实施方案中,有效血浆水平维持至少10小时。在一些实施方案中,有效血浆水平维持至少12小时。在一些实施方案中,有效血浆水平维持至少18小时。在一些实施方案中,有效的血浆水平维持最长达24小时。1.具有侵蚀控制的疏水基质片剂
[0043]
本文提供了疏水基质片剂,其中化合物a与疏水聚合物混合。这会导致缓释,因为药物化合物a在溶解后必须通过疏水聚合物内的通道扩散进行释放。在这些药物制剂中,包衣层或基质包含不溶于或几乎不溶于水性体液体中的物质,并且药物(例如化合物a)的释放借助于所述包衣层或基质对通过其的扩散的抵抗来控制。这样的药物制剂的特征在于用于制备基质的颗粒被制成尽可能地不易崩解。药物从这样的药物制剂中的释放是由药物浓度梯度驱动的,该梯度由于水通过扩散进入制剂而产生。在这种释放方式下,在释放的后期,释放速率用菲克定律描述,即由于浓度梯度的减小和扩散距离的增加,释放速率减小。
[0044]
在本文提供的一些实施方案中,化合物a如美国专利3,458,622中所述进行配制,该专利公开了一种受控释放片剂,用于在长达约8小时的长时间内施用药剂。在一些实施方案中,用于化合物a延长释放的压制片剂由芯中含有化合物a的片剂制成,所述芯由聚合乙烯基吡咯烷酮、优选聚乙烯吡咯烷酮(pvp)和羧基乙烯基亲水聚合物(水胶体)形成。在一些实施方案中,由两种聚合物物质形成的这种芯材料通过在水或胃液的作用下形成复合物来提供受控释放效果。2.具有扩散控制的亲水基质片剂
[0045]
本文还提供亲水基质片剂,其中化合物a与药物溶解/分散于其中的胶凝剂混合。药物(例如化合物a)通常分散在聚合物内,然后通过扩散进行释放。扩散系统的释放速率取
决于药物通过聚合物屏障的溶解速率。然而,为了使药物在该装置中缓释,药物在基质内的溶解速率高于其释放速率。这些制剂具有相对较低的成本和广泛的监管接受度。使用的聚合物可以分为几类:纤维素衍生物、非纤维素天然物和丙烯酸聚合物。
[0046]
在本文提供的一些实施方案中,化合物a如美国专利号4,140,755中所述配制,该专利公开了持续释放片剂。在一些实施方案中,持续释放片剂含有化合物a与一种或多种亲水性水胶体(如黏度为4000cps的羟丙基甲基纤维素)的均匀混合物。在一些实施方案中,水胶体在体温下与胃液接触时在片剂表面形成持久的凝胶状混合物,导致片剂增大并且堆积密度小于1。在一些实施方案中,化合物a从仍漂浮在胃液中的凝胶状混合物的表面缓慢释放。
[0047]
在本文提供的其他实施方案中,化合物a如美国专利号4,259,314中所述配制,该专利公开了一种受控的长效干药物组合物。在一些实施方案中,化合物a的受控长效干药物组合物包括由羟丙基甲基纤维素(hpmc)(在20℃下在2%水溶液中的黏度为50至4000cp)和羟丙基纤维素(hpc)(在25℃下在2%水溶液中的黏度为4000至6500cp)的混合物形成的干载体。
[0048]
在本文提供的一些实施方案中,将聚合物掺入片剂中。在一些实施方案中,当暴露于水性介质时,聚合物的存在导致片剂迅速凝胶化和溶胀;并且药物(例如化合物a)随着其扩散通过片剂的凝胶层以及随着片剂侵蚀而逐渐释放,同时凝胶层进一步进入片剂。在一些实施方案中,不溶性药物(例如化合物a)的释放主要通过片剂侵蚀来介导。
[0049]
在一些实施方案中,药物(例如化合物a)从基质片剂中的释放速率取决于:a.聚合物本身的类型;b.聚合物的具体等级;c.所用聚合物的水平;d.药物(例如化合物a)的溶解度;e.片剂赋形剂的选择(可溶性与不溶性)及其水平;f.片剂的大小;g.片剂的形状;及h.其组合。
[0050]
常见的亲水性聚合物包括例如polyox
tm n60k、71g、methocel
tm k100 lv等。3.具有受控释放包衣的片剂
[0051]
本文还提供了基质片剂,其中片剂被缓慢溶解的包衣包覆。当包衣溶解时,片剂将缓慢释放药物,例如化合物a。这样的溶解系统通常用于在水中具有高至中等溶解度的化合物。与扩散不同,药物释放取决于包衣的溶解度和厚度。由于该机制,此时溶解将成为药物释放的速率限制因素。
[0052]
根据药物(例如化合物a)所在的位置,溶解片剂系统可分解为称为储库装置和基质装置的子类别。在如本文所公开的储库装置系统中,包衣用适当的材料包覆药物,所述材料将缓慢溶解(如上所述)。可替代地,本文还提供了基质片剂,其在基质中具有化合物a并且基质,而不是包衣,缓慢溶解。
[0053]
在本文提供的一些实施方案中,化合物a如美国专利号4,252,786中所述配制。在一些实施方案中,在包含化合物a的不溶性溶胀型延迟释放基质或芯上采用由疏水性和亲水性聚合物的组合形成的可破裂的、相对非水溶性的、透水性的薄膜。在一些实施方案中,芯包括聚乙烯吡咯烷酮和羧基乙烯基亲水聚合物的共混物。
[0054]
在本文提供的其他实施方案中,化合物a如美国专利号4,309,404和4,248,857中所述配制,该专利公开了具有缓慢释放(slow release)包衣的缓慢释放片剂。在一些实施方案中,缓慢释放片剂由含有化合物a(31-53%)、聚羧乙烯(7-14.5%)、氧化锌(0-3%)、硬脂酸(4.5-10%)和甘露醇(3-30%)的芯材料形成;围绕芯的密封包衣;和围绕密封包衣的糖包衣。在一些实施方案中,片剂在施用第一小时后基本上零级释放包含在芯中的药物(例如化合物a)约12小时。因此,仅在第一小时内药物(例如化合物a)释放的初始激增之后才能获得零级释放。4.组合受控释放片剂
[0055]
在本文提供的其他实施方案中,化合物a如美国专利号4,610,870中所述配制,该专利公开了一种受控释放药物制剂,其接近活性药物的零级释放。在一些实施方案中,受控释放药物制剂是含有芯部分的包衣片剂,化合物a从芯部分在受控的时间长度内缓慢释放。芯还包括一种或多种水胶体胶凝剂,该水胶体胶凝剂在20℃下在2%溶液中的黏度在约10,000至约200,000厘泊范围内,如羟丙基甲基纤维素和/或甲基纤维素;一种或多种不可溶胀粘合剂和/或蜡粘合剂(其中化合物a和/或水胶体胶凝剂是不可压缩的);一种或多种惰性填充剂或赋形剂;一种或多种润滑剂和任选的一种或多种抗粘附剂,如二氧化碳和水。
[0056]
在本文提供的其他实施方案中,化合物a如美国专利号4,309,405中所述配制,该专利公开了一种类似于美国专利号4,304,404中公开的持续释放片剂,如上所述。在一些实施方案中,芯含有20至70%的化合物a和30至72%的水溶性聚合物(如羟丙基甲基纤维素或羟丙基纤维素)与非水溶性聚合物(单独的乙基纤维素或乙基纤维素与羧基聚亚甲基、羟丙基纤维素等混合)的混合物。在一些实施方案中,片剂在施用第一小时后基本上零级释放包含在芯中的药物(例如化合物a)约12小时。因此,只有在第一小时内药物(例如化合物a)的释放的初始激增之后才获得零级释放。5.化合物a片剂制剂
[0057]
本文提供了化合物a的缓释制剂,其能够在8小时到至少12小时内接近化合物a的零级或伪零级释放。在一些实施方案中,化合物a的释放超过至少8小时。在一些实施方案中,化合物a的释放超过至少12小时。在一些实施方案中,化合物a的释放超过至少12小时。
[0058]
本发明的缓释药物制剂在片剂芯内包含5%至70%的化合物a,所述片剂芯是未包衣的受控释放基质片剂或包覆有受控释放包衣系统的片剂芯。
[0059]
含有亲水性、疏水性或组合的释放控制聚合物体系的基质片剂还可以包含用于片剂的至少一种粘合剂、填料、助流剂和润滑剂,但不包含任何崩解剂以避免削弱摄入时的机械强度。在一些实施方案中,用于片剂的至少一种粘合剂、填料、助流剂和润滑剂选自:(1)羟丙基甲基纤维素等纤维素醚,(2)纤维素酯,(3)醋酸纤维素,(4)乙基纤维素,(5)聚醋酸乙烯酯,(6)基于丙烯酸乙酯和甲基丙烯酸甲酯的中性共聚物,(7)具有季铵基团的丙烯酸酯和甲基丙烯酸酯的共聚物,(8)ph不敏感的氨基甲基丙烯酸共聚物,(9)聚环氧乙烷,(10)聚乙烯吡咯烷酮,(11)黄原胶和刺槐角豆胶等天然来源的多糖,(12)聚乙二醇,(13)聚丙二
醇,(14)蓖麻油,(15)甘油三乙酸酯,(16)柠檬酸三丁酯,(17)柠檬酸三乙酯,(18)乙酰基柠檬酸三正丁酯,(19)邻苯二甲酸二乙酯,(20)癸二酸二丁酯,(21)乙酰化甘油单酯和甘油二酯及其混合物。
[0060]
在一些实施方案中,本发明的制剂由5%至70%的化合物a在亲水基质片剂中的混合物组成,所述亲水基质片剂包含一种或多种亲水释放控制聚合物,包括但不限于羟丙基甲基纤维素或hpmc(如methocel
tm
,各种分子量)、羟丙基纤维素或hpc(如各种分子量的klucel
tm
)、聚氧化乙烯(如polyox
tm
)、可溶性聚乙烯吡咯烷酮或聚维酮(如各种等级的)、交联聚丙烯酸聚合物等。在一些实施方案中,化合物a的量为10%至50%。在一些实施方案中,化合物a的量为35%至45%。在一些实施方案中,化合物a的量为约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%或约70%。在一些实施方案中,化合物a的量为约40%。
[0061]
在其他实施方案中,本发明的制剂由5%至70%的化合物a在疏水基质片剂中的混合物组成,所述疏水基质片剂包含一种或多种非水溶性释放控制聚合物,例如包括但不限于乙基纤维素(如ethocel
tm
)、醋酸羟丙甲纤维素琥珀酸酯、醋酸纤维素、醋酸丙酸纤维素、和天然蜡等。在一些实施方案中,化合物a的量为10%至50%。在一些实施方案中,化合物a的量为35%至45%。在一些实施方案中,化合物a的量为约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%或约70%。在一些实施方案中,化合物a的量为约40%。
[0062]
在其他实施方案中,本发明的制剂由5%至70%的化合物a在含有亲水聚合物和疏水聚合物的组合的单一基质中的混合物组成。在一些实施方案中,亲水释放控制聚合物是羟丙基甲基纤维素或hpmc(如methocel
tm
,各种分子量)、羟丙基纤维素或hpc(如具有各种分子量的klucel
tm
)、聚氧化乙烯(如polyox
tm
)、可溶性聚乙烯吡咯烷酮或聚维酮(如各种等级的)、交联聚丙烯酸聚合物等。在一些实施方案中,疏水释放控制聚合物是乙基纤维素(如ethocel
tm
)、醋酸羟丙甲纤维素琥珀酸酯、醋酸纤维素、醋酸丙酸纤维素、天然蜡等。在一些实施方案中,化合物a的量为10%至50%。在一些实施方案中,化合物a的量为35%至45%。在一些实施方案中,化合物a的量为约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%或约70%。在一些实施方案中,化合物a的量为约40%。
[0063]
在其他实施方案中,本发明的制剂由含有5%至70%的化合物a的速释片剂芯组成,所述片剂芯用溶解改性包衣系统包衣。在一些实施方案中,溶解改性系统在5至30重量%的非水溶性包衣材料中包含造孔剂,以控制化合物a的释放速率。在其他实施方案中,溶解改性系统是物理的,其中激光或其他方法用于在包衣片剂上产生孔,所述包衣片剂依靠渗透作用来驱动药物释放。在一些实施方案中,化合物a的量为10%至50%。在一些实施方案中,化合物a的量为35%至45%。在一些实施方案中,化合物a的量为约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%或约70%。在一些实施方案中,化合物a的量为约40%。
[0064]
在一些实施方案中,本文所述的化合物a的缓释制剂可优选在24小时内释放超过
70%的药物。在一些实施方案中,在12小时内可以释放超过70%的化合物a。
[0065]
在一些实施方案中,在向空腹的哺乳动物施用后,化合物a在药代动力学谱中的c
max
不超过3000ng/ml。在一些实施方案中,c
max
不超过4000ng/ml。在一些实施方案中,c
max
不超过5000ng/ml。
[0066]
在一些实施方案中,在向空腹的哺乳动物施用后,化合物a在药代动力学谱中的c
min
不小于400ng/ml。在一些实施方案中,c
min
不小于500ng/ml。在一些实施方案中,c
min
不小于600ng/ml。在一些实施方案中,c
min
不小于800ng/ml。
[0067]
在一些实施方案中,在向空腹的哺乳动物施用后,化合物a的血浆浓度(例如至少600ng/ml)维持超过8小时。在一些实施方案中,血浆浓度维持超过10小时。在一些实施方案中,血浆浓度维持超过12小时。在一些实施方案中,血浆浓度维持超过18小时。在一些实施方案中,血浆浓度维持超过24小时。
[0068]
在一些实施方案中,向空腹的哺乳动物施用后的药代动力学谱表明化合物a的c
max
不超过3000ng/ml,并且化合物a的血浆浓度为至少600ng/ml,持续超过8小时。在一些实施方案中,c
max
不超过3000ng/ml并且血浆浓度为至少600ng/ml,持续超过12小时。在一些实施方案中,c
max
不超过3000ng/ml并且血浆浓度为至少600ng/ml,持续超过18小时。在一些实施方案中,c
max
不超过3000ng/ml并且血浆浓度为至少600ng/ml,持续超过24小时。
[0069]
在一些实施方案中,将本文公开的组合物口服施用于哺乳动物,并且缓释的药物制剂能够实现8至至少12小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现8至至少18小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现至少8小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现至少10小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现至少12小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现至少18小时的药物释放。在一些实施方案中,缓释的药物制剂能够实现至少24小时的药物释放。制备方法
[0070]
在一些实施方案中,片剂具有圆形横截面,直径为约1/4至约1/3英寸。在一些实施方案中,片剂具有圆形横截面,直径为约1/4英寸。在一些实施方案中,片剂具有圆形横截面,直径为约1/3英寸。
[0071]
在一些实施方案中,片剂具有圆形横截面,直径为约6.35mm至约8.46mm。在一些实施方案中,片剂具有圆形横截面,直径为约6.35mm。在一些实施方案中,片剂具有圆形横截面,直径为约8.46mm。
[0072]
在一些实施方案中,口服形式具有含量均匀性(例如,对于化合物a而言)。在一些实施方案中,含量均匀性是通过国际药典(ip)、英国药典(bp)、美国药典(usp)或欧洲药典(ph.eur.)中的含量均匀性测试来测量的,它们在此各自通过引用并入。在一些实施方案中,口服形式具有小于或者小于约10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0.5%含量的相对标准偏差。在一些实施方案中,口服形式没有超出范围(例如75-125%、80-125%、85-120%、85-115%、90-120%、90-110%或95-105%含量)的值。在一些实施方案中,口服形式具有不小于或不小于约85%、90%、95%、96%、97%、98%、99%或99.5%的含量。在一些实施方案中,口服形式具有不大于或不大于约100.5%、101%、102%、103%、104%、105%、110%、115%、120%或125%的含量。
[0073]
在一些实施方案中,片剂的硬度为约5kp至约9kp。在一些实施方案中,片剂的硬度为约6kp至约8kp。在一些实施方案中,片剂的硬度为约7kp。在一些实施方案中,片剂的硬度为约8kp至约12kp。在一些实施方案中,片剂的硬度为约12kp至约18kp。在一些实施方案中,片剂的硬度为约14kp至约16kp。在一些实施方案中,片剂的硬度为约15kp。
[0074]
在一些实施方案中,片剂的芯重量为约600mg至约980mg。在一些实施方案中,片剂的芯重量为约600mg至约900mg。在一些实施方案中,片剂的芯重量为约600mg至约630mg。在一些实施方案中,片剂的芯重量为约615mg。在一些实施方案中,片剂的芯重量为约690mg至约710mg。在一些实施方案中,片剂的芯重量为约700mg。在一些实施方案中,片剂的芯重量为约740mg至约760mg。在一些实施方案中,片剂的芯重量为约750mg。在一些实施方案中,片剂的芯重量为约800mg至约830mg。在一些实施方案中,片剂的芯重量为约815mg。
[0075]
在一些实施方案中,片剂的总重量为约600mg至约980mg。在一些实施方案中,片剂的总重量为约600mg至约900mg。在一些实施方案中,片剂的总重量为约600mg至约630mg。在一些实施方案中,片剂的总重量为约615mg。在一些实施方案中,片剂的总重量为约690mg至约710mg。在一些实施方案中,片剂的总重量为约700mg。在一些实施方案中,片剂的总重量为约740mg至约760mg。在一些实施方案中,片剂的总重量为约750mg。在一些实施方案中,片剂的总重量为约840mg至约860mg。在一些实施方案中,片剂的总重量为约850mg。在一些实施方案中,片剂的总重量为约790mg至约810mg。在一些实施方案中,片剂的总重量为约800mg。
[0076]
在一些实施方案中,片剂的化合物a的量为约200mg至约350mg。在一些实施方案中,片剂的化合物a的量为约250mg至约300mg。在一些实施方案中,片剂的化合物a的量为约200mg。在一些实施方案中,片剂的化合物a的量为约250mg。在一些实施方案中,片剂的化合物a的量为约300mg。
[0077]
在一些实施方案中,片剂的化合物a的量为约5%至约70重量%。在一些实施方案中,片剂的化合物a的量为约10%至约50重量%。在一些实施方案中,片剂的化合物a的量为约35%至约45重量%。在一些实施方案中,片剂的化合物a的量为约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%或约70重量%。在一些实施方案中,片剂的化合物a的量为约40重量%。在一些实施方案中,片剂的化合物a的量为约39重量%。在一些实施方案中,片剂的化合物a的量为约39.6重量%。在一些实施方案中,片剂的化合物a的量为约42.4重量%。在一些实施方案中,片剂的化合物a的量为约35.7重量%。在一些实施方案中,片剂的化合物a的量为约37.5重量%。
[0078]
在一些实施方案中,本文提供了通过以下方法制备的药物组合物,所述方法包括:使混合物固化以形成组合物,所述混合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐、溶剂化物和水合物、第一赋形剂和第二赋形剂。
[0079]
在一些实施方案中,第一赋形剂选自亲水性释放控制聚合物,如羟丙基甲基纤维素或hpmc(如methocel
tm
,各种分子量)、羟丙基纤维素或hpc(如具有各种分子量的klucel
tm
)、聚氧化乙烯(如polyox
tm
)、可溶性聚乙烯吡咯烷酮或聚维酮(如各种等级的)、交联聚丙烯酸聚合物等。
[0080]
在一些实施方案中,第一赋形剂选自羟丙基纤维素或hpc(如klucel
tm hxf或exf)、交联聚丙烯酸聚合物(如71g nf)或羟丙基甲基纤维素或hpmc(如methocel
tm k100m)。
[0081]
在其他实施方案中,第一赋形剂选自疏水释放控制聚合物,如乙基纤维素(如ethocel
tm
)、醋酸羟丙甲纤维素琥珀酸酯、醋酸纤维素、醋酸丙酸纤维素、和天然蜡等。
[0082]
在一些实施方案中,第一赋形剂选自(如rlpo)或乙基纤维素(如ethocel
tm 10cp)。
[0083]
在其他实施方案中,第一赋形剂选自亲水性释放控制聚合物,如羟丙基甲基纤维素或hpmc(如methocel
tm
,各种分子量)、羟丙基纤维素或hpc(如具有各种分子量的klucel
tm
)、聚氧化乙烯(如polyox
tm
)、可溶性聚乙烯吡咯烷酮或聚维酮(如各种等级的)、交联聚丙烯酸聚合物等;第二赋形剂选自疏水性释放控制聚合物,如乙基纤维素(如ethocel
tm
)、醋酸羟丙甲纤维素琥珀酸酯、醋酸纤维素、醋酸丙酸纤维素、和天然蜡等。
[0084]
在一些实施方案中,释放速率是于37℃
±
0.5℃的温度在500ml的ph为6.8的水性介质中使用usp设备1(篮式)以100rpm测定的释放速率。在一些实施方案中,释放速率是于37℃
±
0.5℃的温度在900ml的ph为6.8的水性介质中使用usp设备1(篮式)以100rpm测定的释放速率。
[0085]
在一些实施方案中,释放速率是于37℃
±
0.5℃的温度在500ml的包括浓度为0.05m的磷酸钠的水性介质中使用usp设备1(篮式)以100rpm测定的释放速率。在一些实施方案中,释放速率是于温度为37℃
±
0.5℃的温度在900ml的包括浓度为0.05m的磷酸钠的水性介质中使用usp设备1(篮式)以100rpm测定的释放速率。
[0086]
例如,美国药典公约(united states pharmacopeia convention),2012年2月1日,第《711》章(“溶解度”)中描述了usp设备1(篮式),该文献在此通过引用整体并入本文。参见http://www.usp.org/sites/default/files/usp_pdf/en/uspnf/revisions/m99470-gc_711.pdf。usp装置1(篮式)组件由以下部分组成:容器,可被覆盖,由玻璃或其他惰性透明材料制成;马达;金属驱动轴;和圆柱形篮。所述材料不应吸附、反应或干扰被测样本。将容器部分浸入任意合适尺寸的适宜水浴中,或者通过加热夹套等合适的装置进行加热。水浴或加热装置在测试期间使容器内的温度保持在37
±
0.5
°
,并保持浴液恒定、平稳地运动。由于搅拌元件是平稳旋转的,所以组件中的任何部分(包括组件所在的环境)都不会产生明显的运动、搅动或振动。优选允许在测试期间观察样本和搅拌元件的设备。容器为圆柱形,底部为半球形,具有以下尺寸和容量之一:标称容量为1l时,高度为160mm至210mm,内径为98mm至106mm;标称容量为2l时,高度为280mm至300mm,内径为98mm至106mm;标称容量为4l时,高度为280mm至300mm,内径为145mm至155mm。其侧面在顶部具有法兰。可以使用合适的盖子来延缓蒸发。如果使用盖子,其就提供了足够的开口,以随时插入温度计和取出样本。确定轴的位置以使其轴线在任何点距容器垂直轴的距离不超过2mm,并且旋转平稳,而没有影响结果的明显摆动。叶片的垂直中心线穿过轴的轴线,以使叶片的底部与轴的底部齐平。
测试期间,叶片底部与容器内底之间的距离保持在25
±
2mm。金属的或适当惰性的、刚性叶片和轴包括单个实体。如果组件在测试期间保持牢固接合,则可以使用合适的两部分可拆卸设计。
[0087]
使用允许选择轴转速并将其保持在
±
4%以内的指定速率的调速装置。搅拌元件的轴和篮式组件由316型不锈钢或其他惰性材料制成。可以使用具有约0.0001英寸(2.5μm)厚的金涂层的篮子。在每次测试开始时,将剂量单位置于干燥的篮子中。在测试期间,容器内底和篮子底部之间的距离保持在25
±
2mm。
[0088]
例如,美国药典公约,2012年2月1日,第《711》章(“溶解度”)中描述了usp装置2(桨式装置),该文献在此通过引用整体并入本文。参见http://www.usp.org/sites/default/files/usp_pdf/en/uspnf/revisions/m99470-gc_711.pdf。使用来自设备1的组件,不同之处在于由叶片和轴形成的桨用作搅拌元件。确定轴的位置以使其轴线与容器的垂直轴线在任何点的距离不超过2mm,并且旋转平稳,而没有影响结果的明显摆动。叶片的垂直中心线穿过轴的轴线,以使叶片的底部与轴的底部齐平。测试期间,叶片底部与容器内底之间的距离保持在25
±
2mm。金属的或适当惰性的、刚性叶片和轴包括单个实体。如果组件在测试期间保持牢固接合,则可以使用合适的两部分可拆卸设计。桨叶和轴可以涂覆有合适的涂层以使它们成为惰性的。在叶片开始旋转之前,允许剂量单位下沉到容器底部。可以将一小块松散的非反应性材料(如不超过几圈螺旋线)连接至剂量单位(否则其会漂浮)。可以使用其他经过验证的沉降片装置。
[0089]
如果将水或ph小于6.8的指定速率介质指定为介质,可以使用相同的介质并添加纯化的胃蛋白酶,从而每1000ml可产生750,000单位或更少的活性。对于ph为6.8或更高的培养基,可以添加胰酶以使每1000ml产生不超过1750usp单位的蛋白酶活性。
[0090]
可以使用本领域技术人员熟知的技术将本文提供的化合物或组合物配制成药物组合物。除本文提及的那些之外,合适的药学上可接受的载体是本领域已知的;例如,参见remington,the science and practice of pharmacy,第20版,2000,lippincott williams&wilkins,(编辑:gennaro等人)。
[0091]
本文所述的某些化合物可以是不对称的(例如,具有一个或多个立体中心)。除非另有说明,否则所有立体异构体,如对映异构体和非对映异构体都是预期的。含有不对称取代的碳原子的本发明化合物可以以光学活性或外消旋形式分离。关于如何由光学活性起始材料制备光学活性形式的方法是本领域已知的,如通过外消旋混合物的拆分或通过立体选择性合成。
[0092]
化合物的外消旋混合物的拆分可以通过本领域已知的多种方法中的任何一种来进行。示例性方法包括使用“手性拆分酸”进行的分级重结晶(例如,非对映体盐拆分),所述手性拆分酸是光学活性的成盐有机酸。用于分级重结晶法的合适拆分剂是例如光学活性酸,如酒石酸、二乙酰酒石酸、二苯甲酰基酒石酸、扁桃酸、苹果酸、乳酸或各种光学活性樟脑磺酸(如β-樟脑磺酸)的d和l形式。适用于分级结晶法的其他拆分剂包括立体异构纯形式的β-甲基苄胺(例如,s和r形式,或非对映异构纯形式)、2-苯基甘氨醇、去甲麻黄碱、麻黄碱、n-甲基麻黄碱、环己基乙胺、1,2-二氨基环己烷等。
[0093]
外消旋混合物的拆分也可以通过在装有光学活性拆分剂(例如,二硝基苯甲酰基苯基甘氨酸)的色谱柱上洗脱来进行。合适的洗脱溶剂组成可以由本领域技术人员确定。
[0094]
本文所述的化合物还可以出现在中间体或最终化合物中出现的所有原子同位素。同位素包括原子序数相同但质量数不同的原子。例如,氢的同位素包括氚和氘。
[0095]
本文所述的化合物还可以包括互变异构形式,如酮-烯醇互变异构体。互变异构形式可以通过适当的取代处于平衡状态或空间锁定为一种形式。
[0096]
应当理解,为清楚起见,在不同的实施方案的上下文中描述的本文公开的某些特征也可以在单个实施方案中组合提供。相反地,为简洁起见,在单个实施方案的上下文中描述的各种特征也可以单独提供或以任何合适的子组合提供。适应症和治疗方法
[0097]
本文公开的组合物可用于治疗与调节蛋白激酶活性(例如pkcβ活性)相关的疾病和病症,以及改善其症状。因此,本发明的一些实施方案涉及一种通过使蛋白激酶与根据本文所述的任何实施方案的组合物接触来调节pkcβ活性的方法。
[0098]
在一些实施方案中,本文提供了一种用于治疗个体中蛋白激酶(例如pkcβ)介导的病症的方法,包括向有需要的个体施用根据本文任何实施方案所述的组合物。
[0099]
在一些实施方案中,本文提供了一种根据本文任何实施方案所述的组合物,其可用于通过疗法治疗人体或动物体的方法中。
[0100]
在一些实施方案中,本文提供了一种根据本文任何实施方案所述的组合物,其可用于调节蛋白激酶(例如pkcβ)活性的方法中。
[0101]
在一些实施方案中,本文提供了一种根据本文任何实施方案所述的组合物,其可用于抑制pkcβ的方法中。
[0102]
在一些实施方案中,本文提供了一种根据本文任何实施方案所述的组合物,其可用于治疗pkcβ介导的病症的方法。
[0103]
本文公开的组合物可用于治疗与调节蛋白激酶(例如,pkcβ)活性相关的其他疾病和病症,以及改善其症状,但不限于此,该疾病和病症包括以下:1.癌症血液恶性肿瘤
[0104]
血液恶性肿瘤是影响血液和淋巴系统的癌症。癌症可始于造血组织(例如,骨髓)或免疫系统细胞。在一些实施方案中,血液恶性肿瘤是白血病、非霍奇金淋巴瘤(nhl)、霍奇金淋巴瘤或多发性骨髓瘤。血液恶性肿瘤可起源于淋巴组织(例如,淋巴瘤)或骨髓(例如,白血病和骨髓瘤),并且都涉及淋巴细胞或白细胞的不受控制的生长。
[0105]
恶性淋巴瘤是主要存在于淋巴组织内的细胞的致瘤性转化。两类恶性淋巴瘤是霍奇金淋巴瘤和非霍奇金淋巴瘤(nhl)。两种类型的淋巴瘤均浸润网状内皮组织。然而,它们在起源的癌细胞、疾病部位、全身症状的存在和对治疗的反应方面有所不同。非霍奇金淋巴瘤(nhl)是一类多样化的恶性肿瘤,其主要起源于b细胞。nhl可发生在与淋巴系统相关的任何器官中,如脾脏、淋巴结或扁桃体,并且可发生在任何年龄。nhl通常以淋巴结肿大、发烧和体重减轻为特征。nhl分为b细胞或t细胞nhl。尽管化疗可诱导大多数惰性淋巴瘤的缓解,但治愈很少,大多数患者最终会复发,需要进一步治疗。
[0106]
b细胞nhl的非限制性列表包括伯基特淋巴瘤(例如,地方性伯基特淋巴瘤和散发性伯基特淋巴瘤)、皮肤b细胞淋巴瘤、皮肤边缘区淋巴瘤(mzl)、弥漫性大细胞淋巴瘤(dlbcl)、弥漫性混合小细胞和大细胞淋巴瘤、弥漫性小裂细胞、弥漫性小淋巴细胞淋巴瘤、
结外边缘区b细胞淋巴瘤、滤泡性淋巴瘤、滤泡性小裂细胞(1级)、滤泡性混合小裂细胞和大细胞(2级)、滤泡性大细胞(3级)、血管内大b细胞淋巴瘤、血管内淋巴瘤、大细胞免疫母细胞淋巴瘤、大细胞淋巴瘤(lcl)、淋巴母细胞淋巴瘤、malt淋巴瘤、套细胞淋巴瘤(mcl)、免疫母细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、套细胞淋巴瘤、慢性淋巴细胞白血病(cll)/小淋巴细胞淋巴瘤(sll)、结外边缘区b细胞淋巴瘤-黏膜相关淋巴组织(malt)淋巴瘤、纵隔大b细胞淋巴瘤、结边缘区b细胞淋巴瘤、脾边缘区b细胞淋巴瘤、原发性纵隔b细胞淋巴瘤、淋巴浆细胞淋巴瘤、毛细胞白血病、原发性巨球蛋白血症和原发性中枢神经系统(cns)淋巴瘤。其他非霍奇金淋巴瘤也考虑在本发明的范围内,并且对本领域普通技术人员而言是显而易见的。
[0107]
一些患者在针对血液恶性肿瘤的初始治疗后得到了缓解(没有体征和症状)。然而,其他患者即使在强化治疗后仍残留有癌细胞。
[0108]
在一些实施方案中,个体患有在治疗性治疗后复发的血液恶性肿瘤。在一些实施方案中,血液恶性肿瘤对治疗性治疗具有抗性。在一些实施方案中,血液恶性肿瘤对治疗性治疗具有原发性抗性。在一些实施方案中,血液恶性肿瘤对治疗性治疗具有继发性或获得性抗性。在一些实施方案中,血液恶性肿瘤对btk抑制剂治疗具有原发性抗性。在一些实施方案中,血液恶性肿瘤对依鲁替尼治疗具有原发性抗性。在一些实施方案中,血液恶性肿瘤对btk抑制剂治疗具有获得性抗性。在一些实施方案中,血液恶性肿瘤对依鲁替尼治疗具有获得性抗性。在一些实施方案中,用btk抑制剂治疗血液恶性肿瘤是不适宜的或者有其他禁忌。在一些实施方案中,用依鲁替尼治疗血液恶性肿瘤是不适宜的或者有其他禁忌。
[0109]
在一些实施方案中,本文公开了治疗有需要的个体中的血液恶性肿瘤的方法,包括向个体施用缓释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐。在一些实施方案中,本文公开了治疗有需要的个体中的血液恶性肿瘤的方法,包括向个体施用控释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐。在一些实施方案中,本文公开了治疗有需要的个体中的血液恶性肿瘤的方法,包括向个体施用非速释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐。在一些实施方案中,该方法还包括施用btk抑制剂。在一些实施方案中,该方法还包括施用依鲁替尼。dlbcl
[0110]
弥漫性大b细胞淋巴瘤(dlbcl)是西方国家中最常见的侵袭性淋巴瘤亚型,占非霍奇金淋巴瘤(nhl)新病例的约30%。基因测试表明,dlbcl有不同的亚型。这些亚型似乎具有不同的前景(预后)和对治疗的反应。可以区分dlbcl的至少3种分子亚型:生发中心b细胞样(gcb)dlbcl、活化b细胞样(abc)dlbcl和原发性纵隔b细胞淋巴瘤(pmbl)。dlbcl可影响任何年龄组,但主要发生于老年人(平均年龄为60多岁)。
[0111]
dlbcl的abc亚型(abc-dlbcl)占dlbcl诊断总数的约30%。它被认为是dlbcl分子亚型中最难治愈的,因此,与患有其他类型dlcbl的个体相比,诊断患有abc-dlbcl的患者的
生存率通常显著降低。abc-dlbcl最常与使生发中心主调节因子bcl6失调的染色体易位和使prdm1基因失活的突变相关,该prdm1基因编码浆细胞分化所需的转录抑制因子。
[0112]
abc-dlbcl发病机制中一个特别相关的信号通路是由核因子(nf)-κb转录复合物介导的信号通路。nf-κb家族包含5个成员(p50、p52、p65、c-rel和relb),它们形成同源和异源二聚体,并作为转录因子介导各种增殖、凋亡、炎症和免疫反应,对正常b细胞发育和存活至关重要。nf-κb被真核细胞广泛用作控制细胞增殖和细胞存活的基因的调节剂。因此,许多不同类型的人类肿瘤都对nf-κb进行了误调节:也就是说,nf-κb是组成型激活的。活性nf-κb开启基因的表达,这使细胞保持增殖并保护细胞免受可能导致其通过细胞凋亡而死亡的条件。
[0113]
abcdlbcl对nf-kb的依赖性取决于ikb激酶上游的信号通路,所述ikb激酶由card11、bcl10和malt1组成(cbm复合物)。干扰cbm通路可消除abcdlbcl细胞中的nf-kb信号传导并诱导细胞凋亡。nf-kb通路的组成型活性的分子基础是当前研究的主题,但abcdlbcl基因组的一些体细胞改变清楚地调用了该通路。例如,dlbcl中card11的卷曲螺旋结构域的体细胞突变使这种信号传导支架蛋白能够自发地与malt1和bcl10进行核蛋白-蛋白相互作用,从而导致ikk活性和nf-kb激活。b细胞受体信号通路的组成型活性与野生型card11的abcdlbcl中nf-kb的激活有关,这与b细胞受体亚基cd79a和cd79b的胞质尾区的突变有关。信号传导接头myd88中的致癌激活突变可激活nf-kb,并与b细胞受体信号传导协同以维持abcdlbcl细胞的存活。此外,nf-kb通路的负调节因子a20的失活突变几乎仅发生在abcdlbcl中。
[0114]
事实上,最近在超过50%的abc-dlbcl患者中发现了影响nf-κb信号通路多个成分的遗传改变,其中这些病变促进组成性nf-κb激活,从而导致淋巴瘤生长。这些包括card11的突变(约10%的病例),这是一种淋巴细胞特异性细胞质支架蛋白—与malt1和bcl10一起—形成bcr信号体,其将来自抗原受体的信号传递给nf-κb激活的下游介质。更大比例的病例(约30%)携带双等位基因病变,使负向nf-κb调节因子a20失活。此外,已在abc-dlbcl肿瘤样品中观察到高水平的nf-κb靶基因表达。
[0115]
在一些实施方案中,本文公开了治疗有需要的个体中的dlbcl的方法,其包括向个体施用缓释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐。在一些实施方案中,dlbcl是abc-dlbcl。在一些实施方案中,该方法还包括施用btk抑制剂。在一些实施方案中,该方法还包括施用依鲁替尼。在一些实施方案中,该方法进一步包括施用依鲁替尼、来那度胺和cd20抗体。在一些实施方案中,该方法进一步包括施用来那度胺和cd20抗体。滤泡性淋巴瘤
[0116]
如本文所用,术语“滤泡性淋巴瘤”是指几种类型的非霍奇金淋巴瘤中的任意一种,其中淋巴瘤细胞聚集成结节或滤泡。使用术语滤泡是因为细胞倾向于在淋巴结中以圆形或结节状生长。这种淋巴瘤患者的平均年龄为约60岁。滤泡性淋巴瘤是一种b细胞淋巴瘤,是最常见的惰性(生长缓慢)形式的nhl,占所有nhl的约20%至30%。cll/sll
[0117]
慢性淋巴细胞白血病和小淋巴细胞淋巴瘤(cll/sll)通常被认为是相同的疾病,
但具有略不同的临床表现。癌细胞聚集的位置决定了它被称为cll还是sll。当癌细胞主要存在于淋巴结时,称为sll。sll占所有淋巴瘤的约5%至10%。当大多数癌细胞在血液和骨髓时,它被称为cll。
[0118]
cll和sll往往都是缓慢生长的疾病,尽管cll更为常见。cll和sll以相同的方式进行处理。通常认为它们不能通过标准治疗治愈,但是根据疾病的阶段和生长速度,大多数患者的寿命都会超过10年。偶尔随着时间的推移,这些生长缓慢的淋巴瘤可转变为更具侵袭性的淋巴瘤类型。
[0119]
慢性淋巴性白血病(cll)是最常见的白血病类型。cll是一种克隆b细胞的淋巴恶性肿瘤,通常表现出b细胞受体(bcr)信号通路的异常激活。
[0120]
小淋巴细胞白血病(sll)与上文所述的cll非常相似,并且也是一种b细胞癌症。在sll中,异常淋巴细胞主要影响淋巴结。然而,在cll中,异常细胞主要影响血液和骨髓。脾脏在这两种情况下都可受到影响。sll占所有非霍奇金淋巴瘤病例的约1/25。它可以在从青年到老年的任何时间发生,但在50岁以下很少见。sll被认为是一种惰性淋巴瘤。这意味着疾病进展非常缓慢,并且患者在确诊后往往活很多年。然而,大多数患者被诊断为晚期疾病,虽然sll对各种化疗药物反应良好,但通常被认为是无法治愈的。尽管某些癌症往往更频繁地发生在一种性别或另一种性别中,但由于sll引起的病例和死亡人数在男性和女性之间平均分配。确诊时的平均年龄为60岁。
[0121]
虽然sll是惰性的,但它是持续发展的。该疾病的常见模式是对放射疗法和/或化学疗法的高反应率,具有一段时间的疾病缓解期。几个月或几年后,不可避免的复发。再治疗再次导致反应,但疾病会再次复发。这意味着虽然sll的短期预后相当好,但随着时间的推移,许多患者会出现复发性疾病的致命并发症。考虑到通常被诊断患有cll和sll的个体的年龄,本领域需要一种简单有效的疾病治疗,同时具有最小的副作用,不会影响患者的生活质量。本发明满足了本领域中这种长期存在的需要。套细胞淋巴瘤
[0122]
如本文所用,术语“套细胞淋巴瘤”是指b细胞淋巴瘤的亚型,这是由于围绕正常生发中心滤泡的套区的cd5阳性抗原初生前生发中心b细胞所致。由于dna中的t(11:14)染色体易位,mcl细胞通常过度表达细胞周期蛋白d1。男性最常受到影响。患者的平均年龄在60岁出头。淋巴瘤在确诊时通常分布广泛,包括淋巴结、骨髓,而且通常还包括脾脏。套细胞淋巴瘤不是一种生长速度非常快的淋巴瘤,但难以治疗。边缘区b细胞淋巴瘤
[0123]
如本文所用,术语“边缘区b细胞淋巴瘤”是指一组相关的b细胞肿瘤,其涉及边缘区中的淋巴组织,即滤泡套区外的斑片状区域。边缘区淋巴瘤占淋巴瘤的约5%至10%。这些淋巴瘤中的细胞在显微镜下看起来很小。边缘区淋巴瘤具有3种主要类型,包括结外边缘区b细胞淋巴瘤、淋巴结边缘区b细胞淋巴瘤和脾边缘区淋巴瘤。malt
[0124]
如本文所用,术语“粘膜相关淋巴组织(malt)淋巴瘤”是指边缘区淋巴瘤的结外临床表现。大多数malt淋巴瘤是低级别的,尽管少数最初表现为中级别非霍奇金淋巴瘤(nhl)或从低级别发展而来。大多数malt淋巴瘤发生在胃部,大约70%的胃部malt淋巴瘤与幽门螺杆菌感染有关。已经确定了几种细胞遗传学异常,最常见的是3号染色体三体或t(11;
18)。多种其他malt淋巴瘤也与细菌或病毒感染有关。malt淋巴瘤患者的平均年龄约为60岁。淋巴结边缘区b细胞淋巴瘤
[0125]
术语“淋巴结边缘区b细胞淋巴瘤”是指主要在淋巴结中发现的惰性b细胞淋巴瘤。该疾病很罕见,仅占所有非霍奇金淋巴瘤(nhl)的1%。它最常在老年患者中被诊断出来,其中女性比男性更容易患病。该疾病被归类为边缘区淋巴瘤,因为突变发生在b细胞的边缘区。由于其局限在淋巴结中,这种疾病也被归类为淋巴结。脾边缘区b细胞淋巴瘤
[0126]
术语“脾边缘区b细胞淋巴瘤”是指纳入世界卫生组织分类的特定低级别小b细胞淋巴瘤。特征是脾肿大、中度淋巴细胞增多伴绒毛形态、各种器官(尤其是骨髓)的窦道内侵润模式,以及相对惰性的病程。在少数患者中观察到随着急变形式的增加和攻击行为的增加的肿瘤进展。分子和细胞遗传学研究显示异质性结果,可能是由于缺乏标准化的诊断标准。伯基特淋巴瘤
[0127]
术语“伯基特淋巴瘤”是指通常影响儿童的非霍奇金淋巴瘤(nhl)的类型。它是一种高度侵袭性的b细胞淋巴瘤,通常开始于并且涉及淋巴结以外的身体部位。尽管伯基特淋巴瘤具有快速生长的性质,但它通常可以通过现代强化疗法治愈。伯基特淋巴瘤有两种广泛的类型—散发性的和地方性的:
[0128]
地方性伯基特淋巴瘤:该病涉及儿童多于成人,并且在95%的病例中与爱泼斯坦巴尔病毒(ebv)感染有关。它主要发生在赤道非洲,其中约一半的儿童癌症是伯基特淋巴瘤。其特征在于很有可能涉及颚骨,这是在散发性伯基特淋巴瘤罕见的相当不同的特征。它通常还涉及腹部。
[0129]
散发性伯基特淋巴瘤:影响世界其他地区(包括欧洲和美洲)的伯基特淋巴瘤类型是散发型。本文中,它主要是儿童疾病。爱泼斯坦巴尔病毒(ebv)之间的联系并不像地方性病毒那样密切,尽管有五分之一的患者存在ebv感染的直接证据。除淋巴结侵润之外,超过90%的儿童的腹部受到明显影响。骨髓侵润比散发的更常见。华氏巨球蛋白血症
[0130]
术语“华氏巨球蛋白血症”,也称为淋巴浆细胞淋巴瘤,是涉及称为淋巴细胞的白细胞亚型的癌症。它的特征是终末分化的b淋巴细胞不受控制的克隆增殖。它的特征还在于淋巴瘤细胞会产生一种称为免疫球蛋白m(igm)的抗体。igm抗体在血液中大量循环,并导致血液中的液体部分变稠,就像糖浆一样。这会导致流向许多器官的血流量减少,从而导致视力问题(因为眼睛后部的血管循环不良)和大脑内血液流动不良导致的神经系统问题(如头痛、头晕和意识模糊)。其他症状可包括感到疲倦和虚弱,以及容易流血的倾向。潜在病因尚不完全清楚,但已确定许多风险因素,包括6号染色体上的基因座6p21.3。有自身免疫性疾病个人病史的具有自身抗体的人患wm的风险增加2至3倍,尤其是与肝炎、人类免疫缺陷病毒和立克次体病相关的风险升高。多发性骨髓瘤
[0131]
多发性骨髓瘤是一种称为浆细胞的白细胞癌症。浆细胞是一种b细胞,是免疫系统的重要组成部分,负责在人类和其他脊椎动物体内产生抗体。它们在骨髓中产生并通过淋
巴系统运输。当浆细胞癌变并失去控制时,它们会产生称为浆细胞瘤的肿瘤。这些肿瘤通常在骨骼中发育,但在其他组织中也很少发现。当浆细胞瘤开始于其他组织(如肺或其他器官)时,称为髓外浆细胞瘤。只有单个浆细胞肿瘤的个体具有分离的(或孤立的)浆细胞瘤。患有多个浆细胞瘤的个体患有多发性骨髓瘤。白血病
[0132]
白血病是一种血液或骨髓的癌症,其特征是血细胞异常增加,通常是白细胞(白血细胞)。白血病是涵盖一系列疾病的广义术语。第一种区分是急性和慢性形式:(i)急性白血病的特征是未成熟血细胞的快速增加。这种簇拥使骨髓无法产生健康的血细胞。由于恶性细胞的快速发展和积累,急性白血病需要立即治疗,所述恶性细胞会溢出到血液中并扩散到身体的其他器官。急性白血病是儿童中最常见的白血病;(ii)慢性白血病的特点是相对成熟但仍然异常的白细胞过度积聚。通常需要数月或数年进展,细胞的产生速度比正常细胞高得多,导致血液中出现许多异常的白细胞。慢性白血病主要发生在老年人身上,但理论上可以发生在任何年龄组。此外,疾病根据受影响的血细胞类型进行细分。这种划分将白血病分为成淋巴母细胞或淋巴细胞白血病和髓性或髓性白血病:(i)淋巴母细胞或淋巴细胞白血病,癌变发生在一种通常继续形成淋巴细胞的骨髓细胞中,所述淋巴细胞是抗感染的免疫系统细胞;(ii)髓性或髓性白血病,癌变发生在一种骨髓细胞中,所述骨髓细胞通常继续形成红细胞、一些其他类型的白细胞和血小板。
[0133]
在这些主要的类别中,有几个子类别,包括但不限于急性淋巴母细胞白血病(all)、急性髓性白血病(aml)、慢性髓性白血病(cml)和慢性淋巴母细胞白血病(cll)。aml
[0134]
急性髓性白血病(aml),也称为急性髓性白血病、急性成髓细胞性白血病、急性粒细胞性白血病或急性非淋巴细胞性白血病,是一种快速生长的血液和骨髓癌症。尽管总体上aml是一种相对罕见的疾病,但它是影响成人的最常见的急性白血病。aml发生在骨髓开始产生原始细胞时,即尚未完全成熟的细胞。这些原始细胞通常会发育成白细胞。然而,在aml中,这些细胞不会发育,也无法抵御感染。在aml中,骨髓还可产生异常的红细胞和血小板。这些异常细胞的数量迅速增加,异常(白血病)细胞开始排挤身体所需的正常白细胞、红细胞和血小板。
[0135]
将aml与其他主要形式的白血病区分开来的主要因素之一是它具有八种不同的亚型,这些亚型基于白血病由其发展而来的细胞。急性髓性白血病的类型包括:成髓细胞(m0)-特定分析;成髓细胞(m1)-未成熟;成髓细胞(m2)-成熟;早幼粒细胞(m3);髓单核细胞(m4);单核细胞(m5);红白血病(m6);和巨核细胞(m7)。体外研究表明,骨髓间充质基质细胞(bm-msc)可保护aml原始细胞免于自发和化疗诱导的细胞凋亡(a.m.abdul-azizm等人,cancer res(2017)77(2):303-311)。abdul-azizm等人报告了巨噬细胞抑制因子(mif)诱导的基质pkcβ/il8是人类aml基质支持的基本特征。作者证明pkcβ的药理学抑制可抑制mif诱导的bm-msc中的il8诱导。这些结果表明,aml原始细胞和bm-msc之间存在双向的促存活机制,并且这种机制被pkcβ的抑制阻断。
[0136]
bcl2是一种与b细胞淋巴瘤中常见的t(14,18)易位相关的细胞癌基因产物。然而,单独的bcl2表达水平并不总是与诊断患有aml的患者预后不良相关。bcl2的磷酸化状态会影响bcl2的活性。pkcα和细胞外信号相关激酶(erk)已被确定为促进存活的bcl2激酶。还已
证明bcl2在所测试的近一半患者aml原始细胞中被磷酸化。此外,bcl2在激活的pkcα和erk的aml原始细胞中总是被磷酸化,但在缺乏这两种激活激酶的细胞中从未被磷酸化。与表达未磷酸化bcl2的原始细胞的患者相比,表达磷酸化bcl2的原始细胞的aml患者的总生存期较短(尤其是当pkcα活性时)。与没有磷酸化pkc的患者相比,具有活性pkcα的aml患者的生存期较短,并且在pkcα和bcl2被磷酸化的患者中似乎最短。bcl2和pkcα激活上调的患者通常表现出最差的临床结果。已经表明,pkc抑制剂恩扎妥林可促进aml衍生细胞系和新确诊或复发性aml患者衍生的原始细胞的凋亡。这种效应不是由于pkcβ的抑制,而是与pkcα抑制相关。
[0137]
在一些实施方案中,本文描述了在有需要的对象中治疗aml的方法,所述方法包括向个体施用缓释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a)或其药学上可接受的盐。在一些实施方案中,该方法还包括施用blc2抑制剂。
[0138]
已经证明pkcβ以及pkcα抑制可在髓性恶性肿瘤中发挥重要作用。li等人(leukemia&lymphoma(2011),52(7):1312-1320)表明,pkcβ信号传导在人类cml细胞系k562中上调,并且pkcβ抑制以时间和剂量依赖性方式抑制k562细胞增殖。由于pkcβ抑制剂(一种新型双吲哚马来酰亚胺衍生物wk234)通过抑制pkcβ信号通路来延缓细胞增殖并诱导细胞凋亡,因此抑制pkcβ可为治疗cml的有希望的方法。此外,dufies等人(oncotarget 2011;2:874-885)提供了支持证据,表明axl上调是cml细胞对伊马替尼(imatinib)耐性的原因,并且是伊马替尼耐性的标志。作者证明,axl的这种上调需要pkcα和pkcβ。因此,抑制pkcα和pkcβ可为治疗伊马替尼耐性的cml患者的可能机制。
[0139]
在与急性淋巴母细胞白血病(all)相关的研究中,saba等人(leukemia&lymphoma,2011;52(5):877-886)发现pkcβ抑制剂治疗导致在所测试的所有五种all细胞系中的剂量相关性减少。
[0140]
在一些实施方案中,本文描述了一种在有需要的对象中治疗白血病的方法,所述方法包括向个体施用缓释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a),或其药学上可接受的盐,其中所述白血病选自急性淋巴母细胞白血病(all)、急性髓性白血病(aml)、慢性髓性白血病(cml)或慢性淋巴母细胞白血病(cll)。t细胞淋巴瘤
[0141]
在美国,t细胞淋巴瘤占非霍奇金淋巴瘤的比例少于15%。t细胞淋巴瘤有多种类型,但都相当罕见。前体t淋巴母细胞淋巴瘤/白血病
[0142]
前体t淋巴母细胞淋巴瘤/白血病占所有淋巴瘤的约1%。它可以被认为是淋巴瘤或白血病,具体取决于涉及多少骨髓(白血病有更多的骨髓侵润)。癌细胞是中小型的未成熟t细胞。
[0143]
前体t淋巴母细胞淋巴瘤通常始于胸腺,在胸腺中产生许多t细胞。患者通常是青年,其中男性比女性更容易患病。前体t淋巴母细胞淋巴瘤生长迅速,但如果癌症尚未扩散
到骨髓,则化疗后的预后良好。这种疾病的淋巴瘤形式通常以与白血病相同的方式进行治疗。外周t细胞淋巴瘤
[0144]
外周t细胞淋巴瘤(ptcl)是罕见的在成熟白细胞中发展的侵袭性非霍奇金淋巴瘤(nhl)。ptcl通常影响60岁及以上的人群,男性的确诊率略高于女性。
[0145]
皮肤t细胞淋巴瘤(蕈样真菌病、塞扎里综合征等)始于皮肤。皮肤淋巴瘤占所有淋巴瘤的约5%。
[0146]
成人t细胞淋巴母细胞白血病/淋巴瘤通常是由感染称为htlv-1的病毒引起的。这种疾病在美国很少见,而在日本、加勒比地区和非洲部分地区更为常见—htlv-1病毒在这些地区更为常见。有4种亚型:郁积型、慢性型、急性型和淋巴瘤型。
[0147]
郁积亚型在血液中具有异常的t细胞,而血液中的淋巴细胞数量没有增加。这种淋巴瘤可侵润皮肤或肺部,但不侵润其他组织。郁积型生长缓慢,预后良好。
[0148]
慢性亚型也生长缓慢,预后良好。它增加了血液中的总淋巴细胞和t细胞。它可侵润皮肤、肺、淋巴结、肝脏和/或脾脏,但不侵润其他组织。
[0149]
急性亚型类似于急性白血病。它具有高淋巴细胞和t细胞计数,通常伴有淋巴结、肝脏和脾脏肿大。皮肤和其他器官也可与淋巴瘤有关。患者经常发烧、盗汗和/或体重减轻,以及某些异常的血液检查结果。
[0150]
淋巴瘤亚型比慢性型和郁积型生长得更快,但不如急性型快。它有淋巴结肿大,而血液中的淋巴细胞数量没有增加,t细胞计数不高。
[0151]
血管免疫母细胞性t细胞淋巴瘤(aitl)占所有nhl病例的1-2%,通常遵循侵袭性过程。aitl在老年人中更常见。aitl往往侵染淋巴结以及脾脏或肝脏,可导致其肿大。患者通常有发烧、体重减轻和皮疹,并经常发生感染。这种淋巴瘤通常进展迅速。治疗通常最初有效,但淋巴瘤往往会复发。
[0152]
结外鼻自然杀伤/t细胞淋巴瘤是一种罕见的淋巴瘤,通常侵润上呼吸道通道,如鼻子和上咽喉,但它还可侵入皮肤和消化道。这种淋巴瘤的细胞在某些方面与正常的自然杀伤(nk)细胞相似。nk细胞是比t细胞和b细胞对感染反应更快的淋巴细胞。结外鼻nk/t细胞淋巴瘤更常见于亚洲和拉丁美洲,与艾巴氏病毒(ebv)相关。
[0153]
肠病相关的肠道t细胞淋巴瘤(eatl):eatl是发生在肠道内壁的淋巴瘤。这种淋巴瘤最常见于空肠(小肠的第二部分),但还可发生在小肠和结肠的其他部位。eatl通常影响肠道中的多个部位,并且还可扩散到附近的淋巴结。它可导致肠道阻塞或穿孔。这种淋巴瘤有两种亚型。
[0154]
i型eatl发生在患有麸质敏感性肠病(也称为脂泻病、乳糜泻或口炎性腹泻)的人群。口炎性腹泻是一种自身免疫性疾病,其中小麦粉中的主要蛋白质麸质会导致身体产生攻击肠道内壁和身体其他部位的抗体。这种淋巴瘤在男性中比女性更常见,并且往往发生在60多岁和70多岁的人群中。不耐受麸质但没有口炎性腹泻的人似乎不会增加患这种淋巴瘤的风险。ii型eatl与口炎性腹泻无关,比i型少见。
[0155]
间变性大细胞淋巴瘤(alcl)是一种罕见的t细胞淋巴瘤,其占成人所有淋巴瘤病例的约3%。alcl在儿童中更为普遍。alcl通常从淋巴结开始,还可扩散到皮肤。这种类型的淋巴瘤往往会快速生长,但许多患有这种淋巴瘤的人都可通过积极的化疗治愈。
[0156]
alcl的两种主要形式是原发性皮肤(仅影响皮肤)和系统性的。系统性alcl根据间变性淋巴瘤激酶(alk)的存在与否分为亚型。alk阳性的alcl往往发生在年轻患者中,并且往往比alk阴性的类型具有更好的预后。
[0157]
外周t细胞淋巴瘤(未指明)是最常见的ptcl类型,并且是指不适合上述任何组的t细胞淋巴瘤的名称。它们约占所有t细胞淋巴瘤的一半。大多数被诊断患有这种疾病的人都在60多岁。这种淋巴瘤通常累及淋巴结,但也可能累及结外部位,例如肝脏、骨髓、胃肠道和皮肤。作为一个群体,这些淋巴瘤往往分布广泛且生长迅速。一些患者对化疗反应良好,但长期生存并不常见。尤因氏肉瘤
[0158]
尤因氏肉瘤是一种癌性肿瘤,生长在骨骼或骨骼周围的组织(软组织)中,通常是腿、骨盆、肋骨、手臂或脊柱。尤因氏肉瘤可以扩散到肺、骨骼和骨髓。尤因氏肉瘤是第二常见的儿童骨肿瘤,但非常罕见。尤因氏肉瘤是一种高度转移性肿瘤,约25%的患者在诊断时出现转移。约一半的尤因氏肉瘤肿瘤发生在10至20岁的儿童和青年中。虽然不常见,但是尤因氏肉瘤可作为第二种癌症发生,尤其是在接受放射治疗的患者中。
[0159]
尤因氏肉瘤中最常见的易位存在于约90%的病例中,通过ewsr1基因与fli1基因的融合产生异常转录因子。与其他肿瘤类型相比,已发现pkcβ在原发性尤因氏肿瘤中是由ewsr1-fli1调节的靶标。已证明,pkcβ对尤因氏肉瘤的肿瘤细胞的体外存活和体内肿瘤发展至关重要。
[0160]
在一些实施方案中,本文描述了治疗有需要的对象中的尤因氏肉瘤的方法,所述方法包括向个体施用缓释组合物,所述组合物包含5-{[(2s,5r)-2,5-二甲基-4-(四氢-2h-吡喃-4-基甲基)哌嗪-1-基]羰基}-n-(5-氟-2-甲基嘧啶-4-基)-6,6-二甲基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-胺(化合物a),或其药学上可接受的盐。2.自身免疫性病症狼疮
[0161]
狼疮是一种在免疫系统攻击宿主组织和器官时发生的慢性炎性疾病。狼疮引起的炎症会影响许多不同的身体系统,包括关节、皮肤、肾脏、血细胞、大脑、心脏和肺。狼疮难以诊断,因为它的体征和症状通常与其他疾病相似。狼疮最显著的体征是面部皮疹,类似于蝴蝶的翅膀在双颊上展开,并且发生在许多但并非所有狼疮病例中。有些个体一出生就有患狼疮的倾向,这可能由感染、某些药物甚至阳光引发。目前可用的治疗方法可有助于控制症状。大多数患有狼疮的个体都有轻微的疾病,其特征是发作,称为耀斑,在此期间体征和症状会增加,然后在一段时间内减少甚至完全消失。狼疮的体征和症状取决于受疾病影响的身体系统。最常见的体征和症状包括疲劳和发烧、关节疼痛、僵硬和肿胀、覆盖面颊和鼻梁的面部蝴蝶状皮疹、因日晒而出现或恶化的皮肤损伤、手指和脚趾遇冷或在压力时期变白或变蓝(雷诺现象)、呼吸急促、胸痛、干眼、头痛、精神错乱和记忆力减退。
[0162]
起源狼疮疑似是由遗传和环境原因共同引起的。似乎具有狼疮遗传倾向的个体在接触可能引发狼疮的环境因素时可能会患上这种疾病。一些潜在的触发因素包括阳光,因为暴露在阳光下可能会导致狼疮皮肤损伤或引发易感个体的内部反应,和感染发作,因为感染可引发狼疮或导致复发。狼疮可由某些类型的抗癫痫药物、血压药物和抗生素引发。患有药物引发的狼疮的个体通常会在停止服药时观察到其症状消失。
[0163]
系统性红斑狼疮(sle)是一种严重的疾病,其中自身反应性t细胞和b细胞对该疾病的病理生理学做出重要贡献(wahren-herlenius和2013,lancet.382:819-31;murphy等人,2013,lancet.31;382:809-)。敲除pkcβ基因能防止小鼠sle的发展(oleksyn d等人,2013,arthritis rheum 65:1022-31)。该研究支持开发用于自身免疫性疾病的pkcα、β和θ的选择性抑制剂。葡萄膜炎
[0164]
葡萄膜炎是描述一组产生肿胀和破坏眼组织的炎性疾病的通用术语。使用术语“葡萄膜炎”,因为这些疾病通常会影响眼睛的一部分,称为葡萄膜。然而,葡萄膜炎并不局限于葡萄膜。这些疾病还影响晶状体、视网膜、视神经和玻璃体,导致视力下降或失明。葡萄膜炎的常见症状包括视力下降、疼痛、光敏感和飞蚊症增加。
[0165]
葡萄膜是眼睛的中间层,包含眼睛的大部分血管。这是炎症细胞进入眼睛的一种方式。葡萄膜位于巩膜、眼睛的白色外层和眼睛的内层(称为视网膜)之间,由虹膜、睫状体和脉络膜组成。葡萄膜炎通过主要引起晶状体、视网膜、视神经和玻璃体问题而破坏视力。葡萄膜炎的具体类型—按其在眼中发生的部位分类—包括前葡萄膜炎、中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎。
[0166]
葡萄膜炎主要是由眼内的炎症反应引起的。导致葡萄膜炎的示例性炎症反应包括来自身体自身免疫系统的攻击、眼内或身体其他部位发生的感染或肿瘤、眼睛瘀伤以及可穿透眼睛的毒素。
[0167]
葡萄膜炎的诊断可包括彻底检查和患者的完整病史记录。可以进行实验室检查以排除感染或自身免疫性病症。中枢神经系统评估通常对患有中间葡萄膜炎亚组(称为扁平部炎)的患者进行,以确定他们是否患有通常与扁平部炎相关的多发性硬化症。使用的示例性眼科检查包括测量患者视力是否下降的视力表或视力测试、眼底镜检查,其中用滴眼剂扩张瞳孔,然后用称为检眼镜的仪器显示光线以进行无创检查眼睛内部部分中的后部、眼压测量和无创检查眼睛的大部分的裂隙灯检查。
[0168]
葡萄膜炎治疗主要尝试消除炎症、减轻疼痛、防止进一步的组织损伤和恢复任何视力丧失。治疗取决于患者表现出的葡萄膜炎类型。一些治疗方法(如在眼睛周围或眼睛内部使用皮质类固醇滴眼剂和注射剂)可仅仅针对眼睛,而其他治疗方法(如口服免疫抑制剂)可在双眼、特别是双眼后部发生疾病时使用。
[0169]
甾体抗炎药也经常开处方,以滴眼剂的形式施用,以药片的形式吞服,注射到眼睛周围或眼内,静脉内注入血液中,或通过手术植入眼内的胶囊释放到眼睛中。为了避免长期使用类固醇引起的不良副作用,如果患者需要中等或高剂量口服类固醇超过3个月,通常开始使用其他药剂。
[0170]
其他常用的免疫抑制剂包括甲氨蝶呤、麦考酚酯、咪唑硫嘌呤和环孢素等药物。在一些情况下,使用生物反应调节剂(brm)或生物制剂,如阿达木单抗、英夫利昔、达克珠单抗、阿巴西普和利妥昔单抗。这些药物针对免疫系统的特定元素。其中一些药物可增加患癌症的风险。
[0171]
治疗还取决于患者所患的葡萄膜炎的具体类型。治疗前葡萄膜炎,例如服用扩张瞳孔的滴眼剂以防止虹膜和睫状体肌肉痉挛,或服用含有类固醇(如泼尼松)的滴眼剂以减轻炎症。中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎通常通过眼周注射、口服药物或在一些情
况下通过手术植入眼内的时间释放胶囊来治疗。脑炎
[0172]
免疫系统的主要作用是识别和对抗感染。但由于存在功能障碍,免疫系统的一些组分可与天然蛋白质发生反应,从而导致自身免疫性疾病。当这种反应针对大脑中的蛋白质时,它被称为自身免疫性脑炎(ae),是一种严重的免疫系统会攻击大脑、损害大脑功能的医学病况。自身免疫性脑炎越来越被认为是脑炎综合征的重要且可能可逆的非感染性原因。已经描述了多种自身免疫性脑炎,包括抗lgi1脑炎(以前称为抗电压门控钾通道“抗vgkc”抗体脑炎)和抗n-甲基-d-天冬氨酸受体(抗nmdar)脑炎。
[0173]
nmda受体抗体脑炎是一种自身免疫性疾病,会导致精神症状、精神错乱、记忆丧失和癫痫,随后出现运动病症、意识丧失,以及血压、心率和体温的变化。这种疾病对抑制免疫系统和去除潜在肿瘤(如果发现)的各种疗法的响应良好,但改善通常缓慢。在nmda受体抗体相关的脑炎患者中看到的症状和体征可以是独特的,并促使许多临床医生要求进行nmda受体抗体测试来诊断该病况。该疾病主要影响年轻人,约30%的病例在18岁以下。女性比男性更容易受到影响。一旦患者被诊断出患有nmda受体抗体脑炎,通常会寻找潜在的肿瘤。虽然很少有男性检测到肿瘤,但最近的报告表明,20%至57%的女性可能患有潜在的肿瘤。在女性中发现的最常见的肿瘤称为卵巢畸胎瘤。这是一种非癌性肿瘤,但被认为会刺激nmda受体抗体的产生。
[0174]
治疗包括免疫疗法和切除肿瘤(如果存在)。免疫疗法使用药物来抑制免疫系统。这些包括类固醇、免疫球蛋白和血浆交换疗法。此外,一些患者接受其他抑制免疫系统的药物治疗,如环磷酰胺和利妥昔单抗。
[0175]
当抗体靶向大脑中的电压门控钾通道复合物时,它们会导致“电压门控钾通道复合物抗体相关的边缘脑炎”(vgkc-le)。男性受抗lg1抗体脑炎的影响大约是女性的两倍。最初,家庭成员通常会注意到他们的亲戚变得健忘、瞌睡和孤僻。患者还可出现情绪病症,如抑郁症或奇怪的想法和行为。此外,经常发生癫痫。当患者目光呆滞几秒钟时,这些可表现为短暂的“缺席”,也称为“颞叶癫痫”,或可令目击者非常不安的全面发作的手臂和腿抽搐,也称为全身癫痫发作。最后,患者可出现面部和手臂的短暂抽搐,也称为面臂癫痫发作。最后症状是一个重要特征,高度示出vgkc抗体。
[0176]
最近发现vgkc抗体实际上并不针对钾通道。它们靶向称为lgi1的蛋白质并且不太频繁的靶向称为caspr2的蛋白质,这些蛋白质与大脑中的钾通道密切相关。因此,各种报告、诊断测试和医生现在使用术语vgkc、vgkc复合物、lgi1和/或caspr2抗体。在实践中,这些抗体之间通常几乎没有区别,但这是目前正在积极研究的领域,可能会改变我们未来诊断该疾病的方式。
[0177]
vgkc-le可通过使用免疫抑制来抑制引起炎症的免疫反应进行治疗,然而,没有任何一组药物被证明优于其他药物,并且正在研究新的或最佳的治疗方法。然而,大多数临床医生选择使用通过口服或静脉注射类固醇静脉注射免疫球蛋白和/或血浆交换疗法的免疫抑制。
[0178]
自身免疫性脑炎还可由感染引发,在这种情况下,使用术语“感染后脑炎”。急性播散性脑脊髓炎(adem)是一种感染后脑炎。该疾病通常发生在轻度病毒感染(例如在儿童期引起皮疹的病毒感染或免疫接种)之后。通常在引发感染和脑炎发展之间有几天到两至三
周的延迟。adem占所有已知脑炎病例的约10%。adem通常影响儿童,并在儿童皮疹、疹、其他病毒感染或免疫接种后开始。在症状出现之前,通常有几天到两至三周的潜伏期。对这种疾病知之甚少,并且有多种术语用于描述它,这些包括病毒感染后、感染后或副感染。疾病通常以不太特异性的症状开始,如发烧、头痛、颈部僵硬、呕吐和厌食。这些很快就会出现意识抑郁,其中患者可变得意识混乱和偶尔昏迷。可以检测到的神经学特征包括视力下降、手臂和腿笨拙、一侧瘫痪和癫痫。这些症状的持续时间是可变的。一些病例持续数周至一个月,而其他致命病例在数天内呈快速进展过程。
[0179]
普遍认为,不能从adem患者的大脑中分离出致病微生物。该疾病与先前感染或免疫接种的关联表明了免疫过程。涉及测量抗脑抗体和对特定脑抗原的细胞免疫反应的详细实验室研究表明,这些患者已经对他们自己的大脑成分产生了过敏反应,这是一种“自身免疫”反应。
[0180]
理想的治疗形式是免疫调节,其中一旦做出诊断,即应进行免疫调节,并且早期给予具有更多益处。然而,可能难以迅速做出诊断。高剂量的类固醇通常可使得症状快速消退,预后良好。类风湿性关节炎
[0181]
类风湿性关节炎(ra)是一种慢性自身免疫性病症,其中身体的免疫系统攻击关节和其他器官,如皮肤、眼睛、肺和血管。在一些情况下,ra的症状包括疼痛、关节肿胀和/或僵硬、类风湿结节、低红细胞以及肺部和心脏周围的炎症。
[0182]
在一些情况下,ra进一步分为类风湿因子阳性(血清阳性)ra、类风湿因子阴性(血清阴性)ra和青少年ra(或幼年特发性关节炎)。类风湿因子(rf)是一种针对igg的fc区的自身抗体。在一些情况下,类风湿因子包含一种或多种免疫球蛋白同种型,例如iga、igg、igm、ige或igd。在一些情况下,类风湿因子还包括冷球蛋白-一种在低于正常体温的温度下沉淀的抗体。存在或不存在类风湿因子(即血清阳性或血清阴性)被用作评估ra存在和进展的诊断工具的一部分。青少年ra影响16岁以下的儿童,其中炎症持续时间超过6周。
[0183]
在一些实施方案中,th17和th1都与ra的发展和进展有关。例如,th17细胞过度表达il-17会导致滑膜炎症、软骨破坏和骨侵蚀。此外,il-17触发人类滑膜细胞产生il-6、il-8gm-csf和pge2,并在人外周血巨噬细胞中触发产生tnf-α、il-1β、il-12、溶基质素、il-10和il-1r拮抗剂。在一些情况下,还观察到th17细胞在外周血中共表达th1细胞因子ifn-γ,这表明th17细胞的可塑性产生了th1细胞。(nistala等人,“th17 plasticity in human autoimmune arthritis is driven by the inflammatory environment,”pnas 107(33):14751-14756(2010))。
[0184]
在一些情况下,pkc(例如,pkc-θ)与安排th-1依赖性反应有关。事实上,pkc-θ缺陷小鼠在mbsa诱导的关节炎和胶原诱导的关节炎(cia)小鼠模型中表现出疾病严重程度降低、pkc-θ缺陷t细胞响应ag的增殖能力降低以及il-2水平降低、t-bet表达受损、ifn-γ和il-4水平降低。此外,pkc-θ缺乏与疾病高峰之前和期间t细胞增殖、th1/th2细胞分化和t细胞活化的减少相关。(healy等人,“pkc-θ-deficient mice are protected from th1-dependent antigen-induced arthritis,”j immunol 177:1886-1893(2006))。
[0185]
在一些实施方案中,ra的治疗包括改善疾病的抗风湿药(dmard),如甲氨蝶呤、羟化氯喹、柳氮磺胺吡啶、来氟米特、阿巴西普或阿那白滞素;生物制剂,如肿瘤坏死因子α阻
inflammatory diseases,”autoimmunity,39(6):469-478(2006))。
[0191]
pkc-θ参与调节多种t细胞功能,这些功能对于自身免疫性疾病的发展是必需的。pkc-θ消融导致th1细胞因子ifnγ而不是il-2或il-4的产生减少,并且t细胞效应细胞因子il-17的产生减少。pkc-θ消融进一步未能响应tcr激活上调lfa-1表达,tcr激活负责t细胞跨内皮粘附,并且在一些情况下,lfa-1上调参与eae的诱导。(tan等人,“resistance to experimental autoimmune encephalomyelitis and impaired il-17production in protein kinase c{theta}-deficient mice,”j.immunol.176:2872-2879(2006))。
[0192]
pkc-θ对于eae中ag特异性th1细胞的发育和持续存在是很重要的。pkc-θ缺乏会影响小鼠对mog的外周t细胞反应,导致cns组织中的炎症细胞减少和th1细胞因子的产生降低,导致延迟eae发作和疾病的最少临床迹象。(salek-ardakani等人,“protein kinase c{theta}controls th1 cells in experimental autoimmune encephalomyelitis,”j.immunol.175:7635-7641(2005))。炎性肠病
[0193]
炎性肠病(ibd)是一组消化道炎症。在一些情况下,ibd进一步分为克罗恩病、溃疡性结肠炎、胶原性结肠炎、淋巴细胞性结肠炎、转移性结肠炎、贝赛特氏症和局限性结肠炎。
[0194]
克罗恩病,也称为克罗恩综合征或局限性肠炎,是一种影响胃肠道的ibd。克罗恩病的症状包括腹痛、腹泻、发烧和体重减轻。其他并发症包括贫血、皮疹、关节炎、眼睛发炎和疲倦。尽管确切原因尚不清楚,但在一些情况下,环境因素、免疫和细菌因素以及遗传倾向的组合与这种疾病的发展有关。在一些情况下,治疗包括抗生素、5-氨基水杨酸(5-asa)药物、泼尼松等皮质类固醇、咪唑硫嘌呤和甲氨蝶呤等免疫调节剂、英夫利昔、阿达木单抗、赛妥珠单抗和那他珠单抗等生物制剂以及手术。
[0195]
溃疡性结肠炎(uc,或溃疡性结肠炎)是ibd的形式,会导致结肠发炎和溃疡。溃疡性结肠炎的症状包括在一些情况下混合有血液和粘液的腹泻、体重减轻、腹痛和贫血。在一些情况下,治疗包括柳氮磺胺吡啶和美沙拉秦等5-氨基水杨酸(5-asa)药物、泼尼松等皮质类固醇、咪唑硫嘌呤等免疫抑制药物和英夫利昔、阿达木单抗和戈利木单抗等生物制剂。视神经炎
[0196]
视神经炎是视神经的炎症。它进一步分为乳头炎和眼球后神经炎。乳头炎的特征是视神经乳头的炎症,并且眼球后神经炎的特征是神经后部的炎症。在一些情况下,多发性硬化症是视神经炎最常见的病因之一。其他原因包括感染(例如,梅毒、莱姆病、带状疱疹)、自身免疫性病症(例如,狼疮、神经结节病、视神经脊髓炎)、炎性肠病、药物诱导(例如,氯霉素、乙胺丁醇、异烟肼、链霉素、奎宁、青霉胺、氨基水杨酸、吩噻嗪、保泰松)、血管炎、b12缺乏症和糖尿病。视神经炎的症状包括突然的视力模糊或朦胧、与眼球运动相关的疼痛、色觉受损和深度知觉受损。在一些情况下,治疗包括皮质类固醇。视神经脊髓炎
[0197]
视神经脊髓炎(也称为德维克氏病、德维克氏综合征或nmo)是一种b细胞介导的疾病,与视神经(视神经炎)和脊髓(脊髓炎)的同时炎症和脱髓鞘有关。在一些情况下,症状包括视力丧失、眼内疼痛感、感官失调、无力、麻木和/或手臂和腿的麻痹,以及膀胱和肠道失控。在疾病过程中,源自外周b细胞的自身抗体nmo-igg靶向cns星形细胞水通道蛋白4(aqp4),导致补体激活和炎症。在一些情况下,炎性病变类似于多发性硬化症(ms)的病变;
然而,它们的血管周围分布与ms不同。视神经脊髓炎有两种变体,一种是aqp4 nmo,它会导致人自身免疫系统攻击视神经和脊髓的星形胶质细胞,另一种是aqp4-nmo,其病因不明。
[0198]
在一些实施方案中,视神经脊髓炎属于称为视神经脊髓炎谱系病症(nmosd)的类似疾病的集合。在一些情况下,属于nmosd的其他疾病包括标准德维克氏病、有限形式的德维克氏病、亚洲视脊髓ms、纵向广泛性脊髓炎或与系统性自身免疫病相关的视神经炎、视神经炎或nmo-igg阴性nmo。干燥综合征
[0199]
干燥综合征是一种慢性自身免疫性疾病,其中唾液腺和泪腺等外分泌腺被白血球或白细胞破坏。在一些情况下,皮肤和器官,如肾脏、血管、肺、肝脏、胆道系统、胰腺、周围神经系统和大脑也会受到影响。在一些情况下,干燥综合征被分为原发性或继发性干燥综合征。症状包括口干症(即口干)、干燥性角膜结膜炎(即眼干)、关节疼痛、唾液腺肿胀、皮疹或皮肤干燥、阴道干燥、持续干咳和长期疲劳。在一些情况下,治疗包括西维美林和匹鲁卡品等拟交感神经激动剂、非甾体抗炎药(nsaid)、甲氨蝶呤和羟化氯喹等免疫抑制剂或手术。银屑病
[0200]
银屑病是一种以皮肤异常区域为特征的自身免疫性疾病。在一些情况下,牛皮藓进一步分为斑块型、斑点型、反向型、脓疱型和红皮病型。斑块型牛皮藓或寻常型牛皮藓占总病例的约90%。它的特征是存在红色斑块,顶部有白色鳞片。在一些情况下,斑块型牛皮藓发生在前臂、小腿、肚脐和头皮区域。斑点型牛皮藓的特征是滴状病变。脓疱型牛皮藓的特征是小的非感染性脓液填充水疱。反向型牛皮藓的特征是皮肤皱襞区域出现红色斑块。红皮病型牛皮藓的特征是全身出现皮疹,在一些情况下进一步发展为牛皮藓的亚型。在一些情况下,牛皮藓与关节炎症相结合称为牛皮藓关节炎。在一些实施方案中,银屑病的治疗包括非甾体抗炎药(nsaid);免疫抑制剂,如甲蝶蝶呤;富马酸酯,如富马酸二甲酯;生物制剂,如英夫利昔、阿达木单抗、戈利木单抗、赛妥珠单抗;类维生素a;维生素d3霜,或紫外光等光线疗法。系统性硬皮病
[0201]
系统性硬皮病,也称为系统性硬化症或ssc,是一种以皮肤、血管和内脏器官硬化或变硬以及关节和肌肉发炎为特征的结缔组织疾病。在一些情况下,系统性硬皮病进一步分为局限性皮肤硬皮病(lcssc)、弥漫性皮肤硬皮病(dcssc)和系统性硬化症正弦硬皮病(ssssc)。局限性皮肤硬皮病影响面部、手部和足部,其特征是钙质沉着、雷诺现象、食道功能障碍、指端硬化和毛细血管扩张。弥漫性皮肤硬皮病影响全身皮肤,在一些情况下会发展到内脏器官,例如肾脏、心脏、肺和胃肠道。系统性硬化症正弦硬皮病的特征是器官纤维化而没有皮肤硬化。在一些情况下,治疗包括钙通道阻滞剂、前列腺素、他达拉非、波生坦、皮质类固醇和免疫抑制剂。强直性脊柱炎
[0202]
强直性脊柱炎(还称为别赫捷列夫氏病、马-施二氏病或as)是一种中轴骨骼的慢性炎性疾病。强直性脊柱炎主要影响骨盆的脊柱关节和骶髂关节,但在一些情况下也涉及外周关节和非关节结构。在一些情况下,强直性脊柱炎的特征是椎间盘纤维环的外层纤维骨化,并且在严重的情况下,脊柱完全融合。强直性脊柱炎的症状包括下背部和臀部疼痛和僵硬,脊柱活动性和胸部扩张逐渐丧失,前屈、侧屈和腰椎伸展受限。在一些情况下,治疗包
括非甾体抗炎药(nsaid),如布洛芬、保泰松、双氯芬酸、消炎痛、萘普生和cox-2抑制剂;阿片类镇痛剂、缓解疾病的抗风湿药(dmard),如柳氮磺胺吡啶;肿瘤坏死因子-α阻滞剂,如依那西普、英夫利昔、戈利木单抗和阿达木单抗;抗白介素-6抑制剂,如托珠单抗和利妥昔单抗。自身免疫性肝炎
[0203]
自身免疫性肝炎(aih)或狼疮样肝炎的特征是肝脏的慢性炎症。在一些情况下,症状包括疲劳、肌肉酸痛、发烧、黄疸和右上腹痛。在一些情况下,自身免疫性肝炎进一步分为四种亚型:阳性抗核抗体(ana)和抗平滑肌抗体(sma),其特征是免疫球蛋白g升高;阳性肝/肾微粒体抗体(lkm-1、lkm-2或lkm-3);针对可溶性肝抗原的阳性抗体;以及未检测到自身抗体。在一些情况下,治疗包括糖皮质激素,如布地奈德和泼尼松;以及免疫抑制剂,如咪唑硫嘌呤、麦考酚酯、环孢素、他克莫司、甲氨蝶呤等。
[0204]
pkc-θ调节nkt细胞的活化以诱导肝炎。例如,缺乏pkc-θ的小鼠对伴刀豆球蛋白a(cona)诱导的肝炎具有抗性,而在pkc-θ缺陷小鼠中,cona诱导的细胞因子(如ifnγ、il-6和tnfα)产生较低,这些细胞因子介导导致肝损伤的炎症。(fang等人,“ameliorated cona-induced hepatitis in the absence of pkc-theta,”plos one,7(2):e31174(2012))。同种异体病况器官移植排斥
[0205]
当移植组织被宿主的免疫系统排斥时,发生器官移植排斥。在一些情况下,移植的器官包括心脏、肺、肾脏、肝脏、胃、胰腺或肠等实体器官或者皮肤、心脏瓣膜、静脉或角膜等源自实体器官的组织。在一些情况下,器官移植排斥的特征在于超急性排斥、急性排斥和慢性排斥。当移植的组织由于血管形成损伤在几分钟或几小时内被排斥时,发生超急性排斥。急性排斥发生在移植后的前六个月内,并且进一步包括急性细胞排斥和体液排斥。移植六个月后发生慢性排斥。
[0206]
在一些情况下,当供体-宿主人类白细胞抗原(hla)不匹配时,出现移植的同种异体反应性,从而导致随后的b细胞和t细胞介导的反应。例如,在b细胞介导的反应中,同种异体hla抗原被b细胞内化并随后加工成肽以呈递在hlaii类分子上。cd4 t细胞识别hlaii类呈递的hla衍生表位导致b细胞活化和igm向igg同种型转换。因此,产生识别同种异体hla分子的供体特异性igghla同种抗体,从而导致移植器官的排斥。在t细胞介导的反应中,同种异体t细胞要么直接识别完整的同种异体hla分子,要么通过调节b细胞活化和igg同种型转换参与间接识别。
[0207]
在一些情况下,pkc(例如,pkc-θ、pkc-α)参与活化t细胞的存活。事实上,一项研究表明,与wt小鼠相比,将同种异体细胞注射到pkc-θ缺乏的小鼠中会引起t细胞反应降低,并且在没有pkc-θ的情况下同种异体t细胞发生凋亡。(sun,z.“intervention of pkc-θas an immunosuppressive regimen,”frontiers in immunology 3(225):1-9(2012);anderson,等人,“mice deficient in pkc theta demonstrate impaired in vivo t cell activation and protection from t cell-mediated inflammatory diseases,”autoimmunity 39:469-478(2006);manicassamy,等人,“protein kinase c-{theta}-mediated signals enhance cd4 t cell survival by up-regulating bcl-xl,”j.immunol.176:6709-6716(2006))。第二项研究表明,pkc-θ/pkc-α缺乏的组合会引起加性
t细胞反应缺陷(gruber,等人,“pkcθcooperates with pkcαin alloimmune responses of t cells in vivo,”molecular immunology 46:2071-2079(2009))。
[0208]
在一些实施方案中,对于急性排斥有几种不同的治疗选择。示例性治疗选择包括皮质类固醇,如泼尼松龙和氢化可的松;钙调神经磷酸酶抑制剂,如环孢素和他克莫司;抗增殖剂,如咪唑硫嘌呤和霉酚酸;mtor抑制剂,如西罗莫司和依维莫司;生物制剂,如单克隆抗il-2rα受体抗体(例如,巴利昔单抗、达克珠单抗)、多克隆抗t细胞抗体(例如,抗胸腺细胞球蛋白和抗淋巴细胞球蛋白)和单克隆抗cd20抗体(例如,利妥昔单抗)。对于超急性排斥,唯一的治疗选择是切除组织;对于慢性排斥,建议再移植作为首选。
[0209]
pkc-θ增强t细胞存活并促进幼稚t细胞分化为炎性th17细胞。此外,调节pkc-θ活性会改变炎性效应t细胞和抑制性t调节细胞之间的比例,以控制导致自身免疫和同种异体移植排斥的t细胞介导的免疫反应。事实上,pkc-θ缺陷小鼠对几种th2和th17依赖性自身免疫疾病的发展具有抵抗力,并且在移植同种异体移植物和移植物抗宿主病排斥所需的同种免疫反应方面存在缺陷。(sun,z.“intervention of pkc-θas an immunosuppressive regiment,”frontiers in immunology,3(225):1-9(2012))。移植物抗宿主病
[0210]
移植物抗宿主病(gvhd)是同种异体干细胞移植后的并发症,其特征是t细胞介导的对次要组织相容性抗原的识别,随后是器官特异性血管增殖、细胞因子释放和直接细胞介导的对正常组织的攻击。在一些情况下,干细胞是从骨髓、外周血或脐带血中获得的。在一些情况下,存在两种类型的gvhd,即急性或暴发性形式的gvhd(agvhd),以及慢性形式的gvhd(cgvhd)。急性gvhd发生在移植的前100天内,而慢性gvhd发生在100天时间范围之后。在一些情况下,gvhd的治疗包括钙调神经磷酸酶抑制剂,如环孢素和他克莫司;mtor抑制剂,如西罗莫司;和抗增殖剂,如甲氨蝶蝶呤、环磷酰胺和麦考酚酯。
[0211]
pkc-θ在降低t细胞激活所需的整体信号阈值方面发挥着重要作用。因此,pkc-θ的缺失选择性地削弱了低水平和低亲和力tcr激动剂对t细胞的激活。因此,在同种异体环境中,抑制pkc-θ可防止gvhd诱导,同时保持对病毒感染的反应能力和bm移植后诱导移植物抗白血病(gvl)效应的能力。(valenzuela等人,“pkcθis required for alloreactivity and gvhd but not for immune responses toward leukemia and infection in mice,”the journal of clinical investigation,119(12):3774-3786(2009))。3.炎症
[0212]
pkcβ还在炎症中起作用(如上文所述),如炎性肠病引起的炎症为克罗恩病、溃疡性结肠炎、胶原性结肠炎、淋巴细胞性结肠炎、转移性结肠炎、贝赛特氏症或局限性结肠炎。给药
[0213]
当使用本发明的组合物时,剂量可在宽范围内变化,并且是常规的并且是医师已知的,其将针对每个个体病例中的个体条件进行调整。例如,取决于待治疗疾病的性质和严重程度、患者的状况、所用的化合物、或是否治疗或预防急性或慢性疾病状态、或除如本文公开的药物组合物之外是否还施用其他活性化合物。可以在一天施用多个剂次,尤其是当认为需要相对大量时,例如2、3或4剂。根据个体情况并在患者的医生或护理人员认为合适的情况下,可能需要向上或向下偏离本文所述的剂量。
[0214]
治疗所需的活性成分或其活性盐或衍生物的量不仅因所选的特定盐而异,而且还
因给药途径、所治疗病况的性质以及患者的年龄和状况而异,并且最终将由主治医师或临床医生自行决定。通常,本领域技术人员理解如何将在模型系统(通常是动物模型)中获得的体内数据外推至另一种模型系统(如人)。在一些情况下,这些外推可仅基于动物模型与另一种模型(如哺乳动物,优选人)相比的重量,然而,更常见的是,这些外推并非简单地基于重量,而是结合多种因素。代表性因素包括患者的类型、年龄、体重、性别、饮食和医疗状况、疾病的严重程度、给药途径、药理学考虑因素(如所用特定化合物的活性、功效、药代动力学和毒理学特征)、是否使用药物递送系统、是否治疗或预防急性或慢性疾病状态或除如本发明的组合物之外是否还施用其他活性化合物并作为药物组合物的一部分。用本发明的化合物和/或组合物治疗疾病的给药方案根据如上所述的多种因素进行选择。因此,所采用的实际剂量方案可变化很大,因此可偏离优选的剂量方案,并且本领域技术人员将认识到可以测试这些典型范围之外的剂量和剂量方案,并且在适当的情况下,可用于本发明的方法中。
[0215]
所需的剂量可以方便地以单剂量或以适当间隔施用的分剂量给药,例如,每天两、三、四或更多个子剂量。子剂量本身可以进一步例如分分成多个离散的、间隔松散的施用。日剂量可以分成数个部分施用,例如2、3或4部分,尤其是当认为施用相对大量是合适的情况下。如果合适,根据个体行为,可需要向上或向下偏离指示的每日剂量。
[0216]
药物制剂优选为单位剂型。在这种形式中,制剂被细分为含有适量活性成分的单位剂量。单位剂型可以是包装的制剂,所述包装包含离散量的制剂。联合疗法
[0217]
在一些实施方案中,本文公开的pkcβ抑制剂与至少一种其他药剂联合施用。pkcβ抑制剂和其他药剂的施用可以通过相同或不同的施用途径同时或依序进行。
[0218]
在一些实施方案中,在开始施用pkcβ抑制剂之前,将至少一种其他药剂施用给患者。在一些实施方案中,在开始施用pkcβ抑制剂,将至少一种其他药剂施用至少一周、或至少两周、或至少三周、或至少一个月、或至少两个月、或至少三个月。
[0219]
用于特定药剂的特定施用途径的适用性将取决于药剂本身(例如,是否可以口服或局部施用而在进入血流之不前分解)和所治疗的对象。其他药剂或成分的具体施用途径是本领域普通技术人员已知的。
[0220]
所施用的其他药剂的量可以根据所使用的具体药剂、正在治疗的对象、疾病的严重程度和所处阶段以及至少一种pkcβ抑制剂和同时施用于患者的任意任选的其他已知药剂来确定。当与至少一种pkcβ抑制剂联合使用时,可以例如以医师案头参考(pdr)中指示的量或由本领域普通技术人员确定的量来使用至少一种其他药剂。
[0221]
在一些实施方案中,当与至少一种pkcβ抑制剂联合使用时,减少至少一种其他药剂的剂量。在一些实施方案中,不减少剂量。
[0222]
本发明的一些实施方案包括一种生产用于“联合疗法”的药物组合物的方法,该方法包括将至少一种pkcβ抑制剂与至少一种本文所述的其他药剂和药学上可接受的载体混合。
[0223]
在一些情况下,本文所述的方法还包括与至少一种其他肿瘤治疗剂的联合疗法。在一些实施方案中,其他肿瘤治疗剂选自syk抑制剂、双重syk-jak抑制剂、pi3k抑制剂、jak-stat抑制剂、bcl2抑制剂、免疫调节剂、抗体-药物偶联物、免疫检查点抑制剂、pd-1抑
制剂、tim-3抑制剂、ctla-4抑制剂、溴结构域抑制剂、ezh2抑制剂、hdac抑制剂或idh2抑制剂。btk抑制剂
[0224]
在一些实施方案中,其他肿瘤治疗剂是btk抑制剂。
[0225]
布鲁顿氏酪氨酸激酶(btk)抑制剂依鲁替尼是fda批准的针对b细胞恶性肿瘤的抗癌药物。目前处于某临床开发阶段的其他btk抑制剂包括但不限于:ono/gs-4059(ono pharmaceuticals/gilead sciences)、avl-292/cc-292/spebrutinib(celgene corporation)、bgb-3111(beigene)和acp-196/阿卡替尼(acerta pharma)、m7583(emd serono/merck kgaa)、msc2364447c(emd serono/merck kgaa)、biib068(biogen)、ac0058ta(acea biosciences)和dtrmwxhs-12(zhejiang dtrm biopharma)。水合物和溶剂化物
[0226]
如本文所用,术语“水合物”是指化合物或其盐,其进一步包括由非共价分子间力结合的化学计量或非化学计量量的水。如本文所用,术语“溶剂化物”是指化合物或其盐,其进一步包括化学计量或非化学计量量的由非共价分子间力结合的溶剂。优选的溶剂是挥发性的、无毒的和/或用于痕量施用给人类的溶剂。
[0227]
应理解,当提及本文所述的化合物时,当使用短语“药学上可接受的盐、溶剂化物和水合物”或短语“药学上可接受的盐、溶剂化物或水合物”时,其包括化合物的药学上可接受的溶剂化物和/或水合物、化合物的药学上可接受的盐、以及化合物的药学上可接受的溶剂化物和/或化合物的药学上可接受的盐的水合物。还应理解,当提及本文所述的盐时,当使用短语“药学上可接受的溶剂化物和水合物”或短语“药学上可接受的溶剂化物或水合物”时,其包括所述盐的药学上可接受的溶剂化物和/或水合物。
[0228]
对于本领域技术人员显而易见的是,本文所述的组合物可包含本文所述的化合物或其药学上可接受的盐或其药学上可接受的溶剂化物或水合物作为活性组分。此外,本文所述化合物的各种水合物和溶剂化物及其盐将用作制备药物组合物中的中间体。除了本文提及的那些之外,用于制备和鉴定合适的水合物和溶剂化物的典型方法还为本领域技术人员熟知的;例如参见harry g.britain著,polymorphism in pharmaceutical solids,vol.95,marcel dekker,inc,new york 1999中的第202-209页k.j.guillory,“generation of polymorphs,hydrates,solvates,and amorphous solids”。因此,本发明的一个方面涉及施用药物组合物的方法,该药物组合物包含本文所述化合物的水合物和溶剂化物和/或其药学上可接受的盐,它们可通过本领域已知的方法进行分离和表征,如热重分析(tga)、tga-质谱、tga-红外光谱、粉末x射线衍射(xrpd)、karl fisher滴定、高分辨率x射线衍射等。有几个商业实体提供快速有效的服务,用于常规识别溶剂化物和水合物。提供这些服务的示例公司包括wilmington pharmatech(wilmington,de)、avantium technologies(amsterdam)和aptuit(greenwich,ct)。其他应用
[0229]
尤其是基于对本公开的综述,本公开的组合物的其他用途对于本领域技术人员将变得显而易见。
[0230]
如将认识到的,本发明的方法的步骤不需要执行任何特定次数或以任何特定顺序执行。本发明的其他目的、优点和新颖特征对本领域技术人员而言在检查其以下实施例后
将变得显而易见,这些实施例旨在说明而非限制。实施例
[0231]
本文公开的药物组合物及其制备通过以下实施例进一步说明。提供以下实施例以进一步定义本发明,然而,本发明不限于这些实施例的细节。上下文中描述的化合物根据cs chemdraw ultra 7.0.1版、autonom 2.2版、cs chemdraw ultra 9.0.7版或cs chemdraw ultra 12.0版命名。在某些情况下,使用通用名称,并且应理解这些通用名称是被本领域技术人员认识到的。实施例1.pkcβ信号传导测定
[0232]
先前的工作表明,用佛波醇豆蔻酸(pma)和离子霉素的刺激物来刺激pkcβ。这已证明会导致pkcβ介导的pai-1mrna结合蛋白serbp1的磷酸化(3o’brien(2014)cancer res 73,3195-3195)。为了监测pkcβ介导的信号传导,使用alexa-647标记的抗磷酸化_serbp1抗体进行生物标志物标记测定。样品采集
[0233]
简而言之,将每位患者的全血样本吸入柠檬酸钠收集管中。样品将连夜运送到流式细胞仪实验室进行处理和测试。
[0234]
为每个供体的每个治疗条件准备一式两份。为每个供体准备以下条件:未刺激的样品以及pma和离子霉素刺激的样品。将200μl全血置于适当大小的冷冻小瓶中。将如表1中所述处理样品,并在37℃、5.0%co2下培育25-30分钟。表1:刺激*通过添加1μl的8.1mm(5mg/ml)和999μl含有10%fbs的rpmi1640培养基制备pma 8.1μm^通过添加20μl 1mg/ml离子霉素和180μl含有10%fbs的rpmi1640培养基制备100μg/ml离子霉素
[0235]
刺激后,添加2ml 1x bd facslyse,然后涡旋混合,并在暗处在art下培育12-15分钟。在-80℃下立即储存样品直至测试。
[0236]
来自每个对象的样品在所有时间点分批处理,包括正常人对照未刺激样品和刺激样品。所有样品在单线中处理和收集。
[0237]
将样品置于37℃水浴或珠浴中解冻冷冻样品。将样品转移到管中,并在环境室温(art)下在制动器开启的情况下以1700rpm的速度离心5分钟。将样品倒出并用1ml染色缓冲液(fbs)洗涤两次。在200μl染色缓冲液(fbs)中重悬浮样品,然后将100μl转移到适当体积的荧光染料缀合的单克隆表面抗体中(表2)。表2:表面抗体组全血
[0238]
手动混合样品并在art下在暗处培育15-20分钟。样品用1ml染色缓冲液(fbs)洗涤两次。洗涤后,将200μl fix/perm缓冲液添加到每个样品中,然后涡旋混合,并在2-8℃下在暗处培育30-35分钟。样品用1ml 1x透化缓冲液(perm buffer)洗涤两次。添加100μl 1x perm缓冲液和适当体积的pserbp1 af647(记录在研究文件中)并在2-8℃下在暗处培育30-35分钟。样品用1ml 1x perm缓冲液洗涤两次。在125μl 1x染色缓冲液fbs中重悬浮样品,以在流式细胞仪上采集。流式细胞仪校准
[0239]
对于流式细胞仪,在测试的每一天进行常规射流和校准检查,通过按照sop运行bd细胞仪设置以及跟踪珠子和spherotech ultra rainbow珠子进行。还在初始仪器时进行荧光补偿,以解决一个荧光信号可能溢出到另一个荧光信号的问题。如果需要,可以在使用facsdiva
tm
软件(6.1.3版或更高版本)采集数据后进行额外的电子补偿。样品采集和分析
[0240]
流式细胞仪数据采集使用bd facscantoii
tm
进行,其评估了两个散射参数和多达八个彩色荧光通道。将使用bd facsdiva
tm
软件(6.1.3版或更高版本)采集数据。采集样品以通过基于cd45相对于侧向散射的电子门控将感兴趣的细胞与外周血中的其他细胞类型区分开来。该仪器设置为收集50,000个cd45 淋巴细胞事件。生成双重组合细胞图和/或直方图来说明细胞级分的ll(-/-)、lr( /-)、ul(-/ )、ur( / )和/或间隔门。打印流式细胞图并用研究活页夹保持。
[0241]
为每个群体(cd45、cd3、cd19和cd20)报告af647通道的中值荧光强度。还报告cd3 、cd3-cd19 、cd3-cd20 、cd3-cd19 hladr cd86 和cd3-cd20 hladr cd86 的相对%数据。数据通过microsoft excel进行分析以获得描述性统计数据;即,平均值、sd和cv%。表3:门控策略
数据分析
[0242]
分析流式细胞术数据以确定pma/离子霉素刺激后serbp1磷酸化的量。报告的数据是cd19 pserbp1 群体,相对于每个患者在相应时间点自己的未受刺激样品或在暴露于化合物a之前从个体收集的未受刺激样品进行了归一化。
[0243]
对来自患有cll或sll的患者的全血样品进行的pkcβ信号传导测定的生物标志物数据表明,血浆中500-600ng/ml范围内的化合物a浓度完全抑制pkcβ信号传导。表4.pma刺激后β细胞中pkcβ信号传导的抑制相比于化合物a药物浓度
[0244]
图7显示了该实施例的个体患者数据。实施例2:含有控释组合物的片剂的制备
[0245]
控释组合物的一个理想特征是稳定的释放谱,即药物的释放速率基本上不会随时间显著变化。例如,理想特征是释放速率在药物储存的时间段内基本上不会发生显著变化。因此,为了获得具有随时间稳定的化合物a释放速率的组合物,测试了赋形剂的各种组合。
[0246]
合适的组合物的一个示例是片剂形式的组合物。不同剂量的化合物a的控释片剂的示例如表5a-c所示。表5a
表5b表5c
[0247]
片剂各种组分的供应商和等级如表6所示。表6组分制造商供应等级polyoxdupontn60kmethocel k100 lvdupontmethocel k4m premium cr羟丙基纤维素(hpc)ashlandklucel exf磷酸二钙jrs pharmaemcompress甘露醇spi pharmamannogem xl sdcarbopollubrizol71g硬脂酸镁mallinckrodthyqual 5712(植物来源)实施例3.控释片剂的制备
[0248]
制备控释片剂的示例性方法如下。
[0249]
如下制备颗粒。称取甘露醇、化合物a、羟丙基纤维素(kluelexf)和释放控制聚合物(polyox、methocel或carbopol),并通过20目筛分。将经筛选的粉末添加到适当大小的搅拌机中。将混合物混合15分钟。硬脂酸镁通过#30目筛进行筛分,并添加到搅拌机中。将混合物混合3分钟。
[0250]
使用适当大小的工具压制最终的混合物以制备化合物a的持续释放片剂。方法步骤的方框流程图如方案1所示。
[0251]
控释片剂的制剂的示例如下:(a)实施例3-1:通过直接混合和压制制备化合物a 300mg与37.5%polyox n60k的0.5kg共混物。以800-mg目标片剂大小和15-kp目标硬度压制80片,并确定释放谱。与速释片
剂相比,确定片剂的释放速率。(b)实施例3-2:通过直接混合和压制制备0.5kg批次的化合物a与20%methocel k100lv的粉末共混物。80片以800-mg目标片剂大小和15-kp硬度进行压制,并确定释放谱。在时间点《6小时和时间点≥6小时时,将片剂的释放速率与控释胶囊进行比较。(c)实施例3-3:通过共混和压制制备0.5kg批次的化合物a与20%carbopol 71g的粉末共混物。以800-mg目标片剂大小和15-kp硬度压制80片,并确定释放谱。将片剂的释放速率与控释胶囊进行比较。(d)使用0.3071”x 0.7087”长方形工具压缩三种共混物中的每一种。实施例4:制备包含含有的控释组合物的片剂。
[0252]
含有的控释片剂的一个示例如表7所示。表7表7实施例5:制备包含含有ethocel
tm
的控释组合物的片剂。
[0253]
含有ethocel
tm
的控释片剂的一个示例如表8所示。表8
实施例6:制备包含含有的控释组合物的片剂。
[0254]
含有的控释片剂的一个示例如表9所示。表9实施例7:制备包含含有hpc(hxf级)的控释组合物的片剂。
[0255]
含有hpc(hxf级)的控释片剂的一个示例如表10所示。表10实施例8:制备包含含有hpmc(methocel
tm
)的控释组合物的片剂。
[0256]
含有hpmc(methocel
tm
)的控释片剂的一个示例如表11所示。表11
实施例9:制备包含含有和ethocel
tm
的控释组合物的片剂。
[0257]
在一些片剂中,亲水性和疏水性聚合物联合使用以仔细地控制药物释放。
[0258]
含有carbopol和ethocel
tm
的控释片剂的一个示例如表12所示。表12表12实施例10:制备含有包覆有受控释放包衣的速释片芯的片剂。
[0259]
聚醋酸乙烯酯(pvac,mw 450,000)是一种疏水聚合物。pvac是不溶的,并且不像其他缓释聚合物(如,黄原胶、瓜尔胶或刺槐豆胶,以及羟烷基化或羧基烷基化纤维素赋形剂)那样强烈溶胀。pvac以30%的分散体形式提供,所述分散体包含2.7%的聚维酮k30作为成孔剂和0.3%的十二烷基硫酸钠(sls)作为稳定剂/润湿剂。聚维酮在从不溶性pvac薄膜中释放药物分子方面发挥着重要作用,而sls提供了在包覆期间分散聚合物的优势,从而形成均匀的薄膜。此外,pvac的自密封特性对于防止即释和避免任何剂量倾倒也至关重要(ensslin等人,2009)。
[0260]
用受控释放包衣包覆的速释片芯的一个示例如表13所示。表13
*以30%(w/w分散体)喷洒实施例11:制备含有包覆有受控释放包衣的亲水性基质的片剂。
[0261]
含有包覆有受控释放包衣的亲水性基质的片剂的示例如表14所示。表14实施例12:体外溶解
[0262]
药物制剂的释放速率是根据美国药典中的标准化溶解测试方法描述的,其中少于50%的药物在1小时测定期间释放,并且不少于70%的药物在目标给药期(如8至至少12小时)释放。
[0263]
使用usp装置ii(桨式)进行体外药物释放,其中500ml溶解介质在37
±
1℃、50rpm下保持12小时。前2小时使用0.1n hcl(ph 1.2)作为溶解介质,接下来的10小时使用ph 7.2的磷酸盐缓冲液。分别以0.5、2、4、8、12、18和24小时的间隔抽取样品。然后,使用样品的过滤部分通过分光光度法(uv/vis)测定溶解药物的量。在任何时间间隔释放的药物是通过计
算属于来自每个制剂的六个片剂的平均累积药物释放百分比来获得的。实施例13:含有亲水性聚合物基质的300mg含量片剂的制备和表征片剂制备
[0264]
根据表15中提供的配方,使用方案1中描述的一般制造程序以各自500g的规模制备三个试验。简而言之,制造方法涉及简单的直接混合和压制方法。
[0265]
如上文实施例3中所述,使用25%polyox
tm n60 k制备实施例13-1;使用20%methocel
tm k100 lv制备实施例13-2;使用20%71g制备实施例13-3。表15方案1
物理特性
[0266]
化合物a占制剂的37.5%,并且由于制造方法涉及简单的直接混合和压制方法,起始化合物a的物理特性对最终混合物本身具有显著影响。化合物a具有相对粗的粒度分布和中等的流动特性。与赋形剂混合后,实施例13-1(polyox n60k)和实施例13-3(carbopol 71g)的流动特性普遍得到了改善。[与颗粒状和自由流动的polyox n60k和carbopol 71g不同,methocel k100 lv是流动性通常较差的细粉]。然而,尽管实施例13-2(methocel k100 lv)的流动性较差,但是所有制剂在压片期间压制良好。
[0267]
表16和17提供了三种制剂的片剂物理特性的总结。表16粒度分布
表17片剂物理特性
[0268]
每个试验都使用大约15kp的目标片剂硬度。没有遇到粘连或拾取问题,所得片剂没有缺陷。片剂脆性结果非常好。
[0269]
三种制剂中的任何一种都没有检测到粘连或穿孔成膜。对于实施例13-1(polyox
tm n60k)和实施例13-3(71g),观察到良好的流动性以及均匀的重量和硬度。对于实施例13-2(methocel
tm k100 lv),观察到具有一些重量波动和可变硬度的合理流动。溶解测试
[0270]
对每种制剂的样品均进行溶解测试。
[0271]
由usp装置1(篮式)确定的三种制剂的溶解结果产生的溶解谱比预期慢得多,特别是对于包含71g的实施例13-3,在18小时内仅释放33%的药物。包含methocel
tm k100lv的实施例13-2产生了相对线性的谱,在18小时内释放了大约60%的药物。尽管包含polyox
tm n60k的实施例13-1在18小时内也释放了60%的药物,但是该聚合物在所有测试时间点都具有显著高度的变异性(%rsd),而其他两种聚合物产生的结果更加一致。
[0272]
然而,篮可能无法提供与基质片剂足够的流体动力学相互作用,并且篮的细网状材料可能会被片剂侵蚀的凝胶材料阻塞。因此,使用usp装置2(桨式)在75rpm下对含有71g和methocel
tm k100lv的片剂重复进行溶解测试。
[0273]
与初始结果相比,使用usp装置2(桨式)代替装置1生成的两种聚合物的溶解结果都在6小时后产生了更快释放谱。然而,在含有20%carbopol 71g的制剂(实施例13-3)的情况下,结果在18小时时间点显著增加,这表明片剂基质可由于所涉及的增加的流体动力而破裂。
[0274]
表18中提供了三种制剂的溶解结果的总结。表18表18实施例14:小规模制备含有低水平亲水性聚合物基质的300mg含量片剂
[0275]
为了加快实施例13中观察到的溶解速率,用较低水平的所用聚合物配制新片剂。我们根据表19中的配方制备了四种最初的小型试验(50g)共混物。随着聚合物水平的降低,可溶性填料(甘露醇)的水平相应增加,以保持剂量的净重不变。更高水平的可溶性填充剂可以进一步促进释放速率。表19
[0276]
使用mtcm-1液压机手动压制来自这些混合物中的每一种的片剂样品,并使用装置2(桨式)以75rpm将片剂样品放入装配有含900ml水的容器的溶解装置中,以在8小时内物理观察片剂。
[0277]
含有10%聚合物水平的片剂随时间表现出片剂的持续渐进的侵蚀。含有71g的片剂(实施例14-4)实际上在6小时时开始分解成较大的碎片,并在8小时时更完全地分解。
[0278]
基于这些观察结果,基于实施例14-2(10%methocel
tm
k100 lv)和14-4(10%71g)的制剂制备了化合物a片剂的两种较大的制剂。实施例15:制备和表征含有10%亲水性聚合物基质的300mg含量片剂片剂制备
[0279]
使用方案1(实施例13)中描述的一般制备方法,按照表19中提供的配方以各自550g的规模制备两个试验。简而言之,制备方法涉及简单的直接混合和压制方法。
[0280]
实施例15-1使用10%71g制备;使用10%methocel
tm k100 lv制备实施例15-2。表19
物理特性
[0281]
实施例15-2(10%methocel
tm k100 lv)的流动特性明显优于实施例13-2(20%methocel
tm k100 lv)。然而,71g实施例(实施例15-1)在这种较低的聚合物水平下仍保持更好的流动特性和相对较粗的粒度分布。
[0282]
两个实施例均在manesty betapress上以42rpm的速度成功压缩。
[0283]
表20和21中提供了三种制剂的片剂物理特性的总结。表20粒度分布
表21片剂物理特性
[0284]
每个试验都使用大约15kp的目标片剂硬度。没有遇到粘连或拾取问题,所得片剂没有缺陷。片剂脆性结果非常好。
[0285]
使用任一制剂均未检测到粘连或穿孔成膜。对于实施例15-1(71g),观察到良好的流动性以及均匀的重量和硬度。对于实施例15-2(methocel
tm k100 lv),观察到具有一些重量波动和可变硬度的合理流动。溶解度测试
[0286]
如实施例13中所述,使用usp装置2(桨式)对每种制剂的样品进行溶解测试。
[0287]
实施例15-2(10%methocel
tm k100 lv)显示了维持化合物a释放长达18小时的溶解谱。此时95.4%的药物已释放。这比包含20%methocel
tm k100 lv的先前试验(实施例13-2)明显更快。
[0288]
相比之下,与含有20%71g的试验(实施例13-3)相比,实施例15-1
(10%71g)的溶解谱显示出在早期时间点释放速率仅适度增加。与实施例13-3一样,在12小时时间点释放急剧增加,这表明基质可能已经分解。
[0289]
表22中提供了两种制剂的溶解结果的总结。表22
[0290]
虽然在低聚合物浓度下化合物a的释放速率有所提高(特别是使用methocel
tm k100 lv),但是通常认为10%的聚合物水平过低而无法实现18小时的持续释放期,因此结果是出人意料的。在进一步研究化合物a的溶解度特性后,化合物a在ph 7下的溶解度实际上非常低(24小时后为1.04mg/ml),该ph与用于本研究的溶解介质(ph 6.8磷酸钾缓冲液)接近。由于其在该ph值下的低溶解度,化合物a基质片剂的释放将主要受限于凝胶基质的侵蚀,而不是扩散和侵蚀二者。其次,在900ml缓冲液中300mg含量化合物a的预期漏槽条件在最大情况下也是微不足道的。此外,化合物a可与亲水性聚合物协同相互作用,从而产生更强的基质,强于比这些特定聚合物所使用的水平下通常实现的情况。综上,这些结果表明methocel
tm k100 lv为化合物a产生了更理想的溶解谱。结论
[0291]
含有300mg化合物a的持续释放片剂是可行的。极低水平的methocel
tm k100 lv(10%)产生了18小时的持续释放谱,并且在本研究中研究的三种亲水聚合物中,methocel
tm k100 lv产生了最理想的持续释放剂量特征。此外,优选使用桨式装置(相对于篮式装置)来评估基于持续释放基质的片剂。实施例16:临床试验—药代动力学比较研究
[0292]
单剂量和多剂量相对生物利用度研究的目的是评估缓释制剂的pk并展示在单剂量和多剂量施用化合物a后的等效暴露和其他pk参数(例如c
min
)。
[0293]
采用随机、开放标签、2路交叉研究。将一组对象分开,一半暴露于每天(bid给药)两次化合物,一半被给予er制剂中的化合物,其量通常是两倍于通过单剂量给予至bid接受其的患者的量。
[0294]
此外,任选地采用2期研究设计,其中每个期由单剂量阶段组成,随后是使用相同制剂的多剂量阶段。对象随机接受er或速释(ir)片剂。然后对象以交叉方式切换到另一组。
[0295]
对于er治疗,在第1天单剂量er制剂(例如,600mg er片剂),然后从第3天到第7天qd给药er制剂片剂。ir治疗由以下组成:2剂化合物a于ir 300-mg片剂中,其在研究的第1天大约间隔12小时施用,然后在第3天至第7天bid给药ir制剂片剂(间隔12小时)。本研究的多剂量阶段在两种治疗(er和ir)中进行了足够长的时间,以使血浆值达到稳定状态(对于ir化合物a,约5天)。在交叉之前,观察72小时的清除期。
[0296]
在研究的单剂量阶段(第1天),从在给药前(0小时)和给药后0.5、1、2、3、4、6、9、12、24、36和48小时接受er制剂的对象收集样品。对于ir治疗,还在夜晚剂量后0.5、1、2、3、4、6和9小时收集血样。
[0297]
在研究的多剂量阶段,在给药前至给药后24小时,以与单剂量研究中使用的相似方式收集血样。为了建立稳态和c
min
值,在多剂量阶段的第3、4和5天的早晨收集给药前血样。
[0298]
化合物a的分析是使用专门为该化合物开发的典型等离子体处理和分析方法(lc/ms-ms)完成的。使用为此目的开发的软件(例如,winnonlin,certara usa,inc.,princeton,nj,usa)完成对化合物a的pk行为的分析。实施例17:临床试验—食物影响研究
[0299]
单剂量的化合物a ir制剂的临床试验表明,食物对化合物a的药代动力学没有显著影响。为了证实这对于er制剂也是正确的,进行了食物影响研究。
[0300]
为测试食物效应,采用随机、开放标签、单剂量、2期、2路交叉研究。对象(通常为15-25人)随机在禁食或进食条件下接受片剂形式的化合物a。
[0301]
对于禁食治疗,对象在禁食过夜后接受单一的er片剂(例如,600mg)和水(约0.25l)。
[0302]
进食治疗包括在施用化合物a的单一er片剂(600mg)和0.25l水之前30分钟,进食标准(美国食品和药物管理局)高脂肪早餐。使用的早餐是高热量(800-1000卡路里)、高脂肪测试餐(占总卡路里的50%),其中分别大约150、350和500-600卡路里来自蛋白质、碳水化合物和脂肪。要求对象在30分钟内吃完早餐。
[0303]
药物施用后,在给药后约4小时内不给予额外的食物,并且在给药前和给药后2小时内不提供额外的水。针对交叉期的清除期通常为72小时。
[0304]
以多个间隔收集pk样品:给药前(0小时)和每种治疗条件给药后0.5、1、2、3、4、6、9、12、24、36和48小时。
[0305]
使用专门为该化合物开发的典型等离子体处理和分析方法(lc/ms-ms)对化合物a进行分析。使用为此目的开发的软件(例如,winnonlin,certara usa,inc.,princeton,nj,usa)完成对化合物a的pk行为的分析。
[0306]
本领域的技术人员将认识到,可以对本文所阐述的说明性示例进行各种修改、添加和替换而不背离本发明的精神,并且因此认为在本发明的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。