1.本发明涉及生物技术领域,特别涉及人绒毛膜促性腺激素活性的检测方法。
背景技术:
2.人绒毛膜促性腺激素(hcg)是由胎盘的滋养层细胞分泌的一种糖蛋白。人绒毛膜促性腺激素和脑垂体千叶分泌的黄体生成激素(lh)都是糖蛋白激素,hcg和lh通过与靶细胞上同一受体结合传递激素信息。lh/hcg受体位于细胞膜上,在体内分布广泛,不仅在性腺靶组织,且在一些非性腺组织中如前列腺、乳腺、肾上腺、甲状腺、大脑皮层也有表达。近几年的相关研究发现,lh/hcg受体也存在于某些恶性肿瘤细胞表面,如子宫内膜癌、宫颈癌、卵巢癌、乳腺癌、胃癌等。hcg受体分子较大,细胞外氨基端区由约340个氨基酸组成,富含亮氨酸,对激素的识别起重要作用。hcg与卵巢细胞膜上的lh/hcg受体结合,激活腺苷酸环化酶系统而刺激甾体激素的合成,参与哺乳动物的生殖过程,如受精卵着床、性腺发育及功能活动的调节。
3.在临床上,重组人绒毛膜促性腺激素(重组hcg)已被用于治疗不育症、黄体功能不足、功能性子宫出血、隐睾症、男性性机能减退症、先兆流产或习惯性流产等疾病。在相关药物的生产过程中,需要对质量进行严格控制,其中,生物学活性是质量控制的重要指标之一。根据重组hcg的理化性质和药效学特点,重组hcg的活性测定可分为体外细胞测定法、体内测定法、酶促反应测定法和免疫学活性方法,然而各有不足之处。目前的常用检测方法为《中国药典》收录的小鼠子宫增重法,该法操作繁琐、实验周期长、受个体差异影响较大。
4.因此,有必要开发重组hcg的生物活性检测的新方法。
技术实现要素:
5.基于此,本发明的目的之一是提供一种人绒毛膜促性腺激素(hcg)活性的检测方法,该方法是一种hcg活性的体外细胞测定法,采用chaps稀释液配制hcg待测样品,药物专属性和细胞专属性良好、稳定性指示属性良好,中间精密度变异系数小,平均回收率高,线性拟合相关系数为接近1,相对活性检测范围适中,能够实现对hcg生物学活性的准确、灵敏测试,为药物生产的质量控制提供关键技术。
6.在本发明的第一方面,提供一种人绒毛膜促性腺激素活性的检测方法,其包括如下步骤:
7.获取hcg分析标准品、hcg供试品和工具细胞,所述工具细胞为能够表达g蛋白耦联受体和环核苷酸门控通道的细胞;
8.配制分析标准品溶液,其中,所述分析标准品溶液由chaps稀释液和所述hcg分析标准品配制而成;
9.配制供试品溶液,其中,所述供试品溶液由chaps稀释液和所述hcg供试品配制而成;
10.将所述工具细胞与ro20-actone染料进行避光孵育,获得细胞染料样品;其中,所
述 ro20-actone染料为含有磷酸二酯酶抑制剂ro20-1724的actone膜电位染料;和
11.将所述分析标准品溶液和供试品溶液分别与所述细胞染料样品混合,孵育,根据细胞样品的染色结果测定得出所述hcg供试品的相对活性。
12.在一些实施方式中,所述chaps稀释液为chaps与dpbs溶液的混合物,chaps相对于所述dpbs溶液的浓度为0.04%~0.06%(w/v)。
13.在一些实施方式中,所述的检测方法包括如下步骤:
14.获取所述hcg分析标准品、所述hcg供试品和所述工具细胞;
15.将所述工具细胞与所述ro20-actone染料进行避光孵育,并以相同条件在多个培养孔中进行,获得多个细胞染料样品,采集多个所述细胞染料样品的初始荧光信号值f0;
16.向多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述分析标准品溶液,获得具有第一hcg浓度系列的多个细胞样品液;向其他的多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述供试品溶液,获得具有第二hcg浓度系列的多个细胞样品液;在相同条件下对各个细胞样品液进行避光孵育,孵育结束后分别测试终点荧光信号值ft;其中,各浓度的所述分析标准品溶液分别由所述chaps稀释液和所述hcg分析标准品配制而成,各浓度的所述供试品溶液分别由所述chaps稀释液和所述hcg供试品配制而成;
17.根据所述第一hcg浓度系列的多个细胞样品液的f0和ft,分析得到所述hcg分析标准品的半数有效浓度ec
50(s)
;根据所述第二hcg浓度系列的多个细胞样品液的f0和ft,分析得到所述hcg供试品的半数有效浓度ec
50(t)
;根据ec
50(s)
和ec
50(t)
的比值计算出所述hcg供试品的相对活性;其中,所述ec
50(s)
和所述ec
50(t)
均采用四参数逻辑拟合分析法分析得到。
18.在一些实施方式中,所述的检测方法满足如下一个或多个特征:
19.(ta1)所述第一hcg浓度系列中的最高hcg浓度和所述第二浓度系列中的最高hcg浓度各自独立地大于等于50ng/ml;
20.(ta2)所述第一hcg浓度系列中的最低hcg浓度和所述第二hcg浓度系列中的最低hcg浓度各自独立地小于等于0.0008ng/ml;
21.(ta3)所述第一hcg浓度系列中任意两个相邻hcg浓度间的稀释因子和所述第二hcg浓度系列中任意两个相邻hcg浓度间的稀释因子各自独立地选自1.5~5;
22.(ta4)所述第一hcg浓度系列和所述第二hcg浓度系列中的hcg浓度分布数量各自独立地为8、9、10、11、12、13、14或15;
23.(ta5)所述第一hcg浓度系列和所述第二hcg浓度系列的hcg浓度分布范围各自独立地包括0.00076~50ng/ml,稀释因子各自独立地为2或4;
24.(ta6)所述第一hcg浓度系列和所述第二hcg浓度系列各自独立地包括如下hcg浓度值:自高至低排序的各浓度值相对于首孔浓度的稀释因子依次为1、4、4、4、2、2、2、2、 4、4和4,其中所述首孔浓度为50ng/ml;
25.(ta7)所述第一hcg浓度系列和所述第二hcg浓度系列的hcg浓度分布设置相同;和 (ta8)在相同条件下对各个细胞样品液进行避光孵育的步骤中,孵育温度为25~30℃,孵育时间为30~60min。
26.在一些实施方式中,所述hcg分析标准品和所述hcg供试品均为重组人绒毛膜促性腺激素。
(gpcrs)和环核苷酸门控通道(cng);hcg药物能够与lhcgr重组细胞表面的gpcrs 结合并将其激活,经一系列反应生成环磷酸腺苷(camp),在磷酸二酯酶抑制剂ro20存在情况下,hcg药物浓度越高,细胞内增高的camp浓度越高,细胞膜去极化程度越高,荧光信号越强,检测到荧光信号与hcg的剂量明显相关,利用该原理,可以间接测定hcg的细胞生物学活性。根据加样(添加hcg)前的荧光信号值f0和加样后的荧光信号值ft的比值 ft/f0随加样浓度(hcg浓度,记为c
hcg
)对数值的变化曲线(ft/f0-c
hcg
曲线),可采用四参数曲线拟合的方法计算出半数有效浓度ec
50
,将供试品与分析标准品的数据进行比较,可得到供试品的相对活性。
48.发明人经大量探索发现,采用3-[3-(胆固醇氨丙基)二甲基氨基]-1-丙磺酸(chaps)的溶液作为hcg的样品稀释液,可以使测试体系更加稳定灵敏,可以搭配较低的首孔浓度(预设 hcg浓度梯度的首孔浓度可以为50ng/ml)进行hcg的生物学活性测试。进一步地,基于 hek293细胞的lhcg重组细胞(hek293/lhcg重组细胞)能够专属性地用于hcg的体外活性检测。
[0049]
本发明提供的hcg活性的测试方法,药物专属性和细胞专属性良好、稳定性指示属性良好,中间精密度变异系数(cv%)小,平均回收率高,线性拟合相关系数接近1,相对活性检测范围适中(如50%~200%),能够实现对hcg生物学活性的准确、灵敏测试,为药物生产的质量控制提供关键技术。在一些实施例中,所述hcg供试品的相对活性具备如下特征: cv%均小于30%,平均回收率为98%~107%,线性拟合相关系数可达r2≥0.9995,相对活性检测范围为50%~200%。
附图说明
[0050]
为了更清楚地说明本技术实施例中的技术方案、更完整地理解本技术及其有益效果,下面将对实施例描述中所需要使用的附图作简单的介绍。显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对本领域技术人员来说,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0051]
图1、本发明的一实施例中不同浓度的chaps稀释液对应的ft/f0荧光信号随hcg药物浓度变化的曲线图;
[0052]
图2、本发明的一实施例中不同成分的稀释液对应的ft/f0荧光信号随hcg药物浓度变化的曲线图;
[0053]
图3、本发明的一实施例的96孔板中第2-11例的稀释因子依次为2.5倍(2-3列)、2 倍(4-8列)、2.5倍(9-11列)的稀释曲线图;
[0054]
图4、本发明的一实施例的96孔板中第2-11例的稀释因子依次为4倍(2-4列)、2倍 (5-8列)、4倍(9-11列)的稀释曲线图;
[0055]
图5、本发明的一实施例中不同种类药物的ft/f0荧光信号随hcg药物浓度变化的曲线图;
[0056]
图6、本发明的一实施例中不同种类细胞的ft/f0荧光信号随hcg药物浓度变化的曲线图;
[0057]
图7、本发明的一实施例中的稳定性指示属性的ft/f0荧光信号随hcg药物浓度变化的曲线图,采用不同的测试时间点;
[0058]
图8、实测相对活性与理论相对活性的线性分析图。
具体实施方式
[0059]
下面结合附图、实施方式和实施例,对本发明作进一步详细的说明。应理解,这些实施方式和实施例仅用于说明本发明而不用于限制本发明的范围,提供这些实施方式和实施例的目的是使对本发明公开内容理解更加透彻全面。还应理解,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式和实施例,本领域技术人员可以在不违背本发明内涵的情况下作各种改动或修改,得到的等价形式同样落于本发明的保护范围。此外,在下文的描述中,给出了大量具体的细节以便提供对本发明更为充分地理解,应理解,本发明可以无需一个或多个这些细节而得以实施。
[0060]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述实施方式和实施例的目的,不是旨在于限制本发明。
[0061]
术语
[0062]
除非另外说明或存在矛盾之处,本文中使用的术语或短语具有以下含义:
[0063]
本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/或b”包括a、b和a及b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一项(也即均用“逻辑或”连接的技术方案),也包括a、b、 c、d的任意的和所有的组合,也即包括a、b、c、d中任两项或任三项的组合,还包括a、 b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
[0064]
本发明中涉及“多个”、“多种”、“多次”等,如无特别限定,指在数量上大于2或等于2。例如,“一种或多种”表示一种或大于等于两种。
[0065]
本文中所使用的“其组合”、“其任意组合”、“其任意组合方式”等中包括所列项目中任两个或任两个以上项目的所有合适的组合方式。
[0066]
本文中,“合适的组合方式”、“合适的方式”、“任意合适的方式”等中所述“合适”,以能够实施本发明的技术方案、解决本发明的技术问题、实现本发明预期的技术效果为准。
[0067]
本文中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。如果一个技术方案中出现多处“优选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“优选”各自独立。
[0068]
本发明中,“进一步”、“更进一步”、“特别”等用于描述目的,表示内容上的差异,但并不应理解为对本发明保护范围的限制。
[0069]
本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种,或者指选自“包括”或“包括”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。例如,“可选地包括”,表示包括或者包括。
[0070]
本发明中,“第一方面”、“第二方面”等中,术语“第一”、“第二”等仅用于描述目的,
不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
[0071]
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
[0072]
在本技术中,涉及方法的子步骤,如无特别说明,这些子步骤并不是必然按照描述的顺序依次执行。除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,其可以以其他的顺序执行。而且,各个步骤可以独立地包括多个子步骤或者多个阶段,这些子步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,其执行顺序也不必然是依次进行,而是可以与其他步骤或者其他步骤的子步骤或者阶段的至少一部分轮流或者交替或者同时地执行。
[0073]
本发明中,涉及到数值区间(也即数值范围),如无特别说明,该数值区间内可选的数值的分布视为连续,且包括该数值区间的两个数值端点(即最小值及最大值),以及这两个数值端点之间的每一个数值。如无特别说明,当数值区间仅仅指向该数值区间内的整数时,包括该数值范围的两个端点整数,以及两个端点之间的每一个整数,相当于直接列举了每一个整数。当提供多个数值范围描述特征或特性时,可以合并这些数值范围。换言之,除非另有指明,否则本文中所公开之数值范围应理解为包括其中所归入的任何及所有的子范围。该数值区间中的“数值”可以为任意的定量值,比如数字、百分比、比例等。“数值区间”允许广义地包括百分比区间,比例区间,比值区间等区间类型。
[0074]
本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内存在变动。应当理解的是,所述的恒温处理允许温度在仪器控制的精度范围内进行波动。允许在如
±
5℃、
±
4℃、
±
3℃、
±
2℃、
±
1℃的范围内波动。
[0075]
本发明中,术语“室温”一般指25℃~30℃,较佳地指20℃
±
5℃。在本发明的一些实施例中,室温是指25℃~30℃。
[0076]
在本发明中,涉及数据范围的单位,如果仅在右端点后带有单位,则表示左端点和右端点的单位是相同的。比如,40~60mm表示左端点“40”和右端点“60”的单位都是mm。
[0077]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本技术的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技术特征的举例、优选方式也可作为参考纳入本技术中,但以能够实施本发明为限。应当理解,当引用内容与本技术中的描述相冲突时,以本技术为准或者适应性地根据本技术的描述进行修正。
[0078]
在本发明中,如无其他限定,hcg表示人绒毛膜促性腺激素,进一步地,如无特别限定,指人工合成或者经人工分离得到的人绒毛膜促性腺激素,其蛋白序列可以与野生型相同或不同。
[0079]
在本发明中,如无其他限定,lhcgr重组细胞,指经基因重组改造得到的能够表达g 蛋白耦联受体(gpcrs)和环核苷酸门控通道(cng)的重组细胞。
[0080]
在本发明中,如无其他限定,hek293/lhcg重组细胞,指hek293经细胞基因重组改
造得到的能够表达g蛋白耦联受体(gpcrs)和环核苷酸门控通道(cng)的hek293重组细胞。
[0081]
在本发明中,如无其他限定,chaps表示3-[3-(胆固醇氨丙基)二甲基氨基]-1-丙磺酸。
[0082]
在本发明中,如无其他限定,ro20指ro20-1724,是一种磷酸二酯酶抑制剂,可选择性地抑制环磷腺苷-磷酸二酯酶(camp-pde),使其不能水解camp。
[0083]
在本发明中,如无其他限定,ft/f0-c
hcg
曲线,指加样(样品为hcg)前的荧光信号值 f0和加样后的荧光信号值ft的比值ft/f0随加样浓度(hcg浓度,记为c
hcg
)对数值的变化曲线。
[0084]
在本发明中,如无其他限定,“首孔浓度”指用于制作ft/f0-c
hcg
曲线的一系列hcg浓度梯度中的最高hcg浓度所在培养孔对应的浓度。
[0085]
在本发明中,如无特别限定,荧光信号值为相对光单位值(rlu)。
[0086]
在本发明中,如无其他说明,检测对象为hcg,分析标准品指hcg分析标准品,供试品指hcg供试品,质控品指hcg质控品。
[0087]
在本发明中,涉及hcg供试品的相对活性,hcg质控品的相对活性,如无其他说明,均指相对于hcg分析标准品的相对活性,可通过hcg分析标准品的ec
50
与hcg供试品的ec
50
的比值,或hcg分析标准品的ec
50
与hcg质控品的ec
50
的比值表示。
[0088]
本发明的第一方面
[0089]
在本发明的第一方面,提供一种人绒毛膜促性腺激素(hcg)活性的检测方法,该方法是一种hcg活性的体外细胞测定法,采用chaps溶液作为hcg的样品稀释液,可搭配较低的首孔浓度。该方法的药物专属性和细胞专属性良好、稳定性指示属性良好,中间精密度变异系数小(包括ec
50
的中间精密度变异系数),平均回收率高,线性拟合相关系数为接近1,相对活性检测范围适中,能够实现对hcg生物学活性的准确、灵敏测试,为药物生产的质量控制提供关键技术。
[0090]
人绒毛膜促性腺激素(hcg)和脑垂体千叶分泌的黄体生成激素(lh)都是糖蛋白激素,均由α和β两条多肽链组成,卵泡刺激素(fsh)、hcg、lh及促甲状腺素(tsh)的α亚单位相同,而β亚单位是特异性很高的部分。hcg和lh通过与靶细胞上同一受体结合传递激素信息。lh/hcg受体位于细胞膜上,在体内分布广泛,不仅在性腺靶组织,且在一些非性腺组织中如前列腺、乳腺、肾上腺、甲状腺、大脑皮层也有表达。相关研究还发现,lh/hcg 受体也存在于某些恶性肿瘤细胞表面,如子宫内膜癌、宫颈癌、卵巢癌、乳腺癌、胃癌等。在分子结构方面,hcg受体的空间结构与其他g蛋白耦联受体(gpcrs)相同,都属于g蛋白耦联受体视紫质/β2肾上腺素能受体类家族a。lh/hcg受体与其他许多g蛋白受体有共同之处,均有7个跨膜肽区,4个胞质区(包括3个胞质环状区和羧基端区)以及由3个环状区和氨基端组成的细胞外区。hcg受体分子较大,细胞外氨基端区由约340个氨基酸组成,富含亮氨酸,对激素的识别起重要作用。hcg与卵巢细胞膜上的lh/hcg受体结合,激活腺苷酸环化酶系统而刺激甾体激素的合成,参与哺乳动物的生殖过程,如受精卵着床、性腺发育及功能活动的调节。
[0091]
关于hcg的结构信息,还可参见文献“张才田,戴晓华,崔毓桂.黄体生成激素/人绒毛膜促性腺激素受体研究进展[j].国外医学(计划生育/生殖健康分册),2007(03):169-171.”及其引用文献。
[0092]
hcg药物能够与细胞表面的gpcrs结合并将其激活,被激活的g蛋白再激活细胞膜
上的腺苷酸环化酶,催化atp脱去一个焦磷酸而生成环磷酸腺苷(camp),细胞内增高的camp 进而能激活cng通道,导致离子外流,细胞膜去极化,这种去极化的程度可以通过合适的细胞膜荧光染料检测到(如含有磷酸二酯酶抑制剂ro20的actone染料)。此外,camp作为底物可被细胞内环磷腺苷-磷酸二酯酶(camp-pde)水解为无活力的5'-amp,降低胞内 camp含量。因此,hcg药物能够与lhcgr重组细胞表面的gpcrs结合并将其激活,经一系列反应生成camp,在磷酸二酯酶抑制剂ro20存在情况下,ro20可选择性地抑制 camp-pde,使其不能水解camp,此时,hcg药物浓度越高,细胞内增高的camp浓度越高,细胞膜去极化程度越高,荧光信号越强,检测到荧光信号与hcg的剂量明显相关,利用该原理,可以间接测定hcg的细胞生物学活性。
[0093]
根据加样(添加hcg)前的荧光信号值f0和加样后的荧光信号值ft的比值ft/f0随加样浓度(hcg浓度,记为c
hcg
)对数值的变化曲线(ft/f0-c
hcg
曲线),可采用四参数曲线拟合的方法计算出半数有效浓度ec
50
,将hcg供试品与hcg分析标准品的数据进行比较,可得到hcg供试品的相对活性。
[0094]
在本技术中,涉及hcg样品(如供试品或质控品)的活性,如无其他说明,可以采用相对于分析标准品的相对活性来表征。
[0095]
在本技术中,如无其他说明,“相对活性”指hcg样品(如供试品或质控品)相对于分析标准品的相对活性。
[0096]
在本技术中,如无其他说明,“中间精密度”指在方法验证中,在包括不同实验人员、不同实验日期、不同浓度等一种或多种变量变化的不同实验条件下精密度。
[0097]
在本技术中,如无其他说明,“中间精密度变异系数”指在同一个实验室环境下,不同时间由不同实验人员测得结果之间的相对标准差。
[0098]
在本技术中,如无其他说明,“回收率”可表示测试方法的准确度,如无其他说明,数值上等于实测值与理论值的比值百分率。进一步地,如无其他说明,“回收率”指hcg样品 (如供试品或质控品)的相对活性的回收率。
[0099]
在本技术中,如无其他说明,“平均回收率”指hcg样品(如供试品或质控品)的相对活性的平均回收率。
[0100]
在本技术中,如无其他说明,“线性拟合相关系数”指hcg样品的实测相对活性与理论相对活性的线性拟合曲线的相关系数,该系数越接近1,说明线性越好,表明测试结果越准确。
[0101]
在一些实施方式中,将lhcgr重组细胞于96孔荧光板上培养一段时间(如过夜,如 12~18h),加入膜染料室温避光孵育2h后,先用酶标仪在激发波长535nm,发射波长595nm 条件下读取背景荧光值f0。然后分别在不同培养孔中加入待测样品(分析标准品或供试品,还可以为质控品,不同的待测样品在不同培养孔中分别测试)孵育,再于酶标仪上在激发波长535nm,发射波长595nm条件下读取样品荧光信号值ft。根据样品荧光信号值ft与背景荧光值f0的比值(ft/f0),用四参数曲线拟合的方法计算出各待测样品的半数有效浓度ec
50
,将供试品(或质控品)与分析标准品进行比较,可得到供试品(或质控品)的相对活性。
[0102]
在一些实施方式中,提供一种人绒毛膜促性腺激素活性的检测方法,包括如下步骤:
[0103]
获取hcg分析标准品、hcg供试品和工具细胞,所述工具细胞为能够表达g蛋白耦联
受体和环核苷酸门控通道的细胞;
[0104]
配制分析标准品溶液,其中,所述分析标准品溶液由chaps稀释液和所述hcg分析标准品配制而成;
[0105]
配制供试品溶液,其中,所述供试品溶液由chaps稀释液和所述hcg供试品配制而成;
[0106]
将所述工具细胞与ro20-actone染料进行避光孵育,获得细胞染料样品;其中,所述 ro20-actone染料为含有磷酸二酯酶抑制剂ro20的actone膜电位染料;和
[0107]
将所述分析标准品溶液和供试品溶液分别与所述细胞染料样品混合,孵育,根据细胞样品的染色结果测定得出所述hcg供试品的相对活性。
[0108]
在一些实施方式中,提供一种人绒毛膜促性腺激素活性的检测方法,包括如下步骤:
[0109]
s10:获取hcg分析标准品,hcg供试品和工具细胞,所述工具细胞为能够表达g蛋白耦联受体和环核苷酸门控通道的细胞;
[0110]
s20:将所述工具细胞与ro20-actone染料进行避光孵育,并以相同条件在多个培养孔中进行,获得多个细胞染料样品,采集多个所述细胞染料样品的初始荧光信号值f0;其中,所述ro20-actone染料为含有磷酸二酯酶抑制剂ro20的actone膜电位染料;
[0111]
s30:向多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述分析标准品溶液,获得具有第一hcg浓度系列的多个细胞样品液;向其他的多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述供试品溶液,获得具有第二hcg浓度系列的多个细胞样品液;在相同条件下对各个细胞样品液进行避光孵育,孵育结束后分别测试终点荧光信号值ft;其中,各浓度的所述分析标准品溶液分别由chaps稀释液和所述分析标准品配制而成,各浓度的所述供试品溶液分别由chaps稀释液和所述供试品配制而成;
[0112]
s40:根据所述第一hcg浓度系列的多个细胞样品液的f0和ft,分析得到所述hcg分析标准品的半数有效浓度ec
50(s)
;根据所述第二hcg浓度系列的多个细胞样品液的f0和ft,分析得到所述hcg供试品的半数有效浓度ec
50(t)
;根据ec
50(s)
和ec
50(t)
的比值计算出所述 hcg供试品的相对活性;进一步地,所述ec
50(s)
和所述ec
50(t)
均采用四参数逻辑拟合分析法分析得到。
[0113]
在一些实施方式中,荧光信号值(f0及ft)为rlu(相对光单位值)。
[0114]
在一些实施方式中,荧光信号值f0的获取条件为:激发波长535
±
5nm(如535nm),发射波长595
±
5nm(如595nm)。
[0115]
在一些实施方式中,荧光信号值ft的获取条件为:激发波长535
±
5nm(如535nm),发射波长595
±
5nm(如595nm)。
[0116]
在一些实施方式中,所述f0和所述f
t
的获取条件分别包括:激发波长535
±
5nm(如 535nm),发射波长595
±
5nm(如595nm)。
[0117]
在一些实施方式中,荧光信号值f0和荧光信号值ft的获取条件相同,均为:激发波长 535
±
5nm(如535nm),发射波长595
±
5nm(如595nm)。
[0118]
s10:提供待测样品和工具细胞。
[0119]
在步骤s10中,提供人绒毛膜促性腺激素的分析标准品和供试品,还可选地提供质控品。
[0120]
在本发明中,分析标准品通过如下方式获得:采用重组人绒促性素(r-hcg)原液经稀释、分装、检定及标定获得。
[0121]
在本发明中,供试品可以为任意的人绒毛膜促性腺激素,只要是人工合成或经人工分离得到的即可。供试品的hcg可以具有野生序列,也可以为突变体,突变方式可以包括但不限于插入、删除、移位、置换等等。
[0122]
在一些实施方式中,人绒毛膜促性腺激素为重组人绒毛膜促性腺激素。
[0123]
在一些实施方式中,hcg供试品通过如下方式获得:利用重组表达人绒促性素(r-hcg) 细胞株经细胞培养后分离纯化获得。
[0124]
在本发明中,hcg质控品的获取方式与hcg分析标准品的获取方式相同。分析标准品可用于制作随浓度变化的hcg的标准曲线。质控品可起到系统适应性样品的作用。由于质控品的获取方式与分析标准品相同,因此,理论上,质控品相对于分析标准品的相对活性应为 100%,应理解,允许有一定误差区间如
±
30%,对应相对活性70%-130%。通过质控品相对活性的校验,可以考察是否存在系统异常。
[0125]
在一些实施方式中,所述hcg分析标准品和所述hcg供试品均为重组人绒毛膜促性腺激素。
[0126]
在步骤s10中,还提供工具细胞,用于检测hcg样品的活性。
[0127]
在一些实施方式中,所述工具细胞为hek293/lhcgr重组细胞,细胞专属性好。
[0128]
s20:提供细胞染料样品,获取初始荧光信号值f0。
[0129]
可采用下述s200的方法获取细胞悬液。还可参考步骤s300的接种条件,比如培养器皿,接种密度等。
[0130]
在一些实施方式中,将所述工具细胞与ro20-actone染料进行避光孵育的步骤中,所述工具细胞在每个培养腔中的接种密度为1.4
×
103~1.6
×
103个/mm2。
[0131]
在一些实施方式中,将所述工具细胞与ro20-actone染料进行避光孵育的步骤中,孵育温度为25~30℃,孵育时间为120
±
15min。
[0132]
在一些实施方式中,所述ro20-actone染料采用包括如下步骤的方法配制而成:每毫升的1
×
actone膜电位染料中加入0.04~0.06μmol的ro20。
[0133]
在一些实施方式中,ro20-actone染液为含有0.04~0.06mm磷酸二酯酶抑制剂ro20的 1
×
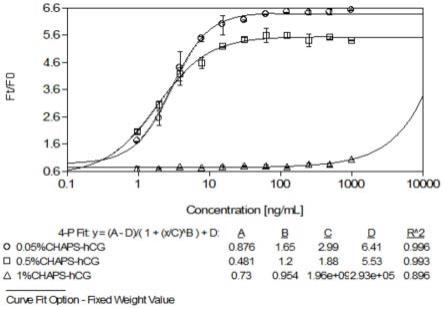
actone膜电位染料,此时,ro20-actone染液的组成为:每ml的1
×
actone膜电位染料中含有0.04~0.06μmol的ro20。此时,ro20在ro20-actone染液中的浓度可以为40~60 μm,举例如40μm、45μm、50μm、55μm、60μm等。在本技术中,涉及“ro20”,如无其他说明,指ro20-1724。
[0134]
在一些实施方式中,所述1
×
actone膜电位染料由10
×
actone膜电位染料(可市购获得)稀释10倍制备而成。在一些实施方式中,所述10
×
actone膜电位染料的厂家为 codexbio solutions。
[0135]
在一些实施方式中,所述ro20-actone染料采用包括如下步骤的方法配制而成:将 40~60mm的ro20溶液与1
×
actone膜电位染料按照体积比1:(1000
±
200)进行混合(例如体积比1:1000、1:800、1:900、1:1200、1:1100等),进一步地,进一步地,所述ro20溶液为ro20的dmso溶液。
[0136]
在一些实施方式中,ro20的dmso溶液中的ro20浓度可以为40mm、45mm、50mm、 55mm
或60mm。
[0137]
在一些实施方式中,将所述工具细胞与ro20-actone染料进行避光孵育的步骤中,所述 ro20-actone染料的加液量为1倍体积。
[0138]
s30:将具有浓度梯度的hcg样品(chaps稀释液配制)与细胞染料样品孵育,获取终点荧光信号值ft。
[0139]
可采用下述步骤s400的方法培养细胞后,加入细胞染料样品进行孵育。
[0140]
chaps稀释液指含有chaps(3-[3-(胆固醇氨丙基)二甲基氨基]-1-丙磺酸)的样品稀释液,用于对hcg待测样品稀释至特定浓度或体积,便于定量加样。在本技术的申请日之前,发明人液尝试过不同成分的样品稀释剂(比如2.5%dmso的dpbs溶液),但发现效果都不大理想,检测方法的稳定性不好。经过大量的探索和辛苦的研究,意外发现采用含有chaps 的溶液作为样品稀释剂,检测效果比较好,实验结果较稳定。推测原因如下:dmso(结构如式),具有高极性,是一种既溶于水又溶于有机溶剂的非质子极性溶剂,被誉为“万能溶剂”小分子物质,但是较多用于化工产业和化学物质的溶解。而chaps(结构为),chaps同时具有亲水基团和疏水基团,能够很好地保护跨膜蛋白的疏水区,因而能为hcg提供较好、较稳定的增溶作用,还可以发挥保护蛋白结构以及增加信号稳定性等作用。
[0141]
在一些实施方式中,所述chaps稀释液为chaps与dpbs溶液的混合物。进一步地, chaps相对于所述dpbs溶液的浓度可以为0.04%~0.06%(w/v),举例如0.04%(w/v)、 0.05%(w/v)、0.06%(w/v)等。
[0142]
在一些实施方式中,所述第一hcg浓度系列中的最高hcg浓度和所述第二浓度系列中的最高hcg浓度各自独立地大于等于50ng/ml。本发明的检测方法允许较低的首孔浓度。
[0143]
在一些实施方式中,所述第一hcg浓度系列中的最低hcg浓度和所述第二hcg浓度系列中的最低hcg浓度各自独立地小于等于0.0008ng/ml,进一步地,可以各自独立地小于等于0.00076ng/ml。
[0144]
在一些实施方式中,所述第一hcg浓度系列中任意两个相邻hcg浓度间的稀释因子和所述第二hcg浓度系列中任意两个相邻hcg浓度间的稀释因子各自独立地选自1.5~5,非限制性示例如1.5、2、2.5、3、3.5、4、4.5、5等。本领域技术人员可以根据待测hcg样品的活性随浓度变化情况选择合适的稀释因子,以便得以从ft/f0-c
hcg
曲线上能够分析得出相应的ec
50
。
[0145]
在本发明中,如无其他说明,浓度系列或浓度梯度的“稀释因子”,将不同浓度按照大小依次从高到低依次排序,稀释因子指任意相邻两个浓度值的倍数关系。在任一个浓度系列中,多个稀释因子可以相同或不同。
[0146]
在一些实施方式中,所述第一hcg浓度系列和所述第二hcg浓度系列中的hcg浓度分布数量各自独立地≥5,进一步可以各自独立地≥6,进一步可以各自独立地≥8,进一步
可以各自独立地≥10,还可以各自独立地选自5~20、5~15、5~12、6~20、6~15、6~12、8~20、8~15、 8~12等,进一步可以各自独立地为8、9、10、11、12、13、14或15。本领域技术人员可以根据待测hcg样品的活性随浓度变化情况选择合适的浓度分布数量,以便更精确地得以从 ft/f0-c
hcg
曲线上分析得出相应的ec
50
。
[0147]
在一些实施方式中,所述第一hcg浓度系列和所述第二hcg浓度系列的hcg浓度分布范围各自独立地包括0.00076~50ng/ml,进一步地,稀释因子各自独立地为2或4。
[0148]
在一些实施方式中,所述第一hcg浓度系列和所述第二hcg浓度系列各自独立地包括如下hcg浓度值:自高至低排序的各浓度值相对于首孔浓度的稀释因子依次为1、4、4、4、 2、2、2、2、4、4和4,其中所述首孔浓度为50ng/ml;各浓度依次对应(部分较低的浓度允许为四舍五入后的近似值):50ng/ml、12.5ng/ml、3.125ng/ml、0.781ng/ml、0.39ng/ml、 0.195ng/ml、0.098ng/ml、0.049ng/ml、0.0122ng/ml、0.003ng/ml和0.00076ng/ml。
[0149]
在一些实施方式中,所述第一hcg浓度系列和所述第二hcg浓度系列各自独立地为如下hcg浓度值:自高至低排序的各浓度值相对于首孔浓度的稀释因子依次为1、4、4、4、2、 2、2、2、4、4和4,其中所述首孔浓度为50ng/ml;各浓度依次对应50(部分较低的浓度允许为四舍五入后的近似值):50ng/ml、12.5ng/ml、3.125ng/ml、0.781ng/ml、0.39ng/ml、 0.195ng/ml、0.098ng/ml、0.049ng/ml、0.0122ng/ml、0.003ng/ml和0.00076ng/ml。
[0150]
在一些实施方式中,所述第一hcg浓度系列和所述第二hcg浓度系列的hcg浓度分布设置可以相同或不同,但优选相同。
[0151]
在一些实施方式中,在相同条件下对各个细胞样品液进行避光孵育的步骤中,孵育温度为25~30℃,孵育时间为30~60min。
[0152]
在一些实施方式中,向多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述分析标准品溶液的步骤中,所述分析标准品溶液相对于每个所述细胞染料样品的加液量均为0.25倍体积;
[0153]
向多个所述细胞染料样品中以不同hcg浓度分别加入相同体积的所述供试品溶液的步骤中,所述供试品溶液相对于每个所述细胞染料样品的加液量均为0.25倍体积。
[0154]
s40:分析得出供试品的相对活性。
[0155]
在本发明中,如无特别限定,hcg供试品的相对活性,可通过hcg分析标准品的ec
50 (可记为ec
50(s)
)与hcg供试品的ec
50
(可记为ec
50(t)
)的比值计算得到。
[0156]
在一些实施方式中,所述进行四参数逻辑拟合分析基于ft/f0比值随hcg浓度对数值的变化曲线。
[0157]
在一些实施方式中,所述进行四参数逻辑拟合分析包括剔除异常数据的步骤。
[0158]
在一些实施方式中,所述的检测方法还包括测试hcg质控品的半数有效浓度ec
50(z)
,所述的检测方法还包括系统适应性判断的步骤,当同时满足如下两个条件时,判定系统适应性通过:条件a,分析所述hcg分析标准品、所述hcg质控品及所述hcg供试品的复孔ec
50
重复性中间精密度变异系数cv%,均应满足不大于30%;和条件b,所述质控品的相对活性应在70%~130%之间。
[0159]
在一些实施方式中,所述hcg供试品的相对活性检测结果满足如下一个或多个特征:
[0160]
50%、75%、100%、125%和可选的200%理论浓度值测试的中间精密度变异系数
均小于 30%;
[0161]
相对活性的平均回收率为98%~107%;
[0162]
相对活性的各次测定结果的回收率范围选自89%~116%;
[0163]
实测相对活性与理论相对活性的线性拟合相关系数为r2≥0.9995;和
[0164]
相对活性检测范围为50%~200%。
[0165]
上述指标均可采用下文实施例所示的方法获得。
[0166]
在本发明的另一些实施方式中,提供一种人绒毛膜促性腺激素活性的检测方法,包括如下步骤:
[0167]
s100:提供人绒毛膜促性腺激素的分析标准品、供试品和质控品;
[0168]
s200:将具有生长活性的重组细胞重悬于培养液,配制得到重组细胞的悬液;其中,重组细胞为lhcgr重组细胞,优选地,lhcgr重组细胞为经基因改造后能够表达g蛋白耦联受体和环核苷酸门控通道的hek293重组细胞,也即hek293/lhcgr重组细胞;
[0169]
s300:设置第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组,每组分别设置多个独立的培养孔;按照如下方式接种重组细胞:向第一实验组、第二实验组、第三实验组和阴性对照组的各培养孔中分别添加重组细胞的悬液,向空白对照组的各培养孔中分别添加培养液,各组别的各培养孔的加液体积(记为v1)相同;
[0170]
s400:完成重组细胞的接种后,将第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组的各培养孔在相同条件下进行重组细胞培养;
[0171]
s500:培养至所需细胞汇合度后,向第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组的各培养孔中分别加入相同体积(记为v2)的ro20-actone染液;添加于各培养孔的ro20-actone染液为含有磷酸二酯酶抑制剂ro20的actone膜电位染料;第一次避光孵育,孵育结束后,读取各培养孔的荧光信号值f0;
[0172]
s600:根据预设的hcg浓度梯度(如选自0.00076~50ng/ml),向第一实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的分析标准品,向第二实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的供试品,向第三实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的质控品,三个实验组均以溶液形式添加(优选地,chaps稀释液预先将分析标准品、供试品和质控品分别稀释为具有相同浓度梯度的三组人绒毛膜促性腺激素溶液);向阴性对照组和空白对照组的各培养孔中分别添加chaps稀释液;各组别的各培养孔的加液体积(记为v3)相同;第二次避光孵育,孵育结束后,读取各培养孔的荧光信号值ft;
[0173]
s700:根据各培养孔的ft值、f0值以及预设hcg浓度梯度,制作ft/f0的浓度曲线,进行四参数逻辑拟合分析,分别获得分析标准品、供试品和质控品的半数有效浓度ec
50
,以分析标准品的ec
50
为参照,分别得出供试品和质控品的相对活性。
[0174]
在一些实施方式中,该检测方法还包括系统适应性判断的步骤s800:当同时满足如下两个条件时,判定系统适应性通过:条件a,分析标准品、质控品及供试品的复孔ec
50
重复性变异系数cv%,均应满足不大于30%;和条件b,质控品的相对活性应在70%~130%之间。当不能同时满足上述的条件a和条件b时,则判定该次实验无效,系统适应性不通过。
[0175]
本发明的各技术方案,也可在省略质控品检测步骤的情况下进行。
[0176]
应当理解,上述步骤s100至步骤s800中,虽然是依次描述,但是这些步骤并不是必
然按照描述的顺序依次执行。除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,其可以以其他的顺序执行。而且,各个步骤可以独立地包括多个子步骤或者多个阶段,这些子步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,其执行顺序也不必然是依次进行,而是可以与其他步骤或者其他步骤的子步骤或者阶段的至少一部分轮流或者交替或者同时地执行。
[0177]
在一些实施方式中,各组别的设计如下:
[0178]
第一实验组的各培养孔:均添加体积v1的lhcgr重组细胞的悬液,均添加体积v2的含ro20的染液,不同培养孔中依次添加预设浓度梯度的hcg分析标准品(体积均为v3);
[0179]
第二实验组的各培养孔:均添加体积v1的lhcgr重组细胞的悬液,均添加体积v2的含ro20的染液,不同培养孔中依次添加预设浓度梯度的hcg供试品(体积均为v3);
[0180]
第三实验组的各培养孔:均添加体积v1的lhcgr重组细胞的悬液,均添加体积v2的含ro20的染液,不同培养孔中依次添加预设浓度梯度的hcg质控品(体积均为v3);
[0181]
阴性对照组的各培养孔:均添加体积v1的lhcgr重组细胞的悬液,均添加体积v2的含ro20的染液,均添加体积v3的样品稀释液(即chaps稀释液,不添加hcg);
[0182]
空白对照组的各培养孔:均添加体积v1的空白培养液(仅不含细胞),均添加体积v2 的含ro20的染液,均添加体积v3的样品稀释液(即chaps稀释液,不添加hcg);
[0183]
其中,各v1相同、各v2相同、各v3相同。
[0184]
在一些实施例中,v1:v2:v3为2:2:1。
[0185]
步骤s100:提供待测样品
[0186]
可参考上文的步骤s10。
[0187]
步骤s200:制备重组细胞的悬液。
[0188]
在步骤s200中,将具有生长活性的重组细胞重悬于培养液,配制得到重组细胞的悬液;其中,重组细胞为lhcgr重组细胞。
[0189]
进一步地,lhcgr重组细胞为经基因改造后能够表达g蛋白耦联受体(gpcr)和环核苷酸门控通道(ncg)的重组细胞。在其中的一些实施例中,lhcgr重组细胞通过对hek293 细胞进行基因改造得到,也即hek293/lhcgr重组细胞,其为经基因改造后能够表达g蛋白耦联受体和环核苷酸门控通道的hek293重组细胞。
[0190]
在一些实施方式中,具有生长活性的重组细胞来源于细胞汇合度生长为60%~90%的 lhcgr重组细胞,进一步为hek293/lhcgr重组细胞。细胞汇合度的举例如60%、70%、 80%、90%等。
[0191]
在一些实施例中,重组细胞的悬液通过将消化后收集的细胞重悬于10%fbs dmem培养液中制得。
[0192]
在一些实施例中,采用胰蛋白酶(如0.25%胰蛋白酶)消化,1~2min至细胞变圆脱壁,加入适量体积新的10%fbs dmem培养液(优选含双抗)中和。用移液器将细胞吹下移至离心管,离心,弃去废液加入10%fbs dmem培养液(优选含双抗)使细胞重新悬浮。在其中的一些实施方式中,离心条件为1000~1200rpm离心5min。
[0193]
在一些实施例中,10%fbs dmem培养液的组分含有如下组分(包括但不限于由如下组分构成):90%
±
2%(v/v)的dmem培养基,10%(v/v)的fbs,1μg/ml嘌呤霉素和250μg/ml 的g-418,均以培养液中的浓度计。
[0194]
在一些实施例中,重组细胞的悬液中的细胞密度为(6~7)
×
105个/ml,例如6.67
×
105个 /ml、6
×
105个/ml、7
×
105个/ml等。
[0195]
步骤s300:接种重组细胞。
[0196]
在步骤s300中,设置第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组,每组分别设置多个独立的培养孔;按照如下方式接种重组细胞:向第一实验组、第二实验组、第三实验组和阴性对照组的各培养孔中分别添加重组细胞的悬液,向空白对照组的各培养孔中分别添加培养液,各组别的各培养孔的加液体积(记为v1)相同。
[0197]
在一些实施方式中,培养器皿为96孔板,进一步可以为平底。
[0198]
在一些实施方式中,重组细胞的悬液中的细胞密度为6.67
×
105个/ml,v1为75μl。进一步地,培养器皿为96孔板,更进一步可以为平底。
[0199]
在一些实施方式中,第一实验组、第二实验组、第三实验组和阴性对照组的各培养孔中的重组细胞的接种密度为1.4
×
103~1.6
×
103个/mm2。
[0200]
s400:重组细胞培养。
[0201]
在步骤s400中,完成重组细胞的接种后,将第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组的各培养孔在相同条件下进行重组细胞培养。
[0202]
在一些实施方式中,重组细胞培养的条件包括:于37℃、5.0%co2的细胞培养箱中,培养至细胞汇合度为60%~90%。细胞汇合度的举例如60%、70%、80%、90%等。
[0203]
在一些实施方式中,培养时间为过夜(如选自12h-18h,进一步举例如12h、13h、14h、 15h、16h、17h、18h等)。
[0204]
s500:加染液孵育。
[0205]
在步骤s500中,培养至所需细胞汇合度后,向第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组的各培养孔中分别加入相同体积(记为v2)的ro20-actone染液;其中,添加于各培养孔的ro20-actone染液为含有ro20的actone膜电位染料;第一次避光孵育,孵育结束后,读取各培养孔的荧光信号值f0。f0为背景荧光信号值。
[0206]
ro20-actone染液可参考前述步骤s20。比如,在一些实施方式中,ro20-actone染液采用如下方法配制:将40~60mm的ro20溶液与1
×
actone膜电位染料按照体积比1:1000 进行混合,进一步地,ro20溶液为ro20的dmso溶液。
[0207]
在一些实施方式中,第一次避光孵育的条件包括:孵育温度为25~30℃,孵育时间为120
ꢀ±
15min。
[0208]
在一些实施方式中,v1:v2的体积比为1:1。
[0209]
s600:加样孵育(添加hcg的待测样品后孵育)。
[0210]
在步骤s600中,根据预设hcg浓度梯度(如选自0.00076~50ng/ml),向第一实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的分析标准品,向第二实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的供试品,向第三实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的质控品(优选地,在添加待测样品前,采用chaps稀释液预先将分析标准品、供试品和质控品分别稀释为具有相同浓度梯度的三组人绒毛膜促性腺激素溶液);向阴性对照组和空白对照组的各培养孔中分别添加chaps稀释液;各组别的各培养孔的加液体积(v3)相同;第二次避光孵育,孵育结束后,读取各培养孔的荧光信号值ft。
[0211]
在一些实施方式中,预设hcg浓度梯度的首孔浓度为50ng/ml。
[0212]
在一些实施方式中,预设hcg浓度梯度选自如下浓度范围:0.00076~50ng/ml。在其中的一些实施方式中,预设hcg浓度梯度包括如下的hcg浓度:50ng/ml、12.5ng/ml、3.125 ng/ml、0.782ng/ml、0.39ng/ml、0.195ng/ml、0.098ng/ml、0.049ng/ml、0.0122ng/ml、 0.003ng/ml和0.00076ng/ml(相对于首孔浓度的稀释因子依次为1、4、4、4、2、2、2、2、 4、4、4)。
[0213]
在一些实施方式中,预设hcg浓度梯度对应的hcg溶液的浓度梯度选自0.00076~50 ng/ml。
[0214]
在一些实施方式中,预设hcg浓度梯度对应的hcg溶液的浓度梯度选自0.0038~250 ng/ml。在其中的一些实施方式中,预设hcg浓度梯度对应的hcg溶液的浓度梯度包括:250 ng/ml、62.5ng/ml、15.63ng/ml、3.91ng/ml、1.95ng/ml、0.98ng/ml、0.49ng/ml、0.24ng/ml、 0.061ng/ml、0.015ng/ml和0.0038ng/ml。
[0215]
在一些实施方式中,第二次避光孵育的条件包括:孵育温度为25~30℃,孵育时间为30~60 min。
[0216]
在一些实施方式中,每孔加液体积v3为30~50μl,举例如30μl、35μl、37.5μl、40μl、 45μl、50μl等。
[0217]
在一些实施方式中,v1:v3为2:1。
[0218]
在一些实施方式中,重组细胞的悬液的每孔加液体积(v1)、ro20-actone染液的每孔加液体积(v2)和hcg溶液的每孔加液体积(v3)的体积比为1:1:0.5(等价于2:2:1)。
[0219]
在一些实施方式中,v1、v2、v3分别为75μl、75μl和37.5μl。
[0220]
s700:计算供试品的相对活性。
[0221]
在步骤s700中,根据各培养孔的ft值、f0值以及预设hcg浓度梯度,制作ft/f0的浓度曲线,进行四参数逻辑拟合分析,分别获得分析标准品、供试品和质控品的半数有效浓度 ec
50
,以分析标准品的ec
50
为参照,分别得出供试品和质控品的相对活性。
[0222]
在一些实施方式中,ft/f0的浓度曲线以ft/f0比值为纵坐标,以培养孔中人绒毛膜促性腺激素浓度的对数值为横坐标。
[0223]
在一些实施方式中,提供一种hcg活性的检测方法,包括如下步骤:
[0224]
提供人绒毛膜促性腺激素的分析标准品、供试品和质控品;
[0225]
将细胞汇合度生长为60%~90%的hek293/lhcgr重组细胞重悬于10%fbs dmem培养液,配制得到hek293/lhcgr重组细胞的悬液;优选地,10%fbs dmem培养液含有: 90%
±
2%(v/v)的dmem培养基,10%(v/v)的fbs,1μg/ml嘌呤霉素和250μg/ml的g-418;
[0226]
按照如下方式接种hek293/lhcgr重组细胞:向第一实验组、第二实验组、第三实验组和阴性对照组的各培养孔中,以选自1.4
×
103~1.6
×
103个/mm2的相同接种密度分别添加hek293/lhcgr重组细胞的悬液,向空白对照组的各培养孔中分别添加10%fbs dmem培养液,各组别的各培养孔的加液体积v1相同;
[0227]
完成hek293/lhcgr重组细胞的接种后,将第一实验组、第二实验组、第三实验组、阴性对照组和空白对照组的各培养孔在37℃、5.0%co2条件下进行重组细胞培养,培养至细胞汇合度为60%~90%;
[0228]
培养至所需细胞汇合度后,向第一实验组、第二实验组、第三实验组、阴性对照组
和空白对照组的各培养孔中分别加入相同体积v2的ro20-actone染液;添加于各培养孔的 ro20-actone染液为含有0.04~0.06mm磷酸二酯酶抑制剂ro20的1
×
actone膜电位染料;于25~30℃进行第一次避光孵育,孵育时间为120
±
15min,孵育结束后,读取各培养孔的荧光信号值f0;
[0229]
根据预设hcg浓度梯度(可选自0.00076~50ng/ml),向第一实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的分析标准品,向第二实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的供试品,向第三实验组的各培养孔中分别添加人绒毛膜促性腺激素浓度符合预设hcg浓度梯度的质控品,三个实验组均以溶液方式添加人绒毛膜促性腺激素(优选地,采用chaps稀释液预先将所述分析标准品、所述供试品和所述质控品分别稀释为具有相同浓度梯度的三组人绒毛膜促性腺激素溶液);向阴性对照组和空白对照组的各培养孔中分别添加chaps稀释液,其中,chaps稀释液为 chaps的dpbs溶液,且其中chaps相对于dpbs溶液的浓度为0.04%~0.06%(w/v);各组别的各培养孔的加液体积v3相同;于25~30℃进行第二次避光孵育,孵育时间为30~60min,读取各培养孔的荧光信号值ft;
[0230]
根据各培养孔的ft值、f0值以及预设hcg浓度梯度,以ft/f0比值为纵坐标,以培养孔中人绒毛膜促性腺激素浓度的对数值为横坐标,制作ft/f0的浓度曲线,进行四参数逻辑拟合分析,分别获得分析标准品、供试品和质控品的半数有效浓度ec
50
,以分析标准品的ec
50
为参照,分别得出供试品和质控品的相对活性;
[0231]
其中,荧光信号值f0和荧光信号值ft的获取条件均为:激发波长535
±
5nm(如535nm),发射波长595
±
5nm(如595nm);v1:v2:v3的体积比为1:1:0.5。
[0232]
s800:可选的系统适应性判断
[0233]
在一些实施方式中,该检测方法可选地还包括系统适应性判断的步骤s800:当同时满足如下两个条件时,判定系统适应性通过:条件a,分析标准品、质控品及供试品的复孔ec
50
重复性变异系数cv%,均应满足不大于30%;和条件b,质控品的相对活性应在70%~130%之间。当不能同时满足上述的条件a和条件b时,则判定该次实验无效,系统适应性不通过。
[0234]
在一些实施方式中,进行四参数逻辑拟合分析包括剔除异常数据的步骤。在其中的一些实施例中,提出异常数据的标准包括如下三个指标:
[0235]
(1)可剔除明确存在技术问题的值,如个别污染孔、非单调量效曲线值等异常数据;
[0236]
(2)ec
50
值前后两点处应该尽量避免剔除值,即使剔除时应当尽量谨慎;和
[0237]
(3)每块板(如96孔板)剔除值不多于3个孔。
[0238]
在一些实施方式中,采用如下方式计算结果:以分析标准品(std)为参照,选择强制平行模式softmax软件将自动计算供试品和质控品的相对活性,结果以百分号前保留整数记录。
[0239]
在一些实施方式中,检测方法还包括系统适应性判断的步骤,当同时满足如下两个条件时,判定系统适应性通过:条件a,分析标准品、质控品及供试品的复孔ec
50
重复性变异系数cv%,均应满足不大于30%;和条件b,质控品的相对活性应在70%~130%之间。
[0240]
在一些实施方式中,所述hcg供试品的相对活性满足如下特征中的一个或多个:
(1) 50%、75%、100%和125%(可选地,还包括200%;另可选地,还包括150%)理论浓度值测试的中间精密度变异系数cv%均小于30%,(2)相对活性的平均回收率为98%~107%, (3)相对活性的各次测定结果的回收率范围选自89%~116%,(4)实测相对活性与理论相对活性的线性拟合相关系数为r2≥0.9995,和(5)相对活性检测范围包括50%~200%。
[0241]
在本发明的第一方面所提供的检测方法,经实验验证了检测hcg的专属性,还验证了方法的准确性、精密度、线性、检测范围和稳定性指示属性,方法验证的结果表明:对药物种类和细胞种类的专属性良好、稳定性指示属性良好。在一些实施方式中,该方法的日间精密度和不同操作员测定结果的cv%均小于30%,平均回收率为98%~107%,线性拟合相关系数为r2=0.9995,相对活性检测范围为50%~200%,能够适用于hcg生物学活性的测定。
[0242]
本发明的第二方面
[0243]
在本发明的第二方面,提供一种人绒毛膜促性腺激素活性的检测试剂盒,其能够用于方便地实施本发明提供的hcg活性的检测方法,可免于复杂的试剂配制环节,加快检测效率。
[0244]
在一些实施方式中,提供一种人绒毛膜促性腺激素活性的检测试剂盒,其包括:
[0245]
本发明的第一方面所述的检测方法中的人绒毛膜促性腺激素的分析标准品;以及
[0246]
用于实施本发明的第一方面的检测方法的非待测物质,其中可选地包括重组细胞及/或培养液。
[0247]
在一些实施方式中,待测物质选自分析标准品、供试品和质控品中的一种或多种。
[0248]
在一些实施方式中,非待测物质不包括分析标准品、供试品和质控品。
[0249]
其中,人绒毛膜促性腺激素的分析标准品、重组细胞、培养液、分析标准品、供试品和质控品的定义各自独立地可参见本发发明的第一方面。
[0250]
以下提供一些具体实施例。
[0251]
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册(如“王军志.生物技术药物研究开发和质量控制(第二版).北京:科学出版社,2007”)或常规条件,还可以按照制造厂商所建议的条件,或者参考本领域已知的实验方法。
[0252]
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
[0253]
表1.试剂信息
[0254][0255]
表2.耗材名称
[0256][0257]
说明:表2中,“*”为优先使用上表中推荐厂家货号的试剂耗材,若暂无法获取:生物试剂如酶应尽量使用推荐厂家,亦可使用经考察合格的其他厂家;其他化学试剂和耗材如无特殊说明可使用分析纯试剂和无菌耗材。
[0258]
表3.实验设备
[0259][0260]
溶液配制
[0261]
g418溶液(50mg/ml):称取g418粉末1g(amresco),加超纯水20ml溶解,0.22μm 过滤除菌,分装后-20℃保存,有效期1年。或者直接取用50mg/ml g418溶液(promega)。
[0262]
嘌呤霉素溶液(2mg/ml):向25mg装的嘌呤霉素试剂瓶中,直接加入超纯水12.5ml 溶解,0.22μm过滤除菌,分装后-20℃保存,有效期1年。
[0263]
ro20溶液(50mm):向100mg装的ro20试剂瓶中,直接加入dmso 7.2ml溶解,配制成50mm的ro20溶液,分装后-20℃保存,有效期2年。
[0264]
10%chaps储存液:称取chaps粉末5g,加超纯水50ml溶解,0.22μm过滤除菌,5
±
3℃保存,有效期2年。
[0265]
10%fbs dmem培养液(含双抗)组成如下:
[0266][0267]
每400ml培养液,取358ml dmem培养液,40ml胎牛血清,2ml g418溶液 (50mg/ml),200μl嘌呤霉素溶液(2mg/ml),混匀,根据实际用量成比例增加或者减少,5
±
3℃保存,有效期3个月。
[0268]
hek293/lhcgr重组细胞的获取
[0269]
细胞铺板
[0270]
取生长汇合度达60%~90%的hek293/lhcgr重组细胞,将培养液弃去,加入dpbs缓冲液或其它合适溶液清洗细胞后弃去,再用0.25%胰蛋白酶1-2ml消化1-2min至细胞变圆脱壁,加入适量体积新的10%fbs dmem培养液(含双抗)中和。用移液器将细胞吹下移至离心管,1000-1200rpm离心5min,弃去废液加入10%fbs dmem培养液(含双抗)使之重新悬浮。细胞计数,调整细胞密度至6.67
×
105个/ml,用多道移液器在黑色底透96孔培养板的第1-11列、b-g排按75μl/孔加入细胞,b12-d12每孔加入75μl细胞作为阴性对照, e12-g12每孔加入75μl 10%fbs dmem培养液(含双抗)作为空白对照。a排和h排各孔加入不少于200μl pbs封闭,以减少边缘效应。将细胞板置于37℃、5.0%co2培养箱中培养过夜至细胞汇合度达60%~90%。
[0271]
ro20-actone染液配制
[0272]
取1ml 10
×
actone dye dilution buffer,加入9ml灭菌超纯水混匀,配制成1
×
actonedye dilution buffer,再取1ml 10
×
actone membrane potential dye solution,加入9ml的1
ꢀ×
actone dye dilution buffer稀释,然后加入50mm的ro20溶液10μl混匀,配制成含ro20 (浓度为50μm)的1
×
actone染料备用。此步操作临用现配,可根据实际用量成比例增加或减少。
[0273]
添加染料
[0274]
将配制好的含50μm ro20的1
×
actone染料,按75μl/孔加入到细胞板中第1-11列、 b-g排,以及b12-d12孔(阴性对照)和e12-g12孔(空白对照),于室温避光孵育2h
±ꢀ
15min,用酶标仪在激发波长535nm,发射波长595nm条件下读取背景荧光值f0。
[0275]
样品稀释液的配制
[0276]
在加样槽中加入dpbs 10ml,然后加入50μl 10%chaps储存液混合均匀,配制成含 0.05%chaps的样品稀释液(可记为0.05%chaps稀释液),可根据实际用量成比例增加或者减少,临用新制。
[0277]
分析标准品(std)、供试品(sam)、质控品(ctl)溶液的制备
[0278]
分析标准品通过企业自制,即用重组人绒促性素(r-hcg)原液经稀释、分装、检定及标定获得;hcg供试品通过利用重组表达人绒促性素(r-hcg)细胞株经细胞培养后分离纯化获得;质控品同分析标准品。
[0279]
取分析标准品(lzm003)、供试品、质控品(以同批次分析标准品替代),先用样品稀
释液稀释至250ng/ml,并以此为起始按照(2-4列)4倍、(5-8列)2倍、(9-11列)4 倍在稀释板中进行稀释,即稀释至下列浓度梯度:250、62.5、15.63、3.91、1.95、0.98、0.49、0.24、0.061、0.015和0.0038ng/ml,各浓度梯度体积不少于50μl。其中,na表示不稀释,对应的是具有最大hcg浓度的首孔所需hcg溶液。按照表5所示方式进行布板。
[0280]
表4.待添加的hcg溶液的浓度梯度
[0281][0282]
表5.
[0283][0284]
注:std-#=分析标准品稀释序号,sam-#=供试品稀释序号、ctl-#=质控品稀释序号。
[0285]
加样
[0286]
将细胞培养板取出,用多道移液器按表5顺序(11至1列,样品浓度由低至高),以37.5 μl/孔加入各稀释梯度的分析标准品、供试品、质控品溶液,然后在b12-g12孔各加入37.5μl 样品稀释液。于室温避光孵育30-60min。
[0287]
检测
[0288]
将细胞板取出放入荧光酶标仪中,按酶标仪标准操作规程操作,设定和选择方法,选择激发波长535nm,发射波长595nm读取荧光信号值ft。计算加样后检测的荧光信号值与加样前的背景荧光信号值比值(ft/f0),以ft/f0值为纵坐标,以lzm003浓度的对数值为横坐标,使用softmax软件进行四参数逻辑拟合分析。根据四参数方程得出半数有效浓度ec
50
,即曲线方程中的参数c值。
[0289]
异常值剔除标准
[0290]
由于相对活性计算时所使用的ec
50
值是来源于多个数据的拟合,剔除一些异常值可提高测定结果的准确性。剔除标准如下:
[0291]
(1)可剔除明确存在技术问题的值,如个别污染孔、非单调量效曲线值等异常数据。
[0292]
(2)ec
50
值前后两点处应该尽量避免剔除值,即使剔除时应当尽量谨慎。
[0293]
(3)一块板剔除值不多于3个孔。
[0294]
结果计算
[0295]
以分析标准品std为参照,选择强制平行模式softmax软件将自动计算供试品和质控品相对活性,以百分比表示,结果以百分号前保留整数记录。
[0296]
供试品的相对活性=分析标准品的ec
50
/供试品的ec
50
;
[0297]
质控品的相对活性=分析标准品的ec
50
/质控品的ec
50
。
[0298]
系统适应性判断
[0299]
分析标准品、质控品及供试品复孔ec
50
的重复性变异系数cv%应不大于30%,质控品相对活性应该在70%~130%之间,同时满足以上两条件系统适应性通过,否则该次实验无效。
[0300]
ec
50
的cv%的可根据统计学中的变异系数公式计算得到。
[0301]
实施例1.lzm003稀释buffer考察
[0302]
目的:考察lzm003样品稀释buffer。
[0303]
方法:
[0304]
1、hek293/lhcgr重组细胞接种量50000个/孔,采用187.5μl体系,lzm003起始浓度200ng/ml,2倍梯度稀释,11个浓度梯度;分别采用含1%chaps的dpbs溶液、0.5% chaps的dpbs溶液以及含0.05%chaps的dpbs溶液稀释lzm003样品,考察对结果的影响。
[0305]
2、hek293/lhcgr重组细胞接种量50000个/孔,采用187.5μl体系,lzm003起始浓度200ng/ml,2倍梯度稀释,11个浓度梯度;分别采用含2.5%dmso的dpbs溶液以及含 0.05%chaps的dpbs溶液稀释lzm003样品,考察不同种类稀释液对结果的影响。
[0306]
结果:可参见图1、图2。
[0307]
结论:从图1可知,采用含1%chaps的样品稀释液明显干扰了lzm003的反应信号,用含0.05%chaps的样品稀释液lzm003信号响应值较用含0.5%chaps的样品稀释液高;从图2可知,用含0.05%chaps的样品稀释液lzm003 ec
50
明显较用含2.5%dmso的样品稀释液小,方法灵敏度更高。
[0308]
实施例2.lzm003起始浓度、稀释梯度优化
[0309]
目的:优化lzm003起始浓度及倍比稀释梯度。
[0310]
方法:
[0311]
1、hek293/lhcgr重组细胞接种量50000个/孔,采用187.5μl体系,lzm003起始浓度250ng/ml(对应首孔浓度为50ng/ml),2-3列进行2.5倍梯度稀释、4-8列2倍梯度稀释、9-11列进行2.5倍梯度稀释,11个浓度梯度。采用含0.05%chaps的dpbs溶液稀释 lzm003样品。
[0312]
2、hek293/lhcgr重组细胞接种量50000个/孔,采用187.5μl体系,lzm003起始浓度250ng/ml(对应首孔浓度为50ng/ml),2-4列进行4倍梯度稀释、5-8列2倍梯度稀释、 9-11列进行4倍梯度稀释,11个浓度梯度。采用含0.05%chaps的dpbs溶液稀释lzm003 样品。根据曲线选择可适用于lzm003起始浓度和稀释梯度。
[0313]
结果:可参见图3(方法1)和图4(方法2)。
[0314]
结论:对比图3和图4可知,采用含0.05%chaps的dpbs溶液稀释lzm003样品, lzm003起始浓度250ng/ml,2-4列4倍、5-8列2倍、9-11列4倍梯度稀释,四参数曲线上平台3个点,下平台3个点,中间3个点,上下平台拐点各1个点,符合四参数拟合要求。
[0315]
实施例3.方法验证
[0316]
3.1.专属性
[0317]
3.1.1.lzm003药物专属性
[0318]
目的:采用r-hcg、r-hcg buffer(制剂缓冲液)、at132(抗tnfα单克隆抗体)、lzm002c (抗cd20单克隆抗体)、lzm005(抗her2单克隆抗体)、lzm009(抗pd-1单克隆抗体)为样品,考察r-hcg与hek293/lhcgr重组细胞表面受体结合的专属性。
[0319]
程序:按确定好的反应条件操作,采用含0.0.5%chaps的dpbs溶液稀释以上样品。
[0320]
结果:可参见图5。
[0321]
结论:不同样品的作用结果表明,r-hcg与hek293/lhcgr重组细胞表面受体结合特异性较好。
[0322]
3.1.2.细胞专属性
[0323]
目的:采用几种不同细胞实验,考察r-hcg与hek293/lhcgr重组细胞表面受体结合的专属性。
[0324]
程序:以50000个/孔接种量,同时接种lhcgr重组细胞hek293(经基因改造表达g 蛋白耦联受体和环核苷酸门控通道的hek293重组细胞,来源于codex biosolutions)、raji细胞(人淋巴瘤细胞,来源中科院上海细胞所)、jurkat细胞(人t淋巴细胞瘤细胞,来源中科院上海细胞所)、pd-1effector cell细胞(重组过表达人pd-1的jurkat细胞系,来源于 promega)、tf-1细胞(人血液白血病细胞,来源于atcc)、hek293(il-6r)细胞(重组过表达人il-6r的hek293细胞系,来源于武汉普健生物)。
[0325]
结果:可参见图6。
[0326]
结论:本例中不同细胞的作用结果表明,r-hcg与hek293/lhcgr重组细胞表面受体结合特异性最好。
[0327]
3.2.稳定性指示属性
[0328]
目的:验证方法能够有效指示样品活性变化。
[0329]
程序:选取分析标准品(arm-lzm003-003),分别采用70℃水浴处理2min、5min、10min、20min、30min,然后与不经过处理的分析标准品在同等条件下进行活性测定,以不经过处理的分析标准品为参比,计算不同处理条件下样品相对活性的变化。
[0330]
结果:可参见图7和表6。
[0331]
表6.不同处理条件下样品活性变化
[0332]
处理条件相对活性arm-lzm003-003100%70℃2min39.1%70℃5min32.9%70℃10min29.3%70℃20min23.4%70℃30min18.7%
[0333]
结论:结果表明,随着处理时间的增加,活性逐渐降低。表明方法能够有效检测到lzm003 活性变化,故方法稳定性好。
[0334]
3.3.准确性
[0335]
目的:采用添加和回收实验来测定准确性,即将已知量的lzm003加到空白中进行
测定,比较测定值和真实值之比(回收率)。
[0336]
程序:按确定好的操作条件和程序,由3名分析员分别于不同日测50%、75%、100%、125%和200%浓度的工作样品,统计回收率的变异系数(cv%)和范围。
[0337]
回收率的计算方法为:实测浓度/理论浓度
×
100%。
[0338]
设置可接受标准:每次实验回收率应在70%~130%,每次重复实验之间的cv%≤30%,平均回收率应在80%~120%。
[0339]
结果:可参见表7。
[0340]
表7.不同检测浓度下回收率统计结果
[0341][0342]
结论:实验回收率范围为89%~116%;重复实验cv%≤30%;平均回收率范围为 98%~107%;总回收率100%,总cv%≤30%,准确度高。
[0343]
3.4.重复性
[0344]
目的:考察不同分析人员在不同实验日期对100%浓度实验相对活性的差异。
[0345]
程序:按确定好的操作程序,由3名分析人员分别于不同日测100%浓度分析标准品,每位分析人员各2次实验,统计相对活性的变异系数(cv%)。
[0346]
设置可接受标准:相对活性的变异系数(cv%)应小于30%。
[0347]
结果:可参见表8。
[0348]
表8.重复性测定结果
[0349][0350]
结论:不同分析人员在不同日测定100%浓度样品,6次实验的cv%≤30%,符合重复性可接受标准要求。
[0351]
3.5.中间精密度
[0352]
目的:不同实验条件,包括不同分析人员、不同实验日期等,比较不同检测浓度(50%、 71%、100%、141%和200%)在不同日操作的精密度。前述浓度可对应分析标准品的理论浓度。
[0353]
程序:分别由3名分析人员于不同日测50%、75%、100%、125%和200%检测浓度的样品,每一分析人员每一浓度各进行2次实验,统计相对活性的变异系数(cv%)。
[0354]
设置可接受标准:由不同分析人员不同日测定每一浓度结果的变异系数均应小于30%。
[0355]
结果:可参见表9。
[0356]
表9.中间精密度统计结果
[0357][0358]
结论:不同分析员不同日测不同浓度结果的变异系数均小于30%,符合可接受标准要求。
[0359]
3.6.线性
[0360]
线性目的:测定各浓度供试品与测定值的线性相关性。
[0361]
实验程序:按确定好的操作程序,分别于不同日测定50%、75%、100%、125%和200%浓度的工作标准品,每一浓度进行3次实验,统计每一浓度的平均相对活性,以理论相对活性为横坐标,以实测相对活性为纵坐标,进行线性拟合。
[0362]
设置可接受标准:拟合曲线的直线相关系数r2应不小于0.99。
[0363]
结果:可参见表9和图8。
[0364]
结论:拟合曲线的直线相关系数r2等于0.9995,符合可接受标准要求。
[0365]
3.7.范围
[0366]
目的:确定分析方法的检测范围。
[0367]
程序:参照准确性实验,分别测定50%、75%、100%、125%和200%浓度的分析标准品,统计不同浓度测定结果的变异和回收率的范围。
[0368]
设置可接受标准:同准确性实验。
[0369]
结果:同准确性实验。
[0370]
结论:在50%~200%测试范围内,各浓度测定结果的cv%均≤30%,平均回收率范围为 98%~107%,符合可接受标准要求。
[0371]
3.8.
[0372]
根据前述实施例,已对专属性、重复性、中间精密度、准确度、线性、范围、稳定性指示属性进行了验证。
[0373]
经实验验证的结果表明:本发明提供的检测方法专属性良好,稳定性指示属性良好、中间精密度变异系数(cv%)小于30%,各次测定结果的回收率范围为89%~116%,线性相关系数为r2可达0.9995,相对活性的检测范围为50%~200%。能够用于lzm003生物学活性的测定。
[0374]
进一步地,提供一组优选的主要参数:lzm003首孔浓度50ng/ml(加样后浓度),2-4 列进行4倍梯度稀释、5-8列2倍梯度稀释、9-11列进行4倍梯度稀释,共11个浓度梯度(加样前的浓度梯度250ng/ml、62.5ng/ml、15.63ng/ml、3.91ng/ml、1.95ng/ml、0.98ng/ml、 0.49ng/ml、0.24ng/ml、0.061ng/ml、0.015ng/ml和0.0038ng/ml),采用含0.05%chaps 的dpbs溶液稀释lzm003样品,加样体积37.5μl,加样后的总体积为187.5μl。
[0375]
以上各实施方式和实施例的各技术特征可以进行任意合适方式的组合,为使描述简洁,未对上述实施方式和实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为在本说明书记载的范围中。
[0376]
以上各实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对本发明保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,得到的等价形式同样落于本发明的保护范围。还应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或者有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。