1.本发明涉及一种钴铬合金支架及药物涂层支架,属于支架技术领域。
背景技术:
2.随着药物洗脱支架(drug eluting stent)越来越多地应用于临床,其优异的临床疗效为临床医生带来了巨大的鼓舞,也给患者带来了福音。虽然第一代des有效地抑制了血管内再狭窄率,但在有效抑制血管平滑肌细胞增殖的同时,也延缓了内皮修复,从而增加了引起支架内血栓形成的几率。
3.目前,国内外市场上出现的des新研发方向无非是针对其构成的三个部分进行改进:
①
药物载体改进:药物支架在置入病变血管后,载体能对药物的释放速率进行有效的控制。
②
支架输送系统的改进:影响支架的输送性及支撑性,帮助支架顺利到达病变,实现精准有效的扩张。
③
药物制剂的创新:起到抑制病变部位的内膜增生、有效降低再狭窄率的作用。
4.对于药物制剂的改进,从第一代des
‑‑
cypher的雷帕霉素(sirolimus)和taxus的紫杉醇,到后来的limus药物衍生物,以及两种药物联合的尝试和最新抗体支架的研发,都是研究人员不断的尝试,以期寻求一种更安全、更有疗效的药物以满足临床需求。武汉大学人民医院的邬瑾对pubmed数据库和万方数据库中2010年至2016年有关“药物涂层支架,药物洗脱支架,雷帕霉素,紫杉醇,肝素,佐他莫司,依维莫司”进行了检索,并筛选其中30篇文献进行分析,结果表明雷帕霉素的衍生物(如依维莫司、佐他莫司或拜尔莫司、他克莫司和吡美莫司等)比雷帕霉素,具有更强的亲脂性而有利于发挥药物的局部作用,并且她认为药物的联合应用和双向药物释放支架将是药物涂层支架的又一个新的闪光点(心血管病患者药物涂层支架载入药物的筛选与应用;邬瑾;中国组织工程研究 第 20 卷 第 38 期)。所以,三氧化二砷与他克莫司混合药物洗脱支架是介入心脏病临床迫切的需要。
技术实现要素:
5.为解决上述技术问题,本发明的目的在于提供一种血管支架以及基于该血管支架的药物涂层支架,该血管支架采用特殊的结构设计,是一种兼具高支撑力高柔软性的细梁支架。
6.为达到上述目的,本发明首先提供了一种钴铬合金支架,其中,该钴铬合金支架包括若干个主体单元;所述主体单元相互连接形成管状;每个所述主体单元由通过柔顺筋连接的若干支撑环组成,所述主体单元呈正弦波形;所述柔顺筋的主体为弹簧圈;相邻的主体单元通过若干个连接筋相连;所述连接筋的主体为弹簧圈。
7.根据本发明的具体实施方案,优选地,每一个支撑环呈一个单独的正弦波形状,若干个支撑环组合在一起,使得这些单独的正弦波也连接在一起形成具有完整的正弦波形,即主体单元的正弦波形。
8.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述支撑环之间通过柔顺筋相连的连接方式为:所述支撑环两端分别设有第一连接槽a和第二连接槽b,所述柔顺筋的弹簧圈的两端分别设有连接柱,同一个柔顺筋的两个连接柱分别连接于一个支撑环的第一连接槽a之中、另一个支撑环的第二连接槽b之中;即支撑环两端分别设有第一连接槽a与第二连接槽b,每个支撑环连接两个柔顺筋,柔顺筋两端的连接柱分别插入两个支撑环各自的第一连接槽a、第二连接槽b,柔顺筋两端的连接柱不能同时插入同一支撑环的第一连接槽a和第二连接槽b;作为另一种可以选择的方式,所述弹簧圈与所述支撑环可以直接焊接连接。
9.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述主体单元之间通过连接筋相连的连接方式为:在用于连接的支撑环的圆弧位置处设有第三连接槽c,所述连接筋的弹簧圈的两端分别设有连接柱,同一个连接筋的两个连接柱分别连接于相邻两个支撑环的第三连接槽c之中。
10.根据本发明的具体实施方案,连接筋和柔顺筋可以具有相同的结构,区别仅在于长度不同;各个支撑环的结构都是一样的,第一连接槽a和第二连接槽b仅是为了便于描述进行了区分,在实际使用中,二者是可以互换的。
11.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所有连接筋的分布整体上呈螺旋形,优选地,所述连接筋整体螺旋形分布的数量为2-4个。
12.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述支撑环的厚度为90-150μm,宽度为60-90μm。
13.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述柔顺筋的长度l1(l1如图2所示)为1-5mm,所述柔顺筋的连接柱的直径为0.05-0.1mm,连接柱的高度为10-50μm,弹簧圈的直径0.1-1mm。
14.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述连接筋的长度l3(l3如图3所示)为0.5-2mm,所述连接筋的连接柱的直径为0.05-0.1mm,连接柱的高度为10-50μm,弹簧圈的直径0.1-1mm。
15.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述第一连接槽a,第二连接槽b,第三连接槽c的直径分别为0.05-0.1mm,深度分别为10-50μm。
16.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,所述主体单元之间距离l2(l2如图2所示)为3-10mm。
17.根据本发明的具体实施方案,优选地,在上述钴铬合金支架中,支撑环由钴铬合金制成,所述钴铬合金具有以下组成:铬含量为15-26%,钨含量为10-20%,镍含量为9.0-11.0%,铁含量为3-6%,其余为钴含量。
18.根据本发明的具体实施方案,优选地,所述钴铬合金支架为血管支架。
19.根据本发明的具体实施方案,优选地,柔顺筋和连接筋所采用的弹簧圈为铂钨合金弹簧圈。铂钨合金具有显影性,在射线下具有优异显影性,能够提高支架显影性,便于医生手术操作。
20.本发明还提供了一种药物涂层支架,其包括上述钴铬合金支架以及位于支架表面的药物涂层;其中,所述药物涂层含有三氧化二砷和他克莫司;以所述钴铬合金支架的表面积计,所述三氧化二砷的含量为3-18微克/毫2、他克莫司的含量为3-10微克/毫米2。
21.在上述药物涂层支架中,优选地,所述三氧化二砷的含量为5-15微克/毫米2。
22.在上述药物涂层支架中,优选地,所述他克莫司的含量为3-5微克/毫米2。
23.本发明的他克莫司的药物释放性能的测试过程为,将药物支架浸泡在 pbs溶液中,放入摇床内进行(震荡速度80r/min),到达对应时间段(1d,7d,14d,21d,28d)后(每个时间点至少3根支架)取出支架进行他克莫司浓度的测试。他克莫司的含量测试可采用《hplc 法测定他克莫司片的含量》(吕永超,宋玉才;药学研究
·
journal of pharmaceutical research 2013 vol.32,no.4)第一页中的检测方法进行检测。
24.本发明的药物释放性能,释放过程为,将药物支架浸泡在pbs溶液中,放入摇床内进行(震荡速度100r/min),到达对应时间段(1d,7d,14d,21d,28d)后(每个时间点至少3根支架)取出5ml溶液进行测试。三氧化二砷的药物释放采用文献《as2o3白蛋白纳米微球的制备和体外释放药特性》(周洁,曾甫清,高翔,谢蜀生,魏树礼,中国新药杂志,第54-57页)公开的方法进行检测。
25.在上述药物涂层支架中,优选地,所述三氧化二砷的释放曲线为1天释放30
±
20%,7天释放40
±
20%,28天释放60
±
20%。
26.在上述药物涂层支架中,优选地,所述他克莫司的释放曲线为1天释放大于等于40%。
27.动物试验证明,本发明的三氧化二砷、他克莫司的混合药物洗脱支架中,两种药物的释放分别具有长期作用和短期作用,并且根据调整比例配方,可将药物释放控制在要求范围内,从而达到满足临床应用的需要。
28.本发明通过三氧化二砷与他克莫司组合,采用三氧化二砷与他克莫司对血管的平滑肌,内膜和炎症的不同作用效果,且控制适合的药物释放速率,利用三氧化二砷药物诱导平滑肌细胞(smc)凋亡,同时借助他克莫司抑制炎症细胞。根据这两种药物的特性,使两种药物对血管壁的共同长期作用,可使药物从支架植入后几小时并长期释放,诱导smc凋亡,抑制血管内膜增生和炎症,同时又不影响内皮的修复,对防止再狭窄起到很好作用。
29.本发明还提供了上述药物涂层支架的制备方法,其包括以下步骤:将聚合物与他克莫司溶解于有机溶剂中,其中,他克莫司的浓度为6-10mg/ml,聚合物的浓度为20-50mg/ml;将三氧化二砷颗粒悬浮在有机溶剂中,其浓度为10-30mg/ml;然后将两种溶液混合,搅拌均匀,将此溶液均匀的喷涂到支架的表面,干燥,挥发溶剂后获得药物涂层。
30.在上述制备方法中,三氧化二砷、他克莫司、聚合物的喷涂可以采用常规的喷涂方式,例如cn200510023714.5和cn1413594a所公开的三氧化二砷的喷涂技术,均采用药物在
溶剂中混合后一起喷涂。
31.在上述制备方法中,优选地,所述三氧化二砷、他克莫司和聚合物的重量比为2-35: 1-10:1-100。
32.在上述制备方法中,两种药物通过聚合物的分解,分别进行缓慢、持续、稳定的释放并发挥作用,本发明采用的聚合物可以为生物型可降解高分子材料,优选地,所述聚合物包括聚乳酸(pla)、羟基乙酸(pga)、聚乳酸-羟基乙酸共聚物、双脂肪酸-葵二酸共聚物(pfad-sa)中的一种或两种以上的组合。
33.在上述制备方法中,优选地,所述有机溶剂选自四氢呋喃、二氯甲烷、无水乙醇、三氯甲烷、二甲基甲酰胺、dmso中的一种或两种以上的组合。
34.在上述制备方法中,优选地,有机溶剂中,聚合物的重量含量为1-30%。
35.本发明提供了兼具高支撑力高柔软性的细梁支架,同时将支架与抗增生、抗炎症的功能性复合药物复合形成单层药物涂层,同时又对单层双药物涂层实现了药物互控,获得了同时对单个药物的缓释放控制。在良好支架设计,功能性复合药物和可控的药物缓释技术联合作用下,支架在植入后的动物模型中表现优良。本发明所提供的药物涂层支架具有防治支架术后再狭窄的疗效并且安全性更高。
36.本发明的技术方案带来的有益效果如下:1、支架的连接筋结构,使得支架通过弯曲血管通过性好,大大提高柔顺性和支架贴合血管内壁性能。
37.2、提高支架显影性,方便医生迅速确认支架位置,便于观察支架扩张效果,节省手术时间。
38.3、目前所有市场销售的支架都使用单一药物,本发明使用三氧化二砷和他克莫司两种药物,通过调整在同一药物层中两种复合药物(ato/tac)的药物释放曲线,在能够有效抑制血管内皮细胞炎性反应的同时,也可有效抑制血管平滑肌细胞的增殖行为,降低血管再狭窄率。
附图说明
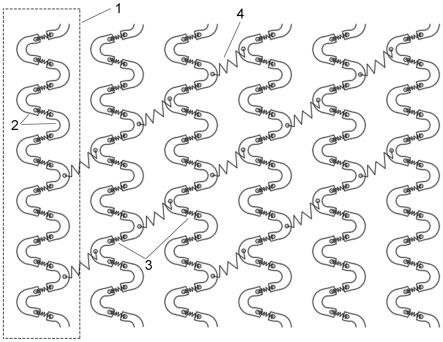
39.图1为本发明的一些具体实施方式提供的钴铬合金支架的展开结构示意图。
40.图2为本发明的一些具体实施方式提供的钴铬合金支架的局部结构示意图。
41.图3为本发明的一些具体实施方式提供的钴铬合金支架的局部结构示意图。
42.图4为柔顺筋和连接筋的结构示意图。
43.图5为支撑环的结构示意图。
44.图6为实施例1的钴铬合金支架的径向抗挤压性能测试结果。
45.图7为实施例2的钴铬合金支架的血管通过性测试结果。
46.图8为对比例1的钴铬合金支架的血管通过性测试结果。
47.图9为不同药物对血管内皮细胞活性友好的浓度范围测试结果。
48.图10为不同药物抑制血管平滑肌细胞活性的有效浓度范围测试结果。
49.图11为tac 抑制血管内皮细胞炎症反应的有效浓度范围测试结果。
50.图12为实施例3-1的三氧化二砷药物的释放结果。
51.图13为实施例3-2的三氧化二砷药物的释放结果。
52.图14为实施例3-3的三氧化二砷药物的释放结果。
53.图15为实施例3-4的tac药物的释放结果。
54.图16为实施例3-5的三氧化二砷药物的释放结果。
55.图17为实施例3-5的tac药物的释放结果。
56.图18为实施例3-6的三氧化二砷药物的释放结果。
57.图19为实施例3-6的tac药物的释放结果。
58.图20为实施例3-7的三氧化二砷药物的释放结果。
59.图21为实施例3-7的tac药物的释放结果。
60.图22为实施例3-1的支架的血管内oct结果图。
61.图23为实施例3-4的支架的血管内oct结果图。
62.图24为实施例3-5的支架的血管内oct结果图。
63.主要附图标号说明:1:主体单元2:支撑环3:柔顺筋4:连接筋5:铂钨合金弹簧圈6:连接柱a:第一连接槽b:第二连接槽c:第三连接槽。
具体实施方式
64.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
65.本发明钴铬合金支架的展开结构如图1所示,该钴铬合金支架包括若干个主体单元1;所述主体单元1相互连接形成管状;每个所述主体单元1由通过柔顺筋3连接的若干支撑环2组成,所述主体单元1呈正弦波形;柔顺筋3由铂钨合金弹簧圈5与连接柱6组成(如图4所示),并且,铂钨合金弹簧圈与连接柱进行焊接固定;相邻的主体单元1通过若干个连接筋4相连;连接筋4由铂钨合金弹簧圈5与连接柱6组成(如图4所示),并且,铂钨合金弹簧圈与连接柱进行焊接固定。连接筋4与柔顺筋3结构相同,区别在于长度的不同。
66.在一些具体实施方案中,所述支撑环之间通过柔顺筋相连的连接方式为:所述支撑环2两端分别设有第一连接槽a和第二连接槽b(如图5所示),所述柔顺筋3的铂钨合金弹簧圈5的两端分别设有连接柱6,同一个柔顺筋3的两个连接柱6分别连接于一个支撑环2的第一连接槽a之中、另一个支撑环2的第二连接槽b之中。
67.在一些具体实施方案中,所述主体单元之间通过连接筋相连的连接方式为:在用于连接的支撑环2的圆弧位置处设有第三连接槽c(如图5所示),所述连接筋4的铂钨合金弹簧圈5的两端分别设有连接柱6,同一个连接筋4的两个连接柱5分别连接于相邻两个支撑环2的第三连接槽c之中。
68.在一些具体实施方案中,主体单元之间的连接筋数量为2-6个。在一些具体实施方案中,在该钴铬合金支架中,所有连接筋的分布整体上呈螺旋形(如图1所示),所述螺旋的数量优选为2-4个。
69.在一些具体实施方案中,所述支撑环的厚度为90-150μm,宽度为60-90μm。
70.在一些具体实施方案中,所述柔顺筋的长度l1为1-5mm,所述柔顺筋的连接柱的直径为0.05-0.1mm,连接柱的高度为10-50μm,铂钨合金弹簧圈的直径0.1-1mm。
71.在一些具体实施方案中,所述连接筋的长度l3为0.5-2mm,所述连接筋的连接柱的直径为0.05-0.1mm,连接柱的高度为10-50μm,铂钨合金弹簧圈的直径0.1-1mm。
72.在一些具体实施方案中,所述第一连接槽a,第二连接槽b,第三连接槽c的直径分别为0.05-0.1mm,深度分别为10-50μm。
73.在一些具体实施方案中,所述主体单元之间距离l2为3-10mm。
74.在一些具体实施方案中,所述柔顺筋与连接筋除了长度不相同,结构相同,柔顺筋与连接筋两端焊接在连接柱上面,如图4所示。其中,所述连接圆柱的直径优选与连接槽的直径的基准尺寸相等,二者为间隙配合。
75.在一些具体实施方案中,所述连接筋的主体材质为铂钨合金。铂钨合金弹簧圈具有显影性,在射线下具有优异显影性,因此提高支架显影性,便于医生手术操作,并且铂钨合金弹簧圈具有优异的柔顺性,大大提高支架通过迂曲血管到达迂曲病变位置性能。
76.本发明的支架的支撑环采用钴铬合金,提供了优良机械性能,能够满足临床使用要求,在一些具体实施方案中,所述钴铬合金具有以下组成:铬含量为15-26%,钨含量为10-20%,镍含量为9.0-11.0%,铁含量为3-6%,其余为钴含量。
77.实施例1本实施例提供了一种钴铬合金支架,其为血管支架,该钴铬合金支架通过连接筋将相邻主体单元的正弦波形的波谷、波峰相连接,连接筋的数量为2个;血管支架主体单元之间的连接筋在空间上呈螺旋状排列分布,且数量为2个;支撑环的厚度为90μm,宽度60μm;柔顺筋的长度0.2mm;连接柱的直径0.05mm,高度50μm;连接筋的长度为0.5mm;第一连接槽、第二连接槽、第三连接槽的直径分别为0.05mm,深度分别为50μm;铂钨合金弹簧圈直径0.1mm。
78.对支架的径向抗挤压性能进行测试,测试过程如下:首先将支架扩张到名义压力下的直径,放入压握机中,调整参数后,将血管支架外径径向挤压,血管支架外径变为90%,此时得到径向支撑力曲线,从而计算出径向支撑力。测试结果如图6所示。本实施例提供的血管支架的主体材质为钴铬合金,提供了优良机械性能,能够满足临床使用要求,由图6可以看出,本实施例的钴铬合金支架具有较高的径向支撑力。
79.实施例2本实施例提供了一种钴铬合金支架,其为血管支架,该钴铬合金支架通过连接筋将相邻主体单元的正弦波形的波谷、波峰相连接,连接筋的数量为3个;血管支架轴向的连接筋在空间上呈螺旋状排列,且数量为3个;支撑环的厚度为120μm,宽度90μm;支撑环的厚度为90μm,宽度60μm;柔顺筋的长度0.5mm;
连接柱的直径0.08mm,高度50μm;连接筋的长度为1mm;第一连接槽、第二连接槽、第三连接槽的直径分别为0.08mm,深度分别为50μm;铂钨合金弹簧圈直径0.5mm。
80.对支架在血管模型中的通过性进行测试,测试过程如下:将支架系统的导管座一端与推送机连接,另外一端(带有血管支架)推送到血管模型(astm f2394-2004血管模型)中,血管模型放入水温37
±
2℃中进行通过性测试,模拟推进与回撤,连续测试3次,得到血管支架在血管模型中推动力曲线。测试结果如图7所示。由图7可以看出:支架推送力大大降低,表明支架具有优良柔顺性能,支架通过弯曲血管性能非常好。
81.对比例1本对比例1提供了一种钴铬合金支架,整个支架由激光切割机切割成型,相比本发明结构柔顺性大大降低。
82.对支架在血管模型中的通过性进行测试,连续测试3次,测试结果如图8所示。由图8可以看出:支架推送力很高,表明支架的柔顺性能较差,支架通过弯曲血管性能较差。
83.测试例1在细胞水平探明了ato和tac对血管内皮细胞活性友好的药物浓度范围通过cck-8细胞活性检测法分别研究了不同浓度的ato、tac和雷帕霉素(rap)对血管内皮细胞(huvecs)作用24h和48h后的细胞活性变化,发现20μm浓度以下的ato、50nm浓度以下的tac和100nm浓度以下的rap均对血管平滑肌细胞(hasmcs)的细胞活性无显著影响,如图9所示。
84.该测试说明,ato对血管内皮细胞很友好,使用浓度范围较宽广。
85.测试例2在细胞水平探明了ato和tac对血管平滑肌细胞活性友好的药物浓度范围通过cck-8细胞活性检测法分别研究了不同浓度的ato、tac和雷帕霉素(rap)对血管平滑肌细胞(hasmcs)作用24h和48h后的细胞活性变化,发现2μm浓度以上的ato对hasmcs的细胞活性产生显著的抑制作用。然而,不同浓度的tac和rap均对血管平滑肌细胞的活性无显著的抑制效果(如图10所示)。
86.该测试说明,ato可有效抑制血管平滑肌细胞的增殖行为。而不同浓度的tac和rap均对血管平滑肌细胞的活性无显著的抑制效果。
87.测试例3在细胞水平验证了tac抑制血管内皮细胞炎症反应的有效浓度范围使用1μg/ml浓度的lps诱导huvecs6h后,通过pcr检测不同浓度的tac对huvecs炎症反应的抑制效果。实验结果表明,10nm的tac可有效降低细胞炎症因子il-6、il-10和tnf-α的基因表达水平(如图11所示)。
88.该测试说明,tac可有效抑制血管内皮细胞的炎性反应。
89.根据测试例1-测试例3结果看,ato可有效抑制血管平滑肌细胞的增殖行为,而tac可有效抑制血管内皮细胞的炎性反应,但不能有效抑制血管平滑肌细胞的增殖行为。研究结果初步证明了复合药物(ato/tac)的必要性,即在植入后1d,也就是炎症发生最严重的时候,利用tac药物作用抑制血管内皮细胞炎性反应;而且ato药物同时作用,并且是长期有效
抑制血管平滑肌细胞的增殖行为。调整出适合的药物释放曲线,例如三氧化二砷:1天释放30
±
20%,7天释放40
±
20%,28d释放60
±
20%;他克莫司:1天释放大于40%),也得到很好的动物试验效果。
90.单层双药物涂层结构的双药物释放的控制对比测试实施例3-1将三氧化二砷0.10g悬浮在10ml无水乙醇中;0.10g聚合物(pdla,以下实施例的聚合物与此相同)溶解在10ml四氢呋喃溶液中;然后将两种溶液混合,充分搅拌均匀。使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为7-15μg/mm2,真空干燥36小时以上,得ato混合药物洗脱支架。其三氧化二砷药物的释放结果见图12。
91.实施例3-2将三氧化二砷0.10g悬浮在10ml无水乙醇中;0.05g聚合物溶解在10ml四氢呋喃溶液中;然后将两种溶液混合,充分搅拌均匀。使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为5.25-11.25μg/mm2,真空干燥36小时以上,得ato混合药物洗脱支架。其三氧化二砷药物的释放结果见图13。
92.实施例3-3将三氧化二砷0.10g悬浮在10ml无水乙醇中;0.01g聚合物溶解在10ml四氢呋喃溶液中;然后将两种溶液混合,充分搅拌均匀。使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为3.85-8.25μg/mm2,真空干燥36小时以上,得ato混合药物洗脱支架。其三氧化二砷药物的释放结果见图14。
93.根据实施例3-1、3-2、3-3以及图12-图14的对比可以看出,单纯调整药物和聚合物的比例时,不能做到一个缓慢的释放过程,当聚合物和药物比例相差不大时,药物是一个及其缓慢释放的过程;当聚合物和药物的比例悬殊时,药物又是一个突释的过程,不能做到理想的药物释放。理想的药物释放过程例如1天释放40%,7天释放60%,28天释放80%以上。
94.实施例3-4将他克莫司0.05g溶解在10ml无水乙醇中;0.10g聚合物溶解在10ml四氢呋喃溶液中,然后搅拌均匀;然后将两种溶液混合,充分搅拌均匀。使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为5.25-11.25μg/mm2,真空干燥36小时以上,得tac混合药物洗脱支架。其tac药物的释放结果见图15。
95.根据实施例3-1、3-2、3-3和实施例3-4进行对比可以看出,三氧化二砷药物和他克莫司药物对于聚合物的混合后药物释放的影响不是很大,两种药物单独与聚合物的混合都不能得到一个理想的药物释放曲线。
96.实施例3-5将三氧化二砷0.14g悬浮在10ml无水乙醇中;0.05g他克莫司和0.10g聚合物溶解在10ml四氢呋喃溶液中,然后搅拌均匀;然后将两种溶液混合,充分搅拌均匀,使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为10.15-21.75μg/mm2,真空干燥36小时以上,得ato和tac混合药物洗脱支架:释放结果见图16和图17。
97.实施例3-6将三氧化二砷0.10g悬浮在10ml无水乙醇中;0.05gtac和0.10g聚合物溶解在10ml四氢呋喃溶液中,然后搅拌均匀;然后将两种溶液混合,充分搅拌均匀。使用超声喷涂设备
将溶液均匀喷涂到支架表面,使每支支架表面的上药量为8.75-18.75μg/mm2,真空干燥36小时,得ato和tac混合药物洗脱支架。释放结果见图18和图19。
98.实施例3-7将三氧化二砷0.10g悬浮在10ml无水乙醇中;0.10gtac和0.20g聚合物溶解在10ml四氢呋喃溶液中,然后搅拌均匀;然后将两种溶液混合,搅拌均匀。使用超声喷涂设备将溶液均匀喷涂到支架表面,使每支支架表面的上药量为14-30μg/mm2,真空干燥36小时,得ato和tac混合药物洗脱支架。释放结果见图20和图21。
99.根据实施例3-1、3-2、3-3与实施例3-4、3-5、3-6、3-7的结果对比可以看出,当单一药物与聚合物混合后释放曲线较平缓,不能设计出是理想的药物释放曲线。但是在两种药物混合后的,两种药物互相促进释放,分析可能原因为两种药物的分子量大小相差较大(他克莫司分子量822.033,三氧化二砷分子量197.84),而且他克莫司分子结构为大环内酯,当它部分释放出来,会给小分子三氧化二砷带来通道,使其释放出来,反之同理。根据配比的选择和聚合物搭配,最后得出理想的药物释放曲线。
100.动物实验结果药物按照实施例3-1的方案进行,涂覆在钴铬支架基体上进行动物试验,三个月得到动物试验结果,造影显示血流通畅无狭窄,oct显示内皮化完成,内膜完全覆盖,内膜较厚。血管内oct结果如图22所示。
101.药物按照实施例3-4的方案进行,涂覆在钴铬支架基体上,进行动物试验,三个月得到动物试验结果,造影显示血流通畅无狭窄,oct显示内皮化完成,内膜完全覆盖,内膜较厚。血管内oct结果如图23所示。
102.药物按照实施例3-5的方案进行,涂覆在钴铬支架基体上,进行动物试验,三个月的动物试验结果显示,血管内膜厚度为212
±
146μm,血管内oct结果如图24所示。支架表面内皮覆盖完整,血管内膜,中膜,外膜清晰,未见明显炎症反应。
103.综上,根据动物试验结果看,药物方面,细胞的研究和动物试验结果一致,且更证明了两种药物复合后的效果更好,ato tac 对抑制平滑肌和内膜增生起到加强作用。支架方面,钴铬支架有高支撑力,更薄的壁厚,更小的外径,大大提高柔顺性和通过性。支架基体和药物涂层的结合,得到很好的动物试验结果。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
