1.本技术涉及一种猴痘病毒疫苗,属于病毒疫苗领域。
背景技术:
2.全球仅有一款猴痘疫苗获批上市:由丹麦疫苗制造商bavarian nordic开发的天花疫苗jynneos于 2018年由美国fda批准上市,是唯一一款非复制型天花疫苗,然而其是否具有预防猴痘病毒感染的效果尚存疑问。目前,直接基于猴痘病毒相关蛋白抗原的疫苗体系相对缺乏。
3.从安全性和有效性角度出发,基于猴痘病毒膜蛋白为抗原的疫苗体系开发有望克服传统灭活疫苗体系的不足。然而目前重组蛋白抗原普遍存在免疫原性弱的问题;传统的铝佐剂在诱导抗原特异性t细胞免疫方面也存在先天缺陷。因此,选择合适的猴痘病毒抗原和佐剂成为猴痘重组蛋白疫苗开发的重点方向。
技术实现要素:
4.针对灭活疫苗在增强疫苗体液和细胞免疫方面的不足,我们首次将模式识别受体激动剂环二核苷酸应用于猴痘疫苗体系,并证明其显著优于铝佐剂的免疫强化效果。我们采用环二核苷酸作为佐剂,并选择猴痘病毒表面膜蛋白a35r作为抗原制备疫苗。本发明采用如下技术方案:
5.一种猴痘病毒疫苗,所述猴痘病毒疫苗中包含猴痘病毒抗原和模式识别受体激动剂环二核苷酸。
6.模式识别受体激动剂环二核苷酸的结构通式如下:
[0007][0008]
其中:b1/b2=a,g,i;
[0009]
x=h,oh,f;
[0010]
y=oh,sh。
[0011]
可选地,所述猴痘病毒抗原为猴痘病毒表面膜蛋白a35r。
[0012]
可选地,所述模式识别受体激动剂环二核苷酸采用如下方法制备得到:
[0013]
步骤一)将全保护的第二核苷酸亚磷酰胺与核苷酸亚磷酸的5位羟基进行反应,然后进行氧化或硫化反应,得到二核苷酸磷酸酯;
[0014]
步骤二)脱去步骤1)中得到的二核苷酸磷酸酯中的第二核苷酸亚磷酰胺上5位羟基的保护基,然后加入环化试剂将脱去保护基的5位羟基与亚磷酸环化连接;
[0015]
步骤三)将步骤二)中的产物进行氧化或硫化反应,然后脱去剩余的保护基,得到
所述模式识别受体激动剂环二核苷酸。
[0016]
可选地,所述第二核苷酸亚磷酰胺的5位羟基连接dmtr保护基、2 位羟基被f取代。
[0017]
可选地,所述步骤一)中的核苷酸亚磷酸采用如下方法制备得到:
[0018]
将全保护的第一核苷酸亚磷酰胺与吡啶-三氟乙酸盐、水、叔丁胺反应,然后脱去5位羟基的保护基得到所述核苷酸亚磷酸。
[0019]
可选地,所述第一核苷酸亚磷酰胺的5位羟基连接dmtr保护基、2 位羟基连接tbs保护基。
[0020]
可选地,使用二氯乙酸脱去5位羟基的保护基。
[0021]
可选地,所述步骤一)中,采用叔丁基过氧化氢或((二甲基氨基-亚甲基)氨基)-3h-1,2,4-二噻唑-3-硫酮进行氧化或硫化反应,得到二核苷酸磷酸酯。
[0022]
可选地,所述步骤二)中,环化试剂为5,5-二甲基-2-氯-1,3,2-二氧磷杂己内酰磷酸酯。
[0023]
可选地,所述步骤三)中采用碘或beaucage试剂对步骤二)中的产物进行氧化或硫化反应。
[0024]
可选地,所述步骤三)中叔丁胺、甲胺和氢氟酸三乙胺盐脱除剩余的保护基。
[0025]
可选地,所述第一核苷酸亚磷酰胺、第二核苷酸亚磷酰胺均为鸟苷酸亚磷酰胺。
[0026]
可选地,所述模式识别受体激动剂环二核苷酸(cdm)具有如下化学式:
[0027][0028]
可选地,所述猴痘病毒疫苗中猴痘病毒抗原和模式识别受体激动剂环二核苷酸的质量比为:0.1~10。
[0029]
可选地,所述猴痘病毒抗原和模式识别受体激动剂环二核苷酸的质量比为1:0.1~5。
[0030]
可选地,猴痘病毒抗原和模式识别受体激动剂环二核苷酸的质量比为1:0.1、1:0.2、1:0.3、1:0.4、1:0.5、1:1、1:2、1:3、1:4、1:5中的任意值,或者上述任两者之间的范围值。
[0031]
将猴痘病毒抗原和模式识别受体激动剂环二核苷酸分散到磷酸盐缓冲液中制备得到猴痘病毒疫苗。
[0032]
可选地,所述猴痘病毒疫苗中猴痘病毒抗原的浓度为:0.05mg/ml
‑ꢀ
0.5mg/ml;
[0033]
模式识别受体激动剂环二核苷酸的浓度为0.05mg/ml-0.5mg/ml。
[0034]
本技术还提出了猴痘病毒疫苗在制备猴痘预防药物上的应用。
[0035]
本技术能产生的有益效果包括:
[0036]
本技术采用环二核苷酸作为佐剂,并选择猴痘病毒表面膜蛋白a35r 作为抗原制备疫苗。后续免疫实验表明环二核苷酸佐剂加a35r膜蛋白抗原的疫苗体系可显著提高猴痘病毒抗原特异性抗体滴度和t细胞免疫反应,可以为猴痘疫苗制备提供新的技术选择。
附图说明
[0037]
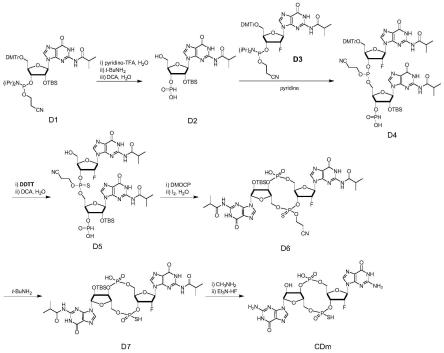
图1为cdm化合物的合成路线图;
[0038]
图2为a35 cdm疫苗体系能够诱导高水平抗原特异性igg抗体反应图;图2a为od450测试图;图2b为igg抗体水平测试图;
[0039]
图3为a35 cdm疫苗体系诱导高水平抗原特异tnf-ɑ
cd4 t细胞反应图;
[0040]
图4为a35 cdm疫苗体系诱导高水平抗原特异性ifn-γ cd4 t细胞(图4a)和tnf-ɑ
ifn-γ 双阳性cd4 t细胞(图4b)反应图;
[0041]
图5为a35r蛋白抗原再刺激后,小鼠脾脏cd69 cd4 t细胞群比例统计图;图中*表示p《0.05。
具体实施方式
[0042]
下面结合实施例详述本技术,但本技术并不局限于这些实施例。
[0043]
实施例中的a35r来自于南京欧凯生物猴痘病毒抗原a35r,货号 c1621。铝佐剂为invivogen公司的adjuvant 2%。
[0044]
如无特别说明,本技术的实施例中的原料均通过商业途径购买。
[0045]
实施例1制备cdm
[0046]
以鸟苷酸作为例,合成cdm,其制备方法如下,具体步骤可以参考图1反应式:
[0047]
合成化合物d2
[0048]
称取0.5mmol鸟苷酸亚磷酰胺单体(s1)和0.116g(0.6mmol)吡啶三氟乙酸盐放入50ml圆底烧瓶中,加入磁子和2.5ml乙腈搅拌溶解,再加入18μl水搅拌反应1min。之后加入2.5ml t-bunh2搅拌反应10 min。反应结束后负压旋除溶剂至蓬松状,再加入5ml乙腈旋至蓬松状,重复操作两次除去t-bunh2。加入6ml二氯甲烷(dcm)溶解固体,之后加入90μl水和6ml 6%二氯乙酸(dca)的dcm溶液(4.4mmol) 搅拌反应10min,中途取样进行esi-ms检测判断dmtr保护基脱除情况。加入0.7ml吡啶中和dca,负压浓缩至2ml,再加入4ml无水乙腈溶解样品,负压旋除溶剂,重复操作三次,最后一次剩余1ml时停止旋蒸,使用橡胶塞塞住待用。
[0049]
合成化合物d4
[0050]
另外称取0.557g(0.65mmol)氟代鸟苷酸亚磷酰胺单体(d3)放入 10ml圆底烧瓶中,加入4ml无水乙腈溶解固体,负压旋除乙腈至蓬松状,重复操作四次,在最后一次剩余2ml时停止旋蒸,使用橡胶塞封闭。使用注射器快速吸取上述干燥好的单体加入到含有d2的圆底烧瓶中,搅拌反应2min。
[0051]
合成化合物d5
[0052]
向含有d4的圆底烧瓶中加入0.113g ddtt(((二甲基氨基-亚甲基) 氨基)-3h-1,2,4-二噻唑-3-硫酮,0.55mmol,1.1当量)硫化三价磷,搅拌反应30min,负压浓缩至油状。加入8ml dcm溶解油状物,在加入 0.09ml水和8ml 6%dca的dcm溶液(1.5mmol)搅拌反应10min,中途取样进行esi-ms检测判断dmtr保护基脱除情况。反应完全后加入 5ml吡啶,负压浓缩至2ml,再加入15ml吡啶浓缩至10ml,使用橡胶塞塞住。
[0053]
合成化合物d6
[0054]
称取0.34g 5,5-二甲基-2-氧代-2-氯-1,3,2-二氧磷(dmocp,1.75 mmol)加入到含有d5的圆底烧瓶中,搅拌反应10min。加入0.32ml 水和165mg碘单质,搅拌反应5min,中途
取样进行esi-ms检测判断氧化完成情况。反应完成后,将混合物倒入含有0.1g亚硫酸氢钠的70ml 水溶液中,搅拌反应5min消耗掉多余氧化剂,再缓慢加入2g碳酸氢钠中和反应体系,继续搅拌5min;将反应体系倒入含有80ml乙醚/乙酸乙酯(体积1/1)混合溶剂的分液漏斗中,加入80ml水进行萃取分离操作,收集有机相之后负压旋除溶剂得到油状液体即为化合物d6。
[0055]
合成化合物d7
[0056]
将d6转移至25ml圆底烧瓶中,加入2ml乙酸乙酯油泵负压旋除,重复操作三次以去除吡啶。加入2.5ml乙腈溶解油状物,再加入2.5 mlt-bunh2搅拌反应10min。之后加入2.5ml乙腈负压旋干,重复操作三次去除t-bunh2。再加入2.5ml甲醇溶解样品,同样负压旋至泡沫状。
[0057]
合成化合物sf1
[0058]
向含有d6的圆底烧瓶中加入10ml 33%甲胺无水乙醇溶液(质量比),塞上橡胶塞搅拌反应1.5h,中途取样进行esi-ms检测判断异丁酰基(ibu)保护基脱除情况。反应完成后,浓缩至油状,加入400μl吡啶和200μl三乙胺继续旋蒸至油状,重复操作三次将产物由t-bunh2盐形式转变为三乙胺盐形式。接着加入400μl吡啶溶解油状物,橡胶塞塞住瓶口,将圆底烧瓶至于50℃油浴锅中搅拌。使用注射器分别吸取1.4ml 三乙胺和0.83ml三乙胺氢氟酸盐并将二者同步缓慢注射到圆底烧瓶中,持续1min。注射完成后搅拌反应1h,中途取样进行esi-ms检测判断 tbs保护基脱除情况。反应完成后,趁热将反应溶液缓慢滴到两个含有 30ml色谱纯丙酮并且正在搅拌的50ml离心管中,可以观察到白色固体慢慢析出。沉淀完成之后,取出磁子,7000rpm离心10min。小心去掉上清,加入新的丙酮洗涤离心,重复两次,负压抽干溶剂即以40%的产率得到最终产物sf1。
[0059]
实施例2猴痘疫苗制备和免疫
[0060]
采用monkeypox virus表面膜蛋白a35r作为疫苗抗原,进行babl/c 小鼠免疫评价。将a35r蛋白10μg/只、激动剂环二核苷酸(cdm)10 μg/只分散到磷酸盐缓冲液(pbs)0.1ml中完成疫苗的制备。
[0061]
另外制备3组对比例:1、a35r处理,仅将a35r蛋白10μg/只分散到磷酸盐缓冲液(pbs)0.1ml中完成疫苗的制备;
[0062]
2、a35r 铝佐剂处理:将a35r蛋白10μg/只、铝佐剂300μg/只分散到磷酸盐缓冲液(pbs)0.1ml中完成疫苗的制备;
[0063]
3、0.1ml磷酸盐缓冲液(pbs)作为空白对照。
[0064]
选用6-8周雌性balb/c小鼠作为疫苗免疫对象,每组3-4只。每只小鼠通过尾根部皮下的免疫方式注射各组样品,免疫流程总共进行三次,间隔两周注射一次,在完成所有免疫后间隔一周处理小鼠收集脾脏和血清样品。
[0065]
实施例3 monkeypox virus特异性igg抗体滴度分析
[0066]
将a35r蛋白溶解于0.1m nahco3(ph=9.6)中配置成1μg/ml的溶液,按照每孔100μl的体积加入到96孔酶标板(costar 3590)中,4℃孵育12h。之后使用pbst溶液(0.05%tween的pbs溶液)清洗,再加入0.25%明胶pbs溶液室温封闭3h。封闭完成之后,使用pbs和pbst 清洗多次控干。
[0067]
将以上各处理组梯度稀释的血清按照每孔100μl的的体积加入到孔板中(血清稀
释倍数依次为1:800、1:3200、1:12800、1:51200、1:102400、 1:204800、1:409600、1:819200),37℃孵育1.5h。使用pbs和pbst清洗多次控干,加入辣根过氧化酶(hrp)修饰的兔抗鼠igg抗体(1/2000 稀释),100μl,37℃孵育1h。再次清洗控干之后,每孔加入200μl 3,3',5,5'-四甲基联苯胺(tmb),避光静置4min后加入2m硫酸终止显色(50μl)。使用酶标仪测定各孔的吸光度值(od450)。疫苗抗体滴度的定义是od450值至少高出空白组0.1的最大稀释倍数。滴度数据表明 a35r cdm疫苗体系能够显著提高a35r抗原特异性igg抗体水平,远高于商业化铝佐剂等对照组(图2)。
[0068]
实施例4 monkeypox virus特异性t细胞免疫分析
[0069]
来源于上述猴痘疫苗免疫小鼠的脾脏组织首先被研磨分散,接着使用70μm细胞滤网过滤得到脾细胞。采用红细胞裂解液裂解脾细胞中的红细胞后进行细胞计数,并加入24孔板中(500万)。a35r抗原刺激浓度:25μg/ml。孵育5h后,加入细胞因子外泌抑制剂(biolegend)孵育 7h,离心取细胞,加入αcd3,αcd4,αcd69抗体在冰上进行表面染色 1h。洗涤后加入穿膜试剂处理,再进行胞内细胞因子(αifn-γ和αtnf
‑ꢀ
ɑ
)染色,最后进行流式分析。流式结果证明a35r cdm疫苗体系能够显著提高a35r抗原特异性的细胞免疫反应强度(图3-图5),明显优于商业化铝佐剂等免疫组。
[0070]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。