1.本发明属于作物抗病性鉴定技术领域,具体涉及一种大豆抗疫病资源、品种、品系的鉴定方法。
背景技术:
2.由大豆疫霉(phytophthora sojae kaufmann&gerdemann)引起的大豆疫病是大豆生产中的一种毁灭性病害。该病已在我国新疆维吾尔自治区,黑龙江省、安徽、福建、吉林等多个省份普遍发生。大豆疫霉在大豆整个生育期均可以侵染,引起根腐、茎腐、植株矮化、枯萎和死亡,一般田块减产10-30%,感病地块减产高达60-90%,甚至造成绝产。目前全世界每年因大豆疫霉病造成的经济损失大约为10亿美元。大豆疫霉为土传病原菌,其卵孢子在土壤中可以长期存活,防治十分困难。防治大豆疫病最为经济、有效且对环境友好的方法是种植抗病品种。
3.目前,国内外通过抗病资源筛选,已鉴定了大量的抗疫病资源,且已在抗病资源中鉴定了30多个抗疫病基因。迄今,我国已经鉴定了10多个大豆抗疫病基因。大豆疫霉群体结构复杂,毒力变异较快。一般认为大豆抗疫病基因的使用寿命为10-15年,为了能够持续不断地有效防止大豆疫病的发生,必须继续不断地挖掘和利用新的抗源。因此需要一种能够快速、准确鉴定大豆抗疫病资源的方法,才能有效获得新的抗源,用于抗病育种。利用多个抗病基因的累加,培育抗性持久、稳定的大豆新品种。
4.目前,大多数研究人员采用下胚轴创伤接种法进行大豆抗疫病的鉴定与评价。但由于接种过程操作比较复杂,且对接种植株的环境培养条件要求较高,在创伤下胚轴时容易导致大豆幼苗茎秆折断,在运输和保湿过程中大豆疫霉接种体有时会从下胚轴滑落,导致结果的假阳性。因此,有必要建立一种快速、简便、高效且准确的大豆疫病抗病性鉴定新方法。
技术实现要素:
5.本发明的目的是提供一种快速、简便、高效、准确的鉴定大豆疫病抗病性的新方法。
6.为了实现上述目的,本发明首先提供了一种新的大豆疫病抗病性鉴定方法。
7.本发明提供的大豆疫病抗病性鉴定方法包括如下步骤:
8.(1)大豆接种植株的培养:培养待测大豆资源、品种或品系的种子,得到大豆接种植株;
9.(2)大豆疫霉菌接种体的培养:培养大豆疫霉菌株,制备菌丝块,得到疫霉接种体;
10.(3)大豆植株接种:先将需要接种的大豆植株的子叶节处对齐,困成一捆并放入装入水的容器中,再向所述接种容器中加入适量的水,然后所述疫霉接种体的菌丝块,得到接种的植株;
11.(4)接种植株培养和抗病性评价:培养所述接种植株,培养后评价待测大豆资源对
大豆疫病的抗病性。
12.上述方法中,所述步骤(1)前还包括对待测大豆材料种子进行清选的步骤;所述清选的方法可为挑选健康种子用于播种。
13.上述方法中,所述步骤(1)中,所述培养的方法可为将待测大豆材料种子播种在以蛭石为基质的容器中。
14.所述播种容器可为深度为6-13cm的各种材料的育苗盘、纸杯或塑料杯,具体可为深度为8cm的一次性纸杯(规格为85mm
×
70mm的200ml的纸杯)。
15.所述培养的温度可为20-30℃(或20-25℃或26-30℃),具体可为20℃或21℃或22℃或23℃或24℃或25℃或26℃或27℃或28℃或29℃或30℃,优选25℃;所述培养的时间可7-15天(或7-11天或12-15天),具体可为7天或8天或9天或10天或11天或12天或13 天或14天或15天,优选10天。
16.上述方法中,所述步骤(2)中,所述大豆疫霉菌株可为本技术领域常见的大豆疫霉菌株,包括各种不同毒力基因型的菌株,如race1,js2,bs7,bsd36,hn1等。在本发明的一个具体实施例中,所述大豆疫霉菌株为race1菌株。
17.所述培养的方法可为将大豆疫霉菌株接种于培养基中。
18.所述培养基可为v8培养基。
19.其中,所述v8培养基的溶剂为蒸馏水,溶质及浓度分别如下:v8蔬菜汁200g/l, caco
3 3g/l,琼脂20g/l,ph5.8。所述ca培养基的溶剂为蒸馏水,溶质及浓度分别如下:胡萝卜200g/l,琼脂20g/l。
20.所述培养的温度可为20-28℃(或20-24℃或24-28℃),具体可为20℃或21℃或 22℃或23℃或24℃或25℃或26℃或27℃或28℃,优选25℃;所述培养时间可为4-7 天(或4-5天或5-7天),具体可为4天或5天或6天或7天,优选5天。
21.所述菌丝块的直径可为5-8mm。
22.制备所述菌丝块的方法可为用孔径为5-8mm的打孔器打取菌丝块。所述打孔器可以是任何常规的能够将病原菌培养物制作成直径为5-8mm圆饼的圆筒状物件,如 200μl移液器枪头、1ml移液器枪头、饮料吸管等穿孔打孔器等,优选1ml移液器枪头。
23.上述方法中,所述步骤(3)前还包括如下步骤:将所述大豆植株从蛭石中拔出,用清水冲洗掉根系上的蛭石,选择高度大小一致的健康植株。
24.上述方法中,所述步骤(3)中,所述将若干大豆植株子叶节处对齐后系成一捆放入接种容器中,可为将5-10颗大豆植株子叶节处对齐后系成一捆,剪去部分根系,使每个植株的子叶节到根的长度一致,然后放入接种容器中。
25.所述接种容器可以是任何常规的杯状容器,如一次性纸杯、一次性塑料杯、玻璃烧杯、塑料烧杯等,优选800ml的透明塑料杯。
26.每个所述接种容器可以放入多份待测大豆材料。具体地,800ml的透明塑料杯可放入5-10份待测大豆材料。优选地,800ml的一次性纸杯放入8份待测大豆材料。
27.所述向接种容器中加适量水可为向接种容器中加水至植株子叶节下0.5-1cm处。当所述接种容器为800ml的透明塑料杯,优先向所述接种容器中加入700ml无菌水。
28.当所述接种容器为800ml的透明塑料杯,每个接种容器中加入700ml无菌水时,每个所述接种容器中可接种10-20个菌丝块,优选接种15个菌丝块。
29.上述方法中,所述步骤(4)中,所述培养的温度可为22-28℃(或22-25℃或 25-28℃),具体可为22℃或23℃或24℃或25℃或26℃或27℃或28℃,优选25℃;所述培养时间可为3-7天,具体可为3天或4天或5天或6天或7天,优选5天。
30.上述方法中,所述步骤(4)中,所述评价待测大豆材料对大豆疫霉病的抗病性的标准为如下标准一或标准二:
31.所述标准一具体如下:若植株存活,植株生长正常,则待测大豆材料对大豆疫霉病为抗病(resistant,r);若植株死亡,则待测大豆材料对大豆疫病为感病 (susceptible,s)。
32.所述标准二具体如下:若植株死亡率≤30%,则待测大豆材料对大豆疫霉病为抗病 (resistant,r),若植株死亡率≥70%,则待测大豆材料对大豆疫霉病为感病 (susceptible,s),若30%<植株死亡率<70%,则待测大豆材料对大豆疫霉病为中间类型(intermediate,i)。
33.在实际应用中,在鉴定单颗大豆植株对大豆疫病的抗性时,如鉴定杂交的f1和f2遗传群体的单颗大豆植株时,可根据植株表型是否死亡进行大豆疫病抗病性评价。在鉴定大豆品种、资源或f3及高代的品系对大豆疫病的抗性时,可根据植株死亡率即上述标准二进行大豆对疫病抗病性评价。
34.上述任一所述方法中,所述培养的环境可为光温可控培养间,如温室、光照培养箱、植物培养室等,优选光照培养箱。
35.为了实现上述目的,本发明还提供了上述方法的新用途。
36.本发明提供了上述方法在如下a1)-a4)任一种中的应用:
37.a1)鉴定或评价大豆对大豆疫病的抗病性;
38.a2)筛选或辅助筛选大豆疫病抗性资源、品种、品系;
39.a3)筛选或辅助筛选大豆疫病感病资源、品种、品系;
40.a4)大豆育种。
41.上述任一所述方法或应用中,所述大豆不仅包括各种大豆资源及其近缘种、品种、品系、育种材料,还包括其变种、栽培变种,以及它们的繁育后代。在本发明的一个具体实施例中,所述大豆为如下品种中的至少一种:williams、中黄13、吉科豆2号、齐茶豆1号、岫94-1、鲁豆4号、诱变30、早熟18、williams82、皖豆15。
42.所述大豆育种的目的为培育大豆疫病抗性品种。
43.本发明首次提出了一种大豆疫病抗病性鉴定方法,本发明的鉴定方法操作速度快,简便,成本低廉,周期短,试验所需空间接种体少,且对环境要求不高,病原菌侵染同于自然侵染,鉴定结果准确可靠,同时在抗性鉴定结束后可以将抗性植株移栽进行繁殖结种子,加速抗性材料的纯合和利用。因此,本发明的鉴定方法不仅有利于大豆抗病资源的高效筛选和抗病品种的快速选育,还可加速大豆疫病的抗性遗传研究以及大豆疫霉的致病力变异的相关研究。将在大豆育种及抗性遗传和抗病机制研究中具有广阔的应用前景。
具体实施方式
44.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术
人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
45.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
46.下述实施例中的williams、中黄13、吉科豆2号、齐茶豆1号、岫94-1、鲁豆4号、诱变30、早熟18、williams82、皖豆15记载于文献“朱振东等,一个抗大豆疫霉根腐病新基因的分子鉴定.作物学报,2007,33(1):154-157;张吉青.大豆对疫病的抗性评价、抗病基因挖掘及候选基因分析[d].中国农业科学院,2013;李银萍.大豆品种齐茶豆1号抗疫霉根腐病基因鉴定及候选基因分析[d].中国农业科学院,2017;钟超.大豆抗疫病基因发掘及特异性标记开发[d].中国农业科学院,2018;zhong et al., genetic mapping and molecular characterization of a broad-spectrumphytophthora sojae resistance gene in chinese soybean.international journalof molecular sciences,2019,20:1809.”中。
[0047]
下述实施例中的大豆疫霉(phytophthora sojae)菌株race1记载于文献“yang et
ꢀꢀ
al.races of phytophthora sojae in iowa soybean fields.plant disease.
”ꢀ
1996,80:1418-1420.中。
[0048]
下述实施例中的v8培养基的溶剂为蒸馏水,溶质及浓度分别如下:v8蔬菜汁 200g/l,caco
3 3g/l,琼脂20g/l,ph5.8。
[0049]
实施例1、一种大豆疫病抗病性鉴定方法(游动孢子自然侵染法)
[0050]
(1)大豆植株的培养:每份大豆材料选取若干健康饱满的种子播种在以蛭石为基质的深度为8cm的一次性纸杯中,播种后放入温室进行培养,培养7-15天,得到大豆植株。
[0051]
(2)接种体的制备:将大豆疫霉(phytophthora sojae)菌株接种于培养基进行培养,培养4-8天后用打孔器在菌落上制备直径为5-8mm的菌丝块,得到接种体。
[0052]
(3)接种大豆植株:先将步骤(1)获得的大豆植株从蛭石中拔出,用清水冲洗掉根系上的蛭石;然后每份大豆材料选择若干高度大小一致的健康植株,子叶节处对齐后系成一捆后放入到接种容器中,再在接种容器中加水至植株子叶节下0.5-1cm 处;最后将步骤(2)制备的接种体打取菌饼后放入到接种容器中。
[0053]
(4)接种植株培养和抗性评价:将接种后的大豆植株放入温室或者植物生长箱进行培养,培养3-6天后进行病情调查,并根据如下标准一或标准二进行抗性鉴定与评价。
[0054]
标准一:若植株生长正常,则待测大豆材料对大豆疫霉为抗病(resistant,r);若植株枯萎死亡,则待测大豆材料对大豆疫霉为感病(susceptible,s)。
[0055]
标准二:若植株死亡率≤30%,则待测大豆材料对大豆疫病为抗病(resistant,r),若植株死亡率≥70%,则待测大豆材料对大豆疫病为感病(susceptible,s),若30%<植株死亡率<70%,则待测大豆材料对大豆疫病为中间类型(intermediate,i)。
[0056]
实施例2、大豆疫霉病抗病性鉴定方法的应用
[0057]
一、供试材料
[0058]
10份大豆种质供试材料具体如下:williams、中黄13、吉科豆2号、齐茶豆1 号、岫94-1、鲁豆4号、诱变30、早熟18、williams82、皖豆15。
[0059]
二、大豆疫病抗病性鉴定
[0060]
按照实施例1中的方法对供试材料的大豆疫霉病抗病性进行鉴定评价。具体步骤
如下:
[0061]
(1)大豆植株的培养:每份大豆材料选取15粒健康饱满的种子播种在以蛭石为基质的200ml的一次性纸杯中,每份大豆材料播种一杯,播种后放入25℃温室,在12小时光照/12小时黑暗条件下培养10天,得到大豆植株。
[0062]
(2)接种体的制备:将大豆疫霉(phytophthora sojae)菌株race1接种于v8 培养基,25℃条件下培养5天,用1ml移液枪枪头末端在菌落上制备直径为8mm的菌丝块,得到接种体。
[0063]
(3)接种大豆植株:先将步骤(1)获得的大豆植株从蛭石中拔出,用清水冲洗掉根系上的蛭石;然后每份大豆材料选择10个大小一致的健康植株,子叶节处对齐后用塑料扎口丝系成一捆,剪去部分根系,使每个植株的子叶节到根的长度一致;再将材料放入到800ml的透明塑料杯中,每个杯中放入10份材料,之后在杯中加入约700ml 无菌水;最后将步骤(2)制备的接种体菌丝块接种到透明塑料杯中,每杯接种15个菌丝块。
[0064]
(4)接种植株培养和抗性评价:将接种后的大豆植株放入25℃植物生长箱中,在12小时光照/12小时黑暗条件下进行培养。培养5天后进行病情调查,并根据如下标准进行抗性鉴定与评价:每份大豆材料,若植株死亡率≤30%,则待测大豆材料对大豆疫霉为抗病(resistant,r),若植株死亡率≥70%,则待测大豆材料对大豆疫霉为感病(susceptible,s),若30%<植株死亡率<70%,则待测大豆材料对大豆疫霉为中间类型(intermediate,i)。
[0065]
同时以下胚轴创伤接种法作为对照。下胚轴创伤接种法参照文献“钟超.大豆抗疫病基因发掘及特异性标记开发[d].中国农业科学院,2018”,具体步骤详见表2。
[0066]
三、鉴定结果
[0067]
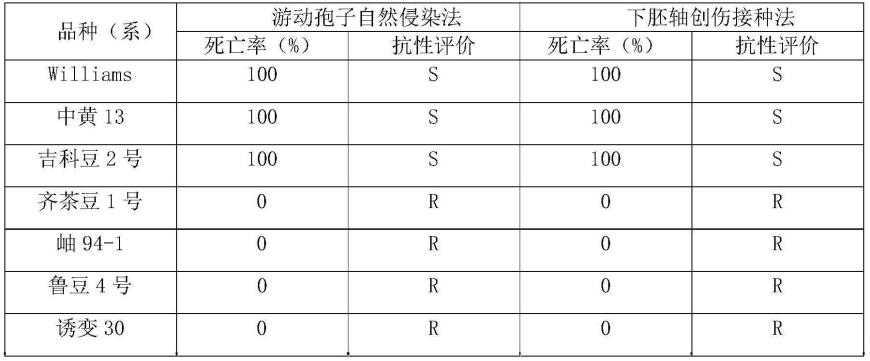
结果如表1所示。利用下胚轴创伤接种法对10份大豆种质材料进行大豆疫病抗病性的鉴定结果表明:10份大豆供试材料中,7份供试材料表现为抗病,3份供试材料表现为感病。本发明的游动孢子自然侵染法的鉴定结果与之相符,且与下胚轴创伤接种法相比,本发明的游动孢子自然侵染法还具有如下优点:操作速度快、简便、成本低廉、试验周期短、试验所需空间和接种体均较少,对环境要求不高,不需要人工划伤,病原菌侵染同于自然侵染,鉴定结果准确可靠,同时在抗性鉴定结束后可以将抗性植株移栽进行繁殖结种子,加速抗性材料的纯合和利用,详细比较情况如表2所示。
[0068]
表1、两种鉴定方法对大豆疫霉抗病性鉴定结果
[0069]
[0070][0071]
表2、游动孢子自然侵染接种法和下胚轴创伤接种法优劣比较
[0072][0073]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
