分泌gdnf的哺乳动物细胞及其治疗用途
1.关于序列表的声明
2.与本技术相关的序列表以代替纸质副本的文本格式提供,并在此通过引用并入本说明书。包含序列表的文本文件的名称是p8881us00_gloriana_arpe-19_cell_line_st25.txt。该文本文件为28kb,创建于2019年11月19日,通过efs网站以电子方式提交。
技术领域
3.本发明涉及用于基因治疗的方法和组合物,特别是用于递送生物活性胶质细胞系源性生的神经营养因子(gdnf)以治疗帕金森病的体内基因治疗。另一方面,本发明涉及包含全长人gdnf序列的密码子优化版本的表达构建体。本发明还涉及能够以增加的量生产gdnf的哺乳动物细胞,以及这些细胞用于重组生产生物活性gdnf和用于治疗用途的用途。
背景技术:
4.帕金森病(pd)是一种极具破坏性的神经退行性障碍,困扰着100万至150万美国人。每年诊断出超过35,000个新病例。帕金森病的发病率在50岁以上的年龄组中最高,尽管在年轻患者中报告了惊人数量的新病例。
5.帕金森病的主要特征表现为运动缓慢(运动缓慢,bradykinesia),手、臂、腿、颌和脸的震颤或颤抖,四肢和躯干僵硬,以及姿势不稳定。随着这些症状的发展,患者可能会在行走、说话或完成其它简单日常生活任务上出现困难。这些行为缺陷与大脑中黑质纹状体系统的退化有关,黑质纹状体系统负责产生平稳、有目的的运动。具体地,位于黑质的神经细胞退化,并且伴随着由这些细胞制造的多巴胺的损失。黑质神经细胞将轴突或突起延伸至纹状体,在纹状体中多巴胺被分泌和利用。据估计,在pd症状出现之前,纹状体内的多巴胺需要损失80%。
6.目前,左旋多巴(商品名sinemet)是帕金森病的主要治疗方法。在大脑中,左旋多巴转化为多巴胺,从而纠正帕金森病患者大脑中多巴胺的缺乏。当左旋多巴与外周脱羧酶抑制剂卡比多巴联合施用时,pd患者获得了显著的益处。然而,问题在于虽然左旋多巴治疗减轻了pd的症状,但它不能取代丢失的神经细胞,也不能阻止疾病的发展。随着pd的发展,患者需要愈益增加的左旋多巴剂量,并且可能出现副作用,最显著的是无法自主的运动和僵硬。事实上,运动障碍专家经常推迟左旋多巴的使用,并最初使用其它多巴胺能药物,以便在疾病过程的后期,当患者最需要左旋多巴时,再使用左旋多巴。
7.因此,左旋多巴有其局限性,需要建立帕金森病的额外治疗策略。在这方面,对pd外科治疗的兴趣已经被重新点燃。近来,一种被称为深度脑刺激的程序获得了相当大的关注。在这个程序中,电极被放置在pd过度活跃的大脑区域,以便对这些大脑区域进行电刺激来纠正过度活跃。对某些患者来说,这可以获得显著的益处。其它外科手术旨在改善黑质纹状体系统的功能。多巴胺能细胞移植已成功改善帕金森病动物模型的运动缺陷。人体多巴胺能细胞移植的初步临床试验已经取得了成功,而一项双盲临床试验显示年轻患者受益,而不是老年患者受益。然而,一些接受移植的患者出现了无法自主的运动。因此,目前,细胞
移植仍应被视为一种实验性方法。
8.另一种方法旨在将生长因子递送至黑质纹状体系统中,以试图防止黑质神经元的退化以及随之而来的神经递质多巴胺的损失。
9.世界上许多实验室在对大鼠和灵长类动物进行的研究中,已经证明胶质细胞系源性神经营养因子(gdnf)可以防止黑质纹状体系统退化的结构和功能后果。在临床前研究中,已经使用蛋白质注射、经由泵的递送和通过体内基因治疗实现了gdnf向cns的递送。许多研究描述了使用表达gdnf的aav或慢病毒来转导cns细胞(kordower,(2003),ann neurol,53(suppl 3):s120-s34;wo03/018821,ozawa et al.;us-2002/187951,aebischer et al.;georgievska et al.,(2002),exp nerol 117(2):461-74;georgievska et al.,(2002),neuroreport 13(1):75-82;wang et al.,(2002),gene thera,9(6):381-9;us-2002/031493,rohne-poulenc rorer sa;u.s.6,180,613,roeckefeller university;kozlowski et al.,(2000),exp neurol,166(1):1-15;bensadoun,(2000),exp neurol,164(1):15-24;connor et al.,(1999),gene therapy,6(12):1936-51;mandel et al.,(1997),pnas,94(25):14083-8;lapchak et al.,(1997),brain res,777(1,2):153-60;bilang-bleuel et al.,(1997),pnas 94(16):8818-23)。
10.治疗帕金森病的其它体内基因治疗方法包括用表达芳香族l-氨基酸脱羧酶(aadc)、丘脑谷氨酸脱羧酶(gad)的病毒进行转导(marutso,(2003),nippon naika gakkai zasshi,92(8):1461-6;howard,(2003),nat biotechnol,21(10):117-8)。
11.尽管gdnf似乎是治疗人类帕金森病的有希望的候选药物,但据报道gdnf治疗会导致某些副作用,主要是体重减轻和异常性疼痛(hoane et al.,(1999),160(1):235-43)。因此,本领域需要开发治疗帕金森病的替代策略,特别是旨在防止黑质神经元退化的策略。
技术实现要素:
12.本发明人已经进行了一系列临床前动物研究,这些研究是基于在6-ohda病变模型中用分泌高水平gdnf的人arpe-19细胞衍生的克隆将gdnf家族生长因子递送至纹状体。6-ohda病变模型是众所周知的帕金森病动物模型。令人惊讶的是,这些实验已经表明,分泌高水平gdnf的细胞的植入表现出神经保护益处,并且所述细胞在延长的时间段内持续分泌gdnf。分泌的gdnf被周围的脑组织正确处理。
13.因此,在第一方面,本发明涉及治疗帕金森病的方法,所述方法包括向有需要的个体的中枢神经系统施用治疗有效量的含有表达载体的细胞,所述载体包含能够指导可操作连接的多肽表达的启动子序列,所述多肽包含能够在哺乳动物细胞中起作用的信号肽,以及选自由前-gdnf、成熟gdnf、n末端截短的成熟gdnf和任何此类gdnf的序列变体组成的组的人、鼠或大鼠gdnf。
14.在优选的实施方案中,本发明的细胞系通过用质粒pt2.can.hog(seq id no.7)和pcmv-sb-100x(seq id no.8)共转染arpe-19细胞而产生。后者质粒表达睡美人转座酶的高活性版本。该质粒不含真核选择标记盒,因此有意仅瞬时表达。然后筛查转染细胞的高、稳定水平的成熟gdnf表达。
15.使用本发明中所述的高效表达构建体的一个重要优点是,可使用更少的细胞和更少的患者体内插入来获得gdnf的治疗益处。
16.在另一方面,本发明涉及细胞表达载体的用途,所述载体包含能够指导可操作连接的多肽表达的启动子序列,所述多肽包含能够在哺乳动物细胞中起作用的信号肽,以及选自由前-gdnf、成熟gdnf、n末端截短的成熟gdnf和任何此类gdnf的序列变体组成的组的人、鼠或大鼠gdnf;用于制备治疗帕金森病的药物。
17.在另一方面,本发明涉及药物组合物,其包含根据本发明的载体以及一种或多种药学上可接受的佐剂、赋形剂、载体和/或稀释剂。该药物组合物可用于体内和体外基因治疗。
18.在另一方面,本发明涉及用根据本发明的载体转导的分离的宿主细胞。
19.与已知的生产gdnf的细胞相比,以及与用编码gdnf的病毒载体转导的细胞相比,这种转导的宿主细胞产生了意想不到的高产量的gdnf。因此,本发明的转导的宿主细胞构成了用于工业规模生产gdnf的具有前景的细胞来源。
20.在另一方面,本发明涉及嵌合的非人哺乳动物,其包含至少一种用根据本发明的载体转导的细胞。这种动物过量表达gdnf,可以用于进行基因分析以及药物的筛查和开发。
21.优选地,转导的细胞具有个体动物的基因型,即不是同种异体或异种移植物。
22.在另一方面,本发明涉及可植入的细胞培养装置,该装置包括:
23.允许gdnf扩散通过的半透膜;和
24.至少一种根据本发明的分离的宿主细胞。
25.这些胶囊可以用于在移植至中枢神经系统后局部递送gdnf。生长因子的局部和延长递送是治疗许多cns障碍的优选施用方法,所述cns障碍包括但不限于帕金森病、阿尔茨海默氏病、亨廷顿氏病、中风和肌萎缩性侧索硬化(als)。
26.在另一方面,本发明涉及生物相容性胶囊,其包含:核,所述核包含分泌用于感染靶细胞的病毒载体的活包装细胞,其中所述病毒载体是根据本发明的载体;和包围所述核的外壳,所述壳包含可渗透的生物相容性材料,所述材料的孔隙率选择为允许直径约100nm的逆转录病毒载体通过,从而允许所述病毒载体从所述胶囊中释放。
27.本发明的胶囊使用胶囊方法将病毒颗粒递送至患者的所需部位。与单次输注相反,载体生产细胞系的封装允许将病毒颗粒连续递送至靶位点。此外,重复治疗是可能的,重复治疗降低了免疫攻击的可能性。胶囊具有足够大的孔,允许从包装细胞释放的病毒颗粒通过,但阻止宿主细胞进入胶囊。
28.这种胶囊方法增加了治疗的安全性和可控性,因为装置可容易地取回(终止治疗)或取出并重新植入(调整治疗)。此外,由于胶囊装置没有打开或外露,感染的机会减少。
29.最后,由于封装可以防止包装细胞在患者体内迁移,并延长植入后包装细胞的存活力,因此该疗法很可能只需要更少的细胞。这可能有利于进一步降低患者的免疫反应。
30.在另一方面,本发明涉及根据本发明的载体作为药物的用途。
31.在另一方面,本发明涉及根据本发明的载体在制备用于治疗神经系统疾病的药物中的用途。
32.另一方面,本发明涉及根据本发明的载体在制备用于治疗cns障碍的药物中的用途。
33.此外,本发明涉及治疗神经系统疾病的方法,所述方法包括向有需要的个体施用:治疗有效量的本发明的载体;或治疗有效量的本发明的药物组合物;或包含根据本发明的
包装细胞系的生物相容性装置。
34.根据本发明的这一方面,提供了用于治疗神经系统疾病的改进的体内基因治疗方法。如所附实施例所证明的,用本发明的载体进行体内转导导致编码的治疗因子(例如gdnf)的前所未见的分泌和组织分布,并因此改善了治疗效果。
35.在另一方面,本发明涉及治疗神经系统疾病的方法,所述方法包括向有需要的个体移植:
36.i.治疗有效量的本发明的转导细胞;或
37.ii.根据本发明的可植入装置。
38.该方面提供了另一种治疗神经系统障碍的方法,该方法基于离体基因治疗和植入能够分泌增加量的gdnf的治疗性细胞。
39.在另一方面,本发明涉及能够以超过20μg gdnf/105细胞/24hr的量分泌gdnf或其功能等同物超过6个月的哺乳动物细胞。
40.本发明中描述的生产gdnf的细胞生产的gdnf的量超过在现有技术的哺乳动物细胞中观察到的量至少一个数量级。本发明的生产gdnf的细胞使得在发酵器中使用哺乳动物细胞生产蛋白质成为可能,其优点是蛋白质已被正确加工、糖基化和折叠,并且可以容易地从培养基中回收。
附图说明
41.图1描述了用于产生gdnf分泌细胞克隆的gdnf表达载体的质粒图谱:pt2.can.hog(a)和pt2.can.hoigsp.gdnf(b)。
42.图2描述了在2d汇合培养物中选择最佳gdnf克隆的gdnf elisa结果。
43.图3描述了来自克隆ca-9,arpe-19/pt2.can.ho.igsp.gdnf#2(igsp#2)和arpe-19/pt2.can.hog#3(ppg#3)的条件培养基样本的gdnf蛋白质印迹(western blot),蛋白质印迹显示gdnf的正确处理。样本在15%sds凝胶上电泳,随后转移至pvdf膜上。将封闭的膜与抗gdnf抗体(r&d systems,af-212-na)一起孵育,然后用hrp-连接的抗山羊抗体孵育并用ecl检测。将来自r&d systems的纯化重组gdnf纳入作为参考。这种蛋白质在预测序列的氨基末端缺少31个氨基酸残基,导致mw略小(非糖基化单体的预测mw为11.6kda)。
44.图4描述了从如图所示的填充有细胞克隆的装置中释放gdnf。该图显示了每个细胞克隆在装置填充后1-4周的gdnf释放。
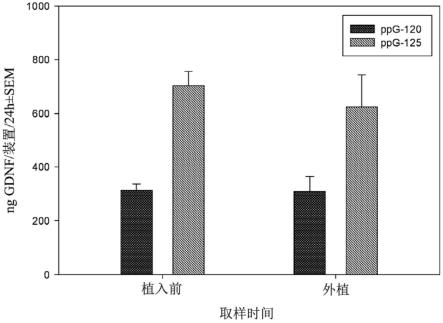
45.图5描述了植入前(填充后2.5周)和外植后测量的gdnf从填充有不同克隆的装置中的释放。数据显示为平均值
±
sem。
46.图6描述了具有克隆ppg-120的装置#73和#74的苏木精染色切片,显示了在大鼠脑中2周后良好的细胞存活。
47.图7描述了具有克隆ppg-125的装置#69和#70的苏木精染色切片,显示了在大鼠脑中2周后良好的细胞存活。
48.图8描述了脑切片上的gdnf免疫组织化学,覆盖了大鼠#1-3纹状体中的植入位点,克隆ppg-2在左侧,ppg-20在右侧。
49.图9描述了脑切片上的gdnf免疫组织化学,覆盖了大鼠#19-21的纹状体中的植入位点,克隆ppg-120和igsp-2g如图所示放置。
50.图10描述了在具有生产gdnf的克隆的植入装置周围测量的gdnf组织水平。尤其是克隆ppg-2、ppg-20、ppg-120和ppg-125产生高gdnf组织水平。从未处理大鼠的纹状体中取出的打孔样本作为阴性对照。请注意,从一个ppg-48装置和所有ppg-125装置测得的样本光密度在标准曲线之外,因此显示的值被低估。
51.图11描述了来自选定植入位点的均质化组织样本的gdnf蛋白质印迹。显示了装置数量和克隆id。阴性对照(第一道)来自未处理大鼠的纹状体。将来自r&d systems公司的纯化重组gdnf纳入作为参考。这种蛋白质在预测序列的氨基末端缺少31个氨基酸残基,导致mw略小(非糖基化单体的预测mw为11.6kda)。可以看到糖基化和非糖基化gdnf的单体和二聚体(用箭头表示);未检测到gdnf前体。
52.图12描述了大鼠脑的水平视图,显示了装置(绿色)和6-ohda注射(黄色)在纹状体中的放置。
53.图13描述了在植入前和外植后收集的培养基样本中从装置中释放gdnf。数据显示为平均值
±
sem。
54.图14描述了具有克隆ppg-120的装置#33和#34的苏木精染色切片,显示了在6-ohda实验结束时外植后良好的细胞存活(装置在大鼠脑中7周)。外植后从所示装置测量的gdnf释放以蓝色显示。
55.图15描述了具有克隆ppg-125的装置#53和#55的苏木精染色切片,显示了在6-ohda实验结束时外植后良好的细胞存活(装置在大鼠脑中7周)。外植后从所示装置测量的gdnf释放以蓝色显示。
56.图16描述了在大鼠28和29中具有装置#53和#55(克隆ppg-125)的植入位点(i)的切片上的gdnf免疫组织化学。gdnf免疫反应性(棕色)表明植入装置分泌的gdnf蛋白扩散良好,覆盖了整个纹状体(str)。
57.图17描述了来自paxinos大鼠脑图谱(1997)的图,显示了选择用于评估纹状体6-ohda病变的切片。
58.图18描述了具有空装置的对照组中的大鼠个体的图像分析,(a)在纹状体的四个切片中以对照侧的%量化病变侧的酪氨酸羟化酶免疫反应性(前卤1.0、0.2、-0.4和-1.0)。虚线分别表示对照侧的50%和100%。平均纹状体酪氨酸羟化酶免疫反应性低于50%的动物用蓝色箭头表示。(b)在黑质的三个切片中以对照侧的%量化病变侧的酪氨酸羟化酶免疫反应性(前卤-4.8,-5.2,-5.6)。虚线表示对照侧的100%。动物应具有足够的纹状体6-ohda病变(与对照侧相比,酪氨酸羟化酶免疫反应性低于50%)以纳入最终分析(绿色箭头)。
59.图19描述了具有ppg-120装置的组中的大鼠个体的图像分析,(a)在纹状体的四个切片中以对照侧的%量化病变侧的酪氨酸羟化酶免疫反应性(前卤1.0、0.2、-0.4和-1.0)。虚线分别表示对照侧的50%和100%。平均纹状体酪氨酸羟化酶免疫反应性低于50%的动物用蓝色箭头表示。(b)在黑质的三个切片中以对照侧的%量化病变侧的酪氨酸羟化酶免疫反应性(前卤-4.8,-5.2,-5.6)。虚线表示对照侧的100%。动物应具有足够的纹状体6-ohda病变(与对照侧相比,酪氨酸羟化酶免疫反应性低于50%)以纳入最终分析(绿色箭头)。
60.图20描述了具有ppg-125装置的组中的大鼠个体的图像分析,(a)在纹状体的四个
切片中以对照侧的%量化病变侧酪氨酸羟化酶免疫反应性(前卤1.0、0.2、-0.4和-1.0)。虚线分别表示对照侧的50%和100%。平均纹状体酪氨酸羟化酶免疫反应性低于50%的动物用蓝色箭头表示。(b)在黑质的三个切片中以对照侧的%量化病变侧的酪氨酸羟化酶免疫反应性(前卤-4.8,-5.2,-5.6)。虚线表示对照侧的100%。动物应具有足够的纹状体6-ohda病变(与对照侧相比,th免疫反应性低于50%)以纳入最终分析(绿色箭头)。
61.图21描述了显示具有ppg-120和ppg-125的装置对黑质(sn)中da神经元的神经保护作用的图像分析结果。列中的数据显示了病变侧黑质中存活的酪氨酸羟化酶阳性神经元(对应于酪氨酸羟化酶免疫反应面积)的平均百分比
±
sem。此外,单只大鼠的平均值用垂直点图表示。空装置组(n=4)、ppg-120组(n=8)和ppg-125组(n=7)。
62.图22描述了黑质(sn)中人工细胞计数的结果,显示了具有ppg-120和ppg-125的装置对da神经元的神经保护作用。列中的数据显示了病变侧黑质中存活的酪氨酸羟化酶阳性神经元的平均百分比
±
sem。此外,单只大鼠的平均值用垂直点图表示。(a)排除具有小病变的动物的结果:空装置组(n=4)、ppg-120组(n=8)和ppg-125组(n=7)。(b)包括所有动物的结果。
63.图23描述了来自ppg-125组(#29)大鼠黑质对照侧和病变侧的酪氨酸羟化酶免疫染色。在病变侧,与正常表达水平(红色箭头)相比,许多存活的神经元显示酪氨酸羟化酶表达下调(蓝色箭头所示)。
64.图24为受试者(12周,左侧,10级)的中耳和内耳切片的全景图。箭头表示装置(切片前已移除)区域及其周围的局部纤维化和炎症。
65.图25为植入导管(箭头所示)周围的鞘的高倍放大图,该植入导管填充有受试者的血液(12周,左侧,8级)。移植位点周围可见纤维结缔组织环和偏心性慢性炎症。
66.图23a和图23b为受试者(12周,左侧)的高倍放大图像,证明神经中的髓鞘(箭头所示)肿胀,表明最小神经损伤(h&e,20x)(图23a),以及神经中的局灶性凋亡碎片(箭头所示),表明最小神经损伤(h&e,20x)(图23b)。
67.定义
68.如本文所用,信号肽或真核信号肽是存在于蛋白质上的肽,所述蛋白质将被分泌或成为膜成分。它通常位于蛋白质的n末端。在本文中,在signalp(2.0版或优选3.0版)中识别为信号肽的所有信号肽都被认为是信号肽。
69.如本文所用,哺乳动物信号肽是衍生自通过内质网分泌的哺乳动物蛋白质的信号肽。
70.如本文所用,异源信号肽是不与gdnf多肽天然可操作性连接的信号肽。
71.如本文所用,成熟人gdnf多肽是指天然人gdnf的134个氨基酸,即seq id no.1的氨基酸1-134,并加工成二聚体。在某些情况下,应理解“分泌的gdnf多肽”是指将要分泌的多肽,而不是已经分泌的多肽。
72.如本文所用,序列同一性是指参考氨基酸序列和变体氨基酸序列之间的同一性,其通过使用clustal w(1.82)的默认设置比对序列来进行的。计算完全保守残基的数量,并除以参考序列中的残基数量。
具体实施方式
73.i.信号序列
74.将分泌的蛋白质靶向分泌途径是通过连接一个短的氨基末端序列来实现的,该序列被称为信号肽或信号序列(von heijne,(1985),j mol biol,184:99-105;kaiser and botstein,(1986),mol cell biol,6:2382-91)。信号肽本身包含几种优化功能所必需的元件,其中最重要的是疏水成分。紧邻疏水序列之前的通常是一个或多个碱性氨基酸,而在信号肽的羧基末端是一对小的不带电荷的氨基酸,它们被一个限定信号肽酶切割位点的中间氨基酸分开。
75.优选的哺乳动物信号肽长度为15至30个氨基酸(真核生物的平均长度为23个氨基酸)。来自各种蛋白质的信号肽的共同结构通常被描述为带正电荷的n-区,接着是疏水性h-区和中性但极性的c-区。(-3,-1)-规则规定-3位和-1位(相对于切割位点)的残基必须是小的和中性的,切割才能正确发生。
76.真核信号序列的n-区仅略微富含精氨酸。h-区很短并且非常疏水性。c-区很短,没有可观察到的模式。如上所述,-3位和-1位由小的中性残基组成。切割位点c端的氨基酸残基在真核生物中不太重要。
77.在c-区中,-1位和-3位的残基是最重要的。这些是小的不带电荷的氨基酸。在-1位的残基优选是a、g、s、i、t或c。更优选-1位是a、g或s。在-3位的残基优选是a、v、s、t、g、c、i或d。更优选-3位是a、v、s或t。
78.疏水区通常由疏水残基组成。这些残基包括a、i、l、f、v和m。优选在-6至-13位。在构成该区域的8个氨基酸中,至少4个残基应该是疏水的,更优选至少5个,更优选至少6个,例如7或8个。
79.各种不同的信号肽可以用于根据本发明的gdnf构建体中。信号肽可以是任何功能性信号肽,例如异源信号肽,如免疫球蛋白信号肽(igsp)。信号肽可以来自任何合适的物种,例如人、小鼠、大鼠、猴、猪。优选来自人。
80.如所附实施例所证明的,使用不含gdnf前肽的igsp通常导致生物活性gdnf在体外和体内的分泌改善。质粒转染细胞的结果是可重复的。当igsp编码序列直接与编码成熟蛋白(不包括gdnf的天然前原部分(seq id no.2))的基因融合时,细胞分泌成熟蛋白作为生物活性蛋白。在一实施方案中,编码的信号肽是小鼠ig重链基因v-区。
81.如所附实施例所证明的,使用这种信号肽通常会导致编码的gdnf的分泌改善。质粒转染细胞的结果是可重复的。即使当igsp基因与编码成熟蛋白(即不包括前原部分)的基因直接融合时,细胞也能产生正确尺寸的成熟蛋白。
82.优选地,igsp是鼠源或人源的,因为已知鼠igsp在小鼠、大鼠和人类中具有功能。为了用于人类,igsp优选是人源的,以降低任何跨物种副作用的风险。
83.编码人gdnf前原肽的核苷酸序列在本技术的seq id no:3中给出。编码的蛋白质长度为211个氨基酸,如seq id no:4所示。优选地,在本发明的上下文中使用的gdnf是人成熟gdnf,但是同样预期可以使用相应的小鼠和大鼠序列。
84.参照编码的生物活性gdnf适当定义本发明的序列变体。预期可以改变gdnf的序列而不改变生长因子的生物活性。在本发明的一个实施方案中,gdnf的序列变体是编码生长因子的序列,其与人或小鼠或大鼠gdnf(seq id no.1、5和6)的氨基酸有至少70%的序列同
一性。更优选地,序列变体与所述gdnf具有至少75%的序列同一性,更优选至少80%,更优选至少85%,更优选至少90%,更优选至少95%,更优选至少97%,更优选至少99%。
85.通过标准技术,例如定点诱变和pcr介导的诱变,可以将突变引入gdnf。优选地,保守氨基酸取代在一个或多个预测的非必需氨基酸残基处进行。“保守氨基酸取代”是指氨基酸残基被具有相似侧链的氨基酸残基取代。本领域已经定义了具有相似侧链的氨基酸残基家族。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸、色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,gdnf蛋白中预测的非必需氨基酸残基被来自相同侧链家族的另一种氨基酸残基取代。
86.氨基酸家族的相关性也可以基于侧链相互作用来确定。取代的氨基酸可以是完全保守的“强”残基或完全保守的“弱”残基。保守氨基酸残基的“强”组可以是下列组中的任一组:sta、neqk、nhqk、ndeq、qhrk、milv、milf、hy、fyw,其中单字母氨基酸编码按那些可以相互取代的氨基酸进行分组。同样地,保守残基的“弱”组可以是以下任一组:csa、atv、sag、stnk、stpa、sgnd、sndeqk、ndeqhk、neqhrk、vlim、hfy,其中每组中的字母代表单字母氨基酸编码。
87.ii.用于治疗神经退行性障碍的靶组织
88.体内基因治疗的一个重要参数是选择合适的靶组织。根据对神经营养因子尤其是gdnf的保留反应性来选择大脑区域。在人体中,对神经营养因子保持反应直至成年的cns神经元包括胆碱能基底前脑神经元、内嗅皮层神经元、丘脑神经元、蓝斑神经元、脊髓感觉神经元和脊髓运动神经元。对gdnf保持反应性的细胞的另一个特征是表达ret和两种共受体gfrα1和gfrα2之一。
89.这种复杂神经元网络的胆碱能分隔间中的异常与许多神经退行性障碍有关,包括ad、帕金森病和肌萎缩性侧索硬化症(als,也称为娄格赫里希氏病)。胆碱能基底前脑(特别是基底前脑的ch4区域)是特别合适的靶组织。
90.在灵长类动物前脑中,大细胞神经元ch1-ch4向大脑皮层、丘脑和杏仁核的基底外侧核提供胆碱能神经支配。在患有神经退行性疾病例如ad的受试者中,与正常对照相比,具有神经生长因子(ngf)受体的ch4区域(meynert的基底核)中的神经元经历显著的萎缩(参见,例如kobayashi et al.,(1991),mol chem neuropathol,15:193-206)。在正常受试者中,神经营养素防止发育过程中的交感和感觉神经元死亡,并防止成年大鼠和灵长类动物中的胆碱能神经元退化(tuszynski et al.,(1996),gene thera,3:305314)。人们认为,基底前脑这一区域中功能神经元的损失与患有神经退行性疾病例如ad的受试者所经历的认知衰退有因果关系(tuszynski et al.,supra and,lehericy et al.,(1993),j comp neurol,330:15-31)。
91.iii.剂量要求和递送方案
92.关于gdnf在帕金森病治疗中的剂量的指导可以在许多引用的关于使用体内基因治疗递送gdnf的参考文献中找到。
93.在优选的实施方案中,如u.s.9,364,427和u.s.9,669,154中所述,通过可植入胶
囊将分泌gdnf的细胞引入靶区域,这两篇文献均通过引用并入本文。
94.在优选的实施方案中,施用位点是大脑的纹状体,特别是尾状核和/或壳核。将本发明的细胞插入壳核可以标记位于脑的不同远区的靶位点,例如苍白球、杏仁核、丘脑下核或黑质。苍白球细胞的转导通常引起丘脑细胞的逆行标记。在优选实施方案中,靶位点(或其中之一)是黑质。细胞也可以插入纹状体和黑质两者。
95.iv.表达载体
96.用于本发明的重组表达gdnf的载体的构建可使用常规技术完成,其不需要向本领域普通技术人员进行详细解释。然而,对于综述,普通技术人员可能希望参考maniatis et al.,in molecular cloning:a laboratory manual,cold spring harbor laboratory,(ny 1982)。
97.本发明中使用的嵌合表达构建体可以如实施例中描述的产生,例如,通过pcr扩增所需片段(信号序列和gdnf编码序列)并在重叠pcr中融合这些片段。由于几个优选的信号序列相对较短,用于扩增gdnf编码序列的5’pcr引物可以包括编码信号序列以及tata盒和其它调控元件的序列。
98.简而言之,重组表达载体的构建采用标准连接技术。为了分析以确认所构建的载体中的正确序列,基因是使用例如messing等的方法((1981),nucleic acids res,9(2):309-21),maxam和gilbert的方法,((1980),methods enzymol,65(1):499-560),或本领域技术人员已知的其它合适方法的序列。
99.切割片段的尺寸分离用常规凝胶电泳进行,例如maniatis等所述((1982),molecular cloning,pp.133-4)。
100.基因的表达在转录、翻译或翻译后水平受到控制。转录起始是基因表达的早期关键事件。这取决于启动子和增强子序列,并受与这些序列相互作用的特定细胞因子的影响。许多基因的转录单元包含启动子,在某些情况下包含增强子或调节子元件(banerji et al.,(1981),cell 27:299);corden et al.,(1980),science,209:1406);以及breathnach和chambon,(1981),ann rev biochem,50:349)。对于逆转录病毒,参与逆转录病毒基因组复制的控制元件位于长末端重复序列(ltr)中(weiss et al.,eds.,the molecular biology of tumor viruses:rna tumor viruses,cold spring harbor laboratory,(ny 1982))。莫洛尼鼠白血病病毒(mlv)和劳斯肉瘤病毒(rsv)ltr含有启动子和增强子序列(jolly et al.,(1983),nucleic acids res,11:1855;capecchi et al.,in:enhancer and eukaryotic gene expression,gulzman and shenk,eds.,pp.101-2,cold spring harbor laboratories(ny 1991))。其它有效的启动子包括衍生自巨细胞病毒(cmv)的启动子和其它野生型病毒启动子。
101.还描述了许多非病毒启动子的启动子和增强子区域(schmidt et al.,(1985),nature,314:285;rossi and decrombrugghe,(1987),proc natl acad sci usa,84:5590-4)。在静止细胞中维持和增加转基因表达的方法包括使用启动子,包括i型胶原蛋白(1和2)(prockop andkivirikko,(1984),n eng j med,311:376);smith and niles,(1980),biochemistry,19:1820;de wet et al.,(1983);j biol chem,258:14385),sv40和ltr启动子。
102.根据本发明的一个实施方案,启动子是组成型启动子,选自由泛素启动子、cmv启
动子、jet启动子(u.s.6,555,674)、sv40启动子和延伸因子1α启动子(ef1-α)组成的组。
103.诱导型/阻抑型启动子的实例包括:tet-on、tet-off、雷帕霉素诱导型启动子、mx1。
104.除了使用病毒和非病毒启动子驱动转基因表达之外,增强子序列也可以用于提高转基因表达水平。增强子不仅可以增加其天然基因的转录活性,还可以增加一些外源基因的转录活性(armelor,(1973),proc natl acad sci usa,70:2702)。例如,在本发明中,胶原增强子序列可以与胶原启动子2(i)一起使用,以增加转基因表达。此外,在sv40病毒中发现的增强子元件可以用于增加转基因表达。如gruss et al.,(1981),proc natl acad sci usa,78:943;benoist and chambon,(1981),nature.290:304,和fromm and berg,(1982),j mol appl genetics,1:457等描述的,增强子序列由72个碱基对的重复序列组成,所有这些文献通过引用并入本文。当该重复序列与各种启动子串联存在时,可以增加许多不同病毒和细胞基因的转录(moreau et al.,(1981),nucl acids res,9:6047)。
105.进一步的表达增强序列包括但不限于土拨鼠肝炎病毒转录后调节元件、wpre、sp163、大鼠胰岛素内含子或其它内含子、cmv增强子和鸡[β]-珠蛋白绝缘体或其它绝缘体。
[0106]
还可使用细胞因子调节启动子活性来增加转基因表达以实现长期稳定表达。已经报道了几种细胞因子调节胶原2(i)和ltr启动子驱动的转基因表达(chua et al.,(1990),connective tiss res.,25:161-170;elias et al.,(1990),annals ny acad sci,580:233-44);seliger et al.,(1988)j immunol,141:2138-44和seliger et al.,(1988),j virol.62:619-21)。例如,转化生长因子(tgf)、白细胞介素(il)-i和干扰素(inf)下调由各种启动子如ltr驱动的转基因的表达。肿瘤坏死因子(tnf)和tgf 1上调并可用于控制由启动子驱动的转基因表达。可能证明其它有用的细胞因子,包括碱性成纤维细胞生长因子(bfgf)和表皮生长因子(egf)。
[0107]
具有胶原增强子序列(coll(e))的胶原启动子也可用于通过进一步抑制对载体的任何免疫反应来增加转基因表达,所述免疫反应可在经处理的脑中产生,尽管其处于免疫保护状态。此外,包括类固醇在内的抗炎剂,例如地塞米松,可以在载体组合物递送后立即施用于治疗的宿主,并优选持续施用,直至任何细胞因子介导的炎症反应消退。也可以施用免疫抑制剂(例如环孢菌素)来减少干扰素的产生,干扰素下调ltr启动子和coll(e)启动子-增强子并减少转基因表达。
[0108]
载体可以包含其它序列,例如编码cre-重组酶蛋白的序列和loxp序列。确保神经胚素(neublastin)短暂表达的另一种方法是通过使用cre-loxp系统,该系统在向细胞施用cre-重组酶时(daewoong et al.,nat biotechnol,19:929-33)或者通过将编码重组酶的基因整合至病毒构建体中(pl
ü
ck,(1996),int j exp path,77:269-78),导致插入dna序列的一部分被切除。将重组酶基因与loxp位点和结构基因(在本例中为神经胚素)一起整合到病毒构建体中,通常导致结构基因表达约5天。
[0109]
v.药物制剂
[0110]
为了形成用于本发明的gdnf组合物,可以将编码gdnf的表达载体置于药学上可接受的悬浮液、溶液或乳液中。合适的介质包括盐水和脂质体制剂。
[0111]
更具体地,药学上可接受的载体可以包括非水溶液的无菌水性溶液、悬浮液和乳液。非水溶剂的实例是丙二醇、聚乙二醇、植物油(例如橄榄油)和可注射的有机酯(例如油
酸乙酯)。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。胃肠外载体包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸林格氏液或不挥发油。
[0112]
静脉内载体包括液体和营养补充剂、电解质补充剂(例如基于林格氏葡萄糖的补充剂)等。
[0113]
也可以存在防腐剂和其它添加剂,例如抗菌剂、抗氧化剂、螯合剂和惰性气体等。此外,gdnf转基因的组合物可以使用本领域公知的方法冻干,用于随后的重构和根据本发明的用途。
[0114]
胶体分散系统也可用于靶向基因递送。
[0115]
胶体分散系统包括大分子复合物、纳米胶囊、微球、微珠和基于脂质的系统,基于脂质的系统包括水包油乳液、胶束、混合胶束和脂质体。脂质体是人工膜囊泡,可用作体外和体内的递送载体。已经表明,尺寸范围为0.2-4.0μm的大单层囊泡(luv)可以封装相当大比例的含有大分子的水性缓冲液。rna、dna和完整的病毒体可以被封装在水性内部,并以生物活性形式递送至细胞(fraley et al.,(1981),trends biochem sci,6:77)。除了哺乳动物细胞,脂质体还用于在植物、酵母和细菌细胞中递送可操作编码的转基因。为了使脂质体成为有效的基因转移载体,脂质体应具有以下特征:(1)高效封装编码gdnf的基因,而不损害它们的生物活性;(2)与非靶细胞相比,优先和充分结合靶细胞;(3)高效地将囊泡的水性内容物递送至靶细胞的细胞质中;和(4)遗传信息的准确和有效表达(mannino et al.,(1988),biotechniques,6:682)。
[0116]
脂质体的组成通常是磷脂的组合,特别是高相变温度的磷脂,通常与类固醇,特别是胆固醇组合。也可以使用其它磷脂或其它脂质。脂质体的物理特性取决于ph、离子强度和二价阳离子的存在。
[0117]
在脂质体生产中有用的脂质的实例包括磷脂酰化合物,例如磷脂酰甘油、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、鞘脂、脑苷脂和神经节苷脂。特别有用的是二酰基磷脂酰甘油,其中脂质部分含有14-18个碳原子,特别是16-18个碳原子,并且是饱和的。说明性的磷脂包括卵磷脂、二棕榈酰磷脂酰胆碱和二硬脂酰磷脂酰胆碱。
[0118]
脂质体的靶向可基于解剖学和机制因素进行分类。解剖学分类基于选择性的水平,例如,器官特异性、细胞特异性和细胞器特异性。机制靶向可以根据它是被动的还是主动的来区分。被动靶向利用脂质体分布到含有窦状毛细血管的器官中网状内皮系统(res)细胞的自然趋势。
[0119]
另一方面,主动靶向涉及通过将脂质体连接至特定配体(例如单克隆抗体、糖、糖脂或蛋白质)或通过改变脂质体的组成或尺寸来改变脂质体,以实现对除天然存在的定位位点以外的器官和细胞类型的靶向。
[0120]
靶向基因递送系统的表面可以通过多种方式修饰。在脂质体靶向递送系统的情况下,可以将脂质基团掺入脂质体的脂质双层中,以保持靶向配体与脂质体双层稳定结合。各种连接基团可用于将脂质链连接至靶向配体上。
[0121]
递送系统的另一个实例包括将能够产生本发明所述载体颗粒的包装细胞组合物移植至治疗区域。这种细胞的封装和移植方法在本领域是已知的,特别是在wo 97/44065(细胞治疗学)中公开。通过选择能够产生慢病毒颗粒的包装细胞系,获得治疗区域中不分裂细胞的转导。通过使用只能够转导分裂细胞的逆转录病毒颗粒,转导被限制在治疗区域
中重新分化的细胞。
[0122]
vi.封装细胞
[0123]
封装细胞疗法基于这样的概念,即在植入宿主体内之前,通过用半透性生物相容性材料包围细胞,将细胞与受体宿主的免疫系统分离。本发明包括一装置,其中gdnf分泌细胞被封装在免疫隔离胶囊中。“免疫隔离胶囊”是指在植入受体宿主后,该胶囊将宿主免疫系统对装置核心细胞的有害影响降至最低。通过将细胞封装在由微孔膜形成的可植入聚合物胶囊中,使细胞与宿主免疫隔离。这种方法防止了宿主和植入组织之间的细胞间接触,通过直接呈递消除了抗原识别。使用的膜也可以根据其分子量进行定制,以控制分子(例如抗体和补体)的扩散(lysaght et al.,(1994),j cell biochem,56:196-204,colton,(1996)trends biotechnol,14:158-62)。使用封装技术,无论使用或不使用免疫抑制药物,细胞都可以被移植至宿主体内而没有免疫排斥。有用的生物相容性聚合物胶囊通常包含含有悬浮在液体介质中或固定在固定基质中的细胞的核,和不含分离细胞的选择性渗透基质或膜(“壳”)的周围或外围区域,壳是生物相容的,并且足以保护核中的细胞免受有害的免疫攻击。封装阻止免疫系统的成分进入胶囊,从而保护被封装的细胞免受免疫破坏。胶囊膜的半透性也允许目标生物活性分子容易地从胶囊扩散至周围的宿主组织中。
[0124]
胶囊可以由生物相容性材料制成。“生物相容性材料”是在植入宿主后,不会引起足以导致排斥胶囊或使其不能操作(例如通过降解)的有害宿主反应的材料。生物相容性材料对大分子例如宿主免疫系统的成分相对不可渗透,但对小分子例如胰岛素、生长因子和营养物质可渗透,同时允许清除代谢废物。多种生物相容性材料适用于通过本发明的组合物递送生长因子。已知许多生物相容性材料,具有各种外表面形态和其它机械和结构特征。优选地,本发明的胶囊将类似于u.s.9,364,427和u.s.9,669,154中所描述的那些,这两篇文献都通过引用并入本文。这种胶囊允许代谢物、营养物和治疗物质通过,同时使宿主免疫系统的有害影响最小化。生物相容性材料的成分可以包括包围的半透膜和内部细胞支撑支架。优选地,将转化的细胞接种到被选择性渗透膜包封的支架上。丝状细胞支撑支架可以由选自丙烯酸、聚酯、聚乙烯、聚丙烯、聚乙腈、聚对苯二甲酸乙二醇酯、尼龙、聚酰胺、聚氨酯、聚丁二酯、丝、棉、甲壳质、碳或生物相容性金属的任何生物相容性材料制成。此外,粘合纤维结构可用于细胞植入(u.s.5,512,600,通过引用并入本文)。可生物降解的聚合物包括由聚(乳酸)pla、聚(乳酸-乙醇酸)plga和聚(乙醇酸)pga及其等价物构成的那些。泡沫支架已被用于提供移植细胞可以粘附的表面(wo 98/05304,通过引用并入本文)。编织网管已经被用作血管移植物(wo 99/52573,通过引用并入本文)。此外,核可以由水凝胶形成的固定基质构成,其稳定细胞的位置。水凝胶是凝胶形式的交联亲水聚合物的三维网络,主要由水构成。
[0125]
各种聚合物和聚合物混合物可用于制造包围的半透膜,包括聚丙烯酸酯(包括丙烯酸共聚物)、聚乙二烯、聚氯乙烯共聚物、聚氨酯、聚苯乙烯、聚酰胺、醋酸纤维素、硝酸纤维素、聚砜(包括聚醚砜)、聚磷腈、聚丙烯腈、聚(丙烯腈/氯乙烯)以及它们的衍生物、共聚物和混合物。优选地,包围的半透膜是生物相容的半透性中空纤维膜。u.s.5,284,761和u.s.5,158,881公开了这种膜及其制造方法,这两篇文献通过引用并入本文。包围的半透膜由聚醚砜中空纤维形成,例如u.s.4,976,859或u.s.4,968,733中描述的那些,这两篇文献通过引用并入本文。另一种包围的半透膜的材料是聚(丙烯腈/氯乙烯)。
[0126]
胶囊可以是为适于维持生物活性并提供产品或功能递送通道的任何构型,包括例如圆柱形、矩形、盘形、贴片形、卵形、星形或球形。此外,胶囊可以盘绕或包裹成网状或嵌套结构。如果胶囊在植入后被回收,倾向于导致胶囊从植入位点迁移的构型(例如小至足以在受体宿主的血管中行进的球形胶囊),是不优选的。某些形状,例如矩形、片状、盘形、圆柱形和平板形,提供了更好的结构完整性,并且在需要回收的地方是优选的。
[0127]
当使用大胶囊时,优选在每个装置中封装103至108个细胞,最优选105至107个细胞。可以通过植入更少或更多数量的胶囊来控制剂量,优选每位患者在1至10粒胶囊。
[0128]
支架可包覆有细胞外基质(ecm)分子。细胞外基质分子的合适实例包括例如胶原、层粘连蛋白和纤连蛋白。支架的表面也可以通过用等离子体辐射处理来修饰,以赋予电荷来增强细胞的粘附。
[0129]
可以使用任何合适的密封胶囊的方法,包括使用聚合物粘合剂或卷曲、打结和热封。此外,也可以使用任何合适的“干”密封方法,例如u.s.5,653,687中所描述的,该文献通过引用并入本文。
[0130]
根据已知技术植入封装的细胞装置。本发明的装置和方法考虑了许多植入位点。这些植入位点包括但不限于中枢神经系统,包括脑、脊髓(参见u.s.5,106,627、u.s.5,156,844和5,554,148,所有这些文献通过引用并入本文),以及眼睛的房水和玻璃体液(wo 97/34586,通过引用并入本文)。
[0131]
arpe-19细胞系是基于封装细胞的递送技术的优良平台细胞系,并且也可用于基于未封装细胞的递送技术。arpe-19细胞系是坚强的(即,该细胞系可以在严格条件下存活,例如植入中枢神经系统或眼内环境中)。可以对arpe-19细胞进行基因修饰,使其分泌有治疗价值的物质。arpe-19细胞具有相对较长的寿命。arpe-19细胞是人类来源的。此外,封装的arpe-19细胞具有良好的体内装置存活力。arpe-19细胞可以递送有效量的生长因子。arpe-19细胞引发的宿主免疫反应可以忽略不计。此外,arpe-19细胞是非致瘤性的。
[0132]
u.s.5,487,739描述了将胶囊植入cns的方法和仪器,该文献通过引用并入本文。
[0133]
一方面,本发明涉及生物相容性胶囊,其包含:核,所述核包含分泌用于感染靶细胞的病毒载体的活包装细胞,其中所述病毒载体是根据本发明的载体;和包围所述核的外壳,所述壳包含可渗透的生物相容性材料,所述材料的孔隙率选择为允许直径约100nm的逆转录病毒载体通过,从而允许所述病毒载体从所述胶囊中释放。
[0134]
优选地,核额外包含基质,包装细胞由基质固定。根据一个实施方案,壳包括水凝胶或热塑性材料。
[0135]
u.s.6,027,721中公开了用于封装包装细胞的方法和装置,该文献通过引用并入本文。
[0136]
vii.医疗用途和治疗方法
[0137]
一方面,本发明涉及根据本发明的载体在制备用于治疗神经系统障碍的药物中的用途。神经系统障碍可以是外周神经系统或中枢神经系统的障碍。
[0138]
治疗不仅指预期的治愈性治疗,还指预防性(preventive,非绝对预防)或预防性(prophylactic)治疗。治疗也可以是缓解性的或对症的。
[0139]
优选地,cns障碍是神经退行性或神经性疾病。神经退行性或神经性疾病可以是涉及病变的和创伤性神经元的疾病,例如外周神经、延髓、脊髓的创伤性病变、脑缺血性神经
元损伤、神经病、外周神经病、神经性疼痛、阿尔茨海默氏病、亨廷顿氏病、帕金森病、肌萎缩性侧索硬化、与痴呆有关的记忆障碍。根据本发明,多发性硬化症的神经退行性部分也是可治疗的。
[0140]
根据本发明的一个优选实施方案,神经退行性疾病是帕金森病(参见实施例)。
[0141]
在另一个优选的实施方案中,疾病是肌萎缩性侧索硬化或脊髓损伤。
[0142]
本发明的载体也可用于治疗眼病,例如色素性视网膜炎、黄斑变性、青光眼、糖尿病性视网膜病。
[0143]
可通过向有需要的个体施用治疗有效量的本发明来治疗神经系统疾病;或治疗有效量的本发明药物组合物。
[0144]
对于帕金森病,胶囊和载体的递送在上文“剂量要求和递送方案”中进行了描述。对于als和脊髓损伤,可以将含有gdnf分泌细胞或病毒载体的胶囊递送至鞘内空间、脑室内或脊髓内。对于脊髓损伤,也可以递送至病变和/或创伤性神经元的区域。胶囊或载体可以递送至下运动神经元附近的颈/腰膨大部。特别是对于als,可以将编码本发明表达构建体的修饰狂犬病毒注射到患病的肌肉组织中,从而完成向患病运动神经元的逆行转运。
[0145]
尽管本发明集中于体内基因治疗,但也考虑了通过向有需要的个体移植以下项来治疗神经系统疾病:
[0146]
i.治疗有效量的根据本发明的转导细胞;
[0147]
ii.包含转导细胞的可植入装置;或
[0148]
iii.包含包装细胞系的生物相容性装置。
[0149]
所述移植可以包括自体移植、同种异体移植或异种移植。
[0150]
大多数(如果不是全部的话)眼科疾病和障碍与三种类型的适应症中的一种或多种相关:(1)血管生成,(2)炎症,和(3)退化。为了治疗这些障碍,本发明的病毒载体、治疗性细胞和封装细胞允许将gdnf递送至眼睛。
[0151]
根据本发明的载体的递送可以使用视网膜下注射、玻璃体内注射或经巩膜注射来完成。
[0152]
例如,糖尿病性视网膜病的特征是血管生成和视网膜退化。本发明考虑通过植入装置来治疗糖尿病性视网膜病,所述装置在眼内,优选在玻璃体中,或者在眼周,优选在眼球筋膜下区域递送gdnf。对于这种适应症,我们更倾向于将胶囊、裸细胞或病毒载体递送至玻璃体中。视网膜病变包括但不限于糖尿病性视网膜病变、增生性玻璃体视网膜病变和中毒性视网膜病变。
[0153]
葡萄膜炎涉及炎症和继发性退化。本发明考虑通过眼内(优选玻璃体或前房)植入分泌gdnf的胶囊或裸细胞或通过向玻璃体施用本发明的载体来治疗葡萄膜炎。
[0154]
相比之下,色素性视网膜炎的特征是原发性视网膜退化。本发明考虑通过眼内(优选玻璃体)放置分泌gdnf的装置或裸细胞或通过向玻璃体施用本发明的载体来治疗色素性视网膜炎。
[0155]
年龄相关性黄斑退化涉及血管生成和视网膜退化。本发明考虑通过使用本发明的胶囊或裸细胞眼内递送gdnf,优选递送至玻璃体,或通过使用本发明的载体眼内递送gdnf,优选递送至玻璃体,来治疗这种疾病。年龄相关性黄斑退化包括但不限于干性年龄相关性黄斑退化、渗出性年龄相关性黄斑退化和近视性黄斑退化。
[0156]
青光眼的特征是眼压升高和视网膜神经节细胞丧失。本发明所考虑的青光眼治疗包括通过胶囊、载体或裸细胞经眼内、优选玻璃体内递送保护视网膜细胞免受青光眼相关损伤的gdnf。
[0157]
本发明可以用于治疗眼部新血管形成,这是一种与许多眼部疾病和障碍相关的病症,并且是大多数严重视力丧失的原因。例如,我们考虑治疗视网膜缺血相关的眼部新血管形成,这是糖尿病和许多其它疾病中失明的主要原因;角膜新生血管形成,使患者易于发生角膜移植失败;以及与糖尿病性视网膜病、视网膜中央静脉阻塞和可能的年龄相关性黄斑退化相关的新血管形成。
[0158]
在本发明的一个实施方案中,分泌生物活性gdnf的活细胞被封装并通过手术插入(在球后麻醉下)眼睛的玻璃体中。对于玻璃体放置,该装置可以通过巩膜植入,该装置或系绳的一部分通过巩膜伸出。最优选地,该装置的整个主体被植入玻璃体中,该装置的任何部分都不会突入或穿过巩膜。优选地,该装置系在巩膜(或其它合适的眼结构)上。系绳可以包括缝线孔眼或任何其它合适的锚固装置(参见例如u.s.6,436,427)。该装置可以在玻璃体中保留达到所需预防或治疗所需的时间。这种治疗例如包括促进神经元或光感受器存活或修复,或抑制和/或逆转视网膜或脉络膜新血管形成,以及抑制葡萄膜、视网膜和视神经炎症。该实施方案对于向视网膜递送gdnf是优选的。
[0159]
通过玻璃体放置,gdnf可以递送至视网膜或rpe。
[0160]
在另一个实施方案中,装载细胞的装置植入眼周,在称为眼球筋膜的空间内或下方。该实施方案比植入玻璃体内的侵入性小,因此通常是优选的。这种施用途径还允许将gdnf递送至rpe或视网膜。该实施方案尤其优选用于治疗脉络膜新生血管和视神经和葡萄膜的炎症。一般而言,从该植入位点的递送将允许gdnf循环至脉络膜脉管系统、视网膜脉管系统和视神经。
[0161]
根据该实施方案,我们优选将gdnf经眼周递送(植入眼球筋膜下)至脉络膜脉管系统,以治疗黄斑退化(脉络膜新生血管形成)。
[0162]
使用本发明的装置和方法将gdnf直接递送至脉络膜脉管系统(眼周)或玻璃体(眼内),可以允许治疗不明确或隐匿的脉络膜新血管形成。它还提供了通过辅助或维持治疗来减少或防止复发性脉络膜新生血管形成的方法。
[0163]
可以通过本领域已知的任何合适的方法改变剂量。这包括改变(1)每个装置的细胞数量,(2)每只眼睛的装置数量,或(3)每个细胞的ntn产生水平。我们优选每个装置使用103至108个细胞,更优选每个装置使用5*104至5*106个细胞。
[0164]
viii.宿主细胞
[0165]
一方面,本发明涉及用根据本发明的载体转导的分离的宿主细胞。这些细胞优选是哺乳动物宿主细胞,因为它们能够正确分泌和加工编码的gdnf。
[0166]
优选的物种包括啮齿动物(小鼠、大鼠)、兔、狗、猫、猪、猴、人类。
[0167]
适于用本发明的载体进行转导的原代培养物和细胞系的良好候选实例包括cho、hek293、cos、pc12、hib5、rn33b、神经元细胞、胎儿细胞、arpe-19、mdx12、c2c12、hela、hepg2、纹状体细胞、神经元、星形胶质细胞、中间神经元。
[0168]
本发明还涉及适于通过裸细胞或封装细胞进行生物递送gdnf的细胞,所述细胞经遗传修饰以过表达gdnf,且可移植至患者体内以局部递送生物活性gdnf多肽。这种细胞可
以广义地称为治疗细胞。
[0169]
在本发明的优选实施方案中,治疗细胞系没有通过插入异源永生化基因而永生化。由于本发明涉及特别适合于细胞移植的细胞,无论是裸细胞还是优选为封装的细胞,这种永生化细胞系是不太优选的,因为存在它们在人体内以不受控制的方式开始增殖并可能形成肿瘤的固有风险。
[0170]
优选地,治疗细胞系是接触抑制细胞系。接触抑制细胞系是指在培养皿中培养时生长至汇合,然后基本上停止分裂的细胞系。这并不排除有限数量的细胞逸出单层的可能性。接触抑制细胞也可以在3d中生长,例如在胶囊内。此外,在胶囊内,细胞生长至汇合,然后增殖速度会显著降低或完全停止分裂。特别优选的细胞类型包括上皮细胞,其本质上是接触抑制的,并且在培养中形成稳定的单层。
[0171]
甚至更优选的是视网膜色素上皮细胞(rpe细胞)。rpe细胞的来源是来自哺乳动物视网膜的原代细胞分离。用于收获rpe细胞的方案是明确的(li and turner,(1988),exp eye res,47:911-7;lopez et al.,(1989),invest ophthalmol vis sci,30:586-8)并被认为是常规方法。在大多数已发表的rpe细胞共移植的报道中,细胞衍生自大鼠(li and turner,(1988);lopez et al.,(1989))。根据本发明,rpe细胞衍生自人类。除了分离的原代rpe细胞,培养的人rpe细胞系也可以用于本发明的实践。
[0172]
在另一个实施方案中,治疗细胞系选自:人成纤维细胞系、人星形胶质细胞系、人中脑细胞系和人内皮细胞系(优选用tert、sv40t或vmyc永生化)。
[0173]
用于生产永生化人体星形胶质细胞系的方法先前已有描述(price et al.,(1999),in vitro cell dev biol anim,35(5):279-88)。该方案可用于产生星形胶质细胞系。
[0174]
优选对该方案进行以下三种修饰,以产生额外的人星形胶质细胞系。
[0175]
·
可以使用从5-12周大的胎儿解剖的人胎儿脑组织代替12-16周大的组织。
[0176]
·
可以使用永生化基因v-myc或tert(端粒酶)代替sv40 t抗原。
[0177]
·
通过磷酸钙沉淀技术,可以使用逆转录病毒基因转移代替质粒转染。
[0178]
ix.用于gdnf生产细胞的支撑基质
[0179]
本发明还包括在植入哺乳动物神经系统或眼睛之前,在支撑基质上体外培养gdnf生产细胞。植入前细胞与微载体的预粘附旨在增强移植细胞的长期存活力,并提供长期功能益处。
[0180]
为了增加移植细胞(即,移植的gdnf分泌细胞)的长期存活力,可以在移植前将待移植的细胞体外附着于支撑基质。可以构成支撑基质的材料包括体外孵育后细胞粘附其上的那些材料,细胞可在其上生长,并且该材料可植入哺乳动物体内而不产生会破坏植入细胞或干扰其生物或治疗活性的毒性反应或炎症反应。这种材料可以是合成的或天然的化学物质或具有生物来源的物质。
[0181]
基质材料包括但不限于玻璃和其它硅氧化物、聚苯乙烯、聚丙烯、聚乙烯、聚偏二氟乙烯、聚氨酯、聚藻酸盐、聚砜、聚乙烯醇、丙烯腈聚合物、聚丙烯酰胺、聚碳酸酯、聚戊烯、尼龙、淀粉酶、天然明胶和改性明胶以及天然胶原和编码胶原、天然多糖和改性多糖,包括葡聚糖和纤维素(例如硝化纤维素)、琼脂和磁铁矿。可以使用可再吸收或不可再吸收的材料。细胞外基质材料也是本领域众所周知的。细胞外基质材料可以通过商业途径获得,或者
通过培养分泌这种基质的细胞、去除分泌细胞并使待移植的细胞与基质相互作用和粘附来制备。待植入细胞在其上生长或与细胞混合的基质材料可以是rpe细胞的固有产物。因此,例如,基质材料可以是细胞外基质或基底膜材料,其由待植入的rpe细胞产生和分泌。
[0182]
为了改善细胞粘附、存活和功能,固体基质可以任选地在其外表面上涂覆本领域已知的因子,以促进细胞粘附、生长或存活。这些因子包括细胞粘附分子、细胞外基质,例如纤连蛋白、层粘连蛋白、胶原蛋白、弹性蛋白、糖胺聚糖或蛋白聚糖或生长因子。
[0183]
或者,如果植入细胞所附着的固体基质由多孔材料构成,则可将一种或多种生长或存活促进因子掺入基质材料中,从而在植入体内后,这些因子将从基质材料中缓慢释放。
[0184]
当附着于根据本发明的支撑物时,用于移植的细胞通常在支撑物的“外表面”上。支撑物可以是实心或多孔的。然而,即使在多孔支撑物中,细胞也与外部环境直接接触,没有中间膜或其它屏障。因此,根据本发明,细胞被认为是在支撑物的“外表面”上,即使它们粘附的表面可以是多孔支撑材料的内部折叠或卷曲的形式,而不在颗粒或微珠本身的外部。
[0185]
支撑物的构型优选为球形,如珠状,但也可为圆柱形、椭圆形、扁平片状或条状、针状或针形等。支撑基质的优选形式是玻璃珠。另一种优选的微珠是聚苯乙烯微珠。
[0186]
微珠直径可以在约10μm至1mm的范围内,优选约90μm至约150μm。关于各种微载体珠的描述,参见例如fisher biotech source 87-88,fisher scientific co.,(1987),pp.72-75;sigma cell culture catalog,sigma chemical co.,st,louis,(1991),pp.162-163;ventrex product catalog,ventrex laboratories,(1989);这些参考文献通过引用并入本文。微珠尺寸的上限可由微珠刺激的不希望的宿主反应来决定,这可能干扰移植细胞的功能或对周围组织造成损伤。微珠尺寸的上限也可以由施用方法决定。本领域技术人员很容易确定这些限制。
[0187]
x.gdnf的体外生产
[0188]
在另一方面,本发明涉及能够以超过20μg gdnf/105细胞/24hr的量分泌gdnf或其功能等同物超过6个月的哺乳动物细胞。如图2所示,最佳质粒转染的arpe-19细胞生产超过20μg gdnf/105细胞/24hr。通过包含增强子元件例如wpre,可以进一步提高表达(u.s.6,136,597)。与现有技术的bhk细胞相比(hoane et al.,(2000),exp neurol.162:189-93),这些量非常高。
[0189]
这种高产细胞可以选自arpe-19细胞、cho细胞、bhk细胞、r1.1细胞、cos细胞、杀伤细胞、辅助t细胞、细胞毒性t淋巴细胞和巨噬细胞。hek293细胞和hib5细胞也是合适的生产细胞。
[0190]
因此,通过培养这些细胞并从培养基中回收gdnf,可大量生产gdnf或其截短或突变形式或生物活性序列变体。哺乳动物生产的gdnf不需要重新折叠就具有生物活性。另一个优点是gdnf是作为成熟肽分泌的,不包括前肽。(参见图3)
[0191]
这些gdnf生产细胞同样可用于治疗目的,并作为裸细胞(支撑的或未支撑的)或封装细胞植入,用于局部递送生物活性gdnf。
[0192]
实施例
[0193]
1.目的
[0194]
本研究的目的是开发胶质细胞源性神经营养因子(gdnf)分泌增加的新细胞系,用
于植入治疗帕金森病的封装细胞(ec)生物递送装置。
[0195]
2.概述
[0196]
使用新的表达技术来开发具有高水平gdnf分泌的人arpe-19细胞衍生克隆。通过gdnf分泌和存活特性的体外和体内试验选择克隆。在体外以及具有gdnf生产克隆的装置周围的组织中证实了gdnf的正确加工。
[0197]
根据体外和体内分析的结果,选择两个克隆,ppg-120和ppg-125,用于在帕金森病的大鼠模型,6-羟基-多巴胺(6-ohda)病变模型中测试神经保护作用,与隆德大学(lund,瑞典)的anders小组合作。
[0198]
这两个克隆在大鼠模型中显示出显著且相当的神经保护作用。由于克隆ppg-125在植入前、外植后和组织中释放最高水平的gdnf,因此将其选择作为用于进一步开发的初步临床细胞候选物。
[0199]
3.gdnf表达细胞克隆的建立
[0200]
采用了两种技术来增强接触抑制型视网膜色素上皮细胞系arpe-19(dunn et al.,(1996),exp eye res,62:155-69)的gdnf表达,该细胞系非常适合于封装:
[0201]
1)使用geneart ag(雷根斯堡,德国)开发的算法对gdnf orf进行密码子优化;和
[0202]
2)使用睡美人转座子系统增强靶序列整合(ivics et al.,(1997),cell,91:501-10)。
[0203]
3.1载体开发
[0204]
全长人gdnf(包括前原序列)以及igsp-gdnf嵌合型(前原区域被编码小鼠ig重链基因v-区信号肽的序列取代)由geneart ag(雷根斯堡,德国)进行密码子优化,并克隆至ca启动子控制下的pcan表达载体中。从pcan构建体中切下由gdnf或igsp-gdnf和新霉素抗性表达盒组成的大片段,并插入到载体pt2bh中,该载体也用作睡美人转座酶的底物载体(ivics et al.,(1997),cell,91:501-10)以产生质粒pt2.can.hog和pt2.can.holgsp.gdnf(见图1)。
[0205]
3.2转染和筛选
[0206]
用质粒pt2.can.hog和pcmv-sb-100x共转染arpe-19,一种自发永生化的人rpe细胞系(dunn et al.,(1996),exp eye res,62:155-69)。后者质粒表达睡美人转座酶的高活性版本。该质粒不含真核选择标记盒,因此有意仅瞬时表达。瞬时表达窗口允许睡美人转座子的活性、转座酶介导的整合,即反向重复的睡美人底物序列和包含在这些重复中的序列。随后对转染的细胞进行g418筛选,分离并扩增单菌落。
[0207]
4.体外表征
[0208]
生产高水平gdnf的克隆的进一步特征在于它们在常规细胞培养物中和在体外封装过程中递送长期gdnf表达的能力。通过gdnf蛋白质印迹分析来自两种不同载体构建体衍生细胞系的gdnf的加工。
[0209]
4.1汇合2d培养物中的gdnf释放
[0210]
选择47个gdnf克隆用于长期2d培养试验,以评估在8周汇合培养期间的形态学和gdnf释放。最佳克隆选择的gdnf elisa结果显示在图2中。最好的克隆在汇合培养物中生产高达25μg/ml/24hr。在细胞每周传代的培养物中,最好的克隆(sbhogdnf-125)生产20μg gdnf/105细胞/24hr超过6个月(结果未显示)。与先前使用非优化gdnf和标准转染技术产生
的gdnf克隆相比,这是大约10倍高的分泌水平。
[0211]
4.2不同载体构建体的gdnf加工
[0212]
人gdnf cdna编码211个氨基酸残基的前原肽,前原肽被加工产生二硫键连接的二聚体糖蛋白。预测成熟的gdnf含有两个134个氨基酸残基的亚单元。gdnf序列包含两个潜在的糖基化位点。非糖基化单体的预测分子量(mw)约为15.1kda。
[0213]
为了评估由两种不同载体构建体衍生克隆分泌的gdnf的加工,每种选择一个克隆用于gdnf蛋白质印迹(wb)分析。克隆arpe-19/pt2.can.ho.igsp.gdnf#2和arpe-19/pt2.can.hog#3的条件培养基在1周后在汇合的2d培养物中取出。将ca-9克隆和r&d system的重组gdnf(cat no.212gd)的样本纳入作为参考。
[0214]
gdnf wb结果显示,由两种克隆生产的gdnf类似于r&d systems的纯化重组gdnf地被加工。克隆分泌的gdnf蛋白主要以加工成熟gdnf的糖基化单体和二聚体存在(图3)。也存在较小部分的非糖基化gdnf(单体和二聚体)。未检测到前gdnf(预测的非糖基化单体的mw:21.6kda)。
[0215]
4.3gdnf从装置中释放
[0216]
4.3.1ec生物递送装置中的细胞封装。
[0217]
为了提高装置的可制造性、填充性、可行性和再现性,已经实施了新的定制聚砜(ps)膜(medivators,普利茅斯,mn)和聚对苯二甲酸乙二醇酯(pet)纱线支架(gloriana,普罗维登斯,ri)。装置由装有纱线支架的7mm长的膜制成。在填充之前,细胞或亲代rpe细胞在生长培养基中培养。将细胞解离并以12,500细胞/μl的密度悬浮在he-sfm(英杰(invitrogen),欧登塞,dk)中。将4μl细胞溶液(总计5
×
104个细胞)注射至每个装置中。将装置保存在he-sfm中,温度为37℃,co2含量为5%。
[0218]
4.3.2在体外从封装的细胞克隆中分泌gdnf。
[0219]
在4周的时间内,在3d培养物(体外保存的装置)中分析了总计16个克隆。每周,从每个装置中取出培养基样本(在孵育4小时后收集)。将样本冷冻在-80℃,并在4周结束后的同一时间通过gdnf elisa分析所有样本。结果如图4所示。几个克隆表现同样出色(2、20、25、48、68和25b)。由于前体分子的细胞内加工的差异,ppgdnf克隆比igsp-gdnf克隆分泌明显更多的gdnf。图4中的ca-9细胞系是先前使用非优化gdnf和标准转染技术产生的。最佳密码子优化的睡美人克隆的产量比ca-9高约25倍,显示了组合使用两种表达优化技术的克隆的优异性能。
[0220]
5.选定克隆的体内试验-2周
[0221]
从3d测试中选出9个克隆。七个克隆衍生自pt2.can.hog载体(ppg#2,20,25,48,68,120和125),两个克隆衍生自pt2.can.ho.igsp.gdnf载体(igsp 2g和39gb)。除igsp-gdnf克隆外,所有克隆在3d培养4周后生产》700jig/ml。将igsp-gdnf克隆(2g和39gb)纳入以测试这种嵌合分子(与体外3d测试相反),是否会在体内表现得比ppgdnf更好。选择标准也是装置中的细胞形态。因此,选择具有不同细胞形状和生长模式的高产克隆用于体内研究。
[0222]
5.1实验程序
[0223]
通过安装在立体定位框架上的植入套管,将填充有九个新克隆和作为参照的ca-9的装置双侧植入大鼠纹状体(n=30只大鼠)(每个克隆有n=6个装置)。对应前囟的植入坐
标为:ap:0.0,ml:
±
3.2,dv:-7.5,tb:-3.3。
[0224]
2周后,将大鼠深度麻醉,断头并取出大脑。将装置外植并在37℃下在he-sfm中孵育。第二天收集培养基样本(孵育4h)用于测定gdnf释放。通过gdnf elisa测定培养基样本中的gdnf浓度。装置在福尔马林中固定,嵌入historesin中并切片。在伊红和苏木精(he)染色的装置切片上评估细胞形态学。
[0225]
在每组三只大鼠的新鲜冷冻脑中在装置周围进行组织打孔。通过gdnf elisa和gdnf蛋白质印迹分析均质化的组织样本。
[0226]
每组中剩余三只大鼠的脑在福尔马林溶液中浸泡固定48小时,然后在0.1m磷酸钠缓冲盐水(pbs)中的30%(w/v)蔗糖溶液中冷冻保护。在冰冻切片机上在冠状水平对脑进行切片,并对切片进行gdnf免疫组织化学处理。
[0227]
5.2植入前和外植后gdnf的释放
[0228]
图5显示了在植入前(填充后2.5周)和在大鼠脑中2周后外植第二天采集的样本中测量的从填充有不同克隆的装置中释放的gdnf。与ca-9相比,四个测试的新克隆,ppg-2、ppg-20、ppg-120和ppg-125,显示出显著增加的gdnf分泌(最多增加7倍)。
[0229]
5.3装置切片的he染色
[0230]
所有生产gdnf的克隆在大鼠脑中2周后在装置中显示良好的细胞存活。细胞均匀地分布在整个装置的纱线支架中,并且没有太密集地填充。图中显示了克隆ppg-120(图6)和ppg-125(图7)的代表性he染色切片。
[0231]
5.4gdnf组织水平,gdnf免疫组织化学
[0232]
在具有相应gdnf生产克隆的三个装置的植入位点的切片上进行gdnf免疫组织化学。结果显示从装置中显著分泌的gdnf,覆盖了整个纹状体。克隆ppg-2、ppg-20、ppg-120和ppg-125显示出特别高的gdnf组织水平。图8显示了克隆ppg-2和ppg-20的大鼠脑切片。
[0233]
图9显示了克隆ppg-120和igsp-2g的gdnf免疫染色。在未处理大鼠的对照切片中,在纹状体中没有观察到gdnf免疫反应性(数据未显示)。
[0234]
5.5gdnf组织水平,gdnf elisa
[0235]
从相应克隆的三个装置周围取出组织打孔样本,通过gdnf elisa分析均质化的组织样本。图10中的结果显示新克隆的组织水平明显高于ca-9(至少增加6倍),尤其是克隆ppg-2、ppg-20、ppg-120和ppg-125显示了高gdnf组织水平。此外,由于用聚砜膜(medivators,普利茅斯,mn)代替akzo聚醚砜膜,ca-9显示出比以前明显改善的性能,导致组织中gdnf释放增加。总的来说,gdnf组织水平已经从先前在ca-9中观察到的大约20pg/mg组织的范围增加至最佳克隆的超过2000pg/mg组织。
[0236]
5.6组织中gdnf的正确处理
[0237]
通过gdnf wb分析选定的均质化组织样本,以检查大脑中释放的gdnf蛋白的加工。将未处理大鼠纹状体的均质化组织和纯化重组gdnf(r&d systems,明尼阿波利斯,mn)纳入作为参考。观察到糖基化和非糖基化gdnf的单体和二聚体(图11)。没有检测到gdnf前体,表明从装置中分泌的gdnf已正确加工,在体内情况下也是如此。
[0238]
6.在大鼠6-羟基多巴胺(6-ohda)病变模型中的试验
[0239]
为了确定具有新克隆的ec生物递送装置是否释放足够量的gdnf以引起相关的生物学效应,选择两个克隆用于在6-羟基多巴胺(6-ohda)大鼠纹状体病变模型中测试,该模
型模拟了在帕金森病中观察到的多巴胺能(da)细胞死亡的一些方面。克隆ppg-2、ppg-20、ppg120和ppg-125都是测试的潜在候选物。选择克隆ppg-120和ppg-125,因为它们在体内2周后似乎具有稍好的存活率。
[0240]
6.1实验程序
[0241]
将填充有克隆ppg-120、ppg-125或不含细胞的装置(每种n=10)植入右侧纹状体中,其相对于前囟的坐标如下:ap:0.5,ml:3.0,dv:-7.5,tb:-2.3。装置植入一周后,进行6-ohda病变。在手术前,再次用异氟醚(sigma-aldrich,圣路易斯,mo)麻醉大鼠,并将大鼠置于立体定位框架中。使用安装在立体定位框架上的28号汉密尔顿注射器在两个位点注射10μg 6-ohda/位点,其相对于前囟的坐标如下:(1)ap:1.2;ml:2.5,dv:-5.0,tb,-2.3和(2)ap:0.2;ml:3.8,dv:-5.0,tb,-2.3。在2分钟内以2μl的总体积输注6-ohda。将注射套管留在原位另外两分钟,以使6-ohda从注射位点自由扩散。然后取出套管并缝合皮肤。图12显示了装置的放置和6-ohda注射。
[0242]
6周后,将大鼠深度麻醉,断头并取出大脑。将装置外植并在37℃下在he-sfm中孵育。第二天收集培养基样本(孵育4h)用于测定gdnf释放。通过gdnf elisa测定培养基样本中的gdnf水平。装置在福尔马林中固定,嵌入historesin中并切片。在he染色的装置切片上评估细胞形态学。将脑在福尔马林溶液中浸泡固定48h,然后在0.1m钠pbs中的30%(w/v)蔗糖溶液中冷冻保护。在冰冻切片机上在冠状水平对脑进行切片,并进行gdnf和酪氨酸羟化酶(th)免疫组织化学处理。
[0243]
6.2植入前和外植后gdnf的释放
[0244]
图13显示了在植入前(填充后4周)和在6-ohda病变模型测试(在大鼠脑中7周)后外植第二天采集的样本中测量的从具有克隆ppg-120和ppg-125的装置中释放的gdnf。具有克隆ppg125的装置在植入前(703
±
53ng gdnf/天)和外植后(623
±
119ng gdnf/天)均显示出最高的gdnf释放。
[0245]
6.3he染色,装置切片
[0246]
总体而言,在6-ohda实验结束后外植的装置中细胞显示出良好的存活率。细胞均匀地分布在整个装置的纱线支架中,并且没有太密集地充满装置。克隆ppg-120的he染色切片的代表性实例显示在图14中,克隆ppg-125的he染色切片显示在图15中。
[0247]
6.4gdnf组织水平,gdnf免疫组织化学
[0248]
对所有三个实验组覆盖纹状体的切片进行gdnf免疫组织化学。没有细胞的空白对照装置的植入位点没有gdnf-免疫反应性(数据未显示)。植入填充ppg-120或ppg-125细胞的装置的大鼠显示出从装置中显著分泌gdnf,覆盖了植入位点周围的纹状体。与克隆ppg-120相比,克隆ppg-125在植入位点周围的gdnf免疫反应性总体上更明显。图16显示了从具有克隆ppg-125的装置的gdnf扩散的代表性实例。
[0249]
6.5gdnf克隆的神经保护作用的量化
[0250]
6.5.1th-免疫反应面积的图像分析
[0251]
为了评估6-ohda的毒性作用以及gdnf对da神经元的保护作用,在覆盖所有三个实验组的纹状体以及黑质(sn)的脑切片上,使用针对da神经元标记物酪氨酸羟化酶(th)的抗体进行免疫组织化学。
[0252]
为了评估纹状体6-ohda病变的尺寸,在每只大鼠的四个选定切片上进行图像分析
(图17)。使用bx61显微镜(olympus corporation of the americas,宾夕法尼亚州,pa)拍摄数字化图像,随后使用visiomorph软件(visiopham,哥本哈根,dk)对th-免疫反应面积的尺寸进行分析。同样,在da细胞体投射到纹状体的sn中,选择三个确定的切片用于th-免疫反应面积的分析。gdnf的保护作用应表现为sn中存活的da神经元数量的增加,而在病变后6周的评估时间点,预期不会发生纹状体中损伤的da投射纤维的再生(发芽)作用。根据这一点,在两组的纹状体病变区都没有观察到th-免疫反应纤维的发芽。因此,在本研究中,预期纹状体6-ohda病变的尺寸与治疗无关。
[0253]
图18显示了对照组中单只大鼠的图像分析结果,其中纹状体(a)和sn(b)为空装置。一些动物的纹状体th-免疫反应性没有显著降低,表明6-ohda诱导的病变在这些动物中相对较小。根据这一点,sn中th-免疫反应面积也相对较高。为了有足够的时间窗来检测gdnf的保护作用,动物应具有足够的纹状体6-ohda病变(与对照侧相比,th免疫反应性小于50%)以纳入最终分析。对照组中的四只动物符合该标准(图18中箭头所示)。
[0254]
在植入含有ppg-120细胞的装置的组中,大多数大鼠(n=8)具有纹状体6-ohda病变,相对于对照侧th-免疫反应性小于50%(图19)。15号和19号大鼠的纹状体病变不足,因此从最终评估中排除。
[0255]
在植入含有ppg-125细胞的装置的组中,十只大鼠中有七只具有纹状体6-ohda病变,相对于对照侧th-免疫反应性小于50%(图20)。
[0256]
在具有gdnf分泌细胞的装置的两组中,病变通常更有效,因此植入装置本身的存在不太可能是原因。空装置的保护作用是不可能的,并且如前所述,在任何一个组的纹状体病变区都没有观察到th免疫反应纤维的发芽。相对不稳定的6-ohda的处理和注射中的小偏差可能会导致变化。
[0257]
6.5.2th-免疫反应面积的图像分析结果
[0258]
图21显示了病变sn中存活的th-阳性神经元(对应于th-免疫反应面积)的平均百分比。发现了两种gdnf分泌克隆均具有显著保护作用(单向anova,然后与对照组进行多重比较(dunnett方法),p《0.05)。
[0259]
6.5.3sn中th-阳性细胞的计数
[0260]
除了图像分析外,如sauer et al.(1995),proc natl acad sci usa,92(19):8935-9先前所述,对黑质的三个选定切片进行th-阳性神经元的人工细胞计数。
[0261]
6.5.4sn中th-阳性细胞的计数结果
[0262]
图22显示了sn中人工细胞计数的结果。如在6.5.1节所述,具有小纹状体6-ohda病变(病变侧的th-免疫反应面积》对照侧的50%)的动物被排除在最终评估之外(图22a)。结果证实了具有ppg-120以及ppg-125的装置对da神经元的显著神经保护作用(与空装置的对照组具有显著差异,单向anova,然后是所有成对多重比较程序,tukey检验,p《0.05)。ppg-120和ppg-125的效果没有显著差异。
[0263]
当包括来自所有动物的细胞计数时,在对照组和两个生产gdnf克隆之间仍有显著差异(单向anova,然后tukey检验,p《0.05)(图22b)。
[0264]
人工细胞计数显示了与图像分析相同的现象,但是克隆ppg120(78
±
7%vs.59
±
7%)和ppg125(71
±
5%vs.63
±
9%)的保护效果稍高。在对照组中,两种评估方法之间的差异较小(17
±
6%vs.12
±
4%)。先前已经表明gdnf下调th表达(georgievska et al.,
(2002),exp neurol,177(2):461-74和georgievska et al.,(2004),j neurosci,24(29):6437-45),并且这种作用在当前的研究中也是明显的(图23)。因此,th-免疫反应细胞的人工计数可能比面积图像分析更准确。
[0265]
此外,可以使用抗囊泡单胺转运蛋白(vmat)的抗体进行免疫染色,该转运蛋白也由da神经元表达,且不受gdnf下调。这可能会产生显示克隆效果更好的现象。
[0266]
6.5.5结论
[0267]
两个生产gdnf的克隆,ppg-120和ppg-125,显示出相当的神经保护作用。由于克隆ppg-125在植入前、外植后和组织中释放最高水平的gdnf,因此将其选择为用于进一步开发的初步临床细胞候选物。
[0268]
7.豚鼠耳蜗长期(6个月)gdnf递送
[0269]
进行体内研究以验证植入豚鼠耳蜗后分泌gdnf的装置的功能和安全性。总计使用了十八(18)只豚鼠。每只动物都接受了装有gdnf分泌细胞的装置的单侧植入。对照的非植入耳蜗用作对照。整体体内研究持续时间为六(6)个月。植入前和外植后1、3、4、5和6个月后,从所有装置中定量测定封装细胞的gdnf释放。外植后,对所选动物(时间点3-6个月)的耳蜗进行组织病理学分析。
[0270]
7.1装置制造:将细胞接种于含有生长培养基的t-175烧瓶中,并保持在37℃、90%湿度和5%co2下;培养基为补充有10%胎牛血清的dmem 谷氨酰胺(lx)。常规培养包括每2-3天饲养细胞,并在70-75%汇合时传代。将细胞封装到3mm长的中空纤维膜中,该中空纤维膜由内部制造的聚砜膜制造,聚砜膜内部装配有聚对苯二甲酸乙二醇酯纱线支架。手术植入前,将装置在37℃和5%co2的he-sfm中保存约2周。
[0271]
7.2手术植入:在手术前,使用氯胺酮(40mg/kg)和甲苯噻嗪(5mg/kg)肌肉注射麻醉所有动物。从头部左侧沿着耳朵剪下头发,用必妥碘和酒精对手术位点进行无菌清洗。用无菌毛巾覆盖动物,仅暴露手术位点。外科医生和acf兽医人员监控动物的适当止血和呼吸。
[0272]
在左耳后部附近做一个切口(约1.0cm)以暴露颞骨。将覆盖的盔瓣和筋膜推到一边,使用#11刀片在覆盖耳蜗的颞骨上做一个2mm的孔。使用手术显微镜,使用0.5mm直径的尖端精细的手持钻,在距圆窗约1mm的耳蜗一侧进行小的(1mm)耳蜗造口术。将单个装置(0.4mm直径
×
3.0mm长度)放入耳蜗,仅将近侧尖端留在耳蜗入口处,以便随后取出。将一块凝胶泡沫放在外部乳突切口上,使用vicryl缝线缝合皮肤。
[0273]
7.3组织病理学:在取出装置的每个指定时间点,如上所述麻醉动物,准备手术,并观察之前的植入。取回后,使用过量的戊巴比妥安乐死处死动物,然后断头。在cbset实验室(莱克星顿,ma)进行组织学处理之前,将头部浸泡在10%福尔马林中固定。将每个头部的两个耳蜗进行外植、脱钙、处理并包埋在石蜡中,以产生总计三十(30)个组织块。对块进行阶梯切割,得到每个耳蜗大约十(10)个切片(总计n=300个切片)。将切片固定在载玻片上,并用苏木精和曙红(h&e)染色(赛诺特生物技术有限公司,罗克维尔,md)。
[0274]
由委员会认证的兽医病理学家根据下表1对每个耳蜗的三(3)个载玻片(耳蜗的近端、中间和远端区域各一(1)个)进行评估。评估参数包括炎症、损伤和神经损伤。病理学家阅读时,研究病理学家对治疗矩阵不知情。
[0275]
表1微观评分矩阵
[0276]
评分微观变化评分矩阵0无明显变化1轻微——组织中几乎察觉不到的特征/变化2轻度/中度——组织中容易识别和/或显著的特征/变化3显著/严重——组织中突出到巨大的特征/变化
[0277]
7.4观察:常规观察动物的行为和健康状况。所有动物在手术后迅速恢复,并在恢复后几小时内表现出正常的活动和进食行为。持续的gdnf分泌对行为没有明显的不利影响。
[0278]
所有装置都很容易完整地取出,并且没有组织粘附在膜上。植入之前,装置分泌约32.4ng gdnf/24小时。当在外植后检查时,随着所有装置继续具有高的和可量化的gdnf水平,gdnf的平均每日分泌增加。装置分泌相对稳定,峰值产量在4-5个月之间。单个装置的产量如下表2所示。
[0279]
7.5组织病理学:从三个月至六个月(3-6)的时间点,总计十五(15)只动物用于组织病理学分析。在耳蜗植入的豚鼠模型中,炎症、纤维化和损伤的组织学参数为轻微至中度,在五(5)个月时略微增加,在六(6)个月时略微减少,并局限于紧邻植入体的区域。神经损伤是罕见的,几乎察觉不到,只有在三(3)和四(4)个月时观察到;到后来的时间点,没有观察到神经损伤。坏死不是任何接受处理的耳蜗的特征。
[0280]
表2:植入豚鼠耳蜗的装置的长期gdnf分泌
[0281][0282]
[0283][0284]
7.6结论:1)当植入豚鼠耳蜗时,所有装置持续(从1-6个月)分泌gdnf;2)所有装置都很容易完整地取出,并且没有组织粘附在膜上;和3)组织病理学分析证实,装置植入和长期gdnf分泌仅产生轻微至中度炎症和纤维化。当观察时,这些参数局部位于植入位点,并且通常与在耳蜗中插入医疗设备所观察到的变化一致。
[0285]
8.豚鼠耳蜗植入的组织病理学评价
[0286]
8.1程序:从接受单侧耳蜗装置植入的动物中收集十五(15)个福尔马林固定的豚鼠头部。在植入后的以下时间点收集头部:三(3)个月(n=6)、四(4)个月(n=3)、五(5)个月(n=3)和六(6)个月(n=3)。将每个头部的两个耳蜗进行外植、脱钙、处理并包埋在石蜡中,以产生总计三十(30)个组织块。对这些块进行阶梯切割,得到每个耳蜗大约十(10)个切片(总计n=300个载玻片)。切片被固定在载玻片上并用苏木精和伊红(h&e)染色。由委员会认证的兽医病理学家根据表1对每个耳蜗的三(3)个载玻片(耳蜗的近端、中间和远端区域各一(1)个)进行评估。评估参数包括炎症、损伤和神经损伤。
[0287]
表1微观评分矩阵
[0288]
评分微观变化评分矩阵0无明显变化1轻微——组织中几乎察觉不到的特征/变化2轻度/中度——组织中容易识别和/或显著的特征/变化3显著/严重——组织中突出到巨大的特征/变化
[0289]
8.2数据获取和分析:从组织形态学分析中获得的值和/或观察值输入到microsoft excel电子表格中。有序的组织学数据(得分)报告为组中值和平均值 sd。必要时进行额外的数据分析(例如,用于比较或澄清目的)。使用软件(版本14)生成计算、数据组织和图表。
[0290]
8.3组织形态学:经处理的左耳蜗的连续切片一致显示对植入物存在的反应,表现为轻微至轻度/中度的局部炎症和纤维化,以及预期的周围骨小梁的手术破坏。15个经处理耳蜗中有3个(20%)的切片显示,在3-4个月时,耳蜗神经受到这些变化的轻微影响。未处理右侧耳蜗一致不显著(未图示)。
[0291]
8.3.1相关的组织形态学观察:经处理的左耳蜗显示出与植入物存在相关的轻微
至轻度/中度组织学变化,包括炎症、损伤和宿主组织纤维化修复反应。处理区域显示了围绕植入管的胶原纤维结缔组织区,其被淋巴细胞占优势的慢性、局部炎症细胞浸润所包围,并且周围骨轻微破裂。两个经处理耳蜗(动物3和8;33%的发生率)在三个月的时间点和一个在四个月的时间点(动物11;33%的发生率)表现出轴突损失形式的轻微神经损伤、微弱的髓鞘肿胀或罕见的消化室形成。这种损伤几乎察觉不到,并且存在于这些动物耳蜗的三个评分切片中的一个或两个。随着时间推移,炎症、损伤和纤维化略有增加,在五(5)个月时达到高峰,然后在六(6)个月时略有下降。仅在三(3)和四(4)个月时出现可检测到的神经损伤。坏死在任何时间点都不是特征。表2-4总结了左耳蜗的相关组织形态学观察得分。
[0292]
表2相关组织形态学观察的平均值
±
sd、中值和发生率-左侧
[0293][0294]
表3平均值
±
sd,相关组织形态学观察值的中值-左侧
[0295]
[0296]
表4相关观察的发生率-耳蜗左侧
[0297][0298]
8.3.2观察:含有分泌gdnf的人细胞的耳蜗内装置的手术放置和长期留置与总体生物相容性一致,没有副作用。炎症、纤维化和损伤的组织学证据仅出现在经处理的耳朵中,仅限于植入物周围的区域,并且处于生物相容性植入物长期存在时通常预期的水平。在三(3)个月的时间点,2/6的动物没有反应至反应轻微,4/6的动物反应轻微或中度。在四(4)个月时,2/3的动物没有反应至反应中度,1/3的动物反应轻微至反应中度。在五(5)个月时,2/3的动物反应轻微至反应中度,1/3的动物反应中度;在六(6)个月时,1/3的动物没有反应至反应中度,1/3的动物反应轻微至反应中度,和1/3的动物反应中度。神经损伤是罕见的,几乎察觉不到,只有在三(3)和四(4)个月观察到;到后来的时间点,神经损伤不再是特征。坏死不是任何经处理耳蜗的特征。
[0299]
等同物
[0300]
虽然已经讨论了本发明的具体实施方案,但是上述说明是说明性的而非限制性的。通过阅读本说明书,本发明的许多变化对于本领域技术人员来说将变得显而易见。本发明的全部范围应当通过参考权利要求及其等同物的全部范围、说明书及其变化来确定。
[0301]
除非另有说明,否则说明书和权利要求中使用的所有表示成分量、反应条件等的数字应理解为在所有情况下均由术语“约”修饰。因此,除非有相反的指示,否则在本说明书和所附权利要求中阐述的数值参数是近似值,其可以根据本发明寻求获得的期望性质而变化。
[0302]
上述讨论旨在说明本发明的原理和各种实施方案。在充分理解了上述公开内容后,许多变化、组合和修改对于本领域技术人员来说将变得显而易见。随附权利要求旨在解释为包含所有这些变化和修改。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。