编码与疱疹病毒糖蛋白d融合的乙型肝炎病毒抗原的腺病毒载体及其使用方法
1.对相关申请的交叉引用
2.本技术要求2020年1月9日提交的美国临时申请号62/958,809、2020年1月9日提交的美国临时申请号62/958,827、2020年1月29日提交的美国临时申请号62/967,242、2020年1月29日提交的美国临时申请号62/967,104、2020年8月12日提交的美国临时申请号63/064,506、2020年8月12日提交的美国临时申请号63/064,571、2020年11月11日提交的美国临时申请号63/112,202和2020年11月11日提交的美国临时申请号63/112,219的优先权,其中每一个申请的公开内容均通过引用整体并入本文。
3.序列表
4.本技术含有序列表,其以ascii格式电子提交并通过引用整体并入本文。ascii副本创建于2021年1月7日,名为111876_000035_sl.txt,大小为151,446个字节。
技术领域
5.本文公开了乙型肝炎病毒(hbv)core蛋白、hbv聚合酶n末端结构域和hbv聚合酶c-末端结构域的非天然变体,以及其免疫原性片段和包含它们的融合蛋白。
背景技术:
6.世界卫生组织估计,2015年有2.57亿人患有慢性乙型肝炎感染(定义为乙型肝炎表面抗原阳性),乙型肝炎导致估计有887,000人死亡,大部分是由于肝硬化和肝细胞癌(即原发性肝癌)。假设育龄妇女占世界人口的25.3%(联合国数据),慢性感染的成年人可能包括6500万育龄妇女,她们可能将hbv传染给她们的婴儿的(世卫组织2017年全球肝炎报告,可在apps_who_int/iris/bitstream/handle/10665/255016/9789241565455-eng.pdf;jsessionid=d78616700ed7322d4109ca4541fb94ea?sequence=1获得)。2016年的总发病率为每100,000人1.0例(centers for disease control and prevention.viral hepatitis surveillance—united states,2017.atlanta:us department of health and human services,centers for disease control and prevention;2019,可在www_cdc_gov/hepatitis/statistics/2017surveillance/index.htm获得)。仅在2017年,就向美国疾病控制和预防中心(centers for disease control and prevention,cdc)报告了总计3,407例急性乙型肝炎病例。
7.尽管可以使用预防性hbv疫苗,但由于治疗选择欠佳以及发展中国家大部分地区的持续的新感染率,慢性hbv感染的负担仍然是一个重大的未得到解决的全球医学问题。
8.发明概述
9.本文提供了包含seq id no:6的氨基酸序列或其免疫原性片段的乙型肝炎病毒(hbv)core蛋白。
10.还提供了包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域。
11.还公开了包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域。
12.还提供了融合蛋白,其包含:n末端单纯疱疹病毒(hsv)糖蛋白(gd)序列或其变体;公开的hbv core蛋白、hbv聚合酶n末端结构域、hbv聚合酶c末端结构域或其免疫原性片段;以及c末端hsv gd序列或其变体。
13.本文还提供了融合蛋白,其包含:n末端单纯疱疹病毒(hsv)糖蛋白(gd)序列或其变体;公开的hbv core蛋白、hbv聚合酶n末端结构域、hbv聚合酶c末端结构域和/或其免疫原性片段的组合;以及c末端hsv gd序列或其变体。
14.本文公开了编码公开的蛋白或融合蛋白的核酸分子、包含所述核酸分子的载体和包含公开的载体的疫苗。
15.本文还提供了在受试者中诱导对hbv的免疫应答的方法,该方法包括向受试者提供有效量的任何公开的融合蛋白、核酸分子、载体或疫苗,从而诱导对hbv的免疫应答。
16.附图简述
17.当结合附图阅读时,将进一步理发明解概述以及以下具体实施方式。为了说明公开的蛋白、疫苗和方法,附图中显示了蛋白、疫苗和方法的示例性实施方案;然而,蛋白、疫苗和方法并不限于所公开的具体实施方案。在附图中:
18.图1说明了表位优化的core氨基酸的频率。氨基酸残基显示在x轴上;所有分析的基因组的序列相似性百分比显示在y轴上。
19.图2a、图2b、图2c、图2d、图2e和图2f说明了c57bl/6小鼠在肌肉内(i.m.)注射指定剂量的以下物质后的疫苗插入物特异性t细胞频率:含有遗传上融合到gd中的表位优化的core序列(seq id no:15)的、黑猩猩血清型6(adc6)的复制缺陷型腺病毒载体(adc6-gdcore)(图2a和图2d);含有遗传上融合到gd中的表位优化的聚合酶c末端结构域序列(seq id no:19)的adc6(adc6-gdpolc)(图2b和图2e);和含有遗传上融合到gd中的表位优化的聚合酶n末端结构域序列(seq id no:17)的adc6(adc6-gdpoln)(图2c和图2f)。注射后14天对小鼠取血,并在用代表hbv序列的重叠肽刺激细胞后,通过针对干扰素(ifn)γ的细胞内细胞因子染色(ics)分析对各种hbv插入物的t细胞频率。在没有肽的情况下培养对照细胞。坐标图显示了个体小鼠的结果,中位数由线表示。图2a-2c显示了插入物特异性cd8
t细胞频率;图2d-2f显示插入物特异性cd4
t细胞频率。
20.图3a、图3b和图3c说明了不同小鼠品系(a:c57bl/6小鼠;b:balb/c小鼠;c:hla-a2转基因(tg)小鼠)对代表所示hbv序列的肽池的t细胞频率。用免疫接种后4周收获的脾细胞并通过针对ifn-γ的ics测试脾细胞获得结果。肽以矩阵排列,以便识别2个池就鉴别一种肽。坐标图显示了对不同池的反应;对含所有肽的池的反应显示在右侧。减去没有肽的情况下获得的背景频率。每个图的底部列出了被认为引起应答的池和响应于不同池而鉴别的肽。显示了balb/c小鼠的cd8
t细胞和cd4
t细胞应答;显示了hla-a2 tg小鼠的cd8
t细胞应答,该小鼠携带人类mhc i类分子,但携带小鼠mhc ii类分子。在激活的cd44
细胞上对t细胞进行门控(gate)。每个连续编号的“肽”都由从core、poln或polc序列的第1、6、11等氨基酸开始的15个氨基酸组成。因此,例如,core的肽1对应于seq id no:6(即表位优化的core氨基酸序列)的氨基酸1-15,core的肽2对应于seq id no:6的氨基酸6-20,core的肽3对应于seq id no:6的氨基酸11-25等。类似地,poln的肽1对应于seq id no:8(即表位优化的
poln氨基酸序列)的氨基酸1-15,poln的肽2对应于seq id no:8的氨基酸6-20,poln的肽3对应于seq id no:8的氨基酸11-25等。同样,polc的肽1对应于氨基seq id no:10(即表位优化的polc氨基酸序列)的氨基酸1-15,polc的肽2对应于seq id no:10的氨基酸6-20,polc的肽3对应于seq id no:10的氨基酸11-25等。
21.图4a、图4b和图4c显示了在用不同剂量的所示载体免疫的c57bl/6小鼠中,用adc6-gdcore(a)、adc6-gdpolc(b)和adc6-gdpoln(c)加强后(boost)的ifn-γ反应。左坐标图显示了用adc6载体初免(priming)后2周从血液中测试的反应。8周后,用相同剂量的表达相同插入物的adc7载体对小鼠进行加强。右坐标图显示了加强后2周血液中的反应。
22.图5a、图5b和图5c说明了不同小鼠品系(a:c57bl/6小鼠;b:balb/c小鼠;c:hla-a2 tg小鼠)对代表所示hbv序列的肽池的t细胞频率。用表达3个插入物(即core、polc或poln)中任何一个的adc6载体对小鼠进行初免,并在8周后用表达相同插入物的adc7载体进行加强。用免疫接种后4周收获的脾细胞并通过针对ifn-γ的ics测试脾细胞获得结果。肽以矩阵排列,以便识别2个池就鉴别一种肽。坐标图显示了对不同池的反应;对含有所有肽的池的反应显示在右侧。减去没有肽的情况下获得的背景频率。每个图的底部列出了被认为引起反应的池和响应于不同池而鉴别的肽。显示了balb/c小鼠的cd8
t细胞和cd4
t细胞反应;显示了hla-a2 tg小鼠的cd8
t细胞反应,该小鼠都带人类mhc i类分子但携带小鼠mhc ii类分子。在激活的cd44
细胞上对t细胞进行门控。每个连续编号的“肽”由从core、poln或polc序列的第1、6、11等氨基酸开始的15个氨基酸组成。因此,例如,core的肽1对应于seq id no:6(即表位优化的core氨基酸序列)的氨基酸1-15,core的肽2对应于seq id no:6的氨基酸6-20,core的肽3对应于seq id no:6的氨基酸11-25等。类似地,poln的肽1对应于seq id no:8(即表位优化的poln氨基酸序列)的氨基酸1-15,poln的肽2对应于seq id no:8的氨基酸6-20,poln的肽3对应于seq id no:8的氨基酸11-25等。同样,polc的肽1对应于氨基seq id no:10(即表位优化的polc氨基酸序列)的氨基酸1-15,polc的肽2对应于seq id no:10的氨基酸6-20,polc的肽3对应于seq id no:10的氨基酸11-25等。
23.图6说明了疫苗接种对aav-1.3hbv攻击后的血清中的hbv基因组拷贝数的影响。用1x10
10
、1x10
11
或1.5x10
11
个病毒基因组(virus genome,vg)的腺相关病毒8(aav8)-1.3hbv载体攻击一组3只小鼠,8周后接种adc6-gdpoln。疫苗接种后8周测试病毒滴度,并与疫苗接种前的滴度进行比较。显示了每个处理组相对于基线的病毒变化。
24.图7a、图7b、图7c、图7d和图7e说明了示例性hbv表位转变(shifting)实验。图7a-用adc6-gdpoln疫苗免疫小鼠。4周后,针对对于代表poln序列的肽池的ifn-γ反应,通过细胞内细胞因子染色测试脾细胞。对刺激后的t细胞进行t细胞标志物染色。图7b-使用来自用1x10
10
个vg的aav8-1.3-hbv攻击的小鼠的脾细胞通过相同测定获得的结果。4周后,给小鼠接种疫苗,10周后从脾脏测试t细胞反应。图7c-使用来自用1.5x10
11
个vg的aav8-1.3-hbv攻击的小鼠的脾细胞通过相同测定获得的结果。4周后给小鼠接种疫苗,10周后从脾脏测试t细胞反应。图7a、7b和7c显示了相对于所有cd44
cd8
t细胞的产生ifn-γ的cd44
cd8
t细胞的频率。减去通过在没有肽池的情况下孵育的脾细胞获得的背景反应。图7d
–
肽池。图7e
–
各个肽序列。图7e按照出现的顺序分别公开了seq id no:55-68和189-233。
25.图8a、图8b和图8c显示了来自在上面图7中描述的相同实验的数据。基于对肽池的反应,确定哪些单独的肽(图7中所示的池和肽)是阳性的。坐标图显示了对所有肽的反应。
每个肽都存在于两个池中,因此获得了每个肽的两个频率值;此图中仅显示了较低的数据点。
26.图9a、图9b和图9c说明了在c57bl/6小鼠(每组n=5)上进行的示例性免疫原性实验的结果,小鼠注射了不同剂量的示例性adc6-gdcore、adc6-gdpoln或adc6-gdpolc载体,并在第一次注射后两个月用含有相同插入物(即adc7-gdcore、adc7-gdpoln或adc7-gdpolc载体)的adc7载体进行加强。图9a说明抗原免疫原性,图9b说明了反应的持续时间,而图9c说明了初免-加强反应(prime-boost response)。
27.图10说明在用adc6-gdpoln初免和adc7-gdpoln加强进行疫苗接种后,balb/c、c57b1/6和hla-a2转基因小鼠中poln表位的cd8
t细胞肽识别。将cd8
t细胞肽识别计算为初免或加强后两周识别的阳性肽除以来自poln的8个重叠肽的总数(总共59个肽)的分数。
28.图11a和图11b说明了在注射了所示载体的c57b1/6小鼠的肝脏中,疫苗诱导的hbv特异性cd8
t细胞反应。*p值为0.01-0.05;***p值为0.0001-0.001;通过单因素anova。
29.图12a、12b、图12c、12d、图12e和图12f说明了来自注射了所示载体的c57bl/6小鼠的肝脏样品的苏木精和伊红染色。20倍放大率。箭头表示淋巴细胞浸润区域。
30.图13a和图13b说明了注射了所示载体的c57b1/6小鼠的肝脏中cd8
t细胞激活/耗竭的疫苗诱导标志物。**p值为0.001-0.01;***p值为0.0001-0.001;通过单因素anova。
31.图14a和图14b说明注射了示例性adc6-gdpoln载体的c57bl/6小鼠中的hbv病毒动力学。提供了第4周的中位hbv dnavl/ml-7.3log
10
cps/ml。n=7;一只小鼠因缺少数据而被排除在外。
32.图15a和图15b说明了aav诱导的hbv对c57bl/6小鼠中cd8
t细胞反应的影响,所述c57bl/6小鼠首先注射了10
10
或10
11
个vg的aav-1.3hbv,然后4周后用10
10
vp的示例性adc6-gdpoln载体加强。在图15b中,每一小块代表单独的表位,其大小显示了总表位的比例;仅包括》0.1%的反应。拔出(pullout)代表仅在aav8-1.3hbv感染的小鼠中识别的表位。
33.图16说明了个体c57bl/6小鼠的产生ifn-γ的cd8
t细胞的频率,该小鼠i.v.注射了10
10
个vg的aav8-1.3hbv载体,4周后接种5x109vp的adc6-gdpoln载体,并在2个月后用相同剂量的adc7-gdpoln疫苗加强。对照小鼠只接受疫苗。幼稚小鼠作为额外的对照。
34.图17a和图17b说明:a)个体小鼠肝脏淋巴浸润物中cd8
t细胞的百分比;和b)同一浸润物中poln-四聚体
cd8
t细胞的频率。给c57bl/6小鼠i.v.注射10
10
或10
11
个vg的aav8-1.3hbv载体,4周后接种5x109vp的adc6-gdpoln载体,并在2个月后用相同剂量的adc7-gdpoln疫苗加强。对照小鼠只接受疫苗。幼稚小鼠作为额外的对照。
35.图18a、图18b、图18c、图18d、图18e和图18f说明了浸润性四聚体
cd8
t细胞与幼稚(即四聚体-cd44-cd8
)t细胞相比、用所示标志物的平均荧光强度(mfi)分析的表型。上面带有星号的线表示通过多次t检验的显著差异。(*)p≤0.05-0.01,(**)p≤0.01-0.001,(***)p≤0.001-0.0001,(****)p≤0.0001。
36.图19a、图19b、图19c、图19d、图19e和图19f说明了对所示标志物阳性的tet
或幼稚cd8
t细胞的百分比。上面带有星号的线表示通过多次t检验的显著差异。(*)p≤0.05-0.01,(**)p≤0.01-0.001,(***)p≤0.001-0.0001,(****)p≤0.0001。
37.图20a、图20b、图20c、图20d、图20e和图20f说明了cd8
t细胞对跨越poln序列的各个肽的反应。总池——对所有poln肽的混合物的反应;幼稚——幼稚小鼠对所有poln肽的
混合物的反应。图20a和图20d显示了仅接受adc6-gdpoln疫苗的小鼠的cd8
t细胞反应。图20b和图20e显示了在接种adc6-gdpoln前4周注射了10
10
个vg的aav8-1.3hbv的小鼠的cd8
t细胞反应。图20c和图20f显示了在接种adc6-gdpoln前4周注射了10
11
个vg的aav8-1.3hbv的小鼠的cd8
t细胞反应。图20a、20b和20c可以用于使用图7d所示肽池和利用图7e识别的各个肽序列计算各个表位的免疫应答的广度。
38.图21a和图21b说明了小鼠脾脏或肝脏中的poln特异性cd8
t细胞。图21a左图显示了随后接受或未接受5
×
10
10
vp的adc6-gdpoln疫苗的注射aav8-1.3hbv小鼠的脾脏中的cd8
t细胞反应。图21a中图显示了小鼠肝脏中的cd8
t细胞频率,该小鼠在初免加强方案中接受了不同剂量的aav8-1.3hbv的处理,然后接受疫苗。图21a右图显示来自同一实验的poln特异性cd8
t细胞或幼稚cd8
t细胞中的tox-1表达水平。图21b说明了ifn-γ
cd8
细胞百分比。
39.图22a和图22b说明了a)注射了所示adc6载体的小鼠血液中的cd8
t细胞频率;以及b)四聚体
cd8
t细胞频率。
40.图23说明了注射了所示adc7载体的小鼠血液中cd8
t细胞频率。
41.图24a、图24b、图24c、图24d、图24e和图24f说明了注射了所示adc7载体(“初免后”),然后用相应adc6载体加强(“加强后”)的小鼠血液中对gdhbv2和gdhbv3插入物的cd8
(图24a-图24c)和cd4
(图24d-图24f)t细胞频率。坐标图显示了产生ifn-γ的t细胞的频率、产生tnf-α的t细胞的频率以及产生任一细胞因子的t细胞的频率总和。
42.图25a和图25b说明了c57bl/6小鼠中的hbv dna病毒滴度,该小鼠用1x109个vg的aav8-1.3hbv进行了攻击,并在4周后接种了1x10
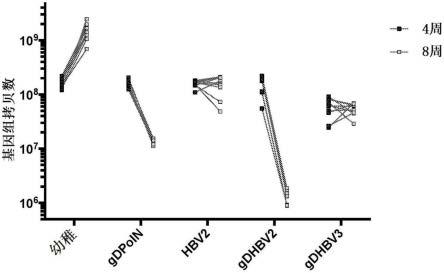
10 vp的adc6-gdpoln(“gdpoln”)、adc6-gdhbv2(“gdhbv2”)、adc6-gdhbv3(“gdhbv3”)或无gd的adc6-hbv2(“hbv2”);aav感染、未接种疫苗的动物(“幼稚”)和非aav感染、未接种疫苗的动物(数据未显示)用作对照。图25a说明了aav攻击后第4周和第8周各组的病毒滴度;图25b说明了aav攻击后第4周和第8周各个小鼠的结果。
43.图26a、图26b、图26c和图26d说明了,使用所示构建体初免后2周和8周以及加强后2周和4周(作为平均值),产生ifn-γ和/或tnf-α的亲代cd8
t细胞(图26a)、cd44
cd8
t细胞(图26b)、cd4
t细胞(图26c)或cd44
cd4
t细胞(图26d)的百分比。
44.图27a、图27b和图27c说明了多个时间点的cd8
t细胞:用所示构建体(poln=gdpoln;hbv2=gdhbv2;hbv3=gdhbv3)初免后4周(图27a);加强后两周(图27b);和加强后4周(图27c)。该图表显示了由ics评估的产生ifn-γ
的cd8
t细胞的总体频率。
45.图28a、图28b和图28c说明了在多个时间点由ics评估的产生细胞因子的cd4
t细胞:用所示构建体(poln=gdpoln;hbv2=gdhbv2;hbv3=gdhbv3)初免后4周(图28a);加强后两周(图28b);和加强后4周(图28c)。基于幼稚小鼠的结果,虚线表示阳性反应的截止值。
46.图29a和图29b说明了在用所示构建体(poln=gdpoln;hbv2=gdhbv2)初免后4周,在cd8
t细胞(图29a)或cd44
cd8
t细胞(图29b)上进行门控的四聚体染色结果。
47.图30a、图30b、图30c、图30d、图30e和图30f说明了四聚体
cd8
t细胞的表型,其显示为与所示抗体连接的染料的平均荧光强度:图30a-与bv605缀合的抗pd1抗体;图30b-与bv650缀合的抗lag3抗体;图30c-与pe-cy7-a缀合的抗tim3抗体;30d-与pe-a缀合的抗ctla4抗体;图30e-与af488缀合的抗eomes抗体;和图30f-与bv786缀合的抗t-bet抗体。
48.图31说明了初免接种5x10
10 vp adc7-gdhbv2,接着两个月后接种5x10
10 vp adc6-gdhbv2后的cd8
t细胞反应。x轴上的数字对应于本文提供的seq id no。
49.图32说明了初免接种5x10
9 vp adc7-gdhbv2,接着两个月后接种5x10
9 vp adc6-gdhbv2后的cd8
t细胞反应。x轴上的数字对应于本文提供的seq id no。
50.图33显示了初免接种5x10
10 vp adc7-gdhbv3,接着两个月后接种5x10
10 vp adc6-gdhbv3后的免疫原性。x轴上的数字对应于本文提供的seq id no。
51.图34说明了对应于本文提供的seq id no(x轴)的adc6-gdhbv2和adc7-gdhbv2疫苗的免疫原性。两种hbv2构建体中的core、polc和poln区域均具有免疫原性。
52.图35说明了对应于本文提供的seq id no(x轴)的adc6-gdhbv3和adc7-gdhbv3疫苗的免疫原性。两种hbv3构建体中的core、polc和poln区域均具有免疫原性。
具体实施方式
53.通过参考以下结合附图进行的详细描述,可以更容易地理解所公开的蛋白、疫苗和方法,这些附图和详细描述构成本公开的一部分。应当理解,所公开的蛋白、疫苗和方法不限于本文描述和/或显示的特定蛋白、疫苗和方法,并且本文所用的术语仅仅是为了通过举例的方式描述具体实施方案的目的,并非旨在限制要求保护的蛋白、疫苗和方法。
54.除非另有明确说明,否则任何关于可能的作用机制或模式或改进原因的描述都意图仅是说明性的,所公开的蛋白、疫苗和方法不受任何此类提出的作用机制或方式或改进理由的正确性或不正确性的限制。
55.在全文中,描述涉及蛋白和使用所述蛋白的方法。在本公开描述或要求保护与蛋白相关的特征或实施方案的情况下,这样的特征或实施方案同样适用于使用所述蛋白的方法。同样,在本公开描述或要求保护与使用蛋白的方法相关的特征或实施方案的情况下,这样的特征或实施方案同样适用于蛋白。
56.在本文列举或建立数值范围的情况下,该范围包括其端点以及该范围内的所有各个整数和小数,并且还包括由这些端点以及内部整数和小数的所有各种可能的组合形成的其中的每个较窄范围,以在所述范围内形成较大值的组的子组,其程度如同明确列举这些较窄范围中的每一个一样。在本文将数值范围描述为大于陈述的值的情况下,该范围仍然是有限的并且在其上限以在本文描述的本发明的上下文中可操作的值为界。在本文将数值范围描述为小于陈述的值的情况下,该范围仍然在其下限以非零值为界。并不意图将本发明的范围限制为在定义范围时列举的特定值。所有范围都是包括性的和可组合的。
57.当通过使用先行词“约”将值表示为近似值时,应当理解,特定值形成另一个实施方案。对特定数值的引用至少包括该特定值,除非上下文另有明确规定。
58.应当理解,本文为了清楚而在单独的实施方案的上下文中描述的所公开的蛋白、疫苗和方法的某些特征,也可以在单个实施方案中组合提供。相反,本文为了简洁而在单个实施方案的上下文中描述的所公开的蛋白、疫苗和方法的各种特征,也可以单独或以任何子组合提供。
59.如本文所用,单数形式“一个/一种(a,an)”和“该/所述(the)”包括复数。
60.在整个说明书和权利要求书中使用了与描述的各方面相关的各种术语。除非另有说明,否则这些术语将被赋予其在本领域中的普通含义。其他具体定义的术语应以与本文
提供的定义一致的方式解释。
61.如本文所用,“其免疫原性片段”是指所公开的hbv core(core)、hbv聚合酶n-末端结构域(poln)或hbv聚合酶c末端结构域(polc)的可以在受试者中产生免疫应答的一部分。
62.如本文所用,“向受试者提供”和类似术语表示将融合蛋白、核酸分子、载体或疫苗递送至受试者的程序,从而使受试者的靶细胞、组织或身体部分与融合蛋白、核酸分子、载体或疫苗接触。“向受试者提供”包括肠胃外和非肠胃外给药途径。
63.术语[批准的参照药品(reference produc)/生物药,即参比制剂(reference listed drug)]的“生物仿制药(biosimilar)”,是指这样的生物产品,尽管在临床非活性成分方面存在微小差异,但其与参照药品高度相似,且基于来自以下的数据,在安全性、纯度和效力方面,生物仿制药和参照药品之间在临床上没有有意义的差异:(a)分析研究,该研究表明生物产品与参照药品高度相似,尽管在临床非活性成分方面存在微小差异;(b)动物研究(包括毒性评估);和/或(c)一项或多项临床研究(包括评估免疫原性和药代动力学或药效动力学),该研究足以证明在一种或多种适当的使用条件下的安全性、纯度和效力,该条件是参照药品获得许可和预期使用的,且是生物仿制药寻求许可的。生物仿制药可以是可以用来替代药房的参照药品的可互换产品,而无需处方医疗保健专业人员的干预。为了满足“可互换性”的另外的标准,预计生物仿制药在任何给定患者中产生与参照药品相同的临床结果,并且,如果向个体施用不止一次生物仿制药,则在生物仿制药和参照药品的使用之间交替或转换的安全性或效力降低方面的风险,不大于在没有这种交替或转换的情况下使用参照药品的风险。生物仿制药对建议的适用疾病状况使用相同的作用机制,只要这些机制对于参照药品是已知的。针对生物仿制药提出的标签中规定、推荐或建议的一种或多种适用疾病状况先前已被批准用于参照药品。生物仿制药的给药途径、剂型和/或强度与参照药品相同,并且在满足经设计以确保生物仿制药继续是安全的、纯的和有效的标准的设施中制造、加工、包装或保存生物仿制药。与参照药品相比,生物仿制药可以包括氨基酸序列的微小修饰,例如预计不会改变生物仿制药性能的n或c末端截短。所公开的蛋白和融合蛋白的生物仿制药包括在本公开的范围内。
[0064]
如本文所用,术语“受试者”旨在表示任何动物,特别是哺乳动物。尽管本文举例说明了在小鼠中诱导免疫应答,但是可以使用所公开的方法治疗任何类型的哺乳动物。因此,该方法适用于人类和非人类动物,尽管优选用于小鼠和人类,并且最优选用于人类。
[0065]
术语“包括/包含(comprising)”旨在包括由术语“基本上由
……
组成”和“由
……
组成”所涵盖的实例;类似地,术语“基本上由
……
组成”旨在包括由术语“由
……
组成”所涵盖的实例。
[0066]
本文使用以下缩写:乙型肝炎病毒(hbv);腺病毒(ad);单纯疱疹病毒(hsv);糖蛋白(gd);和病毒基因组(vg)。
[0067]
本文提供了乙型肝炎病毒(hbv)core蛋白的非天然存在的变体。公开的hbv core蛋白可以包含seq id no:6的氨基酸序列或其免疫原性片段。seq id no:6的示例性免疫原性片段包括下表3中提供的seq id no:20-54。在一些实施方案中,hbv core蛋白的免疫原性片段包含seq id no:180的氨基酸序列。在一些实施方案中,hbv core蛋白的免疫原性片段包含seq id no:183的氨基酸序列。
[0068]
还提供了编码hbv core蛋白或其免疫原性片段的核酸分子。核酸分子可以编码包
含seq id no:6的氨基酸序列的hbv core蛋白。在一些实施方案中,核酸分子包含seq id no:7的核苷酸序列。核酸分子可以编码表3中提供的core片段。在一些实施方案中,核酸分子编码seq id no:180的氨基酸序列。在一些实施方案中,核酸分子编码seq id no:183的氨基酸序列。
[0069]
还提供了包含编码hbv core蛋白或其免疫原性片段的核酸分子的载体。合适的载体包括病毒载体,例如慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体、甲病毒复制子、疱疹病毒载体、痘病毒载体和弹状病毒载体。在一些实施方案中,病毒载体是腺病毒载体。腺病毒载体可以是黑猩猩源腺病毒载体。在一些方面,载体是adc68载体,其描述于farina sf,gao gp,xiang zq,rux jj,burnett rm,alvira mr,marsh j,ertl hc,wilson jm.“replication-defective vector based on a chimpanzee adenovirus.”j virol.2001dec;75(23):11603-13。在一些方面,载体是adc7载体,其描述于reyes-sandoval a,fitzgerald jc,grant r,roy s,xiang zq,li y,gao gp,wilson jm,ertl hc.“human immunodeficiency virus type 1-specific immune responses in primates upon sequential immunization with adenoviral vaccine carriers of human and simian serotypes”j virol.2004jul;78(14):7392-9。在一些方面,载体是adc6载体,其描述于pinto ar,fitzgerald jc,giles-davis w,gao gp,wilson jm,ertl hc.“induction of cd8
t cells to an hiv-1antigen through a prime boost regimen with heterologous e1-deleted adenoviral vaccine carriers”j immunol.2003dec 15;171(12):6774-9。
[0070]
在一些实施方案中,载体包含含seq id no:7的核苷酸序列的核酸分子。在一些实施方案中,载体是包含含seq id no:7核苷酸序列的核酸分子的adc6载体。在一些实施方案中,载体是包含含seq id no:7的核苷酸序列的核酸分子的adc7载体。
[0071]
在一些实施方案中,载体包含编码seq id no:180的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。在一些实施方案中,载体包含编码seq id no:183的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。
[0072]
还公开了包含载体的疫苗,该载体包含编码hbv core蛋白或其免疫原性片段的核酸分子。在一些实施方案中,疫苗包含载体,该载体包含含seq id no:7的核苷酸序列的核酸分子。在一些实施方案中,疫苗包含adc6载体,该adc6载体包含含seq id no:7的核苷酸序列的核酸分子。在一些实施方案中,疫苗包含adc7载体,该adc7载体包含含seq id no:7的核苷酸序列的核酸分子。在一些实施方案中,疫苗包含adc6载体,该adc6载体包含编码seq id no:180的氨基酸序列的核酸分子。在一些实施方案中,疫苗包含adc7载体,该adc7载体包含编码seq id no:180的氨基酸序列的核酸分子。在一些实施方案中,疫苗包含adc6载体,该adc6载体包含编码seq id no:183的氨基酸序列的核酸分子。在一些实施方案中,疫苗包含adc7载体,该adc7载体包含编码seq id no:183的氨基酸序列的核酸分子。
[0073]
疫苗还可以包含药学上可接受的运载体或药学上可接受的赋形剂。如本文所用,“药学上可接受的运载体”或“药学上可接受的赋形剂”包括,当与所公开的融合蛋白、核酸或载体组合时,允许融合蛋白、核酸或载体保留生物活性并且是与受试者的免疫系统无反应的任何物质。实例包括但不限于任何标准药物运载体,例如磷酸盐缓冲盐溶液、水,乳液,
例如油/水乳液,以及各种类型的润湿剂。用于气雾剂或肠胃外给药的优选稀释剂是磷酸盐缓冲盐水或生理盐水(0.9%)。通过众所周知的常规方法配制包含此类运载体的组合物(参见例如remington's pharmaceutical sciences,第18版,a.gennaro编辑,mack publishing co.,easton,pa.,1990;和remington,the science and practice of pharmacy,第20版,mack publishing,2000)。
[0074]
本文还公开了hbv聚合酶n末端结构域(poln)和hbv聚合酶c末端结构域(polc)的非天然存在的变体。所公开的hbv聚合酶n末端结构域可以包含seq id no:8的氨基酸序列或其免疫原性片段。seq id no:8的示例性免疫原性片段包括下表4中提供的seq id no:55-113。在一些实施方案中,hbv poln的免疫原性片段包含seq id no:178的氨基酸序列。在一些实施方案中,hbv poln的免疫原性片段包含seq id no:181的氨基酸序列。所公开的hbv聚合酶c末端结构域可以包含seq id no:10的氨基酸序列或其免疫原性片段。seq id no:10的示例性免疫原性片段包括下表5中提供的seq id no:114-172。在一些实施方案中,hbv polc的免疫原性片段包含seq id no:179的氨基酸序列。在一些实施方案中,hbv polc的免疫原性片段包含seq id no:182的氨基酸序列。
[0075]
还提供了编码hbv聚合酶n末端结构域或其免疫原性片段或hbv聚合酶c末端结构域或其免疫原性片段的核酸分子。核酸分子可以编码包含seq id no:8的氨基酸序列的hbv聚合酶n末端结构域。在一些实施方案中,编码hbv聚合酶n末端结构域的核酸分子包含seq id no:9的核苷酸序列。核酸分子可以编码表4中提供的hbv聚合酶n末端结构域片段。核酸分子可以编码包含seq id no:10的氨基酸序列的hbv聚合酶c末端结构域。在一些实施方案中,编码hbv聚合酶c末端结构域的核酸分子包含seq id no:11的核苷酸序列。核酸分子可以编码表5中提供的hbv聚合酶c末端结构域片段。在一些实施方案中,核酸分子编码seq id no:178的氨基酸序列。在一些实施方案中,核酸分子编码seq id no:181的氨基酸序列。在一些实施方案中,核酸分子编码seq id no:179的氨基酸序列。在一些实施方案中,核酸分子编码seq id no:182的氨基酸序列。
[0076]
还提供了包含编码hbv聚合酶n末端结构域或其免疫原性片段或c末端结构域或其免疫原性片段的核酸分子的载体。合适的载体包括上述那些载体。在一些实施方案中,载体包含含seq id no:9的核苷酸序列的核酸分子。在一些实施方案中,载体包含含seq id no:11的核苷酸序列的核酸分子。在一些方面,载体是腺病毒载体。合适的腺病毒载体包括例如adc6载体或adc7载体。在一些实施方案中,载体是adc6载体,该adc6载体包含含seq id no:9的核苷酸序列的核酸分子。在一些实施方案中,载体是adc7载体,该adc7载体包含包含seq id no:9的核苷酸序列的核酸分子。在一些实施方案中,载体是adc6载体,该adc6载体包含含seq id no:11的核苷酸序列的核酸分子。在一些实施方案中,载体是adc7载体,该adc7载体包含含seq id no:11的核苷酸序列的核酸分子。在一些实施方案中,载体包含编码seq id no:178的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。在一些实施方案中,载体包含编码seq id no:181的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。在一些实施方案中,载体包含编码seq id no:179的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。在一些实施方案中,载体包含编码seq id no:182的氨基酸序列的核酸分子。在一些方面,载体是adc6载体。在一些方面,载体是adc7载体。
id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域;
[0126]
(2)包含seq id no:6的氨基酸序列的hbv core蛋白的一个或多个免疫原性片段和包含seq id no:8的氨基酸序列的hbv聚合酶n末端结构域的一个或多个免疫原性片段。例如,表3中提供的seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)和表4中提供的seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段);
[0127]
(3)包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;
[0128]
(4)包含seq id no:6的氨基酸序列的hbv core蛋白的一个或多个免疫原性片段和包含seq id no:10的氨基酸序列的hbv聚合酶c末端结构域的一个或多个免疫原性片段。例如,表3中提供的seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)和表5中提供的seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段);
[0129]
(5)包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;
[0130]
(6)包含seq id no:8的氨基酸序列的hbv聚合酶n-末端结构域的一个或多个免疫原性片段和包含seq id no:10的氨基酸序列的hbv聚合酶c末端结构域的一个或多个免疫原性片段。例如,表4中提供的seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段)和表5中提供的seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段);
[0131]
(7)包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白、包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、以及包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;或者
[0132]
(8)包含seq id no:6的氨基酸序列的hbv core蛋白的一个或多个免疫原性片段、包含seq id no:8的氨基酸序列的hbv聚合酶n末端结构域的一个或多个免疫原性片段、以及包含seq id no:10的氨基酸序列的hbv聚合酶c末端结构域的一个或多个免疫原性片段。例如,表3中提供的seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)、表4中提供的seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段)和表5中提供的seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段);
[0133]
(9)包含seq id no:178的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、包含seq id no:179的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域、以及包含seq id no:180的氨基酸序列或其免疫原性片段的hbv core蛋白;或者
[0134]
(10)包含seq id no:181的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、包含seq id no:182的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域、以及包含seq id no:183的氨基酸序列或其免疫原性片段的hbv core蛋白;和
[0135]
c末端hsv gd蛋白序列或其变体。
[0136]
在一些实施方案中,n末端hsv gd序列可以至少包含hsv gd的氨基酸1-269。例如,n末端hsv gd序列可以包含seq id no:12的氨基酸序列。在一些实施方案中,n末端hsv gd序列包含seq id no:12的氨基酸残基26-269。
[0137]
在一些实施方案中,c末端hsv gd序列包含hsv gd的跨膜结构域。例如,c末端hsv gd序列可以包含seq id no:13的氨基酸序列。
[0138]
融合蛋白可以包含seq id no:14的氨基酸序列(对应于gdcore)或其免疫原性片段。融合蛋白可以包含seq id no:16的氨基酸序列(对应于gdpoln)或其免疫原性片段。融合蛋白可以包含seq id no:18的氨基酸序列(对应于gdpolc)或其免疫原性片段。在一些实施方案中,seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽。
[0139]
融合蛋白可以包含seq id no:185的氨基酸序列(gdhbv2)。融合蛋白可以包含seq id no:187的氨基酸序列(gdhbv3)。
[0140]
还提供了编码任何公开的融合蛋白的核酸分子。在一些实施方案中,核酸分子包含seq id no:15的核苷酸序列(对应于gdcore)。在一些实施方案中,核酸分子包含seq id no:17的核苷酸序列(对应于gdpoln)。在一些实施方案中,核酸分子包含seq id no:19的核苷酸序列(对应于gdpolc)。
[0141]
核酸分子可以包含seq id no:184的核苷酸序列(gdhbv2)。核酸分子可以包含seq id no:186的核苷酸序列(gdhbv3)。
[0142]
还公开了包含编码融合蛋白的核酸分子的载体。合适的载体包括上述那些,包括例如腺病毒载体。在一些实施方案中,腺病毒载体是adc6载体。在一些实施方案中,腺病毒载体是adc7载体。载体可以包含seq id no:184的核苷酸序列(gdhbv2)。在一些方面,载体是包含seq id no:184的核苷酸序列(gdhbv2)的adc6载体。在一些方面,载体是包含seq id no:184的核苷酸序列(gdhbv2)的adc7载体。载体可以包含seq id no:186的核苷酸序列(gdhbv3)。在一些方面,载体是包含seq id no:186的核苷酸序列(gdhbv3)的adc6载体。在一些方面,载体是包含seq id no:186的核苷酸序列(gdhbv3)的adc7载体。
[0143]
还提供了包含任何公开的载体的疫苗。疫苗还可以包含如上公开的药学上可接受的运载体或药学上可接受的赋形剂。疫苗可包含含seq id no:184的核苷酸序列(gdhbv2)的载体。在一些方面,疫苗包含含seq id no:184的核苷酸序列(gdhbv2)的adc6载体。在一些方面,疫苗包含含seq id no:184的核苷酸序列(gdhbv2)的adc7载体。疫苗可以包含含seq id no:186的核苷酸序列(gdhbv3)的载体。在一些方面,疫苗包含含seq id no:186的核苷酸序列(gdhbv3)的adc6载体。在一些方面,疫苗包含含seq id no:186的核苷酸序列(gdhbv3)的adc7载体。
[0144]
本文提供了在受试者中诱导对hbv的免疫应答的方法,该方法包括向受试者提供有效量的任何公开的融合蛋白、任何公开的核酸分子、任何公开的载体或任何公开的疫苗,从而诱导对hbv的免疫应答。在一些实施方案中,该方法包括向受试者提供有效量的任何公开的融合蛋白,从而诱导对hbv的免疫应答。在一些实施方案中,该方法包括向受试者提供有效量的任何公开的核酸分子,从而诱导对hbv的免疫应答。在一些实施方案中,该方法包括向受试者提供有效量的任何公开的载体,从而诱导对hbv的免疫应答。在一些实施方案中,该方法包括向受试者提供有效量的任何公开的疫苗,从而诱导对hbv的免疫应答。
[0145]
该方法可以包括向受试者提供有效量的包含adc6载体的疫苗,其中adc6载体包含含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,该方法还包括在提供包含adc6载体的疫苗之后,向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段的融合蛋白。这样的初免-加强方法可以包括:
[0146]-向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:14的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:14的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:14的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;
[0147]-向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:16的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:16的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:16的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;或者
[0148]-向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:18的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:18的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:18的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽。
[0149]
该方法可以包括向受试者提供有效量的包含adc7载体的疫苗,其中adc7载体包含含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,该方法还包括在提供包含adc7载体的疫苗之后,向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段的融合蛋白。这类初免-加强方法可以包括:
[0150]-向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:14的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:14的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:14的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;
[0151]-向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:16的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:16的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:16的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;或者
[0152]-向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:18的氨基酸序列或其免疫原性片段的融合蛋白,随后向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:18的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:18的氨基酸序列或其免疫原性片段不含有n-末端25个氨基酸的信号肽。
[0153]
该方法可以包括向受试者提供有效量的包含adc6载体的疫苗,其中该adc6载体包含含seq id no:185或187的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,该方法还包括在提供包含adc6载体的疫苗之后,向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:185或187的氨基酸序列或其免疫原性片段的融合蛋白。这类初免-加强方法可以包括:
[0154]-向受试者提供包含包含adc6载体的疫苗,该adc6载体包含含seq id no:185的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:185的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:185的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;或者
[0155]-向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:187的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:187的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:187的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽。
[0156]
该方法可以包括向受试者提供有效量的包含adc7载体的疫苗,其中adc7载体包含含seq id no:185或187的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,该方法还包括在提供包含adc7载体的疫苗之后,向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:185或187的氨基酸序列或其免疫原性片段的融合蛋白。这类初免-加强方法可以包括:
[0157]-向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:185的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:185的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:185的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽;或者
[0158]-向受试者提供包含adc7载体的疫苗,该adc7载体包含含seq id no:187的氨基酸序列或其免疫原性片段的融合蛋白,并且随后向受试者提供包含adc6载体的疫苗,该adc6载体包含含seq id no:187的氨基酸序列或其免疫原性片段的融合蛋白。在一些实施方案中,seq id no:187的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽。
[0159]
由所公开的方法诱导的免疫应答包括但不限于t细胞反应、b细胞反应或两者(即细胞和/或体液免疫应答)。免疫应答可以是初级免疫应答或次级免疫应答。与单独的hbv core或聚合酶抗原(即没有gd)相比,所公开的方法可以更大程度地诱导受试者针对hbv的免疫应答。
[0160]
所公开的方法可用于治疗性治疗和预防或防预措施,并可降低症状的严重性和/或频率,消除症状和/或症状的根本原因,降低症状的频率或可能性和/或其根本原因,并改善或补救由hbv直接或间接造成的损害。治疗还包括与未接受治疗的受试者的预期生存期相比延长生存期。要治疗的受试者包括患有hbv的受试者以及易患有hbv的受试者或要预防hbv的受试者。
[0161]
诱导对hbv的免疫应答所需的所公开的融合蛋白、核酸分子、载体或疫苗的量(例如“有效量”)可以根据诸如受试者的疾病状态、年龄、性别和体重以及融合蛋白、核酸分子、载体或疫苗在受试者中引起期望的反应的能力等因素而变化。有效量的示例性指标包括,例如,改善受试者的健康和减少、消除或预防hbv症状。
[0162]
还提供了任何所公开的融合蛋白、核酸分子、载体或疫苗在制备用于在受试者中诱导对hbv的免疫应答的药物中的用途。
[0163]
还提供了用于在受试者中诱导对hbv的免疫应答的所公开的融合蛋白、核酸分子、载体或疫苗。
[0164]
实施例
[0165]
为了进一步描述本文公开的一些实施方案,提供了以下实施例。实施例旨在说明而非限制所公开的实施方案。
[0166]
表位优化的core序列的生成
[0167]
基于系统发育聚类,乙型肝炎病毒(hbv)可归类为几种基因型。为了帮助开发用于慢性感染患者的多基因型hbv疫苗的抗原插入物,对基因型a、b、c和d的编码hbv core和hbv聚合酶的基因进行了初步生物信息学评估。
[0168]
从乙型肝炎病毒数据库(hbvdb)(发布版本45.0;最后更新于2018年8月2日)下载了四个主要hbv进化枝的core氨基酸序列,作为比对的clustalw序列。氨基酸序列代表了欧洲用户输入的数千个hbv基因组,如下表所总结。
[0169]
表1.分析的独特core基因组数量
[0170][0171]
首先使用洛斯阿拉莫斯国家实验室(los alamos national laboratory)(www.hiv.lanl.gov/content/sequence/entropy/entropy)主管的shannon entropy工具为每个基因型鉴别“共有”core序列,该工具计算每个氨基酸位置的变异和频率。对每种基因型重复这些计算,生成四个“共有”core序列,每个分析的基因型一个(seq id no:1-4):
[0172]
基因型a共有序列(seq id no:1)
[0173]
mdidpykefgatvellsflpsdffpsvrdlldtasalyrealespehcsphhtalrqailcwgelmtlatwvgnnledpasrdlvvnyvntnmglkirqllwfhiscltfgretvleylvsfgvwirtppayrppnapilstlpettvvrrrdrgrsprrrtpsprrrrsqsprrrrsqsresqc-[0174]
基因型b共有序列(seq id no:2)
[0175][0176]
基因型c共有序列(seq id no:3)
[0177][0178]
基因型d共有序列(seq id no:4)
[0179][0180]
(带有下划线的粗体残基代表频率小于90%的氨基酸)。
[0181]
组合上文的“共有”core序列,以生成表位优化的core序列。在来自每个基因型(a、b、c和d)的core蛋白的每个氨基酸残基处鉴别了保守氨基酸,并确定了给定的基因型基因组样品内的频率和变异。为了选择变异位点的氨基酸,使用表位预测算法在多个hla类型中测试每个变异,并选择最具免疫原性的序列。具体来说:
[0182]
(1)保持在四个基因型中的相同的每个残基。还计算了基因组加权频率以了解变
异性,在适用的情况下添加间隔子以比对序列的差异。
[0183]
(2)鉴定了在四种基因型中不相同的残基,并记录了氨基酸差异(参见表2)。下文提供了初始core序列(seq id no:5),其中在四个基因型中不相同的残基标记为x1–
x
11
,频率低于90%的残基以带有下划线的粗字体显示:
[0184][0185]
表2.在四种基因型中不同的残基
[0186][0187]
(3)为了确定这些位置的最终氨基酸,使用表位预测算法来选择合适的氨基酸。对于在基因型之间表现出变异性的氨基酸,选择存在于3个基因型中的氨基酸或使用mhc i类表位预测软件来选择最具免疫原性的氨基酸。这种方法使在最大数量的hla类型中的潜在免疫原性最大化。所有基因型中和基因型内的表位优化core序列如下文所示(seq id no:6):
[0188]
didpykefgatvellsflpsdffpsirdlldtasalyrealespehcsphhtalrqailcwgelmtlatwvgsnledpasrelvvsyvnvnmglkirqllwfhiscltfgretvieylvsfgvwirtppayrppnapilstlpettvvrrrdrgrsprrrtpsprrrrsqsprrrrsqsresqc
[0189]
计算了所有基因组中每个位点的平均变异,其由分析的进化枝特异性基因组的数量加权,并显示了更高和更大保守的区域和残基。图1。
[0190]
表位优化的聚合酶序列的生成
[0191]
如上文针对core序列所讨论的,从四个主要的hbv进化枝生成表位优化的聚合酶序列。因为聚合酶很长,所以生成了两个片段——n末端片段(从中去除了基因型之间的高度可变区段)和c末端片段。两个片段的长度约为300个氨基酸。表位优化的聚合酶氨基酸序列如下文和表9所示:
[0192]
表位优化的hbv聚合酶n末端氨基酸序列(seq id no:8):
[0193]
plsyqhfrklllldeeagpleeelprladeglnrrvaedlnlgnlnvsipwthkvgnftglysstvpvfnpewqtpsfpkihlqedivdrckqfvgpltvnekrrlklimparfypnvtkylpldkgikpyypehavnhyfqtrhylhtlwkagilykrettrsasfcgspysweqelqhgscwwlqfrnskpcseyclthlvnlledwgpcdehgehhiriprtparvtggvflvdknphntaesrlvvdfsqfsrgitrvswpkfavpnlqsltnllssnlswlsldvsaafyhiplhpaamp
[0194]
表位优化的hbv聚合酶c末端氨基酸序列(seq id no:10):
[0195]
hllvgssglsryvarlssnsriinhqhgtmqnlhdscsrnlyvsllllyktfgrklhlyshpiilktkrwgyslnfmgyvigswgslpqdhiiqkikecfrklpvnrpidwkvcqrivgllgfaapftqcgypalmplyaciqskqaftfsptykaflskqylnlypvarqrpglcqvfadatptgwglamghqrmrgtfvaplpihtaellaacfarsrsgakilgtdnsvvlsrkytsfpwllgcaanwilrgtsfvyvpsalnpaddpsrgrlglsrpllrlpfrpttgrtslyavspsv
[0196]
表达表位优化的core和聚合酶序列的adc6和adc7载体的生成
[0197]
将编码表位优化的core或聚合酶氨基酸序列的基因克隆到含有受cmv启动子控制的单纯疱疹病毒(hsv)糖蛋白d(gd)序列的转移载体中。然后将基因克隆到e1缺失、e3 orf 3、4、5、6和7缺失的复制缺陷型腺病毒载体中(如pct/us2017/043315中所述),以生成以下载体:
[0198]
·
含有融合于gd的表位优化的core序列的adc6(adc6-gdcore);
[0199]
·
含有融合于gd的表位优化的聚合酶n末端序列的adc6(adc6-gdpoln);
[0200]
·
含有融合于gd的表位优化的聚合酶c末端序列的adc6(adc6-gdpolc);
[0201]
·
含有融合于gd的表位优化的core序列的adc7(adc7-gdcore);
[0202]
·
含有融合于gd的表位优化的聚合酶n末端序列的adc7(adc7-gdpoln);以及
[0203]
·
含有融合于gd的表位优化的聚合酶c末端序列的adc7(adc7-gdpolc)。
[0204]
通过限制酶消化鉴别正确的克隆并对克隆位点进行测序。在hek 293细胞中拯救和扩增载体,通过氯化铯(cscl)梯度离心纯化,并通过分光光度法测定载体浓度(vp)。载体在hek 293细胞中在一系列稀释物中扩增后,针对感染单位对其进行滴定,然后进行rna的分离和逆转录以及六邻体(hexon)特异性巢式pcr反应。通过限制酶消化然后对纯化的病毒dna进行凝胶电泳来确定载体的遗传完整性。使用gd特异性抗体通过蛋白质印迹测定蛋白质表达。通过将载体在hek 293细胞中连续传代(12-15)然后对纯化的病毒dna进行限制酶消化和凝胶电泳,确定遗传稳定性。
[0205]
在小鼠中测试疫苗的免疫原性
[0206]
给c57bl/6、balb/c和hla-a2 tg小鼠(每组n=5)注射不同浓度的每种上述载体。幼稚小鼠作为对照。在注射后的不同时间对小鼠取血,并通过针对ifn-γ的细胞内细胞因子染色(ics)测定插入物特异性cd8
和cd4
t细胞的频率。第一次注射后两个月,用表达相同插入物的异源载体(adc7)加强adc6免疫小鼠。再次测试hbv特异性t细胞的频率。初免后的结果显示于图2a-2f以及图3a(c57bl/6小鼠)、图3b(balb/c小鼠)和图3c(hla-a2小鼠)中。加强后的结果显示于图4a-4c和5a-5b中。
[0207]
c57bl/6小鼠对表位优化的聚合酶n末端序列表现出非常稳健的cd8
t细胞反应,对表位优化的聚合酶c末端序列和表位优化的core序列表现出较低的反应,而针对表位优
化的core序列和表位优化的聚合酶c末端序列,cd4
反应较好(图2a-图2f)。c57bl/6小鼠中的表位作图表明对poln的反应比对polc的反应更高和更广(图3a)。在poln内,cd8
t细胞识别了总共14种肽,而在polc内,仅识别了两种相邻的肽,它们很可能反映了一个表位。cd4
t细胞对poln或polc没有反应。这种模式主要反映在balb/c小鼠中,其中cd8
t细胞对poln的反应最高,识别了12种肽,其次是polc,识别了4种肽(图3b)。对core的反应较低,但出人意料地广泛,识别了10种肽(图3b)。balb/c cd4
t细胞对core的反应最好,识别了15种肽,而对polc(4种肽)或poln(2种肽)的识别较低。还在hla-a2 tg小鼠中测试了cd8
t细胞反应,其中poln再次触发了涉及12种肽的最高反应(图3c)。对polc的反应较低但更广(16种肽),而仅检测到core的一种肽(图3c)。在初免实验中测试的肽的序列提供于表3(core肽)、表4(poln肽)和表5(polc肽)中。表6-8提供了来自初免实验的肽池的肽组成。总体而言,这些数据表明插入物引发了可检测的t细胞反应,这些反应在大多数情况下针对每个序列内的多个表位。
[0208]
表3.表位优化的core肽
[0209]
[0210][0211]
b/c=balb/c;bl/6=c57bl/6;hla=hla-a2
[0212]
表4.表位优化的poln肽
[0213]
[0214][0215]
b/c=balb/c;bl/6=c57bl/6;hla=hla-a2
[0216]
表5.表位优化的polc肽
[0217]
[0218][0219]
b/c=balb/c;bl/6=c57bl/6;hla=hla-a2
[0220]
表6.表位优化的core池
[0221]
core矩阵abcdefg123456h789101112i131415161718j192021222324k252627282930l3132333435 [0222]
表7.表位优化的poln池
[0223]
pol n矩阵abcdefghi12345678j910111213141516k1718192021222324l2526272829303132m3334353637383940n4142434445464748o4950515253545556p575859
ꢀꢀꢀꢀꢀ
[0224]
表8.表位优化的polc池
[0225]
[0226][0227]
在c57bl/6、balb/c和hla-a2 tg小鼠中测试的加强后,反应的增加主要见于插入物以及初免后诱导次优反应的载体剂量,即,对于以1x109vp的载体剂量测试的core(图4a-4c)。尽管当以高剂量注射载体时,更强的(booster)免疫未能增加对poln或polc的反应,但加强仍然扩宽了t细胞反应(图5a-5c)。
[0228]
免疫原性总结
[0229]
上述结果说明:
[0230]
·
疫苗是免疫原性的:对cd8
t细胞而言,poln》polc》core;对cd4
t细胞反应而言,core》polc》poln;
[0231]
·
异源疫苗运载体可以加强免疫应答;
[0232]
·
免疫应答广泛;和
[0233]
·
加强后t细胞反应的广度增加。
[0234]
疫苗接种对hbv滴度低剂量aav-1.3hbv攻击的影响
[0235]
用1x10
10
、1x10
11
或1.5x10
11
个vg的aav-1.3hbv攻击一组3只小鼠,并在8周后对其接种adc6-gdpoln。疫苗接种后8周测试病毒滴度,并与疫苗接种前的滴度进行比较。图6显示了每个处理组相对于基线的病毒变化。
[0236]
表位转变
[0237]
在慢性hbv感染期间,针对hbv抗原的cd8
t细胞会耗竭。与次优势表位相比,针对优势表位的cd8
t细胞趋向耗竭的进展更快且更明显。根本原因是,耗竭是由通过t细胞受体的压倒性抗原驱动的刺激驱动的。与对其限制性元件(restricting element)的亲和力较低的次优势表位相比,优势表位以更高的水平呈递在由抗原呈递细胞表达的mhc i类抗原上。典型的疫苗方法主要诱导对优势表位的免疫应答。治疗性疫苗应考虑到在慢性病毒感染期间针对优势表位的t细胞的丧失,并其应被设计为有利于扩展针对次优势表位的cd8
t细胞,次优势表位更有可能抵抗疾病驱动的耗竭,从而转化为更好的疾病控制。
[0238]
测定了用腺病毒载体免疫的幼稚小鼠中的表位谱(epitope profile),该腺病毒载体包含编码与单纯疱疹病毒糖蛋白d融合的hbv聚合酶n末端结构域(poln)的核酸序列(“adc6-gdpoln”,其中gdpoln的氨基酸序列是seq id no:16)。将未用aav8-1.3hbv载体预处理的小鼠的反应与在接种adc6-gdpoln之前用表达1.3hbv基因组的aav8载体感染的小鼠中获得的反应进行比较。aav8-1.3hbv载体诱导血清中高滴度的hbv,这可能驱动cd8
t细胞耗竭。
[0239]
在第一系列实验中,用肽池矩阵鉴别接种了adc6-gdpoln载体但未用aav-1.3hbv载体攻击的小鼠中的表位。在这些幼稚小鼠中鉴别出许多引发有效反应(例如,大于1%的产生ifn-γ的cd8
cd44
t细胞,图7a和图8a)的区域。在第二实验中,用1x10
10
个病毒基因组
gdpoln的单次im注射(-),或在4周后,在有或没有5x10
9 vp的adc6-gdpoln的单次im注射的情况下,通过尾静脉接受1x10
11
个病毒基因组(vg)的aav8-1.3hbv的静脉内给药。aav8-1.3hbv给药后约2个月,处死小鼠,取出肝脏,从三组中的每一组制备肝切片,用苏木精和伊红染色并评估淋巴细胞浸润物。在同一个实验中,用针对t-bet的特异性四聚体和荧光色素标记的抗体(克隆4b10,bv785株),或pd-1的抗体(克隆29f.1a12,bf605株)、tim-3的抗体(克隆rmt3-23,pe/cy7株)、ctla-4的抗体(克隆uc10-4b9,pe株)或lag-3的抗体(克隆c9b7w,bv650株),对细胞染色。通过流式细胞术分析细胞,并对其在cd44
cd8四聚体阳性细胞上进行门控,然后在标志物上对其进行门控。与幼稚t细胞相比,从直方图中鉴别出标志物阳性细胞的百分比。
[0249]
方法——功效
[0250]
aav8-1.3hbv载体研究——为了评估adc6-gdpoln对慢性hbv病毒暴露的影响,用1x10
10
个vg的aav8-1.3hbv通过尾静脉静脉内攻击c57bl/6小鼠(每组n=8),并在4周后,通过单次im注射5x10
9 vp的adc6-gdpoln进行免疫。通过qpcr评估hbv dna病毒滴度;报告了疫苗接种前和疫苗接种后相对于基线的变化(log
10
拷贝/ml)。在aav8攻击后4、6、8、10和12周评估病毒基因组拷贝数。通过pcr评估随着时间的推移的病毒动力学,并评估每毫升hbv拷贝的log10变化。评估在治疗后不同时间点表现出1、2或3个对数减少的小鼠的数量。
[0251]
随着时间的推移,慢性hbv病毒暴露对cd8
t细胞抗原识别的影响-评估了aav8-1.3hbv对疫苗诱导的肝cd8
t细胞的影响。疫苗接种后4周,测定通过单次im注射5x10
9 vp的adc6-gdpoln免疫的幼稚小鼠的脾细胞中的表位谱。小鼠,其用1x10
10
和1.5x10
11
个vg的aav8-1.3hbv攻击并随后在4周后接种5x10
9 vp的adc6-gdpoln,在疫苗接种后10周(aav注射后14周)在脾细胞中具有cd8
t细胞表位谱。比较了aav幼稚和aav处理的接种疫苗的动物之间的表位谱。分析来自肝脏的poln特异性cd8
t细胞的分化标志物。
[0252]
结果
[0253]
免疫原性-疫苗接种诱导了cd8
t细胞对poln的稳健和持续的反应(相对于所有循环cd8
t细胞的中位频率:6.0%)和对polc和core的较低反应(中位频率:分别为1.0%和0.4%;图9a和图9b)。在第8周进行的加强增加了对所有区域的反应,其中针对core观察到显著的变化(p=0.007)(图9c)。图9a-9c显示了相对于各个小鼠所有cd8
t细胞的%cd8
t细胞,中位数由线表示。加强后进一步增强了疫苗接种诱导的cd8
t细胞的广泛表位识别(27%至34%;图10)。
[0254]
在adc6-gdpoln疫苗接种后第12周,aav8-1.3hbv感染的接种疫苗的小鼠表现出肝cd8
浸润物的优先增加(图11a-11b和图12a-12f)、疫苗诱导的hbv特异性cd8
t细胞的存在减少(图11a和图11b)和t-bet水平略微降低(提示效应子功能的丧失)(图13a-13b)。图11a显示了相对于来自各个肝脏的所有回收淋巴细胞的%cd8
t细胞。图11b显示了四聚体阳性cd8
细胞的百分比,其通过与幼稚t细胞相比从直方图中鉴别。然而,在接种疫苗的aav1.3hbv感染的和未感染的小鼠之间,未观察到提示t细胞分化为耗竭表型的细胞标志物的明确模式(图13a-13b)。
[0255]
功效-在单次im注射adc6-gdpoln载体后,aav8-1.3hbv感染的小鼠血清中的hbv dna多对数下降,下降在疫苗接种后的整个8周内持续存在(图14)。疫苗接种后,4周和8周时血清hbv dna病毒载量水平的中位下降分别为0.86和2.69log
10 cps/ml(图14a)。在第8周,
相对于基线,所有动物均具有》1log
10 cps/ml的下降,6/7(86%)的动物具有》2log
10 cps/ml的下降,2/7(29%)的动物具有》3log
10 cps/ml的下降(图14b)。
[0256]
在单次adc6-gdpoln载体注射后,当比较aav-hbv感染的小鼠和幼稚小鼠时,观察到脾细胞中对poln肽的不同cd8
t细胞识别模式。图15a和图15b说明了来自实验的结果,在实验中,首先给小鼠注射aav-1.3hbv,然后在4周后用10
10
vp的adc6-gdpoln载体进行加强,在免疫后8周收获脾细胞,并在用跨越poln序列的各个肽进行短暂体外刺激后,通过针对ifn-γ的ics进行测试。减去没有肽的情况下获得的背景频率。图15a显示仅接受adc6-gdpoln疫苗的小鼠的肽识别谱,随后是那些首先注射所示剂量的aav8-1.3hbv载体的小鼠。图15b中的饼形图显示了对达到所有cd44
cd8
细胞的0.1%阈值的肽的相应反应(数据对应于图15a中的那些)。每个小块/颜色代表对各个肽的反应频率,大小显示总比例;仅包括大于0.1%的反应。拔出指示仅在aav8-1.3hbv感染的小鼠中识别的表位。发现用aav预处理既减少了单次im初免后识别的表位数量,也减少了作为产生ifn-γ的cd8
t细胞的总数相对于cd8
t细胞池的免疫应答的幅度(magnitude)。aav预处理将t细胞识别转变到新表位,其约占可检测到的cd8
t细胞反应的三分之一。功能性hbv特异性cd8
t细胞反应的百分比在幼稚小鼠中最高(4.4%,图15b),但在低剂量和高剂量aav8-1.3hbv存在时降低(分别为2.0%和0.6%;图15b)。aav8-1.3hbv未感染的动物对许多表位表现出强烈的cd8
t细胞反应,其在aav-hbv感染的动物中减少并转变,以包括新表位的t细胞识别。
[0257]
讨论
[0258]
生成了使用gd作为基因编码的检查点抑制剂靶向早期cd8
t细胞激活的hbv治疗性疫苗,并且证明其:
[0259]
·
诱导cd8
t细胞对关键hbv抗原的有效和持久的反应(图9);
[0260]
·
刺激非常广泛的cd8 t细胞反应(图10),包括次优势表位识别(图15);和
[0261]
·
在aav小鼠模型(图14)中实现持续的多对数hbv dna病毒载量降低,其中优先将功能性cd8
t细胞运输至肝脏(图11和12)。
[0262]
在公开的aav研究中,aav诱导的hbv感染在接种adc6-gdpoln后导致cd8
t细胞对poln的优势表位的识别丧失(图15)。在不受理论束缚的情况下,据信是gd诱导的cd8
t细胞的广度和它们识别次优势表位的能力导致持续的免疫应答和hbv的多对数抑制。
[0263]
在aav诱导的hbv感染动物接种疫苗后血液和肝脏中adc6/7-gdpoln的免疫原性
[0264]
进行了以下研究以评估在存在预先存在的aav诱导的hbv感染的情况下,动物的血液、脾脏和肝脏中cd8
t细胞对adc6-gdpoln疫苗的反应。
[0265]
实验#1-aav8-1.3hbv感染小鼠中的cd8
t细胞反应:血液中的反应动力学
[0266]
目的
–
评估持续滴度的hbv抗原对cd8
t细胞对adc6载体中表达的gdpoln抗原的反应的影响。
[0267]
方法-给c57bl/6小鼠i.v.注射10
10
的aav8-1.3hbv载体。4周后,给它们接种5x109vp的adc6-gdpoln载体。对照小鼠仅接受adc6-gdpoln载体。幼稚小鼠作为额外的对照。2个月后,用相同剂量的adc7-gdpoln疫苗对小鼠进行加强。在初免和加强后的不同时间收集血液,并针对产生ifn-γ的cd8 t细胞测试pbmc。
[0268]
结果-如图16所示,小鼠在疫苗接种后2周表现出(mounted)强烈的poln特异性cd8
t细胞反应,反应到第8周逐渐下降,然后在加强后再次增加。加强后的cd8 t细胞反应比初
免后更稳定。在大多数时间点,注射了aav8-1.3hbv载体的小鼠的测试的反应低于未注射aav载体的对照。
[0269]
实验#2-aav8-1.3hbv感染小鼠的cd8
t细胞反应:肝脏中的反应
[0270]
目的
–
评估aav8-1.3hbv感染的接种疫苗的小鼠肝脏中的cd8
t细胞反应,包括指示t细胞耗竭的标志物。
[0271]
方法-给c57bl/6小鼠i.v.注射10
10
或10
11
vg的aav8-1.3hbv载体。4周后,给它们接种5x109vp的adc6-gdpoln载体。对照小鼠仅接受adc6-gdpoln载体。幼稚小鼠作为额外的对照。2个月后,用相同剂量的adc7-gdpoln疫苗对小鼠进行加强。
[0272]
为了获得肝淋巴细胞,将肝脏切成碎块并在l15中用2mg/ml胶原酶p、1mg/ml dnase i(均来自roche,basel switzerland)和2%fbs(tissue culture biologicals,tulare,ca)在搅拌下处理1小时。将肝碎块均质化,通过70μm过滤器过滤,通过percoll梯度离心纯化淋巴细胞并用补充有10%fbs的dmem洗涤。在 4℃下在黑暗中用以下将淋巴细胞染色30min:violet live/dead dye(thermo fisher scientific)、抗cd8-apc(克隆53-6.7,biolegend)、抗cd44-alexa flour 700(克隆im7,biolegend)、抗eomes-alexa fluor 488(克隆dan11mag,ebioscience)、抗pd1-bv605(克隆29f.1a12,biolegend)、抗lag3-bv650(克隆c9b7w,biolegend)、抗t-bet-bv786(克隆4b10,biolegend)、抗ctla-4-pe-a(克隆uc10-4b9,biolegend)、抗tim-3-pe-cy7-a(克隆rmt3-23,biolegend)和对应于hbv聚合酶的氨基酸396-404即favpnlqsl(seq id no:188)(肽55)的apc标记的mhc i类四聚体(nih tetramer facility,emory university,atlanta ga)。洗涤细胞并通过bd facs celesta(bd biosciences,san jose,ca)和diva软件进行分析。使用flowjo(treestar,ashland,or)进行采集后(post-acquisition)分析。
[0273]
结果-分析了淋巴细胞肝浸润物中cd8
t细胞的频率。与幼稚小鼠相比,接种疫苗的小鼠淋巴细胞肝浸润物中cd8
t细胞的频率增加,并且在疫苗接种前已经注射aav8-1.3hbv载体的小鼠中观察到进一步增加(图17a)。在注射了aav-1.3hbv的小鼠中,通过用对poln插入物中存在的表位具有特异性的四聚体染色鉴别的poln特异性cd8
t细胞的频率降低(图17b)。
[0274]
通过测定与给定抗体连接的染料的平均荧光强度(图18a-图18f),并通过评估对所示标志物呈阳性的cd8
t细胞的百分比(图19a-图19f),来评估浸润性四聚体
cd8
t细胞与幼稚cd8
t细胞(即四聚体-cd44-cd8
t细胞)相比的表型。
[0275]
与仅疫苗组相比,在疫苗接种前注射了aav8-1.3hbv的小鼠的肝cd8
t细胞上,控制许多cd8
t细胞功能的t-bet减少。在aav8-1.3hbv预处理组中耗竭标志物没有增加,这表明在hbv存在的情况下观察到的poln特异性cd8
t细胞的丧失不太可能是由经典cd8
t细胞耗竭引起的(图18a-图18f,图19a-图19f)。
[0276]
实验#3-aav8-1.3hbv感染的小鼠中poln特异性cd8
t细胞反应的广度
[0277]
目的-评估hbv的存在是否会影响cd8
t细胞对adc疫苗在gd内表达的poln的反应的广度。
[0278]
方法-给小鼠i.v.注射10
10
或10
11
vg的aav8-1.3hbv载体,并在2个月后用相应的adc7载体加强。对照小鼠仅接受adc6-gdpoln载体。10周后对小鼠实施安乐死,并在非aav感染动物研究中针对肽池测试汇集的(pooled)脾细胞。结果提供在图20a-图20c中。
[0279]
在第二实验中,给小鼠i.v.注射10
10
或10
11
vg的aav8-1.3hbv载体。4周后,给它们接种5x10
10
vp的adc6-gdpoln载体。对照小鼠仅接受adc6-gdpoln载体。幼稚小鼠作为额外的对照。6周后,针对响应于跨越poln序列的各个肽的产生ifn-γ的cd8
t细胞,分析脾细胞。结果提供在图20d-图20f中。
[0280]
结果-hbv的存在,尤其是高滴度hbv的存在,例如在注射10
11
vg剂量的aav8-hbv1.3后,不仅降低了cd8
t细胞对adc6-gdpoln疫苗所呈现的poln序列的总体反应,而且还导致表位识别谱的转变。
[0281]
实验#4
–
aav8-1.3hbv感染的小鼠中肝poln特异性cd8
t细胞的功能
[0282]
目的
–
评估肝浸润性poln特异性cd8
t细胞在aav8-1.3hbv感染的小鼠中是否保持功能。
[0283]
方法-在第一实验中,给c57bl/6小鼠i.v.注射3x10
11
个vg的aav8-1.3hbv。8周后,一组接种了5x10
10
vp的adc6-gdpoln载体。另一组未接种疫苗。4.5个月后对小鼠实施安乐死,并针对响应于poln肽池的产生ifn-γ的cd8
t细胞的频率,测试脾细胞。
[0284]
在第二实验中,给小鼠注射分级浓度的aav8-1.3hbv(1x10
10
、4x10
10
或1x10
11
)。4周后,所有小鼠都接种了5x10
10 vp的adc6-gdpoln载体。2个月后,用相同剂量的adc7-gdpoln载体对小鼠进行加强。2个月后对小鼠实施安乐死,从肝脏中分离出淋巴细胞,并针对响应于poln肽池的产生ifn-γ的cd8
t细胞测试淋巴细胞。还用tox的抗体给细胞染色,tox是在耗竭的t细胞中增加的转录因子。
[0285]
结果-如图21所示,疫苗诱导的cd8
t细胞在注射了aav8-1.3hbv载体的小鼠中仍然具有功能。
[0286]
实验#5-给aav8-1.3hbv感染的小鼠接种疫苗对肝脏组织学的影响
[0287]
目的-评估aav.8-1.3hbv接种小鼠的adc6/7-gdpoln疫苗接种是否会导致持续的肝损伤。
[0288]
方法-给小鼠i.v.注射10
10
个vg的aav8-1.3hpv。一个月后,给它们接种5x109vp的adc6-gdpoln载体。2个月后,用相同剂量的adc7-gdpoln载体对小鼠进行加强。约2个月后对小鼠实施安乐死。收集肝切片并固定在10%甲醛中。制备切片(约3μm厚)并用苏木精伊红(h&e)染色。在光学显微镜下以20x放大率对它们进行检查。
[0289]
结果-在接受aav载体和疫苗两者的小鼠的33个切片中,有一个显示了位于肝切片边缘的小的淋巴细胞浸润物。
[0290]
如图21b所示,在hla-a2-tg小鼠中单次gdpoln疫苗接种后,与仅接种疫苗的小鼠相比,在接受aav的小鼠中产生ifn-γ的肝cd8
t细胞的频率降低。
[0291]
结论
[0292]
·
在aav8-1.3hbv感染的小鼠中,cd8
t细胞对poln的反应降低。尽管如此,它们仍然是可以检测到的。
[0293]
·
在aav8-1.3hbv预处理的动物中,耗竭标志物没有增加,这表明在hbv存在的情况下观察到的poln特异性cd8
t细胞的丧失不太可能是由经典cd8
t细胞耗竭引起的。
[0294]
·
aav诱导的hbv感染导致cd8
t细胞对poln的反应的表位识别谱发生转变。
[0295]
·
疫苗诱导的cd8
t细胞在先前感染了aav8-1.3hbv载体的小鼠中仍然具有功能。
[0296]
·
初免加强方案所用的疫苗不会在hbv阳性小鼠中造成明显的肝损伤。
[0297]
hbv poln-polc-core构建体的生成
[0298]
生成了两个多抗原插入物(第二代poln-polc-core和第三代poln-polc-core)。这些插入物的序列如下所示:
[0299]
第二代hbv疫苗插入物(“hbv2”)(pol n(斜体)-pol c(下划线)-core)(seq id no:174)
[0300][0301]
第三代hbv疫苗插入物(“hbv3”)(pol n(斜体)-pol c(下划线)-core)(seq id no:175)
[0302][0303][0304]
第二代hbv(“hbv2”)插入物包括免疫优势poln表位,这些表位是从疫苗接种前未感染aav8-1.3hbv载体的小鼠中鉴定出来的。在通过预施用aav8-1.3hbv载体(如上文“表位转变”中定义)引起的慢性hbv感染的小鼠模型中,发现这些表位中有许多表位丧失。第三代hbv(“hbv3”)插入物选择了poln的优先被具有高hbv载量的小鼠识别的连续区域(见上文)。使用以下方案为两种构建体选择core和polc的区域:在c57bl/6、balbc和hla-a2 tg小鼠中,在初免(图3)或加强(图5)区域中具有最高免疫应答的区域,目的是选择大的连续区域,而不是选择独特的表位,并在它们之间插入间隔序列。
[0305]
第二代和第三代hbv插入物(hbv2和hbv3)的遗传完整性和稳定性
[0306]
蛋白质印迹-评估了纯化的重组病毒载体制剂(adc6-gdhbv2、adc6-gdhbv3、adc7-gdhbv2和adc7-gdhbv3)在体外引发转基因产物表达的能力。为此,进行蛋白质印迹分析,以评估细胞培养物感染目的载体后细胞裂解物中gd蛋白的表达。用已知量的纯化载体感染hek293贴壁细胞单层,并在感染后48小时收获,重悬于含有蛋白酶抑制剂的裂解和提取缓冲液中,并通过超声处理裂解。通过使用二硫苏糖醇作为氧化还原剂使总蛋白提取物变性,并在12%bis-tris聚丙烯酰胺凝胶(page)中进行电泳。在通过sds-page分离蛋白之后,通过湿电泳转移将样品转移到激活的聚偏氟乙烯膜上。使用在盐水中稀释至1:1000的gd一抗(克隆pa1-30233,invitrogen,carlsbad,ca)在室温下对膜进行免疫染色1小时,以检测gd蛋白。用1x tbs-t洗涤膜,然后用与hrp缀合的山羊抗兔二级igg(ab6721,abcam,cambridge uk)在室温下孵育1h。随后添加基于鲁米诺的化学发光底物。将染色的膜暴露于放射自显影胶片,并在自动胶片显影器处理后评估信号发射。在记录感染的hek293细胞裂解物中的gd蛋白表达后,剥离膜并重新探测总蛋白提取物样品中β-肌动蛋白的存在。该染色步骤用于评估page上样步骤的一致性,从而更好地支持重组病毒载体体外刺激gd蛋白表达的半定量
分析。
[0307]
稳定性-为了确保病毒构建体的遗传完整性,通过在hek293贴壁细胞培养物中连续病毒传代评估每个重组病毒载体批次(lot)的遗传稳定性。将每次转染产生的重组病毒池在标准生长条件下培养总计12代。在最后一次传代中,扩大病毒池,并通过氯化铯梯度纯化粗收获物。载体纯化后,使用qiagen dneasy blood&tissue kit分离病毒dna,并使用ase i和bgl ii通过限制酶消化对其进行评估,ase i和bgl ii是两种以不同的构建体特异性预定义条带模式切割dna模板的限制酶。消化后,使样品在含有溴化乙锭的1%琼脂糖凝胶中进行电泳,以使消化的条带可视化,然后使用数字凝胶成像系统记录结果。表现出与早期传代病毒相同的条带模式的病毒制剂视为保持了初始的分子克隆结构,因此在12次病毒传代结束时视为是稳定的。
[0308]
结果-与5次传代后相比,病毒载体dna的条带模式在12次传代后保持稳定,表明载体基因组是稳定的(数据未显示)。
[0309]
adc6或adc7载体表达的第2代和第3代hbv插入物(hbv2和hbv3)的免疫原性
[0310]
目的-评估cd8
t细胞对adc6载体或adc7载体表达的hbv2和hbv3插入物的反应。
[0311]
方法-给c57bl/6小鼠组注射5x109或5x10
10
vp的adc6-gdhbv2或adc6-gdhbv3载体。注射相同剂量adc6-gdpoln载体的小鼠作为阳性对照;幼稚小鼠作为阴性对照。14天后对小鼠取血,并针对响应对应于hbv插入物的肽池的产生ifn-γ的cd8
t细胞频率测试pbmc。4周后(疫苗接种后6周),对小鼠再次取血并用poln特异性四聚体进行测试。adc6-gdhbv3免疫小鼠被排除在外,因为这种插入物缺乏对应于四聚体的表位。
[0312]
给c57bl/6小鼠组注射5x109或5x10
10
vp的adc7-gdhbv2或5x10
10
vp的adc7-gdhbv3载体。幼稚小鼠作为阴性对照。14天后对小鼠取血,并针对响应对应于hbv插入物的肽池的产生ifn-γ的cd8
t细胞频率测试pbmc。
[0313]
adc7初免/adc6加强的免疫原性
[0314]
约4周后对小鼠取血,并针对响应于插入物的肽的产生ifn-γ和/或tnf-α的cd8
t细胞,通过ics重新测试pbmc。初免后两个月用相同剂量的表达相同插入物的异源载体对小鼠进行加强。2周后通过ics测试pbmc,并比较了加强前和加强后的cd8
和cd4
t细胞反应。初免后adc7-gdhbv2载体诱导产生ifn-γ和/或tnf-α的cd8
t细胞的稳健频率。在adc6-gdhbv2加强后频率增加,这在低载体剂量后和对于产生ifn-γ的cd8
t细胞尤其明显。adc7-gdhbv3载体的免疫原性较差,但在adc6-gdhbv3加强后cd8
t细胞反应变为阳性。同样,初免后cd4
t细胞反应是微不足道的,但在加强后增加。cd4对hbv2或hbv3插入物的反应没有显著差异。
[0315]
结论
[0316]
·
adc6-gdhbv2和adc7-gdhbv2载体均具是高免疫原性的(图22a、图22b和图23),并且在用表达相同插入物的异源adc载体加强后反应增加(图24)。
[0317]
·
adc7-gdhbv2和adc7-gdhbv3载体显示出与其设计一致的临界免疫原性,因为它们缺乏对应于所用四聚体的表位(图22a和图23)。
[0318]
·
用adc6-gdhbv2加强adc7-gdhbv2增强cd8
t细胞反应。
[0319]
adc6-gdpoln、adc6-gdhbv2、adc6-gdhbv3或adc6-hbv2 aav感染的小鼠中hbv dna病毒滴度的比较
[0320]
方法
[0321]
用1x109个vg的aav8-1.3hbv攻击五组c57bl/6小鼠,4周后接种1x10
10 vp的adc6-gdpoln(n=10)、adc6-gdhbv2(n=10)、adc6-gdhbv3(n=10)或没有gd的adc6-hbv2(n=10);aav感染、未接种疫苗的动物(“幼稚”)(n=10)和非aav感染、未接种疫苗的动物(n=2-5)用作对照。在aav注射后4周(疫苗接种前)测试病毒滴度,并与疫苗接种后4周(aav注射后第8周)的水平进行比较。
[0322]
结果
[0323]
在第8周,中位hbv病毒滴度在幼稚小鼠中增加了0.98log
10 cps/ml,在接种adc6-hbv2的小鼠中保持不变,在接种adc6-gdhbv3、adc6-gdpoln和adc6-gdhbv2的动物中分别下降了-0.04、-1.09和-2.13log
10
cps/ml(图25a)。各小鼠的结果显示在图25b中
–
所有接种adc6-gdpoln和adc6-gdhbv2的动物分别有超过1和2log
10
拷贝/ml的下降;相反,在第8周,幼稚、接种adc6-hbv2或接种adc6-gdhbv3的动物均都没有1log
10
拷贝/ml的下降或更大的下降。
[0324]
gdhbv2和gdhbv3的免疫原性研究
[0325]
评估了单次初免注射或初免后用含有相同插入物的异源载体进行加强免疫后,对gdhbv2或gdhbv3所含hbv core和聚合酶的片段的cd8
t细胞反应的诱导及其广度。
[0326]
实验1
[0327]
目的:在c57bl/6小鼠中用异源黑猩猩腺病毒载体(adc6和adc7)表达的gd-hbv2和gd-hbv3进行初免和加强疫苗接种后,评估ifn-γ
cd8
t细胞反应。
[0328]
方法:按如下通过肌肉注射使四组(每组5只)c57bl/6小鼠免疫:(a)5x10
10 vp的adc7-gdhbv2,两个月后是5x10
10 vp的adc6-gdhbv2;(b)5x10
9 vp的adc7-gdhbv2,两个月后是5x10
9 vp的adc6-gdhbv2;(c)5x10
10 vp的adc7-gdhbv3,两个月后是5x10
10 vp的adc6-gdhbv3;或(d)没有疫苗。在初免后2周和6周、加强前以及加强后2周和4周,通过ics评估血液的ifn-γ
cd8
t细胞反应。
[0329]
结果:在测试的所有时间点,发现每种疫苗构建体均诱导ifn-γ
cd8
t细胞。图26显示产生ifn-γ和/或tnf-α的亲代cd8
t细胞(图26a)、cd44
cd8
t细胞(图26b)、cd4
t细胞(图26c)或cd44
cd4
t细胞(图26d)的百分比。在初免后2和8周以及加强后2和4周,通过ics评估的各小鼠pbmc的免疫应答显示为平均值。
[0330]
实验2
[0331]
目的:在c57bl/6小鼠中使用异源黑猩猩腺病毒载体(adc6和adc7),比较用gd-hbv2和gd-hbv3与用gd-poln进行不同剂量的初免和加强疫苗接种后的ifn-γ
cd8
t细胞反应。
[0332]
方法:按如下使c57bl/6小鼠组(n=5只小鼠/组)免疫:
[0333]
gdpoln组
[0334]
(a)5x10
9 vp的adc6-gdpoln,三个月后5x10
9 vp的adc7-gdpoln;和
[0335]
(b)5x10
10 vp的adc6-gdpoln,三个月后5x10
10 vp的adc7-gdpoln
[0336]
gdhbv2组
[0337]
(c)5x10
9 vp的adc6-gdhbv2,三个月后5x10
9 vp的adc7-gdhbv2和;
[0338]
(d)5x10
10 vp的adc6-gdhbv2,三个月后5x10
10 vp的adc7-gdhbv2
[0339]
gdhbv3组
[0340]
(e)5x10
9 vp的adc6-gdhbv3,三个月后5x10
9 vp的adc7-gdhbv3和;
[0341]
(f)5x10
10 vp的adc6-gdhbv3,三个月后5x10
10 vp的adc7-gdhbv3
[0342]
没有治疗作为对照
[0343]
对于所有处理组,免疫原性cd8
t细胞反应来自在初免后2周和6周、加强前以及加强后2和6周通过ics针对ifn-γ
评估的血液。在初免后第4周,还通过使用apc标记的mhc i类四聚体(nih tetramer facility,emory university,atlanta ga)进行四聚体染色来评估免疫原性,所述mhc i类四聚体对应于hbv聚合酶的氨基酸396-404即favpnlqsl(肽55)。hbv3不含favpnlqsl肽。
[0344]
结果:在所有时间点,发现每种测试的疫苗都诱导ifn-γ
cd8
t细胞。使用gdhbv2疫苗获得的结果与使用gdpoln疫苗获得的结果相似;gdhbv3疫苗的免疫原性较低。在四聚体染色后,在两种疫苗之间,特异性cd8
t细胞的频率相当;许多激活标志物倾向于在gdhbv2免疫组的四聚体
cd8
t细胞上更高表达。图27显示了多个时间点的cd8
t细胞:初免后4周(图27a);加强后两周(图27b);和加强后4周(图27c)。坐标图显示了通过ics评估的产生ifn-γ
的cd8
t细胞的总体频率。
[0345]
图28显示了在多个时间点由ics评估的产生细胞因子的cd4
t细胞:初免后4周(图28a);加强后两周(图28b);和加强后4周(图28c)。基于幼稚小鼠的结果,虚线表示阳性反应的截止值。
[0346]
图29显示了在初免后4周,在cd8
t细胞(图29a)或cd44
cd8
t细胞(图29b)进行门控的四聚体染色的结果。
[0347]
图30显示了四聚体
cd8
t细胞的表型,其显示为与所示抗体连接的染料的平均荧光强度:图30a,与bv605缀合的抗pd1抗体;图30b,与bv650缀合的抗lag3抗体;图30c,与pe-cy7-a缀合的抗tim3抗体;图30d,与pe-a缀合的抗ctla4抗体;图30e,与af488缀合的抗eomes抗体;和图30f,与bv786缀合的抗t-bet抗体。
[0348]
实验3
[0349]
由接种疫苗的c57bl/6小鼠的汇集的脾细胞,评估反应的广度,针对hbv疫苗插入物中存在的各个肽通过ics测试汇集的脾细胞。
[0350]
方法:按如下通过肌肉注射使四组(每组5只)c57bl/6小鼠免疫:(a)5x10
10 vp的adc7-gdhbv2,两个月后5x10
10 vp的adc6-gdhbv2;(b)5x10
9 vp的adc7-gdhbv2,两个月后5x10
9 vp的adc6-gdhbv2;(c)5x10
10
vp的adc7-gdhbv3,两个月后5x10
10 vp的adc6-gdhbv3;或(3)没有疫苗。加强后八周处死动物,并通过ics评估汇集的脾细胞对各个hbv2或hbv3肽的ifn-γ
cd8
t细胞反应(阳性反应的截止值设定为0.1%)。
[0351]
结果:与剂量无关,用gdhbv2疫苗进行的初免加强方案诱导了对core和聚合酶内几个表位的反应。图31显示了5x10
10 vp的adc7-gdhbv2初免疫苗接种接着两个月后接种5x10
10 vp的adc6-gdhbv2后的cd8
t细胞反应。x轴上的数字对应于本文提供的seq id no。图32显示用5x10
9 vp的adc7-gdhbv2初免疫苗接种接着两个月后接种5x10
9 vp的adc6-gdhbv2后的cd8
t细胞反应。x轴上的数字对应于本文提供的seq id no。图33显示了用5x10
10 vp的adc7-gdhbv3初免疫苗接种接着两个月后接种5x10
10 vp的adc6-gdhbv3后的免疫原性。x轴上的数字对应于本文提供的seq id no。
[0352]
实验4
[0353]
由接种疫苗的balb/c小鼠的汇集的脾细胞,评估反应的广度,针对hbv疫苗插入物中存在的各个肽通过ics测试了汇集的脾细胞。
[0354]
方法:按如下通过肌肉注射使五组(每组5只)balb/c小鼠免疫:(a)5x10
10 vp的adc6-gdhbv2;(b)5x10
10 vp的adc6-gdhbv3;(c)5x10
10 vp的adc7-gdhbv2;(d)5x10
10 vp的adc7-gdhbv3;或(e)没有疫苗。疫苗接种后12周处死动物,收集脾脏,并通过ics评估汇集的脾细胞对各个hbv2或hbv3肽的ifn-γ
cd8
t细胞反应(阳性反应的截止值设定为0.1%)。
[0355]
结果:在第12周,发现每种疫苗构建体在疫苗递送的core和聚合酶基因的多个区域中具有免疫原性。图34显示了对应于本文提供的seq id no(x轴)的adc6-gdhbv2和adc7-gdhbv2疫苗的免疫原性。两种hbv2构建体中的core、polc和poln区域均具有免疫原性。图35显示了对应于本文提供的seq id no(x轴)的adc6-gdhbv3和adc7-gdhbv3疫苗的免疫原性。两种hbv3构建体中的core、polc和poln区域均具有免疫原性。
[0356]
实验5
[0357]
方法:用1x109个vg的aav8-1.3hbv攻击五组c57bl/6小鼠,并在4周后接种(“初免疫苗接种”)1x10
10 vp的adc6-gdpoln(n=10)、adc6-gdhbv2(n=10)、adc6-gdhbv3(n=10)或没有gd的adc6-hbv2(n=10);aav感染的未接种疫苗的动物(n=10)和非aav感染的未接种疫苗的动物(n=2-5)作为对照。在注射后的不同时间对小鼠取血,并通过针对ifn-γ的细胞内细胞因子染色(ics)确定插入物特异性cd8
和cd4
t细胞的频率。初免疫苗接种后2周、6周、8周进行pcr,并在初免疫苗接种后4周进行t细胞测定。
[0358]
在初免疫苗接种后8周,用adc7载体对小鼠进行加强(“加强疫苗接种”),该载体含有初免疫苗接种所用的相同抗原插入物,并如前所述在疫苗接种后的不同时间测试血液和血清的cd8
/cd4
t细胞。加强疫苗接种后2周、6周、10周进行pcr,并在加强疫苗接种后4周、12周进行t细胞测定。
[0359]
本领域的技术人员应当理解,可以对本发明的优选实施方案进行许多改变和修改,并且可以在不背离本发明的精神的情况下进行这些改变和修改。因此,所附权利要求旨在涵盖所有落入本发明的真正精神和范围内的所有这类等效变型。
[0360]
本文件中引用或描述的每件专利、专利申请和出版物的公开内容通过引用整体并入本文。
[0361]
表9.序列
[0362]
[0363]
[0364]
[0365]
[0366]
[0367]
[0368]
[0369]
[0370]
[0371]
[0372][0373]
实施方案
[0374]
以下实施方案列表旨在补充而不是取代或代替先前的描述。
[0375]
实施方案1.乙型肝炎病毒(hbv)core蛋白,包含seq id no:6的氨基酸序列或其免疫原性片段。
[0376]
实施方案2.如实施方案1所述的hbv core蛋白,其中所述免疫原性片段包含seq id no:20-54中的任一个。
[0377]
实施方案3.乙型肝炎病毒(hbv)core蛋白,其包含seq id no:180的氨基酸序列或其免疫原性片段,或seq id no:183的氨基酸序列或其免疫原性片段。
[0378]
实施方案4.核酸分子,编码实施方案1-3中任一项所述的hbv core蛋白。
[0379]
实施方案5.如实施方案4所述的核酸分子,其中所述核酸分子包含seq id no:7的核苷酸序列。
[0380]
实施方案6.载体,包含实施方案4或5所述的核酸分子。
[0381]
实施方案7.如实施方案6所述的载体,其中所述载体是腺病毒载体。
[0382]
实施方案8.如实施方案7所述的载体,其中所述腺病毒载体是adc6载体或adc7载体。
[0383]
实施方案9.疫苗,包含实施方案6-8中任一项所述的载体。
[0384]
实施方案10.hbv聚合酶n末端结构域,包含seq id no:8的氨基酸序列或其免疫原性片段。
[0385]
实施方案11.如实施方案10所述的hbv聚合酶n末端结构域,其中所述免疫原性片段包含seq id no:55-113中的任一个。
[0386]
实施方案12.hbv聚合酶n末端结构域,包含seq id no:178的氨基酸序列或其免疫原性片段,或seq id no:181的氨基酸序列或其免疫原性片段。
[0387]
实施方案13.hbv聚合酶c末端结构域,包含seq id no:10的氨基酸序列或其免疫原性片段。
[0388]
实施方案14.如实施方案13所述的hbv聚合酶c末端结构域,其中所述免疫原性片段包含seq id no:114-172中的任一个。
[0389]
实施方案15.hbv聚合酶c末端结构域,包含seq id no:179的氨基酸序列或其免疫原性片段,或seq id no:182的氨基酸序列或其免疫原性片段。
[0390]
实施方案16.核酸分子,编码实施方案10-15中任一项所述的hbv聚合酶。
[0391]
实施方案17.如实施方案16所述的核酸分子,其中所述核酸分子包含seq id no:9的核苷酸序列。
[0392]
实施方案18.如实施方案16所述的核酸分子,其中所述核酸分子包含seq id no:11的核苷酸序列。
[0393]
实施例19.载体,包含实施方案16-18中任一项所述的核酸分子。
[0394]
实施方案20.如实施方案19所述的载体,其中所述载体是腺病毒载体。
[0395]
实施方案21.如实施方案20所述的载体,其中所述腺病毒载体是adc6载体或adc7载体。
[0396]
实施方案22.疫苗,包含实施方案19-21中任一项所述的载体。
[0397]
实施方案23.融合蛋白,包含以下中的一种或多种:
[0398]
包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白、包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域。
[0399]
实施方案24.如实施方案23所述的融合蛋白,包含:
[0400]
(1)包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白和包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域;
[0401]
(2)seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)和seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段);
[0402]
(3)包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;
[0403]
(4)seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)和seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段);
[0404]
(5)包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;
[0405]
(6)seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段)和seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段);
[0406]
(7)包含seq id no:6的氨基酸序列或其免疫原性片段的hbv core蛋白、包含seq id no:8的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域和包含seq id no:10的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域;或者
[0407]
(8)seq id no:20-54中的一个或多个(seq id no:6的免疫原性片段)、seq id no:55-113中的一个或多个(seq id no:8的免疫原性片段)和seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段)。
[0408]
实施方案25.融合蛋白,包含:
[0409]
包含seq id no:178的氨基酸序列或其免疫原性片段的hbv聚合酶n-末端结构域、包含seq id no:179的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域和包含seq id no:180的氨基酸序列或其免疫原性片段的hbv core蛋白。
[0410]
实施方案26.如实施方案25所述的融合蛋白,包含seq id no:174的氨基酸序列。
[0411]
实施例27.融合蛋白,包含:
[0412]
包含seq id no:181的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、包含seq id no:182的氨基酸序列或其免疫原性片段的hbv聚合酶c-末端结构域和包含seq id no:183的氨基酸序列或其免疫原性片段的hbv core蛋白。
no:55-113中的一个或多个(seq id no:8的免疫原性片段)以及seq id no:114-172中的一个或多个(seq id no:10的免疫原性片段),和
[0440]
c末端hsv gd蛋白序列或其变体。
[0441]
实施方案36.融合蛋白,包含:
[0442]
n末端hsv gd序列或其变体;
[0443]
hbv core蛋白,其包含seq id no:180的氨基酸序列或其免疫原性片段,或seq id no:183的氨基酸序列或其免疫原性片段;和
[0444]
c末端hsv gd序列或其变体。
[0445]
实施方案37.融合蛋白,包含:
[0446]
n末端hsv gd序列或其变体;
[0447]
hbv聚合酶n末端结构域,其包含seq id no:178的氨基酸序列或其免疫原性片段,或seq id no:181的氨基酸序列或其免疫原性片段;和
[0448]
c末端hsv gd蛋白序列或其变体。
[0449]
实施方案38.融合蛋白,包含:
[0450]
n末端hsv gd序列或其变体;
[0451]
hbv聚合酶c末端结构域,其包含seq id no:179的氨基酸序列或其免疫原性片段,或seq id no:182的氨基酸序列或其免疫原性片段;和
[0452]
c末端hsv gd蛋白序列或其变体。
[0453]
实施方案39.融合蛋白,包含:
[0454]
n末端hsv gd序列或其变体;
[0455]
hbv序列,其包含:
[0456]
(1)包含seq id no:178的氨基酸序列或其免疫原性片段的hbv聚合酶n-末端结构域、包含seq id no:179的氨基酸序列或其免疫原性片段的hbv聚合酶c-末端结构域、以及包含seq id no:180的氨基酸序列或其免疫原性片段的hbv core蛋白;或者
[0457]
(2)包含seq id no:181的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、包含seq id no:182的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域、以及包含seq id no:183的氨基酸序列或其免疫原性片段的hbv core蛋白;和
[0458]
c末端hsv gd蛋白序列或其变体。
[0459]
实施方案40.如实施方案39所述的融合蛋白,其中所述hbv序列包含含seq id no:178的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、含seq id no:179的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域以及含seq id no:180的氨基酸序列或其免疫原性片段的hbv core蛋白。
[0460]
实施方案41:如实施方案40所述的融合蛋白,其中所述hbv序列包含seq id no:174的氨基酸序列。
[0461]
实施方案42.如实施方案39所述的融合蛋白,其中所述hbv序列包含含seq id no:181的氨基酸序列或其免疫原性片段的hbv聚合酶n末端结构域、含seq id no:182的氨基酸序列或其免疫原性片段的hbv聚合酶c末端结构域以及含seq id no:183的氨基酸序列或其免疫原性片段的hbv core蛋白。
[0462]
实施方案43.如实施方案42所述的融合蛋白,其中所述hbv序列包含seq id no:
175的氨基酸序列。
[0463]
实施方案44.如实施方案29-43中任一项所述的融合蛋白,其中所述n末端hsv gd序列包含seq id no:12的氨基酸序列。
[0464]
实施方案45.如实施方案29-43中任一项所述的融合蛋白,其中所述n末端hsv gd序列包含seq id no:12的氨基酸残基26-269。
[0465]
实施方案46.如实施方案29-45中任一项所述的融合蛋白,其中所述c末端hsv gd序列包含hsv gd的跨膜结构域。
[0466]
实施方案47.如实施方案29-46中任一项所述的融合蛋白,其中所述c末端hsv gd序列包含seq id no:13的氨基酸序列。
[0467]
实施方案48.如实施方案29-47中任一项所述的融合蛋白,其中所述融合蛋白包含以下中任一者的氨基酸序列:seq id no:14或其免疫原性片段、seq id no:16或其免疫原性片段或seq id no:18或其免疫原性片段。
[0468]
实施方案49.如实施方案39-47中任一项所述的融合蛋白,其中所述融合蛋白包含seq id no:185的氨基酸序列。
[0469]
实施方案50.如实施方案39-47中任一项所述的融合蛋白,其中所述融合蛋白包含seq id no:187的氨基酸序列。
[0470]
实施方案51.核酸分子,编码实施方案23-50中任一项所述的融合蛋白。
[0471]
实施方案52.如实施方案51所述的核酸分子,其中所述核酸分子包含seq id no:15、17或19中任一个的核苷酸序列。
[0472]
实施方案53.如实施方案51所述的核酸分子,其中所述核酸分子包含seq id no:176的核苷酸序列。
[0473]
实施方案54.如实施方案51所述的核酸分子,其中所述核酸分子包含seq id no:177的核苷酸序列。
[0474]
实施方案55.如实施方案51所述的核酸分子,其中所述核酸分子包含seq id no:184的核苷酸序列。
[0475]
实施方案56.如实施方案51所述的核酸分子,其中所述核酸分子包含seq id no:186的核苷酸序列。
[0476]
实施方案57.载体,包含实施方案51-56中任一项所述的核酸分子。
[0477]
实施方案58.如实施方案57所述的载体,其中所述载体是腺病毒载体。
[0478]
实施方案59.如实施方案58所述的载体,其中所述腺病毒载体是adc6载体或adc7载体。
[0479]
实施方案60.疫苗,包含实施方案57-59中任一项所述的载体。
[0480]
实施方案61.在受试者中诱导对hbv的免疫应答的方法,所述方法包括向所述受试者提供有效量的实施方案23-50中任一项所述的融合蛋白、实施方案51-56中任一项所述的核酸分子、实施方案57-59中任一项所述的载体或实施方案60所述的疫苗,从而诱导对hbv的免疫应答。
[0481]
实施方案62.如实施方案61所述的方法,其中所述疫苗包含adc6载体,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段。
[0482]
实施方案63.如实施方案62所述的方法,还包括在提供包含adc6载体的疫苗之后,向所述受试者提供包含adc7载体的疫苗,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段。
[0483]
实施方案64.如实施方案61所述的方法,其中所述疫苗包含adc7载体,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段。
[0484]
实施方案65.如实施方案64所述的方法,还包括在提供包含adc7载体的疫苗之后,向所述受试者提供包含adc6载体的疫苗,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:14、16或18中任一个的氨基酸序列或其免疫原性片段。
[0485]
实施方案66.如实施方案61所述的方法,其中所述疫苗包含adc6载体,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:185的氨基酸序列。
[0486]
实施方案67.如实施方案66所述的方法,还包括在提供包含adc6载体的疫苗之后,向所述受试者提供包含adc7载体的疫苗,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:185的氨基酸序列。
[0487]
实施方案68.如实施方案61所述的方法,其中所述疫苗包含adc7载体,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:185的氨基酸序列。
[0488]
实施方案69.如实施方案68所述的方法,还包括在提供包含adc7载体的疫苗之后,向所述受试者提供包含adc6载体的疫苗,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:185的氨基酸序列。
[0489]
实施方案70.如实施方案61所述的方法,其中所述疫苗包含adc6载体,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:187的氨基酸序列。
[0490]
实施方案71.如实施方案70所述的方法,还包括在提供包含adc6载体的疫苗之后,向所述受试者提供包含adc7载体的疫苗,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:187的氨基酸序列。
[0491]
实施方案72.如实施方案61所述的方法,其中所述疫苗包含adc7载体,所述adc7载体包含融合蛋白,所述融合蛋白包含seq id no:187的氨基酸序列。
[0492]
实施方案73.如实施方案72所述的方法,还包括在提供包含adc7载体的疫苗之后,向所述受试者提供包含adc6载体的疫苗,所述adc6载体包含融合蛋白,所述融合蛋白包含seq id no:187的氨基酸序列。
[0493]
实施方案74.如实施方案61-73中任一项所述的方法,其中seq id no:14、16、18、185或187中任一个的氨基酸序列或其免疫原性片段不含有n末端25个氨基酸的信号肽。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
