甲醇脱氢酶融合蛋白
1.优先权要求
2.本技术要求于2015年10月30日提交的美国临时专利申请62/249,032和于2015年11月25日提交的美国临时专利申请62/260,189的优先权,其全部内容通过引用并入此处。同时,亦以引用的方式将2016年10月26日创建的标题为“gno0027wo_sequence_listing.txt”、大小为28kb的ascii文本技术件的全部内容并入本技术。
技术领域
3.本技术涉及含有甲醇脱氢酶的融合蛋白和表达这些融合体的工程细胞以及使用甲醇生产生物产品的方法。
背景技术:
4.在细胞内代谢途径中,代谢中间体是途径产物的前体分子,所述途径产物通常是生物学上重要的分子。
5.各种因素可影响产物途径中代谢中间体的加工。当将中间体转化为随后的代谢物的过程中存在速率限制事件时,该中间体可能在细胞中积累。在一些情况下,中间体的积累可能会对细胞产生不利影响。例如,中间体的积累可能通过转移细胞内能源资源或通过减少生物重要产物的产生来间接影响细胞。在其他情况下,代谢中间体的积累可能对细胞产生直接的不良影响。例如,小分子如甲基乙二醛或甲醛浓度升高,可非特异性修饰细胞内蛋白质并对细胞健康产生不利影响。
6.醇脱氢酶(adh;ec 1.1.1.1)促进醇类向醛类或酮类转化,通常伴随着烟酰胺腺嘌呤二核苷酸的还原(nad
至nadh)。adh在各种代谢产物的生物合成过程中协助产生具有醛基、酮基和醇基的重要化合物。然而,部分所述化合物,例如含醛化合物,包括当在细胞中积累时会产生问题的甲醛。
7.甲醇脱氢酶(medh)是醇脱氢酶中的一类。medh将甲醇(meoh)转化为甲醛(fald),可用在工程化到微生物中的酶促途径里,使得meoh成为唯一碳源或与其他原料(例如,葡萄糖、右旋糖、植物生物量或合成气)成为共同碳源,以产生有价值的产物。微生物代谢甲醇,且在某些情况下,经由甲醇脱氢酶进行所述代谢,并在更少的情况下,生产有价值的产物。增加medh活性将提高对meoh的使用,促进meoh作为唯一碳源,降低生产成本,减少更昂贵的次要或共同碳源(例如葡萄糖)的用量,增加产物产量,并提供更快的meoh利用速度。
技术实现要素:
8.本发明涉及包括甲醇脱氢酶活性和至少一种促进甲醛固定的其他活性的融合蛋白。例如,所述融合体可以包括促进甲醇转化为甲醛然后从甲醛转化为磷酸酮糖(如己酮糖6-磷酸或果糖-6-磷酸)的活性。可选地,例如,所述融合体可以包括促进甲醇转化为甲醛,然后从甲醛转化为二羟基丙酮(dha)和甘油-3-磷酸(g3p),然后转化为果糖-6-磷酸的活性。本发明还涉及表达这种融合蛋白的工程细胞,以及具有异源甲醇脱氢酶与促进甲醛固
定的融合蛋白组合的工程细胞。通过甲醇脱氢酶融合体表达增加和/或通过使用活性变体、或通过融合增加甲醛固定成酮磷酸化合物的效率,工程细胞可以显示增加的甲醇吸收。尽管这促进了甲醛形成的增加,但是因为融合蛋白中由于酶活性的局限,甲醛更快地固定到磷酸酮糖化合物例如己酮糖6-磷酸或果糖-6-磷酸或dha和g3p中。因此,不会在细胞内积聚甲醛不良水平并对生长造成不利影响。
9.此外,酮糖磷酸化合物或dha和g3p的通量和形成可增加,提供糖酵解途径的前体。反过来,增加的糖酵解可以增加随后的中间化合物如甘油3-磷酸,丙酮酸和乙酰-coa。这些中间体化合物可以用于形成所需(目标)生物产品的产物途径,例如丁二醇(bdo)如1,3-丁二醇(1,3-bdo)和1,4-丁二醇(1,4-bdo),4-羟基丁酸(4-hb)、丁二烯、6-氨基己酸(6aca)、六亚甲基二胺(hmda)、己二酸、巴豆醇、甲基乙烯基甲醇、3-丁烯-1-醇、1,2-丙二醇(丙烯乙二醇)、正丙醇、1,3-丙二醇,等。因此,融合体可以在天然具有所述产物途径的细胞中表达,或者经工程化表达融合蛋白的细胞可以进一步工程化,以包括用于使用因表达本公开的融合蛋白而可用量增加的中间产物的目标产物途径酶。
10.本发明的融合蛋白提高了微生物在作为碳源的甲醇上生长的能力。使用甲醇途径融合体的在甲醇上生长的提高,可能是由于融合体提供了几种益处:1)由于融合hps的局部存在,甲醛(medh反应的潜在毒性产物)快速转化成己糖-6-磷酸(或可选地dha和g3p);2)甲醇途径中融合蛋白的效率增加减少了甲醇有效利用所需的总甲醇途径蛋白的量;3)甲醇途径融合蛋白的存在将反应向前推进甲醇利用方面所需的方向。
11.在实施例中,本发明提供了融合蛋白,其包括:(1a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,和(1b)第二区域,其包含3-己酮糖-6-磷酸脱氢酶或其酶促活性部分;(2a)第一区域,其包含甲醇脱氢酶或其酶活性部分的,(2b)第二区域,其包含3-己酮糖-6-磷酸脱氢酶或其酶促活性部分的;和(2c)第三区域,其包含甲醇脱氢酶活化剂或其酶促活性部分;(3a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,和(3b)第二区域,其包含6-磷酸-3-己酮糖异构酶或其酶促活性部分;(4a)第一区域,其包含甲醇脱氢酶或其酶活性部分,(4b)第二区域,其包含3-己酮糖-6-磷酸脱氢酶或其酶促活性部分;和(4c)第三区域,其包含甲醇脱氢酶活化剂或其酶促活性部分;(5a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,(5b)第二区域,其包含3-己酮糖-6-磷酸脱氢酶或其酶促活性部分;和(5c)第三区域,其包含6-磷酸-3-己酮糖异构酶或其酶促活性部分;或(6a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,(6b)第二区域,其包含3-己酮糖-6-磷酸脱氢酶或其酶促活性部分;(6c)第三区域,其包含6-磷酸-3-己酮糖异构酶或其酶促活性部分;以及(6d)第四区域,其包含甲醇脱氢酶活化剂或其酶促活性部分;其中,所述融合蛋白可选地包含位于所述融合蛋白的第一、第二和第三区域中的两个或更多个之间的一个或多个接头氨基酸序列。
12.在针对具有一种或多种dha途径酶融合蛋白的medh的替代实施例中,本发明提供了融合蛋白,其包括:(7a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,和(7b)第二区域,其包含dha合成酶或其酶促活性部分;(8a)第一区域,其包含甲醇脱氢酶或其酶活性部分,(8b)第二区域,其包含dha合成酶或其酶促活性部分;和(8c)第三区域,其包含甲醇脱氢酶活化剂或其酶促活性部分的;(9a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,和(9b)第二区域,其包含f6p醛缩酶或其酶促活性部分的;(10a)第一区域,其包含甲醇脱氢酶或其酶促活性部分的,(10b)第二区域,其包含dha合成酶或其酶促活性部分;和(10c)第三
区域,其包含甲醇脱氢酶活化剂或其酶促活性部分的;(11a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,(11b)第二区域,其包含dha合成酶或其酶促活性部分;和(11c)第三区域,其包含f6p醛缩酶或其酶促活性部分;或(12a)第一区域,其包含甲醇脱氢酶或其酶促活性部分,(12b)第二区域,其包含dha合成酶或其酶促活性部分;(12c)第三区域,其包含f6p醛缩酶或其酶促活性部分;以及(12d)第四区域,其包含甲醇脱氢酶活化剂或其酶促活性部分;其中,所述融合蛋白可选地包含位于所述融合蛋白的第一、第二和第三区域中的两个或更多个之间的一个或多个接头氨基酸序列。
13.本发明的实施例还包括编码含medh的融合蛋白(1-6)或(7-12)的核酸,包含该核酸的表达构建体,包含含有medh的融合蛋白(1-6)或(7-12)的工程细胞,如包含表达融合蛋白(1-6)或(7-12)的外源核酸的工程细胞,以及产生包括培养所述工程细胞的目标产物或其中间体的方法,所述工程细胞包含含有medh融合蛋白(1-6)或(7-12)。
14.本发明还提供了融合蛋白,其中,甲醇脱氢酶被分成由3-己酮糖-6-磷酸脱氢酶、6-磷酸-3-己酮糖异构酶或/和甲醇脱氢酶活化剂中的至少一个区域分开的至少两个部分,或者可选地被dhas、f6p醛缩酶或/和甲醇脱氢酶活化剂的至少一个区域分开。在该实施例中,本发明提供了融合蛋白,其包括甲醇脱氢酶的第一和第二部分以及如下的一种或多种:位于甲醇脱氢酶的第一和第二部分之间的3-己酮糖-6-磷酸脱氢酶或其酶促活性部分、6-磷酸-3-己酮糖异构酶或其酶促活性部分,或甲醇脱氢酶活化剂或其酶促活性部分;或者可选地,在该实施例中,本发明提供了融合蛋白,其包括甲醇脱氢酶的第一和第二部分以及如下的一种或多种:dhas或其酶促活性部分、f6p醛缩酶或其酶促活性部分,或位于甲醇脱氢酶的第一和第二部分之间的甲醇脱氢酶活化剂或酶促部分。可选地,融合蛋白包含位于融合蛋白的第一、第二和第三区域中的两个或更多个之间的一个或多个接头氨基酸序列。
15.本发明的实施例还包括编码具有分裂medh序列的融合蛋白的核酸、包含该核酸的表达构建体、包含具有分裂medh序列的融合蛋白的工程细胞,例如包含表达融合蛋白的外源核酸的工程细胞,以及生产包括培养工程细胞的目标产物或其中间体的方法,所述工程化细胞包含具有分裂medh序列的融合蛋白。
16.本公开的其它实施例涉及从使用具有融合蛋白的工程细胞的方法而得到的目标产物所制成的产品。示例性的产品包括用目标生物产品制造的聚合物,例如由二醇目标产物与二酸结合制成的聚合物。
附图说明
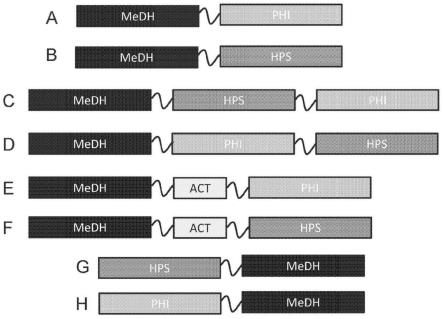
17.图1a-1f是具有位于蛋白质n端部分的medh区的融合蛋白的示意图。
18.图1g-1h是具有位于蛋白质c端部分的medh区的融合蛋白的示意图。
19.图2a-2h是具有位于蛋白质n端和c端部分之间的medh区的融合蛋白的示意图。
20.图3a-3c是具有在融合蛋白中分成两部分的medh区的融合蛋白的示意图。
21.图4a和4b是在用于形成果糖-6-磷酸的甲醇途径中的hps-phi和medh-hps-phi融合蛋白的示意图。
22.图5显示了替代甲醛同化途径(rump和dha)以及各自的可用于产品途径的代谢中间体。催化反应的酶是(1)甲醇脱氢酶,例如,ec 1.1.1,(2)己酮糖-6-磷酸合成酶,例如,ec 4.1.2.43,(3)6-磷酸-3-己酮糖异构酶,例如,ec 5.3.1.27,(6)dha(二羟基丙酮)合成酶,
例如,ec 2.2.1.3,(7)f6p(果糖-6-磷酸)醛缩酶,例如,ec 4.1.2,(8)dha激酶,例如,ec 2.7.1.121,(9)果糖二磷酸醛缩酶,例如,ec 4.1.2.13。本技术所述的融合体可以催化两种或更多种反应。
23.图6显示了示例性的目标产物途径,即1,4-bdo产物途径,其可以利用如本技术所公开的从甲醇同化获得的乙酰-coa。催化生物合成反应的酶有:(1)琥珀酰-coa合成酶;(2)非coa依赖性的琥珀酸半醛脱氢酶;(3)α-酮戊二酸脱氢酶;(4)谷氨酸:琥珀酸半醛转氨酶;(5)谷氨酸脱羧酶;(6)coa依赖性琥珀酸半醛脱氢酶;(7)4-羟基丁酸脱氢酶;(8)α-酮戊二酸脱羧酶;(9)4-羟基丁酰coa:乙酰-coa转移酶;(10)丁酸激酶;(11)磷酸转丁酰基酶;(12)醛脱氢酶;(13)醇脱氢酶。
24.图7a-7f是具有位于融合蛋白n端部分的medh区域的dha(二羟基丙酮)合成酶(dhas)或f6p(果糖-6-磷酸)醛缩酶(f6p ald)融合蛋白的示意图。图7g-7h是具有位于融合蛋白c端部分的medh区的融合蛋白的示意图。
25.图8a-8h是具有位于蛋白的c端和n端部分之间的medh区域的dha(二羟基丙酮)合成酶或f6p(果糖-6-磷酸)醛缩酶(f6p ald)融合蛋白的示意图。
26.图9a-9c是具有在融合蛋白中分裂为两部分的medh区域的dha(二羟基丙酮)合成酶(dhas)或f6p(果糖-6-磷酸)醛缩酶(f6p ald)融合蛋白的示意图。
27.图10a和10b是非融合(10a)和示例性融合(10b)medh-dhas-f6pald蛋白的形成果糖-6-磷酸的甲醇途径的对比示意图,所述medh-dhas-f6pald蛋白中发生的中间体(fald,dha,g3p)扩散较少。
具体实施方式
28.本技术中所述的实施例并不意在将本公开内容尽数穷举,或将其限制为以下详细描述中所公开的精确形式。相反,对实施例进行的选择和描述,是为了便于本领域技术人员可以理解和明白本说明书中的原理和实践。
29.本技术提及的所有出版物和专利在此通过引用方式并入本技术。本技术所公开的出版物和专利仅用于公开目的。本技术中的内容均不可解释为承认发明人没有先于任一出版物和/或专利的资格,包括本技术引用的任何出版物和/或专利。
30.在甲烷营养细菌中,由甲烷和甲醇氧化制成的甲醛用于在通路中形成代谢中间体,从而形成细胞产物(anthony,c.(1991)biotechnology 18:79-109)。丝氨酸和d-核酮糖-5-磷酸(rump)途径使用甲醛生产含碳中间体化合物,随后将其转化为其他下游产物。
31.rump途径己糖-6-磷酸合成酶(hps)酶促缩合甲醛和d-核酮糖-5-磷酸(rump)以形成己酮糖-6-磷酸(hump)。6-磷酸-3-己酮糖异构酶(hpi)将hump酶促转化为β-d-呋喃果糖6-磷酸(fmp)。hps和hpi是具有rump途径的天然有机体所独有的。对于每一个同化的甲醛分子,都会产生一个fmp分子。
32.然后可以通过两种途径中的任一种将fmp裂解成3-碳化合物。这些其他途径的酶并非专属于那些表达hps和hpi的甲烷营养细菌。
33.在一种途径中,6-磷酸果糖激酶(ec 2.7.1.11)将fmp磷酸化为1,6-二磷酸果糖(fdp)。然后果糖二磷酸醛缩酶(ec 4.1.2.13)将fdp裂解成二羟基丙酮磷酸(dhap)和甘油醛3-磷酸。
34.在另一途径中,葡萄糖-6-磷酸异构酶(ec 5.3.1.9)将fmp异构化为葡萄糖-6-磷酸(gmp)。然后葡萄糖-6-磷酸-1-脱氢酶(ec 1.1.1.49)将gmp脱氢为d-葡糖酸-1,5-内酯-6-磷酸,其被6-磷酸葡糖酸内酯酶(ec 3.1.1.31)进一步脱氢成6-磷酸葡糖酸。然后磷酸葡糖酸脱水酶(ec 4.2.1.12)将6-磷酸葡糖酸转化为2-酮-3-脱氧-6-磷酸-d-葡萄糖酸(kdpg)。随后,kdpg醛缩酶(ec 4.1.2.14)将kdpg裂解成甘油醛-3-磷酸和丙酮酸。通过该途径形成的丙酮酸和dhap可用于合成生物分子的细胞途径。
35.在本公开的工程细胞中,甲醇消耗最低需要三种基因的异源表达:甲醇脱氢酶(medh)、3-己酮糖-6-磷酸脱氢酶(hps或rmpa)和6-磷酸-3-己酮糖异构酶(phi或rmpb)。在另一个实施例中,本公开的工程细胞,甲醇消耗最低需要三种基因异源表达:甲醇脱氢酶(medh)、dha(二羟基丙酮)合成酶(dhas)和f6p(果糖-6-磷酸)醛缩酶(f6p ald)(例如,参见图5的dha途径)或可选地,优选级较低地,medh、dha(二羟基丙酮)合成酶和dha激酶可选地与果糖二磷酸醛缩酶(图5,dha途径2)。medh蛋白催化甲醇和甲醛的相互转化。如本技术所述,hps蛋白催化甲醛和d-核酮糖-5-磷酸之间的键形成,形成己酮糖-6-磷酸,且phi蛋白催化己糖-6-磷酸向果糖-6-磷酸的异构化,所述果糖-6-磷酸是糖酵解的中间体。此外,辅助蛋白medh活化剂(act)的存在可以提高medh的活性并改善甲醇摄取。人们普遍认识到,这种异源途径的活性限制了非天然有机体消耗甲醇和以甲醇作为碳源生长的能力。与将有机体转化为甲基营养有关的问题之一是medh产物甲醛的潜在毒性积聚。
36.本公开的融合蛋白提供了通过提高使用甲醛和d-核酮糖-5-磷酸作为底物的hps反应的效率,以避免甲醛不良累积的方法,从而形成己糖-6-磷酸。hps效率的提高可以例如通过medh和hps的共同局部化来完成,因此hps可以轻松获得更高局部浓度的甲醛。具有dha途径1或途径2的一种或多种酶的medh融合蛋白,通过提高使用甲醛和木酮糖-5-磷酸的dha合成酶的反应效率,来避免甲醛不良积累,并形成dha和g3p。也获得了提高的甲醇利用速率。
37.通常,本公开提供的融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性。通常,在另一个实施例中,本公开提供的融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)dha合成酶活性和/或果糖-6-磷酸醛缩酶活性;或在又一个实施例中,至少具有(i)甲醇脱氢酶活性和(ii)dha合成酶活性和/或dha激酶活性。融合蛋白还可以包括甲醇脱氢酶活化剂活性。因此,本公开的融合蛋白可以包括两个、三个或四个或更高个区域,每个区域提供不同的活性。这些区域可以包括酶的完整(例如,天然)序列,或者可以包括其活性部分。可选地,融合蛋白中的一个区域可用与另一个区域通过一个或多个接头序列连接。
38.甲醇脱氢酶活性、3-己酮糖-6-磷酸脱氢酶活性、6-磷酸-3-己酮糖异构酶活性和甲醇脱氢酶活化剂活性可通过甲醇脱氢酶、3-己酮糖-6-磷酸脱氢酶、6-磷酸-3
‑‑
己酮糖异构酶活性,以及甲醇脱氢酶活化酶及其活性部分提供,包括本领域已知的那些多肽序列以及本技术所述的多肽序列。甲醇脱氢酶活性、dha合成酶、f6p醛缩酶和dha激酶活性以及甲醇脱氢酶活化剂活性,可通过甲醇脱氢酶、dha合成酶、f6p醛缩酶和dha激酶以及甲醇脱氢酶活化剂酶及其活性部分提供,包括本领域已知的那些多肽序列以及本技术所述的多肽序列。在示例性融合蛋白图中,首字母缩略词“medh”可以表示具有甲醇脱氢酶活性的多肽区域;首字母缩略词“hps”可以表示具有3-己酮糖-6-磷酸脱氢酶活性的多肽区域;首字母缩
略词“phi”可以表示具有6-磷酸-3-己酮糖异构酶活性的多肽区域;而首字母缩略词“act”可以表示具有甲醇脱氢酶活化剂活性的多肽区域。首字母缩略词“dhas”可以表示具有dha合成酶活性的多肽区域;首字母缩略词“f6pald”可以表示具有f6p醛缩酶活性的多肽区域;首字母缩略词“dhak”可以表示具有dha激酶活性的多肽区域。融合蛋白可以包括位于融合蛋白的多肽区域之间的一个或多个多肽接头。
39.本技术描述了编码融合蛋白的核酸以及包括该核酸的表达构建体。
40.本技术还描述了:表达该融合蛋白的工程细胞,其可选地包括一种或多种额外的代谢途径转基因、甲醇代谢途径基因和/或目标产物途径基因;包括所述细胞的细胞培养物组合物;用于提高所述目标产物或其中间体的细胞生产的方法;包括所述目标产物或其中间体的组合物;和从所述目标产物或其中间体制得的产物。
41.术语“非天然存在的”用于生物体(例如,微生物)时,是指该生物体具有至少一个通常不存在于所称物种的天然存在生物体中的基因改变。天然存在的生物体可以称为“野生型”,例如所称物种的野生型菌株。同样地,“非天然的”多肽或核酸,可以包括至少一个通常不会存在于天然存在的多肽或核酸中的基因改变。本公开的融合蛋白被认为是非天然多肽。天然存在的生物体、核酸和多肽可以称为“野生型”或“原始的”,例如所称物种的野生型菌株。同样地,存在于野生型生物体中的任何氨基酸位置的氨基酸可以称为“原始的”。
42.使生物体变得非天然的基因改变可以包括例如如下修饰:引入编码代谢多肽的可表达核酸,其它核酸添加、核酸删除和/或对生物体遗传物质的其它功能破坏。这样的修饰包括,例如,所称物种的异源、同源或异源和同源的多肽的编码区和功能片段。其他的修饰包括,例如,非编码调节区,其中所述修饰改变了基因或操纵子的表达。
43.在融合蛋白中,相对于具有甲醇脱氢酶活性(medh)的多肽,具有3-己酮糖-6-磷酸脱氢酶活性(hps)、6-磷酸-3-己酮糖异构酶活性(phi)和甲醇脱氢酶活化剂活性(act)区域的位置,可以相对于融合蛋白的氨基(n)和/或羧基(c)末端来说明。在另一个实施例中,相对于具有甲醇脱氢酶活性(medh的多肽),所述融合蛋白的具有dhas、f6p ald(或dhak)和甲醇脱氢酶活化剂活性(act)的区域的位置,可以相对于融合蛋白的氨基(n)和/或羧基(c)末端来说明。例如,根据需要,融合蛋白的区域可以相对于彼此被描述为在融合蛋白的“蛋白n端部分”或“蛋白c端部分”。根据需要,融合蛋白的区域也可以描述为“从(融合蛋白的)n端向内延伸”或“从(融合蛋白的)c端向内延伸”。融合蛋白的一些区域可以描述为“位于蛋白的一个区域和n端部分之间”、“位于蛋白的一个区域和c端部分之间”,或“位于蛋白的n端部分和蛋白的c端部分之间”。
44.在多个实施例中,融合蛋白的n端和c端部分可以包括medh、hps、phi或act区域,或者可选地包括medh、dhas、f6p ald(或dhak)或act区域,可以可选地根据从融合蛋白的n端或c端向内延伸的氨基酸残基的数目来描述。例如,融合蛋白的n端和c端部可分别从融合蛋白的n或c端向内包含至多50、75、100、125、150、175、200、225、250、275、300、325、350、375、400、425、450、475或500个氨基酸。同样,n端和c端部分之间的一个或多个区域可以包含medh、hps、phi或act区域中的一个或多个,并且可根据氨基酸残基的量来描述。例如,n端和c端部分之间的融合蛋白的区域可包含至多50、75、100、125、150、175、200、225、250,、275、300、325、350、375、400、425、450、475或500个氨基酸。
45.本公开的实施例包括但不限于以下融合蛋白结构:(a)具有medh区和phi区的融合
蛋白,其中phi区在medh区和融合蛋白的c端之间;(b)具有medh区和hps区的融合蛋白,其中hps区位于medh区和融合蛋白的c端之间;(c)具有medh区和phi区的融合蛋白,其中phi区位于medh区和融合蛋白的n端之间;(d)具有medh区和hps区的融合蛋白,其中hps区位于medh区和融合蛋白的n端之间;(e)具有medh、hps和phi区的融合蛋白,其中medh区位于hps和phi区之间,并且其中phi区位于medh区和融合蛋白的n端之间,并且其中hps区是在medh区域和融合蛋白的c端之间;(f)具有medh、hps和phi区的融合蛋白,其中medh区位于hps和phi区之间,并且其中hps区位于medh区和融合蛋白的n端之间,并且其中phi区是在medh区和融合蛋白的c端之间;(g)具有medh、hps和phi区的融合蛋白,其中hps区位于medh和phi区之间,其中medh区位于hps区和融合蛋白的n端之间,并且其中phi区是在hps区和融合蛋白的c端之间;(h)具有medh、hps和phi区的融合蛋白,其中hps区在medh和phi区之间,并且其中phi区在hps区和融合蛋白的n端之间,并且其中medh区在融合蛋白的hps区域和c端之间;以及(i)具有act、medh、hps和phi区的融合蛋白,其中medh和hps区位于act和phi区之间,并且其中act位于medh区和融合蛋白的n端之间,并且其中phi区位于hps区和融合蛋白的c端之间。接头序列可以存在于(a)-(i)的融合蛋白的任何一个或多个区域之间。
46.例如,图1a是具有从n端延伸的medh区和从c端延伸的phi区的融合蛋白的示意图。这种融合蛋白可称为medh-phi。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为medh-l
1-phi。
47.作为另一个实施例,图1b是具有位于蛋白n端部分的medh区和位于蛋白质c端部分的hps区域的融合蛋白的示意图。这种融合蛋白可称为medh-hps。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为medh-l
1-hps。
48.作为另一个实施例,图1c是具有位于蛋白n端部分的medh区和位于蛋白质c端部分的phi区以及位于medh和phi区之前的hps区的融合蛋白的示意图。这种融合蛋白可称为medh-hps-phi。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-hps-phi、medh-hps-l
1-phi或medh-l
1-hps-l
2-phi。
49.作为另一个实施例,图1d是具有位于蛋白n端部分的medh区和位于蛋白c端部分的hps区以及位于medh和hps之间的phi区的融合蛋白的示意图。这种融合蛋白可称为medh-phi-hps。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-phi-hps、medh-phi-l
1-hps或medh-l
1-phi-l
2-hps。
50.作为另一个实施例,图1e是具有位于蛋白n端部分的medh区和位于蛋白c端部分的phi区以及位于medh和phi之间的act区的融合蛋白的示意图。这种融合蛋白可称为medh-act-phi。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-act-phi、medh-act-l
1-phi或medh-l
1-act-l
2-phi。
51.作为另一个实施例,图1f是具有位于蛋白n端部分的medh区和位于蛋白c端部分的hps区以及位于medh和hps之间的act区的融合蛋白的示意图。这种融合蛋白可称为medh-act-hps。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-act-hps、medh-act-l
1-hps或medh-l
1-act-l
2-hps。
52.作为另一个实施例,图1g是具有位于蛋白c端部分的medh区和位于蛋白质n端部分的hps区的融合蛋白的示意图。这种融合蛋白可称为hps-medh。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为hps-l
1-medh。
53.作为另一个实施例,图1h是具有位于蛋白c端部分的medh区和位于蛋白n端部分的phi区的融合蛋白的示意图。这种融合蛋白可称为phi-medh。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为phi-l
1-medh。
54.在其他实施例中,medh位于两个其他氨基酸序区域之间。作为另一个实施例,图2a是具有位于蛋白n端部分的hps区和位于蛋白c端部分的phi区以及位于hps和phi之间的medh区的融合蛋白的示意图。这种融合蛋白可称为hps-medh-phi。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为hps-medh-l
1-phi、hps-l
1-medh-phi或hps-l
1-medh-l
2-phi。
55.作为另一个实施例,图2b是具有位于蛋白n端部分的phi区和位于蛋白c端部分的hps区以及位于phi和hps之间的medh区的融合蛋白的示意图。这种融合蛋白可称为phi-medh-hps。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为phi-medh-l
1-hps、phi-l
1-medh-hps或phi-l
1-medh-l
2-hps。
56.作为另一个实施例,图2c是具有位于蛋白n端部分的phi区和位于蛋白c端部分的act区以及位于phi和act之间的medh区的融合蛋白的示意图。这种融合蛋白可称为phi-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为phi-medh-l
1-act、phi-l
1-medh-act或phi-l
1-medh-l
2-act。
57.作为另一个实施例,图2d是具有位于蛋白n端部分的hps区和位于蛋白c端部分的act区以及位于hps和act之间的medh区的融合蛋白的示意图。这种融合蛋白可称为hps-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为hps-medh-l
1-act、hps-l
1-medh-act或hps-l
1-medh-l
2-act。
58.作为另一个实施例,图2e是具有位于蛋白n端部分的act区和位于蛋白c端部分的phi区以及位于act和phi之间的medh和hps区的融合蛋白的示意图,且所述medh更接近act区,所述hps更接近phi区。这种融合蛋白可称为act-medh-hps-phi。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为act-l
1-medh-hps-phi、act-medh-l
1-hps-phi、act-medh-hps-l
1-phi、act-l
1-medh-l
2-hps-phi、act-l
1-medh-hps-l
2-phi、act-medh-l
1-hps-l
2-phi和act-l
1-medh-l
2-hps-l
3-phi。
59.作为另一个实施例,图2f是具有位于蛋白n端部分的act区和位于蛋白c端部分的hps区以及位于act和hps之间的medh和hps区的融合蛋白的示意图,且所述medh更接近act区,所述phi更接近hps区。这种融合蛋白可称为act-medh-phi-hps。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为act-l
1-medh-phi-hps、act-medh-l
1-phi-hps、act-medh-phi-l
1-hps、act-l
1-medh-l
2-phi-hps、act-l
1-medh-phi-l
2-hps、act-medh-l
1-phi-l
2-hps和act-l
1-medh-l
2-phi-l
3-hps。
60.作为另一个实施例,图2g是具有位于蛋白n端部分的hps区和位于蛋白c端部分的act区以及位于hps和act之间的phi和medh区的融合蛋白的示意图,且所述phi更接近hps区,所述medh更接近act区。这种融合蛋白可称为hps-phi-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为hps-l
1-phi-medh-act、hps-phi-l
1-medh-act、hps-phi-medh-l
1-act、hps-l
1-phi-l
2-medh-act、hps-l
1-phi-medh-l
2-act、hps-phi-l
1-medh-l
2-act和hps-l
1-phi-l
2-medh-l
3-act。
61.作为另一个实施例,图2h是具有位于蛋白n端部分的phi区和位于蛋白c端部分的
act区以及位于phi和act之间的hps和medh区的融合蛋白的示意图,且所述hps更接近phi区,所述medh更接近act区。这种融合蛋白可称为phi-hps-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为phi-l
1-hps-medh-act、phi-hps-l
1-medh-act、phi-hps-medh-l
1-act、phi-l
1-hps-l
2-medh-act、phi-l
1-hps-medh-l
2-act、phi-hps-l
1-medh-l
2-act和phi-l
1-hps-l
2-medh-l
3-act。
62.在其他实施例中,在融合蛋白中,甲醇脱氢酶被氨基酸序列的至少一个不同区域(例如phi或hps区)中断。例如,核酸将编码框内具有以medh、phi或hps区为第一部分,然后具有以medh为第二部分的多肽。尽管medh序列被中断,但融合蛋白仍保持甲醇脱氢酶活性。
63.例如,图3a是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的medh的第一部分、位于蛋白c端部分的medh的第二部分以及第一和第二甲醇脱氢酶部分之间的phi区。这种融合蛋白可以被称为medh(p1)-phi-medh(p2)。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh(p1)-l
1-phi-medh(p2)、medh(p1)-phi-l
1-medh(p2)或medh(p1)-l
1-phi-l
2-medh(p2)。
64.作为另一个实施例,图3b是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的medh的第一部分、位于蛋白c端部分的medh的第二部分以及第一和第二medh部分之间的hps和phi区,所述hps更接近medh的第一部分,所述phi更接近medh的第二部分。这种融合蛋白可称为medh(p1)-hps-phi-medh(p2)。可选地,如果多肽接头位于不同部分和区域之间,则称融合蛋白为medh(p1)-l
1-hps-phi-medh(p2)、medh(p1)-hps-l
1-phi-medh(p2)、medh(p1)-hps-phi-l
1-medh(p2)、medh(p1)-l
1-hps-l
2-phi-medh(p2)、medh(p1)-l
1-hps-phi-l
2-medh(p2)、medh(p1)-hps-l
1-phi-l
2-medh(p2)或medh(p1)-l
1-hps-l
2-phi-l
3-medh(p2)。
65.作为另一个实施例,图3c是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的act区、位于蛋白c端部分的medh的第二部分以及act区和medh的第二部分之间的meoh的第一部分和hps区,所述hps在第一和第二medh部分。这种融合蛋白可称为act-medh(p1)-hps-medh(p2)。可选地,如果多肽接头位于不同部分和区域之间,则称融合蛋白为act-l
1-medh(p1)-hps-medh(p2)、act-medh(p1)-l
1-hps-medh(p2)、act-medh(p1)-hps-l
1-medh(p2)、act-l
1-medh(p1)-l
2-hps-medh(p2)、act-medh(p1)-l
1-hps-l
2-medh(p2)、act-l
1-medh(p1)-hps-l
2-medh(p2)或act-l
1-medh(p1)-l
2-hps-l
3-medh(p2)。
66.本公开的另外的实施例包括但不限于medh与一种或多种dha途径酶的以下融合蛋白结构:(a)具有medh区和dhas区的融合蛋白,其中dhas区在medh区和融合蛋白的c端之间;(b)具有medh区和f6pald区(或者写作“f6p ald”)的融合蛋白,其中f6pald区位于medh区和融合蛋白的c端之间;(c)具有medh区和dhas区的融合蛋白,其中dhas区位于medh区和融合蛋白的n端之间;(d)具有medh区和f6pald区的融合蛋白,其中f6pald区位于medh区和融合蛋白的n端之间;(e)具有medh、f6pald和dhas区的融合蛋白,其中medh区位于dhas和f6pald区之间,并且其中dhas区位于medh区和融合蛋白的n端之间,并且其中f6pald区是在medh区和融合蛋白的c端之间;(f)具有medh、f6pald和dhas区的融合蛋白,其中medh区位于f6pald和dhas区之间,并且其中f6pald区位于medh区和融合蛋白的n端之间,并且其中dhas区是在medh区和融合蛋白的c端之间;(g)具有medh、f6pald和dhas区的融合蛋白,其中f6pald区位于medh和dhas区之间,其中medh区位于f6pald区和融合蛋白的n端之间,并且其中dhas区是
在f6pald区和融合蛋白的c端之间;(h)具有medh、f6pald和dhas区域的融合蛋白,其中f6pald区在medh和dhas区之间,并且其中dhas区在f6pald区和融合蛋白的n端之间,并且其中medh区域是在f6pald区和融合蛋白的c端之间;以及(i)具有act、medh、f6pald和dhas区的融合蛋白,其中medh和f6pald区位于act和dhas区之间,并且其中act位于medh区和融合蛋白的n端之间,并且其中dhas区位于f6pald区和融合蛋白的c端之间。接头序列可以存在于(a)-(i)的融合蛋白的任何一个或多个区域之间。
67.例如,图7a是具有从n端延伸的medh区和从c端延伸的dhas区的融合蛋白的示意图。这种融合蛋白可称为medh-dhas。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为medh-l
1-dhas。
68.作为另一个实施例,图7b是具有位于蛋白n端部分的medh区域和位于蛋白质c端部分的f6pald区域的融合蛋白的示意图。这种融合蛋白可称为medh-f6pald。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为medh-l
1-f6pald。
69.作为另一个实施例,图7c是具有位于蛋白n端部分的medh区和位于蛋白c端部分的dhas区以及位于medh和dhas之间的f6pald区的融合蛋白的示意图。这种融合蛋白可称为medh-f6pald-dhas。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-f6pald-dhas、medh-f6pald-l
1-dhas或medh-l
1-f6pald-l
2-dhas。
70.作为另一个实施例,图7d是具有位于蛋白n端部分的medh区和位于蛋白c端部分的f6pald区以及位于medh和f6pald之间的dhas区的融合蛋白的示意图。这种融合蛋白可称为medh-dhas-f6pald。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-dhas-f6pald、medh-dhas-l
1-f6pald或medh-l
1-dhas-l
2-f6pald。
71.作为另一个实施例,图7e是具有位于蛋白n端部分的medh区和位于蛋白c端部分的dhas区以及位于medh和dhas之间的act区的融合蛋白的示意图。这种融合蛋白可称为medh-act-hps。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-act-dhas、medh-act-l
1-dhas或medh-l
1-act-l
2-dhas。
72.作为另一个实施例,图7f是具有位于蛋白n端部分的medh区和位于蛋白质c端部分的f6pald区以及位于medh和f6pald之间的act区的融合蛋白的示意图。这种融合蛋白可称为medh-act-f6pald。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-act-f6pald、medh-act-l
1-f6pald或medh-l
1-act-l
2-f6pald。
73.作为另一个实施例,图7g是具有位于蛋白c端部分的medh区和位于蛋白n端部分的f6pald区的融合蛋白的示意图。这种融合蛋白可称为f6pald-medh。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为f6pald-l
1-medh。
74.作为另一个实施例,图7h是具有位于蛋白c端部分的medh区和位于蛋白n端部分的dhas区的融合蛋白的示意图。这种融合蛋白可称为dhas-medh。可选地,如果多肽接头位于两个区域之间,则称融合蛋白为dhas-l
1-medh。
75.在其他实施例中,medh位于两个其他氨基酸序列的区域之间。作为另一个实施例,图8a是具有位于蛋白n端部分的f6pald区和位于蛋白c端部分的dhas区以及位于f6pald和dhas之间的medh区的融合蛋白的示意图。这种融合蛋白可称为f6pald-medh-dhas。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为f6pald-medh-l
1-dhas、f6pald-l
1-medh-dhas或f6pald-l
1-medh-l
2-dhas。
76.作为另一个实施例,图8b是具有位于蛋白n端部分的dhas区和位于蛋白c端部分的f6pald区以及位于dhas和f6pald之间的medh区的融合蛋白的示意图。这种融合蛋白可称为dhas-medh-f6pald。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh-l
1-f6pald、dhas-l
1-medh-f6pald或dhas-l
1-medh-l
2-f6pald。
77.作为另一个实施例,图8c是具有位于蛋白n端部分的dhas区和位于蛋白c端部分的act区以及位于dhas和act之间的medh区的融合蛋白的示意图。这种融合蛋白可称为dhas-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为dhas-medh-l
1-act、dhas-l
1-medh-act或dhas-l
1-medh-l
2-act。
78.作为另一个实施例,图8d是具有位于蛋白n端部分的f6pald区和位于蛋白c端部分的act区以及位于f6pald和act之间的medh区的融合蛋白的示意图。这种融合蛋白可称为f6pald-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为f6pald-medh-l
1-act、f6pald-l
1-medh-act或f6pald-l
1-medh-l
2-act。
79.作为另一个实施例,图8e是具有位于蛋白n端部分的act区和位于蛋白c端部分的dhas区以及位于act和dhas之间的medh和f6pald区的融合蛋白的示意图,且所述medh更接近act区,所述f6pald更接近dhas区。这种融合蛋白可称为act-medh-f6pald-dhas。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为act-l
1-medh-f6pald-dhas、act-medh-l
1-f6pald-dhas、act-medh-f6pald-l
1-dhas、act-l
1-medh-l
2-f6pald-dhas、act-l
1-medh-f6pald-l
2-dhas、act-medh-l
1-f6pald-l
2-dhas和act-l
1-medh-l
2-f6pald-l
3-dhas。
80.作为另一个实施例,图8f是具有位于蛋白n端部分的act区和位于蛋白c端部分的f6pald区以及位于act和f6pald之间的medh和dhas区的融合蛋白的示意图,且所述medh更接近act区,所述dhas更接近f6pald区。这种融合蛋白可称为act-medh-dhas-f6pald。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为act-l
1-medh-dhas-f6pald、act-medh-l
1-dhas-f6pald、act-medh-dhas-l
1-f6pald、act-l
1-medh-l
2-dhas-f6pald、act-l
1-medh-dhas-l
2-f6pald、act-medh-l
1-dhas-l
2-f6pald和act-l
1-medh-l
2-dhas-l
3-f6pald。
81.作为另一个实施例,图8g是具有位于蛋白n端部分的f6pald区和位于蛋白c端部分的act区以及位于f6pald和act之间的dhas和medh区的融合蛋白的示意图,且所述dhas更接近f6pald区,所述medh更接近act区。这种融合蛋白可称为f6pald-dhas-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为f6pald-l
1-dhas-medh-act、f6pald-dhas-l
1-medh-act、f6pald-dhas-medh-l
1-act、f6pald-l
1-dhas-l
2-medh-act、f6pald-l
1-dhas-medh-l
2-act、f6pald-dhas-l
1-medh-l
2-act和f6pald-l
1-dhas-l
2-medh-l
3-act。
82.作为另一个实施例,图8h是具有位于蛋白n端部分的dhas区和位于蛋白c端部分的act区以及位于dhas和act之间的f6pald和medh区的融合蛋白的示意图,且所述f6pald更接近dhas区,所述medh更接近act区。这种融合蛋白可称为dhas-f6pald-medh-act。可选地,如果多肽接头位于不同区域之间,则称融合蛋白为dhas-l
1-f6pald-medh-act、dhas-f6pald-l
1-medh-act、dhas-f6pald-medh-l
1-act、dhas-l
1-f6pald-l
2-medh-act、dhas-l
1-f6pald-medh-l
2-act、dhas-f6pald-l
1-medh-l
2-act和dhas-l
1-f6pald-l
2-medh-l
3-act。
83.在其他实施例中,在融合蛋白中,甲醇脱氢酶被氨基酸序列的至少一个不同区域(例如dhas或f6pald区)中断。例如,核酸将编码框内具有medh和dhas和/或f6pald区的第一部分,然后具有medh的第二部分的多肽。尽管medh序列被中断,但融合蛋白仍保持甲醇脱氢
酶活性。
84.例如,图9a是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的medh的第一部分、位于蛋白c端部分的medh的第二部分以及在第一和第二甲醇脱氢酶部分之间的dhas区,且dhas区与第一和第二甲醇脱氢酶部分在框内。这种融合蛋白可以被称为medh(p1)-dhas-medh(p2),可选地,如果多肽接头位于不同区域之间,则称融合蛋白为medh(p1)-l
1-dhas-medh(p2)、medh(p1)-dhas-l
1-medh(p2)或medh(p1)-l
1-dhas-l
2-medh(p2)。
85.作为另一个实施例,图9b是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的medh的第一部分、位于蛋白c端部分的medh的第二部分以及第一和第二medh部分之间的f6pald和dhas区,且所述dhas更接近medh的第一部分,所述f6pald更接近medh的第二部分。这种融合蛋白可称为medh(p1)-dhas-f6pald-medh(p2)。可选地,如果多肽接头位于不同部分和区域之间,则称融合蛋白为medh(p1)-l
1-dhas-f6pald-medh(p2)、medh(p1)-dhas-l
1-f6pald-medh(p2)、medh(p1)-dhas-f6pald-l
1-medh(p2)、medh(p1)-l
1-dhas-l
2-f6pald-medh(p2)、medh(p1)-l
1-dhas-f6pald-l
2-medh(p2)、medh(p1)-dhas-l
1-f6pald-l
2-medh(p2)或medh(p1)-l
1-dhas-l
2-f6pald-l
3-medh(p2)。
86.作为另一个实施例,图9c是融合蛋白的示意图,该融合蛋白具有位于蛋白n端部分的act区、位于蛋白c端部分的medh的第二部分以及act区和medh的第二部分之间的meoh的第一部分和f6pald区,所述f6pald在第一和第二medh部分之间。这种融合蛋白可称为act-medh(p1)-f6pald-medh(p2)。可选地,如果多肽接头位于不同部分和区域之间,则称融合蛋白为act-l
1-medh(p1)-f6pald-medh(p2)、act-medh(p1)-l
1-f6pald-medh(p2)、act-medh(p1)-f6pald-l
1-medh(p2)、act-l
1-medh(p1)-l
2-f6pald-medh(p2)、act-medh(p1)-l
1-f6pald-l
2-medh(p2)或act-l
1-medh(p1)-f6pald-l
2-medh(p2)。
87.在本技术上文和其它地方特别考虑的融合蛋白实施例中,dha激酶(dhak)取代f6p醛缩酶。
88.表1包括预测为卷曲二级结构的medh序列甲醇芽孢杆菌(bacillus methanolicus)mga3 medh(seq id no:1)中的氨基酸结构域列表。这些结构域代表用于分裂medh序列和插入另一个开放阅读框(具有或不具有侧翼接头序列)的位点,如图3a-3c所示。例如,对应于甲醇芽孢杆菌mga3 medh(seq id no:1)中的氨基酸139-146的序列agtgsett,代表具有预测卷曲的第一结构域。本公开的融合蛋白可以具有在该结构域内任何位置存在的medh序列中具有分裂,并且插入选自phi、hps和act或者dhas、f6pa1d(或者可选地dhak)和act中的一个或多个序列的序列。例如,对于该结构域,medh序列可以在氨基酸139和140、140和141、141和142、142和143、143和144、144和145或145-146之间分裂。
89.表1
90.类型序列氨基酸位置卷曲agtgsett139-146卷曲gipsgy334-339卷曲hstgl42-46卷曲aqpdp67-71卷曲gsshd97-101卷曲vnsv122-125
卷曲ipp7-9卷曲itp167-169
91.任何medh的二级结构都可以使用emboss(emboss:the european molecular biology open software suite(2000)rice,p.longden,i.and bleasby,a.trends in genetics 16,(6)pp276—277)进行预测。构成预测卷曲的残基(不存在于任何构象如螺旋、转角或片层中的残基)被认为是可以分裂medh序列并插入第二个开放阅读框的位点。
92.本发明的实施例包括具有提供甲醇脱氢酶(medh)活性的氨基酸序列的区域的融合蛋白。在融合蛋白中,medh氨基酸序列可以基于全长蛋白质序列、部分序列(例如具有n和/或c端删除的部分序列)或变体序列(例如具有一个或多个与野生型序列不同的氨基酸取代的变体序列)。
93.在一些实施例中,融合蛋白具有甲醇脱氢酶的第一和第二部分,所述甲醇脱氢酶被不同于甲醇脱氢酶的另一氨基酸序列中断,例如3-己酮糖-6-磷酸脱氢酶或6-磷酸-3-己酮糖异构酶(或备选dhas或f6pa1d;或进一步备选dhas或dhak中)氨基酸序列或其酶促活性部分、或甲醇脱氢酶活化剂或其酶促活性部分,其位于甲醇脱氢酶的第一和第二部分之间。
94.融合蛋白可以包括基于来自甲醇芽孢杆菌mga3(genbank登录号eij77596.1,gi号:387585261;本技术命名为medh 2315,长度为382个氨基酸;seq id no:1)的nad(p) 依赖性甲醇脱氢酶的多肽序列。medh 2315在文献中报道为来自甲醇芽孢杆菌mga3的nad(p)依赖性甲醇脱氢酶,且其序列记载于brautaset et al.,“plasmid-dependent methylotrophy in thermotolerant bacillus methanolicus”,journal of bacteriology,vol.186,pp1229-1238(2004)。它还在brautaset的wo2013/110797中称为medh mga3,并在krog等人的“methylotrophic bacillus methanolicus encodes two chromosomal and one plasmid born nad dependent mathanol dehydrogenase paralogs with different catalytic and biochemical properties”,plos one,pp.1-11,(2013)中称为medh“m”,其报道了另外的野生型芽孢杆菌medh。seq id no:2是编码seq id no:1的核酸序列。
95.本公开的融合蛋白可以可选地具有与甲醇芽孢杆菌mga3(seq id no:1)少于100%一致性的甲醇脱氢酶序列。例如,融合多肽中的甲醇脱氢酶区域可以与seq id no:1具有50%或更高、60%或更高、70%或更高、80%或更高、85%或更高、90%或更高、95%或更高、96%或多、97%或更高、98%或更高或99%或更高一致性。
96.在一些情况下,可以通过seq id no:1与其他已知的甲醇脱氢酶或醇脱氢酶的序列比对来产生与seq id no:1一致性低于100%的变体,以鉴定是保守的和/或对于蛋白的酶促功能重要的区域。一旦鉴定出这些区域,可以在这些保守区域之外的一个或多个氨基酸位置对甲醇脱氢酶进行修饰。因此,融合蛋白的甲醇脱氢酶区域可以具有一个或多个氨基酸取代、删除或添加,这些氨基酸取代、删除或添加导致序列与天然甲醇脱氢酶不同,同时保留某些序列特征。表2是各种甲醇脱氢酶(包括甲醇芽孢杆菌mga3 medh(seq id no:1))的成对序列一致性的表。
97.表2
98.[0099][0100]
1:eij77596.1
[0101]
2:eij83020.1
[0102]
在其他情况下,可通过已知的甲醇脱氢酶变体产生与seq id no:1的一致性少于100%的变体,例如本领域所述。这些变体可以提供融合蛋白中增加的催化活性,例如增加甲醇转化为甲醛,然后由于hps和/或psi在融合蛋白中的本地化而转化成磷酸酮糖化合物,如己酮糖6-磷酸或果糖-6-磷酸。
[0103]
国际专利申请pct/us2014/059135中描述了甲醇芽孢杆菌mga3 medh(seq id no:1)的示例性变体,其公开内容并入本技术。包含本公开的medh区的融合蛋白可以包括基于这些变体中的一个或多个氨基酸取代。seq id no:1的示例性氨基酸取代包括但不限于如下:s11t、d38n、h42q、e48d、n53i、e56k、d60e、v61a、i63f、p65q、d70n、p71i、p71t、p71v、t74s、d81g、k84r、e86k、n87k、i94v、s99p、s99t、a103v、i106l、g107s、l108v、l108w、v109y、n112k、n112r、r115h、i116f、n117d、n117q、n117y、q120h、q120r、g121a、g121d、g121e、g121l、g121m、g121r、g121s、g121t、g121v、g121w、g121y、v122a、v122p、n123d、n123i、n123l、n123r、n123y、s124i、s124l、s124r、v125c、v125g、v125w、e126g、e126v、k127c、k127r、p128a、p128r、p128s、v129a、v129m、v129p、v129s、v130f、v130i、v130y、a134t、s143t、t145m、t146n、s147r、l148a、l148f、l148g、l148i、l148t、l148v、l148w、a149l、a149m、a149t、a149v、v150a、v150i、t152m、a155v、k157n、v158e、v158h、v158k、v158w、p161a、p161g、p161q、p161s、p161v、i163f、i163n、i163q、i163t、d164g、d164n、e165g、k181r、a184t、l186m、t190a、t190s、i199v、q217k、l226m、g256c、q267h、g269s、g270m、g270s、g270y、t296s、r298h、a300t、i302v,g312v、a316v、i323m、f333l、p336l、s337c、g343d、v344a、v344g、k345e、e350k、k354m、n355d、n355i、n355k、e358g、v360a、v360g、v360k、v360r、v360s、c361n、c361r、q363k和k379m。
[0104]
seq id no:1的其他示例性氨基酸取代包括:d38n、d60e、p71i、p71v、n87k、s99t、a103v、g107s、l108v、l108w、v109y、r115h、i116f、n117d、n117q、g121d、g121e、g121l、
g121m、g121r、g121s、g121t、g121v、g121w、g121y、v122p、n123d、n123i、n123l、n123r、n123y、s124i、s124l、v125c、v125g、v125w、e126g、k127c、k127r、p128a、p128r、p128s、v129a、v129m、v129p、v129s、v130f、v130i、v130y、a134t、s143t、t146n、a149l、a149m、a149t、a149v、v150a、k157n、v158e、v158h、v158k、v158w、i163q、d164n、q267h、g270m、g270s、g270y、k345e、n355d、v360g、v360k、v360r、v360s、c361r。
[0105]
在示例性实施例中,包含本公开的medh区的融合蛋白包括1、2、3或全部4个选自以下的氨基酸取代:v129m、v130i、g270s和n355d。示例性的medh变体是由核酸序列seq id no:9编码的seq id no:8。
[0106]
基于seq id no:1的比对,也可以在其他甲醇脱氢酶序列中进行相应的氨基酸取代。
[0107]
seq id no:1或与seq id no:1具有至少50%或更高一致性的氨基酸序列可以用于本公开的任何融合蛋白中,包括但不限于medh-phi、medh-hps、medh-hps-phi、medh-act-phi、medh-act-hps、hps-medh、phi-medh、hps-medh-phi、phi-medh-hps、phi-medh-act、hps-medh-act、act-medh-phi-hps、act-medh-hps-phi、hps-phi-medh-act、phi-hps-medh-act、medh(p1)-phi-medh(p2)、medh(p1)-hps-phi-medh(p2)和act-medh(p1)-hps-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。在另一个实施例中,seq id no:1或与seq id no:1具有至少50%或更高一致性的氨基酸序列可以用于本公开的任何融合蛋白中,包括但不限于medh-dhas、medh-f6pald、medh-f6pald-dhas、medh-act-dhas、medh-act-f6pald、f6pald-medh、dhas-medh、f6pald-medh-dhas、dhas-medh-f6pald、dhas-medh-act、f6pald-medh-act、act-medh-dhas-f6pald、act-medh-f6pald-dhas、f6pald-dhas-medh-act、dhas-f6pald-medh-act、medh(p1)-dhas-medh(p2)、medh(p1)-f6pald-dhas-medh(p2)和act-medh(p1)-f6pald-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0108]
与seq id no:1具有至少50%或更高一致性的示例性medh是由核酸序列seq id no:11编码的seq id no:10。
[0109]
融合蛋白可以包括基于其他甲醇脱氢酶序列的多肽序列,包括本领域已知的甲醇脱氢酶序列。甲醇脱氢酶属于(ec)1.1.1类酶。其他medh序列包括甲醇芽孢杆菌mga3 medh(3eij77596.1);甲醇芽孢杆菌c1 medh(aaa22593.1);甲醇芽孢杆菌pb1 medh(eij77618.1);甲醇芽孢杆菌pb1 medh(eij78790.1);甲醇芽孢杆菌mga3 medh(eij80770.1);甲醇芽孢杆菌pb1 medh(eij78397.1);甲醇芽孢杆菌mga3 medh(eij83020.1);梭形赖氨酸芽孢杆菌(lysinibacillus fusiformis)medh(efi69743.1);凝结芽孢杆菌(bacillus coagulans)36d1 medh(yp_004860127.1);球形赖氨酸芽孢杆菌(lysinibacillus sphaericus)medh(yp_001699778.1);产氮芽孢杆菌(bacillus azotoformans)lmg 9581medh(zp_11313277.1);泰国伯克氏菌(burkholderia thailandensis)e264 medh(zp_05587334.1);钩虫贪铜菌(cupriavidus necator)n-1medh(yp_004681552.1);未培养的生物体medh(agf87161);geobacter bemidjiensis bem medh(yp_002138168.1);生氢氧化碳嗜热菌(carboxydothermus hydrogenoformans)z-2901medh(yp_359772.1);产琥珀酸放线杆菌(actinobacillus succinogenes)130z medh(yp_001343716.1);鲍氏不动杆菌(acinetobacter baumannii)naval-82 medh(zp_
16224338.1);巴氏梭菌(clostridium pasteurianum)dsm 525medh(aac45651.1);马氏甲烷八叠球菌(methanosarcina mazei)tuc01 medh(yp_007491369.1);普通脱硫弧菌(desulfovibrio vulgaris str.)'miyazaki f'medh(yp_002434746);非洲沼脱硫弧菌(desulfovibrio africanus str.)walvis bay medh(yp_005052855);产气荚膜梭菌(clostridium perfringens str.)13medh(np_561852.1);坎氏弧菌(vibrio campbellii)atcc baa-1116medh(yp_001447544);还原脱硫肠球菌(desulfotomaculum reducens)mi-1medh(yp_001113612.1);普通脱硫弧菌(desulfovibrio vulgaris str.)hildenborough medh(yp_011618);深海发光杆菌(photobacterium profundum)3tck medh(zp_01220157.1);地芽孢杆菌属(geobacillus sp)y4.1mc1 medh(yp_003990729.1);食果糖脱硫弧菌(desulfovibrio fructosovorans)jj medh(zp_07335453.1);奥奈达希瓦氏菌(shewanella oneidensis)mr-1medh(np_717107);sebaldella termitidis atcc33386medh(yp_003310546.1);皮奥里亚芽孢杆菌(paenibacillus peoriae)kctc3763medh(zp_10241531.1);肺炎克雷伯氏菌亚种pneumoniae mgh 78578medh(yp_001337153.1);大肠杆菌(escherichia coli)medh(yp_026233.1);产气荚膜梭菌atcc 13124medh(yp_694908);真氧产碱杆菌(ralstonia eutropha)h16 medh(yp_725376.1);高温厌氧杆菌属(thermoanaerobacter sp.)x514 medh(yp_001663549);人类肠道宏基因组medh(ekc54576);或嗜热脱氮地芽孢杆菌(geobacillus thermodenitrificans)ng80-2 medh(yp_001126968.1)。技术人员可以基于medh序列(包括本领域已知的序列)的比对,用一个或多个氨基酸取代、删除和/或添加修饰medh。
[0110]
任何这些medh序列或与这些序列具有至少50%或更高一致性的氨基酸序列可以用于本公开的任何融合蛋白,包括但不限于medh-phi、medh-hps、medh-hps-phi、medh-act-phi、medh-act-hps、hps-medh、phi-medh、hps-medh-phi、phi-medh-hps、phi-medh-act、hps-medh-act、act-medh-phi-hps、act-medh-hps-phi、hps-phi-medh-act、phi-hps-medh-act、medh(p1)-phi-medh(p2)、medh(p1)-hps-phi-medh(p2)和act-medh(p1)-hps-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。在具有dha途径酶的medh的实施例中,任何这些medh序列或与这些序列具有至少50%或更高一致性的氨基酸序列可以用于本公开的任何融合蛋白中,包括但不限于medh-dhas、medh-f6pald、medh-f6pald-dhas、medh-act-dhas、medh-act-f6pald、f6pald-medh、dhas-medh、f6pald-medh-dhas、dhas-medh-f6pald、dhas-medh-act、f6pald-medh-act、act-medh-dhas-f6pald、act-medh-f6pald-dhas、f6pald-dhas-medh-act、dhas-f6pald-medh-act、medh(p1)-dhas-medh(p2)、medh(p1)-f6pald-dhas-medh(p2)和act-medh(p1)-f6pald-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0111]
在本公开的一些实施例中,除了不与另一蛋白(例如,野生型形式的medh蛋白)融合的medh蛋白之外,工程细胞还可以表达包含medh区的一种或多种融合蛋白。未融合的medh蛋白与包含3-己酮糖-6-磷酸脱氢酶活性或6-磷酸-3-己酮糖异构酶区的medh融合蛋白的组合表达,可允许表达期望量的在细胞中产生medh、hps、phi、和act的多肽。如本技术所讨论,medh和medh融合蛋白可以形成多蛋白复合物,并且预定量的medh、hps、phi和act可以存在于多蛋白复合物中,以提供从d-阿拉伯-3-己酮糖-6-磷酸到果糖-6-磷酸的最佳甲醇转化。在本公开的具有dha途径酶的medh的实施例中,除了不与另一种蛋白融合的medh蛋
白(例如,野生型形式的medh蛋白)之外,工程细胞还可以表达包含medh区的一种或多种融合蛋白。未融合的medh蛋白与包含dhas或f6pald(或dhak)区的medh融合蛋白的组合表达,可允许表达期望量的在细胞中产生medh、hps、phi、和act的多肽。如本技术所讨论,medh和medh融合蛋白可以形成多蛋白复合物,并且预定量的medh、dhas、f6pald(或dhak)和act可以存在于多蛋白复合物中以提供甲醇通过dha和g3p到果糖-6-磷酸的最佳转化。
[0112]
其它可用于本公开的融合蛋白中的合适的甲醇脱氢酶序列,包括作为已知甲醇脱氢酶序列(例如seq id no:1)的“直系同源物”的可鉴定序列,并且该序列的部分或全部序列可用于制备本公开的融合蛋白。“直系同源物”是与具有垂直亲缘关系的一种或多种基因,它们在不同生物中负责基本上相同或相同的功能。例如,当基因之间共享的序列相似性足以表明其同源性,或来自共同祖先的进化亲缘性时,则基因具有垂直亲缘关系。若基因具有相同三维结构但不一定具有序列相似性,其程度足以表明其从一级序列相似性无法识别的共同祖先发展而来,则该基因也可以视为直系同源物。直系同源的基因,可以编码具有约45%至100%氨基酸序列一致性的序列相似性蛋白质,并且更优选地,约60%至100%的氨基酸序列一致性。
[0113]
例如,与来自甲醇芽孢杆菌mga3(2315a)的nad(p)依赖性甲醇脱氢酶共有期望的一致性(例如,45%、50%、55%、或60%或更高)的基因,包括直系同源物和旁系同源物,可以通过本领域技术人员公知的方法来测定。例如,对于两个多肽的核酸或氨基酸序列的检查,将揭示对比序列之间的序列一致性和相似性。基于这样的相似性,本领域的技术人员可确定该相似性是否足够高到可以表明这些蛋白质通过从共同祖先进化得到而相关。
[0114]
序列比对和生成序列一致性的计算方法,包括全局比对和局部比对。全局比对使用全局优化来使得比对范围跨越所有查询序列的整个长度。与此相反,局部比对则是识别整体往往大相径庭的长序列中的相似性区域。
[0115]
为了理解目标序列与已知甲醇脱氢酶(如甲醇芽孢杆菌mga3(2315a)模板)的一致性,可以使用全局比对。可选地,为了全局比对和生成识别得分,可以排除与模板序列共有极低或没有一致性的目标序列的氨基末端和/或羧基末端序列。
[0116]
本领域技术人员公知的算法,诸如align,blast,clustal w等,比较并确定原始序列相似性或一致性,且还确定序列中的空位的存在或显著性,并可对其分配权重或评分。在比对中,可使用默认参数,且使用blosum62作为评分矩阵。
[0117]
这种算法也是本领域已知的,并且同样适用于确定核苷酸序列相似性或一致性。基于用于计算统计学相似度(或在随机多肽中找到相似匹配的机会)以及确定匹配的显著性的公知方法,来计算相似性是否足以确定相关性的参数。根据需要,对两个或更多个序列的电脑比较,还可以由本领域技术人员进行视觉优化。可以期望,相关基因产物或蛋白质具有高相似性,例如,45%至100%的序列一致性。在扫描了足够大的数据库的情况下,无相关性的蛋白质的一致性预期可以与偶然结果基本相同(5%左右)。
[0118]
在某些情况下,使用基本局部比对搜索工具(basic local alignment search tool,blast)算法来理解模板序列和目标序列之间的氨基酸基序的序列一致性,是有用的。因此,在实践的优选模式中,blast用于识别或理解模板和目标蛋白之间的较短氨基酸段(例如,序列基序)的一致性。blast通过定位两个序列之间的短匹配,使用近似smith-waterman算法的启发式方法发现相似序列。所述(blast)算法可以识别与查询序列的相似
gastri)hps(baa90546.1)。
[0124]
任何这些hps序列或与这些序列具有至少50%或更高一致性的氨基酸序列可以用于本公开的融合蛋白,包括但不限于medh-phi、medh-hps、medh-hps-phi、medh-act-phi、medh-act-hps、hps-medh、phi-medh、hps-medh-phi、phi-medh-hps、phi-medh-act、hps-medh-act、act-medh-phi-hps、act-medh-hps-phi、hps-phi-medh-act、phi-hps-medh-act、、medh(p1)-hps-phi-medh(p2)、act-medh(p1)-hps-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0125]
其它可用于本公开的融合蛋白中的合适的3-己酮糖-6-磷酸脱氢酶序列包括已知3-己酮糖-6-磷酸脱氢酶序列的“直系同源物”(例如seq id no:3的直系同源物)的可鉴定序列,并且该序列得到部分或全部序列可用于制备本公开的融合蛋白。
[0126]
本领域技术人员可以基于hps序列(包括本领域已知的序列)的比对,用一个或多个氨基酸取代、删除和/或添加来修饰hps。表3a和3b是各种3-己酮糖-6-磷酸脱氢酶序列(包括甲醇芽孢杆菌mga hps(seq id no:3))的成对序列一致性的表。
[0127]
表3a
[0128]
[0129]
[0130][0131]
表3b
[0132]
[0133]
[0134][0135]
6-磷酸-3-己酮糖异构酶活性(phi)可以将d-阿拉伯糖-3-己酮糖-6-磷酸(hu6p)异构化为果糖6-磷酸(f6p)。融合蛋白可以包括基于甲醇芽孢杆菌mga3 phi(genbank登录号aar39393.1,184个氨基酸长;seq id no:4)的多肽序列。
[0136]
本公开的融合蛋白可以可选地具有与甲醇芽孢杆菌mga3 phi(seq id no:4)少于100%一致性的6-磷酸-3-己酮糖异构酶序列。例如,融合多肽中的甲醇脱氢酶区域可以与(seq id no:4)具有50%或更高、60%或更高、70%或更高、80%或更高、85%或更高、90%或更高、95%或更高、96%或多、97%或更高、98%或更高或99%或更高一致性。
[0137]
在一些情况下,可以通过seq id no:4与其他已知的6-磷酸-3-己酮糖异构酶序列比对来产生与seq id no:4一致性低于100%的变体,以鉴定保守和/或对于蛋白的酶促功能重要的区域。一旦鉴定出这些区域,可以在这些保守区域之外的一个或多个氨基酸位置对6-磷酸-3-己酮糖异构酶进行修饰。因此,融合蛋白的6-磷酸-3-己酮糖异构酶区域可以具有一个或多个氨基酸取代、删除或添加,这些氨基酸取代、删除或添加使得序列与天然6-磷酸-3-己酮糖异构酶不同,同时保留某些序列特征。
[0138]
seq id no:4或与seq id no:4具有至少50%或更高一致性的氨基酸序列可以用于本公开的任何融合蛋白中,包括但不限于medh-phi、medh-hps-phi、act-medh-hps-phi、phi-medh、hps-medh-phi、phi-medh-hps、medh(p1)-phi-medh(p2)、medh(p1)-hps-phi-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0139]
融合蛋白可以包括基于其他6-磷酸-3-己酮糖异构酶活性序列的多肽序列,包括本领域已知的多肽序列。6-磷酸-3-己酮糖异构酶属于(ec)5.3.1.27类酶。其他phi序列包括,但不限于:甲醇芽孢杆菌pb1 phi(eij81376.1);胃分枝杆菌pb1 phi(baa90545.1);鞭毛甲基小杆菌kt phi(yp 545762.1);枯草芽孢杆菌phi(np_388227.1);甲基营养嗜甲基菌atcc 53528hps(wp_018985297.1);嗜甲基拟无枝酸菌239phi(aij24609.1);地芽孢杆菌ghh01 phi(yp_007402408.1);地芽孢杆菌y4.1mc1 phi(yp_003990383.1);嗜热脱氮地芽孢杆菌ng80-2 phi(wp_011887353.1);methylomonas aminofaciens phi(baa83098.1);葡萄糖营养甲基菌sip3-4 phi(yp_003051269.1);和甲基菌种mp688 phi(adq84715.1)。
[0140]
任何这些phi序列或与这些序列具有至少50%或更高一致性的氨基酸序列可以用于本公开的融合蛋白,包括但不限于medh-phi、medh-hps-phi、act-medh-hps-phi、phi-medh、hps-medh-phi、phi-medh-hps、medh(p1)-phi-medh(p2)、medh(p1)-hps-phi-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0141]
技术人员可以基于phi序列(包括本领域已知的序列)的比对,用一个或多个氨基酸取代、删除和/或添加来修饰phi。表4a和4b是各种6-磷酸-3-己酮糖异构酶序列(包括甲醇芽孢杆菌mga3 phi(seq id no:4))的成对序列一致性的表。
[0142]
表4a
[0143]
[0144][0145]
表4b
[0146]
[0147]
[0148][0149]
本公开的工程细胞还可以表达包含天然存在的hps-phi融合蛋白序列或其变体的含medh的融合蛋白。
[0150]
工程融合蛋白可以包括基于天然hps-phi融合体的多肽序列,例如来自荚膜甲基球菌(methylococcus capsulatus)(yp_115138.1);methylomicrobium album(白甲基微菌)bg8(eic30826.1);激烈火球菌(pyrococcus abyssi)(np_127388.1);炽热火球菌(pyrococcus furiosus)(np_577949.1);极端嗜热火球菌(pyrococcus horikoshii)ot3(np_143767.1);或超好热始原菌(thermococcus kodakaraensis)(yp_182888.1)的融合体。一个示例性hps-phi融合体是seq id no:5。
[0151]
任何这些hps-phi序列或与这些序列具有至少50%或更高一致性的氨基酸序列可以用于本公开的融合蛋白,例如medh-phi、medh-hps-phi、act-medh-hps-phi和medh(p1)-hps-phi-medh(p2),包括在融合蛋白的区域/部分之间具有一个或多个接头序列的融合蛋白。
[0152]
本公开的工程细胞(无论使用hpa和phi还是使用dhas或f6pald,或dhas和dhak)也可以表达包含medh活化剂序列的含medh的融合蛋白。medh活化剂序列可以通过提供nad辅因子的烟酰胺单核苷酸(nmn)部分的水解去除来活化medh酶。medh活化剂在镁离子存在下具有活性并且也能够使用adp-核糖(kloosterman,h.,et al.(2002)j biol chem.277:34785-34792)。
[0153]
工程融合蛋白可以包括基于medh活化剂序列的多肽序列,例如甲醇芽孢杆菌mga3(wp_004435441.1;seq id no:12)和甲醇芽孢杆菌pb1(wp_004437560.1)的活化剂。
[0154]
这些medh活化剂序列,或与seq id no:12具有至少50%或更高一致性的氨基酸序列,可以用于本公开内容的融合蛋白中,例如medh-act-phi、medh-act-hps、hps-medh-act、act-medh-phi-hps、act-medh-hps-phi、hps-phi-medh-act、phi-hps-medh-act和act-medh(p1)-hps-medh(p2)。
[0155]
一个或多个接头氨基酸序列可存在于本公开的融合蛋白的区域之间。接头序列可以在融合蛋白中提供所需的功能。本公开的一些融合蛋白可以表达为单个开放阅读框而不引入接头,并且本公开的一些融合蛋白可以包括融合蛋白的一个或多个区域之间的接头序列,其中,接头可以允许该区域展现出期望的酶促活性。接头序列一般可被描述为“刚性”或“柔性”,而较长长度的接头序列通常被认为柔性更大。刚性接头通常形成α-螺旋结构。可以制备接头序列以提供所需的性质,例如长度、溶解度和蛋白酶敏感性。
[0156]
示例性的接头序列的长度为1至150、1至100或1至50个氨基酸。一些接头序列是短的,例如长度从一个到十个,或从两个到六个氨基酸。接头序列可以被称为“接头”、“接头肽”、“接头肽序列”。接头可以包括任何氨基酸,但优选包括选自甘氨酸、丙氨酸、丝氨酸和苏氨酸的一个或多个氨基酸。在一些接头序列中,大部分(》50%)的氨基酸残基是甘氨酸。一些接头序列可以包括酸性残基如asp或glu,或碱性残基如lys、arg。可以选择接头序列以赋予融合蛋白一种或多种特定性质,例如改善的稳定性或溶解度性质。氨基酸可以在融合
蛋白中的medh、phi,hps和/或act区域之间提供柔性区域。
[0157]
示例性的接头序列包括但不限于(g)n,其中n是4-8;(gs)n,(ggs)n,(gggs)n,(ggggs)n和(gggggs)n,其中n是1-6,例如1,2,3,4,5或6;[(ggs)x(gs)y]n,其中x是1-6,y是1-6,并且n是1-4;(ge)n,(gge)n,(ggge)n和(gggge)n,其中n是1-10;(gd)n,(ggd)n,(gggd)n和(ggggd)n,其中n是1-10;(gk)n,(ggk)n,(gggk)n和(ggggk)n,其中n是1-10;(gr)n,(ggr)n,(gggr)n和(ggggr)n,其中n是1-10;(eaaak)n,其中n是1-10;a(eaaak)na,其中n是1-10;a(eaaak)4alea(eaaak)4a;(papap)n,其中n是1-4;(aeaaakeaaaka)n,其中n是1-4;(ap)n,其中n是1-35;(kp)n,其中n是1-35;(ep)n,其中n是1-35;(le)n,其中n是1-35;(ga2pa3pakqea3papa2kaeapa3pa2ka)n,其中n是1-5;(kesgsvsseqlaqfrsld)n,其中n是1-5;(egkssgsgseskst)n,其中n是1-5;(gsagsaagsgef)n,其中n是1-4;[a(eaaak)na]y其中n是1-5并且y是1-4;(ggsggsgsgsggsgsgsggs)n,其中n是1或2;和ssgwgsgg。
[0158]
优选地,接头是[(ggs)x(gs)y(ggs)z]n,其中x是1-6,y是1-6,z是0-3,并且n是1-4,优选其中x是1-3,y是1-3,z是1-2,并且n是1-2。
[0159]
融合蛋白配方可以可选地参照一个或多个seq id no进行描述。例如,通式medh-l
1-hps-l
2-phi的融合蛋白可以更具体地描述为seq id no:1-l
1-seq id no:3-l
2-seq id no:4。如果融合蛋白的序列与参考序列的一致性低于100%(例如90%或更高的一致性),则融合蛋白可描述如下:[seq id no:1,≥90%]-l
1-[seq id no:3,≥90%]-l
2-[seq id no:4,≥90%]。或者,例如,通式medh-l
1-dhas-l
2-f6pald的融合蛋白可以更具体地描述为seq id no:1-l
1-seq id no:x-l
2-seq id no:y,其中,x和y分别是dhas或f6pa1d序列的seq id号,其中示例性序列在本技术和下文中描述。如果融合蛋白的序列与参考序列的一致性低于100%(例如90%或更高的一致性),则融合蛋白可描述如下:[seq id no:1≥90%]-l
1-[seq id no:x≥90%]-l
2-[seq id no:y≥90%]。
[0160]
作为另一个实例,通式act-l
1-medh-l
2-phi-l
3-hps的融合蛋白可以更具体地描述为seq id no:12-l
1-seq id no:1-l
2-seq id no:4-l
3-seq id no:3。如果融合蛋白的某些区域的序列与参考序列的一致性低于100%(例如85%或更高的一致性),则融合蛋白可描述如下:seq id no:12-l
1-[seq id no:1≥90%]-l
2-seq id no:4-l
3-[seq id no:3≥85%]。
[0161]
作为另一个例子,通式medh-l
1-hps-phi的融合蛋白可以更具体地描述为seq id no:1-l
1-seq id no:5,seq id no:6-l
1-seq id no:5,seq id no:8-l
1-seq id no:5或seq id no:10-l
1-seq id no:5。在一些排列中,l1是seq id no:7。在一些实施例中,与seq id no:1-seq id no:7-seq id no:5、seq id no:6-seq id no:7-seq id no:5、seq id no:8-seq id no:7-seq id no:5或seq id no:10-seq id no:7-seq id no:5相比,融合蛋白具有50%或更高、60%或更高、70%或更高、80%或更高、85%或更高、90%或更高、95%或更高、96%或更高、97%或更高、98%或更高、或99%或更高一致性。
[0162]
在本发明的一些实施例中,融合蛋白在工程细胞中表达以提供包括融合蛋白的多蛋白复合物。通过medh-medh相互作用可以形成多蛋白复合物。medh被认为是一种同源多聚体蛋白,通常由10个单体亚基组成。已经表明来自荚膜甲基球菌(bath)的medh主要是溶液中的二聚体,并且在较高蛋白质浓度下形成分子量为~450-560kda的寡聚物(culpepper m.a.,rosenzweig,a.c.(2014)biochemistry 53:6211-6219)。因此,在细胞中形成多蛋白
复合物,可通过融合蛋白的medh部分之间的相互作用,或融合蛋白的medh部分与非融合medh、hps、phi和/或act(例如野生型)之间的相互作用,或融合蛋白medh部分与非融合medh、dhas、f6pald(或dhak)和/或act(例如野生型)部分蛋白之间的相互作用。期望的融合蛋白或融合蛋白与未融合蛋白的组合的表达可以产生多种异十聚体或异多聚体,其具有针对甲醇利用而优化的活性,在一些情况下随后的生物产品形成。例如,可以将细胞工程化以提供多甲基蛋白复合物,所述多甲基蛋白复合物将甲醇有效地转化为d-阿拉伯糖-3-己酮糖-6-磷酸并转变成果糖6-磷酸,然后该果糖6-磷酸可以进一步用作期望的生物产品的前体。
[0163]
细胞可以改造为,提供所需比例的medh、hps、phi和act序列,或提供所需比例的medh、dhas、f6pald(或dhak)和act序列。例如,细胞可以包括编码以下融合蛋白的外源核酸:medh-phi、medh-hps和medh-act(或者可选地medh-dhas、medh-f6pald和medh-act),并且如果细胞经过工程化使得这些融合蛋白中均以相同数目表达,那么medh序列的量将比phi、hps和act序列(或者可选地dhas、f6pald和act序列)在化学计量上更多(三倍)。可选地,细胞可以被工程化以表达medh(非融合)蛋白。融合蛋白可以与非融合medh蛋白一起组装,以形成具有期望蛋白质组分比例的多蛋白质复合物,这又可以提供甲醇途径活性的最佳平衡以最大化甲醇通量。
[0164]
在一些实施例中,工程细胞以提供大于hps、phi或act(medh》hps、phi或act)中的任何一种的medh的化学计量比。例如,medh与hps、phi或act中的任何一个的比例可以在10:1至0.5:1、6:1至1:1或3:1至1:1的范围内。可选地,在一些实施例中,工程细胞以提供大于hps、phi或act(medh》hps、phi或act)中的任何一种的medh的化学计量比。例如,medh与dhas、f6pald或act中的任何一个的比例可以在10:1至0.5:1、6:1至1:1或3:1至1:1的范围内。
[0165]
一种或多种表达载体可构造成包括一种或多种如本技术所示例的编码蛋白并与宿主生物体中的功能性表达控制序列可操作连接的核酸。适用于所提供的微生物宿主生物体中的表达载体包括,例如,质粒、噬菌体载体、病毒载体、附加体和人工染色体(包括可操作用于稳定整合到宿主染色体中的载体和选择序列或标记)。此外,表达载体可以包括一个或多个选择性标记基因和适当的表达控制序列。所包括的选择性标记基因还可以用于,例如,提供对抗生素或毒素的抗性,补充营养缺陷不足,或提供培养基中缺乏的关键营养物。表达控制序列可以包括本领域中公知的组成型和诱导型启动子、转录增强子、转录终止子等等。
[0166]
融合蛋白可以与一种或多种另外的核酸共表达,所述另外的核酸可以编码可用于将中间体例(如果糖6-磷酸(f6p)和f6p下游的其他化合物)转化为期望的生物产品的酶。当要共表达两个或更高的外源编码核酸时,这两种核酸可以插入到例如单一表达载体或分开的表达载体中。对于单一载体表达,编码核酸可以可操作地连接到一个共同的表达控制序列,或连接于不同的表达控制序列,诸如一个诱导型启动子和一个组成型启动子。参与代谢或合成途径的外源核酸序列的转化,可以使用本领域中公知的方法来确认。所述方法包括,例如,核酸分析,如northern印迹法或mrna的聚合成酶链反应(pcr)扩增,或表达基因产物的免疫印迹,或其他合适的分析方法,来测试所引入核酸序列或其对应的基因产物的表达。本领域技术人员可以理解,该外源核酸的表达量足以产生期望的产物,且进一步理解的是,
可以使用本领域中公知的方法和本技术所公开的方法优化该表达水平,以获得充分表达。
[0167]
术语“外源的”是指,所指的分子或所指的活性被引入到宿主微生物有机体中。该分子的引入可以是,例如,通过将编码核酸导入宿主遗传物质中,例如通过整合进宿主染色体中,或作为非染色体遗传物质,如质粒。因此,该术语用于编码核酸的表达时,是指将编码核酸的可表达形式引入微生物有机体中。当涉及生物合成活性时,该术语是指引入到宿主参照生物体中的活性。其来源可以是,例如,在导入宿主微生物有机体后表达所指的活性的同源或异源的编码核酸。因此,术语“内源性”指的是,存在于宿主中的所指的分子或活性。类似地,当用于提及编码核酸的表达时,该术语是指包含在微生物有机体中的编码核酸的表达。术语“异源的”是指来自除所指的物种以外来源的分子或活性,而“同源”是指来自宿主微生物有机体的分子或活性。对应地,编码核酸的外源表达可以利用异源或同源编码核酸中的任一种或两种。
[0168]
可以理解,当在微生物有机体中包括多个外源核酸时,所述多个外源核酸是指所指的编码核酸或生物合成活性,如上所论述。还应当理解,如本技术所公开的,多个外源核酸可以通过分开的核酸分子、多顺反子的核酸分子或其组合引入宿主微生物有机体中,而仍然看作是多个外源核酸。例如,如本技术所公开的,微生物可被工程化以表达两种或更多种编码期望途径酶或蛋白质的外源核酸,例如表达本公开的融合蛋白的外源核酸以及一种或多种其他酶,所述酶将来自rump途径的中间体(或者可选地dha途径,优选dha途径1)转化为期望的生物产品。
[0169]
在编码期望活性的两个外源核酸被引入宿主微生物有机体的情况下,可以理解,这两个外源核酸的引入可以作为单一核酸,例如通过单个质粒,通过分开的质粒,可以整合到宿主染色体中的单个或多个位点,而仍然被看作是两个外源核酸。类似地,可以理解,两个以上的外源核酸可以以任何期望组合引入到宿主生物体中,例如,通过单个质粒,通过分开的质粒,可以整合到宿主染色体中的单个或多个位点,而仍然被看作是两个或多个的外源核酸,例如三个外源性核酸。因此,所指的外源性核酸或生物合成活性的数量,是指编码核酸的数量或生物合成活性的数量,而不是引入到宿主生物体中的单独的核酸的数量。
[0170]
使用本领域公知的技术,包括但不限于,接合、电穿孔、化学转化、转导、转染、和超声波转化,可以将编码外源性融合蛋白的核酸序列稳定或短暂地引入宿主细胞中。可选地,对于在大肠杆菌或其它原核细胞中的外源表达,真核核酸的基因或cdna中的一些核酸序列可以编码靶向信号,例如n-末端线粒体或其他靶向信号,其可以根据需要,在转化进原核宿主细胞之前去除。例如,除去线粒体前导序列,使得在大肠杆菌中的表达增加(hoffmeister et al.,j.biol.chem.280:4329-4338(2005))。对于在酵母或其它真核细胞中的外源表达,基因可以在细胞溶质中表达而无需添加前导序列,或可以通过加入合适的靶向序列,诸如适于宿主细胞的线粒体靶向或分泌信号,从而靶向线粒体或其它细胞器,或靶向用于分泌。因此,可以理解,对核酸序列进行的删除或并入靶向序列的适当修饰,可以包含在外源核酸序列中,以赋予所需性质。此外,基因可以以在本领域中公知的技术进行密码子优化,以实现蛋白质的最佳表达。
[0171]
术语“微生物的”、“微生物有机体”或“微生物”,旨在表示作为古细菌、细菌或真核生物的领域中所包括的微观细胞存在的任何生物体。因此,该术语旨在包括具有微观尺寸的原核或真核细胞或生物体,并且包括细菌、古细菌和真细菌的所有物种以及真核微生物
tuberculosis)、牙龈卟啉单胞菌(porphyromonas gingivalis)、拟南芥(arabidopsis thaliana)、嗜热细菌(thermus thermophilus),假单胞菌种,包括绿脓杆菌(pseudomonas aeruginosa)、恶臭假单胞菌(pseudomonas putida)、施氏假单胞菌(pseudomonas stutzeri)、荧光假单胞菌(pseudomonas fluorescens)、智人、穴兔(oryctolagus cuniculus)、浑球红假单胞菌(rhodobacter spaeroides)、布氏热厌氧菌(thermoanaerobacter brockii)、勤奋金属球菌(metallosphaera sedula)、肠系膜明串珠菌(leuconostoc mesenteroides)、橙色绿屈挠菌(chloroflexus aurantiacus)、光合玫瑰弯菌(roseiflexus castenholzii)、赤杆菌(erythrobacter)、霍霍巴(simmondsia chinensis)、不动杆菌种(acinetobacter species),包括醋酸钙不动杆菌(acinetobacter calcoaceticus)和不动杆菌(acinetobacter baylyi)、牙龈卟啉单胞菌(porphyromonas gingivalis)、嗜热古菌(sulfolobus tokodaii)、硫磺矿硫化叶菌(sulfolobus solfataricus)、嗜酸热硫化叶菌(sulfolobus acidocaldarius)、枯草芽孢杆菌(bacillus subtilis)、蜡样芽胞杆菌(bacillus cereus)、巨大芽胞杆菌(bacillus megaterium)、短杆菌(bacillus brevis)、短小芽胞杆菌(bacillus pumilus)、褐家鼠(rattus norvegicus)、肺炎克雷伯菌(klebsiella pneumonia)、产酸克雷伯菌(klebsiella oxytoca)、小眼虫(euglena gracilis)、齿垢密螺旋体(treponema denticola)、热醋穆尔氏菌(moorella thermoacetica)、海栖热袍菌(thermotoga maritima)、嗜盐菌(halobacterium salinarum)、嗜热脂肪土芽孢杆菌(geobacillus stearothermophilus)、敏捷气热菌(aeropyrum pernix)、野猪(sus scrofa)、秀丽隐杆线虫(caenorhabditis elegans)、谷氨酸棒杆菌(corynebacterium glutamicum)、发酵氨基酸球菌(acidaminococcus fermentans)、乳酸乳球菌(lactococcus lactis)、植物乳杆菌(lactobacillus plantarum)、嗜热链球菌(streptococcus thermophilus)、产气肠杆菌(enterobacter aerogenes)、假丝酵母(candida)、土曲霉(aspergillus terreus)、戊糖片球菌(pedicoccus pentosaceus)、运动发酵单胞菌(zymomonas mobilis)、巴氏醋酸杆菌(acetobacter pasteurianus)、乳酸克鲁维酵母(kluyveromyces lactis)、巴克氏真杆菌(eubacterium barkeri)、多毛拟杆菌(bacteroides capillosus)、anaerotruncus colihominis、嗜热盐碱厌氧菌(natranaerobius thermophilus)、空肠弯曲杆菌(campylobacter jejuni)、流感嗜血杆菌(haemophilus influenzae)、灵杆菌(serratia marcescens)、无丙二酸柠檬酸杆菌(citrobacter amalonaticus)、黄色黏球菌(myxococcus xanthus)、具核梭杆菌(fusobacterium nuleatum)、产黄青霉(penicillium chrysogenum)、海洋γ-变形杆菌(marine gamma proteobacterium)、丁酸产生菌(butyrate-producing bacterium)、艾阿华诺卡氏菌(nocardia iowensis)、皮诺卡氏菌(nocardia farcinica)、灰色链霉菌(streptomyces griseus)、粟酒裂殖酵母(schizosaccharomyces pombe)、热葡糖苷酶芽胞杆菌(geobacillus thermoglucosidasius)、鼠伤寒沙门氏菌(salmonella typhimurium)、霍乱弧菌(vibrio cholera)、幽门螺杆菌(heliobacter pylori)、烟草(nicotiana tabacum)、稻(oryza sativa)、地中海富盐菌(haloferax mediterranei)、根癌土壤杆菌(agrobacterium tumefaciens)、反硝化无色杆菌(achromobacter denitrificans)、具核梭杆菌(fusobacterium nucleatum)、棒状链霉菌(streptomyces clavuligenus)、鲍氏不动杆菌
96、变异棒杆菌(corynebacterium variabile)、钩虫贪铜菌n-1、蓝菌pcc7001、食烯烃脱硫酸菌(desulfatibacillum alkenivorans)ak-01、哥本哈根脱亚硫酸菌(desulfitobacterium hafniense)、金属还原脱亚硫酸菌(desulfitobacterium metallireducens)dsm 15288、还原脱硫肠状菌(desulfotomaculum reducens)mi-1、非洲沼脱硫弧菌菌株walvis bay、食果糖脱硫弧菌jj、普通脱硫弧菌菌株(desulfovibrio vulgaris str.)hildenborough、普通脱硫弧菌菌株'miyazaki f'、盘基网柄菌ax4、大肠杆菌、大肠杆菌k-12、大肠杆菌k-12mg1655、霍氏真杆菌(eubacterium hallii)dsm 3353、flavobacterium frigoris、具核梭杆菌亚属polymorphum atcc 10953、地芽孢杆菌属y4.1mc1、嗜热脱氮地芽孢杆菌(geobacillus themodenitrificans)ng80-2、geobacter bemidjiensis、硫还原地杆菌(geobacter sulfurreducens)、硫还原地杆菌pca、嗜热脂肪土芽孢杆菌dsm 2334、流感嗜血杆菌、幽门螺杆菌、智人、嗜热氢杆菌(hydrogenobacter thermophilus)、嗜热氢杆菌tk-6、脱氮生丝微菌(hyphomicrobium denitrificans)atcc 51888、查氏生丝微菌(hyphomicrobium zavarzinii)、肺炎克雷伯氏菌亚种pneumoniae mgh 78578、短乳杆(lactobacillus brevis)atcc 367、肠系膜明串珠菌、梭形赖氨酸芽孢杆菌、球形赖氨酸芽孢杆菌、中慢生型百脉根根瘤菌maff303099、勤奋金属球菌、乙酸甲烷八叠球菌(methanosarcina acetivorans)、乙酸甲烷八叠球菌c2a、巴氏甲烷八叠球菌(methanosarcina barkeri)、马氏甲烷八叠球菌(methanosarcina mazei)tuc01、海洋甲基细菌(methylobacter marinus)、扭脱甲基杆菌(methylobacterium extorquens)、扭脱甲基杆菌am1、荚膜甲基球菌、methylomonas aminofaciens、热醋穆尔氏菌、分枝杆菌属jc1 dsm 3803菌株、鸟型结核分支杆菌亚属类结核k-10、牛结核分枝杆菌bcg、胃分枝杆菌、海鱼分枝杆菌m、包皮垢分支杆菌、包皮垢分支杆菌mc2 155、结核杆菌、萨拉里拉氨氧化古菌(nitrosopumilus salaria)bd31、加尔加亚氨氧化古菌(nitrososphaera gargensis)ga9.2、皮诺卡氏菌ifm 10152、艾阿华诺卡氏菌种(nrrl 5646)、念珠藻种pcc 7120、ogataea angusta、ogataea parapolymorpha dl-1、多形汉逊酵母(hansenula polymorpha)dl-1)、皮奥里亚芽孢杆菌kctc 3763、脱氮副球菌(paracoccus denitrificans)、产黄青霉、深海发光杆菌3tck、phytofermentans isdg、毕赤酵母(pichia pastoris)、灼热嗜酸古菌(picrophilus torridus)dsm9790、牙龈卟啉单胞菌、牙龈卟啉单胞菌w83、绿脓杆菌pa01、脱氮假单胞杆菌(pseudomonas denitrificans)、pseudomonas knackmussii、恶臭假单胞菌、假单胞菌种、丁香假单胞菌pv.syringae b728a、冰岛热棒菌(pyrobaculum islandicum)dsm 4184、激烈火球菌(pyrococcus abyssi)、炽热火球菌、极端嗜热火球菌ot3、真氧产碱杆菌、真氧产碱杆菌h16、荚膜红细菌(rhodobacter capsulatus)、类球红细菌(rhodobacter sphaeroides)、类球红细菌atcc 17025、沼泽红假单胞菌(rhodopseudomonas palustris)、沼泽红假单胞菌cga009、沼泽红假单胞菌dx-1、深红红螺菌(rhodospirillum rubrum)、深红红螺菌atcc 11170、卵形瘤胃球菌(ruminococcus obeum)atcc 29174、酿酒酵母、酿酒酵母s288c、肠道沙门氏菌(salmonella enterica)肠道沙门氏菌亚种enterica serovar typhimurium lt2菌株、肠道沙门氏菌typhimurium、鼠伤寒沙门氏菌、粟酒裂殖酵母、白蚁塞巴尔德氏菌(sebaldella termitidis)atcc 33386、奥奈达希瓦氏菌(shewanella oneidensis)mr-1、苜蓿中华根瘤菌(sinorhizobium meliloti)1021、天蓝色链霉菌(streptomyces coelicolor)、灰色链霉
菌亚属灰色nbrc 13350、嗜酸热硫化叶菌、硫磺矿硫化叶菌p-2、集胞藻菌株pcc 6803、甲酸氧化互营杆菌(syntrophobacter fumaroxidans)、thauera aromatica、高温厌氧杆菌属(thermoanaerobacter sp.)x514、thermococcus kodakaraensis、嗜热高温球菌(thermococcus litoralis)、嗜酸热原体(thermoplasma acidophilum)、中性热变形菌(thermoproteus neutrophilus)、海栖热袍菌、桃红荚硫菌(thiocapsa roseopersicina)、tolumonas auensis dsm 9187、阴道毛滴虫g3、布氏锥虫、微变冢村氏菌dsm20162、霍乱弧菌、哈氏弧菌(vibrio harveyi)atcc baa-1116、自养黄色杆菌(xanthobacter autotrophicus)py2、中间耶尔森菌(yersinia intermedia)和玉米。
[0179]
因此,包含融合蛋白的工程细胞中,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性,或者可选地包括至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白,所述工程细还胞可以包括一个或多个提高一种或多种中间产物或其产物的水平所需的基因改变,如插入转基因、删除、减毒、突变等,并且包括如美国专利公开号2014/0058056(burgard et al.)所描述的基因修饰,所述专利通过引用并入本技术。
[0180]
本技术描述的从宿主细胞获得的目标产物和适合于在宿主细胞中生产的产物途径包含下文所述各项;所述宿主细胞表达融合蛋白,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性,或者可选地包括至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。
[0181]
特别感兴趣的是使用丙酮酸和乙酰-coa作为其产物途径的入口点或前体而获得的目标产物,部分是因为使用该新型酶的甲醇代谢途径允许将甲醇的碳固定到通向丙酮酸和乙酰-coa的途径中。目标产物包括(a)1,4-丁二醇及其中间体,如4-羟基丁酸(4-羟基丁酸(4-hydroxybutanoate)、4-羟基丁酸(4-hydroxybutyrate)、4-hb),(b)丁二烯及其中间体,如1,4-丁二醇、1,3-丁二醇、巴豆醇、3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇,(c)1,3-丁二醇及其中间体,如2,4-戊二烯酸、巴豆醇或3-丁烯-1-醇,(d)己二酸、6-氨基己酸、己内酰胺、六亚甲基二胺和乙酰丙酸及其中间体,例如4-氨基丁酰基-coa,(e)甲基丙烯酸(2-甲基-2-丙烯酸)及其酯共同称为甲基丙烯酸酯,例如甲基丙烯酸甲酯、甲基丙烯酸甲酯、3-羟基异丁酸酯和/或2-羟基异丁酸酯及其中间体,(f)1,2-丙二醇(丙二醇)、正丙醇、1,3-丙二醇和甘油及其中间体和(g)琥珀酸及其中间体。
[0182]
在一些方面中,将编码融合蛋白的基因引入到具有增加的1,4-丁二醇(bdo)水平或羟基丁酸(4-hb)生物合成能力的工程细胞中,所述基因编码至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包括至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白;本领域技术人员将理解,将本技术提供的教导和指导应用于特定物种时,其中代谢修饰的鉴定可以包括直系同源物的鉴定和包含或失活。在编码催化相似或基本上相似的代谢反应的酶的所指的微生物中存在旁系同源物和/或非直系基因置换的程度范围上,本领域的技术人员也可以利用这些进化相关的基因。
[0183]
使用现在超过550种物种的完整基因组序列(其中超过一半可在公共数据文库如ncbi上找到),包括395种微生物基因组和各种酵母、真菌、植物和哺乳动物基因组,识别编码必要bdo或4-hb生物合成途径的基因,以及识别近缘物种或远缘物种中的编码其他已知
to useful products”的wo2010071697a1;2009年7月30公布的标题为“methods and organisms for utilizing synthesis gas or other gaseous carbon sources and methanol”的wo2009094485a1;2009年2月19日公布的标题为“methods and organisms for the growth-coupled production of 1,4-butanediol”的wo2009023493a1;2008年9月25日公布的标题为“compositions and methods for the biosynthesis of 1,4-butanediol and its precursors”的wo2008115840a2;以及2013年8月27日提交的国际申请号pct/us13/56725标题为“microorganisms an methods for enhancing the availability of reducing equivalents in the presence of methanol,and for producing 1,4-butanediol related thereto”。
[0187]
丁二烯及其中间体,如1,4-丁二醇、1,3-丁二醇、巴豆醇、3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇,是可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。除了直接发酵生产丁二烯外,1,3-丁二醇、1,4-丁二醇、巴豆醇、3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇可以被分离、纯化(用于任何用途),然后在涉及金属基催化的第二步骤中脱水为丁二烯。合适的产物途径和酶、筛选方法和分离方法可以在以下文件中找到,在此引入作为参考:2011年11月10日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2011140171a2;2012年2月9日公布的标题为“microorganisms and methods for the biosynthesis of aromatics,2,4-pentadienoate and 1,3-butadiene”的wo2012018624a2;2011年11月10日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2011140171a2;2012年12月27日公布的标题为“microorganisms for producing butadiene and methods related thereto”的wo2012177710a1;2012年8月9日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2012106516a1;2013年2月28日公布的标题为“microorganisms and methods for producing 2,4-pentadienoate,butadiene,propylene,1,3-butanediol and related alcohols”的wo2013028519a1;以及美国专利公布号2015/0050708。
[0188]
1,3-丁二醇及其中间体如2,4-戊二烯酸、巴豆醇或3-丁烯-1-醇是可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。合适的产物途径和酶、筛选方法和分离方法可以在本技术和以下文件中找到,在此引入作为参考:2011年1月16日公布的标题为“methods and organisms for converting synthesis gas or other gaseous carbon sources and methanol to 1,3-butanediol”的wo2011071682a1;2011年3月17日公布的标题为“microorganisms and methods for the co-production of isopropanol with primary alcohols,diols and acids”的wo2011031897a;2010年11月4日公布的标题为“organisms for the production of 1,3-butanediol”的wo2010127319a2;2013年5月16日公布的标题
为“eukaryotic organisms and methods for increasing the availability of cytosolic acetyl-coa,and for producing 1,3-butanediol”的wo2013071226a1;2013年2月28日公布的标题为“microorganisms and methods for producing 2,4-pentadienoate,butadiene,propylene,1,3-butanediol and related alcohols”的wo2013028519a1;2013年3月14日公布的标题为“eukaryotic organisms and methods for producing 1,3-butanediol”的wo2013036764a1;2013年1月24日公布的标题为“methods for increasing product yields”的wo2013012975a1;2012年12月27日公布的标题为“microorganisms for producing 1,3-butanediol and methods related thereto”的wo2012177619a2;以及美国专利公布号2015/0050708。
[0189]
己二酸、6-氨基己酸、己内酰胺、六亚甲基二胺和乙酰丙酸及其中间体例如4-氨基丁酰基-coa是可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。合适的产物途径和酶、筛选方法和分离方法可以在本技术和以下文件中找到,在此引入作为参考:2010年11月11日公布的标题为“microorganisms and methods for the biosynthesis of adipate,hexamethylenediamine and 6-aminocaproic acid”的wo2010129936a1;2013年1月24日公布的标题为“methods for increasing product yields”的wo2013012975a1;2012年12月27日公布的标题为“microorganisms for producing 6-aminocaproic acid”的wo2012177721a1;2012年7月26日公布的标题为“methods for increasing product yields”的wo2012099621a1;以及标题为“microorganisms an methods for enhancing the availability of reducing equivalents in the presence of methanol,and for producing adipate,6-aminocaproate,hexamethylenediamine or caprolactam related thereto”的美国专利公布号2014/0329916。
[0190]
甲基丙烯酸(2-甲基-2-丙烯酸;用于制备其统称为甲基丙烯酸酯的酯,如甲基丙烯酸甲酯,尤其是用在聚合物制造中)、甲基丙烯酸酯(如甲基丙烯酸甲酯)、3-羟基异丁酸酯和/或2-羟基异丁酸酯及其中间体是可用于例如制备聚合物的目标产物,并可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。合适的产物途径和酶、筛选方法和分离方法可以在本技术和以下文件中找到,在此引入作为参考:2012年10月4日公布的标题为“microorganisms for producing methacrylic acid and methacrylate esters and methods related thereto”的wo2012135789a2;2009年11月5日公布的标题为“microorganisms for the production of methacrylic acid”的wo2009135074a2;以及标题为“microorganisms an methods for enhancing the availability of reducing equivalents in the presence of methanol,and for producing 3-hydroxyisobutyate or methacrylic acid related thereto”的美国专利公布号2014/0288254。
[0191]
1,2-丙二醇(丙二醇)、正丙醇、1,3-丙二醇和甘油及其中间体是可用于例如制造
尼龙聚合物,并可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。合适的产物途径和酶、筛选方法和分离方法可以在本技术和以下文件中找到,在此引入作为参考:2009年11月9日公布的标题为“primary alcohol producing organisms”的wo2009111672a1;2011年3月17日公布的标题为“microorganisms and methods for the co-production of isopropanol with primary alcohols,diols and acids”的wo2011031897a1;2012年12月27日公布的标题为“microorganisms for producing n-propanol 1,3-propanediol,1,2-propanediol or glycerol and methods related thereto”的wo2012177599a2;以及标题为“microorganisms an methods for enhancing the availability of reducing equivalents in the presence of methanol,and for producing 1,2-propanediol,n-propanol,1,3-propanediol,or glycerol related thereto”的美国专利公布号2014/0302575。
[0192]
琥珀酸及其中间体(可用于生产产品,包括聚合物,例如pbs、1,4-丁二醇、四氢呋喃、吡咯烷酮、溶剂、油漆、除冰剂、塑料、燃料添加剂、织物、地毯、颜料和洗涤剂)是可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的融合蛋白共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。合适的产物途径和酶、筛选方法和分离方法可以在本技术和以下文件中找到,在此引入作为参考:2008年7月2日公布的标题为“methods and organisms for the growth-coupled production of succinate”的ep1937821a2;和标题为“microorganisms and methods for enhancing the availability of reducing equivalents in the presence of methanol,and for producing succinate related thereto”的美国专利公布号2014/0302575。
[0193]
从共表达本技术所述融合蛋白的宿主细胞中获得的目标产物和适合用于在宿主细胞中生产的产物途径包括以下,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。丁二烯及其中间体如1,4-丁二醇、1,3-丁二醇、巴豆醇、3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇是可以通过下列文献及本技术中所描述的产物途径,与本技术所描述的新型醇脱氢酶共表达来获得的目标产物,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白。除了直接发酵生产丁二烯外,1,3-丁二醇,1,4-丁二醇,巴豆醇,3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇可以被分离、纯化(用于任何用途),然后在涉及金属基催化的第二步骤中脱水为丁二烯。合适的产物途径和酶,筛选方法和分离方法,可以在以下文件中找到:2011年11月10日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2011140171a2;2012年2月9日公布的标题为“microorganisms and methods for the biosynthesis of aromatics,2,4-pentadienoate and 1,3-butadiene”的
wo2012018624a2;2011年11月10日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2011140171a2;2013年3月21日公布的标题为“microorganisms and methods for producing alkenes”的wo2013040383a1;2012年12月27日公布的标题为“microorganisms for producing butadiene and methods related thereto”的wo2012177710a1;2012年8月9日公布的标题为“microorganisms and methods for the biosynthesis of butadiene”的wo2012106516a1;2013年2月28日公布的标题为“microorganisms and methods for producing 2,4-pentadienoate,butadiene,propylene,1,3-butanediol and related alcohols”的wo2013028519a1;以及美国专利公布号2015/0050708。
[0194]
用于将从乙酰-coa、琥珀酸和琥珀酰-coa到各种产物(如bdo)的途径工程化到微生物中的酶、基因和方法,是本领域公知的(参见,例如,u.s.publ.no.2011/020108)。bdo途径酶组代表可以将琥珀酸或α-酮戊二酸转化为bdo的酶组,如图6所示。例如,bdo可以从琥珀酰-coa通过以前公开的途径产生(参见例如,burk et al.,wo 2008/115840)。图6示出了可以使用如本技术所述通过使用甲醇作为碳源制备的初级代谢物(例如乙酰-coa)的示例性途径。如图6所示,生物体包含至少一种编码表达量足以生产bdo的bdo途径酶的外源核酸。在某些实施例中,bdo途径酶选自(1)琥珀酰-coa合成酶;(2)非coa依赖性的琥珀酸半醛脱氢酶;(3)α-酮戊二酸脱氢酶;(4)谷氨酸:琥珀酸半醛转氨酶;(5)谷氨酸脱羧酶;(6)coa依赖性琥珀酸半醛脱氢酶;(7)4-羟基丁酸脱氢酶;(8)α-酮戊二酸脱羧酶;(9)4-羟基丁酰coa:乙酰-coa转移酶;(10)丁酸激酶;(11)磷酸转丁酰基酶;(12)醛脱氢酶;和(13)醇脱氢酶。优选的途径包括来自α-酮戊二酸的途径,例如,步骤8、7、9、12和13;步骤3、6、7、9、12和步骤13;以及步骤1、6、7、9、12、13。或者,单一蛋白质可以包含步骤12和13的活性。例如,可以在wo2008115840中找到具体的酶、酶的种类和酶的来源及其基因。
[0195]
在一些实施例中,本公开内容提供了包含融合蛋白的生物体,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白,并且所述生物体被工程化以提高可用于生产目标产物分子的还原当量的可用性。本领域技术人员可以知晓,任何生产中需用还原当量的产物分子,均可以在其他的生物合成途径中显示出增加的产量。
[0196]
在许多工程化的途径中,受到还原当量不足或还原当量损失为副产物,妨碍了基于碳水化合物原料实现最大产物产量。甲醇是一种相对廉价的有机原料,其可以通过使用融合蛋白和一种或多种代谢酶用于产生还原当量,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。通过甲醇代谢产生的还原当量随后可用于驱动葡萄糖进入bdo生产途径,例如,如图6所示。
[0197]
图6示出了可以使用如本技术所述通过使用甲醇作为碳源制备的初级代谢物(例如乙酰-coa)的示例性途径。如图6所示,生物体包含至少一种编码表达量足以生产bdo的bdo途径酶的外源核酸。在某些实施例中,bdo途径酶选自(1)琥珀酰-coa合成酶;(2)非coa依赖性的琥珀酸半醛脱氢酶;(3)α-酮戊二酸脱氢酶;(4)谷氨酸:琥珀酸半醛转氨酶;(5)谷
氨酸脱羧酶;(6)coa依赖性琥珀酸半醛脱氢酶;(7)4-羟基丁酸脱氢酶;(8)α-酮戊二酸脱羧酶;(9)4-羟基丁酰coa:乙酰-coa转移酶;(10)丁酸激酶;(11)磷酸转丁酰基酶;(12)醛脱氢酶;和(13)醇脱氢酶。优选的途径包括来自α-酮戊二酸的途径,例如,步骤8、7、9、12和13;步骤3、6、7、9、12和步骤13;以及步骤1、6、7、9、12、13。或者,单一蛋白质可以包含步骤12和13的活性。例如,可以在wo2008115840a2中找到具体的酶、酶的种类和酶的来源及其基因。
[0198]
用于将从琥珀酸和琥珀酰-coa到各种产物(如bdo)的途径改造到微生物中的酶、基因和方法,是本领域公知的(参见,例如,u.s.publ.no.2011/0201089)。bdo途径酶组代表可以将琥珀酸或α-酮戊二酸转化为bdo的酶组,如图6所示。如本技术所公开的从medh途径获得的额外还原当量,在利用基于碳水化合物的原料时,提高所有这些产物的产量。例如,bdo可以从琥珀酰-coa通过以前公开的途径产生(参见例如,burk et al.,wo 2008/115840)。
[0199]
经由图6中所示的途径并补充氧化tca循环的反应(例如,柠檬酸合成酶、顺乌头酸、异柠檬酸脱氢酶、α-酮戊二酸脱氢酶)的bdo最大理论产率是1.09mol/mol。
[0200]
1 c6h
12
o6→
1.09c4h
10
o2 1.64co2 0.55h2o
[0201]
当糖和甲醇这两种原料都可用时,甲醇可用于通过采用一种或多种酶来产生还原当量。从甲醇产生的还原当量可用来驱动葡萄糖至bdo生产途径,例如,如图6所示。从理论上讲,葡萄糖中的所有碳都将被保留,由此得到从葡萄糖产生bdo的最大理论产率为每摩尔葡萄糖2mol bdo,无论是在有氧或无氧条件下:
[0202]
10ch3oh 3c6h
12
o6=6c4h
10
o2 8h2o 4co2[0203]
以类似的方式中,琥珀酸和4-hb的最大理论产率可以达到2mol/mol葡萄糖。
[0204]
c6h
12
o6 0.667ch3oh 1.333co2→
2c4h6o4 1.333h2o
[0205]
c6h
12
o6 2ch3oh
→
2c4h8o3 2h2o
[0206]
在其他实施例中,单独的或与本技术提供的bdo途径结合的具有融合蛋白的生物体,可以进一步包含第二甲醛同化途径,所述融合蛋白至少具有(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白,或者可选地包含至少具有(i)甲醇脱氢酶活性和(ii)dhas活性和/或f6pa1d活性的融合蛋白。第二fap还可以利用甲醛(例如未被融合蛋白利用的甲醛)形成可用于例如形成生物质的某些中心代谢途径的中间体。
[0207]
参考图5,在第二甲醛同化途径中,生物体包含至少一种编码甲醛同化途径酶的外源核酸,所述甲醛同化途径酶不同于medh、psi、hps和act蛋白质。第二甲醛同化途径酶可以以足够量表达以产生可用于形成生物质的糖酵解和/或代谢途径的中间体。在一个实施例中,第二甲醛同化途径酶以足以产生糖酵解中间体的量表达。在另一个实施例中,第二甲醛同化途径酶以足以产生可用于形成生物质的代谢途径的中间体的量表达。在一些实施例中,第二甲醛同化途径包含二羟基丙酮(dha)合成酶或dha激酶。优选的dha途径是图5中的dha途径1,其是dha(二羟基丙酮)合成酶的组合,例如ec 2.2.1.3(步骤6)和f6p(果糖-6-磷酸)醛缩酶(步骤7)。在一个实施例中,中间体是dha、dha磷酸盐或其组合。在某些实施例中,生物体包含两种外源性核酸,每种核酸编码一个第二甲醛同化途径酶。
[0208]
除了具有至少(i)甲醇脱氢酶活性和(ii)3-己酮糖-6-磷酸脱氢酶活性和/或6-磷酸-3-己酮糖异构酶活性的融合蛋白以外,细胞还可以具有通过二羟基丙酮(dha)进行的途
径。rump途径和dha途径的融合蛋白都可以用于甲醛的解毒和同化。如图5所示,转酮醇酶首先将甘醇醛从木酮糖-5-磷酸转移至甲醛(步骤6,图5),从而形成dha和g3p,所述dha和g3p是糖酵解中的中间体。然后从dha合成酶得到的dha由dha激酶进一步磷酸化而形成dha磷酸盐(dhap)。dhap可以同化进入糖酵解及其他几个途径。可选地,dha和g3p可由果糖-6-磷酸醛缩酶转化成果糖-6-磷酸(f6p)(图5,步骤7)。
[0209]
在一些实施例中,除了具有至少(i)甲醇脱氢酶活性和(ii)dhas和/或f6pald活性的融合蛋白以外,细胞还可具有如图5所描绘的通过己糖-6-磷酸(h6p)进行的途径。通过己糖-6-磷酸(h6p)进行的途径可以任选使用medh融合蛋白。例如,本公开的工程细胞可以包括dha途径的medh融合蛋白和rump途径的medh融合蛋白,其可以用于甲醛的解毒和同化。
[0210]
工程细胞中的dha合成酶(其在一些实施例中可以作为具有medh的融合蛋白)可以是外源dha合成酶,例如来自以下的dha合成酶:分枝杆菌种(mycobacter sp.)jc1 dsm 3803菌株(aag12171.2);ogataea parapolymorpha dl-1(efw95760.1);或博伊丁假丝酵母(aac83349.1)。dha合成酶属于(ec)2.2.1.3类酶。表5是各种dha合成酶序列的成对序列一致性的表。
[0211]
表5
[0212][0213]
工程细胞中的dha激酶(其在一些实施例中可以作为具有medh的融合蛋白)可以是外源dha激酶,例如来自以下的dha激酶:安格斯毕赤酵母(pichia angusta)(aich27705.1);酿酒酵母s288c(p54838.1);酿酒酵母s288c(p43550.1);弗氏柠檬酸杆菌atcc 8090(zp_16280678.1);肺炎克雷伯菌亚种(klebsiella pneumoniae subsp.)wglw3(zp_18488498.1);大肠杆菌k-12mg1655(np_415718.6);大肠杆菌k-12mg1655(np_415717.1);或大肠杆菌k-12mg1655(np_415716.4)。dha合成酶属于(ec)2.7.1.121类酶。表6是各种dha激酶序列的成对序列一致性的表。
[0214]
表6
[0215][0216][0217]
工程细胞中的果糖-6-磷酸醛缩酶(在一些实施例中可以作为具有medh的融合蛋白),可以是外源果糖-6-磷酸醛缩酶,例如来自以下的果糖-6-磷酸醛缩酶:嗜甲基拟无枝酸菌239的(aij24623.1);甲醇芽孢杆菌mga3质粒pbm19(wp_003349819.1);甲醇芽孢杆菌pb1质粒pbm20(wp_003352247.1);嗜热脱氮地芽孢杆菌ng80-2(wp_008880720.1);嗜热脱氮地芽孢杆菌ng80-2(wp_008880032.1);甲基营养嗜甲基菌atcc 53528(wp_018986971.1);以及甲醇芽孢杆菌mga3(wp_003346852.1)。果糖
‑‑
6-磷酸醛缩酶属于(ec)4.1.2.类酶。
[0218]
工程细胞中的果糖二磷酸醛缩酶(在一些实施例中可以作为具有medh的融合蛋
白),可以是外源性果糖二磷酸醛缩酶。果糖二磷酸醛缩酶属于(ec)4.1.2.13类酶。
[0219]
可以使用公知的方法进行适当的纯化和/或测试,例如对于bdo的生产。对于每一种受试的工程菌株,可以培养适当的重复式样,例如一式三份的培养物。例如,可以监控工程化生产宿主中的产物和副产物的形成。最终产物和中间体,以及其它有机化合物,可通过如hplc(高效液相色谱)、gc-ms(气相色谱-质谱)和lc-ms(液相色谱-质谱法)或其它使用在本领域中公知的其他常规程序的合适分析方法来进行分析。产物从发酵液中的释放,还可以用培养物上清液来测试。副产物和残余的葡萄糖可以通过hplc来量化,例如,对于葡萄糖和醇使用折光率检测器,以及对于有机酸使用uv检测器(lin et al.,biotechnol.bioeng.90:775-779(2005)),或在本领域中公知的其他适合的试验和检测方法。来自外源dna序列的各个酶或蛋白质活性,也可以使用本领域中公知的方法测定。
[0220]
bdo或其它目标分子可以使用多种本领域中公知的方法从培养物的其他成分中分离。所述分离的方法包括,例如,萃取程序,以及包括连续液-液萃取、渗透蒸发、蒸发、过滤、膜过滤(包括反渗透、纳米过滤、超滤、和微滤)、膜渗滤、膜分离、反渗透、电渗析、蒸馏、萃取蒸馏、反应性蒸馏、共沸蒸馏、结晶和重结晶、离心、萃取过滤、离子交换层析,尺寸排阻层析、吸附层析,活性碳吸附、氢化、和超滤在内的方法。所有上述方法在本领域中是公知的。
[0221]
目标分子隔离工艺的实施例包括:对于13bdo、14bdo、丁二烯、甲基乙烯基甲醇、3-丁烯-1-醇、正丙醇,异丙醇,丙烯和巴豆醇使用蒸馏;对于6aca(可选地,其可转化为己内酰胺,然后以蒸馏纯化作为最终步骤)、hmda、己二酸或其衍生物、琥珀酸或其衍生物使用结晶;或对于甲基丙烯酸或其衍生物使用结晶、蒸馏、或萃取的任一种。
[0222]
目标分子例如13bdo。14bdo、丁二烯、甲基乙烯基甲醇、正丙醇、异丙醇、丙二醇,巴豆醇;3-丁烯-1-醇,6aca,hmda,己二酸或其衍生物,琥珀酸或其衍生物,或甲基丙烯酸或其衍生物,是在商业和工业应用中使用的化学品。在一些实施例中,bdo和/或4-hb用于各种商业和工业应用中。这种应用的非限制性实施例包括用于生产塑料、弹性纤维、聚氨酯、聚酯(包括聚羟基脂肪酸酯如p4hb或其共聚物),ptmeg和聚氨酯-聚脲共聚物(称为氨纶)、弹性纤维或者lycra
tm
、尼龙等。此外,bdo和/或4-hb也在广泛范围的产品生产中用作原料,包括塑料、弹性纤维、聚氨酯、聚酯(包括聚羟基脂肪酸酯如p4hb或其共聚物),ptmeg和聚氨酯-聚脲共聚物(称为氨纶)、弹性纤维或者lycra
tm
、尼龙等。
[0223]
因此,在一些实施例中,提供了生物基的塑料、弹性纤维、聚氨酯、聚酯(包括聚羟基脂肪酸酯如p4hb或其共聚物)、ptmeg和聚氨酯-聚脲共聚物(称为氨纶)、弹性纤维或者lycra
tm
、尼龙等,其包含一种或多种由本技术所提供的生物体或使用本技术所公开的方法而产生的生物衍生bdo和/或4-hb或生物衍生bdo和/或4-hb中间体。
[0224]
如本技术所用的术语“生物衍生”,意思是来源于生物有机体或由生物有机体合成,并可以看作是可再生的资源,因为其可以由生物有机体产生。这样的生物有机体,特别是本技术所公开的微生物有机体,可利用原料或生物质,例如,从农业、植物、细菌或动物来源获得的糖或碳水化合物。可选地,生物有机体可以利用大气中的碳。如本技术中所使用的术语“生物基”是指全部或部分由本公开的生物衍生化合物组成的产物。生物基或生物衍生的产物与石油衍生的产物相反,其中后者产物衍生或合成自石油或石化原料。
[0225]
在一些实施例中,本技术提供了包含生物衍生bdo的培养基。在一些实施例中,所述生物衍生bdo是通过培养本技术所提供的具有融合蛋白和bdo途径的生物体产生的。在某
些实施例中,生物衍生bdo的碳-12,碳-13和碳-14同位素比率反映了大气二氧化碳摄取源。在一个实施例中,所述培养基分离自具有融合蛋白和bdo途径的生物体。
[0226]
在其他实施例中,本技术提供了一种生物衍生bdo。在一些实施例中,所述生物衍生bdo是通过培养本技术所提供的具有融合蛋白和bdo途径的生物体产生的。在某些实施例中,上述生物衍生bdo的fm值为至少80%,至少85%,至少90%,至少95%或至少98%。在某些实施例中,所述生物衍生bdo是培养基的组分。
[0227]
在某些实施例中,本技术提供了包含本技术所提供的生物衍生bdo的组合物,例如,通过培养本技术所提供的具有mdh蛋白和bdop(bdo途径)的生物体产生的生物衍生bdo。在一些实施例中,所述组合物进一步包括除所述生物衍生bdo以外的化合物。在某些实施例中,除所述生物衍生bdo以外的化合物,是痕量的本技术所提供的具有融合蛋白和bdo途径的生物体的细胞部分。
[0228]
在一些实施例中,本技术提供包含本技术提供的生物衍生bdo的生物基产物。在某些实施例中,所述生物基产物是塑料、弹性纤维、聚氨酯、聚酯、聚羟基脂肪酸酯、聚-4-hb,聚-4-hb共聚物、聚(四亚甲基醚)二醇、聚氨酯-聚脲共聚物、氨纶、弹性纤维、lycra
tm
,或尼龙。在某些实施例中,所述生物基产物包含至少5%的生物衍生bdo。在某些实施例中,生物基产物是(i)聚合物、thf或thf衍生物或gbl或gbl衍生物;(ii)塑料、弹性纤维、聚氨酯、聚酯、聚羟基脂肪酸酯、聚-4-hb、聚-4-hb共聚物、聚(四亚甲基醚)二醇、聚氨酯-聚脲共聚物、氨纶、弹性纤维、lycra
tm
、或尼龙;(iii)聚合物、树脂、纤维、珠粒、颗粒、丸粒、薄片、塑料、聚酯、热塑性聚酯、模塑制品、注射模塑制品、注射模塑部件、汽车部件、挤出树脂、电气部件和外壳;并且可选地在生物基产物被增强或填充的地方以及生物基产物被玻璃增强或填充或被矿物增强或填充的地方;(iv)聚合物,其中所述聚合物包含聚对苯二甲酸丁二醇酯(pbt);(v)聚合物,其中所述聚合物包含pbt,并且所述生物基产物为树脂、纤维、珠粒、颗粒、丸粒、薄片、塑料、聚酯、热塑性聚酯、模塑制品、注射模塑制品、注射模塑部件、汽车部件、挤出树脂、电气部件和外壳;并且可选地其中生物基产物被增强或填充,以及进一步地,其中生物基产物被玻璃增强或填充或被矿物增强或填充;(vi)thf或thf衍生物,其中thf衍生物是聚四亚甲基醚二醇(ptmeg)、聚酯醚(cope)或热塑性聚氨酯;(viii)thf衍生物,其中thf衍生物包含纤维;或(ix)gbl或gbl衍生物,其中gbl衍生物是吡咯烷酮。在某些实施例中,所述生物基产物包含至少10%的生物衍生bdo。在一些实施例中,生物基产物包含生物衍生的bdo为至少20%。在其他实施例中,生物基产物包含至少30%的生物衍生bdo。在一些实施例中,生物基产物包含生物衍生bdo为至少40%。在其他实施例中,生物基产物包含至少50%的生物衍生bdo。在一个实施例中,生物基产物包括所述生物衍生bdo的一部分作为重复单元。在另一个实施例中,本技术提供了通过模制本技术提供的生物基产物而获得的模制产品。在其他实施例中,本技术提供的是用于生产本技术提供的生物基产物的方法,包括令所述生物衍生bdo与自身或与另一种化合物,发生产生所述生物基产物的反应。在某些实施例中,本技术提供包含生物衍生bdo或通过转化生物衍生bdo得到的聚合物。在其他实施例中,本技术提供了一种用于生产聚合物的方法,包括:通过化学或酶促转化,将所述生物衍生bdo转化为聚合物。在其它实施例中,本技术提供包含所述生物衍生bdo或其细胞裂解物或培养物上清液的组合物。
[0229]
bdo是用于生产高性能聚合物,溶剂和精细化学品的宝贵化学品。它是用于制备其
他高价值化学品如四氢呋喃(thf)和γ-丁内酯(gbl)的基础。该价值链由三个主要部分组成,包括:(1)聚合物,(2)thf衍生物,和(3)gbl衍生物。在聚合物的情形中,bdo是用于生产聚对苯二甲酸丁二醇酯(pbt)的共聚单体。pbt是用于汽车,电器,供水系统以及小家电的中等性能的热塑性工程塑料。转化为thf,随后转化为聚四亚甲基醚二醇(ptmeg),提供了用于制造氨纶产物如纤维的中间体。ptmeg还与bdo结合用于生产特种聚酯醚(cope)。cope是具有优异的机械性能和油/环境抵抗性的高模量弹性体,能够在高温和低温极限下操作。ptmeg和bdo也用于在标准的热塑性挤出、压延和模塑设备中加工的热塑性聚氨酯,其具有出色的韧性和耐磨性特征。从bdo产生的gbl为制备吡咯烷酮并服务于农用化学品市场提供了原料。吡咯烷酮作为高性能溶剂越来越多地用于提取工艺中,包括例如在电子工业和制药生产中。因此,本技术中提供的是根据本技术描述的方法得到的生物衍生bdo,和包括生物衍生bdo或使用生物衍生bdo而获得的生物基产物。
[0230]
在一些实施例中,碳质原料及其他细胞摄取源,如磷酸盐、氨、硫酸盐、氯化物及其它卤素,可以选择为改变存在于bdo和/或4-hb或任何bdo和/或4-hb途径中间体中的原子的同位素分布。如上列举的各种碳原料和其他摄取源,将在本技术中统称为“摄取源”。摄取源可以为任何存在于产物bdo和/或4-hb或任何bdo和/或4-hb途径中间体中的原子,或为偏离bdo和/或4-hb途径的反应中产生的副产物,提供同位素富集。可以在任何目标原子中实现同位素富集,例如,碳,氢,氧,氮,硫,磷,氯或其它卤素。这同样适用于本技术所提供的mmps和faps,及其中间体。
[0231]
在一些实施例中,可以选择摄取源以改变碳-12,碳-13,碳-14的比率。在一些实施例中,可以选择摄取源,以改变氧-16,氧-17和氧-18的比率。在一些实施例中,可以选择摄取源,以改变氢,氘和氚比率。在一些实施例中,可以选择摄取源,以改变氮-14和氮-15的比率。在一些实施例中,可以选择摄取源,以改变硫-32,硫-33,硫-34,以及硫-35的比率。在一些实施例中,可以选择摄取源,以改变磷-31,磷-32,磷-33的比率。在一些实施例中,可以选择摄取源,以改变氯-35,氯-36,和氯-37的比率。
[0232]
在一些实施例中,目标原子的同位素比率可以通过选择一个或多个摄取源来改变为所需的比例。摄取源可以从天然来源得到,如在自然界中发现,或从人造来源得到,且本领域技术人员可以选择天然来源、人造来源,或其组合,以得到所需的目标原子同位素比率。人造摄取源的一个例子包括,例如,至少部分衍生自化学合成反应的摄取源。这种同位素富集的摄取源可商购获得,或在实验室中制备和/或可选地与天然来源的摄取源混合,以获得所需的同位素比率。在一些实施例中,可以通过选择自然界中存在的摄取源的期望来源,来得到摄取源的目标同位素比率。例如,如本技术所讨论的,天然来源可以是源自或合成于生物有机体的生物基来源,或可以是例如基于石油的产品或大气。在一些所述实施例中,碳的来源,例如,可以来自化石燃料碳源(其碳-14可以相对贫乏),或环境或大气碳源,如二氧化碳,其可具有比其石油衍生对应物更多的碳-14。
[0233]
同位素富集容易通过使用本领域中已知的技术进行质谱分析法评估,如稳定同位素比率质谱法(sirms)和核磁共振位点特异性天然同位素分馏(snif-nmr)。所述质谱技术可以与分离技术例如液相色谱(lc)和/或高效液相色谱(hplc)组合使用。
[0234]
因此,在一些实施例中,提供了bdo和/或4-hb或bdo和/或其4-hb途径中间体,其具有的碳-12、碳-13、碳-14比率反映着大气中的碳(也称环境碳)摄取源。
[0235]
此外,本公开部分涉及如本技术所公开的生物产物bdo和/或4-hb或bdo和/或4-hb中间体,以及由此衍生的产物,其中所述bdo和/或4-hb或bdo和/或4-hb中间体的碳-12,碳-13,碳-14同位素比率与环境co2具有大约相同的值。
[0236]
本领域技术人员将会理解,生物体可以被工程化为以碳源(如单独的甲醇或与其他碳水化合物组合)生长时分泌生物合成化合物。所述化合物包括,例如,bdo和任何bdop中间代谢物。所需要的只是对一个或多个所需的酶或蛋白质的活性进行改造,以达成所需的化合物或其中间体的生物合成,包括,例如,包括部分或全部的bdo生物合成途径。因此,本技术提供的是一种生物体,其在碳水化合物或其他碳源上生长时生产和/或分泌bdo,和/或在碳水化合物或其他碳源上生长时生产和/或分泌任何在bdop中所示的中间代谢物。本技术所提供的生产bdo的微生物有机体可从中间体开始合成。这同样适用于甲醛同化作用中的中间体。
[0237]
在一个实施例中,碳源是甲醇或甲酸。在某些实施例中,使用甲醇作为碳源。在其他实施例中,使用甲酸作为碳源。在具体的实施例中,在本技术所述的生物体中,单独使用甲醇作为碳源,或与本技术所提供的产物途径相互组合。
[0238]
在一个实施例中,碳源包括甲醇和糖(例如葡萄糖)或含糖生物质。在另一个实施例中,所述碳源包括甲酸和糖(例如,葡萄糖)或含糖的生物质。在一个实施例中,所述碳源包括甲醇、甲酸和糖(例如,葡萄糖)或含糖的生物质。在具体的实施例中,在发酵原料中,提供甲醇或甲酸或两者与糖(例如,葡萄糖)或含糖生物质的混合物。在某些实施例中,所提供的糖允许菌株充分生长。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为200:1至1:200。在某些实施例中,碳源包括甲酸和糖(例如葡萄糖)。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸:糖为200:1至1:200。在某些实施例中,碳源包括甲醇、甲酸和糖(例如葡萄糖)的混合物。在某些实施例中,所提供的糖用于菌株充分生长。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸:糖为200:1至1:200。
[0239]
实施例1:制备medh融合蛋白构建体
[0240]
制备用于表达各种含有medh的融合蛋白的核酸构建体,以及无融合的对照构建体和无插入对照。表7是核酸构建体的列表,表8提供了融合蛋白构建体中使用的基因的细节。
[0241]
表7
[0242]
pzs13s-p100-2315ls-linker-hps-phipzs13s-p100-2435a-linker-hps-phipzs13s-p100-2451a-linker-hps-phipzs13s-p108-2315ls-linker-hps-phipzs13s-p108-2435a-linker-hps-phipzs13s-p108-2451a-linker-hps-phipzs13s-p100-2435a-hps-phipzs13s-p100-2451a-hps-phipzs13s-p108-2315ls-hps-phipzs13s-p108-2435a-hps-phipzs13s-p108-2451a-hps-phi
[0243]
表8
[0244][0245]
如实施例2所述,将表达这些medh-ggsggsgsgsggsgsgsggs-2616a融合体的核酸构建体转化到大肠杆菌中。
[0246]
实施例2:表达medh融合蛋白的工程大肠杆菌的制备及分析
[0247]
将表7中列出的核酸构建体转化到大肠杆菌中。评估表达medh-2616a融合体的大肠杆菌转化体的可溶性蛋白表达、大肠杆菌细胞裂解物中的甲醇脱氢酶活性、以及赋予工程化大肠杆菌菌株(eckh-8665)以甲醇为碳源的生长能力的能力。测试若干变量以鉴定赋予改善活性的组合,包括:启动子强度,不同的medh变体,以及medh和2616融合体中的肽接头。
[0248]
将核酸构建体转化到大肠杆菌7539菌株中,并在37℃下在5ml lb carb100肉汤中生长过夜。
[0249]
体外测定条件如下:细胞裂解:收集1ml细胞,并用有溶菌酶和核酸酶的200μl bugbuster裂解细胞(在数据归一化时将样品的全部od归一化)。测定:将10μl裂解物加入到100μl测定缓冲液中,在2小时内在340nm监测nadh产生速率。测定缓冲液:100mm tris 8.5,500mm甲醇,5mm mgcl2,500mm nad
。
[0250]
在含有所示质粒的大肠杆菌宿主eckh-8665的bioscreen仪器中生长。培养基是含有2g/l甘油和500mm甲醇的mm9基本培养基。重复3次。见表9。
[0251]
表9
[0252][0253]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。