干燥固体以及由其制造的液体氯氧化物
1.本技术是申请日为2019年4月2日、申请号为201980034372.7(国际申请号为pct/jp2019/014649)、发明名称为“由劣化次氯酸盐得到新型氯氧化物组合物的制造方法”的发明专利申请的分案申请。
技术领域
2.本发明涉及一种对贮存中氯发生了分解并生成了氯离子或氯酸根离子的次氯酸钠进行再生而获得新型有用的杀菌消毒剂的制造方法。
背景技术:
3.次氯酸钠是向氢氧化钠溶液中通入氯气而得到的液体氯,作为供水管道、游泳池、食品添加剂的有用的杀菌消毒剂是已知的,而另一方面,由于次氯酸钠不稳定,氯成分在贮存中发生分解,生成氯离子(cl-),或因歧化反应而生成氯酸根离子(clo
3-),从而失去其功效。另外,氯酸根离子(clo
3-)在干燥结晶的状态下会因摩擦等而经常发生起火、爆炸等事故,废弃方法需要注意。
4.另一方面,次氯酸钠的大规模制造商通过使用冷却器等进行温度管理来防止品质降低,但主要面向食品制造商等少量用户的细分商难以进行温度管理,在贮存中品质降低而发生上述问题。
5.另外,当次氯酸钠中的次氯酸根离子减少、氯离子或氯酸根离子的含量增多时,难以正常使用,其废弃时需要进行脱氯
·
中和后而废弃,或让承包商取走,在那里进行废弃处理。
6.现有技术文献
7.专利文献
8.专利文献1:日本专利第5931253号
技术实现要素:
9.用于解决问题的方案
10.本发明解决上述问题,将贮存中品质降低了的次氯酸钠或回收的次氯酸钠当作资源,通过使其重新反应来生产新型具有有用的价值的杀菌消毒剂。另外,完成的杀菌消毒剂通过使内容物成分重新反应而完成同时含有次氯酸根离子、亚氯酸根离子的前所未有的氯氧化物液体,而且通过进一步使其干燥,还成功地制造出即使长期保存,内容物成分也不会发生变化的固体。而且还发现,该杀菌消毒剂还具有不仅杀菌效果提高而且氯的气味也小的优点,并具有能够生产随着循环利用可以消化制造成本的具有附加价值的商品的优点。
11.研究开发了一种制造新型杀菌消毒剂的方法,即,回收贮存中品质降低了的次氯酸钠,通过使其重新反应来再生次氯酸,并且使贮存中生成的氯酸也发生反应,制造同时含有次氯酸、亚氯酸的新型杀菌消毒剂。
12.另外,提供一种获得随着循环利用可以消化制造成本的具有附加价值的新型杀菌
消毒剂的方法。
13.本发明人为了解决上述问题,使品质降低了的次氯酸钠重新反应来制造新型具有商品价值的杀菌消毒剂。
14.该杀菌消毒剂是通过如下方法得到的同时含有次氯酸和亚氯酸新型的氯氧化物液体或固体,即,通过将浓度降低了的次氯酸钠以氯气的形式进行再回收,并且使其与难以进行废弃处理的氯酸钠反应,以二氧化氯气体的形式进行再回收,并使其碱性稳定,从而获得同时含有次氯酸和亚氯酸新型的氯氧化物液体或固体。
15.首先,确认由次氯酸钠品质的差异导致了什么样的品质劣化的差异。此时重要的是随着有效氯的消失的氯离子与氯酸根离子的生成量是否存在差异,12%的普通级次氯酸钠溶液流通时大多会生成约14000~26000ppm的氯酸根离子,而12%的低食盐级次氯酸钠溶液中的氯酸根离子为5000~6000ppm,最多为 12000ppm以下,而且最终的氯离子的生成量也存在很大的差异,因此可知,在研讨反应制法时,需要在考虑氯酸根离子、氯离子的最大生成量的基础上确立反应制法。然而,即使次氯酸钠的有效氯因分解而消失了,有效氯4%以下的状态也不符合次氯酸钠的标准,也不能说将次氯酸钠用于原料。因此可知,对于作为原料的品质降低了的次氯酸钠(以下称为劣化次氯酸钠),有效氯为4%以上、氯酸根离子生成量至约48000ppm的成为目标原料。
16.接着,考虑对劣化次氯酸钠中所含的次氯酸根离子、氯酸根离子、氯离子等进行定量,通过反应找到使其气化的条件以得到回收液。然而,与通常已知的各种氯原料的反应制法不同,由于劣化次氯酸钠中同时存在大量的各种氯离子成分,而且氯酸根离子与氯离子为伴随着有效氯消失的生成物,因此,与以单品或饱和液为原料时的通常的化学反应方法相比反应性差,需要找到新的反应条件和回收方法。
17.另外可知,对于该反应方法而言,重要的是投入的硫酸的浓度与反应母液中的酸度、劣化次氯酸钠中的生成物即氯离子的量,特别是因氯离子为源于次氯酸钠的生成物而难以调节,需要组合温度、酸度、空气的吹入条件等来调节反应生成量以增加收率。
18.另外,可知通过反应获得的氯气与二氧化氯气体用氢氧化钠或氢氧化钙来回收,然而如果不分别回收氯气与二氧化氯气体,则会导致收率降低或生成氯酸根离子,可知需要一种由加入劣化次氯酸钠和硫酸后的反应母液中使氯气、然后是二氧化氯气体的阶段性释放技术。
19.亦即,第一反应是由以劣化次氯酸钠为原料并在其中加入了硫酸的反应母液中产生氯气。接着进行第二反应,即,追加添加硫酸等,在改变其它各条件的基础上使其产生二氧化氯气体。另外,因为已经明确了在第一反应中,因反应母液中的酸度等反应条件不同而导致氯离子或氯酸根离子有所增减,因此,在第一反应后针对组成变化了的反应母液进行第二反应的调节,使其产生二氧化氯气体是本制造方法的一个特征。
20.另外,虽然第一反应中产生的氯气能够用氢氧化钠溶液或氢氧化钙溶液来回收,但如果将主要在第二反应时产生的二氧化氯气体吹入到只是氢氧化钠溶液或氢氧化钙溶液中,则会生成大量的氯酸根离子。因此,需要通过使用在氢氧化钠溶液或氢氧化钙溶液中加入过氧化氢水而成的溶液作为回收液来防止氯酸根离子的产生,但相反地在过氧化氢存在下氯气会发生分解而转化成氯离子。
21.综上所述,对于第一反应用的回收液与第二反应用的回收液,设有两个回收槽,分
别回收以氯气为主的回收液a与以二氧化氯气体为主的回收液b,然后进行混合并使其稳定也是本发明的特征之一。
22.另外,通过本制造方法制造且符合作为食品添加剂的次氯酸钠的标准的混合液的状态的保存性差,只能在冷藏条件下进行销售。
23.因此,不仅用氢氧化钠回收第一反应的氯气,而且还用氢氧化钙来回收,然后与由第二反应获得的回收液混合并使其干燥而得到的固体杀菌消毒剂也是本发明的特征之一。
24.而且,在杀菌消毒剂为固体的情况下,需要通过干燥而将有效氯浓缩为高浓度,因此,需要在尽可能降低回收液的碱度并尽可能降低氯离子或残碱成分量的基础上进行回收,如此制造并干燥而成的固体杀菌消毒剂的特征在于,符合作为食品添加剂的高级漂白粉的标准,而且即使在常温下保存其内容物成分的组成也不会发生变化。
25.因而,在杀菌消毒剂为液体的情况下和为固体的情况下,所需的反应条件与所需的回收液的纯度不同,但通过该方法制造的杀菌消毒剂的特征在于,兼备次氯酸和亚氯酸各自的杀菌特征,符合作为食品添加剂的次氯酸钠或高级漂白粉的标准,且可以单一制剂的形式来提供。
26.而且,为了实现这些,用低食级次氯酸钠和普通级次氯酸钠,调节反应条件,作为第一反应,在为低食级次氯酸钠的情况下,将反应母液中的硫酸浓度设为4.0%~6.37%。在为普通级次氯酸钠的情况下,将反应母液中的硫酸浓度设为4.0%~4.5%。接着,作为第二反应,在为低食级次氯酸钠的情况下,在最终产品为次氯酸钠标准品的情况下,在反应母液中加入过氧化氢水,并且使反应母液中的硫酸浓度为30.0%~59.4%,在为高级漂白粉的情况下,设为30.0%~ 40.0%。而且,硫酸浓度使用50.0w/w%~70.0w/w%。在为普通级次氯酸钠的情况下,设为25.0%~30.0%,并且使用的硫酸浓度为65w/w%,进而,通过设置中间捕集槽来清洗去除氯气,防止氯气随着过量生成而混入回收液中。
27.另外,需要在投入原料后立即向反应槽中吹入大量的空气以提高回收率。
28.对于通过本制造方法分别回收的回收液a和回收液b,为了满足次氯酸钠的食品添加剂标准,以将回收液a设为1时的有效氯浓度比计,以1:0.43~1:0.6混合时符合标准,为了满足高级漂白粉的食品添加剂标准,以有效氯浓度比计为1:33.95的范围符合标准。
29.而且,发现以该配比制造的高级漂白粉比通常销售的高级漂白粉具有长期保存性,且符合标准。
30.本发明还提供以下内容。
31.(项目1)
32.一种干燥固体,其含有次氯酸盐和亚氯酸盐。
33.(项目2)
34.如项目1所述的干燥固体,其中,前述固体为干燥颗粒状。
35.(项目3)
36.如项目1或2所述的干燥固体,其中,前述固体含有次氯酸钙。
37.(项目4)
38.如项目1~3中任一项所述的干燥固体,其中,前述固体:
39.(1)含有有效氯60.0%以上;
40.(2)有氯的气味;
41.(3)在该固体0.5g中加入水5ml并摇动混合,在其中浸入红色石蕊试纸时,石蕊试纸变成蓝色,然后褪色;
42.(4)向0.1g该固体中加入2ml乙酸(1
→
4)时,产生气体并溶解,在其中加入水5ml,进行过滤后的液体呈现出钙盐的反应。
43.(项目5)
44.如项目1~4中任一项所述的干燥固体,其中,前述固体含有检测界限以上且8100ppm以下的so4系成分。
45.(项目6)
46.如项目1~5中任一项所述的干燥固体,其中,前述固体中的次氯酸盐与亚氯酸盐之比为1:5~25。
47.(项目7)
48.如项目1~6中任一项所述的干燥固体,其中,前述固体中的有效氯浓度为600,000ppm~900,000ppm的范围内,游离残留氯浓度为900ppm~60,000ppm的范围内。
49.(项目8)
50.一种液体,所述液体是使项目1~7中任一项所述的干燥固体溶解而得到的。
51.(项目9)
52.如项目8所述的液体,其中,在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:7~35。
53.(项目10)
54.如项目8或9所述的液体,其中,在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,游离残留氯浓度为150ppm~900ppm的范围内。
55.(项目11)
56.如项目8所述的液体,其中,在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6~30。
57.(项目12)
58.如项目8或11所述的液体,其中,在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,游离残留氯浓度为1,000ppm~6,000ppm的范围内。
59.(项目13)
60.如项目8所述的液体,其中,在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6~30。
61.(项目14)
62.如项目8或13所述的液体,其中,在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,游离残留氯浓度为2,500ppm~12,000ppm的范围内。
63.(项目15)
64.一种方法,所述方法是制造含有次氯酸盐和亚氯酸盐的干燥固体的方法,其包括如下工序:
65.准备含有次氯酸根离子、氯酸根离子和氯离子的溶液的工序;
66.在该溶液中添加硫酸,使其生成氯气的第一反应工序;
67.在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的
形式回收的工序;
68.在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;
69.在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;
70.将回收液a与回收液b混合的工序;和
71.使获得的混合溶液干燥而制成固体的工序。
72.(项目16)
73.如项目15所述的方法,其中,前述回收液a含有氢氧化钙。
74.(项目17)
75.如项目15或者16所述的方法,其中,还包含在第1反应后的反应母液中添加过氧化氢的工序。
76.(项目18)
77.如项目15~17中任一项所述的方法,其中,在将前述回收液a与前述回收液b混合的工序中,将该回收液a的有效氯浓度设为1时,回收液b的有效氯浓度为9.6~33.95的范围内。
78.(项目19)
79.如项目15~18中任一项所述的方法,其中,在将前述回收液a与前述回收液b混合的工序中,该回收液a和该回收液b分别制成浆料后混合。
80.(项目20)
81.如项目15~19中任一项所述的方法,其中,将前述回收液a与回收液b 混合的工序包含如下工序:将前述回收液a预干燥,形成造粒核,将回收液b 制成浆料,然后,将回收液a干燥物投入回收液b浆料中。
82.(项目21)
83.如项目15~20中任一项所述的方法,其中,前述干燥而制成固体的工序包含进行热风干燥20分钟~30分钟的工序。
84.(项目22)
85.如项目15~21中任一项所述的方法,其中,前述干燥而制成固体的工序包括:使回收液a和回收液b的水分量分别减少至20%以下。
86.(项目23)
87.一种方法,所述方法是由含有次氯酸根离子、氯酸根离子和氯离子的溶液制造新型杀菌消毒剂的方法,其包括如下工序:
88.对该溶液中的次氯酸根离子浓度、氯酸根离子浓度和氯离子浓度进行定量的工序;
89.在该溶液中添加硫酸,使其生成氯气的第一反应工序;
90.在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的形式回收的工序;
91.在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;
92.在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;和
93.将回收液a与回收液b混合,得到新型杀菌消毒剂的工序。
94.(项目24)
95.如项目23所述的方法,其中,前述含有次氯酸根离子、氯酸根离子和氯离子的溶液含有品质劣化了的次氯酸盐的溶液。
96.(项目25)
97.如项目24所述的方法,其中,前述含有品质劣化了的次氯酸盐的溶液源于低食盐级次氯酸钠溶液。
98.(项目26)
99.如项目24所述的方法,其中,前述含有品质劣化了的次氯酸盐的溶液源于普通级次氯酸钠溶液。
100.(项目27)
101.如项目25所述的方法,其中,前述杀菌消毒剂为固体产品,第一反应工序中的反应母液中的硫酸浓度为4.00~6.37%,第二反应工序中的反应母液中的硫酸浓度为30.00~40.00%,第二反应工序中使用的硫酸浓度为50.0w/w%~ 70.0w/w%。
102.(项目28)
103.如项目25所述的方法,其中,前述杀菌消毒剂为液体产品,第一反应工序中的反应母液中的硫酸浓度为4.00~6.37%,第二反应工序中的反应母液中的硫酸浓度为30.00~59.04%,第二反应工序中使用的硫酸浓度为50.0w/w%~ 70.0w/w%。
104.(项目29)
105.如项目26所述的方法,其中,第一反应工序中的反应母液中的硫酸浓度为 4.00~4.50%,第二反应工序中的反应母液中的硫酸浓度为25.00~30.00%,第二反应工序中使用的硫酸浓度为65w/w%。
106.(项目30)
107.如项目23~29中任一项所述的方法,其中,在第一反应中,将原料中的氯化物浓度设为x%、反应母液中的硫酸浓度设为y%时,满足如下关系式:
108.(1)y=-1.2676x 9.84393;
109.(2)x≤4。
110.(项目31)
111.如项目23~30中任一项所述的方法,其中,前述回收液a含有氢氧化钠或氢氧化钙。
112.(项目32)
113.如项目23~31中任一项所述的方法,其中,前述回收液b含有氢氧化钠和过氧化氢。
114.(项目33)
115.如项目23~32中任一项所述的方法,其中,一边吹入空气一边进行前述第一反应工序。
116.(项目34)
117.如项目23~33中任一项所述的方法,其中,一边吹入空气一边进行前述第二反应工序。
118.(项目35)
119.如项目23~34中任一项所述的方法,其中,在反应槽与含有回收液b的回收槽之间,设置有含有过氧化氢的中间捕集槽。
120.(项目36)
121.如项目23~35中任一项所述的方法,其中,还包含在第1反应后的反应母液中添加过氧化氢的工序。
122.(项目37)
123.如项目23~36中任一项所述的方法,其中,在将前述回收液a与回收液b 混合的工序中,使回收液a的有效氯浓度为1,回收液b的有效氯浓度为0.43~ 0.6。
124.(项目38)
125.如项目23~37中任一项所述的方法,其中,前述杀菌消毒剂含有次氯酸钠。
126.(项目39)
127.如项目38所述的方法,其中,前述杀菌消毒剂:
128.(1)含有有效氯4.0%以上;
129.(2)有氯的气味;
130.(3)呈现出钠盐的反应和次氯酸盐的反应;
131.(4)在本品的水溶液(1
→
25)4ml中加入磷酸缓冲液(ph8)100ml后的溶液在波长291~294nm处有最大吸收部;
132.(5)在本品中浸入红色石蕊试纸时,石蕊试纸变成蓝色,然后褪色。
133.(项目40)
134.如项目23~39中任一项所述的方法,其中,前述杀菌消毒剂含有检测界限以上且8100ppm以下的so4系成分。
135.(项目41)
136.如项目23~40中任一项所述的方法,其中,前述消毒剂中的次氯酸根离子与亚氯酸根离子之比为1:0.24~0.3。
137.(项目42)
138.如项目23~41中任一项所述的方法,其中,前述消毒剂中的有效氯浓度为约60,000ppm,游离残留氯浓度为约60,000ppm。
139.(项目43)
140.一种杀菌消毒剂,其是通过项目23~42中任一项所述的方法制造而成的。
141.(项目44)
142.如项目43所述的杀菌消毒剂,其中,次氯酸根离子与亚氯酸根离子之比为 1:0.24~0.3。
143.(项目45)
144.如项目43或44所述的杀菌消毒剂,其中,前述消毒剂中的有效氯浓度为约60,000ppm,游离残留氯浓度为约60,000ppm。
145.(项目46)
146.一种液体氯氧化物,其是使用项目1~7中任一项所述的干燥固体而制造的液体氯氧化物,通过包含如下工序的方法来制备:
147.(a)将该干燥固体溶解于水中,制备ph升高了的溶液的工序;
148.(b)在维持工序(a)中制备的溶液的ph的同时,通过在该溶液中加入非钙无机碱性试剂而使钙盐沉淀,从而形成包含液相和含有钙盐的固相、且该液相中的钙离子浓度降低了的固液混合相的工序;和
149.(c)由工序(b)中所形成的固液混合相中仅取出液相,从而得到液体氯氧化物的工序。
150.(项目47)
151.一种液体氯氧化物,其是使用项目1~7中任一项所述的干燥固体而制造的液体氯氧化物,通过包含如下工序的方法来制备:
152.(a)将该干燥固体溶解于水中,制备ph为10.0以上的溶液的工序;
153.(b)在将工序(a)中制备的溶液的ph维持在10.0以上的同时,通过在该溶液中加入非钙无机碱性试剂而使钙盐沉淀,从而形成包含液相和含有钙盐的固相、且使该液相中的钙离子浓度为24ppm以下的固液混合相的工序;和
154.(c)由工序(b)中所形成的固液混合相中仅取出液相,从而得到液体氯氧化物的工序。
155.(项目48)
156.如项目8~14、46和47中任一项所述的液体或液体氯氧化物,其中,钙浓度实质上为检测界限以下。
157.(项目49)
158.如项目8~14、46和47中任一项所述的液体或液体氯氧化物,其中,钙浓度为24ppm以下。
159.(项目50)
160.项目1~7中任一项所述的干燥固体、项目8~14中任一项所述的液体、或者项目46~49中任一项所述的液体或液体氯氧化物作为杀菌消毒剂的用途。
161.(项目51)
162.项目1~7中任一项所述的干燥固体、项目8~14中任一项所述的液体、项目43~45中任一项所述的杀菌消毒剂、或者项目46~49中任一项所述的液体或液体氯氧化物作为食品添加剂的用途。
163.(项目52)
164.项目1~7中任一项所述的干燥固体、项目8~14中任一项所述的液体、项目43~45中任一项所述的杀菌消毒剂、或者项目46~49中任一项所述的液体或液体氯氧化物用于对食品进行杀菌消毒的用途。
165.(项目53)
166.一种方法,所述方法是由含有次氯酸根离子、氯酸根离子和氯离子的溶液制造新型药剂的方法,其包括如下工序:
167.对该溶液中的次氯酸根离子浓度、氯酸根离子浓度和氯离子浓度进行定量的工序;
168.在该溶液中添加硫酸,使其生成氯气的第一反应工序;
169.在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的形式回收的工序;
170.在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;
171.在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;和
172.将回收液a与回收液b混合,得到新型药剂的工序。
173.(项目54)
174.如项目53所述的方法,所述方法具有用药剂替代了项目24~项目42中指定的杀菌消毒剂时的特征中的一个或多个特征。
175.(项目55)
176.一种药剂,其是通过项目53或者54所述的方法制造而成的。
177.(项目56)
178.如项目55所述的药剂,所述药剂具有用药剂替代了项目44或项目45中指定的杀菌消毒剂时的特征中的一个或多个特征。
179.(项目57)
180.项目55或56所述的药剂作为杀菌消毒剂的用途。
181.(项目58)
182.项目55或56所述的药剂作为食品添加剂的用途。
183.(项目59)
184.项目55或者56所述的药剂用于对食品进行杀菌消毒的用途。
185.发明的效果
186.本发明由品质降低且生成了氯离子和氯酸根离子的次氯酸钠得到有用的新型杀菌消毒剂,是以作为食品添加剂的次氯酸钠为原料重新获得兼备次氯酸根离子和亚氯酸根离子的特性、并且符合次氯酸钠或高级漂白粉的标准的杀菌消毒剂的发明。另外,次氯酸根离子和亚氯酸根离子共存的液体如果没有冷藏贮存则保存性差,但通过加工成干燥颗粒状固体,具有能够长期保存的优点。
187.另外,通过本方法完成的次氯酸钠或高级漂白粉与同浓度的液体相比,具有氯的气味小、减轻了操作者的负担、容易使用的优点,可以说即使使用复杂的再生方法也能够消化制造成本,制成实际销售的商品。
附图说明
188.图1是表示劣化次氯酸钠的反应17的第二反应时的回收量和组成1的图表。
189.图2是表示劣化次氯酸钠的反应18的第二反应时的回收量和组成2的图表。
190.图3是表示劣化次氯酸钠的反应19的第二反应时的回收量和组成3的图表。
191.图4是表示劣化次氯酸钠的反应20的第二反应时的回收量和组成4的图表。
192.图5涉及(关于回收液a与回收液b的混合溶液(次氯酸钠标准)),表示确认试验(1)次氯酸钠(3)高锰酸钾的褪色,从左起,表示仅次氯酸钠、次氯酸钠与亚氯酸钠的有效氯比
为1:0.6、次氯酸钠与亚氯酸钠的有效氯比为1: 0.7、仅亚氯酸钠。
193.图6表示(关于回收液a与回收液b的混合溶液(次氯酸钠标准))的样品1(有效氯比1:0.429)的吸光度和样品2(有效氯比1:0.6)的吸光度。
194.图7是表示干燥工序的流程图。
195.图8是确认杀菌效果的流程图。
具体实施方式
196.下面,一边示出最佳方式一边说明本发明。在整个本说明书中,应该理解的是,只要没有特别说明,单数形式的表达也包括其复数形式的概念。因而,应该理解的是,只要没有特别说明,单数形式的冠词(例如,英语情况下“a”、“an”、“the”等)也包括其复数形式的概念。另外,应该理解的是,只要没有特别说明,本说明书中所使用的术语以该领域中通常使用的含义来使用。因而,只要没有另外定义,本说明书中所使用的所有专业术语及科学技术术语具有与本发明所属的领域的技术人员通常理解的含义相同的含义。在有冲突的情况下,以本说明书(包括定义)为准。
197.(术语的定义)
198.下面,对本说明书中的术语进行说明。
199.在本说明书中,“含有品质劣化了的次氯酸盐的溶液”是指贮存中氯发生分解而生成了氯离子或氯酸根离子的次氯酸钠的溶液。在本说明书中,次氯酸盐有时也简略为“次”。
200.在本说明书中,“低食盐级次氯酸钠溶液”是指降低了食盐量的次氯酸钠溶液,12%的低食盐级次氯酸钠溶液中的氯酸根离子为5000~6000ppm,最多为 12000ppm以下。
201.在本说明书中,“普通级次氯酸钠溶液”是指未降低食盐量的次氯酸钠溶液, 12%的普通级次氯酸钠溶液流通时生成约14000~26000ppm的氯酸根离子。
202.在本说明书中,“有效氯”或“有效氯浓度”是指漂白粉等杀菌消毒剂中所含的对漂白作用有效的氯的浓度。有效氯可以通过如下方法来定量有效氯浓度,例如,在次氯酸钠试样中加入碘化钾,用硫代硫酸钠对通过cl2 钾i
→
i2 钾cl (1)式生成的游离的碘进行氧化还原滴定(i2 2na2s2o3→
2nai na2s4o6(2)式)。
203.本说明书中,“游离氯”、“游离氯浓度”或“游离残留氯浓度”是通过“日本厚生劳动大臣基于水道法实行规则第17条第2项的规定确定的游离残留氯和结合氯的检验方法”的附录3(以下称为比色法(dpd指示剂))测定的值,是通过dpd指示剂被氧化而获得的值。
204.在本说明书中,“so4系成分”是指源于硫酸的成分,是指硫酸、硫酸盐等。
205.在本说明书中,通过如下方法来进行“热风干燥”,作为干燥条件,将仓库内环境温度设为50~60℃,将仓库内湿度设为10%以下,以1.9m3/s的风量送入热风。
206.在本说明书中,“氯氧化物”是指氯的任意的氧化物。可以列举例如:次氯酸、亚氯酸、氯酸、高氯酸和它们的盐等。还包括七氧化二氯、六氧化二氯、三氧化二氯、二氧化氯、一氧化二氯等。
207.在本说明书中,“高级漂白粉”满足食品添加剂公定书第8版的高级漂白粉中所规定的标准。具体而言,满足以下条件:
208.(1)含有有效氯60.0%以上;
209.(2)有氯的气味;
210.(3)在该固体0.5g中加入水5ml并摇动混合,在其中浸入红色石蕊试纸时,石蕊试纸变成蓝色,然后褪色;
211.(4)向0.1g该固体中加入2ml乙酸(1
→
4)时,产生气体并溶解,在其中加入水5ml,进行过滤后的液体呈现出钙盐的反应。
212.在本说明书中,“t.al”如下所述,为了测定试样中的碱度,用0.1mol/l 盐酸-酸标准溶液滴定试样至其ph达到4.0,当为了使100g试样的ph变成4.0 而所需的0.1mol/l盐酸为1ml时,将碱度(t.al)设为1。ph为4.0是碳酸钠的第二中和点。需要说明的是,高级漂白粉的标准宽泛,通常情况下,由于氯氧化物在各公司里与ph调节剂等的配合不同,因此通常在标准中未记载 t.al的情况较多。然而,由于高级漂白粉含有氯,故显示出较高的t.al值,为高碱性。
213.在本说明书中,“非钙无机碱性试剂”是指含有具有钙以外的阳离子的无机碱性物质的(药)制剂。可理解为只要含有具有钙以外的阳离子的无机碱性物质,任何的无机碱性试剂都可以使用。可以列举例如:碳酸钠、磷酸氢二钠、硫酸钠和氢氧化钠,但并不限定于这些。
214.在本说明书中,“二价以上的无机碱性试剂”是指非钙无机碱性试剂中价数为二价以上的无机碱性试剂。优选为含钠碱性试剂,但并不限定于此。作为优选的二价以上的无机碱性试剂,具有能够使ph变成10以下的能力的无机碱性试剂是有利的。因为可以降低高级漂白粉的ph。作为那样的例子,可以列举碳酸钠、磷酸氢二钠和硫酸钠,但并不限定于这些。然而,本发明中表明,根据情况也可以使用低于二价的无机碱性试剂,例如氢氧化钠。另外,加入硫酸钠等可能是有利的。虽然不希望受理论的束缚,但当加入硫酸钠时,反应后的沉淀槽容易固化,变得难以漂浮,因此操作性提高,因此优选。相对于其它普通无机碱性试剂的投入量1而言,硫酸钠的投入量为0.1左右,只要能够实现目标,也可以为其它的量,可以列举10%以下、优选5%以下、2%以下、1%以下等。
215.在本说明书中,“回收液a”表示在本发明的含有次氯酸盐的溶液的处理方法中回收第一反应工序中生成的气体后的回收液。在本说明书中,“回收液b”表示在本发明的含有次氯酸盐的溶液的处理方法中回收第二反应工序中生成的气体后的回收液。
216.(优选实施方式的说明)
217.下面对本发明的优选实施方式进行说明。下面所提供的实施方式是为了更好地理解本发明而提供的,可理解本发明的范围并不应该限定于下面的记载。因而,本领域技术人员清楚,参考本说明书中的记载可以在本发明的范围内进行适当改变。另外,可理解本发明的下面的实施方式可单独使用,或者也可以使这些实施方式组合而使用。
218.在一个方面中,本发明提供含有次氯酸盐和亚氯酸盐的干燥固体。作为次氯酸盐,可举出次氯酸的碱金属盐或碱土金属盐,可举出例如:钠盐、钾盐、钙盐和镁盐等。作为亚氯酸盐,可举出亚氯酸的碱金属盐或碱土金属盐,可举出例如:钠盐、钾盐、钙盐和镁盐等。本发明的固体的杀菌消毒剂即使在常温下保存其内容物成分的组成也不会发生变化,在制成钙盐的情况下,能够符合作为食品添加剂的高级漂白粉的标准。钾盐或镁盐等盐可以通过在回收液中使用对应的碱金属或碱土金属的碱溶液或者将钠盐或钙盐更换成对应的金属来得到。
219.在一个实施方式中,前述固体为干燥颗粒状。
220.在一个实施方式中,前述固体含有次氯酸钙。
221.在一个实施方式中,前述固体满足食品添加剂公定书第8版的高级漂白粉所规定的标准。具体而言,前述固体:
222.(1)含有有效氯60.0%以上;
223.(2)有氯的气味;
224.(3)在该固体0.5g中加入水5ml并摇动混合,在其中浸入红色石蕊试纸时,石蕊试纸变成蓝色,然后褪色;
225.(4)在该固体0.1g中加入乙酸(1
→
4)2ml时,产生气体并溶解,在其中加入水5ml,进行过滤后的液体呈现出钙盐的反应。
226.在一个实施方式中,前述固体含有检测界限以上且8100ppm以下的so4系成分。so4系成分可以为8000ppm以下、7000ppm以下、6000ppm以下、5000ppm 以下、4000ppm以下、3000ppm以下、2000ppm以下、1000ppm以下。so4系成分可以为100ppm以上、200ppm以上、300ppm以上、400ppm以上、500ppm 以上、600ppm以上、700ppm以上、800ppm以上、900ppm以上、1000ppm以上、1100ppm以上。该so4系成分是反应槽中所含的硫酸的雾沫夹带,so4系成分量可以成为表示通过本发明制作氯氧化物的指标之一。
227.在一个实施方式中,前述固体中的次氯酸盐与亚氯酸盐之比为1:5~25。该比率是对于使混合溶液干燥而制成的固体而言的值,所述混合溶液是将用于得到前述固体的回收液a与回收液b分别预干燥以使其水分量变成约20%后混合而获得的。在固体产品中,可以认为游离残留氯浓度=有效氯浓度,因此,能够由游离残留氯浓度推导出次氯酸根离子的浓度。亚氯酸根离子浓度能够通过离子色谱来测定。由各离子之比可推导出次氯酸盐与亚氯酸盐之比。前述固体中的次氯酸盐与亚氯酸盐之比可以为1:9~25。前述固体中的次氯酸盐与亚氯酸盐之比可以为1:5~9。对于前述固体中的次氯酸盐与亚氯酸盐之比而言,将次氯酸盐设为1时,亚氯酸盐可以为5~25之间的任意的数值或数值范围内。例如,将次氯酸盐设为1时,亚氯酸盐可以为5、6、7、8、9、10、11、12、 13、14、15、16、17、18、19、20、21、22、23、24或25,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,前述固体中的次氯酸盐与亚氯酸盐之比为1:5.53~23.59。前述固体中的次氯酸盐与亚氯酸盐之比可以为1: 8.92~23.59。前述固体中的次氯酸盐与亚氯酸盐之比可以为1:5.53~8.92。具有上述比率的干燥固体的纯度高,具有长期保存性,杀菌效果好,氯气的气味小。在为钙盐的情况下,符合高级漂白粉的标准。根据需要,也可以制作次氯酸盐与亚氯酸盐之比为上述范围以外的值的固体。
228.在一个实施方式中,前述固体中的有效氯浓度为600,000ppm~900,000ppm 的范围内,游离残留氯浓度为900ppm~60,000ppm的范围内。前述固体中的有效氯浓度可以为600,000ppm~900,000ppm的范围内的任意的数值或数值范围内。前述固体中的有效氯浓度可以为600,000ppm、650,000ppm、700,000ppm、 750,000ppm、800,000ppm、850,000ppm、900,000ppm,可以为这些数值的任意组合的范围内。前述固体中的游离残留氯浓度可以为900ppm~60,000ppm的范围内的任意的数值或数值范围内。前述固体中的游离残留氯浓度可以为900ppm、 1,000ppm、2,000ppm、3,000ppm、4,000ppm、5,000ppm、6,000ppm、7,000ppm、 8,000ppm、9,000ppm、10,000ppm、15,000ppm、20,000ppm、25,000ppm、30,000ppm、 35,000ppm、40,000ppm、45,000ppm、50,000ppm、55,000ppm、60,000ppm,可以为这些数值的任意
组合的范围内。作为一个具体例,前述固体中的有效氯浓度为606,811ppm~881,677ppm的范围内,游离残留氯浓度为901ppm~ 58,728ppm的范围内。前述固体中的有效氯浓度可以为606,811ppm~ 881,677ppm的范围内。前述固体中的有效氯浓度可以为606,811ppm、 616,877ppm、632,513ppm、647,265ppm、781,019ppm、782,210ppm、824,064ppm 或881,667ppm。作为一个具体例,前述固体中的游离残留氯浓度可以为 901ppm~58728ppm的范围。前述固体中的游离残留氯浓度可以为901ppm、 2,145ppm、2,625ppm、20,785ppm、49,314ppm、55,916ppm或58,728ppm。具有上述浓度的干燥固体的纯度高,具有长期保存性,杀菌效果好,氯气的气味小。在为钙盐的情况下,符合高级漂白粉的标准。根据需要,也可以制作有效氯浓度和游离残留氯浓度为上述范围以外的值的固体。
229.在一个方面中,本发明提供使上述干燥固体溶解而获得的液体。作为用于使其溶解的溶剂,可举出:水、醇、醚等。作为水,可举出:自来水、井水、海水、去离子水、精制水等任意的水。
230.在一个实施方式中,在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:7~35,在将次氯酸根离子设为 1时,亚氯酸根离子可以为7、8、9、10、11、12、13、14、15、16、17、18、 19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35,可以为这些数值间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:7.16~34.36。在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,游离残留氯浓度为150ppm~900ppm的范围内,游离残留氯浓度可以为 150ppm、200ppm、250ppm、300ppm、350ppm、400ppm、450ppm、500ppm、 550ppm、600ppm、650ppm、700ppm、750ppm、800ppm、850ppm、900ppm,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为1%的方式用水进行了稀释的情况下,游离残留氯浓度为 187.07ppm~836.70ppm的范围内。由于在操作过程中游离残留氯会发生分解,因此,次氯酸根离子与亚氯酸根离子之比会根据稀释程度而变化。具有上述比率的液体的纯度高,杀菌效果好,氯臭气少。
231.在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6~30,在将次氯酸根离子设为1时,亚氯酸根离子可以为6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、 23、24、25、26、27、28、29、30,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6.31~29.54。在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,游离残留氯浓度为1,000ppm~ 6,000ppm的范围内,游离残留氯浓度可以为1,000ppm、1,500ppm、2,000ppm、 2,500ppm、3,000ppm、3,500ppm、4,000ppm、4,500ppm、5,000ppm、5,500ppm、 6,000ppm,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为6%的方式用水进行了稀释的情况下,游离残留氯浓度为 1296.01ppm~5624.20ppm的范围内。由于在操作过程中游离残留氯会发生分解,因此,次氯酸根离子与亚氯酸根离子之比会根据稀释程度而变化。具有上述比率的液体的纯度高,杀菌效果好,氯臭气少。
232.在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6~30,在将次氯酸根离子设为1时,亚氯酸根离子可以为6、7、8、9、10、
11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,次氯酸根离子与亚氯酸根离子之比为1:6.39~28.16。在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,游离残留氯浓度可以为 2,500ppm~12,000ppm的范围内,游离残留氯浓度可以为2,500ppm、3,000ppm、 3,500ppm、4,000ppm、4,500ppm、5,000ppm、6,000ppm、6,500ppm、7,000ppm、 7,500ppm、8,000ppm、8,500ppm、9,000ppm、9,500ppm、10,000ppm、10,500ppm、 11,000ppm、11,500ppm、12,000ppm,可以为这些数值之间的任意的数值或数值范围内。作为一个具体例,在以使有效氯浓度成为12%的方式用水进行了稀释的情况下,游离残留氯浓度为2736.70ppm~11378.81ppm的范围内。由于在操作过程中游离残留氯会发生分解,因此,次氯酸根离子与亚氯酸根离子之比会根据稀释程度而变化。具有上述比率的液体的纯度高,杀菌效果好,氯臭气少。
233.在一个方面中,本发明提供一种方法,所述方法是制造含有次氯酸盐和亚氯酸盐的干燥固体的方法,其包括如下工序:准备含有次氯酸根离子、氯酸根离子和氯离子的溶液的工序;在该溶液中添加硫酸,使其生成氯气的第一反应工序;在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的形式回收的工序;在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;将回收液a与回收液b混合的工序;使获得的混合溶液干燥而制成固体的工序。本方法对品质劣化了的次氯酸钠进行再生,可重新获得有用的杀菌消毒剂。通过本方法制造并干燥而成的固体的杀菌消毒剂即使在常温下保存其内容物成分的组成也不会发生变化,在制成钙盐的情况下,能够符合作为食品添加剂的高级漂白粉的标准。通过本方法完成的干燥固体具有氯气的气味小、减轻了操作者的负担、容易使用的优点,可以说即使使用复杂的再生方法也能够消化制造成本,制成实际销售的商品。
234.在一个实施方式中,前述回收液a含有氢氧化钙。
235.在一个实施方式中,还包含在第1反应后的反应母液中添加过氧化氢的工序。通过该添加过氧化氢的工序,能够抑制氯气生成。
236.在一个实施方式中,在将前述回收液a与前述回收液b混合的工序中,将该回收液a的有效氯浓度设为1时,回收液b的有效氯浓度为9.6~33.95的范围内。相对于回收液a的有效氯浓度为1,回收液b的有效氯浓度可以为9.6 以上、9.7以上、9.8以上、9.9以上、10.0以上、11以上、12以上、13以上、 14以上、15以上、16以上、17以上、18以上、19以上、20以上、21以上、 22以上、23以上、24以上、25以上、26以上、27以上、28以上、29以上、 30以上、31以上、32以上、33以上,可以为33.95以下、33.9以下、33.8以下、33.7以下、33.6以下、33.5以下、33.4以下、33.3以下、33.2以下、33.1 以下、33以下、32以下、31以下、30以下、29以下、28以下、27以下、26 以下、25以下、24以下、23以下、22以下、21以下、20以下、19以下、18 以下、17以下、16以下、15以下、14以下、13以下、12以下、11以下、10 以下、9.9以下、9.8以下、9.7以下的任意的数值的范围内。相对于回收液a 的有效氯浓度为1,回收液b的有效氯浓度可以为9.6、9.7、9.8、9.9、10、11、 12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、 29、30、31、32、33。优选的是,相对于回收液a的有效氯浓度为1,回收液 b的有效氯浓度为20。在回收液b的有效氯浓度小于9.6的有效氯比的情况下,有效氯低于60%,不符合高级漂
白粉的标准,因此该有效氯比为下限值。当回收液b的有效氯比率超过33.95时,不符合游离残留氯和钙的标准。
237.在一个实施方式中,在将前述回收液a与前述回收液b混合的工序中,该回收液a和该回收液b在分别制成浆料后混合。制成浆料后混合并干燥的情况与未制成浆料的情况相比,可缩短整个操作时间,能够防止有效氯消失或组成发生变化。
238.在一个实施方式中,将前述回收液a与回收液b混合的工序包含如下工序:将前述回收液a预干燥,形成造粒核,将回收液b制成浆料,然后,将回收液 a干燥物投入回收液b浆料中。预先使其进行某种程度干燥,可提高操作性、稳定性。
239.在一个实施方式中,前述干燥而制成固体的工序包含进行热风干燥20分钟~30分钟的工序。可以在仓库内环境温度为50~60℃、仓库内湿度为10%以下的干燥条件下进行热风干燥。另外,以1.9m3/s的风量送入热风。
240.在一个实施方式中,前述干燥而制成固体的工序包括:使回收液a和回收液b的水分量分别减少至20%以下。在一个实施方式中,水分量可以为26%以下、25%以下、24%以下、23%以下、22%以下、21%以下、20%以下、19%以下、18%以下、17%以下、16%以下、15%以下、14%以下、13%以下、12%以下、11%以下、10%以下。如果水分量为26%以上,则回收液a中的游离残留氯(次氯酸根离子)与亚氯酸根离子发生反应,从而使有效氯浓度减少,氯酸根离子增加,纯度、干燥率也降低。另外,如果水分量超过30%,则游离残留氯(次氯酸根离子)自分解变得明显,游离残留氯(次氯酸根离子)格外减少,并且纯度、干燥率降低。优选使水分量减少至20%以下,但可以考虑操作性、成本来选择适当的水分量。
241.在一个方面中,本发明提供一种方法,所述方法是由含有次氯酸根离子、氯酸根离子和氯离子的溶液制造新型杀菌消毒剂的方法,其包括如下工序:对该溶液中的次氯酸根离子浓度、氯酸根离子浓度和氯离子浓度进行定量的工序;在该溶液中添加硫酸,使其生成氯气的第一反应工序;在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的形式回收的工序;在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;将回收液a与回收液b混合,得到新型杀菌消毒剂的工序。回收液a与回收液b的混合物可以作为杀菌消毒剂使用。本方法对品质劣化了的次氯酸钠进行再生,可重新获得有用的杀菌消毒剂。在通过本方法制造的杀菌消毒剂制成钠盐的情况下,能够符合次氯酸钠作为食品添加剂的标准。
242.在一个实施方式中,前述含有次氯酸根离子、氯酸根离子和氯离子的溶液是含有品质劣化了的次氯酸盐的溶液。
243.在一个实施方式中,前述含有品质劣化了的次氯酸盐的溶液源于低食盐级次氯酸钠溶液。
244.在一个实施方式中,前述含有品质劣化了的次氯酸盐的溶液源于普通级次氯酸钠溶液。
245.第一反应中重要的是,通过调节硫酸浓度,控制混入回收液a中的二氧化氯气体,作为第一反应时的反应母液中的酸度,重要的是不要使氯酸根离子分解。
246.对于第二反应时的硫酸,取决于使用的硫酸浓度与第二反应时的反应母液中的硫
酸浓度这两种硫酸浓度。另外,在第二反应时使用的硫酸浓度高一点好,在第二反应中重要的不仅仅是反应母液中的硫酸浓度。
247.在一个实施方式中,前述含有品质劣化了的次氯酸盐的溶液源于低食盐级次氯酸钠溶液,前述杀菌消毒剂为固体产品,第一反应工序中的反应母液中的硫酸浓度为4.00~6.37%,第二反应工序中的反应母液中的硫酸浓度为30.00~ 40.00%,第二反应工序中使用的硫酸浓度为50.0w/w%~70.0w/w%。在另一个实施方式中,在前述杀菌消毒剂为固体产品的情况下,第一反应工序中的反应母液中的硫酸浓度可以为4.00%、4.10%、4.20%、4.30%、4.40%、4.50%、4.60%、 4.70%、4.80%、4.90%、5.00%、5.10%、5.20%、5.30%、5.40%、5.50%、5.60%、 5.70%、5.80%、5.90%、6.00%、6.10%、6.20%、6.30%或6.37%,第二反应工序中的反应母液中的硫酸浓度为30.0%、31.0%、32.0%、33.0%、34.0%、35.0%、 36.0%、37.0%、38.0%、39.0%或40.0%,第二反应工序中使用的硫酸浓度为 50.0w/w%、51.0w/w%、52.0w/w%、53.0w/w%、54.0w/w%、55.0w/w%、56.0w/w%、 57.0w/w%、58.0w/w%、59.0w/w%、60.0w/w%、61.0w/w%、62.0w/w%、63.0w/w%、 64.0w/w%、65.0w/w%、66.0w/w%、67.0w/w%、68.0w/w%、69.0w/w%或70.0w/w%。
248.在一个实施方式中,前述含有品质劣化了的次氯酸盐的溶液源于低食盐级次氯酸钠溶液,前述杀菌消毒剂为液体产品,第一反应工序中的反应母液中的硫酸浓度为4.00~6.37%,第二反应工序中的反应母液中的硫酸浓度为30.00~59.04%,第二反应工序中使用的硫酸浓度为50.0w/w%~70.0w/w%。在另一个实施方式中,前述杀菌消毒剂为液体产品,第一反应工序中的反应母液中的硫酸浓度为4.00、4.10%、4.20%、4.30%、4.40%、4.50%、4.60%、4.70%、4.80%、 4.90%、5.00%、5.10%、5.20%、5.30%、5.40%、5.50%、5.60%、5.70%、5.80%、 5.90%、6.00%、6.10%、6.20%、6.30%或6.37%,第二反应工序中的反应母液中的硫酸浓度为30.0%、31.0%、32.0%、33.0%、34.0%、35.0%、36.0%、37.0%、 38.0%、39.0%、40.0%、41.0%、42.0%、43.0%、44.0%、45.0%、46.0%、47.0%、 48.0%、49.0%、50.0%、51.0%、52.0%、53.0%、54.0%、55.0%、56.0%、57.0%、 58.0%、59.0%或59.04%,第二反应工序中使用的硫酸浓度为50.0w/w%、 51.0w/w%、52.0w/w%、53.0w/w%、54.0w/w%、55.0w/w%、56.0w/w%、57.0w/w%、 58.0w/w%、59.0w/w%、60.0w/w%、61.0w/w%、62.0w/w%、63.0w/w%、64.0w/w%、 65.0w/w%、66.0w/w%、67.0w/w%、68.0w/w%、69.0w/w%或70.0w/w%。
249.在一个实施方式中,前述含有品质劣化了的次氯酸盐的溶液源于普通级次氯酸钠溶液,第一反应工序中的反应母液中的硫酸浓度为4.00~4.50%,第二反应工序中的反应母液中的硫酸浓度为25.00~30.00%,第二反应工序中使用的硫酸浓度为65w/w%。在另一个实施方式中,第一反应工序中的反应母液中的硫酸浓度为4.00%、4.10%、4.20%、4.30%、4.40%或4.50%,第二反应工序中的反应母液中的硫酸浓度为25.0%、26.0%、27.0%、28.0%、29.0%或30.00%,第二反应工序中使用的硫酸浓度为65w/w%。
250.在一个实施方式中,在第一反应中,在将原料中的氯化物浓度设为x%、将反应母液中的硫酸浓度设为y%时,满足如下关系式:
251.(1)y=-1.2676x 9.84393;
252.(2)x≦4。
253.该关系式是基于如下条件推导的:以原料中的氯酸根离子不分解或增加作为上
限,并且考虑安全性,以氯酸根离子增加至110%以上作为条件,而且,考虑此时原料中的氯化物浓度越高,可添加的硫酸浓度越低。
254.在一个实施方式中,前述回收液a含有氢氧化钠或氢氧化钙。
255.在一个实施方式中,前述回收液b含有氢氧化钠和过氧化氢。
256.可以一边吹入空气一边进行反应工序。空气有助于防止反应槽中产生的氯气或二氧化氯气体返回溶液中或进行逆反应生成。
257.在一个实施方式中,一边吹入空气一边进行前述第一反应工序。
258.在一个实施方式中,一边吹入空气一边进行前述第二反应工序。
259.在一个实施方式中,在反应槽与含有回收液b的回收槽之间,设置有含有过氧化氢的中间捕集槽。可利用中间捕集槽来防止氯气混入回收液b中。
260.在一个实施方式中,还包含在第1反应后的反应母液中添加过氧化氢的工序。通过在第二反应时添加过氧化氢,可抑制氯气的生成。
261.在一个实施方式中,在将前述回收液a和回收液b混合的工序中,以回收液a的有效氯浓度为1,回收液b的有效氯浓度为0.43~0.6。在一个实施方式中,以回收液a的有效氯浓度为1,回收液b的有效氯浓度可以为0.43以上、 0.44以上、0.45以上、0.46以上、0.47以上、0.48以上、0.49以上、0.5以上、 0.51以上、0.52以上、0.53以上、0.52以上、0.53以上、0.54以上、0.55以上、 0.56以上、0.57以上、0.58以上、0.59以上,可以为0.6以下、0.59以下、0.58 以下、0.57以下、0.56以下、0.55以下、0.54以下、0.53以下、0.52以下、0.51 以下、0.50以下、0.49以下、0.48以下、0.47以下、0.46以下、0.45以下、0.44 以下的任意的数值的范围。在为上述范围的情况下,回收液a与回收液b的混合物能够满足次氯酸钠的食品添加剂标准。
262.在一个实施方式中,前述杀菌消毒剂含有次氯酸钠。
263.在一个实施方式中,前述杀菌消毒剂符合食品添加剂、次氯酸钠的标准。具体而言,前述杀菌消毒剂:
264.(1)含有有效氯4.0%以上;
265.(2)有氯的气味;
266.(3)呈现出钠盐的反应和次氯酸盐的反应;
267.(4)在本品的水溶液(1
→
25)4ml中加入磷酸缓冲液(ph8)100ml后的溶液在波长291~294nm处有最大吸收部;
268.(5)在本品中浸入红色石蕊试纸时,石蕊试纸变成蓝色,然后褪色。
269.在一个实施方式中,前述杀菌消毒剂含有检测界限以上且8100ppm以下的 so4系成分。so4系成分可以为8000ppm以下、7000ppm以下、6000ppm以下、 5000ppm以下、4000ppm以下、3000ppm以下、2000ppm以下、1000ppm以下可以为
る
。so4系成分
は
、100ppm以上、200ppm以上、300ppm以上、400ppm 以上、500ppm以上、600ppm以上、700ppm以上、800ppm以上、900ppm以上、1000ppm以上、1100ppm以上。该so4系成分是反应槽中所含的硫酸的雾沫夹带,so4系成分量可以成为表示通过本发明制作氯氧化物的指标之一。
270.在一个实施方式中,前述消毒剂中的次氯酸根离子与亚氯酸根离子之比为 1:0.24~0.3。需要说明的是,在为液体产品的情况下,由于难以从游离残留氯浓度中指定物质而求出浓度,因此,通过离子色谱求出源于回收液b的亚氯酸根离子并换算成有效氯,从
总的有效氯中减去。此外,将剩余的有效氯确定为源于回收液a的有效氯,乘以系数而求出次氯酸根离子,获得最终的离子比。对于前述消毒剂中的次氯酸根离子与亚氯酸根离子之比而言,将次氯酸盐设为 1时,亚氯酸盐可以为0.24~0.3之间的任意的数值或数值范围内。例如,将次氯酸盐设为1时,亚氯酸盐为0.24、0.25、0.26、0.27、0.28、0.29或0.30。具有上述比率的消毒液的纯度高,杀菌效果好,氯气味气少。
271.在一个实施方式中,前述消毒剂中的有效氯浓度为约60,000ppm,游离残留氯浓度为约60,000ppm的范围内。前述消毒剂中的有效氯浓度可以为 55,000ppm、56,000ppm、57,000ppm、58,000ppm、59,000ppm、60,000ppm、 61,000ppm、62,000ppm、63,000ppm、64,000ppm、65,000ppm,可以为这些数值的任意组合的范围内。作为具体例,前述消毒剂中的有效氯浓度为60,114ppm、 60,814ppm。前述消毒剂中的游离残留氯浓度可以为55,000ppm、56,000ppm、 57,000ppm、58,000ppm、59,000ppm、60,000ppm、61,000ppm、62,000ppm、 63,000ppm、64,000ppm、65,000ppm,可以为这些数值的任意组合的范围内。作为一个具体例,前述消毒剂中的游离残留氯浓度为58,157ppm、59,380ppm。具有上述浓度的消毒剂的纯度高,杀菌效果好,氯臭气少。
272.在一个方面中,本发明提供一种通过上述方法中任一项记载的方法制造的杀菌消毒剂。
273.在一个实施方式中,在前述杀菌消毒剂中,前述消毒剂中的次氯酸根离子与亚氯酸根离子之比为1:0.24~0.3。对于前述消毒剂中的次氯酸根离子与亚氯酸根离子之比而言,将次氯酸盐设为1时,亚氯酸盐可以为0.24~0.3之间的任意的数值或数值范围内。例如,将次氯酸盐设为1时,亚氯酸盐为0.24、0.25、 0.26、0.27、0.28、0.29或0.30。具有上述比率的消毒液的纯度高,杀菌效果好,氯气味气少。
274.在一个实施方式中,前述消毒剂中的有效氯浓度为约60,000ppm,游离残留氯浓度为约60,000ppm。前述消毒剂中的有效氯浓度可以为55,000ppm、 56,000ppm、57,000ppm、58,000ppm、59,000ppm、60,000ppm、61,000ppm、 62,000ppm、63,000ppm、64,000ppm、65,000ppm,可以为这些数值的任意组合的范围内。作为具体例,前述消毒剂中的有效氯浓度为60,114ppm、60,814ppm。前述消毒剂中的游离残留氯浓度可以为55,000ppm、56,000ppm、57,000ppm、 58,000ppm、59,000ppm、60,000ppm、61,000ppm、62,000ppm、63,000ppm、 64,000ppm、65,000ppm,可以为这些数值的任意组合的范围内。作为一个具体例,前述消毒剂中的游离残留氯浓度为58,157ppm、59,380ppm。具有上述浓度的消毒剂的纯度高,杀菌效果好,氯臭气少。
275.在一个实施方式中,提供一种使用前述干燥固体而制造的液态氯氧化物,该液态氯氧化物通过包含如下工序的方法来制备:(a)将该干燥固体溶解于水中,制备ph升高了的溶液的工序;(b)在维持工序(a)中制备的溶液的ph 的同时,通过在该溶液中加入非钙无机碱性试剂而使钙盐沉淀,从而形成包含液相和含有钙盐的固相、且该液相中的钙离子浓度降低了的固液混合相的工序;和(c)由工序(b)中所形成的固液混合相中仅取出液相,从而得到液态氯氧化物的工序。工序(a)的ph可以为10.0以上。工序(b)的ph可以为10.0 以上。该方法可以为日本专利第5931253号中所示的方法。在将前述干燥固体制成液体而使用时,钙盐会以残渣的形式残留,进行食品加工的终端加工者会担心异物混入食品中的问题。另外,处理大量的钙盐也非常麻烦。该液态氯氧化物去除了钙,因此是有用的。具有即使长期
贮存也不会析出钙盐的效果。另外,通过本方法完成的产品与同浓度的次氯酸钠溶液相比,具有氯的气味小、减轻了操作者的负担、容易使用的优点。即使使用能够长期贮存的原料即高级漂白粉,也能够制造化学工业产品,并且,钙盐不会从通过该方法生产、流通的产品中析出,而且氯的气味非常小,因此终端用户也能够放心地使用。
276.在一个实施方式中,提供一种钙浓度基本上为检测界限以下的前述液体或液态氯氧化物。优选为
くは
、含有氯氧化物的溶液中的钙浓度为24ppm以下。或者,含有氯氧化物的溶液中的钙浓度更优选为23ppm以下、22ppm以下、 21ppm以下、20ppm以下、19ppm以下、18ppm以下、17ppm以下、16ppm以下、15ppm以下、14ppm以下、13ppm以下、12ppm以下、11ppm以下、10ppm 以下、9ppm以下、8ppm以下、7ppm以下、6ppm以下、5ppm以下、4ppm以下、3ppm以下、2ppm以下、1ppm以下、0.9ppm以下、0.8ppm以下、0.7ppm 以下、0.6ppm以下、0.5ppm以下、0.4ppm以下、0.3ppm以下、0.2ppm以下、 0.1ppm以下或0.01ppm以下。如果达到这些浓度,则能够达到氯的气味减少至不会发生问题的水平、优选基本上感觉不到氯的气味的水平(轻微的氯气味(例如0.1ppm以下等))的状态。
277.在一个实施方式中,提供上述干燥固体、上述液体、或者上述液体或液态氯氧化物作为杀菌消毒剂的用途。在一个实施方式中,提供上述干燥固体、上述液体、上述杀菌消毒剂、或者上述液体或液态氯氧化物作为食品添加剂的用途。在一个实施方式中,提供上述干燥固体、上述液体、上述杀菌消毒剂、或者上述液体或液态氯氧化物用于对食品进行杀菌消毒的用途。
278.在一个实施方式中,提供一种由含有次氯酸根离子、氯酸根离子和氯离子的溶液制造新型药剂的方法,该方法包括如下工序:对该溶液中的次氯酸根离子浓度、氯酸根离子浓度和氯离子浓度进行定量的工序;在该溶液中添加硫酸,使其生成氯气的第一反应工序;在回收液a中,使该生成的氯气与氢氧化钠或氢氧化钙反应而以次氯酸根离子的形式回收的工序;在第一反应工序后的反应母液中,添加浓度高于第一反应工序中的硫酸的硫酸,使其生成二氧化氯气体的第二反应工序;在回收液b中,使该生成的二氧化氯气体与氢氧化钠和过氧化氢反应而以亚氯酸根离子的形式回收的工序;将回收液a与回收液b混合,得到新型药剂的工序。该方法会具有用药剂替代上述中指定的杀菌消毒剂时的特征中的一个或多个特征。在一个实施方式中,提供一种通过该方法制造而成的药剂。该药剂具有用药剂替代上述中指定的杀菌消毒剂时的特征中的一个或多个特征。可提供该药剂作为杀菌消毒剂的用途、作为食品添加剂的用途和用于对食品进行杀菌消毒的用途。
279.通过本发明制作的氯氧化物使用品质降低了的次氯酸钠作为原料,因此,原料中会含有各种成分,另外,在处理品质降低了的次氯酸钠的阶段,会进行各种反应而生成含有各种氯氧化物的各种成分。因而,虽然回收液a和回收液 b中会分别含有次氯酸盐和亚氯酸盐作为主要成分,但未必能够识别所有成分。因而,使回收液a与回收液b混合而制作的本发明的杀菌消毒剂虽然满足次氯酸钠的标准、高级漂白粉的标准,但也会包含无法识别的成分。上述无法识别的成分可能会有助于提高杀菌效果或提高稳定性,可期待获得与简单地使次氯酸盐与亚氯酸盐组合的情况不同的效果。
280.需要说明的是,本说明书中所引用的科学文献、专利、专利申请等参考文献整体以参考形式并入本说明书中,各科学文献、专利、专利申请以参考形式并入的程度与具体地记载的情况的程度相同。
281.以上,为了容易理解而示出了优选实施方式对本发明进行了说明。下面,基于实施例对本发明进行说明,但上述的说明及以下的实施例仅以示例为目的而提供,并非以限定本发明为目的而提供。因而,本发明的范围并不限定于本说明书中具体地记载的实施方式或实施例,仅受权利要求书限定。
282.实施例
283.硫酸根离子的量通过以下的试验方法(离子色谱)来测定。
284.试样溶液的制备
285.在试样中加入水进行稀释,以硫酸根离子计,调节为0~40mg/l。
286.校准曲线用的标准溶液的制备
287.将关东化学(株)制的试剂阴离子混合标准iv设为标准溶液。
288.(1ml该溶液含有约40μg硫酸根离子)。
289.测定条件
290.使用带电导检测器的离子色谱(抑制器方式),在以下条件下进行测定。
291.填充剂:乙烯乙烯基苯-二乙烯基苯聚合物系阴离子交换树脂
292.色谱柱:内径4.0mm、长度250mm
293.洗脱液:12mmol/l碳酸钠、5mmol/l碳酸氢钠的混合液
294.柱温:室温
295.流速:1.0ml/分钟
296.试样溶液注入量:250μl
297.校准曲线
298.将250μl标准溶液分别准确地注入离子色谱中,由获得的峰面积制作硫酸根离子的校准曲线。
299.定量
300.通过由试样溶液获得的峰面积和校准曲线求出试样溶液中的硫酸根离子的浓度(a),通过下式计算试样原液中的硫酸根离子的含量(x)〔mg/l〕。
301.(x)=a
×k302.a:试样溶液中的硫酸根离子的浓度(mg/l)
303.k:制备试样溶液时的稀释倍率
304.(次氯酸钠的品质劣化)
305.作为食品添加剂流通的12%的次氯酸钠溶液主要有低食盐级和普通级两种,低食盐级的氯酸根离子生成量为约20000~25000ppm,普通级的氯酸根离子生成量为约30000~42000ppm。另外,作为理论值,认为有效盐每减少1%,氯酸根离子增加约3500ppm,但可知由于次氯酸钠的品质不同,有时氯酸根离子初始值较高,而且有时生成量为理论值以上。
306.需要说明的是,在12%的次氯酸钠溶液中加入酸而强制性地使有效氯消失时的氯酸根离子生成量为约58000~66000ppm,因此,可知源于12%次氯酸钠溶液的氯酸根离子生成量不会超过上述值。
307.[表1]
[0308]
贮存温度:40℃
[0309]
《低食盐级》单位:ppm
[0310][0311]
《普通级》单位:ppm
[0312][0313]
《在普通级中添加酸并将ph设定为9.7》单位:ppm
[0314][0315]
(劣化次氯酸钠的反应1)
[0316]
劣化次氯酸钠中分别含有次氯酸根离子、氯离子、氯酸根离子,首先,对于用硫酸使预计难以进行分解反应的氯酸根离子反应的情况进行了初步验证。另外,为了对反应性进行比较而设定了氯酸钠区。
[0317]
其结果,氯酸钠区通过利用硫酸使其反应,容易产生二氧化氯气体,通过氢氧化钠能够得到亚氯酸根离子。另外,通过在氢氧化钠中加入过氧化氢,可提高亚氯酸根离子的收率。
[0318]
另一方的结果是,由劣化次氯酸钠仅能回收氯离子而无法回收亚氯酸根离子,进而在氢氧化钠中加入过氧化氢时,氯离子的回收量增加。
[0319]
可认为,用硫酸使劣化次氯酸钠反应时,首先由反应性高的次氯酸根离子生成氯气,并与回收液中的过氧化氢发生反应,结果氯离子增加。
[0320]
另外,回收液中的过氧化氢因氯气而减少,回收液中的亚氯酸根离子的回收率降低,并且生成氯酸根离子。
[0321]
由此可知,本制造方法以劣化次氯酸钠为反应母液,但需要采用两阶段连续反应方法,从此一种反应母液中,作为第一反应回收氯气,然后回收二氧化氯气体,而且需要将这些气体分别进行回收,然后使其合并。
[0322]
因而可知,作为反应模型,需要对如下两阶段的反应条件进行研讨,第一反应是由加入了劣化次氯酸钠和硫酸溶液的反应母液产生氯气,用氢氧化钠或氢氧化钙回收次氯酸根离子。接着,使其产生二氧化氯气体,用氢氧化钠和过氧化氢回收亚氯酸根离子。
[0323]
·
cl2 2naoh
→
nacl naclo h2o
·····
(1)
[0324]
·
cl2 2naoh h2o2→
nacl naclo h2o
[0325]
naclo h2o2→
nacl h2o o2·····
(2)
[0326]
·
2clo2 2naoh
→
naclo2 naclo3 h2o
·····
(3)
[0327]
·
2clo2 2naoh h2o2→
2naclo2 o2 2h2o
·····
(4)
[0328]
[表2]
[0329]
《原料(投入液)》
[0330]
a劣化次氯酸钠(*)0.1ml
×
50次=合计滴加5.0mlb50w/w%氯酸钠0.1ml
×
20次=合计滴加2.0ml
[0331]
*测定值:氯酸根离子15,980ppm,氯离子106,640ppm
[0332]
《接收溶液(反应槽)》
[0333]
50w/w%h2so450ml35%h2o22.33ml
[0334]
过氧化氢的最终浓度:1.56%
[0335]
*h2so4为30w/w%以下时因反应性低而不符合。
[0336]
《回收液(吸收槽)》
[0337] (1)(2)12%naoh50ml50ml35%h2o
2-1.47ml
[0338]
过氧化氢的最终浓度:1.00%
[0339]
《回收液的分析》(单位:ppm)
[0340][0341]
(劣化次氯酸钠的反应2)
[0342]
由于劣化次氯酸钠中的氯酸根离子为少量,仅分别少量滴加硫酸时反应性差,因此,考虑通过以间歇式进行反应、将投入的硫酸浓度提高至65w/w%、进而升高反应时的温度而使氯气、二氧化氯气体顺次地产生。另外,考虑准备回收液a、回收液b两种回收液,第一反应时用回收液a回收次氯酸根离子,在第一反应结束后切换配管,用回收液b回收亚氯酸根离子。其结果,开始产生二氧化氯,并开始回收亚氯酸根离子,因此可知反应母液中的温度与酸度的影响很重要。然而,由于大部分亚氯酸根离子是在未添加过氧化氢的回收液a 中被回收,因此收率差,且因不存在过氧化氢还生成了氯酸根离子。因此可知,需要确立条件以使氯气、二氧化氯气体更顺次地产生并将其吹入各个回收液中。
[0343]
[表3-1]
[0344]
(1)原料
[0345]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0346]
*12%的低食盐级次氯酸钠
[0347]
(2)反应条件(第一反应、第二反应)
[0348][0349]
(3)回收液
[0350] 回收液a回收液b2n氢氧化钠200g-1n氢氧化钠-200g过氧化氢-6g
[0351]
[测定结果](单位:ppm)
[0352] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a58781.0630319.84679.99979.2198.6回收液b1055.4749.0259.000反应母液-14491.900∞
[0353]
[表3-2]
[0354]
[亚氯酸根离子和有效氯的回收率]
[0355][0356]
(劣化次氯酸钠的反应3)
[0357]
为了确认第一反应时优先产生氯气时所需的硫酸浓度,将硫酸浓度设定为 50w/w%而进行反应。另外,此时的反应母液中的硫酸浓度为25.0%。
[0358]
其结果,能够更逐步地控制第一反应中的氯气回收、第二反应中的二氧化氯气体回收。而且发现加入了氢氧化钠和过氧化氢的回收液b中的亚氯酸根离子的回收率提高。然而,可能是因二氧化氯气体混入回收液a中而导致亚氯酸根离子被回收,而且因未添加过氧化氢还生成了氯酸根离子。因此可知,不仅需要研讨硫酸的浓度,而且还需要研讨硫酸的投入方法。
[0359]
[表4-1]
[0360]
(1)原料
[0361]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0362]
*12%的低食盐级次氯酸钠
[0363]
(2)反应条件(第一反应、第二反应)
[0364][0365]
(3)回收液
[0366] 回收液a回收液b2n氢氧化钠200g-1n氢氧化钠-200g过氧化氢-6g
[0367]
[测定结果](单位:ppm)
[0368] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a35533.5719483.8696.91479.4175.4回收液b18249.143083.28659.4169.40反应母液-17579.200∞
[0369]
[表4-2]
[0370]
[亚氯酸根离子和有效氯的回收率]
[0371][0372]
(劣化次氯酸钠的反应4)
[0373]
为了进行劣化次氯酸钠的反应并以两阶段从反应母液中进行回收,反应温度、基于硫酸的酸度很重要,但如果初始硫酸浓度过高,则会产生氯气和二氧化氯气体两种气体,无法进行回收液的切换。因此,不仅降低硫酸浓度而且分两次添加而使其反应时,虽然没有观察到收率的明显变化,但却清楚了与投入 200g 50w/w%硫酸的情况相比,在分两次投入100g 65w/w%硫酸的情况下,第一反应时的二氧化氯气体产生量增多。由此可知,第一反应时中的反应母液中的硫酸浓度仍然过量,反应性因投入时的硫酸的设定浓度不同而不同。
[0374]
[表5-1]
[0375]
(1)原料
[0376]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0377]
*12%的低食盐级次氯酸钠
[0378]
(2)反应条件(第一反应、第二反应)
[0379][0380]
(3)回收液
[0381] 回收液a回收液b2n氢氧化钠200g-1n氢氧化钠-200g过氧化氢-6g
[0382]
[测定结果](单位:ppm)
[0383] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a38843.3027151.51847.73645.8115.4回收液b21625.571117.48413.873.70
[0384]
[表5-2]
[0385]
[亚氯酸根离子和有效氯的回收率]
[0386][0387]
(劣化次氯酸钠的反应5)
[0388]
对通过分别设定第一反应和第二反应的硫酸浓度与量、温度、并进一步进行硫酸的两次投入来分别回收氯气和二氧化氯气体的情况进行了研讨。通过将第一反应时使用的硫酸浓度设为50w/w%、将投入量设为25g,使反应母液中的硫酸浓度为5.6%。另外,通过将二次反应时的硫酸浓度设为65w/w%、将投入量设为250g,使反应母液中的硫酸浓度为36.8%。其结果,能够使混入回收液 a中的二氧化氯气体减少,且能够使亚氯酸根离子、氯酸根离子分别减少。
[0389]
另外,回收液b中的亚氯酸根离子回收量比以往增加20%,成为期待值的 60%以上。亦即,可知在第一反应时通过调节硫酸浓度来控制混入回收液a中的二氧化氯气体很重要,作为第一反应时的反应母液中的酸度,使氯酸根离子不发生分解很重要。
[0390]
[表6-1]
[0391]
(1)原料
[0392]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0393]
*12%的低食盐级次氯酸钠
[0394]
(2)反应条件(第一反应、第二反应)
[0395][0396]
(3)回收液
[0397] 回收液a回收液b2n氢氧化钠200g-1n氢氧化钠-200g过氧化氢-6g
[0398]
[测定结果](单位:ppm)
[0399] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a29923.7023857.073.9154.686.0回收液b29948.555949.013371.0402.80
[0400] [表6-2]
[0401]
[亚氯酸根离子和有效氯的回收率]
[0402][0403]
(劣化次氯酸钠的反应6)
[0404]
明确了第一反应时和第二反应时的硫酸浓度与量,因此对将处理量提高至 5倍时的回收率的变化进行了确认。另外,为了确认气体回收有无泄漏,对回收液a、b分别设置了预回收槽。进而,提前了吹入空气的时间,在原料投入后立即向反应槽吹入空气,并逐渐提高空气量。
[0405]
其结果,即使将处理量提高至5倍,回收液a中也仅回收了次氯酸根离子,亚氯酸根离子、氯酸根离子的生成量还是很少。另外,回收液b中的亚氯酸根离子也增加为87.42%。作为该回收率升高是因第二反应时送入空气的时间而使回收率提高的原因,可认为如果使反应槽中产生的氯气或二氧化氯气体自然回收,则会返回溶液中或进行逆反应。
[0406]
然而,在反应中,因反应槽中产生气体且进一步吹入空气而导致内压升高,在气体或空气吹入减弱时产生逆流。该试验结果表明,虽然回收率良好但产生了逆流,在回收液中检测到硫酸根离子,因此需要进行再次试验,需要在反应槽与回收槽之间设定释放压力的防逆流用的捕集槽。该捕集槽的作用是防止逆流、防止来自反应液的雾沫夹带、以及作为气体回收槽。
[0407]
[表7-1]
[0408]
(1)原料
[0409]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0410]
*12%的低食盐级次氯酸钠
[0411]
(2)反应条件(第一反应、第二反应)
[0412][0413]
(3)回收液
[0414] 回收液a1回收液a2回收液b1回收液b22n氢氧化钠1000g200g
‑‑
1n氢氧化钠
‑‑
1000g200g过氧化氢
‑‑
30g6g
[0415]
[测定结果](单位:ppm)
[0416] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a130573.8227119.3170.4294.9116.5回收液a2135.9016.741.219.30回收液b135221.862605.818616.1205.025688.0回收液b2106.2216.233.000
[0417]
*在回收液b1中发生了硫酸的逆流混入。
[0418]
[表7-2]
[0419]
[亚氯酸根离子和有效氯的回收率]
[0420][0421]
(劣化次氯酸钠的反应7)
[0422]
在设置捕集槽、此外没有大的更改处的状态下,对是否因空气的送入时间而使回收率提高进行了再次验证,结果可知,同样还是从反应初始阶段送入空气时的有效氯的回收率好。另外,回收液a中的亚氯酸根离子、氯酸根离子减少,且回收液b中的氯离子减少,因
此可知回收液a、b能够分别回收。
[0423]
在第一反应中,在投入劣化次氯酸钠与50w/w%硫酸的阶段,因急剧产生氯气而无需向反应槽吹入空气,在反应减弱的1小时25分钟后送入空气2小时 50分钟,进行反应合计4小时15分钟。接着,在第二反应中,在向反应母液投入1000g 65w/w%硫酸的阶段,急剧产生二氧化氯气体,在其后20分钟后反应减弱,将空气逐渐增强并送入3小时50分钟,进行反应合计4小时5分钟。由以上的情况可知,尤其是在第二反应中向反应槽积极地送入空气、且将二氧化氯气体强制性吹入回收液中的情况下,可大幅度提高回收率。
[0424]
[表8-1]
[0425]
(1)原料
[0426]
原料有效氯浓度clo
3-劣化次氯酸钠(*)36360.427120.5
[0427]
*12%的低食盐级次氯酸钠
[0428]
(2)反应条件(第一反应、第二反应)
[0429][0430]
(3)回收液
[0431] 回收液a1回收液a2回收液b1回收液b22n氢氧化钠800g200g
‑‑
1n氢氧化钠
‑‑
800g200g过氧化氢
‑‑
24g6g
[0432]
[测定结果](单位:ppm)
[0433] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a130643.6425265.977.9225.831.9回收液a293.3317.923.712,90回收液b135902.82729.316857.038.586.8回收液b2112.5241.133.800
[0434] [表8-2]
[0435]
[亚氯酸根离子和有效氯的回收率]
[0436][0437]
(劣化次氯酸钠的反应8)
[0438]
为了再次验证空气的开始时间的回收率的差异,对故意延迟空气开始时间时的回收率进行了确认。
[0439]
在此,在第二反应时进行自然反应2小时30分钟,在发泡、气体产生减少了的阶段吹入空气。需要说明的是,该方法是研究初期实施的方法。
[0440]
其结果,回收率大幅度降低,由此可以再次确认,从反应初始阶段积极地吹入空气时可提高回收率。而且,在第二反应时,在约15分钟以内因产生二氧化氯气体而急剧发泡会影响产量,因此,为了提高回收率,需要在此时刻之前向反应槽中送入空气,并逐渐增加空气量。
[0441]
[表9-1]
[0442]
(1)原料
[0443]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)36360.427120.554989.0
[0444]
*12%的低食盐级次氯酸钠
[0445]
(2)反应条件(第一反应、第二反应)
[0446][0447]
回收液
[0448] 回收液a1回收液a2回收液b1回收液b22n氢氧化钠800g200g
‑‑
1n氢氧化钠
‑‑
800g200g过氧化氢
‑‑
24g6g
[0449]
[测定结果](单位:ppm)
[0450] 有效氯浓度cl-clo
2-clo
3-so
42-回收液a130279.1522465.248.4143.136.8
回收液a246.466.212.75.30回收液b130533.273519.814290.6175.188.6回收液b287.3526.920.000
[0451]
[表9-2]
[0452]
[亚氯酸根离子和有效氯的回收率]
[0453][0454]
(劣化次氯酸钠的反应9)
[0455]
在研讨有用的杀菌消毒剂时,药品浓度很重要。而且,以往相对于作为原料的劣化次氯酸钠的投入量,设定了大约等量的回收液,在该回收液的量即使减半的情况下,进行了回收率是否也不会降低的浓缩回收试验。
[0456]
其结果,源于次氯酸的有效氯浓度为3%左右的能够获得8.38%的回收液,源于亚氯酸的有效氯浓度为3.5%左右的能够获得4.96%的回收液。然而,在回收液a中的浓缩回收比较容易,相对于此,回收液b的回收率差,只能回收回收期待值的63.04%。
[0457]
另外,还进行了得到回收液a后的反应母液的测定、得到回收液b后的反应母液的测定,结果可知第一反应后的反应母液的氯酸根离子由24378.5ppm增加至33990.4ppm。另外,还可知相反地氯离子由50079.5ppm减少至23532.4ppm。可认为该氯酸根离子的增加是由于基于硫酸投入的强酸化的再次歧化反应而使氯酸根离子增加了,对于进一步投入硫酸时的氯离子的减少,认为产生盐酸并有助于反应。
[0458]
通过以下的化学式能说明这些,劣化次氯酸钠中生成的氯离子在硫酸存在下生成盐酸,其后,在第二反应中由盐酸与氯酸产生二氧化氯气体。
[0459]
2naclo h2so4→
na2so4 cl2 h2o
·····
(5)第一反应
[0460]
2nacl h2so4→
2hcl na2so4·····
(6)第一反应、第二反应
[0461]
naclo 2hcl
→
nacl cl2 h2o
·····
(7)第一反应
[0462]
3naclo
→
2naclo naclo3·····
(8)第一反应
[0463]
2naclo3 h2so4→
2hclo3 na2so4·····
(9)第二反应
[0464]
hclo3 hcl
→
hclo2 hclo
·····
(10)第二反应
[0465]
hclo3 hclo2→
2clo2 h2o
·····
(11)第二反应
[0466]
[表10-1]
[0467]
(1)原料
[0468]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)49293.8424378.550079.5
[0469]
*12%的低食盐级次氯酸钠
[0470]
(2)反应条件(第一反应、第二反应)
[0471][0472]
(3)回收液
[0473] 回收液a回收液b4n氢氧化钠1000g-2n氢氧化钠-1000g过氧化氢-55g
[0474] [测定结果](单位:ppm)
[0475] 有效氯浓度cl-clo
2-clo
3-so
42-第一反应后-23532.4033990.4159909.8回收液a83778.79102926.7405.42901.490.6第二反应后-20751.400∞回收液b49571.71583.726587.562.255.1
[0476]
[表10-2]
[0477]
[亚氯酸根离子和有效氯的回收率]
[0478][0479]
(劣化次氯酸钠的反应10)
[0480]
为了确认第一反应、第二反应中的反应母液中的硫酸浓度的上限,调节酸度,并且将反应母液中的硫酸浓度设定为6.37%和37.03%而实施了试验。另外,还实施了浓缩回收。
[0481]
其结果,回收液a的回收率为69.87%,但还生成了一些亚氯酸根离子、氯酸根离子,因此,可知不适合进一步提高第一反应中的酸度。
[0482]
另外,作为回收液b的回收率,有效氯的回收率由63.04%升高至74.48%、亚氯酸根离子的回收率由71.03%升高至78.91%,因此认为上限时的酸度不足。另外,该试验还确认第一反应结束后的反应母液中的氯酸根离子增加且氯离子减少。
[0483]
[表11-1]
[0484]
(1)原料
[0485]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)54843.7321571.045351.5
[0486]
*12%的低食盐级次氯酸钠
[0487]
(2)反应条件(第一反应、第二反应)
[0488][0489]
(3)回收液
[0490] 回收液a1回收液b14n氢氧化钠800g-2n氢氧化钠-800g过氧化氢-38.4g
[0491]
[表11-2]
[0492]
[测定结果](单位:ppm)
[0493] 反应前重量反应后重量增加率回收液a800.00g879.90g109.99%回收液b838.40g892.72g106.48%
[0494] 有效氯浓度cl-clo
2-clo
3-so
42-第一反应后-30689.4038833.090011.4回收液a76635.5586579.0246.31124.9136.4第二反应后-23072.200∞回收液b52123.42771.926555.2569.828.0
[0495]
[亚氯酸根离子和有效氯的回收率]
[0496][0497]
(劣化次氯酸钠的反应11)
[0498]
以往的反应方法对于劣化次氯酸钠使用大致相同重量的硫酸溶液来进行第二反应。然而,虽然劣化次氯酸钠中生成的氯酸根离子经由第一反应增加了,但不足以作为提高反应性的浓度。
[0499]
因此,对使第二反应时的反应母液中的硫酸浓度为50%以上进行第二反应时的收率的差异进行了检验证明。此时,使用的硫酸设定为70w/w%的硫酸且反应母液中的硫酸浓度设定为58.47%以上后进行第二反应的回收率确认。
[0500]
进而,由于明确了在第一反应结束后再次生成了氯酸,因此还确认了,在投入硫酸
后,在反应母液中追加投入作为还原剂的过氧化氢,回收率是否提高。
[0501]
其结果,可以确认,在使用70w/w%的硫酸且使反应母液中的硫酸浓度增加至58.47%以上的情况下,反应母液中的氯酸根离子全部分解,有效氯的回收率大幅度升高,有效氯的回收率为83.46%,亚氯酸根离子的回收率为99.63%,因此可知,第二反应时投入的硫酸的浓度为65w/w%以上(尽可能使用70w/w%的硫酸),并且反应母液中的硫酸浓度至59.39%,能够得到优选的结果。
[0502]
然而,在回收液b中产生大量的氯离子,比亚氯酸根离子还多。该结果在次氯酸钠等液体产品的情况下没有问题,但在加工成高级漂白粉等粉末产品的情况下,如果无机盐类增多则浓缩率下降,无法得到高浓度的有效氯。
[0503]
另外,另一方面可以确认,在作为原料的劣化次氯酸钠中加入硫酸、其后添加过氧化氢时,回收率大大降低。可认为这是由以下的化学反应所致,通过硫酸与氯离子的反应而生成的盐酸发生了分解而无助于反应。
[0504]
h2o2 2hcl
→
2h2o cl2·····
(12)
[0505]
而且,可知如果生成的盐酸在反应前被分解,则不仅回收率降低,而且产生的氯气会混入回收液b中,被回收液b中的过氧化氢分解而生成大量的氯离子。
[0506]
[表12-1]
[0507]
(1)原料
[0508]
《原料(投入液)》
[0509] 有效氯浓度clo
3-cl-劣化次氯酸钠(*)46299.2631019.556959.5
[0510]
*12%的低食盐级次氯酸钠
[0511]
(2)反应条件(第一反应、第二反应)
[0512][0513]
(3)回收液
[0514] 回收液a回收液b1回收液b2回收液b32n氢氧化钠400g
‑‑‑
1n氢氧化钠-100g100g100g过氧化氢-2.4g 2.0g2.4g 2.0g2.4g 2.0g
[0515]
[表12-2]
[0516]
[测定结果](单位:ppm)
[0517] 有效氯浓度cl-clo
2-clo
3-第一反应后26.3125333.4037519.8第二反应后(1)19.311378.800第二反应后(2)30.921499.000第二反应后(3)27.401256.600
[0518] 有效氯浓度cl-clo
2-clo
3-回收液a43228.2531250.00124.8回收液b140792.4225884.923180.52704.2回收液b240861.6422431.722605.8819.1回收液b334860.4426768.617853.31688.5
[0519]
[亚氯酸根离子和有效氯的回收率](单位:ppm)
[0520][0521]
(劣化次氯酸钠的反应12)
[0522]
为了确认第二反应时的反应母液中的硫酸浓度的下限值,使反应母液中的硫酸浓度为35.7%,再次确认了回收率。并且对反应结束后的反应母液分别进行了测定,确认了第一反应、第二反应结束后中的残渣成分。
[0523]
其结果,由于回收液b中的氯离子较多,因此,尽管还限定在次氯酸钠的标准之内,但呈现高回收率的结果。
[0524]
[表13-1]
[0525]
(1)原料
[0526]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)46299.2631019.556959.5
[0527]
*12%的低食盐级次氯酸钠
[0528]
(2)反应条件(第一反应、第二反应)
[0529][0530]
(3)回收液
[0531] 回收液a回收液b2n氢氧化钠200g-1n氢氧化钠-100g过氧化氢-2.4g 2g
[0532]
[表13-2]
[0533]
[测定结果](单位:ppm)
[0534] 有效氯浓度cl-clo
2-clo
3-反应母液第一反应后19.6130615.0044510.4反应母液第二反应后24.56942.800
[0535] 有效氯浓度cl-clo
2-clo
3-回收液a41759.1339759.20202.9回收液b35751.3228129.021741.32428.8
[0536] [亚氯酸根离子和有效氯的回收率](单位:ppm)
[0537][0538]
(劣化次氯酸钠的反应14)
[0539]
使用低食盐级次氯酸钠作为原料,将投入第一反应、第二反应时的反应母液中的硫酸浓度均设为70w/w%,而且,第一反应时的反应母液中的硫酸浓度设定为6.37%,使第二反应时的硫酸浓度为35.7%,实施了制造。
[0540]
其结果,对于第一反应时的硫酸而言,认为与投入的硫酸浓度无关而取决于第一反应时的反应母液中的硫酸浓度。
[0541]
另外,对于第二反应时的硫酸而言,可知取决于使用的硫酸浓度与第二反应时的反应母液中的硫酸浓度这两个硫酸浓度。另外,可知第二反应时使用的硫酸浓度高一点好,适宜为70%w/w,至少为65%w/w以上,可知在第二反应中重要的不仅仅是反应母液中的硫酸浓度。
[0542]
而且,回收液b的回收率超过80%,非常好,但是,氯离子的浓度高于亚氯酸根离
子,所以该组成只能用于次氯酸钠标准。
[0543]
[表14-1]
[0544]
(1)原料
[0545]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)46299.2631019.556959.5
[0546]
*12%的低食盐级次氯酸钠
[0547]
(2)反应条件(第一反应、第二反应)
[0548][0549]
(3)回收液
[0550] 回收液a回收液b2n氢氧化钠200g 1n氢氧化钠 100g过氧化氢-4.4g 0.1g
[0551]
[表14-2]
[0552]
[测定结果](单位:ppm)
[0553] 有效氯浓度cl-clo
2-clo
3-第一反应后19.2630037.0042540.6第二反应后12.611989.000
[0554] 有效氯浓度cl-clo
2-clo
3-回收液a43112.5730211.799.0339.6回收液b41365.7626040.723688.21201.5
[0555]
[亚氯酸根离子和有效氯的回收率]
[0556][0557]
(劣化次氯酸钠的反应15)
[0558]
不仅使用低食盐次氯酸钠,而且使用12%的普通级次氯酸钠溶液的品质降低了的劣化次氯酸钠,确认了本制造方法中的反应性与回收率。
[0559]
需要说明的是,作为普通级次氯酸钠的特征,与低食盐次氯酸钠相比,药品单价便宜,组成中的氯离子的量多,并且氯酸根离子从最初开始就有高的倾向。
[0560]
因此,在试验中,由于原料中的氯离子过多,因此将第一反应时的反应母液的硫酸浓度设定为低至4.47%,进而,在第二反应时为了使反应母液中的氯酸根离子全部分解,追加添加氯化钠,积极地促进盐酸生成。
[0561]
然后,回收液a使用10%氢氧化钙,而且,如果过于要求回收液b的回收率,由于确认了回收液b中的氯离子有增加倾向,因此,经由中间捕集槽(含有过氧化氢)后进行回收。需要说明的是,对于此时的氯离子,认为是来自反应槽的盐酸的雾沫夹带或混入了氯气这两种。
[0562]
其结果,回收液a的回收率良好,但尽管降低了第一反应时的反应母液中的硫酸浓度,但结果氯离子、氯酸根离子均减少,与使用低食盐次氯酸钠作为原料时的结果不同。
[0563]
另外,回收液b的回收率为约20%,在氯离子的回收捕集槽(含有过氧化氢)中回收了大量的氯离子,另外,回收液b中的氯离子也显示出较高的数值。
[0564]
可认为这些结果是由于强酸化中过多地生成了盐酸。本来在强酸性条件下容易使氯酸分解而产生二氧化氯气体,但在该普通级劣化次氯酸钠中,已经产生了大量氯离子,导致其在强硫酸存在下过量产生盐酸。其结果,可知在使氯酸钠分解时进行了产生氯气的副反应,而主反应几乎没有进行,使回收率大幅度下降。因此,在使用普通级劣化次氯酸钠时,无需追加添加氯化钠,同时回收液b中大量生成的氯离子估计是副反应进行的结果的氯气混入。
[0565]
因而,使氯酸根离子分解的反应存在主反应和副反应,反应比率根据反应条件而变化。认为特别是在接近反应终点时氯酸根离子减少,副反应容易进行。
[0566]
2naclo3 4hcl
→
2clo2 cl2 2nacl 2h2o
·····
(13)主反应
[0567]
naclo3 6hcl
→
3cl2 nacl 3h2o
·····
(14)副反应
[0568]
*特别是在普通级劣化次氯酸钠反应的情况下,主副反应的进行容易根据酸度、盐酸的生成量而变化。
[0569]
[表15-1]
[0570]
(1)原料
[0571]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)41784196966045204
[0572]
*普通级次氯酸钠
[0573]
(2)反应条件(第一反应、第二反应)
[0574]
[0575]
(3)回收液等
[0576] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
2n氢氧化钠
‑‑
200g去离子水-200g-过氧化氢-10g12g
[0577]
[表15-2]
[0578]
[测定结果](单位:ppm)
[0579] 有效氯浓度cl-clo
2-clo
3-第一反应后4005132829036950第二反应后438101321320
[0580] 有效氯浓度cl-clo
2-clo
3-回收液a315413481900捕集槽29779916229回收液b14921558227202980
[0581]
[亚氯酸根离子和有效氯的回收率]
[0582][0583]
(劣化次氯酸钠的反应16)
[0584]
在使用普通级劣化次氯酸钠的情况下,与低食盐级劣化次氯酸钠相比,可以确认主反应和副反应的进行更容易逆转。例如,在第一反应时已经有氯酸根离子容易分解的趋势,其原因是由劣化次氯酸钠中产生的大量氯离子与硫酸的反应而导致过量产生盐酸,但作为原料中的生成物的氯离子难以预先去除。
[0585]
因此,对于普通级劣化次氯酸钠的反应而言,实施了在第二反应时预先投入过氧化氢、其后添加硫酸的预备试验。这是由于在硫酸存在下通过氯酸根离子与过氧化氢的反应而追加了二氧化氯气体产生路径,并且通过使过量生成的盐酸分解、氯化,防止氯酸根离子通过副反应进行而产生氯气。
[0586]
另外,在预备试验中,为了确认反应母液在反应中的组成变化,将第二反应时的硫酸投入分成两次,并进行中途分析。而且,第二反应的硫酸浓度设定为最终37.37%。
[0587]
其结果,可知即使在第二反应(1)的硫酸浓度(21.57%)下,在1小时左右反应母液中的氯酸根离子的80%以上发生了分解。然而,在预备试验的设备环境中,不能很好地回收气体,不能验证回收率,但在第二反应中,在1小时左右80%以上的氯酸根离子分解,组成为亚氯酸根离子>氯离子,因此可以确认,基于主反应进行的亚氯酸根离子生成比率有升高的趋势。
[0588]
然而,在其后通过追加65w/w%硫酸而使反应母液中的硫酸浓度为最终 37.37%、并继续反应时,几乎只回收了氯离子,且回收液b中的亚氯酸根离子的纯度大大降低。由以
上结果可知,在使用普通级劣化次氯酸钠的情况下,由于盐酸的过量产生,氯酸根离子会在短时间内分解,因此可知,在该反应时间中如何使主反应优先进行很重要。
[0589]
[表16-1]
[0590]
(1)原料
[0591]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)417841933121543651
[0592]
*12%的普通级次氯酸钠
[0593]
(2)反应条件(第一反应、第二反应)
[0594][0595]
(3)回收液
[0596] 回收液a回收液b(1)回收液b(2)2n氢氧化钠200g200g200g过氧化氢
‑‑
10g
[0597]
[表16-2]
[0598]
[测定结果](单位:ppm)
[0599] 有效氯浓度cl-clo
2-clo
3-clo
3-分解率第一反应后63614789165408186.49%第二反应(1)后949113658188435483.61%第二反应(2)后107652091880100.00%
[0600] 有效氯浓度cl-clo
2-clo
3-回收液a306643169200回收液b(1)8200139223193122回收液b(2)3106127281158204
[0601]
[亚氯酸根离子和有效氯的回收率]
[0602]
[0603]
(劣化次氯酸钠的反应17)
[0604]
为了确认普通级劣化次氯酸钠的第一反应的硫酸条件,将反应母液中的硫酸浓度设定为4.0%。可认为这是由于如果将硫酸浓度设定为4.5%,则在第一反应时会稍微过量地生成盐酸,结果氯酸根离子发生分解。
[0605]
另外,将第二反应时的反应母液中的硫酸浓度设定为30%。可认为这是由于硫酸浓度为20%左右时氯酸根离子会残留20%左右而不会全部分解。而且,与上一次同样地,在硫酸投入前添加过氧化氢。本来添加过氧化氢是为了抑制二氧化氯产生,或在低硫酸浓度下使二氧化氯气体产生,根据条件而显示出不同的反应的情况居多。这次添加是为了通过添加过氧化氢来抑制副反应。
[0606]
进而,对于空气,在投入硫酸后立即大量送入,并优先使气体充满空捕集槽(防逆流
·
气体回收槽)。这是因为在反应槽中充满气体的情况下放置时会担心气体返回溶液或发生逆反应。
[0607]
另外,每1小时测定回收液b的有效氯,制作有效氯的回收曲线,同时确认回收液b中的组成变化。
[0608]
其结果,确认在第二反应1小时后氯酸根离子全部分解,此时的有效氯的回收率为57.7%,2小时后的回收率也没有变化,因此确认第二反应在约2小时左右结束。因而可知,即使考虑设备或配管内残留有气体,也最多进行2小时 30分钟左右的反应和回收,第二反应结束。而且,即使在这次的试验条件下,回收液b中的组成也为亚氯酸根离子>氯离子,可知优先进行了主反应。
[0609]
因而,在第二反应中重要的是通过使主反应优先进行、防止氯离子的生成来提高纯度。因此,可以说在这次的试验中主反应进行的结果是回收率提高了,但氯酸根离子全部分解的硫酸浓度和主副反应变化的硫酸浓度未必相同。另外,过氧化氢的添加、量也是同样的。
[0610]
[表17-1]
[0611]
(1)原料
[0612]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)417841933121543651
[0613]
*12%的普通级次氯酸钠
[0614]
(2)反应条件(第一反应、第二反应)
[0615]
[0616]
(3)回收液
[0617] 回收液a回收液b2n氢氧化钠200g200g过氧化氢-10g
[0618]
[表17-2]
[0619]
[测定结果](单位:ppm)
[0620][0621][0622]
[亚氯酸根离子和有效氯的回收率]
[0623][0624]
(劣化次氯酸钠的反应18)
[0625]
在为普通级次氯酸钠的情况下,由于包含大量氯离子,因此如果反应条件过度,则主反应和副反应容易替换。
[0626]
因此,在将第二反应时的反应母液中的硫酸浓度设定为40.0%后使其反应时,确认优先进行的是主反应和副反应中的哪一个反应。
[0627]
其结果,当第二反应时的反应母液中的硫酸浓度提高40.0%时,从回收液 b中产生氯离子,变成氯离子>亚氯酸根离子,因此认为优先进行了副反应。另外,回收率也大幅度降低,因此可知,即使添加了过氧化氢,在将反应母液中的硫酸浓度提高至40.0%时,氯气的产生或副反应也会进行。
[0628]
[表18-1]
[0629]
(1)原料
[0630]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)407642024823247442
[0631]
*12%的普通级次氯酸钠
[0632]
(2)反应条件(第一反应、第二反应)
[0633][0634]
(3)回收液
[0635] 回收液a回收液b2n氢氧化钠200g200g过氧化氢-10g
[0636] [表18-2]
[0637]
[测定结果](单位:ppm)
[0638][0639][0640]
[亚氯酸根离子和有效氯的回收率]
[0641][0642]
(劣化次氯酸钠的反应19)
[0643]
在第二反应时的反应母液中的硫酸浓度为40.0%的情况下,副反应进行而生成了大量源于氯气的氯离子,回收率变差。
[0644]
接着,使反应母液中的硫酸浓度为30.0%,而且在没有预先添加过氧化氢的情况下实施了试验。在该试验中,可预测因未抑制第二反应中的氯气,总体上的反应性提高,其反面生成了大量氯离子。
[0645]
其结果,在第二反应进行了24分钟后,回收液b中的过氧化氢不足,需要进行追加添加。认为这是由于回收液b中回收的氯气或二氧化氯气体多于预期,过氧化氢不足的结果是氯气成为氯离子,二氧化氯气体以氯酸根离子的形式被回收。另外,由于回收组成为氯离子>亚氯酸根离子,因此认为伴随着副反应进行大部分氯气混入。
[0646]
另外,虽然伴随着回收液b中的过氧化氢不足而导致回收损失,但是可以确认,反应性增加的结果是亚氯酸根离子的回收率趋于增加。然而,虽然亚氯酸根离子的回收率升高了,但同时产生了大量的氯离子,纯度降低了。而且,如果纯度达不到某种程度,则在干燥浓缩时难以高浓度回收,因此无法加工成高级漂白粉。在任何情况下,都需要通过在第二反应时添加过氧化氢来抑制氯气的产生,而且,需要追加防止氯气混入回收液b中的中间捕集槽。
[0647]
[表19-1]
[0648]
(1)原料
[0649]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)407642024823247442
[0650]
*12%的普通级次氯酸钠
[0651]
(2)反应条件(第一反应、第二反应)
[0652][0653]
(3)回收液
[0654] 回收液a回收液b2n氢氧化钠200g200g过氧化氢-12.0g 2.5g*
[0655]
*追加添加过氧化氢(由于回收时过氧化氢不足)
[0656]
[表19-2]
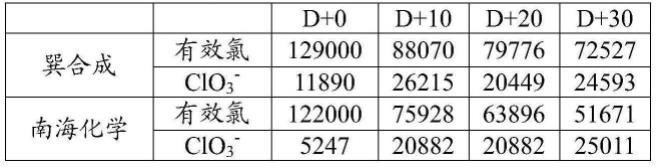
[0657]
[测定结果](单位:ppm)
[0658]
[0659][0660]
[亚氯酸根离子和有效氯的回收率]
[0661][0662]
(劣化次氯酸钠的反应20)
[0663]
为了确认使用普通级次氯酸钠时的反应条件,以普通级劣化次氯酸钠为原料,使用50w/w%硫酸,将反应母液中的硫酸浓度设定为4.0%,一边投入空气一边实施第一反应。此时的反应时间为1小时。而且,在回收液a中用氢氧化钠(或氢氧化钙)进行回收。
[0664]
另外,在第二反应中,在结束第一反应后的反应母液中预先添加用于抑制氯离子生成的过氧化氢水,而且,使用65w/w%硫酸,将反应母液中的硫酸浓度设定为30.0%,在温度升高至60~70℃时一边送入空气一边实施第二反应。此时的反应时间为2小时~2小时30分钟即可。然后,经由加入了过氧化氢的中间捕集槽,在回收液b中用氢氧化钠和过氧化氢进行回收。需要说明的是,通过使过氧化氢溶液通过中间捕集槽进行氯气清洗,可起到去除氯离子的作用,其结果,能够回收纯度高的回收液b,其后,通过进行干燥工序达到能够以高浓度进行浓缩的水平。
[0665]
需要说明的是,在本发明中,如反应式(13)和(14)所示,二氧化氯气体和氯气这两种气体必定会生成,但通过在中间捕集槽中使用过氧化氢来清洗去除氯气,即使使二氧化氯气体通过,根据反应式(15)、(16)也只能去除氯气产生量的约一半量。如果用另一种方法以高水平去除氯气,则同样为氧化剂的二氧化氯气体也会发生反应,因此,使用次氯酸钠为原料的本发明的回收液必定包含氯离子。
[0666]
2naclo3 4hcl
→
2clo2 cl2 2nacl 2h2o
·····
(13)主反应
[0667]
naclo3 6hcl
→
3cl2 nacl 3h2o
·····
(14)副反应
[0668]
cl2 3h2o2→
2hcl 2h2o 2o2·····
(15)
[0669]
2hcl h2o2→
2h2o cl2·····
(16)
[0670]
[表20-1]
[0671]
(1)原料
[0672]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)402091918055747063
[0673]
*12%的普通级次氯酸钠
[0674]
(2)反应条件(第一反应、第二反应)
[0675][0676]
(3)回收液
[0677] 回收液a中间捕集槽回收液b2n氢氧化钠200g-200g过氧化氢-20g20g去离子水-200g-[0678]
[表20-2]
[0679]
[测定结果](单位:ppm)
[0680][0681][0682]
[亚氯酸根离子和有效氯的回收率]
[0683][0684]
(劣化次氯酸钠的反应21)
[0685]
以往在第二反应时使温度为60~70℃来进行反应。然而,在使用普通级次氯酸钠时反应性高,在与低食盐级次氯酸钠同样的反应条件下会产生大量的氯离子且是过量的,因此需要进行降低反应母液中的硫酸浓度等调节。
[0686]
因此,在第二反应时确认了在常温(没有温度控制)下的反应性。
[0687]
其结果,可知在使用普通级次氯酸钠为原料的情况下,即使不特别地调节第二反
应时的温度,回收率也没有明显变化。
[0688]
[表21-1]
[0689]
(1)原料
[0690]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)366731846393047093
[0691]
*12%的普通级次氯酸钠
[0692]
(2)反应条件(第一反应、第二反应)
[0693][0694]
(3)回收液
[0695] 回收液a中间捕集槽回收液b2n氢氧化钠200g-200g过氧化氢-20g20g去离子水-200g-[0696] [表21-2]
[0697]
[测定结果](单位:ppm)
[0698][0699][0700]
[亚氯酸根离子和有效氯的回收率]
[0701][0702]
(劣化次氯酸钠的反应22)
[0703]
进行第二反应中的回收液b中的氢氧化钠量的研讨。为了防止回收泄漏,第二反应中的碱量以过量为宜,但如果无机碱盐多,则进行干燥时的浓缩率降低,并导致最终浓度降低。
[0704]
因此,使回收液b的氢氧化钠为0.5n来确认回收率的变化。
[0705]
其结果,第二反应前的回收溶液b的t.al为515.46,反应结束后成为149.25,可知反应中消耗了366.21的t.al。而且,回收液b的回收率趋于稍微降低,但干燥效率升高,因此能够使其干燥成含有非常高浓度的有效氯的粉末。
[0706]
然而,由于劣化次氯酸钠中所含的氯酸根离子为低浓度,并且还生成副产物氯离子,因此无法获得如理论值那样的回收率。而且,为了将由此获得的回收液体以高浓度进行干燥浓缩,需要进行35倍左右的浓缩,结果残碱、氯离子也浓缩了35倍。
[0707]
为了实现以上目标,需要控制回收液中的碱量和氯离子,但在使用次氯酸钠为原料的情况下,相对于亚氯酸根离子总会生成一定量的氯离子,因此,控制回收液b中的残碱和无机盐很重要。
[0708]
[表22-1]
[0709]
(1)原料
[0710]
原料有效氯浓度cl-clo
2-clo
3-劣化次氯酸钠(*)348871773293445837
[0711]
*12%的普通级次氯酸钠
[0712]
(2)反应条件(第一反应、第二反应)
[0713][0714]
(3)回收液
[0715] 回收液a中间捕集槽回收液b0.5n过氧化氢200g-200g过氧化氢-20g20g
去离子水-200g-[0716]
[表22-2]
[0717]
[测定结果](单位:ppm)
[0718][0719][0720]
[亚氯酸根离子和有效氯的回收率]
[0721][0722]
[表22-3]
[0723]
[回收液b的回收前后的t.al]
[0724]
回收前515.46回收后149.25基于回收的消耗366.21
[0725]
[仅回收液b的干燥效率]
[0726] 浓度倍cl-clo
2-clo
3-有效氯干燥前1307716451836668干燥后(120分钟)3598535436480700936850干燥收率(*) 91.5%75.8%250%73.0%
[0727]
*干燥后实际测定值/(干燥前
×
35)
[0728]
(劣化次氯酸钠的反应23)
[0729]
为了实施试验以验证第一反应、第二反应中的硫酸浓度是否由原料组成确定,使用氯化物较多的另一制造商的低食盐级次氯酸钠为原料,进行了反应条件的验证。另外,在测定原料中的氯化物浓度时,通过使用莫尔(mohr)法来进行次氯酸钠中的氯离子的分别定量,确认氯化物浓度和硫酸浓度的反应条件。
[0730]
其结果,相对于原料中的有效氯50,511ppm、氯化物浓度42186ppm,使反应母液中的硫酸浓度为6.37%而使其反应,结果可知有效氯减少至598ppm,可以用回收液a进行氯回收,但同时氯酸根离子因分解而减少,硫酸是过量的。另外,在使第二反应的反应母液中的硫酸浓度为58.00%而使其反应,结果认为回收液b中生成源于氯的氯离子,主要进行了副
反应。因此可知,相对于第一反应结束后的反应母液中的氯化物浓度15,523ppm,将硫酸浓度设定为58.00%而使其进行第二反应也是过量的。
[0731]
[表23-1]
[0732]
(1)原料
[0733]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)50511421866530519333644
[0734]
*12%的低食盐级次氯酸钠
[0735]
(2)反应条件(第一反应、第二反应)
[0736][0737]
(3)回收液
[0738] 回收液a中间捕集槽回收液b10%氢氧化钙180g
‑‑
0.6n氢氧化钠
‑‑
180g过氧化氢
‑‑
9g
[0739]
*在为低食盐级次氯酸钠的情况下,没有中间捕集槽
[0740]
[表23-2]
[0741]
[测定结果](单位:ppm)
[0742]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后1hr后598155231768302950712.3%第二反应后2hr后01144248300100.0%
[0743]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a1hr后42570-5038600回收液b2hr后30209-206461472280
[0744]
[亚氯酸根离子和有效氯的回收率]
[0745][0746]
(劣化次氯酸钠的反应24)
[0747]
对于第一反应条件,通过与(劣化次氯酸钠的反应23)同样操作来确认再现性,将
第二反应时的反应母液中的硫酸浓度设定为30.0%。
[0748]
其结果,第一反应后的氯酸根离子分解了5.15%,可以确认相对于原料中的氯化物浓度43429ppm,硫酸仍然是过量的,氯酸根离子的分解率会存在一些偏差。对于第二反应,相对于第一反应结束后的反应母液中的氯化物浓度 18225ppm,以30%硫酸浓度使其反应,但回收液b中几乎没有生成氯离子和氯酸根离子,因此能够以主反应为中心使其反应,且能够以高纯度进行回收。
[0749]
[表24-1]
[0750]
(1)原料
[0751]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)4989743429624833932922
[0752]
*12%的低食盐级次氯酸钠
[0753]
(2)反应条件(第一反应、第二反应)
[0754][0755]
(3)回收液
[0756] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0757]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0758]
[表24-2]
[0759]
[测定结果](单位:ppm)
[0760]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后1hr后26718225214600312275.15%第二反应后2hr后0139651393100100.0%
[0761]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a1hr后39421-46547630回收液b2hr后36676-1071807929
[0762]
[亚氯酸根离子和有效氯的回收率]
[0763][0764]
(劣化次氯酸钠的反应25)
[0765]
相对于原料中的氯化物浓度41983ppm,将第一反应时的反应母液中的硫酸浓度设定为4.00%并进行了制造。
[0766]
其结果,在第一反应结束后的反应母液中,有效氯残留14397ppm,氯酸根离子增加了13.82%,但是相对于有效氯而言反应不足。
[0767]
另外,如果反应母液中存在大量的有效氯,则会担心在回收液b中产生氯离子,而实际上氯离子较少,以高纯度进行回收,同时由于第一反应结束后的反应母液中的氯酸根离子增加了的影响,回收率也升高了。
[0768]
[表25-1]
[0769]
(1)原料
[0770]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)50989419837142113634262
[0771]
*12%的低食盐级次氯酸钠
[0772]
(2)反应条件(第一反应、第二反应)
[0773][0774]
(3)回收液
[0775] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0776]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0777]
[表25-2]
[0778]
[测定结果](单位:ppm)
[0779]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后1hr后143973334449041038998-13.82%第二反应后2hr后0242293684100100.0%
[0780]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a1hr后21401-2229500回收液b2hr后42758-2509231310
[0781]
[亚氯酸根离子和有效氯的回收率]
[0782][0783]
(劣化次氯酸钠的反应26)
[0784]
相对于原料中的氯化物浓度41416ppm,将第一反应时的反应母液中的硫酸浓度设定为5.00%并进行了制造。其结果,在第一反应结束后的反应母液中,有效氯残留13281ppm,氯酸根离子减少了1.36%,可确认为稍微过量。
[0785]
[表26-1]
[0786]
(1)原料
[0787]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)50017414166878217333191
[0788]
*12%的低食盐级次氯酸钠
[0789]
(2)反应条件(第一反应、第二反应)
[0790][0791]
(3)回收液
[0792] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0793]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0794]
[表26-2]
[0795]
[测定结果](单位:ppm)
[0796]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后1hr后1328125145351780327401.36%第二反应后2hr后0242293684100100.0%
[0797]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a1hr后27397-3127900回收液b2hr后37758-16591951716
[0798]
[亚氯酸根离子和有效氯的回收率]
[0799][0800]
(劣化次氯酸钠的反应27)
[0801]
相对于原料中的氯化物浓度41416ppm,将第一反应时的反应母液中的硫酸浓度设定为6.00%并进行了制造。其结果,在第一反应结束后的反应母液中,有效氯残留13281ppm,氯酸根离子减少了3.6%,可确认为过量。另外,由于氯酸根离子减少了,回收液b的回收率也降低了。
[0802]
[表27-1]
[0803]
(1)原料
[0804]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)50017414166878217333191
[0805]
*12%低食盐级次氯酸钠
[0806]
(2)反应条件(第一反应、第二反应)
[0807][0808]
(3)回收液
[0809] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0810]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0811]
[表27-2]
[0812]
[测定结果](单位:ppm)
[0813]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后1hr后15618411233580319963.60%
第二反应后2hr后0127981747400100.0%
[0814]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a1hr后39835-4773700回收液b2hr后35482-1491971355
[0815] [亚氯酸根离子和有效氯的回收率]
[0816][0817]
(劣化次氯酸钠的反应28)
[0818]
相对于原料中的氯化物浓度42614ppm,将第一反应时的反应母液中的硫酸浓度设定为4.50%并进行了制造。另外,在第一反应结束后的反应母液中,可以预测有效氯残留,因此,将包括通气在内的反应时间设定为2小时。
[0819]
其结果,在第一反应结束后的反应母液中,确认有效氯残留13333ppm,氯酸根离子增加了12.56%。而且,以往针对同批次的原料,将反应母液中的硫酸浓度分别设定为4.0%、4.5%、5.0%、6.0%、6.37%来确认原料中的有效氯的分解和氯酸根离子的增减,相对于原料中的氯化物浓度约42000ppm,到4.0%、 4.5%为止氯酸根离子增加了但是从5.0%开始氯酸根离子急剧减少。
[0820]
根据这些情况,当根据原料中的氯化物浓度来确定可投入的硫酸浓度、且为了使原料中的有效氯全部分解而投入硫酸时,存在根据氯化物浓度而氯酸根离子减少的情况,其后的收率降低,因此,第一反应时的硫酸浓度由原料中的氯化物浓度来确定,如果氯化物浓度过高,则即使有效氯浓度高也不能添加大量硫酸。
[0821]
[表28-1]
[0822]
(1)原料
[0823]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)5062642614690819332999
[0824]
*12%的低食盐级次氯酸钠
[0825]
(2)反应条件(第一反应、第二反应)
[0826][0827]
(3)回收液
[0828] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0829]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0830]
[表28-2]
[0831]
[测定结果](单位:ppm)
[0832]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后2hr后81132901339179036426-12.56%第二反应后2hr后46213923066800100.0%
[0833]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a2hr后29392-3273100回收液b2hr后38133-7772087869
[0834]
[亚氯酸根离子和有效氯的回收率]
[0835][0836]
(劣化次氯酸钠的反应29)
[0837]
以往,相对于原料中的氯化物浓度约42000ppm,硫酸浓度为4.5%是适宜范围内,但是却使用另一批次的原料中的氯化物浓度为约35000ppm的原料实施了反应试验。另外,作为硫酸浓度,由于42000
÷
35000=1.2,估计4.5%
×
1.2=5.4%为适宜值,但是该条件是考虑了氯酸根离子增加至约110%以上的反应上的偏差后的安全数值。因此,初次设定为6.0%进行了反应。
[0838]
其结果,确认了第一反应结束后的氯酸根离子为约104%,处于氯酸根离子未减少的适宜范围内,为110%以下。另外,对于经由第二反应的回收液b,确认能够回收氯离子少的纯度高的亚氯酸根离子。
[0839]
[表29-1]
[0840]
(1)原料
[0841]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)67786347286367916429228
[0842]
*12%低食盐级次氯酸钠
[0843]
(2)反应条件(第一反应、第二反应)
[0844][0845]
(3)回收液
[0846] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0847]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0848]
[表29-2]
[0849]
[测定结果](单位:ppm)
[0850]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后2hr后50241851623083030406-4.03%第二反应后2hr后27154011962800100.0%
[0851]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a2hr后38517-4450000回收液b2hr后32308-3741687186
[0852] [亚氯酸根离子和有效氯的回收率]
[0853][0854]
(劣化次氯酸钠的反应30)
[0855]
作为第一反应时的反应母液中的硫酸浓度的添加方式,以原料中的氯酸根离子不分解或增加为上限,并且考虑安全性,以将氯酸根离子增加至110%以上为条件。
[0856]
而且,此时,如果原料中的氯化物浓度高,则可添加的硫酸浓度降低,因此,其计算式如下所述。另外,设定为(2)x≦4是为了使原料中的有效氯不会过量残留。
[0857]
(1)y=-1.2676x 9.84393
[0858]
(2)x≦4
[0859]
(y为反应母液中的硫酸浓度,x为原料中的氯化物浓度)
[0860]
因此,第一反应时根据计算式添加5.4%的硫酸,第二反应时设定为40.0%硫酸浓度,然后实施了试验。
[0861]
其结果,第一反应结束后的氯酸根离子浓度增加至118.24%,第二反应后的回收液b的回收率也为93.7%。
[0862]
需要说明的是,回收液b中的氯离子增加至3827ppm,可确认为了提高回收率而增加硫酸浓度会导致生成副产物氯离子。如果最终产品为次氯酸钠溶液,则即使回收液b中的氯化物浓度高也无妨,但在最终产品为高级漂白粉的情况下,如果超过4000ppm则干燥时的浓缩率降低,结果无法制造高浓度的高级漂白粉。
[0863]
[表30-1]
[0864]
(1)原料
[0865]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)69262352736484918628951
[0866]
*12%的低食盐级次氯酸钠
[0867]
(2)反应条件(第一反应、第二反应)
[0868][0869]
(3)回收液
[0870] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0871]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0872]
[表30-2]
[0873]
[测定结果](单位:ppm)
[0874]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后2hr后81902232631092034233-18.24%第二反应后2hr后0107371521800100.0%
[0875]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a2hr后34581-4066300回收液b2hr后43868-38272416950
[0876]
[亚氯酸根离子和有效氯的回收率]
回收液a2hr后28606-3201400回收液b2hr后44382-111432365395
[0893]
[亚氯酸根离子和有效氯的回收率]
[0894][0895]
(劣化次氯酸钠的反应32)
[0896]
使用低食盐级次氯酸钠为原料,将第二反应时的反应母液中的硫酸浓度设定为40.0%进行了反应。
[0897]
在使用低食盐级次氯酸钠来实施本制造方法的情况下,由于原料中的氯化物浓度对反应而言已经过多,因此,即使用过氧化氢水来防止氯气产生,回收液b中也会产生源于氯气的氯离子。在硫酸浓度高时或原料中的氯化物浓度高时会出现这种情况,但是在通过本制造方法制造固体产品的情况下,如果回收液b中的氯离子不是4000ppm左右,则无法以高浓度进行浓缩,因此,40.0%为上限值。(然而,在制造液体产品的情况下无需考虑浓缩率,因此,不限于此,可以至59.4%。)
[0898]
[表32-1]
[0899]
(1)原料
[0900]
原料有效氯浓度clcl-clo
2-clo
3-劣化次氯酸钠(*)49923419776340915131096
[0901]
*12%的低食盐级次氯酸钠
[0902]
(2)反应条件(第一反应、第二反应)
[0903][0904]
(3)回收液
[0905] 回收液a中间捕集槽回收液b10%氢氧化钙200g
‑‑
0.6n氢氧化钠
‑‑
200g过氧化氢
‑‑
10g
[0906]
*在为低食盐级次氯酸钠的情况下,无中间捕集槽
[0907]
[表32-2]
[0908]
[测定结果](单位:ppm)
[0909]
反应母液 有效氯浓度clcl-clo
2-clo
3-clo
3-分解率第一反应后2hr后60552904940830036331-16.83%第二反应后2hr后091931235400100.0%
[0910]
ꢀꢀ
有效氯浓度clcl-clo
2-clo
3-回收液a2hr后29468-2895300回收液b2hr后45900-40952523879
[0911]
[亚氯酸根离子和有效氯的回收率]
[0912][0913]
(反应时的硫酸浓度)
[0914]
作为原料的劣化次氯酸钠有低食盐级和普通级两种,各自的氯离子、氯化物浓度不同,适宜的硫酸浓度也根据其浓度而变化。
[0915]
作为第一反应时的适宜的硫酸浓度,以原料中的氯酸根离子不分解而使有效氯转化为氯气为条件,通过测定原料中的氯化物浓度,来确定反应母液中的硫酸浓度。
[0916]
此时,假设在原料中含有高浓度的氯化物的情况下,因氯酸根离子分解而无法提高硫酸的投入量,结果有效氯会残留,但为了使有效氯减少而过多地投入硫酸时氯酸根离子会分解,因此其后的回收液b的收率会降低。然而,如果有效氯过多地残留,则下一阶段的回收液b中产生氯离子,纯度会降低,因此,在这种情况下,需要将通空气时间延长至2小时,从反应母液中去除有效氯。
[0917]
而且,根据以往的试验数据,此时的计算式如下所述,形成第一反应结束后的氯酸根离子浓度增加率为110%以上且加上了安全性的添加式。另外,设定为(2)x≦4是为了使原料中的有效氯不会过量残留。
[0918]
(1)y=-1.2676x 9.84393
[0919]
(2)x≦4
[0920]
(y为反应母液中的硫酸浓度,x为原料中的氯化物浓度)
[0921]
接下来,对于第二反应而言,第一反应结束后的反应母液成为原料,原料中包含用于反应的足够的氯化物,稍微过量的情况居多。而且,如果过于提高反应母液中的硫酸浓度,则因副反应进行而仅产生氯气,会使回收液b中产生大量的氯离子。另外,即使硫酸浓度过少也是同样的。
[0922]
因而,作为第二反应时适宜的硫酸浓度,使反应母液中的氯酸根离子全部分解,同时控制副反应、使回收液b中没有产生大量氯离子为条件。
[0923]
然而,第一反应结束后的反应母液中的氯酸根离子、氯化物浓度与硫酸浓度没发
现有密切相关性。例如,低食盐次氯酸钠与普通级次氯酸钠的一次反应结束后的氯离子过剩地含有3至7.5倍,但两者在硫酸浓度30%下的回收率均良好。
[0924]
因此,根据以往的数据,第二反应的反应母液中的硫酸浓度如下所述。
[0925]
[表33-1]
[0926][0927]
*在为普通级次氯酸钠的情况下,需要通过中间捕集槽去除氯气的工序。
[0928]
(反应条件数据一览表)
[0929]
[表33-2]
[0930][0931]
单位:ppm
[0932]
(关于回收液a与回收液b的混合溶液(次氯酸钠标准))
[0933]
以劣化次氯酸钠为原料使其重新反应,在防止再次生成氯酸根离子的同时获得回收液a与回收液b,将它们混合,为了使其符合作为食品添加剂的次氯酸钠的标准,需要使有效氯浓度为4%以上,其它确认试验合格。
[0934]
因此,确认了将回收液a与回收液b混合的情况下的有效氯比率。
[0935]
其结果,可知以回收液a的有效氯浓度为1,回收液b的有效氯浓度的上限值为0.6是合适的,为0.7时确认试验(1)的次氯酸(3)的项目不适合。因此,基于本发明的目的考虑构成,优选以0.43~0.6的有效氯浓度比使其合并。另外,通过外部机关的分析,以该有效氯浓度比制造的杀菌消毒剂符合作为次氯酸钠的标准。
[0936]
[表34]
[0937] 试样1试样2试样3回收液a;有效氯42004187539412回收液b;有效氯180002512527588有效氯合计600006700067000有效氯浓度比0.4290.60.7
[0938]
《检查结果》
[0939]
日本食品添加剂公定书第8版d成分标准
·
保存基准各条"次氯酸钠"
[0940][0941]
另外,同样地测定了以以下的比率合并时的最终液体产品的有效氯浓度和游离残留氯浓度。
[0942]
[表35]
[0943]
有效氯比(a:b)1:0.431:0.6源于回收液a的有效氯浓度41,95837,500源于回收液b的有效氯浓度18.04222,500有效氯合计60,00060,000有效氯浓度60,11460,814游离残留氯浓度59,38058,157
[0944]
用dpd试剂测定游离残留氯浓度,可测定58,157~59,380ppm,认为得到的值与有效氯浓度值近似,因此,显示出次氯酸以外的其它反应。
[0945]
在为液体产品的情况下,由于难以从游离残留氯浓度求出,因此,通过离子色谱求出源于回收液b的亚氯酸根离子浓度并换算成有效氯浓度,从总的有效氯浓度中减去。此外,将剩余的有效氯浓度确定为源于回收液a的有效氯浓度,乘以系数而求出次氯酸根离子浓度,获得最终的离子比。
[0946]
[表36]
[0947]
有效氯浓度比a:b1:0.431:0.6源于回收液a的有效氯4195837500源于回收液b的有效氯1804222500有效氯合计6000060000
[0948]
有效氯浓度(a b)6052360788clo
2-(ic)76099084源于回收液b的有效氯*1598519084源于回收液a的有效氯*4453841704clo-3233430277
[0949]
最终液体的有效氯浓度比1:0.361:0.46离子比clo-:clo
2-1:0.241:0.30
[0950]
*用以下的换算式计算
[0951]
(换算式)
[0952]
有效氯浓度
×
0.476=亚氯酸根离子浓度(clo
2-)
[0953]
有效氯浓度
×
0.726=次氯酸根离子浓度(clo-)
[0954]
该换算式是通过使用已知浓度的亚氯酸根离子或次氯酸根离子浓度推导与有效氯浓度的关系而获得的。
[0955]
(关于混合溶液的保存性)
[0956]
确认了基于本制造方法制造的杀菌消毒剂(符合食品添加剂、次氯酸钠的标准的产品)的保存性。
[0957]
其结果可知,制造了初始的有效氯浓度为约6.94%的杀菌消毒剂,但即使在冷藏温度(6℃)下保存时,d 30时有效氯浓度也为约5%(约72%),而在 40℃下保存时,d 3时有效氯浓度减少至约3.8%(约54%),可知包含次氯酸根离子与亚氯酸根离子两者的杀菌消毒剂(液体)的保存性非常差,因此难以在常温下销售,优选在冷藏条件下销售。
[0958]
[表37]
[0959]
《6℃》(单位:ppm)
[0960][0961]
《40℃》(单位:ppm)
[0962][0963]
(第一反应时的回收液组成的研讨)
[0964]
使第一反应中的回收液为氢氧化钙,通过使其干燥而制成固体来研讨保存性和有效氯浓度的提高。其结果,在相对于劣化次氯酸钠1而言用20%氢氧化钙1回收时与相对于劣化次氯酸钠2而言用20%氢氧化钙1回收时,没有发现回收率有明显变化,可知能够进行浓缩回收。
[0965]
而且,在相对于劣化次氯酸钠1而言用10%氢氧化钙1回收时的回收率最高,认为这是由于氢氧化钙浆料的流动性高。因此可知,与在回收液阶段使有效氯浓缩的情况相比,优选在其后的干燥工序中使其浓缩。
[0966]
[表38]
[0967][0968]
*低食盐级次氯酸钠
[0969] 回收液a1回收液a2回收液a3回收液a4回收液a520%氢氧化钙200g200g200g200g-10%氢氧化钙
‑‑‑‑
200g
[0970]
[测定结果](单位:ppm)
[0971] 有效氯浓度clo
3-有效氯回收率回收液a1331182157.68%回收液a2322549757.34%回收液a36107733561.18%回收液a458788252960.60%回收液a51707057066.43%
[0972]
(关于回收液a与回收液b的混合溶液(高级漂白粉))
[0973]
以劣化次氯酸钠为原料使其重新反应,在防止生成氯酸根离子的同时获得回收液a与回收液b,将它们混合,需要使其符合作为食品添加剂的高级漂白粉的标准,需要使有效
氯浓度为60%以上,其它确认试验合格。
[0974]
然后,为此,在以回收液a的有效氯浓度为1、回收液b的有效氯浓度为 9.6~33.95的范围内调节有效氯浓度比来进行干燥工序。需要说明的是,由于本产品的特征,为了避免回收液b的比率变得过高,相对于回收液a为1而言主体配合回收液b为9.6。
[0975]
进而,可知收率因干燥工序、投入顺序而变差,特别是游离残留氯容易分解,因此,预先仅用回收液a形成造粒核,接着,对回收液b进行某种程度的浓缩而制成浆料。在该状态下将它们混合并进行干燥时,游离残留氯不容易分解,能够以干燥前后的组成变化非常小的状态得到干燥固体。
[0976]
根据外部机关的分析,通过以上方法制造的干燥固体符合高级漂白粉的标准。
[0977]
通过本制造方法制造的高级漂白粉与一般市场流通的高级漂白粉相比,组成特殊,因此,希望以杀菌剂(食品添加剂制剂)或消毒剂制剂的形式销售而不是以高级漂白粉单品的形式销售。
[0978]
(回收液a与回收液b的标准组成比率)
[0979]
将回收液a与回收液b混合并使其干燥时,由于各自干燥时的浓缩率不同,因此,无法测定最终产品中的有效氯比。因此,为了确认回收液a与回收液b 的有效氯比率的下限,作为预备试验,使用将回收液a、回收液b分别以单体的形式干燥而成的产品,分别测定有效氯浓度,然后制作样品。
[0980]
[表39]
[0981]
(回收液a、回收液b单体的最大干燥)
[0982] 回收液a回收液b有效氯228,600994,851cl-157,38096090clo2-0464,890
[0983] 试样1试样2试样2源于回收液a的有效氯660006940066380源于回收液b的有效氯70400700600703620有效氯合计770000770000770000有效氯浓度比9.610.110.6
[0984]
(仅就上述数据,为了验证构成模型,使回收液a、回收液b分别极限干燥,并使粉末彼此混合后加入少量的水,准确称量,然后取得数据)
[0985]
[表40]
[0986]
《检查结果》
[0987]
日本食品添加剂公定书第8版d成分标准
·
保存基准各条"高级漂白粉"
[0988]
[0989]
(干燥工序)
[0990]
干燥条件为:使仓库内环境温度为50~60℃、仓库内湿度为10%以下。另外,以1.9m3/s的风量送入热风。此时的热风无需直接对准干燥仓库内的液体,目的是为了维持仓库内的温度和湿度。
[0991]
然后,在分别形成回收液a的造粒核和回收液b的浆料后混合,这样干燥后的收率以及内容物组成稳定。特别是次氯酸根离子与亚氯酸根离子混在时有效氯分解,同时生成氯离子和氯酸根离子。在这种情况下,不仅最终产品的有效氯浓度降低,而且因生成副产物而使纯度也降低。
[0992]
干燥工序的流程图如图7所示。
[0993]
(由干燥工序的差异导致的收率变化)
[0994]
与no.1法相比,no.2法的游离残留氯的减少非常少,作为副产物的氯离子、氯酸根离子的生成也少。
[0995]
[表41]
[0996][0997]
(由干燥工序时的水分差异导致的收率变化)
[0998]
[表42]
[0999][1000]
关于将a液与b液混合而使其干燥时的稳定性,受干燥前保持的水分量和混合回收液a与回收液b时的有效氯比这两个因素的影响。
[1001]
在本制造方法中得到的结果是,通过用回收液a形成造粒核和用回收液b 形成浆料,并预先干燥至某种程度,这样可提高操作性、稳定性,作为其目标,分别进行预先干燥至干燥前的整体水分量达到20%以下为好。
[1002]
此时,如果水分量为26%以上,则由于回收液a中的游离残留氯(次氯酸根离子)与亚氯酸根离子发生反应,有效氯浓度也减少,氯酸根离子增加,纯度、干燥率也降低。另外,如果水分量超过30%,则游离残留氯(次氯酸根离子)的自分解明显,游离残留氯(次氯酸根离子)特别减少,纯度、干燥率仍然会降低。
[1003]
进而,对于回收液a与回收液b混合时的有效氯比,由于其为1:20时没有生成副产物而纯度最高,因此,在使回收液a与回收液b稳定地存在的同时进行干燥的情况下,将有效氯比设定为1:20、使水分量为20%以下时可获得最佳结果。
[1004]
(预干燥后的水分量20%区的固体产品的计算值)
[1005]
[表43]
[1006][1007]
另外,根据预干燥后的水分量20%区的固体产品的测定值,计算干燥后的有效氯比和离子比。次氯酸根离子:亚氯酸根离子的含量为1:5.53~23.18。
[1008]
(回收液a、b的组成与合并干燥结果(1:9.61))
[1009]
这是以有效氯比计以回收液a为1、回收液b为9.61进行混合、干燥时的测定结果,在为该有效氯比的情况下,以下的反应变得过度,生成氯化物和氯酸根离子。
[1010]
clo- clo
2-→
clo
3- cl-[1011]
因此,认为在有效氯比高于该值的情况下,有效氯会降低60%,变得不符合高级漂白粉的标准,因此该有效氯比为下限。
[1012]
[表44]
[1013]
(单位:ppm)
[1014] 有效氯cl-clo
2-clo
3-回收液a280243017100回收液b4453149622286925
[1015] 回收液a 回收液b重量配比%24.94:150.75重量比1.00:6.05有效氯3977ppm:38211ppm有效氯浓度比1.00;9.61
[1016]
(干燥后)
[1017]
(单位:ppm)
[1018] 有效氯游离氯cl-clo
2-clo
3-ca
2
高级漂白粉616877587281418122356003680015.40%
[1019]
(回收液a、b的组成与合并干燥结果(1:33.95))
[1020]
这是以有效氯比计以回收液a为1、回收液b为33.95进行混合、干燥时的测定结果,如果回收液b的有效氯比率变得太高,则预计不符合游离残留氯与钙的标准。该比率的结果是,干燥后的钙离子浓度为5.64%,处于高级漂白粉中的钙量适合的条件的下限,因此,该有效氯比基本上为上限。
[1021]
[表45]
[1022]
(单位:ppm)
[1023] 有效氯cl-clo
2-clo
3-回收液a289382969800回收液b4361142702403315
[1024] 回收液a 回收液b重量配比%6.40:144.23重量比1.00:22.53有效氯1230ppm:41757ppm有效氯浓度比1.00;33.95
[1025]
(干燥后)
[1026]
(单位:ppm)
[1027] 有效氯游离氯cl-clo
2-clo
3-ca2 高级漂白粉82406420785107320349840168405.64%
[1028]
(回收液a、b的组成与合并干燥结果(一览表))
[1029]
在(1)区的情况下,如果游离残留氯较多,则次氯酸根离子和亚氯酸根离子发生反应,有效氯减少同时生成氯离子和氯酸根离子。在这种情况下,不仅有效氯分解,而且产生无助于有效氯的副产物,因此干燥浓缩率也降低,有效氯浓度变得最低。
[1030]
另一方面,对于(4)区、(5)区、(6)区而言,尽管减少了游离残留氯的初始投入量,但是副产物氯离子、氯酸根离子的产生比率也较高。其原因尚不清楚,但可知在次氯酸根离子和亚氯酸根离子的有效氯比率中,当次氯酸根离子较高时,由于有效氯的分解而偏离了标准,相反地,即使在次氯酸根离子较低的情况下,由于转化成氯离子和氯酸根离子等副产物的比例增加,因此纯度降低,且阻碍了干燥浓缩。
[1031]
[表46]
[1032] (1)区(2)区(3)区(4)区(5)区*(6)区*a:b1:9.611:20.011:25.011:33.951:40.631:45.04有效氯616,877781,019802,432824,064817,143797,500游离残留氯58,72849,31436,27220.7858,5993,054cl136,948124,480113,405101,87399,998107.605cl-141,812122,170124,880107,320100.710114,820
clo
2-235,600319,280339,450349,840353,190360.520clo
3-36,8009,40017,74016,84020,85023,760so
42-2880137018001140660320ca
2
15.40%9.57%7.66%5.64%7.48%4.54%
[1033]
*(5)区是参考区,由于钙浓度低于5%,因此另外添加了氢氧化钙。(6)区是参考区,由于钙浓度偏离了标准,有时即使游离残留氯为1000ppm,也可观察到褪色,因此实施的参考区。
[1034]
另外,由于本制造方法是由氯气的反应中获得的,因此含有1140ppm左右以上的硫酸根离子,该硫酸根离子为反应槽中所含的硫酸的雾沫夹带,由于回收液中存在过量的氢氧化钙,因此主要采取硫酸钠的形式。
[1035]
[表47]
[1036] tosoh corporation日本曹达株式会社有效氯浓度75.36%69.33%so
42-194608110
[1037] (在溶解固体产品的情况下)
[1038]
基于下述的配比表,以使稀释后的有效氯浓度为1%、6%、12%的方式添加去离子水,并用搅拌器搅拌15分钟以使其没有未溶解的残留物。接下来,将其在10℃的培养箱中静置1小时(获得澄清的上清液),以不吸入沉淀物的方式回收上清液。然后,测定上清液的游离残留氯浓度、有效氯浓度、各种离子浓度(离子色谱法)。
[1039]
[表48]
[1040][1041]
在用去离子水稀释固体产品并制成液体时,因稍微促进了游离残留氯的分解而减少,有效氯比、离子比如附表所述。
[1042]
[表49-1]
[1043][1044]
有效氯(a b)824064616877游离残留氯(a)2078558728
有效氯(b)803279558149有效氯比1:38.651:9.50
[1045]
clo-(a)
×
0.7261509042637clo
2-(b)ic349840235600离子比clo-:clo
2-1:23.181:5.53
[1046]
<溶解后的上清液(制成液体)浓度和比率> 稀释至有效氯浓度为1%,6%,12%
[1047][1048][1049][1050]
(从固体产品中去除了钙时的组成)
[1051]
基于下述的配比表和去除ca的关系式(*),以使将去除ca后的回收液稀释后的有效氯浓度为1%、6%、12%的方式添加去离子水,并用搅拌器搅拌15 分钟以使其没有未溶解的残留物。(加入由关系式求出的20%碳酸钠溶液并搅拌 1分钟。)接下来,将其在10℃的培养箱中静置19小时(获得澄清的上清液),以不吸入沉淀物的方式回收上清液。然后,测定上清液的游离残留氯浓度、有效氯浓度、各种离子浓度(离子色谱法)。
[1052]
*高级漂白粉中的钙离子浓度(%)<x1>与20%碳酸氢钠溶液的添加量 (g)<y1>的关系式(1)为y1=14.042x1 0.0185。
[1053]
另外,关于钙离子的测定,使用nn指示剂,用edta溶液进行滴定。
[1054]
0.05mol/l edta溶液1ml=3.705mgca(oh)2×
钙离子的分子量(40.08)/氢氧化钙的分子量(74.08)=0.05mol/l edta溶液1ml=2.005mgca
2
[1055]
[表49-2]
[1056][1057]
在用去离子水稀释固体产品、通过关系式去除钙离子并制成液体时,发现通过增加碱可抑制游离残留氯的分解,有效氯比、离子比如附表所述。
[1058]
[表49-3]
[1059][1060]
有效氯(a b)801591606811游离残留氯浓度(a)1963451718有效氯(b)781957555093有效氯比1:39.831:10.73
[1061]
clo-(a)
×
0.7261425437547clo
2-(b)ic336190240800离子比clo-:clo
2-1:23.591:6.41
[1062]
<去除ca后的浓度和比率>
[1063][1064]
[表49-4]
[1065]
钙盐的定量
[1066][1067]
<食品、添加剂等的标准第2添加剂d成分标准
·
保存标准各条氢氧化钙>定量法
[1068]
准确称量本品约2g,加入盐酸(1
→
4)30ml使其溶解,进一步加入水而准确制成250ml作为样品溶液,通过钙盐定量法中的第一种方法进行定量。
[1069]
0.05mol/l edta溶液1ml=3.705mgca(oh)2[1070]
<食品、添加剂等的标准第2添加剂b一般试验法8.钙盐定量法>
[1071]
钙盐定量法是用乙二胺四乙酸二钠(edta)来定量钙盐类的含量的方法,有基于edta溶液的直接滴定法(第一种方法)和加入过量的edta后用乙酸锌溶液进行滴定的反向滴定法(第二种方法)。
[1072]
操作方法
[1073]
除了另行规定以外,利用以下任一种方法。
[1074]
第一种方法
[1075]
准确量取10ml另行规定的样品溶液,加入50ml水,加入10ml氢氧化钾溶液(1
→
10),放置约1分钟后,加入约0.1g nn指示剂,并立即用 0.05mol/ledta溶液进行滴定。滴定终点是溶液的红紫色完全消失而变成蓝色时。
[1076]
第二种方法
[1077]
准确量取20ml另行规定的样品溶液,并准确量取25ml 0.02mol/ledta溶液而加入,接着加入50ml水和5ml氨
·
氯化铵缓冲液(ph10.7),放置约1分钟后,加入0.025g铬黑t
·
氯化钠指示剂,并立即用0.02mol/l乙酸锌溶液滴定过量的edta。滴定终点是溶液的蓝色变为蓝紫色时。另行进行空白试验。
[1078]
0.05mol/l edta溶液1ml=3.705mgca(oh)2×
钙离子的分子量(40.08)/氢氧化钙的分子量(74.08)=0.05mol/l edta溶液1ml=2.005mgca
2
[1079]
(保存数据)
[1080]
为了进行比较对照,在25℃和40℃下对市售品的高级漂白粉 (“toyokuron-ptgiii”)和通过本制造方法生产的高级漂白粉(“高级漂白粉a”) 进行了保存试验。作为保存试验项目,实施“高级漂白粉”公定标准试验,测定了水分、基于过氧化氢水的反应的气泡的确认(游离残留氯)、溶胀。
[1081]
其结果,不管是25℃、40℃的哪一个贮存温度区域,有效氯都几乎没有减少,符合“高级漂白粉”公定标准试验,另外,可以确认基于过氧化氢水产生了气泡,即使在保存后,也没有观察到组成的变化。
[1082]
而且,与市售“高级漂白粉”相比,可以确认保存性优异。
[1083]
对于样品,将回收液a预干燥而形成造粒核,并且将经预干燥的回收液b 混合,使
其干燥。
[1084]
[表50-1]
[1085]
"高级漂白粉a"制造时的测定结果
[1086]
ꢀꢀ
有效氯浓度818,640cl-121,520clo
2-369,460
[1087]
(单位:ppm)
[1088]
(1)toyokuron 25℃
[1089][1090]
[表50-2]
[1091]
高级漂白粉a 25℃
[1092][1093]
toyokuron 40℃
[1094][1095]
从d 50开始,表面变湿,固体变软。
[1096]
[表50-3]
[1097]
高级漂白粉a 40℃
[1098][1099]
(氧化还原电位、氯气浓度)
[1100]
对于作为所制作的混合溶液(次氯酸钠标准)的样品(1)和样品(2),测定orp(氧化还原电位)和氯气浓度。另外,使用同浓度的次氯酸钠溶液作为比较对照。其结果,关于orp(氧化还原电位),次氯酸钠即使稀释也没有变化,相对于此,样品(1)和样品(2)的氧化能力通过稀释均升高了。另外,关于氯气浓度,即使使其与有机物接触也几乎没有发现释放出氯气,可以确认仅测定约1/31~1/50左右的优越性。
[1101]
[表51]
[1102][1103]
<使用仪器
·
设备>
[1104]
gastec corporation制的气体采集器gv-100s
[1105]
gastec corporation制的检测管no.8ll:测定范围0.025~2.0ppm
[1106]
gastec corporation制的检测管no.8la:测定范围0.1~16ppm
[1107]
gastec corporation制的检测管no.8h:测定范围25~1000ppm
[1108]
(粉末溶解产品的氯气浓度)
[1109]
使用所制作的高级漂白粉液体产品,在与同浓度的次氯酸钠比较的情况下,测定接触有机物时的氯气浓度。其结果,即使使高级漂白粉液体产品与有机物接触也没有急剧产生氯气,仅能测定1/1000~1/6000左右的氯气。而且,由此还会减少附着在杀菌对象食品上的氯的气味。
[1110]
<试验区>
[1111]
·
次氯酸钠
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
200ppm、1000ppm
[1112]
·
高级漂白粉液体产品
ꢀꢀ
200ppm、1000ppm
[1113]
量取上述每种溶液50g,在与液体比例1:10的条件下将切碎的园白菜5g 浸入其中并密封。其后,在25℃下浸渍1小时,测定氯气浓度。
[1114]
[表52]
[1115][1116]
<使用仪器
·
设备>
[1117]
gastec corporation制的气体采集器gv-100s
[1118]
gastec corporation制的检测管no.8ll:测定范围0.025~2.0ppm
[1119]
gastec corporation制的检测管no.8la:测定范围0.1~16ppm
[1120]
gastec corporation制的检测管no.8h:测定范围25~1000ppm
[1121]
(杀菌效果的确认)
[1122]
使用通过本发明所制作的液体产品(次氯酸钠标准)和固体产品(高级漂白粉标准),针对已知原料菌数高的大葱来确认杀菌效果。流程图如图8所示。
[1123]
与作为对照区的次氯酸钠相比,能确认液体产品针对一般活菌数、大肠杆菌群数的杀菌效果均具有优越性,能确认针对大肠杆菌群的杀菌效果特别显著。
[1124]
另外,对于固体产品而言,在去除高级漂白粉中的钙前后两区进行了确认,结果能同样地确认针对大肠杆菌群的杀菌效果,作为本发明中的杀菌剂的整体特征,确认针对大肠杆菌群的杀菌效果高。
[1125]
[表53]
[1126]
·
试验结果
[1127][1128]
(logcfu)
[1129]
(与r2法的反应的差异1)
[1130]
原料不是劣化次氯酸钠,但类似的反应方法有r2法。
[1131]
r2法是在基于硫酸的高酸性条件(8n~11n)下使氯酸钠与氯化钠间歇式反应而得到二氧化氯气体。r2法使劣化次氯酸钠直接反应,回收液a中产生氯酸根离子,因此与本制造方法的目的不同。另外,在本制造方法中,在作为原料的劣化次氯酸钠中自然产生了氯酸根离子、氯离子这两种离子,而且通过进行第一反应,氯酸根离子、氯离子分别增加或减少。另外,在劣化的次氯酸钠中氯离子已经产生了过量的盐酸,相反地需要控制基于氯离子的盐酸的过量产生。
[1132]
然而,如r2法那样,通过向反应母液中添加氯化钠,也可能会提高回收率。如果那样操作,则可能会降低使用硫酸的成本,因此,使用完成了第一反应的反应母液(劣化次氯酸钠 硫酸)来实施第二反应,添加50%硫酸和氯化钠,确认了氯酸根离子的分解率和回收液b中的回收率。
[1133]
其结果,在添加50%硫酸和氯化钠、使反应母液中的硫酸浓度为17%左右而进行第二反应时,随着添加氯化钠而使其反应,反应母液中的氯酸根离子的分解率提高了,而氯离子增加了。进而,可观察到回收液b中的亚氯酸根离子的回收率低、氯离子增加。
[1134]
由该结果可知,由于基于硫酸的反应母液中的酸度低而使副反应进行,通过使氯酸分解而产生氯气,反应母液中的氯离子增加,另外,在回收液b中通过用过氧化氢分解氯气而使氯离子增加,并且,由于主反应没有进行,二氧化氯的生成减少,亚氯酸根离子的回收率减少。
[1135]
[表54-1]
[1136]
(1)反应条件(第一反应、第二反应)
[1137] (1)(2)(3)反应母液*200g200g200g氯化钠0g5.0g10.29g50%硫酸100g100g100g反应母液(合计)300g305g310.29g投入硫酸浓度合计17.87%17.99%17.37%温度40~50℃40~50℃40~50℃
反应时间5h5h5h通气时间5h5h5h
[1138]
*第一反应结束后的反应母液
[1139]
(2)回收液
[1140] 回收液b(1)回收液b(2)回收液b(3)2n氢氧化钠200g200g200g过氧化氢9g9g9g
[1141]
[表54-2]
[1142]
[测定结果](单位:ppm)
[1143]
第二反应后so
42-cl-clo
2-clo
3-分解率*反应母液(1)31690828108891405134.47%反应母液(2)2990763307601118435.89%反应母液(3)263892591890952355.92%
[1144]
根据反应母液(第一反应结束后)中的氯酸根离子计算
[1145] 有效氯浓度cl-clo
2-clo
3-回收液b(1)12354137265475156回收液b(2)980096954475159回收液b(3)16593152598122297
[1146] [亚氯酸根离子和有效氯的回收率](单位:ppm)
[1147][1148]
(*)根据反应母液(第一反应结束后)中的氯酸根离子计算
[1149]
(与r2法的反应的差异2)
[1150]
可知通过在第一反应结束后的反应母液中添加氯化钠,即使没有过量投入硫酸,氯酸根离子的分解率也达到100%,虽然氯酸根离子的分解率提高,但相反地收率变差。
[1151]
因此,使用50%w/w硫酸,使反应母液中的硫酸浓度为25.0%和27.28%而实施了反应试验。
[1152]
其结果,利用强酸性条件使主反应进行,伴随着二氧化氯气体的产生而进行了亚氯酸根离子的回收,但回收液b中仍然回收了大量氯离子,这被认为是伴随着副反应进行氯气混入。
[1153]
根据以上情况可知,当基于硫酸的酸度低时,副反应容易进行,但在过量的硫酸浓度时盐酸产生增加,仍然是副反应进行,因此,太在意氯酸分解会导致副反应进行,回收率不会提高。而且,在已经存在足够的氯离子的劣化次氯酸钠的反应中,不论从哪一个角度说,通过控制过量产生的盐酸来防止副反应进行是重要的。
[1154]
[表55-1]
[1155]
(1)反应条件(第一反应、第二反应)
[1156] (4)(5)反应母液*200g200g氯化钠0g10.0g50%硫酸200g250g反应母液(合计)400g450g投入硫酸浓度合计25.00%27.78%温度40~50℃40~50℃反应时间5h5h通气5h5h
[1157]
*第一反应结束后的反应母液
[1158]
(2)回收液
[1159] 回收液b(4)回收液b(5)2n氢氧化钠200g200g过氧化氢9g9g
[1160]
[表55-2]
[1161]
[结果](单位:ppm)
[1162]
第二反应后so
42-cl-clo
2-clo
3-分解率反应母液(4)62398452260360778.68%反应母液(5)610874706600100.00%
[1163] 有效氯浓度cl-clo
2-clo
3-回收液b(4)287292475415355576回收液b(5)339582869522064656
[1164]
[亚氯酸根离子和有效氯的回收率]
[1165][1166]
(*)根据反应母液(第一反应结束后)中的氯酸根离子计算
[1167]
(与r2法的反应的差异3)
[1168]
可知通过在第一反应结束后的反应母液中投入氯化钠而产生盐酸,即使没有过量投入硫酸,氯酸根离子的分解率也达到100%。
[1169]
然而,可知虽然氯酸根离子的分解率达到100%,但亚氯酸的回收率没有提高,这是由于氯酸的分解反应有主反应和副反应这两种,反应的进行根据反应条件而变化,回收液b中的氯离子与通过氯酸根离子分解而产生的氯气有关。因此,伴随着过量产生盐酸而想使氯酸根离子完全分解时,会产生大量的氯离子,导致回收率变差和纯度降低。
[1170]
[表56-1]
[1171]
(1)反应条件(第一反应、第二反应)
[1172] (6)(7)(8)反应母液*400g400g400g氯化钠20g20g20g50%硫酸500g500g500g反应母液(合计)920g920g920g投入硫酸浓度合计27.2%27.2%27.2%温度40~50℃40~50℃40~50℃反应时间5h5h5h通气5h5h5h
[1173]
*第一反应结束后的反应母液
[1174]
(2)回收液
[1175] 回收液b(6)回收液b(7)回收液b(8)2n氢氧化钠200g
‑‑
1.8n过氧化氢-200g-1.4n氢氧化钠
‑‑
214.15g35%过氧化氢16g16g16g
[1176]
[表56-2]
[1177]
[测定结果](单位:ppm)
[1178]
第二反应后so
42-cl-clo
2-clo
3-分解率反应母液(6)50019823404300100.0%反应母液(7)5050482081600100.0%反应母液(8)4881632288000100.0%
[1179] 有效氯浓度cl-clo
2-clo
3-回收液b(6)6311252593336041068回收液b(7)674584064136015263回收液b(8)67569460603590469
[1180]
[亚氯酸根离子和有效氯的回收率]
[1181][1182]
(*4)根据反应母液(第一反应结束后)中的氯酸根离子计算
[1183]
(第一反应的条件与氯酸根离子增加的确认基础试验1)
[1184]
在使用劣化次氯酸钠进行了第一反应后,确认氯离子和氯酸根离子增加或减少的
程度。另外,通常在常温下实施第一反应,20℃~30℃、因反应时的放热而最高为40℃。
[1185]
而且,在实验性地仅进行一次反应时,确认氯离子减少和氯酸根离子增加,可知氯酸根离子在到达40℃左右持续增加。
[1186]
然而,如果在40℃下进行一次反应,则回收液中可检测到亚氯酸根离子,因此,可知作为一次反应的温度条件,优选在30℃左右的常温下使其反应。另外,认为温度升高太多是不优选的,因为会产生蒸气,向回收液的硫酸或盐酸等的雾沫夹带增加。
[1187]
[表57-1]
[1188]
(1)原料
[1189]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)675702057744855
[1190]
*12%的低食盐级次氯酸钠
[1191]
(2)反应条件(第一反应、第二反应)
[1192] 反应母液 第一反应劣化次氯酸钠200g50%硫酸25g投入硫酸浓度合计5.56%反应时间2h 30m(通气时间)2h
[1193]
(3)反应温度
[1194] (1)(2)(3)(4)反应温度20℃30℃40℃50℃
[1195]
(4)回收液
[1196] 回收液a2n氢氧化钠200g
[1197] [表57-2]
[1198]
[测定结果](单位:ppm)
[1199]
反应母液(第一反应结束后)
[1200] (1)20℃(2)30℃(3)40℃(4)50℃最终液量219219218218有效氯11000787083005570cl-30258.825921.431942.430570.0clo
2-‑‑‑‑
clo
3-36452.432967.440662.640603.6cl-减少率32.54%42.21%28.79%31.85%clo
3-增加率177.15%160.21%197.61%197.33%
[1201]
回收液a
[1202] (1)20℃(2)30℃(3)40℃(4)50℃
最终液量207207208208有效氯32020341503368035520cl-23945.926969.527120.828865.6clo
2-22.124.7103.371.5clo
3-145.4194.899.6437.5so
42-32.629.924.826.6
[1203]
(第一反应的条件和氯酸根离子增加的确认基础试验2)
[1204]
作为前面的试验的再次验证,通过进一步追加65w/w%硫酸来确认第一反应中的酸度的影响。
[1205]
其结果,与温度的影响相比,提高酸度会使氯酸根离子的增加更多。然而,另一方面,认为也促进了盐酸的产生,其结果,在回收液a中检测到亚氯酸根离子和氯酸根离子,因也认为回收率变差,所以,在第一反应中过度地提高反应母液中的硫酸浓度是不优选的。
[1206]
[表58-1]
[1207]
(1)原料
[1208]
原料有效氯浓度clo
3-cl-劣化次氯酸钠(*)675702057744855
[1209]
*12%的低食盐级次氯酸钠
[1210]
(2)反应条件(第一反应、第二反应)
[1211] 反应母液 第一反应劣化次氯酸钠200g50%硫酸25g65%硫酸25g中途追加投入硫酸浓度合计11.5%反应时间2h 30m(通气时间)2h
[1212]
(3)反应温度
[1213] (1)(2)(3)(4)反应温度20℃30℃40℃50℃
[1214]
(4)回收液
[1215] 回收液a2n氢氧化钠200g
[1216]
[表58-2]
[1217]
[测定结果](单位:ppm)
[1218]
接收溶液(1)20℃(2)30℃(3)40℃(4)50℃最终液量240240239239有效氯《25《25《25《25cl-17681.820023.019742.224436.2
clo
2-‑‑‑‑
clo
3-34958.235515.232078.637960.4cl-减少率60.58%55.36%55.99%45.52%clo
3-增加率169.89%172.6%155.9%184.48%
[1219]
回收液a(1)20℃(2)30℃(3)40℃(4)50℃最终液量209209210210有效氯49340477604544044170cl-42367.440490.138570.537112.9clo
2-117.791.0124.1188.9clo
3-231.8190.9287.3266.4so
42-110.558.445.342.3
[1220]
(试验的解说)
[1221]
使品质降低了的次氯酸钠即劣化次氯酸钠重新反应而再次制造次氯酸钠本身虽然并不是新颖的技术,但存在不能将再次制造的成本附加于产品单价的问题。
[1222]
因此,着眼于在劣化次氯酸钠中产生的氯离子和氯酸根离子,对能不能通过使它们反应来制造以各种氯氧化物的离子复合的状态存在的杀菌消毒剂进行了研讨。
[1223]
其结果可确认,如果使劣化次氯酸钠反应并用一种溶液回收氯气和二氧化氯气体这两种气体,则存在分解成氯离子、产生氯酸根离子等弊病,为了分别进行回收,需要确定从由劣化次氯酸钠和硫酸组成的反应母液中顺次地取出氯气和二氧化氯气的反应条件。
[1224]
另外,关于该反应条件,可知根据作为原料的次氯酸钠的等级(低食盐级或普通级)而不同。
[1225]
接着,关于回收液,在第一反应中,仅用氢氧化钠或氢氧化钙进行回收,在第二反应中,在氢氧化钠中加入过氧化氢来进行回收。
[1226]
进而,在第二反应回收时,在反应槽与回收槽之间,设置用于防逆流的中间槽,特别是对于普通级次氯酸钠而言,为了防止氯气混入,可以加入过氧化氢水。
[1227]
这些在其后使颗粒干燥时,可通过去除残碱成分、氯离子来提高纯度。
[1228]
而且,关于回收液a与回收液b的混合比,需要符合作为食品添加剂的次氯酸钠或高级漂白粉的标准,如果为次氯酸钠时,以回收液a的有效氯为1,回收液b的有效氯不能超过0.6,根据本发明的特征,希望调节至0.43~0.6的范围内。同样地,在为高级漂白粉时,以回收液a的有效氯为1,需要使回收液b的有效氯为33.95以下,考虑本制造产品的特征,希望为1:9.6。
[1229]
另外,在进行干燥浓缩时,与在溶液阶段使两种溶液合并相比,分别制成某种程度的浆料后混合并进行干燥的方法可缩短时间,且可以防止有效氯消失或组成变化。通过这些方法制造的干燥固体成为游离残留氯的分解非常少、且长期保持内容物的组成的状态的氯氧化物固体。
[1230]
如上所述,通过试验可清楚地看出,根据该发明,以品质降低了的次氯酸钠为原料,不单单是将其废弃或复原成廉价的次氯酸钠,而是可以将其再生成对终端消费者而言有附加价值的杀菌消毒剂。
[1231]
如上所述,使用本发明的优选实施方式对本发明进行了示例,可理解,本发明应该
仅由权利要求书来解释其范围。本技术对日本专利申请特愿 2018-71515(2018年4月3日提出申请)主张优先权,其内容全部以参考的形式引入本说明书中。可理解,本说明书中引用的专利、专利申请及其它文献的内容应该以参考的形式引入本说明书中,与其内容本身具体地记载于本说明书中的情况相同。
[1232]
产业上的可利用性
[1233]
本发明的组合物作为杀菌消毒剂是有用的。本发明的方法对品质劣化了的次氯酸钠进行再生,可重新获得有用的杀菌消毒剂。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。