瑞美吉泮的口服快速分散型剂型
1.相关申请交叉引用
2.本技术要求于2020年2月27日提交的美国临时申请第62/982,456号的优先权,以及根据35u.s.c.
§
119从中产生的所有权益,所述美国临时申请的内容通过引用整体并入本文。
技术领域
3.本发明涉及(5s,6s,9r)-4-(2-氧代-2,3-二氢-1h-咪唑并[4,5-b]吡啶-1-基)-1-哌啶甲酸5-氨基-6-(2,3-二氟苯基)-6,7,8,9-四氢-5h-环庚[b]吡啶-9-基酯(瑞美吉泮(rimegepant)(一种降钙素基因相关肽(cgrp)受体拮抗剂)的药物组合物。具体地,本发明涉及可以用于治疗如偏头痛等cgrp相关病症的瑞美吉泮的口服快速分散型剂型。
背景技术:
[0004]
偏头痛是一种慢性且使人衰弱的病症,其特征在于持续四至72小时的反复发作且伴有多种症状,通常包含中度至重度疼痛强度的单侧搏动性头痛,并伴有恶心或呕吐和/或对声音的敏感性(畏声)和对光的敏感性(畏光)。偏头痛通常先于短暂的神经学警告症状,称为先兆,其通常涉及视觉障碍,如闪光,但也可能涉及身体各部位的麻木或刺痛。偏头痛具有广泛性和致残性。偏头痛研究基金会将偏头痛列为世界第三大流行疾病,2015年全球疾病负担研究将偏头痛列为全球第七大特定残疾原因。根据偏头痛研究基金会的数据,在美国,大约3600万人患有偏头痛发作。虽然大多数患者每月会经历一次或两次偏头痛发作,但有超过400万人患有慢性偏头痛,其定义为每月经历至少15天头痛,其中至少八天为偏头痛,持续时间超过三个月。其它人患有偶发性偏头痛,其特征在于每月经历少于15天的偏头痛。患有偶发性偏头痛的人可能会随着时间的推移发展为慢性偏头痛。偏头痛发作可持续四小时或长达三天。超过90%的患有偏头痛发作的患者在偏头痛发作期间无法正常工作或发挥作用,其中许多人会出现如抑郁、焦虑和失眠等并发症。此外,患有偏头痛的患者通常伴有恶心并在发作期间厌恶食用食物或液体。
[0005]
cgrp(降钙素基因相关肽)是37个氨基酸的神经肽,其属于包含降钙素、肾上腺髓质素和胰淀素的肽家族。在人类中,存在两种形式的cgrp(α-cgrp和13-cgrp),并且这两种形式的cgrp具有类似的活性。它们因三种氨基酸而有所不同,并表现出不同的分布。至少两种cgrp受体亚型也可以解释不同的活性。cgrp受体位于疼痛信号通路、颅内动脉和肥大细胞内,并且认为其激活在偏头痛病理生理学中起因果作用。例如,研究和临床研究已表明:cgrp的血清水平在偏头痛发作期间升高,静脉内输注cgrp在偏头痛患者和非偏头痛患者中产生持续疼痛,并且用抗偏头痛药物治疗使cgrp活性正常化。
[0006]
cgrp可能与偏头痛相关已经成为许多化合物的开发和临床测试的基础,所述化合物包含例如,奥塞吉泮(olcegepant)(康涅狄格州里奇菲尔德的勃林格殷格翰公司(boehringer ingelheim,ridgefield,ct))、替卡格泮(telcagepant)(新泽西州凯尼尔沃思的默克夏普公司(merck sharp&dohme corp.,kenilworth,nj))、乌布吉泮(ubrogepant)
(爱尔兰都柏林的艾尔建公司(allergan plc,dublin,ireland))、瑞美吉泮(康涅狄格州纽黑文的生物医药控股有限公司(biohaven pharmaceutical holding company ltd.,new haven,ct))、伽奈珠单抗(galcanezumab)(印第安纳州印第安纳波利斯的礼来公司(eli lilly and company,indianapolis,in))、瑞玛奈珠单抗(fremanezumab)(以色列佩塔提克瓦的梯瓦制药公司(teva pharmaceutical industries,petah tikva,israel))、依普奈珠单抗(eptinezumab)(华盛顿州博塞尔的奥尔德生物制药公司(alder biopharmaceuticals,inc.,bothell,wa))和厄瑞努单抗(erenumab)(加利福尼亚千橡市的安进公司(amgen inc.,thousand oaks,ca))。最近研究的用于治疗偏头痛的另一种化合物是拉米地坦(lasmiditan)(印第安纳州印第安纳波利斯的礼来公司)。
[0007]
目前,临床医生使用多种药剂进行偏头痛的急性治疗。美国头痛协会在2015年发表的一项研究得出结论,认为对偏头痛的急性治疗有效的药物分为以下几类:曲坦类药物、麦角胺衍生物、非甾体抗炎药(“nsaid”)、阿片类药物和联合药物。目前偏头痛急性治疗的护理标准是血清素5-ht
1b/1d
受体激动剂曲坦类药物的处方。过去二十年来,曲坦类药物已被开发并批准用于偏头痛的急性治疗。曲坦类药物的最初引入代表了朝向更选择性地靶向偏头痛的疑似病理生理学的药物转变。虽然曲坦类药物占医疗保健提供者在诊所就诊时开具的抗偏头痛疗法的近80%,但如不完全效应或头痛复发的问题仍然是重要的临床限制。事实上,仅约30%的临床试验患者在服用曲坦类药物后的两小时没有疼痛。另外,曲坦类药物禁用于患有心血管疾病、脑血管疾病或存在显著危险因素的患者,因为5-ht
1b
介导的作用可能导致全身和脑血管血管收缩。此外,根据2017年1月《头痛》杂志中公开的一项研究,美国估计有260万偏头痛患者伴有限制曲坦类药物作为治疗选择的潜力的心血管事件、病状或程序。
[0008]
因此,仍然存在对于与现有疗法相比可以提供增强的患者益处的偏头痛治疗的显著未满足的医疗需求。另外,cgrp受体拮抗剂对于涉及其它cgrp病症的病症来说可能是有用的药物。除了偏头痛,此类病症可以包含丛集性头痛(doods(2001)《研究药物的最新观点(curr.opin.invest.drugs)》2,1261-1268;edvinsson等人(1994)《头痛(cephalalgia)》14,320-327);慢性紧张型头痛(ashina等人(2000)《神经病学(neurology)》14,1335-1340);疼痛(yu等人(1998)《欧洲药理学杂志(eur.j pharmacol.)》347,275-282);慢性疼痛(hulsebosch等人(2000)《疼痛(pain)》86,163-175);神经性炎症和炎性疼痛(holzer(1988)《神经科学(neuroscience)》24,739-768;delay-goyet等人(1992)《斯堪的纳维亚生理学学报(acta physiol.scanda.)》146,537-538;salmon等人(2001)《自然神经科学(nature neurosci.)》4,357-358);眼痛(may等人(2002)《头痛》22,195-196);牙痛(awawdeh等人(2002)《国际内分泌学杂志(int.endocrin.j)》35,30-36);非胰岛素依赖型糖尿病(molina等人(1990)《糖尿病(diabetes)》39,260-265);血管病症;炎症(zhang等人(2001)《疼痛》89,265);关节炎、支气管高反应性、哮喘(foster等人(1992)《纽约科学院年鉴(ann.ny acad.sci.)》657,397-404;schini等人(1994)《美国生理学杂志(am.j physiol.)》267,h2483-h2490;zheng等人(1993)《病毒学杂志(j viral.)》67,5786-5791);休克、败血症(beer等人(2002)《危症监护医学(crit.care med.)》30,1794-1798);阿片戒断综合征(salmon等人(2001)《自然神经科学》4,357-358);吗啡耐受(menard等人(1996)(神经科学杂志《j neurosci.)》16,2342-2351);男性和女性潮热(chen等人(1993)《柳叶刀
(lancet)》342,49;spetz等人(2001)《泌尿外科杂志(j urology)》166,1720-1723);过敏性皮炎(wallengren(2000)《接触性皮炎(contact dermatitis)》43,137-143);牛皮癣;脑炎、脑外伤、缺血、中风、癫痫和神经退行性疾病(rohrenbeck等人(1999)《疾病神经生物学(neurobiol.dis.)》6,15-34);皮肤疾病(geppetti和holzer编辑,《神经源性炎症(neurogenic inflammation)》,1996,佛罗里达州波卡拉顿的crc出版社(crc press,bocaraton,fl));神经源性皮肤发红、皮肤玫瑰色和红斑;耳鸣(herzog等人(2002)《膜生物学杂志(j membr.biol.)》189,225;肥胖症(walker等人(2010)《内分泌学(endocrinology)》151,4257-4269);炎性肠病、肠易激综合征(hoffman等人(2002)《斯堪的纳维亚胃肠病学杂志(scand.j gastroenterol.)》37,414-422)和膀胱炎。
技术实现要素:
[0009]
本发明涉及通过向患者口服施用包含药学上可接受的载体和治疗有效量的瑞美吉泮或其药学上可接受的盐的药物组合物来治疗cgrp相关病状,例如,偏头痛。
[0010]
在一实施例中,所述药物组合物可以是快速分散型药物组合物。
[0011]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内实现偏头痛疼痛消失。
[0012]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内使至少21.2%的患者实现偏头痛疼痛消失。
[0013]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内实现最令人烦恼的症状的消失。
[0014]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内使至少35.1%的患者实现最令人烦恼的症状的消失。
[0015]
在一实施例中,所述最令人烦恼的症状可以是畏光、恶心、畏声或其组合。
[0016]
在一实施例中,施用所述药物组合物可以在施用时间的90分钟内实现疼痛缓解。
[0017]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内实现疼痛缓解。
[0018]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内使至少59.3%的患者实现疼痛缓解。
[0019]
在一实施例中,施用所述药物组合物可以在施用时间的2到48小时内实现持续的疼痛缓解。
[0020]
在一实施例中,施用所述药物组合物可以在施用时间的2到48小时内使至少42.2%的患者实现持续的疼痛缓解。
[0021]
在一实施例中,施用所述药物组合物可以在施用时间的2到48小时内实现持续的疼痛消失。
[0022]
在一实施例中,施用所述药物组合物可以在施用时间的2到24小时内使至少13.5%的患者实现持续的疼痛消失。
[0023]
在一实施例中,施用所述药物组合物可以在施用时间的24小时内实现补救药物的使用减少。
[0024]
在一实施例中,施用所述药物组合物可以在施用时间的24小时内使至多14.2%的患者使用补救药物。
[0025]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内实现正常功能。
[0026]
在一实施例中,施用所述药物组合物可以在施用时间的2小时内使至少38.1%的患者报告正常功能。
[0027]
在一实施例中,瑞美吉泮的每日剂量可以为约75mg。
[0028]
在一实施例中,所述药物组合物可以在30天时间段内向患者施用至多15次。
[0029]
在一实施例中,所述药学上可接受的盐或瑞美吉泮可以是瑞美吉泮半硫酸盐。瑞美吉泮半硫酸盐的每日剂量可以为约85.65mg。
[0030]
在一实施例中,所述药物组合物可以进一步包含苄醇、桉油精、明胶、柠檬烯、甘露醇、薄荷醇、薄荷酮、乙酸薄荷酯、三氯蔗糖、香草醛或其组合。
[0031]
在一实施例中,1.3%或更少的接受所述药物组合物的患者可能经历恶心。
[0032]
在一实施例中,0.15%或更少的接受所述药物组合物的患者可能经历超敏反应。
[0033]
在一实施例中,所述超敏反应可以包含呼吸困难、皮疹或其组合。
附图说明
[0034]
从以下结合附图对实施例的描述中,这些和/或其它方面将变得显而易见并且更容易理解,其中:
[0035]
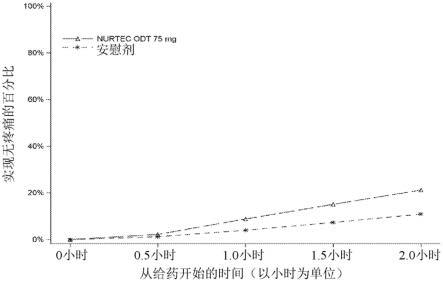
图1是实现疼痛消失的百分比对从给药起以小时为单位的时间(以小时为单位)的图,所述图展示了研究1中2小时内实现疼痛消失的患者的百分比;以及
[0036]
图2是实现最令人烦恼的综合征(mbs)消失的百分比对从给药起以小时为单位的时间的图,所述图展示了研究1中的额外偏头痛功效端点。
具体实施方式
[0037]
提供以下详细描述以帮助本领域技术人员实践本发明。本领域普通技术人员可以在不脱离本公开的精神或范围的情况下对本文描述的实施例进行修改和变化。除非另有定义,否则本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的相同含义。本说明书中使用的术语仅用于描述特定实施例,并不旨在进行限制。
[0038]
如在本技术中使用的,除非本文另有明确规定,否则以下术语中的每一个将具有以下阐述的含义。其它定义在整个申请中阐述。在术语在本文中没有具体定义的情况下,该术语被赋予本领域普通技术人员将该术语在上下文中应用于其在描述本发明中的用途的本领域公认的含义。
[0039]
冠词“一个”和“一种”指代所述冠词的语法对象的一个或多于一个(即,至少一个)语法对象,除非上下文清楚地另外指明。作为实例,“一个元件”是指一个元件或多于一个元件。
[0040]
术语“约”是指如由本领域普通技术人员所确定的在具体值或组合物的可接受的误差范围内的值或组合物,这将部分地取决于如何测量或确定值或组合物,即,测量系统的限制。例如,根据本领域的实践,“约”可以意指在1个或大于1个标准偏差内。可替代地,根据应用的上下文,“约”可以意指至多1%、5%、10%或20%(即,
±
10%或
±
20%)的范围。例如,约3mg可以包含2.7mg与3.3mg之间(对于10%)或2.4mg与3.6mg之间(对于20%)的任何数字。此外,特别是对于生物系统或过程,这些术语可以指至多一个数量级或至多5倍的值。
当在本技术和权利要求中提供了具体值或组合物时,除非另外陈述,否则“约”的含义应被假定在所述具体值或组合物的可接受误差范围之内。
[0041]
术语“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任何方法和递送系统将包括治疗剂的组合物物理引入到受试者。施用也可以例如进行一次、多次和/或在一个或多个延长的时间段内进行,并且可以是治疗有效剂量或亚治疗剂量。
[0042]
术语“auc”(曲线下面积)是指吸收或暴露于受试者的药物总量。通常,auc可以通过数学方法在受试者体内药物浓度随时间变化的曲线中获得,直到浓度可以忽略不计。术语“auc”也可以指特定时间间隔的部分auc。
[0043]
术语“c
max”是指在施用第一剂量与施用第二剂量之间受试者的血液、血清、特定区室或测试区域中药物的最大浓度。如果指定,那么术语c
max
也可以指剂量归一化比率。
[0044]
术语“与...组合”和“与...结合”是指除另一种治疗方式外还施用一种治疗方式。因此,“与...组合”或“与...结合”是指在向受试者施用其它治疗形式之前、期间或之后施用一种治疗形式。
[0045]
术语“药学上可接受的盐”是指本文所描述的化合物中的一种或多种的盐形式,所述化合物通常呈现为增加化合物在患者胃肠道的胃液或胃肠液中的溶解度,以促进化合物的溶解和生物利用度。药学上可接受的盐包含衍生自药学上可接受的无机或有机碱和酸的那些,如果适用的话。合适的盐包含例如衍生白药学领域众所周知的许多其它酸和碱中的碱金属(如钾和钠)、碱土金属(如钙、镁和铵盐)的那些盐。
[0046]
术语“受试者”和“患者”是指任何人或非人动物。术语“非人动物”包含但不限于脊椎动物,如非人灵长类动物、羊、狗以及如小鼠、大鼠和豚鼠等啮齿动物。在一些实施例中,受试者是人。术语“受试者”和“患者”在本文中可互换地使用。
[0047]
术语药剂(有时在本文中也称为“药物”)的“有效量”、“治疗有效量”、“治疗有效剂量(therapeutically effective dosage)”和“治疗有效剂量(therapeutically effective dose)”是指当单独使用或与另一种药剂组合使用时保护受试者免于疾病发作或促进疾病消退的药剂的任何量,其表现为疾病症状的严重程度的降低、无疾病症状期的频率和持续时间的增加,或防止因疾病折磨而出现损伤或残疾。可以使用本领域技术人员已知的多种方法来评估药剂的治疗有效量,如在临床试验期间在人类受试者中,在预测人类功效的动物模型系统中,或通过在体外测定中测定药剂的活性来评估。
[0048]
术语“t
max”是指施用药物之后,受试者的血液、血清、特定区室或测试区域中达到最大浓度(c
max
)时的时间或时间段。
[0049]
术语“治疗”是指对受试者的病状或疾病的任何治疗,并且可以包含:(i)防止受试者发生疾病或病状,所述受试者可能易患所述疾病或病状但尚未被诊断为患有所述疾病或病症;(ii)抑制疾病或病状,即,阻止其发展;缓解疾病或病状,即,使病状消退;或(iii)改善或缓解由疾病引起的病状,即,疾病的症状。治疗可以与其它标准疗法组合使用或单独使用。受试者的治疗或“疗法”还包含对受试者进行的任何类型的干预或过程或向受试者施用药剂,目的是逆转、减轻、改善、抑制、减慢或预防与疾病相关的症状、并发症或病状或生化标记的发作、进展、发展、严重程度或复发。
[0050]
关于头痛,“治疗”是用于获得对受试者有益的或期望的结果的方法。出于本发明的目的,有益的或期望的临床结果包含但不限于以下中的一者或多者:头痛的任何方面的
改善,包含减轻严重程度、减轻疼痛强度和其它相关症状、降低复发频率、提高患有头痛的患者的生活质量、降低治疗头痛所需的其它药物的剂量以及减少每月头痛天数。对于偏头痛,其它相关症状包含但不限于恶心、呕吐和对光、声音和/或移动敏感。对于丛集性头痛,其它相关症状包含但不限于眼睛下方或周围肿胀、过度流泪、红眼、流涕或鼻塞,以及脸红。
[0051]
出于本公开的目的,参考美国食品和药物管理局(fda)的出版物行业指南“偏头痛:开发用于急性治疗的药物(migraine:developing drugs for acute treatment)”,2018年2月,所述出版物可从https://www.fda.gov/downloads/drugs/guidances/ucm419465.pdf获得。实例中使用的术语,例如,最令人烦恼的症状(mbs)和疼痛消失,在所述fda指南中进行了描述。
[0052]
可用于制备本发明的药物组合物的起始材料容易商购获得或者可以由本领域技术人员制备。
[0053]
本发明涵盖瑞美吉泮的口服快速分散型剂型。本发明进一步涵盖通过口服施用组合物来调节cgrp和治疗患有与异常水平的cgrp或cgrp受体信号传导相关的医学病状的患者的方法。瑞美吉泮在化学上被描述为(5s,6s,9r)-4-(2-氧代-2,3-二氢-1h-咪唑并[4,5-b]吡啶-1-基)-1-哌啶甲酸5-氨基-6-(2,3-二氟苯基)-6,7,8,9-四氢-5h-环庚[b]吡啶-9-基酯,并且其结构式为:
[0054][0055]
瑞美吉泮描述于例如2011年4月21日发布的wo 2011/046997中。
[0056]
如本文所使用的,短语“快速分散型剂型”是指在被放置成与流体接触之后1到60秒,优选地1到30秒,更优选地1到10秒,并且特别是2到8秒内崩解或分散的组合物。所述流体优选地是如在口服施用时在口腔中发现的流体,即,唾液。
[0057]
在一优选实施例中,本发明的组合物是固体快速分散型剂型,其包括活性成分、瑞美吉泮和含有鱼明胶的水溶性或水分散性载体的固体网络。因此,载体对活性成分是惰性的。所述网络是通过从固态组合物中升华溶剂而获得的,所述组合物包括活性成分和载体在溶剂中的溶液。本发明的剂型可以根据gregory等人,英国专利第1,548,022号中公开的方法使用鱼明胶作为载体来制备。因此,制备包括活性成分和鱼明胶载体在溶剂中的溶液的初始组合物(或混合物),然后升华。升华优选地通过冷冻干燥组合物来进行。组合物可以在冷冻干燥期间包含在模具中以产生任何期望形状的固体形式。在将组合物沉积在模具中之前的预备步骤中,可以使用液氮或固态二氧化碳冷却所述模具。在冷冻模具和组合物后,
100mg、60-90mg和70-80mg。液体组合物通常在1-100mg/ml的单位剂量范围内。液体剂量单位的一些实例是0.1mg/ml、1mg/ml、10mg/ml、25mg/ml、50mg/ml和100mg/ml。
[0063]
本发明的药物组合物可以制备成任何合适的剂型,包含例如,片剂、胶囊剂、喷鼻剂、粉剂、颗粒剂、软膏剂、溶液剂、栓剂、注射剂、吸入剂、凝胶剂、微球剂和气雾剂。
[0064]
含有瑞美吉泮的本发明的药物组合物通常还包含其它药学上可接受的载体(也被称为赋形剂),例如,粘合剂、润滑剂、稀释剂、包衣剂、崩解剂、屏障层组分、助流剂、着色剂、溶解度增强剂、胶凝剂、填充剂、蛋白质、辅因子、乳化剂、增溶剂、悬浮剂、调味剂、防腐剂和其混合物。赋形剂的选择取决于组合物的期望的特性和调配物中其它药理学活性化合物的性质。合适的赋形剂是本领域技术人员已知的(参见由rowe等人编辑的《药用赋形剂手册(handbook of pharmaceutical excipients)》,第五版,2005,麦格劳希尔出版公司(mcgraw hill))。
[0065]
可以用于制备本发明的药物组合物的药学上可接受的载体的实例可以包含但不限于:填充剂,如糖,包含乳糖、蔗糖、甘露醇或山梨糖醇;纤维素制剂,如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、聚乙烯吡咯烷酮(pvp)、滑石粉、硫酸钙、植物油、合成油、多元醇、海藻酸、磷酸盐缓冲溶液、乳化剂、等渗盐水、无热原水和其组合。如果期望的话,也可以组合崩解剂,示例性崩解剂可以是但不限于交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,如海藻酸钠。在本发明的一方面,调味剂选自薄荷、胡椒薄荷、浆果、樱桃、薄荷醇和氯化钠调味剂和其组合。在本发明的一方面,甜味剂选自糖、三氯蔗糖、阿斯巴甜、安赛蜜、纽甜和其组合。
[0066]
通常,本发明的药物组合物可以以本领域己知的常规方法制造,例如通过常规的混合、溶解、制粒、制糖衣丸、磨细、乳化、封装、包埋、冻干方法等。
[0067]
在本发明的一方面,药物组合物被制备成口服固体模制快速分散型剂型,如于2015年11月24日发布的美国专利第9,192,580中描述的。
[0068]
在一些实施例中,一种方法可以包括与瑞美吉泮同时或依序向受试者施用一种或多种额外的药剂。在一些实施例中,额外的药剂可以是抗头痛药物,如本领域己知的示例抗头痛药物(例如,5-ht1激动剂、曲坦类、麦角生物碱类、阿片类、肾上腺素能拮抗剂、nsaid或抗体)。在一些实施例中,与单独使用瑞美吉泮或一种或多种额外的药剂相比,治疗效果可能更大。因此,可以实现瑞美吉泮与一种或多种额外的药剂之间的协同作用。在一些实施例中,一种或多种额外的药剂可以由受试者预防性地服用。
[0069]
除了偏头痛,可以通过本发明的药物组合物和方法治疗的其它cgrp相关病症包含,例如,丛集性头痛;慢性紧张型头痛;慢性疼痛;神经源性炎症和炎性疼痛;眼痛;牙痛;非胰岛素依赖型糖尿病;血管病症;炎症;关节炎;支气管高反应性;哮喘;休克;败血症;阿片戒断综合征;吗啡耐受;男性和女性潮热;过敏性皮炎;牛皮癣;脑炎、脑外伤、缺血、中风、癫痫和神经退行性疾病;皮肤疾病;神经源性皮肤发红、皮肤玫瑰色和红斑;耳鸣;肥胖;炎性肠病;肠易激综合症;和膀胱炎。
[0070]
一方面,本发明还提供了用于本发明方法的试剂盒。试剂盒可以包含一个或多个包括本文所描述的药物组合物和根据本文所描述的任何方法使用的说明书的容器。通常,这些说明书包括根据本文所描述的任何方法施用药物组合物以治疗、改善或预防头痛(如偏头痛)或其它crgp病症的描述。例如,试剂盒可以包括基于鉴定个体是否患有头痛或个体
是否处于患上头痛的风险而选择适于治疗的个体的说明书。说明书通常以包装插页或标签的形式提供,符合将向患者提供药物组合物的管辖区的监管部门的要求。
[0071]
根据本发明,向受试者施用包括瑞美吉泮的药物组合物可以促进降低严重程度(这可以包含减少对通常用于此病状的其它药物和/或疗法的需要和/或所述药物和/或疗法的量(例如,暴露于所述药物和/或疗法),包含例如,用于偏头痛的麦角胺、二氢麦角胺或曲坦类药物)、持续时间和/或频率(包含例如,延迟个体下一次发作或增加到下一次发作的时间)。
[0072]
另外,与不施用治疗相比,向受试者施用包括瑞美吉泮的药物组合物可以促进减轻或改善一种或多种头痛症状,或减少症状的持续时间。
[0073]
另外,向受试者施用包括瑞美吉泮的药物组合物可以促进在特定时间段(例如,每月)内个体头痛发作频率的降低(与治疗前的水平相比)。例如,与治疗前的水平相比,个体的发作频率可以减少至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%中的任一项。
[0074]
另外,向受试者施用包括瑞美吉泮的药物组合物可以有助于头痛发展的延迟,即,推迟、阻碍、减缓、延缓、稳定和/或延迟疾病的进展。这种延迟可以具有不同的时间长度,这取决于疾病的历史和/或正在治疗的个体。
[0075]
另外,向受试者施用包括瑞美吉泮的药物组合物可以延迟头痛的发展或进展,即,延迟最初的临床表现和/或病症的随后进展。头痛的发展可以是可检测到的并且可以使用如本领域所熟知的标准临床技术进行评估。然而,发展还指可能无法检测到的进展。
[0076]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2小时内实现偏头痛疼痛消失的患者的数量增加。例如,在施用时间的2小时内实现偏头痛疼痛消失的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2小时内实现偏头痛疼痛消失的患者的数量可以为约21.2%。
[0077]
施用药物组合物可以在施用时间的2小时内实现偏头痛疼痛消失。例如,药物组合物的施用可以在施用时间的1.9小时内、1.8小时内、1.7小时内、1.6小时内、1.5小时内、1.4小时内、1.3小时内、1.2小时内、1.1小时内、1.0小时内、0.9小时内、0.8小时内、0.7小时内、0.6小时内、0.5小时内、0.4小时内、0.3小时内、0.2小时内或0.1小时内实现偏头痛疼痛消失。
[0078]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2小时内实现最令人烦恼的症状的消失的患者的数量增加。例如,在施用时间的2小时内实现最令人烦恼的症状的消失的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2小时内实现偏头痛疼痛消失的患者的数量可以为约35.1%。最令人烦恼的症状包含畏光、恶心、畏声或其组合。
[0079]
施用药物组合物可以在施用时间的2小时内实现最令人烦恼的症状的消失。例如,药物组合物的施用可以在施用时间的1.9小时内、1.8小时内、1.7小时内、1.6小时内、1.5小时内、1.4小时内、1.3小时内、1.2小时内、1.1小时内、1.0小时内、0.9小时内、0.8小时内、0.7小时内、0.6小时内、0.5小时内、0.4小时内、0.3小时内、0.2小时内或0.1小时内实现最令人烦恼的症状的消失。
[0080]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的90分钟内实现疼痛缓解的患者的数量增加。例如,在施用时间的90分钟内实现疼痛缓解的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的90分钟内实现疼痛缓解的患者的数量可以为约49.6%。
[0081]
施用药物组合物可以在施用时间的90分钟内实现疼痛缓解。例如,药物组合物的施用可以在施用时间的85分钟内、80分钟内、75分钟内、70分钟内、65分钟内、60分钟内、55分钟内、50分钟内、45分钟内、40分钟内、35分钟内、30分钟内、25分钟内、20分钟内、15分钟内、10分钟内或5分钟内实现疼痛缓解。
[0082]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2小时内实现疼痛缓解的患者的数量增加。例如,在施用时间的2小时内实现疼痛缓解的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2小时内实现疼痛缓解的患者的数量可以为约59.3%。
[0083]
施用药物组合物可以在施用时间的2小时内实现疼痛缓解。例如,药物组合物的施用可以在施用时间的1.9小时内、1.8小时内、1.7小时内、1.6小时内、1.5小时内、1.4小时内、1.3小时内、1.2小时内、1.1小时内、1.0小时内、0.9小时内、0.8小时内、0.7小时内、0.6小时内、0.5小时内、0.4小时内、0.3小时内、0.2小时内或0.1小时内实现偏头痛疼痛缓解。
[0084]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2到48小时内实现持续的疼痛缓解的患者的数量增加。例如,在施用时间的2到48小时内实现持续的疼痛缓解的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2到48小时内实现持续的疼痛缓解的患者的数量可以为约42.2%。
[0085]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2到24小时内实现持续的疼痛消失的患者的数量增加。例如,在施用时间的2到24小时内实现持续的疼痛消失的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%
或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2到24小时内实现持续的疼痛消失的患者的数量可以为约15.7%。
[0086]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2到48小时内实现持续的疼痛消失的患者的数量增加。例如,在施用时间的2到48小时内实现持续的疼痛消失的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2到48小时内实现持续的疼痛消失的患者的数量可以为约13.5%。
[0087]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的24小时内实现使用补救药物的患者的数量减少。例如,在施用时间的24小时内使用补救药物的患者的数量可以为约95%或更少、约90%或更少、约85%或更少、约80%或更少、约75%或更少、约70%或更少、约65%或更少、约60%或更少、约55%或更少、约50%或更少、约45%或更少、约40%或更少、约35%或更少、约30%或更少、约25%或更少、约20%或更少、约15%或更少、约10%或更少或约5%或更少。例如,在施用时间的24小时内使用补救药物的患者的数量可以为约14.2%。
[0088]
另外,施用包括瑞美吉泮的药物组合物可以使在施用时间的2小时内报告正常功能的患者的数量增加。例如,在施用时间的2到24小时内报告正常功能的患者的数量可以为约5%或更多、约10%或更多、约15%或更多、约20%或更多、约25%或更多、约30%或更多、约35%或更多、约40%或更多、约45%或更多、约50%或更多、约55%或更多、约60%或更多、约65%或更多、约70%或更多、约75%或更多、约80%或更多、约85%或更多、约90%或更多、约95%或更多或约100%。例如,在施用时间的2小时内报告正常功能的患者的数量可以为约38.1%。
[0089]
施用药物组合物可以在施用时间的2小时内实现报告正常功能。例如,药物组合物的施用可以在施用时间的1.9小时内、1.8小时内、1.7小时内、1.6小时内、1.5小时内、1.4小时内、1.3小时内、1.2小时内、1.1小时内、1.0小时内、0.9小时内、0.8小时内、0.7小时内、0.6小时内、0.5小时内、0.4小时内、0.3小时内、0.2小时内或0.1小时内实现报告正常功能。
[0090]
患者在30天时间段内可能有15次偏头痛或更少。例如,患者在30天时间段内可能有15次偏头痛、14次偏头痛、13次偏头痛、12次偏头痛、11次偏头痛、10次偏头痛、9次偏头痛、8次偏头痛、7次偏头痛、6次偏头痛、5次偏头痛、4次偏头痛、3次偏头痛、2次偏头痛或1次偏头痛。
[0091]
药物组合物可以在30天时间段内向患者施用至多15次。例如,药物组合物可以在30天时间段内向患者施用一次、两次、3次、4次、5次、6次、7次、8次、9次、10次、11次、12次、13次、14次或15次。
[0092]
在一实施例中,口服快速分散型剂型可以含有在化学上被描述为(5s,6s,9r)-4-(2-氧代-2,3-二氢-1h-咪唑并[4,5-b]吡啶-1-基)-1-哌啶甲酸5-氨基-6-(2,3-二氟苯基)-6,7,8,9-四氢-5h-环庚[b]吡啶-9-基酯半硫酸盐倍半水合物的瑞美吉泮半硫酸盐,并且其结构式为:
[0093][0094]
瑞美吉泮半硫酸盐的经验式为c
28h28
f2n6o
3 0.5 h2so
4 1.5 h2o,表示分子量为610.63。瑞美吉泮游离碱的分子量为534.56。瑞美吉泮半硫酸盐的每日剂量可以为约85.65mg。
[0095]
通常,瑞美吉泮可以以所有药学上可接受的盐形式包含在本发明的组合物中。药学上可接受的盐是其中抗衡离子对化合物的生理活性或毒性没有显著贡献并且本身作为药理学等价物起作用的那些。这些盐可以根据常规有机技术使用市售试剂制备。一些阴离子盐形式包含乙酸盐、醋硬脂酸盐、苯磺酸盐、溴化物、氯化物、柠檬酸盐、富马酸盐、葡萄糖醛酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、碘化物、乳酸盐、马来酸盐、甲磺酸盐、硝酸盐、双羟萘酸盐、磷酸盐、琥珀酸盐、硫酸盐、酒石酸盐、甲苯磺酸盐和昔萘酸盐,但不限于此。一些阳离子盐形式包含铵、铝、苄星(benzathine)、铋、钙、胆碱、二乙胺、二乙醇胺、锂、镁、葡甲胺、4-苯基环己胺、哌嗪、钾、钠、氨丁三醇和锌,但不限于此。
[0096]
本发明旨在包含存在于具有式i的化合物中的原子的所有同位素。同位素包含原子序数相同但质量数不同的那些原子。作为一般实例而非限制,氢的同位素包含氘和氚。碳的同位素包含
13
c和
14
c。同位素标记的本发明的化合物通常可以通过本领域技术人员己知的常规技术或通过与本文描述的那些类似的方法,使用适当的同位素标记的试剂代替另外使用的未标记的试剂来制备。此类化合物可以具有多种潜在用途,例如作为测定生物活性的标准品和试剂。在稳定同位素的情况下,此类化合物可能具有有利地改变生物、药理学或药物动力学特性的潜力。
[0097]
治疗活性组分可以包含两种或更多种化合物,其中每一种可以是口服生物可利用的活性药物成分(“api”),例如,抗偏头痛药物。
[0098]
本发明通过以下非限制性实例进一步说明。
[0099]
实例
[0100]
本发明以瑞美吉泮半硫酸盐为例,其是一种微溶于水的白色至灰白色结晶固体。含有瑞美吉泮半硫酸盐的口服快速分散型剂型在下文中称为“nurtec odt”。
[0101]
nurtec odt可能是用于舌下或口腔用途的口腔崩解片,并且可以含有85.65mg瑞美吉泮半硫酸盐,相当于75mg瑞美吉泮游离碱。nurtec odt可以进一步包含以下非活性成分:苯甲醇、桉油精、明胶、柠檬烯、甘露醇、薄荷醇、薄荷酮、乙酸薄荷酯、三氯蔗糖和香草醛。
[0102]
适应症与使用
[0103]
nurtec odt适用于成人有或无先兆偏头痛的急性治疗。nurtec odt不适用于偏头痛的预防性治疗。
[0104]
剂量和施用
[0105]
给药信息
[0106]
nurtec odt的推荐剂量为75mg口服。24小时时间段内的最大剂量为75mg。在30天时间段内治疗超过15次偏头痛的安全性尚未确定。
[0107]
施用信息
[0108]
应按照以下指导服用nurtec odt的患者:
[0109]
·
用干燥的双手打开泡罩包装。
[0110]
·
剥去一个泡罩的铝箔覆盖物,并且轻轻取出口腔崩解片(odt)。不要推动odt穿过铝箔。
[0111]
·
泡罩打开时,取出odt并且放置在舌头上;可替代地,可以将odt放置在舌下。
[0112]
·
odt将在唾液中分解,因此无需额外的液体即可吞咽。
[0113]
·
打开泡罩包装后立即服用odt。不要将odt储存在泡罩包装外以备将来使用。
[0114]
与cyp3a4强或中度抑制剂相伴施用
[0115]
应避免nurtec odt和cyp3a4的强抑制剂的相伴施用。当与cyp3a4的中度抑制剂相伴施用时,还应避免在48小时内的另一剂量的nurtec odt[参见药物相互作用和临床药理学]。
[0116]
与cyp3a强或中度诱导剂相伴施用
[0117]
应避免nurtec odt与cyp3a的强或中度诱导剂的相伴施用,这可能导致nurtec odt功效丧矢[参见药物相互作用和临床药理学]。
[0118]
与p-gp或bcrp的抑制剂相伴施用
[0119]
应避免nurtec odt与p-糖蛋白(p-gp)或乳腺癌耐药蛋白(bcrp)的抑制剂的相伴施用[参见药物相互作用和临床药理学]。
[0120]
剂型和规格
[0121]
nurtec odt可以是口腔崩解片的形式,其可以是白色至灰白色,可以是圆形,并且可以具有凹入符号。每片可以含有75mg瑞美吉泮。
[0122]
禁忌症
[0123]
nurtec odt禁用于对瑞美吉泮、nurtec odt或其任何组分有超敏反应史的患者。然而,已发生迟发性严重超敏反应[参见警告和注意事项]。
[0124]
警告和注意事项
[0125]
超敏反应
[0126]
在临床研究中,nurtec odt曾发生超敏反应,包含呼吸困难和皮疹。超敏反应可以在施用之后数日发生,并且已发生迟发性严重超敏反应。如果发生超敏反应,应停止使用nurtec odt并且启动适当的疗法[参见禁忌症]。
[0127]
不良反应
[0128]
临床上显著的不良反应可以包含超敏反应,这些不良反应在警告和注意事项中进行了讨论。
[0129]
临床试验经验
[0130]
由于临床试验是在广泛不同的条件下进行的,因此在一种药物的临床试验中观察到的不良反应率不能直接与另一种药物的临床试验中的发生率进行比较,并且可能无法反
映在临床实践中观察到的发生率。
[0131]
nurtec odt的安全性已在一项随机、双盲、安慰剂对照试验(研究1)中针对682名接受一次75mg剂量的nurtec odt的偏头痛患者进行了评估[参见临床研究]。大约85%是女性,74%是白人,21%是黑人,并且17%是西班牙裔或拉丁裔。在进入研究时的平均年龄为40岁(年龄范围为18-75岁)。
[0132]
在一项使用不同口服剂型瑞美吉泮的开放标签扩展研究中评估了长期安全性。此研究评估了间断给药至多一年的1,798名患者,包含1,131名患者暴露于75mg瑞美吉泮至少6个月,以及863名患者暴露至少一年,所有这些患者平均每月至少治疗两次偏头痛发作。
[0133]
研究1中最常见的不良反应是恶心(与接受安慰剂的患者中为0.4%相比,接受nurtec odt的患者中为2%)。
[0134]
在接受nurtec odt治疗的患者中,少于1%的患者出现超敏反应,包含呼吸困难和严重皮疹[参见禁忌症和警告和注意事项]。
[0135]
药物相互作用
[0136]
cyp3a4抑制剂
[0137]
nurtec odt与cyp3a4的强抑制剂相伴施用使瑞美吉泮暴露显著增加。避免nurtec odt与cyp3a4的强抑制剂相伴施用[参见临床药理学]。
[0138]
nurtec odt与cyp3a4的中度抑制剂相伴施用可能使瑞美吉泮的暴露增加。当与cyp3a4的中度抑制剂相伴施用时,避免在48小时内的另一剂量的nurtec odt[参见临床药理学]。
[0139]
cyp3a诱导剂
[0140]
nurtec odt与cyp3a的强或中度诱导剂相伴施用可能使瑞美吉泮暴露显著减少,这可能导致nurtec odt功效丧失。避免nurtec odt与cyp3a的强或中度诱导剂相伴施用[参见临床药理学]。
[0141]
转运蛋白
[0142]
瑞美吉泮是p-gp和bcrp外排转运蛋白的底物。nurtec odt与p-gp或bcrp的抑制剂相伴施用可能使瑞美吉泮暴露显著增加[参见临床药理学]。避免nurtec odt与p-gp或bcrp的抑制剂一起使用。
[0143]
在特定人群中使用
[0144]
妊娠期
[0145]
风险总结
[0146]
没有足够的数据表明与孕妇使用nurtec odt相关联的发育风险。在动物研究中,在器官形成期间口服施用瑞美吉泮对大鼠的发育产生不利影响(减少胎儿体重和增加胎儿变异的发生率),其暴露大于临床使用的暴露,并且与母体毒性相关联。在整个妊娠期和哺乳期口服瑞美吉泮后对发育影响的评估是不充分的(参见数据)。
[0147]
在美国普通人群中,临床公认妊娠中重大出生缺陷和流产的估计背景风险分别为2%到4%和15%到20%。患有偏头痛的女性分娩时重大出生缺陷(2.2%到2.9%)和流产(17%)的估计发生率与未患有偏头痛的女性报告的发生率类似。
[0148]
临床考虑
[0149]
疾病相关的孕产妇和/或胚胎/胎儿风险
[0150]
已发表的数据表明,患有偏头痛的女性在妊娠期间患上先兆子痫和妊娠期高血压的风险可能会增加。
[0151]
数据
[0152]
动物数据
[0153]
在器官形成期期间向妊娠的大鼠口服施用瑞美吉泮(0mg/kg/天、10mg/kg/天、60mg/kg/天或300mg/kg/天)使胎儿体重减少,并且使在测试的最高剂量(300mg/kg/天)下胎儿变异的发生率增加,这与母体毒性相关联。无作用剂量(60mg/kg/天)下对胚胎发育产生不良影响的血浆暴露(auc)大约为人类最大推荐人用剂量(mrhd)75mg/天的45倍。
[0154]
在器官形成期期间向妊娠的兔口服施用瑞美吉泮(0mg/kg/天、10mg/kg/天、25mg/kg/天或50mg/kg/天)对胚胎发育没有不良影响。测试的最高剂量(50mg/kg/天)与血浆暴露(auc)相关联,大约是人类mrhd的10倍。
[0155]
对大鼠的产前和产后发育研究,其中在整个妊娠期和哺乳期口服施用瑞美吉泮(0mg/kg/天、10mg/kg/天、25mg/kg/天或60mg/kg/天),不足以评估瑞美吉泮在这些发育期期间的不良反应。
[0156]
哺乳期
[0157]
没有关于人乳汁中存在瑞美吉泮或其代谢物、瑞美吉泮对母乳喂养婴儿的影响或瑞美吉泮对产奶量的影响的数据。没有关于乳汁中瑞美吉泮的排泄的动物数据。母乳喂养对发育和健康的益处应与母亲对nurtec odt的临床需求以及nurtec odt或潜在母亲状况对母乳喂养婴儿的任何潜在不利影响一起考虑。
[0158]
儿科使用
[0159]
nurtec odt在儿科患者中的安全性和有效性尚未确定。
[0160]
老年使用
[0161]
在药代动力学研究中,在老年受试者与年轻受试者之间没有观察到有临床意义的药代动力学差异。nurtec odt的临床研究未包含足够数量的65岁及以上患者以确定其应答是否与较年轻患者的应答不同。
[0162]
肝损伤
[0163]
患有轻度(child-pugh a级)或中度(child-pugh b级)肝损伤的患者无需调整nurtec odt的剂量。患有重度(child-pugh c级)肝损伤的受试者的瑞美吉泮血浆浓度显著更高。应避免在患有重度肝损伤的患者中使用nurtec odt[参见临床药理学]。
[0164]
肾脏损伤
[0165]
患有轻度、中度或重度肾脏损伤的患者无需调整nurtec odt的剂量。nurtec odt尚未在患有晚期肾病的患者和透析患者中进行研究。应避免在晚期肾病(clcr<15毫升/分钟)患者中使用nurtec odt[参见临床药理学]。
[0166]
过剂量
[0167]
nurtec odt过剂量的临床经验有限。对nurtec odt过剂量的治疗应由一般支持措施组成,包含监测生命体征和观察患者的临床状态。没有可用于治疗瑞美吉泮过剂量的特定解毒剂。
[0168]
由于高血清蛋白结合,瑞美吉泮不太可能通过透析显著去除[参见临床药理学]。
[0169]
临床药理学
[0170]
作用机制
[0171]
瑞美吉泮是降钙素基因相关肽受体拮抗剂。
[0172]
药效动力学
[0173]
药效动力学活性与瑞美吉泮发挥其临床作用的机制之间的关系尚不清楚。与向健康志愿者单独施用舒马曲坦(sumatriptan)相比,当瑞美吉泮与舒马曲坦相伴施用(12mg皮下施用,按两次6mg间隔一小时给予)时,未观察到静息血压的临床相关差异。
[0174]
心脏电生理学
[0175]
在4倍于推荐剂量的单剂量下,瑞美吉泮不会将qt间隔延长到任何临床相关程度。
[0176]
药代动力学
[0177]
吸收
[0178]
口服施用nurtec odt后,瑞美吉泮在1.5小时以最大浓度被吸收。瑞美吉泮的绝对口服生物利用度为大约64%。
[0179]
食物的影响
[0180]
在进食条件下与高脂肪餐食一起施用nurtec odt后,t
max
延迟1小时,并且使c
max
降低42%到53%,并且auc减少32%到38%。在临床安全性和功效研究中,在不考虑食物的情况下施用nurtec odt。由于与食物一起施用而减少瑞美吉泮暴露对瑞美吉泮功效的影响尚不清楚。
[0181]
分布
[0182]
瑞美吉泮的稳态分布容积为120l。瑞美吉泮的血浆蛋白结合为大约96%。
[0183]
消除
[0184]
代谢
[0185]
瑞美吉泮主要由cyp3a4代谢,并且在较小程度上由cyp2c9代谢。
[0186]
瑞美吉泮主要以未改变的形式(剂量的约77%)被消除,其中在血浆中未检测到主要代谢物(即,>10%)。
[0187]
排泄
[0188]
在健康受试者中,瑞美吉泮的消除半衰期为大约11小时。向健康男性受试者口服施用[
14
c]-瑞美吉泮后,总放射性的78%在粪便中回收,并且24%在尿液中回收。未改变的瑞美吉泮是排泄的粪便中(42%)和尿液中(51%)的主要单一组分。
[0189]
特定群体
[0190]
肾脏损伤
[0191]
在比较患有轻度(估计肌酐清除率[clcr]60-89毫升/分钟)、中度(clcr 30-59毫升/分钟)和重度(clcr 15-29毫升/分钟)肾脏损伤的受试者与正常受试者(健康匹配对照)中瑞美吉泮的药代动力学的专门的临床研究中,在患有中度肾脏损伤的受试者中,单次75mg剂量后瑞美吉泮的暴露高大约40%。然而,与肾功能正常的受试者(clcr>=90毫升/分钟)相比,患有重度肾脏损伤的受试者的瑞美吉泮暴露没有临床上有意义的差异。nurtec odt尚未在患有晚期肾病的患者中进行研究(clcr<15毫升/分钟)[参见在特定人群中的使用]。
[0192]
肝损伤
[0193]
在比较患有轻度、中度和重度肝损伤的受试者与正常受试者(健康匹配对照)中瑞
美吉泮的药代动力学的专门的临床研究中,在患有重度损伤(child-pugh c级)的受试者中,单次75mg剂量后瑞美吉泮的暴露(c
max
和auc)大约高2倍。与肝功能正常的受试者相比,患有轻度(child-pugha级)和中度肝损伤(child-pugh b级)的受试者的瑞美吉泮暴露没有临床上有意义的差异[参见在特定人群中的使用]。
[0194]
其它特定群体
[0195]
基于年龄、性别、种族/民族、体重或cyp2c9基因型,未观察到瑞美吉泮的药代动力学有临床上显著的差异[参见临床药理学]。
[0196]
药物相互作用研究
[0197]
体外研究
[0198]
·
酶
[0199]
瑞美吉泮是cyp3a4和cyp2c9的底物[参见体内研究]。瑞美吉泮在临床相关浓度下不是cyp1a2、2b6、2c9、2c19、2d6或ugt1a1的抑制剂。然而,瑞美吉泮是具有时间依赖性抑制作用的cyp3a4弱抑制剂。瑞美吉泮在临床相关浓度下不是cyp1a2、cyp2b6或cyp3a4的诱导剂。
[0200]
·
转运蛋白
[0201]
瑞美吉泮是p-gp和bcrp的底物。p-gp或bcrp的抑制剂的相伴施用可能会增加瑞美吉泮的暴露[参见药物相互作用]。没有进行专门的药物相互作用研究来评估它们对瑞美吉泮的药代动力学的影响。
[0202]
瑞美吉泮不是oatp1b1或oatp1b3的底物。考虑到其低肾清除率,瑞美吉泮未被评估为oat1、oat3、oct2、mate1或mate2-k的底物。
[0203]
瑞美吉泮在临床相关浓度下不是p-gp、bcrp、oat1或mate2-k的抑制剂。它是oatp1b1和oat3的弱抑制剂。瑞美吉泮是oatp1b3、oct2和mate1的抑制剂。预计nurtec odt与这些转运蛋白在临床相关浓度下不会发生临床药物相互作用。
[0204]
体内研究
[0205]
cyp3a4抑制剂
[0206]
在专门的药物相互作用研究中,75mg瑞美吉泮(单剂量)与处于稳态的cyp3a4强抑制剂伊曲康唑(itraconazole)的相伴施用使瑞美吉泮的暴露增加(auc增加4倍,并且c
max
增加约1.5倍)[参见药物相互作用]。没有进行专门的药物相互作用研究来评估cyp3a4弱抑制剂的相伴施用对瑞美吉泮的药代动力学的影响。瑞美吉泮与cyp3a4中度抑制剂相伴施用可能会使瑞美吉泮暴露(auc)增加不到2倍[参见药物相互作用]。预计瑞美吉泮与cyp3a4弱抑制剂相伴施用不会对瑞美吉泮暴露产生临床上显著的影响。
[0207]
cyp3a诱导剂
[0208]
在专门的药物相互作用研究中,75mg瑞美吉泮(单剂量)与处于稳态的cyp3a4强诱导剂利福平(rifampin)的相伴施用使瑞美吉泮的暴露减少(auc减少80%,并且c
max
减少64%),这可能导致功效丧失[参见药物相互作用]。没有进行专门的药物相互作用研究来评估cyp3a4的中度或弱诱导剂的相伴施用对瑞美吉泮的药代动力学的影响。由于瑞美吉泮是cyp3a4的中度敏感底物,因此作为cyp3a4的中度诱导剂的药物也可以使瑞美吉泮暴露显著减少,从而使功效丧失[参见药物相互作用]。预计cyp3a4的弱诱导剂和瑞美吉泮的相伴施用不会产生临床上显著的相互作用。
[0209]
cyp2c9抑制剂
[0210]
在专门的药物相互作用研究中,75mg瑞美吉泮(单剂量)与联合cyp3a4和cyp2c9中度抑制剂氟康唑(fluconazole)的相伴施用使瑞美吉泮的暴露增加(auc增加1.8倍),其中对c
max
没有相关影响。瑞美吉泮主要由cyp3a4代谢,并且在较小程度上由cyp2c9代谢。瑞美吉泮暴露的增加可以归因于cyp2c9和cyp3a4的联合抑制与氟康唑施用,这表明cyp2c9的贡献很小。因此,预计单独的cyp2c9抑制不会显著影响瑞美吉泮暴露。
[0211]
其它药物
[0212]
当瑞美吉泮与口服避孕药(诺孕曲明(norelgestromin)、乙炔雌二醇)、咪达唑仑(midazolam)(一种敏感的cy3a4底物)或舒马曲坦相伴施用时,未观察到显著的药代动力学相互作用[参见临床药理学]。
[0213]
药物基因组学
[0214]
具有如cyp2c9*2和cyp2c9*3等位基因等遗传变体的个体的cyp2c9活性降低。与正常代谢者(即,*1/*1,n=72)相比,cyp2c9中间代谢者(即,*1/*2,*2/*2,*1/*3,n=43)中的瑞美吉泮c
max
和auc
0-inf
类似。无法从cyp2c9弱代谢者(即,*2/*3)中获得足够的pk数据。由于cyp2c9对瑞美吉泮代谢的贡献被认为是次要的,预计cyp2c9多态性不会显著影响其暴露。
[0215]
非临床毒理学
[0216]
癌变、诱变、生育力损伤
[0217]
癌变
[0218]
向tg.rash2小鼠口服施用瑞美吉泮(0mg/k/天、10mg/k/天、100mg/k/天或300mg/k/天)持续26周,并且向大鼠口服施用瑞美吉泮(0mg/k/天、5mg/k/天、20mg/k/天或45mg/kg/天)持续91-100周,结果是没有证据表明在这两个物种中存在药物诱导的肿瘤。在大鼠中,测试的最高剂量(45mg/kg/天)的血浆暴露(auc)是人类中最大推荐人用剂量(mrhd)75mg/天的大约30倍。
[0219]
诱变
[0220]
瑞美吉泮在体外(细菌反向突变、中国仓鼠卵巢细胞中染色体畸变)和体内(大鼠微核)测定中均为阴性。
[0221]
生育力损伤
[0222]
在交配前和交配期间向雄性和雌性大鼠口服施用瑞美吉泮(0mg/kg/天、30mg/kg/天、60mg/kg/天或150mg/kg/天)并且在雌性大鼠中持续到妊娠日(gd)第7天使在所有剂量下均有子宫萎缩,并且在测试的最高剂量下生育力降低。在测试较低剂量(0mg/kg/天、5mg/kg/天、15mg/kg/天或25mg/kg/天)的第二项生育力研究中,未观察到对生育力、子宫组织病理学或早期胚胎发育的不良影响。针对大鼠生育力和早期胚胎发育损伤的无作用剂量(25mg/kg/天)与血浆药物暴露(auc)相关联,大约是人类mrhd的15倍。
[0223]
临床研究
[0224]
在以下随机、双盲、安慰剂对照试验中证明了nurtec odt对于成人有先兆和无先兆偏头痛的急性治疗的功效:研究1(nct03461757)。此研究将患者随机分配到75mg nurtec odt(n=732)或安慰剂(n=734)。患者被指示治疗中度至重度头痛疼痛强度的偏头痛。在初始治疗之后2小时允许使用补救药物(即,nsaid、对乙酰氨基酚和/或止吐剂)。初始治疗的48小时内不允许使用其它形式的补救药物,如曲坦类。大约14%的患者在基线状态下正在
服用预防偏头痛的药物。研究1中的患者均未相伴服用作用于cgrp途径的预防性药物。
[0225]
主要功效分析是在被治疗中度至重度疼痛偏头痛的患者中进行的。与安慰剂相比,nurtec odt 75mg在给药之后两小时表现出对疼痛消失和最令人烦恼的症状(mbs)的消失的影响。疼痛消失被定义为中度或重度头痛减轻至无头痛,并且mbs消失被定义为不存在自我鉴定的mbs(即,畏光、畏声或恶心)。在选择mbs的患者中,最常选择的症状是畏光(54%),其次是恶心(28%)和畏声(15%)。
[0226]
在研究1中,与接受安慰剂的患者相比,在接受nurtec odt的患者中,在单剂量之后两小时实现头痛疼痛消失和mbs消失的患者的百分比在统计学上显著更高(表1)。
[0227]
表1:研究1的偏头痛功效终点
[0228][0229]
*n=应答者数量/n=此治疗组中的患者数量
[0230]
图1呈现了研究1中治疗后2小时内实现偏头痛疼痛消失的患者的百分比。
[0231]
在研究1中,nurtec odt与安慰剂相比的统计学显著效果在2小时疼痛缓解、2-48小时持续的疼痛消失、24小时内使用补救药物以及给药后两小时报告正常功能的患者的百分比等额外的功效终点方面得到证实(表2)。疼痛缓解被定义为偏头痛疼痛从中度或重度严重程度降低到轻度或无。给药后两小时报告正常功能的患者的百分比的测量结果来自单项问卷,所述问卷要求患者在4点量表上选择一个应答:正常功能、轻度损伤、重度损伤或需要卧床休息。
[0232]
表2.研究1中额外的偏头痛功效终点
[0233][0234]
*n=应答者数量/n=此治疗组中的患者数量
[0235]
**此分析仅包含在给药后24小时内使用nsaid、对乙酰氨基酚或止吐剂;不允许使用曲坦类或其它急性偏头痛药物。
[0236]
与安慰剂相比,施用nurtec odt 75mg后,畏光和畏声的发生率降低。
[0237]
如何供应/储存和处理
[0238]
如何供应
[0239]
nurtec odt 75mg可以呈口腔崩解片的形式,其可以是白色至灰白色,可以是圆形,可以具有凹入符号并且可以以含有8片口腔崩解片的泡罩包装的纸盒的形式供应。每片odt可以含有75mg瑞美吉泮。
[0240]
ndc:72618-3000-2
[0241]
储存和处理
[0242]
nurtec odt在20℃到25℃(68
°
f到77
°
f)的受控室温下储存;其中允许在15℃到30℃(59
°
f到86
°
f)之间偏移[参见usp受控室温]。
[0243]
患者咨询信息
[0244]
应建议患者阅读fda批准的患者标签(患者信息)。
[0245]
口腔崩解片包装的处理
[0246]
应指示患者在准备好使用外部铝袋内的口腔崩解片之前,不要从所述外部铝袋中取出泡罩[参见剂量与施用]。
[0247]
超敏反应
[0248]
应告知患者关于超敏反应的体征和症状,并且这些反应可能在nurtec odt施用后数天发生。应建议患者如果发生超敏反应的体征或症状,那么立即联系其医疗保健提供者
[参见警告和注意事项]。
[0249]
处方信息要点
[0250]
适应症和使用。nurtec odt是适用于成人有或无先兆偏头痛的急性治疗的降钙素基因相关肽受体拮抗剂。nurtec odt不适用于偏头痛的预防性治疗。
[0251]
剂量和施用。根据需要,推荐剂量为口服75mg。24小时时间段内的最大剂量为75mg。在30天时间段内治疗超过15次偏头痛的安全性尚未确定。
[0252]
剂型和强度。nurtec odt口腔崩解片:75mg。
[0253]
禁忌症。对瑞美吉泮、nurtec odt或对其任何组分有超敏反应史的患者。
[0254]
警告和注意事项。超敏反应:如果发生严重的超敏反应,那么停止nurtec odt并且启动适当的疗法。严重的超敏反应已包含呼吸困难和皮疹,并且可能在施用后数天发生。
[0255]
不良反应。在用nurtec odt治疗的患者中,≥1%的患者报告的不良反应是恶心。
[0256]
药物相互作用。
[0257]
·
cyp3a4强抑制剂:避免相伴施用。
[0258]
·
cyp3a4中度抑制剂:与cyp3a4中度抑制剂一起施用时,避免在48小时内的另一剂量。
[0259]
·
cyp3a强和中等诱导剂:避免相伴施用。
[0260]
·
p-gp或bcrp的抑制剂:避免相伴施用。
[0261]
在特定人群中的使用。患有严重肝损伤的受试者中的暴露显著更高。避免在患有严重肝损伤(child-pugh c级)的患者中使用。
[0262]
在本技术中,各种出版物以作者名称和日期,或以专利号或专利公开号引用。这些出版物的公开内容在此通过引用整体并入本技术,以便更充分地描述本领域技术人员在本文描述和要求保护的本发明之日起已知的现有技术。然而,本文引用的参考文献不应被解释为承认这种参考文献是本发明的现有技术。
[0263]
本领域技术人员将认识到或能够仅使用常规实验就确定本文所述的具体程序的许多等同物。这些等同物被认为是在本发明的范围内,并且被所附权利要求所覆盖。例如,可以使用不同于本文说明书和实施例中具体公开的那些的药学上可接受的盐。此外,项目列表中的特定项目或更大项目组中的项目子集组可以与其它特定项目、项目子集组或更大项目组组合,而不管本文是否存在标识这种组合的特定公开。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。