1.本公开属于生物技术和基因工程技术领域,具体涉及一种具有启动子活性的多核苷酸,包含具有启动子活性的多核苷酸的转录表达盒、重组表达载体、重组宿主细胞,以及调控目标基因转录的方法、制备蛋白的方法和生产目标化合物的方法。
背景技术:
2.微生物发酵法可以生产多种目标化合物,如氨基酸、有机酸、生物基材料、药物化合物等等,这些目标化合物可广泛应用于医药、健康、食品、动物饲料和化妆品等领域,具有巨大的经济价值。近年来,随着对氨基酸、有机酸、生物基材料、原料药物等市场需求的不断增加,如何提高目标化合物的产量,实现对目标化合物的工业化大规模生产,是当前亟需解决的重要问题。
3.选育高产的发酵微生物是提高目标化合物工业化产量的重要手段,与传统诱变育种的技术相比,基因工程选育技术具有针对性强、稳定性高以及效率高等优势。通过基因工程的方法对微生物代谢途径中的关键基因进行改造,是提高目标化合物的发酵产量的重要方法。影响基因表达的因素包括启动子的活性、基因翻译效率、基因拷贝数等。然而,基因拷贝数的增加会降低菌种基因组的稳定性,与此相比,通过提高启动子活性以提高基因的表达效率成为对关键基因进行改造的重要手段。
4.鉴定强启动子或组成型启动子可为发酵微生物的基因工程育种提供高效的基因表达元件。其中,强启动子对转录酶具有较高的亲和力,可以高效启动目标基因的转录。组成型启动子就是不需要任何诱导物,即可持续性表达目的蛋白。利用强启动子或组成型启动子对代谢途径中的关键基因进行改造,可有效增加关键基因的表达水平,增加代谢流量。
5.因此,开发具有高活性的强启动子或组成型启动子,以增强目标化合物合成途径关键基因的表达,提高目标化合物的产量,提升工业化应用的潜能,是微生物发酵领域亟需解决的重要问题。
技术实现要素:
6.发明要解决的问题
7.鉴于现有技术中存在的技术问题,例如,需要开发更多具有高活性的强启动子或组成型启动子,以提高目标化合物合成途径中关键基因的表达。为此,本公开提供了一种具有启动子活性的多核苷酸,为包含如seq id no:2-4任一项所示序列的多核苷酸的突变体,与野生型启动子相比,本公开提供的突变体的启动子活性显著提高,且不再受到诱导剂的诱导作用,是一种新型的强组成型启动子。将突变体与目标基因可操作性的连接,可有效提高目标基因的表达,进而可实现在保持基因组稳定性的条件下有效提高目标化合物的产量。
8.用于解决问题的方案
9.本公开提供了一种具有启动子活性的多核苷酸,其中,所述多核苷酸选自如下
(i)-(vi)组成的组中的任一项:
10.(i)包含如seq id no:2所示序列的多核苷酸的突变体,所述突变体在seq id no:2所示序列的第204-211位中的一个或多个位置处具有突变的核苷酸;所述突变体的活性高于包含如seq id no:2所示序列的多核苷酸的启动子活性,且所述突变体在seq id no:2所示序列的第204-211位中的核苷酸序列不为ccacaatg;
11.(ii)包含如seq id no:3所示序列的多核苷酸的突变体,所述突变体在seq id no:3所示序列的第164-171位中的一个或多个位置处具有突变的核苷酸;所述突变体的活性高于包含如seq id no:3所示序列的多核苷酸的启动子活性,且所述突变体在seq id no:3所示序列的第164-171位中的核苷酸序列不为ccacaatg;
12.(iii)包含如seq id no:4所示序列的多核苷酸的突变体,所述突变体在seq id no:4所示序列的第106-113位中的一个或多个位置处具有突变的核苷酸;所述突变体的活性高于包含如seq id no:4所示序列的多核苷酸的启动子活性,且所述突变体在seq id no:4所示序列的第106-113位中的核苷酸序列不为ccacaatg;
13.(iv)包含与(i)至(iii)中任一项所示的核苷酸序列的反向互补序列的多核苷酸;
14.(v)包含在高严格性杂交条件或非常高严格性杂交条件下,能够与(i)至(iii)中任一项所示的核苷酸序列杂交的序列的反向互补序列的多核苷酸;
15.(vi)包含与(i)至(iii)中任一项所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%序列同一性的序列的多核苷酸。
16.在一些实施方式中,根据本公开所述的具有启动子活性的多核苷酸,其中,所述突变体与包含如seq id no:2-4所示序列的多核苷酸相比,具有5-13倍以上提高的启动子活性。
17.在一些实施方式中,根据本公开所述的具有启动子活性的多核苷酸,其中,所述突变体对应seq id no:2所示序列的第204-211位,或对应seq id no:3所示序列的第164-171位,或对应seq id no:4所示序列的第106-113位核苷酸序列选自如下(p1)-(p
18
)组成的组中的任一项:
18.(p1)actgtagg,
19.(p2)tattatgg,
20.(p3)aattgggg,
21.(p4)tatggttg,
22.(p5)tagggtag,
23.(p6)aatggaat,
24.(p7)tagacttc,
25.(p8)aatgggta,
26.(p9)taccatta,
27.(p
10
)actgaggg,
28.(p
11
)actagaag,
29.(p
12
)aattagtg,
30.(p
13
)aatagggt,
31.(p
14
)tagtattg,
32.(p
15
)actggact,
33.(p
16
)taacatgg,
34.(p
17
)actagggg,
35.(p
18
)tataagtt。
36.在一些实施方式中,根据本公开所述的具有启动子活性的多核苷酸,其中,所述突变体的核苷酸序列选自如seq id no:5-22任一项所示的序列。
37.本公开提供了一种转录表达盒,其中,所述转录表达盒包含根据本公开所述的具有启动子活性的多核苷酸;可选地,所述转录表达盒还含有目标基因,所述目标基因与所述具有启动子活性的多核苷酸可操作地连接;优选地,所述目标基因为蛋白编码基因。
38.本公开提供了一种重组表达载体,其中,所述重组表达载体包含根据本公开所述的具有启动子活性的多核苷酸,或根据本公开所述的转录表达盒。
39.本公开提供了一种重组宿主细胞,其中,所述重组宿主细胞包含根据本公开所述的转录表达盒,或根据本公开所述的重组表达载体。
40.在一些实施方式中,根据本公开所述的重组宿主细胞,其中,所述宿主细胞来源于棒状杆菌属、短杆菌属、节杆菌属、微杆菌属或埃希氏菌属;优选地,所述宿主细胞为谷氨酸棒杆菌或大肠杆菌;更优选地,所述宿主细胞为谷氨酸棒杆菌atcc 13032、谷氨酸棒杆菌atcc 13869或谷氨酸棒杆菌atcc 14067。
41.本公开提供了一种根据本公开所述的具有启动子活性的多核苷酸,根据本公开所述的转录表达盒,根据本公开所述的重组表达载体,根据本公开所述的重组宿主细胞在如下至少一种中的用途:
42.(a)调控基因的转录水平,或制备用于调控基因的转录水平的试剂或试剂盒;
43.(b)制备蛋白,或制备用于制备蛋白的试剂或试剂盒;
44.(c)生产目标化合物,或制备用于生产目标化合物的试剂或试剂盒。
45.在一些实施方式中,根据本公开所述的用途,其中,所述蛋白选自基因表达调控蛋白或与目标化合物合成相关的蛋白。
46.在一些实施方式中,根据本公开所述的用途,其中,所述目标化合物包括氨基酸、有机酸中的至少一种;可选地,所述氨基酸包括脯氨酸、赖氨酸、谷氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、半胱氨酸、谷氨酰胺、甲硫氨酸、天冬氨酸、天冬酰胺、精氨酸、组氨酸、苯丙氨酸、酪氨酸、色氨酸中的至少一种,所述有机酸包括柠檬酸、琥珀酸、乳酸、醋酸、丁酸、棕榈酸、草酸、酒石酸、丙酸、己烯酸、癸酸、辛酸、戊酸、苹果酸中的至少一种。
47.本公开提供了一种调控目标基因转录的方法,其中,所述方法包括将根据本公开所述的具有启动子活性的多核苷酸与目标基因可操作地连接的步骤。
48.本公开提供了一种制备蛋白的方法,其中,所述方法包括利用根据本公开所述的转录表达盒,根据本公开所述的重组表达载体,或根据本公开所述的重组宿主细胞表达所述蛋白的步骤;可选地,所述蛋白为与目标化合物合成相关的蛋白或基因表达调控蛋白;
49.任选地,所述方法还包括分离或纯化所述蛋白的步骤。
50.本公开提供了一种生产目标化合物的方法,其中,所述方法包括利用根据本公开所述的转录表达盒,根据本公开所述的重组表达载体,或根据本公开所述的重组宿主细胞
表达与目标化合物合成相关的蛋白或基因表达调控蛋白,在所述与目标化合物合成相关的蛋白或所述基因表达调控蛋白存在的环境下生产目标化合物的步骤;
51.可选地,所述目标化合物包括氨基酸、有机酸中的至少一种;可选地,所述氨基酸包括赖氨酸、谷氨酸、苏氨酸、脯氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、半胱氨酸、谷氨酰胺、甲硫氨酸、天冬氨酸、天冬酰胺、精氨酸、组氨酸、苯丙氨酸、酪氨酸、色氨酸中的至少一种,所述有机酸包括柠檬酸、琥珀酸、乳酸、醋酸、丁酸、棕榈酸、草酸、酒石酸、丙酸、己烯酸、癸酸、辛酸、戊酸、苹果酸中的至少一种;
52.可选地,所述与目标化合物合成相关的蛋白为与l-氨基酸合成相关的蛋白;可选地,所与l-氨基酸合成相关的蛋白包括丙酮酸羧化酶、磷酸烯醇式丙酮酸羧化酶、γ-谷氨酰激酶、谷氨酸半醛脱氢酶、吡咯啉-5-羧酸还原酶、氨基酸运输蛋白、ptsg系统、丙酮酸脱氢酶、高丝氨酸脱氢酶、草酰乙酸脱羧酶、葡萄糖酸阻遏蛋白、葡萄糖脱氢酶、天冬氨酸激酶、天冬氨酸半醛脱氢酶、天冬氨酸氨裂合酶、二氢吡啶二羧酸合成酶、二氢吡啶甲酸还原酶、琥珀酰二氨基庚二酸氨基转移酶、四氢吡啶二羧酸酯琥珀酰酶、琥珀酰二氨基庚二酸脱酰基酶、二氨基庚二酸差向异构酶、二氨基庚二酸脱酰基酶、甘油醛-3-磷酸脱氢酶、转酮酶、二氨基庚二酸脱氢酶和丙酮酸羧化酶中的一种或两种以上的组合;
53.任选地,所述方法还包括分离或纯化所述目标化合物的步骤。
54.发明的效果
55.在一些实施方式中,本公开提供的具有启动子活性的多核苷酸,为包含如seq id no:2-4任一项所示序列的多核苷酸的突变体,与包含如seq id no:2-4所示序列的野生型启动子相比,突变体的启动子活性显著提高。将突变体与目标基因可操作地连接后,可以显著提高目标基因的表达效率,且不需要任何诱导条件即能实现目标基因的稳定、高效表达,为目标化合物合成途径中关键基因的改造提供了一种极具应用潜力的表达元件。将突变体应用于目标化合物的生产中,可以显著提高目标化合物的转化率,为氨基酸、有机酸等目标化合物的工业发酵提供了一种极具应用潜力的强组成型的启动子。
56.在一些实施方式中,本公开提供的具有启动子活性的多核苷酸,其启动子活性与野生型的启动子相比,具有5-13倍以上提高的启动子活性,且本公开中突变体的启动子活性高于谷氨酸棒杆菌内源强启动子tuf的启动子活性。
57.在一些更为具体的实施方式中,本公开提供的具有启动子活性的多核苷酸,其启动子活性与野生型的启动子相比,具有5.89-12.61倍提高的启动子活性。
58.在一些实施方式中,本公开提供了转录表达盒、重组表达载体、重组宿主细胞,包含上述具有启动子活性的多核苷酸。在转录表达盒、重组表达载体、重组宿主细胞中,具有启动子活性的多核苷酸与目标基因可操作地连接,能够实现目标化合物合成途径中关键基因的高效表达。
59.在一些实施方式中,本公开提供了制备蛋白的方法,能够提高与氨基酸、有机酸等合成相关的蛋白或基因表达调控蛋白的表达量,进而实现目标化合物的高效生产。
60.在一些实施方式中,本公开提供了生产目标化合物的方法,利用上述具有启动子活性的多核苷酸,能够提高与目标化合物合成相关的蛋白的表达效率,从而稳定、高效的生产目标化合物,实现对目标化合物的大规模工业化生产。
附图说明
61.图1示出了不同长度ncgl1418启动子的活性比较结果。
具体实施方式
62.当在权利要求和/或说明书中与术语“包含”联用时,词语“一(a)”或“一(an)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
63.如在权利要求和说明书中所使用的,词语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
64.在整个申请文件中,术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
65.虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
66.当用于权利要求书或说明书时,选择/可选/优选的“数值范围”既包括范围两端的数值端点,也包括相对于前述数值端点而言,所述数值端点中间所覆盖的所有自然数。
67.如本公开所使用的,术语“多核苷酸”指由核苷酸组成的聚合物。多核苷酸可以是单独片段的形式,也可以是更大的核苷酸序列结构的一个组成部分,其是从至少在数量或浓度上分离一次的核苷酸序列衍生而来的,能够通过标准分子生物学方法(例如,使用克隆载体)识别、操纵以及恢复序列及其组分核苷酸序列。当一个核苷酸序列通过一个dna序列(即a、t、g、c)表示时,这也包括一个rna序列(即a、u、g、c),其中“u”取代“t”。换句话说,“多核苷酸”指从其他核苷酸(单独的片段或整个片段)中去除的核苷酸聚合物,或者可以是一个较大核苷酸结构的组成部分或成分,如表达载体或多顺反子序列。多核苷酸包括dna、rna和cdna序列。
68.如本公开所使用的,术语“野生型的”指在自然界中可以找到的对象。例如,一种存在于生物体中,可以从自然界的一个来源中分离出来并且在实验室中没有被人类有意修改的多肽或多核苷酸序列是天然存在的。如本公开所用的,“天然存在的”和“野生型的”是同义词。在一些实施方式中,本公开中野生型的启动子是指野生型ncgl1418基因的启动子,也即如seq id no:2所示序列的多核苷酸。
69.如本公开所使用的,术语“突变体”是指相对于“野生型”,或者“相比较的”多核苷酸或多肽,在一个或多个(例如,若干个)位置处包含改变(即,取代、插入和/或缺的多核苷酸,其中,取代是指用不同的核苷酸置换占用一个位置的核苷酸。缺失是指去除占据某一位置的核苷酸。插入是指在邻接并且紧随占据位置的核苷酸之后添加核苷酸。
70.在一些实施方式中,本公开的“突变”为“取代”,是由一个或多个核苷酸中的碱基被另一个不同的碱基取代所引起的突变,也称为碱基置换突变(subsititution)或点突变(point mutation)。
71.具体来说,seq id no:1所示的序列是ncgl1418基因启动子的核心区序列,包括-35区和-10区主要序列。本公开中的突变体是在-10区位置处引入突变的核苷酸,并且发现在上述位置处引入突变后,突变体的启动子活性明显增强,得到了一种新型的强组成型启动子,且启动子活性高于谷氨酸棒杆菌内源强启动子tuf的启动子活性。
72.在一些实施方式中,包含如seq id no:2所示序列的多核苷酸的突变体,是指包含
如seq id no:2所示序列的多核苷酸的突变体,所述突变体在seq id no:2所示序列的第204-211位中的一个或多个位置处具有突变的核苷酸,且不包含seq id no:2所示序列的第204-211位突变为ccacaatg的多核苷酸。与包含seq id no:2所示序列的多核苷酸相比,突变体具有提高的启动子活性。
73.在一些实施方式中,包含如seq id no:3所示序列的多核苷酸的突变体,是指包含如seq id no:3所示序列的多核苷酸的突变体,所述突变体在seq id no:3所示序列的第164-171位中的一个或多个位置处具有突变的核苷酸,且不包含seq id no:3所示序列的第164-171位突变为ccacaatg的多核苷酸。与包含seq id no:3所示序列的多核苷酸相比,突变体具有提高的启动子活性。
74.在一些实施方式中,包含如seq id no:4所示序列的多核苷酸的突变体,是指包含如seq id no:4所示序列的多核苷酸的突变体,所述突变体在seq id no:4所示序列的第106-113位中的一个或多个位置处具有突变的核苷酸,且不包含seq id no:4所示序列的第106-113位突变为ccacaatg的多核苷酸。与包含seq id no:4所示序列的多核苷酸相比,突变体具有提高的启动子活性。
75.在一些实施方式中,本公开中包含seq id no:2所示序列的多核苷酸的突变体,与包含seq id no:2所示序列的多核苷酸相比,具有5-13倍以上提高的启动子活性。
76.进一步的,突变体与包含seq id no:2所示序列的多核苷酸相比,具有8.31、12.18、8.93、8.07、7.63、10.31、5.89、5.92、6.49、7.66、8.63、8.41、10.21、9.52、9.91、8.52、12.61、9.16倍的增强启动子活性。
77.如本公开所使用的,术语“启动子”是指一种核酸分子,通常位于目标基因编码序列的上游,为rna聚合酶提供识别位点,并位于mrna转录起始位点的5’方向的上游。它是不被翻译的核酸序列,rna聚合酶与这一核酸序列结合后启动目标基因的转录。在核糖核酸(rna)的合成中,启动子可以和调控基因转录的转录因子产生相互作用,控制基因表达(转录)的起始时间和表达的程度,包含核心启动子区域和调控区域,就像“开关”,决定基因的活动,继而控制细胞开始生产哪一种蛋白质。
78.如本公开所使用的,术语“启动子核心区”是指位于原核生物启动子区的一段核酸序列,是发挥启动子功能的核心序列区,主要包括-35区、-10区、-35区和-10区之间的区域以及转录起始位点,-35区是rna聚合酶的识别位点,-10区是rna聚合酶的结合位点。在一些实施方式中,本公开的具有启动子活性的多核苷酸,是包含ncgl1418基因的启动子核心区,且在启动子核心区的-10区引入突变的突变体,以获得相比ncgl1418基因的启动子明显提高的启动子活性。
79.如本公开所使用的,术语“序列同一性”和“同一性百分比”指两个或更多个多核苷酸或多肽之间相同(即同一)的核苷酸或氨基酸的百分比。两个或更多个多核苷酸或多肽之间的序列同一性可通过以下方法测定:将多核苷酸或多肽的核苷酸或氨基酸序列对准且对经对准的多核苷酸或多肽中含有相同核苷酸或氨基酸残基的位置数目进行评分,且将其与经对准的多核苷酸或多肽中含有不同核苷酸或氨基酸残基的位置数目进行比较。多核苷酸可例如通过含有不同核苷酸(即取代或突变)或缺失核苷酸(即一个或两个多核苷酸中的核苷酸插入或核苷酸缺失)而在一个位置处不同。多肽可例如通过含有不同氨基酸(即取代或突变)或缺失氨基酸(即一个或两个多肽中的氨基酸插入或氨基酸缺失)而在一个位置处不
同。序列同一性可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中氨基酸残基的总数来计算。举例而言,可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中核苷酸或氨基酸残基的总数且乘以100来计算同一性百分比。
80.在一些实施方式中,当使用序列比较算法或通过目视检查测量以最大的对应性进行比较和比对时,两个或多个序列或子序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%核苷酸的“序列同一性”或“同一性百分比”。在某些实施方案中,所述序列在任一或两个相比较的生物聚合物(例如,多核苷酸)的整个长度上基本相同。
81.如本公开所使用的,术语“互补的”是指在核苷酸或核苷酸之间的杂交或碱基配对,例如双链dna分子的两条链之间或者寡核苷酸引物与被测序或扩增的单链核苷酸上的引物结合位点之间等。
82.如本公开所使用的,术语“高严格条件”是指,对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃处在5x sspe(saline sodium phosphate edta)、0.3%sds、200微克/ml剪切并变性的鲑精dna和50%甲酰胺中预杂交和杂交12至24小时。最后在65℃处使用2x ssc、0.2%sds将载体材料洗涤三次,每次15分钟。
83.如本公开所使用的,术语“非常高严格条件”是指,对于长度为至少100个核苷酸的探针而言,遵循标准dna印迹程序,在42℃处在5x sspe(saline sodium phosphate edta)、0.3%sds、200微克/ml剪切并变性的鲑精dna和50%甲酰胺中预杂交和杂交12至24小时。最后在70℃处使用2x ssc、0.2%sds将载体材料洗涤三次,每次15分钟。
84.在一些具体的实施方案中,本公开中的具有启动子活性的多核苷酸能够用于起始蛋白编码基因的表达。在另外一些实施方案中,本公开中的具有启动子活性的多核苷酸能够用于起始非编码基因的表达。
85.如本公开所使用的,术语“表达”包括涉及rna产生及蛋白产生的任何步骤,包括但不限于:转录、转录后修饰、翻译、翻译后修饰和分泌。
86.如本公开所使用的,术语“转录表达盒”是包含具有启动子活性的多核苷酸的重组表达元件。在一些实施方式中,具有启动子活性的多核苷酸为包含如seq id no:2所示序列的第204-211位核苷酸的多核苷酸的突变体。在一些实施方式中,具有启动子活性的多核苷酸为包含如seq id no:3所示序列的第164-171位核苷酸的多核苷酸的突变体。在一些实施方式中,具有启动子活性的多核苷酸为包含如seq id no:4所示序列的第106-113位核苷酸的多核苷酸的突变体。在一些更为具体的实施方式中,转录表达盒中包括与突变体可操作地连接的目标基因,利用本公开中启动子活性提高的突变体对目标基因的表达进行调控。在一些实施方式中,对目标基因进行调控的转录调控元件除了具有启动子活性的突变体,还可以包含增强子、沉默子、绝缘子等元件。在一些实施方式中,本公开中目标基因具体为蛋白编码基因。目标基因与具有启动子活性的多核苷酸“可操作地连接”,是指将具有启动子活性的多核苷酸与目标基因功能性连接,以启动和介导目标基因的转录,所述可操作地连接的方式可以采用本领域技术人员所述的任何方式。
87.如本公开所使用的,术语“载体”指的是dna构建体,其含有与合适的控制序列可操作地连接的dna序列,从而在合适的宿主中表达目标基因。“重组表达载体”指用于表达例如编码所需多肽的多核苷酸的dna结构。重组表达载体可包括,例如包含i)对基因表达具有调
控作用的遗传元素的集合,例如启动子和增强子;ii)转录成mrna并翻译成蛋白质的结构或编码序列;以及iii)适当的转录和翻译起始和终止序列的转录亚单位。重组表达载体以任何合适的方式构建。载体的性质并不重要,并可以使用任何载体,包括质粒、病毒、噬菌体和转座子。用于本公开的可能载体包括但不限于染色体、非染色体和合成dna序列,例如细菌质粒、噬菌体dna、酵母质粒以及从质粒和噬菌体dna的组合中衍生的载体,来自如牛痘、腺病毒、鸡痘、杆状病毒、sv40和伪狂犬病等病毒的dna。在本公开中,“重组表达载体”与“重组载体”可以互换地使用。
88.如本公开所使用的,术语“目标基因”涉及与本公开中具有启动子活性的多核苷酸连接,以对其转录水平进行调控的任一种的基因。
89.在一些实施方案中,目标基因是指编码微生物中目标蛋白质的基因。示例性的,目标基因是编码与目标化合物的生物合成相关的酶的基因、编码与还原力相关的酶的基因,编码与糖酵解或tca循环相关的酶的基因,或编码与目标化合物的释放相关的酶的基因等等。
90.如本公开所使用的,术语“目标化合物”可以选自氨基酸、有机酸,也可以选自本领域中可能通过生物合成得到的其他种类的化合物。
91.在一些实施方式中,目标化合物为“氨基酸”或“l-氨基酸”。“氨基酸”或“l-氨基酸”通常是指其中氨基和羧基结合至相同碳原子的蛋白质的基本构成单元。示例性的,氨基酸选自甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸、丝氨酸、半胱氨酸、谷氨酰胺、甲硫氨酸、天冬氨酸、天冬酰胺、谷氨酸、赖氨酸、精氨酸、组氨酸、苯丙氨酸、酪氨酸、色氨酸、脯氨酸中的一种或两种以上的组合,或者是本领域中其他种类的氨基酸。
92.在一些实施方式中,目标化合物为有机酸。有机酸可以是具有酸性的有机化合物,例如,其中包括羧基和磺酸基的那些化合物。示例性的,有机酸包括乳酸、醋酸、琥珀酸、丁酸、棕榈酸、草酸、酒石酸、柠檬酸、丙酸、己烯酸、癸酸、辛酸、戊酸、苹果酸中的一种或两种以上的组合,或者是本领域中其他种类的有机酸。
93.本公开中的术语“蛋白编码基因”是指能够通过一定的规则指导蛋白的合成dna分子,蛋白编码基因指导蛋白合成的过程一般包括以双链dna为模板的转录过程和以mrna为模板的翻译过程。蛋白编码基因含有cds序列(coding sequence),能够指导编码蛋白质的mrna的产生。
94.示例性的,蛋白编码基因包括但不限于用于编码与目标化合物合成相关的蛋白,在一些实施方式中,蛋白编码基因涉及用于编码与合成l-氨基酸的相关的蛋白。示例性的,与合成l-氨基酸的相关的蛋白包括但不限于丙酮酸羧化酶、磷酸烯醇式丙酮酸羧化酶、γ-谷氨酰激酶、谷氨酸半醛脱氢酶、吡咯啉-5-羧酸还原酶、氨基酸运输蛋白、ptsg系统、丙酮酸脱氢酶、高丝氨酸脱氢酶、草酰乙酸脱羧酶、葡萄糖酸阻遏蛋白、葡萄糖脱氢酶中的一种或两种以上的组合。在一些实施方式中,与合成l-氨基酸的相关的蛋白为与合成l-赖氨酸相关的蛋白,对于与合成l-赖氨酸的相关的蛋白,包括天冬氨酸激酶、天冬氨酸半醛脱氢酶、天冬氨酸氨裂合酶、二氢吡啶二羧酸合成酶、二氢吡啶甲酸还原酶、琥珀酰二氨基庚二酸氨基转移酶、四氢吡啶二羧酸酯琥珀酰酶、琥珀酰二氨基庚二酸脱酰基酶、二氨基庚二酸差向异构酶、二氨基庚二酸脱酰基酶、甘油醛-3-磷酸脱氢酶、赖氨酸运输蛋白、转酮酶、二氨基庚二酸脱氢酶和丙酮酸羧化酶中的一种或两种以上的组合。
95.在一些实施方式中,蛋白编码基因涉及用于编码与合成有机酸相关的蛋白,示例性的,蛋白编码基因用于编码与合成柠檬酸有关的蛋白,或用于编码与合成琥珀酸有关的蛋白。在一些实施方式中,蛋白编码基因涉及与基因编辑相关的蛋白,例如cpf1蛋白。
96.本公开的术语“基因表达调控蛋白”包括不限于外源的基因表达调控工具蛋白,例如crispri调控需要的dcas9蛋白、dcpf1蛋白,srna调控需要的hfq蛋白等,以及内源或外源的转录调控因子,进而调控代谢通路中关键基因的表达。
97.本公开中的术语“宿主细胞”意指易于用包含本公开的多核苷酸的转录起始元件或表达载体转化、转染、转导等的任何细胞类型。术语“重组宿主细胞”涵盖导入转录起始元件或重组表达载体后不同于亲本细胞的宿主细胞,重组宿主细胞具体通过转化来实现。
98.本公开中的术语“转化”具有本领域技术人员普遍理解的意思,即将外源性的dna导入宿主的过程。所述转化的方法包括任何将核酸导入细胞的方法,这些方法包括但不限于电穿孔法、磷酸钙沉淀法、氯化钙(cacl2)沉淀法、微注射法、聚乙二醇(peg)法、deae-葡聚糖法、阳离子脂质体法以及乙酸锂-dmso法。
99.本公开的宿主细胞可以是原核细胞或真核细胞,只要是能够导入本公开的具有启动子活性的多核苷酸的细胞即可。在一些实施方式中,宿主细胞指原核细胞,具体地,宿主细胞来源于适合发酵生产氨基酸、有机酸的微生物,例如棒状杆菌属、短杆菌属、节杆菌属、微杆菌属或埃希氏菌属。作为优选地,宿主细胞是来源于棒状杆菌属的谷氨酸棒杆菌。其中,谷氨酸棒杆菌可以是谷氨酸棒杆菌atcc 13032、谷氨酸棒杆菌atcc 13869或谷氨酸棒杆菌atcc 14067等。
100.本公开的宿主细胞的培养可以根据本领域的常规方法进行,包括但不限于孔板培养、摇瓶培养、批次培养、连续培养和分批补料培养等,并可以根据实际情况适当地调整各种培养条件如温度、时间和培养基的ph值等。
101.除非在本公开中另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
102.包含ncgl1418基因的启动子核心区的突变体
103.本公开利用ncgl1418基因的启动子核心区序列,在ncgl1418基因的启动子-10区引入突变,得到包含-10区突变的ncgl1418基因的启动子核心区的突变体。
104.本公开中的具有启动子活性的多核苷酸,通过对ncgl1418基因的启动子核心区进行突变,具体地是在ncgl1418基因的启动子核心区的-10区(ccacaatg)引入突变,与包含ncgl1418基因的启动子核心区的野生型启动子相比,本公开中的突变体具有显著提高的启动子活性,是一种新型的强组成型启动子;在应用于目标化合物的发酵时,突变体与野生型启动子相比,表现出更高的目标化合物的转化率。
105.此外,通过对启动子进行不同长度的截短,分别获得了具有203bp(seq id no:3)、145bp(seq id no:4)的ncgl1418启动子片段,这两个片段都具备ncgl1418启动子的核心区,在盐浓度、渗透压升高的环境下也同样能够表现出明显增强的启动子活性。那么,采用上述实施例中的启动子改造方法,即对seq id no:3所示序列的第164-171位中的一个或多个位置进行突变,或者对seq id no:4所示序列的第106-113位中的一个或多个位置进行突变,将获得强组成型的启动子突变体。
106.在一些实施方式中,本公开的突变体是指包含如seq id no:2所示序列的多核苷
酸的突变体,是指包含如seq id no:2所示序列的多核苷酸的突变体,所述突变体在seq id no:2所示序列的第204-211位中的一个或多个位置处具有突变的核苷酸且不包含seq id no:2所示序列的第204-211位突变为ccacaatg的多核苷酸。与包含seq id no:2所示序列的多核苷酸相比,突变体具有提高的启动子活性。
107.在一些实施方式中,突变体在对应seq id no:2所示序列的第204-211位中的1个、2个、3个、4个、5个、6个、7个或8个位置处具有突变的核苷酸。
108.在一些实施方式中,包含如seq id no:3所示序列的多核苷酸的突变体,是指包含如seq id no:3所示序列的多核苷酸的突变体,所述突变体在seq id no:3所示序列的第164-171位中的一个或多个位置处具有突变的核苷酸且不包含seq id no:3所示序列的第164-171位突变为ccacaatg的多核苷酸。与包含seq id no:3所示序列的多核苷酸相比,突变体具有提高的启动子活性。
109.在一些实施方式中,突变体在对应seq id no:3所示序列的第164-171位中的1个、2个、3个、4个、5个、6个、7个或8个位置处具有突变的核苷酸。
110.在一些实施方式中,包含如seq id no:4所示序列的多核苷酸的突变体,是指包含如seq id no:4所示序列的多核苷酸的突变体,所述突变体在seq id no:4所示序列的第106-113位中的一个或多个位置处具有突变的核苷酸且不包含seq id no:4所示序列的第106-113位突变为acaccgagtg的多核苷酸。与包含seq id no:4所示序列的多核苷酸相比,突变体具有提高的启动子活性。在一些实施方式中,突变体在对应seq id no:4所示序列的第106-113位中的1个、2个、3个、4个、5个、6个、7个或8个位置处具有突变的核苷酸。
111.在一些实施方式中,本公开中的具有启动子活性的多核苷酸,还包括与seq id no:2、seq id no:3、seq id no:4所示的突变体的核苷酸序列方向互补的多核苷酸。
112.在一些实施方式中,本公开中的具有启动子活性的多核苷酸,还包括在高严格性杂交条件或非常高严格性杂交条件下,与seq id no:2、seq id no:3、seq id no:4所示的突变体或杂交的序列的反向互补的多核苷酸。并且所述多核苷酸在对应seq id no:2所示序列的第204-211位中的核苷酸序列不为ccacaatg,在对应seq id no:3所示序列的第164-171位中的核苷酸序列不为ccacaatg,在对应seq id no:4所示序列的第106-113位中的核苷酸序列不为ccacaatg。
113.在一些实施方式中,本公开中的具有启动子活性的多核苷酸,为与上述的多核苷酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%序列同一性(包括这些数值之间所有范围和百分数)的序列。并且所述多核苷酸在对应seq id no:2所示序列的第204-211位中的核苷酸序列不为ccacaatg,在对应seq id no:3所示序列的第164-171位中的核苷酸序列不为ccacaatg,在对应seq id no:4所示序列的第106-113位中的核苷酸序列不为ccacaatg。
114.在一些具体的实施方式中,所述突变体对应seq id no:2所示序列的第204-211位的核苷酸序列,或在对应seq id no:3所示序列的第164-171位的核苷酸序列,或在对应seq id no:4所示序列的第106-113位中的核苷酸序列选自如下(p1)-(p
18
)组成的组中的任一项:(p1)actgtagg,(p2)tattatgg,(p3)aattgggg,(p4)tatggttg,(p5)tagggtag,(p6)aatggaat,(p7)tagacttc,(p8)aatgggta,(p9)taccatta,(p
10
)actgaggg,(p
11
)actagaag,(p
12
)aattagtg,(p
13
)aatagggt,(p
14
)tagtattg,(p
15
)actggact,(p
16
)taacatgg,(p
17
)
actagggg,(p
18
)tataagtt。
115.在一些具体的实施方式中,所述突变体的核苷酸序列选自如seq id no:5-22任一项所示的序列。
116.在一些实施方式中,本公开中的具有启动子活性的多核苷酸,与seq id no:2所示序列的多核苷酸相比,具有5-13倍以上提高的启动子活性。进一步的,与包含seq id no:2所示序列的多核苷酸相比,具有8.31、12.18、8.93、8.07、7.63、10.31、5.89、5.92、6.49、7.66、8.63、8.41、10.21、9.52、9.91、8.52、12.61、9.16倍的提高的启动子活性。
117.重组表达载体和重组宿主细胞
118.在一些实施方式中,本公开以atcc13032基因组(corynebacterium glutamicum atcc 13032,nc_003450.3))为模板,以1418-f和1418-r为引物,扩增获得ncgl1418基因启动子的dna片段;以pxm-gfp质粒为模板,以pgfp-f和pgfp-r引物,扩增去除laci基因和tac启动子的载体片段;将上述片段重组连接,得到重组表达载体pxm-p
ncgl1418-gfp。
119.在一些实施方式中,本公开以pxm-p
ncgl1418-gfp为模板,以1418mutant-f和1418mutant-r引物对pxm-p
ncgl1418-gfp进行反向pcr扩增,得到的线性化质粒片段;将线性化质粒片段进行磷酸化和连接,收集抗性克隆,得到ncgl1418基因的启动子突变体文库。
120.在一些实施方式中,本公开以ncgl1418基因的启动子突变体文库和pxm-con、pxm-p
ncgl1418-gfp分别转化谷氨酸棒杆菌atcc13032,得到重组宿主细胞。通过平板培养后筛选重组宿主细胞的荧光强度,进行启动子强度提高的突变体的筛选。
121.在一些具体的实施方案中,本公开以atcc 13032基因组为模板,利用引物1418-l-f和1418-l-r,以及引物lyse-f和lyse-r,分别通过pcr扩增得到ncgl1418基因的启动子序列和lyse基因的dna序列。以pec-xk99e为模板,利用引物pec-f和pec-r通过pcr扩增获得载体片段,将上述三个片段回收后行重组连接,得到重组表达载体pec-p
ncgl1418-lyse。
122.在一些具体的实施方案中,本公开以pxm-p
tuf-gfp为模板,利用引物tuf-lyse-f和tuf-lyse-f扩增得到包含ncgl1418基因的rbs区的tuf基因的启动子序列。同时,以pxm-p
ncgl1418-lyse为模板,利用引物tuf-pec-f和tuf-pec-r,通过pcr扩增获得包含lyse基因的载体片段。将上述两个片段回收后进行重组连接,得到重组表达载体pec-p
tuf-lyse。
123.在一些具体的实施方案中,本公开以pxm-p
ncgl1418-gfp为模板,利用引物10p2-pec-f和10p2-pec-r,通过pcr扩增得到带有突变启动子10p2且包含lyse基因的载体片段,然后利用t4 pnk将载体片段磷酸化,并通过自身环化构建获得pec-p
10p2-lyse。
124.在一些具体的实施方案中,本公开以pxm-p
ncgl1418-gfp为模板,利用引物10p17-pec-f和10p2-pec-r,通过pcr扩增得到带有突变启动子10p17且包含lyse基因的载体片段,然后将线性化的载体片段磷酸化,并通过自身环化构建获得pec-p
10p17-lyse。
125.在另外一些实施方式中,本公开还可以根据具体的克隆需要,利用10p1、10p3、10p4、10p5、10p6、10p7、10p8、10p9、10p10、10p11、10p12、10p13、10p14、10p15、10p16、10p18的启动子序列构建所需的重组载体。
126.在一些实施方式中,本公开的谷氨酸棒杆菌scgl30菌株,将谷氨酸棒杆菌atcc13032基因组上天冬氨酸激酶(lysc基因编码)第311位的苏氨酸突变为异亮氨酸,构建获得一株具有一定赖氨酸合成能力的菌株scgl30。
127.在一些实施方式中,本公开将pec-p
10p2-lyse转化scgl30重组菌株,获得重组宿主
细胞。在一些实施方式中,本公开将pec-p
10p17-lyse转化scgl30重组菌株,获得重组宿主细胞。在另外一些实施方式中,本公开还可以分别将包含10p1、10p3、10p4、10p5、10p6、10p7、10p8、10p9、10p10、10p11、10p12、10p13、10p14、10p15、10p16、10p18的启动子序列的重组载体转化scgl30重组菌株,获得重组宿主细胞。
128.目标化合物的生产过程
129.(1)将具有启动子活性的多核苷酸,与目标化合物合成相关的蛋白编码基因或基因表达调控蛋白编码基因可操作的连接,得到能够与目标化合物合成相关的蛋白或基因表达调控蛋白的重组表达载体,利用重组表达载体转化宿主细胞,获得重组宿主细胞。
130.(2)对重组宿主细胞进行发酵培养,从重组宿主细胞或重组宿主细胞的培养液中收集目标化合物,完成目标化合物的生产过程。
131.上述生产过程中,由于多核苷酸具有改进的启动子活性,在重组宿主细胞中,与目标化合物合成相关的蛋白或基因表达调控蛋白的编码基因的转录活性提高,与目标化合物合成相关的蛋白或基因表达调控蛋白的表达量提高,进而使目标化合物的产量显著提升。
132.在一些具体的实施方案中,本公开采用的制备氨基酸的方法的步骤中,不添加诱导剂。在一个具体的实施方案中,本公开采用的制备氨基酸的方法的步骤中,不添加iptg。
133.在一些实施方式中,目标化合物为氨基酸,与目标化合物合成相关的蛋白编码基因是指与合成氨基酸相关的蛋白编码基因。在一些实施方式中,目标化合物为l-氨基酸,与合成氨基酸相关的蛋白编码基因是指与合成l-氨基酸相关的蛋白编码基因。在一些具体的实施方案中,l-氨基酸为l-赖氨酸,与氨基酸合成相关的蛋白为赖氨酸转运蛋白lyse,以具有启动子活性的多核苷酸增加lyse的表达,可促进赖氨酸的胞外排放和胞外积累。
134.在一些具体的实施方案中,宿主细胞为谷氨酸棒杆菌(corynebacterium glutamicum),谷氨酸棒杆菌是用于生产l-赖氨酸的重要菌株,具有强组成型启动子活性的多核苷酸、转录表达盒或重组表达载体对谷氨酸棒杆菌进行改造后,谷氨酸棒杆菌内与赖氨酸合成相关的蛋白的表达量显著提高,进而使谷氨酸棒杆菌长时间发酵积累l-赖氨酸的能力大大提高。
135.在一些具体的实施方案中,宿主细胞是经过如下改良的谷氨酸棒杆菌:谷氨酸棒杆菌atcc13032基因组上天冬氨酸激酶(lysc基因编码)第311位的苏氨酸突变为异亮氨酸。
136.在一些具体的实施方案中,重组宿主细胞的培养条件为:将重组宿主细胞接种含有相应抗生素的tsb培养基,30℃,220r/min过夜培养,按照初始od 0.3分别转接发酵培养基,培养体系为24孔板装液1ml,30℃,800r/min培养24h后终止发酵,检测剩余葡萄糖含量、od
600
和赖氨酸产量。
137.对于赖氨酸发酵培养基,配方为:葡萄糖80g/l、酵母粉8g/l、尿素9g/l、k2hpo
4 1.5g/l、mops 42g/l、feso
4 0.01g/l、mnso
4 0.01g/l、mgso
4 0.6g/l,氯霉素终浓度为5μg/ml,和/或卡那霉素终浓度为25μg/ml。
138.在一些具体的实施方案中,对于重组宿主细胞或重组细胞的培养液回收目标化合物,可通过本领域常用方法,包括但不限于:过滤、阴离子交换色谱、结晶或hplc。
139.在本领域,用于操纵微生物的方法是已知的,如《分子生物学现代方法》(online isbn:9780471142720,john wiley and sons,inc.)、《微生物代谢工程:方法和规程》(qiong cheng ed.,springer)和《系统代谢工程:方法和规程》(hal s.alper ed.,
springer)等出版物中被解释。
140.实施例
141.本公开的其他目的、特征和优点将从以下详细描述中变得明显。但是,应当理解的是,详细描述和具体实施例(虽然表示本公开的具体实施方式)仅为解释性目的而给出,因为在阅读该详细说明后,在本公开的精神和范围内所作出的各种改变和修饰,对于本领域技术人员来说将变得显而易见。
142.本实施例中所用到的实验技术与实验方法,如无特殊说明均为常规技术方法,例如下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所使用的材料、试剂等,如无特殊说明,均可通过正规商业渠道获得。
143.表1实施例中质粒构建所使用的引物序列如下所示:
[0144][0145]
实施例1.包含ncgl1418基因启动子序列的表征质粒构建
[0146]
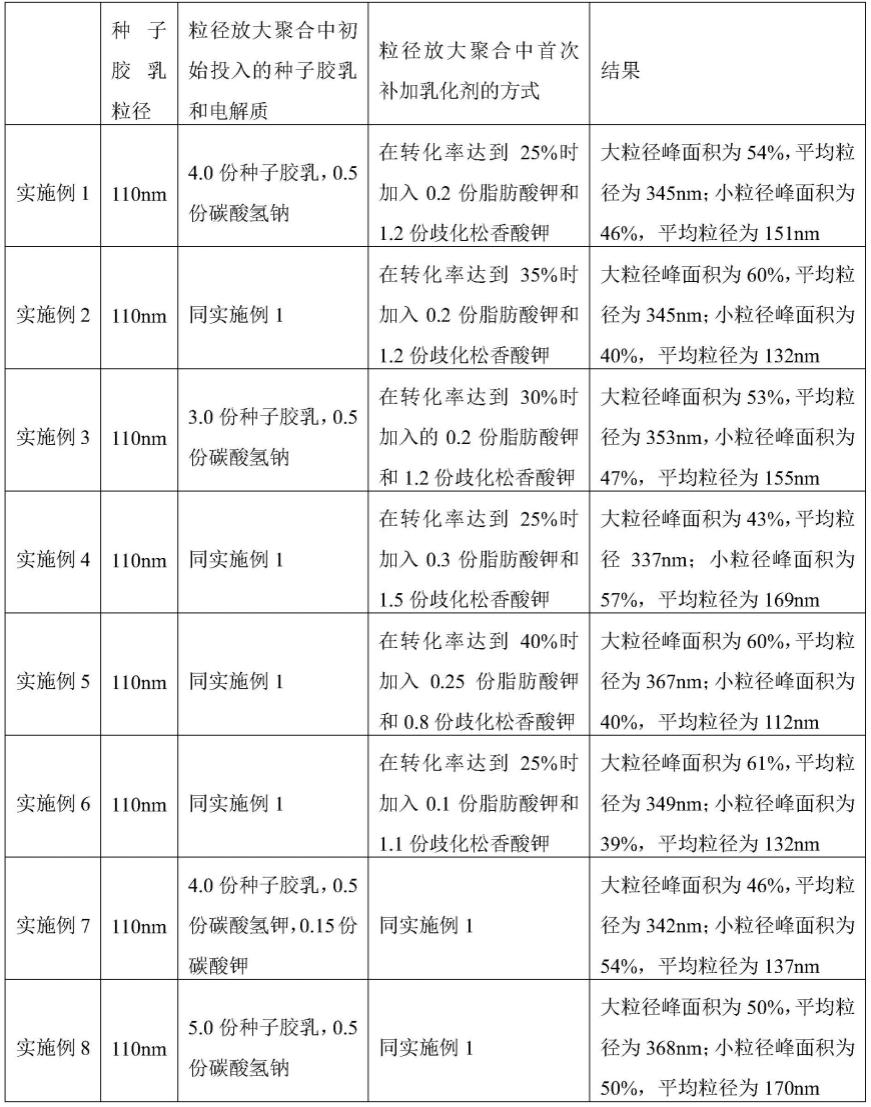
我们首先利用添加和不添加0.6m nacl或赖氨酸硫酸盐的cgxii培养基培养谷氨酸棒状杆菌atcc13032菌株,通过转录组测序分析,确定ncgl1418基因的启动子为高盐高渗诱导型启动子。此外,通过对启动子进行不同长度的截短,分别获得了具有203bp(seq id no:3)、145bp(seq id no:4)和94bp的ncgl1418启动子片段,分别比较高盐(添加0.6m硫酸钠)和正常培养基条件下不同长度ncgl1418启动子的强度。结果见图1,数据显示94bp长度的ncgl1418启动子尽管包含了核心序列(-35区和-10区),但却基本丧失了启动子的正常功能;145bp长度的启动子在高盐条件下虽然诱导强度有所下降,但仍可以达到243bp启动子
活性的74%以上;203bp长度的启动子在高盐渗透压条件下基本保持了243bp启动子的活性,为243bp启动子活性的94%;以上结果表明ncgl1418启动子的启动子活性以及在高盐渗透压条件下的活性至少需要包括seq id no:3所示的145bp长度的dna序列。
[0147]
根据ncbi公布的谷氨酸棒杆菌(corynebacterium glutamicum)atcc 13032的基因组序列(nc_003450.3),设计引物1418-f(seq id no:24)/1418-r(seq id no:25)。以atcc 13032基因组为模板通过pcr扩增得到ncgl1418基因的启动子序列(seq id no:2)。同时,以文献报道的pxm-gfp为模板
[1]
,利用引物pgfp-f(seq id no:26)和pgfp-r(seq id no:27),通过pcr扩增获得去除laci基因和tac启动子的载体片段。上述两个片段回收后,利用vazyme clon express multies一步重组试剂盒进行重组连接,获得重组载体pxm-p
ncgl1418-gfp。同时,利用t4 pnk将载体片段磷酸化,并通过自身环化构建获得对照载体pxm-con。将上述重组载体转化谷氨酸棒杆菌atcc 13032,获得重组菌株。
[0148]
实施例2.包含tuf启动子序列的对照质粒构建
[0149]
目前,已知通用的谷氨酸棒杆菌内源强组成型启动子是p
tuf
,因此,本公开以该启动子作为对照构建质粒,以表征ncgl1418突变启动子的相对强度。
[0150]
根据ncbi公布的谷氨酸棒杆菌(corynebacterium glutamicum)atcc 13032的基因组序列(nc_003450.3),设计引物tuf-f(seq id no:28)和tuf-r(seq id no:29)。以atcc 13032基因组为模板通过pcr扩增得到带有tuf基因的启动子序列(seq id no:23)。同时,以pxm-p
ncgl1418-gfp为模板,利用引物tuf-pgfp-f(seq id no:30)和tuf-pgfp-r(seq id no:31),通过pcr扩增获得包含ncgl1418基因rbs区的载体片段。上述片段回收后利用vazyme clon express multies重组试剂盒进行重组连接,并将连接产物转化到trans t1感受态细胞,涂布氯霉素抗性平板过夜培养,挑阳性克隆进行菌落pcr验证,并将正确转化子进行测序确认,获得的重组载体命名为pxm-p
tuf-gfp。将该重组载体转化谷氨酸棒杆菌atcc 13032,获得重组菌株。
[0151]
实施例3.ncgl1418基因启动子突变文库构建
[0152]
鉴于启动子-10区对启动子的强度和性质可能具有重要的调控作用,本实施例对ncgl1418基因启动子核心区(seq id no:1)的-10区进行随机突变,下划线处分别为启动子-35区和-10区主要序列:
[0153]
tattaaagatcacaccgagtggtggaatttcctcaagtgatttacccacaatggactttg;
[0154]
具体突变序列为:
[0155]
tattaaagatcacaccgagtggtggaatttcctcaagtgatttacnnnnnnnngactttg。
[0156]
利用1418mutant-f/r引物(seq id no:38和seq id no:39)对pxm-p
ncgl1418-gfp反向pcr扩增,通过对得到的线性化质粒片段进行磷酸化和连接,转化大肠杆菌t1感受态细胞,获得抗性克隆。对获得的所有克隆菌进行细胞收集并提取质粒,获得ncgl1418基因启动子的突变体文库。
[0157]
实施例4.ncgl1418基因启动子突变文库筛选和突变启动子表征
[0158]
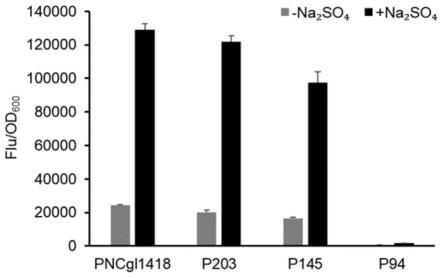
将上述启动子突变体文库转化谷氨酸棒杆菌atcc13032,使用菌株atcc13032(pxm-con)、atcc13032(pxm-p
ncgl1418-gfp)作为空载体和野生型对照,接种上述菌株于含有5μg/ml氯霉素的tsb培养基,30℃,220r/min培养8~10h后,按照初始od1分别转接添加0.6m na2so4的cgxiiy培养基,培养体系为24孔板装液1ml,30℃,800r/min培养6h后,将所得菌液
用pbs缓冲液稀释50倍,然后超声处理6min后,通过流式细胞仪进行荧光分选(top 0.01%)。
[0159]
将上述分选获得的菌株及野生型ncgl1418启动子、tuf启动子和无启动子对照菌株分别接种含有5μg/ml氯霉素的tsb培养基,30℃,220r/min过夜培养。其中,tsb液体培养基成份为(g/l):葡萄糖,5g/l;酵母粉,5g/l;大豆蛋白胨,9g/l;尿素,3g/l;丁二酸,0.5g/l;k2hpo4·
3h2o,1g/l;mgso4·
7h2o,0.1g/l;生物素,0.01mg/l;维生素b1,0.1mg/l;mops,20g/l。
[0160]
按照初始od 0.5分别转接添加或不添加0.6m na2so4的cgxiiy培养基,培养体系为24孔板装液1ml,30℃,800r/min培养24h后检测不同菌株的gfp荧光强度及od
600
,利用单位菌体的荧光强度(扣除相同条件下对照菌株的单位菌体荧光强度)表征不同条件下突变启动子的相对强度。其中cgxiiy培养基配方为:葡萄糖50g/l、nh4cl 16.5g/l、尿素5g/l、kh2po
4 1g/l、k2hpo
4 1g/l、mops 42g/l、mgso
4 0.25g/l、feso4·
7h2o 0.01g/l、mnso4·
h2o 0.01g/l、znso4·
7h2o 0.001g/l、cuso
4 0.2mg/l、nicl
·
6h2o 0.02mg/l、cacl
2 0.01g/l、原儿茶酸0.03g/l、生物素0.2mg/l、维生素b1 0.1mg/l,氯霉素终浓度为5μg/ml。根据检测获得的荧光强度筛选获得18个强组成型突变启动子,强度均高于谷氨酸棒杆菌内源强组成型启动子p
tuf
,且基本不再受高盐高渗的诱导(表2)。
[0161]
表2
[0162]
[0163][0164]a各启动子荧光强度/野生型ncgl1418基因启动子荧光强度(不添加na2so4)
[0165]b添加na2so4的荧光强度/不添加na2so4的荧光强度
[0166]
实施例5.利用突变启动子调控lyse表达在赖氨酸合成中的应用
[0167]
根据ncbi公布的谷氨酸棒杆菌(corynebacterium glutamicum)atcc 13032的基因组序列(nc_003450.3),分别设计引物1418-l-f(seq id no:32)和1418-l-r(seq id no:33),lyse-f(seq id no:34)和lyse-r(seq id no:35)。以atcc 13032基因组为模板通过pcr扩增分别得到ncgl1418基因的启动子序列和lyse基因的dna序列。同时,以文献报道的pec-xk99e为模板
[2]
,利用引物pec-f(seq id no:36)和pec-r(seq id no:37),通过pcr扩增获得载体片段。将上述三个片段回收后,利用vazyme clon express multies一步重组试剂盒进行重组连接,并将连接产物转化到trans t1感受态细胞,涂布卡那霉素抗性平板过夜培养,挑阳性克隆进行菌落pcr验证,并将正确转化子进行测序确认,获得的重组载体命名为pec-p
ncgl1418-lyse。
[0168]
以pxm-p
tuf-gfp为模板,利用引物tuf-lyse-f(seq id no:40)和tuf-lyse-r(seq id no:41)扩增得到包含ncgl1418基因的rbs区的tuf基因的启动子序列(seq id no:47)。同时,以pxm-p
ncgl1418-lyse为模板,利用引物tuf-pec-f(seq id no:42)和tuf-pec-r(seq id no:43),通过pcr扩增获得包含lyse基因的载体片段。将上述两个片段回收后利用vazyme clon express ii重组试剂盒进行重组连接,并将连接产物转化到trans t1感受态细胞,涂布卡那霉素抗性平板过夜培养,挑阳性克隆进行菌落pcr验证,并将正确转化子进行测序确认,获得的重组载体命名为pec-p
tuf-lyse。
[0169]
以pxm-p
ncgl1418-lyse为模板,利用引物10p2-pec-f(seq id no:44),10p17-pec-f(seq id no:45)分别和10p2-pec-r(seq id no:46),通过pcr扩增获得带有突变启动子10p2和10p17且包含lyse基因的载体片段。然后利用t4 pnk将载体片段磷酸化,并通过自身环化构建获得pec-p
10p2-lyse和pec-p
10p17-lyse。
[0170]
将上述重组载体pec-p
ncgl1418-lyse、pec-p
tuf-lyse、pec-p
10p2-lyse、pec-p
10p17-lyse和pec-xk99e分别转化谷氨酸棒杆菌scgl30,获得重组菌株和对照菌株。将上述菌株分别接种含有25μg/ml卡那霉素的tsb培养基,30℃,220r/min过夜培养,按照初始od 0.3分别转接发酵培养基,培养体系为24孔板装液1ml,30℃,800r/min培养24h后终止发酵,检测剩余葡萄糖含量、od
600
和赖氨酸产量。其中赖氨酸发酵培养基配方为:葡萄糖80g/l、酵母粉8g/l、尿素9g/l、k2hpo
4 1.5g/l、mops 42g/l、feso
4 0.01g/l、mnso
4 0.01g/l、mgso
4 0.6g/l,卡那霉素终浓度为25μg/ml。检测结果见表3,数据显示利用p
tuf
过表达lyse时赖氨酸产量和葡萄糖转化率分别比对照菌株提高31%和32%,而利用野生型ncgl1418基因启动子过表达lyse,由于低渗条件下启动子强度较弱,赖氨酸产量和葡萄糖转化率只提高了16%和15%,而利用突变筛选获得的强组成型启动子10p2和10p17过表达lyse,赖氨酸产量分别提高了38%和69%,而葡萄糖转化率分别比对照菌株提高了45%和88%,均远高于野生型ncgl1418启动子和内源强启动子p
tuf
,展现出良好的应用前景。
[0171]
表3组成型强启动子调控lyse表达在赖氨酸合成中的应用效果
[0172][0173]
此外,本公开图1中证明了145bp长度的启动子在高盐渗透压条件下可以达到243bp启动子活性的74%以上;203bp长度的启动子在高盐渗透压条件下基本保持了243bp启动子的活性,为243bp启动子活性的94%;说明了由于seq id no:3和seq id no:4的启动子片段含有ncgl1418基因的启动子的核心区,seq id no:3和seq id no:4的启动子片段在盐浓度、渗透压升高的环境下也同样能够表现出明显增强的启动子活性。因此,采用上述实
施例中对启动子核心区进行改造的方法,即对seq id no:3所示序列的第164-171位中的一个或多个位置进行突变,或者对seq id no:4所示序列的第106-113位中的一个或多个位置进行突变,同样能够获得强组成型的启动子突变体。
[0174]
引用文献:
[0175]
[1]sun dh et al.,journal of industrial microbiology&biotechnology 2019,46(2):203-208.
[0176]
[2]o kirchner,et al.journal of biotechnology,2003,104:287-299.
[0177]
本说明书公开的所有技术特征都可以任何组合方式进行组合。本说明所公开的每个特征也可以被其它具有相同、相等或相似作用的特征所替换。因此,除非特殊说明,所公开的每一特征仅仅是一系列相等或相似特征的实例。
[0178]
此外,从上述描述中,本领域技术人员可从本公开中很容易清楚本公开的关键特征,在不脱离本公开的精神及范围的情况下,可对发明进行很多修改以适应各种不同的使用目的及条件,因此这类修改也旨在落入所附权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。