1.本发明涉及生物医学技术领域,尤其涉及一种用于胶质瘤恶性程度诊断标志物及其检测方法。
背景技术:
2.目前胶质瘤的分子诊断标志物如idh1突变、mgmt启动子甲基化、染色体1p19q共缺失、tert启动子突变、egfr扩增或egfrvⅲ重排和petn、tp53突变等极大地促进了胶质瘤的分子诊断的进步,也为胶质瘤的个体户诊疗提供了依据。举例来说,mgmt启动子甲基化,全称叫六氧-甲基鸟嘌呤-dna-甲基转移酶(o6-methylguanine-dna-methyltransferas,mgmt)启动子甲基化,该启动子促进mgmt的转录,而mgmt是一种重要的dna修复酶,能够迅速修复由烷化剂药物引起的dna烷基化损伤,从而导致细胞对烷化剂的耐受,由于该启动子富含cpg岛,正常情况下处于非甲基化状态。高级别胶质瘤标准治疗方案里的核心化学治疗药物替莫唑胺是一种烷化剂药物,mgmt甲基化的患者对于替莫唑胺的药物反应性较好,相应的患者更容易从中获益,因此mgmt甲基化检测基本成了高级别胶质瘤患者的常规检测指标。
3.然而现有公认的胶质母细胞瘤生物标志物的发现基本是在基因层面或者表观遗传层面的,而作为生命活动主要执行者的蛋白质,在恶性肿瘤的发生发展及恶性生物学行为中无疑是十分重要的,但是目前尚缺乏比较有价值的蛋白质标志物来评估胶质母细胞瘤的恶性程度。
4.此外,在天冬酰胺内肽酶(aep)小分子抑制剂运用过程中,对于高级别胶质瘤具有一定的杀伤抑制作用,但是还缺少一个比较可靠的肿瘤标志物来指导天冬酰胺内肽酶小分子抑制剂的用药。因此,需要解决两个问题,其一,寻找用于评估高级别胶质瘤恶性程度的生物蛋白标志物;其二,根据该肿瘤标志物的检测结果指导天冬酰胺内肽酶小分子抑制剂的治疗。
技术实现要素:
5.本发明的提供一种用于胶质瘤恶性程度诊断标志物及其检测方法,天冬酰胺内肽酶切割产生的人原肌球蛋白调节蛋白3(tmod3)的特异切割带。
6.本发明的方案是:
7.一种用于胶质瘤恶性程度诊断标志物,是由天冬酰胺内肽酶切割产生的人原肌球蛋白调节蛋白3的特异性切割带。
8.本发明还公开了一种用于胶质瘤恶性程度诊断标志物的作用,观察检测样本的所述人原肌球蛋白调节蛋白3特异性切割带的切割率。
9.本发明还公开了一种检测用于胶质瘤恶性程度诊断标志物方法,通过免疫印迹法检测样本中的人原肌球蛋白调节蛋白3特异性切割带。
10.作为优选的技术方案,所述免疫印迹法为:
11.1)蛋白样品准备,细胞或组织蛋白抽提后加入适量的电泳上样缓冲液,金属浴100℃煮10min;
12.2)聚丙烯酰胺凝胶电泳,用微量加样器将蛋白样品及蛋白分子量标准小心地加入孔中,正确连接电泳槽,设置电泳为80v,待蛋白样品前沿进入分离胶后,将电压调为120v,直到样品前沿迁移至凝胶底部,关闭电泳仪;
13.3)转膜,提前备好1
×
转膜缓冲液,并预冷处理,裁剪好pvdf膜,取出pvdf膜放入甲醇中浸泡14~16秒,活化pvdf膜;蛋白电泳转膜装置的夹板正确顺序依次摆放;在冰浴中用250ma恒流转膜2小时;
14.4)封闭,先将已经转膜好的pvdf膜移至含有洗涤缓冲液溶液的器皿中,然后再浸入5%脱脂牛奶中,在室温下封闭1小时;
15.5)一抗孵育,将所需要的一抗anti-flag、anti-tmod3、anti-aep按照抗体说明书上的比例要求,稀释在洗涤缓冲液溶液配置的5%脱脂牛奶中,放在摇床上4℃过夜;次日,取出已孵育好一抗的pvdf膜,需用洗涤缓冲液溶液洗,每隔10min换一次洗涤缓冲液溶液,共3次;
16.6)二抗孵育,根据不同的种属一抗,选择hrp标记过的鼠/兔/羊二抗;将所需要的二抗按说明书上的稀释比例用洗涤缓冲液溶液配置的5%脱脂牛奶稀释,然后把清洗后的pvdf膜放置在二抗中孵育,密封后放在在摇床上或电动转子上孵育2小时;取出pvdf膜,继续用洗涤缓冲液溶液洗15min,每5min换一次洗涤缓冲液溶液;
17.7)显影,将化学发光显影剂将试剂盒中a、b液按照1:1的比例配好制成发光工作液,所需剂量要根据膜面积大小而定,在使用前需要避光;曝光前先用平头镊将pvdf膜从洗涤缓冲液溶液中取出,用滤纸将膜背面水分略微吸干后放到压片盒内,正面向上;表面滴加适量的发光工作液,在显影仪内进行显影。
18.本发明还公开了一种构建野生型tmod3及相应点突变tmod3过表达胶质瘤稳转细胞株方法,包括下列步骤:
19.1)慢病毒包装,将正处于对数生长期的293t细胞按照1
×
106细胞/孔接种到6cm细胞培养皿中,常规培养过夜;次日,倒掉培养液并用pbs轻轻地洗涤一次,再加入1.5ml无抗、无血清的dmem培养液;再取250μl的dmem培养液,并加入10μl的转染试剂,常温下静置5min后,加入4μg/平皿的慢病毒载体混合物250μl,在室温下放置20min后,轻缓地将其加入至上述细胞培养液,轻轻摇晃使其混匀,混匀后放入37℃、5%co2温箱中培养6小时;6小时后丢弃培养液,再加入2ml含10%fbs、无抗生素的dmem培养基,继续培养72小时;72小时后,收集病毒上清液,离心管内3000rpm离心10分钟,并吸取上清分装到ep管中,-80℃保存备用;
20.2)慢病毒感染,将处于对数生长期的胶质瘤细胞按照2
×
105细胞/孔接种在6孔板中,加入上述步骤1)制成病毒液,再加入终浓度6μg/ml的助染液,常规恒温孵育箱内培养过夜;次日更换新鲜的培养液,继续培养48h,在光镜下观察荧光。
21.作为优选的技术方案,所述慢病毒载体混合物包括tmod3克隆质粒、壳蛋白质粒pmd2g和包装质粒pspax2,并将上述按照摩尔数4:1:2比例配制。
22.本发明还公开了一种构建tmod3重组质粒与相应点突变的tmod3重组质粒的方法,包括下列步骤:
23.1)片段扩增;使用高保真dna聚合酶进行片段扩增;
24.2)琼脂糖凝胶电泳及凝胶回收;
25.3)载体酶切;
26.4)连接及感受态转化;
27.5)质粒抽提。
28.作为优选的技术方案,所述3)载体酶切中的表达载体pcdna3.1( )-3
×
flag-c。
29.作为优选的技术方案,所述2)琼脂糖凝胶电泳及凝胶回收中用的琼脂糖胶包括tae缓冲液与琼脂糖。
30.作为优选的技术方案,所述1)片段扩增中用到的引物如下:
[0031][0032]
由于采用了上述技术方案,一种用于胶质瘤恶性程度诊断标志物,是由天冬酰胺内肽酶切割产生的人原肌球蛋白调节蛋白3的特异性切割带。
[0033]
本发明的优点:
[0034]
本发明检测到了人原肌球蛋白调节蛋白3(tmod3)的特异性切割带,并通过点突变的方法准确筛选到了相应的aep切割位点;在正常脑胶质细胞和胶质瘤相关细胞系中进行了验证,相较于正常细胞,胶质瘤细胞中存在显著的tmod3切割带;因此人原肌球蛋白调节
蛋白3(tmod3)切割率可以用做患者的预后数据使用指标之一,在动物实验上提供了aep切割人原肌球蛋白调节蛋白3(tmod3)是aep小分子抑制剂发挥抗肿瘤疗效的指征之一;
[0035]
本发明提供了人原肌球蛋白调节蛋白3(tmod3)的特异性切割带的检测手段,筛选了天冬酰胺内肽酶靶向切割的特异性肽链位点;本发明还提供了tmod3特异性切割带的比例(切割率)作为胶质母细胞瘤恶性程度量化标准的应用。检测新鲜肿瘤组织中tmod3的切割,计算切割率,结合胶质瘤患者的预后情况,用于评估胶质母细胞瘤的恶性程度。
附图说明
[0036]
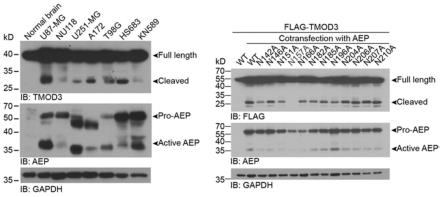
图1为本发明表达图与标记图;其中左侧为用免疫印迹法检测正常脑胶质细胞和多种常用胶质瘤细胞系中tmod3及其切割带、aep及内参蛋白gapdh的表达;右侧为hek293细胞单转flag标记的tmod3或共转flag标记的tmod3野生型或点突变和aep,然后和用用免疫印迹法检测单独转染flag标签标记的野生型tmod3的293细胞或点突变的tmod3;
[0037]
图2为核磁共振检测小鼠颅内成瘤情况图与小鼠颅内肿瘤he染色典型图;上部为将过表达tmod3-wt及过表达tmod3-n157a的u87-mg细胞立体定向接种到裸小鼠颅内构建肿瘤模型,分别给予aep小分子抑制剂尾静脉注射,核磁共振检测小鼠颅内成瘤情况;下部分为以上两组小鼠颅内肿瘤he染色典型图;
[0038]
图3为本发明载体酶切中的表达载体信息图。
具体实施方式
[0039]
为了弥补以上不足,本发明提供了一种用于胶质瘤恶性程度诊断标志物及其检测方法以解决上述背景技术中的问题。
[0040]
一种用于胶质瘤恶性程度诊断标志物,是由天冬酰胺内肽酶切割产生的人原肌球蛋白调节蛋白3的特异性切割带。
[0041]
本发明还公开了一种用于胶质瘤恶性程度诊断标志物的作用,观察检测样本的所述人原肌球蛋白调节蛋白3特异性切割带的切割率。
[0042]
本发明还公开了一种检测用于胶质瘤恶性程度诊断标志物方法,通过免疫印迹法检测样本中的人原肌球蛋白调节蛋白3的特异性切割带。
[0043]
所述免疫印迹法为:
[0044]
1)蛋白样品准备,细胞或组织蛋白抽提后加入适量的电泳上样缓冲液,金属浴100℃煮10min;
[0045]
2)聚丙烯酰胺凝胶电泳,用微量加样器将蛋白样品及蛋白分子量标准小心地加入孔中,正确连接电泳槽,设置电泳为80v,待蛋白样品前沿进入分离胶后,将电压调为120v,直到样品前沿迁移至凝胶底部,关闭电泳仪;
[0046]
3)转膜,提前备好1
×
转膜缓冲液,并预冷处理,裁剪好pvdf膜,取出pvdf膜放入甲醇中浸泡14~16秒,活化pvdf膜;蛋白电泳转膜装置的夹板正确顺序依次摆放;在冰浴中用250ma恒流转膜2小时;
[0047]
4)封闭,先将已经转膜好的pvdf膜移至含有洗涤缓冲液溶液的器皿中,然后再浸入5%脱脂牛奶中,在室温下封闭1小时;
[0048]
5)一抗孵育,将所需要的一抗anti-flag、anti-tmod3、anti-aep按照抗体说明书
上的比例要求,稀释在洗涤缓冲液溶液配置的5%脱脂牛奶中,放在摇床上4℃过夜;次日,取出已孵育好一抗的pvdf膜,需用洗涤缓冲液溶液洗,每隔10min换一次洗涤缓冲液溶液,共3次;
[0049]
6)二抗孵育,根据不同的种属一抗,选择hrp标记过的鼠/兔/羊二抗;将所需要的二抗按说明书上的稀释比例用洗涤缓冲液溶液配置的5%脱脂牛奶稀释,然后把清洗后的pvdf膜放置在二抗中孵育,密封后放在在摇床上或电动转子上孵育2小时;取出pvdf膜,继续用洗涤缓冲液溶液洗15min,每5min换一次洗涤缓冲液溶液;
[0050]
7)显影,将化学发光显影剂将试剂盒中a、b液按照1:1的比例配好制成发光工作液,所需剂量要根据膜面积大小而定,在使用前需要避光;曝光前先用平头镊将pvdf膜从洗涤缓冲液溶液中取出,用滤纸将膜背面水分略微吸干后放到压片盒内,正面向上;表面滴加适量的发光工作液,在显影仪内进行显影。
[0051]
本发明还公开了一种构建野生型tmod3及相应点突变tmod3过表达胶质瘤稳转细胞株方法,包括下列步骤:
[0052]
1)慢病毒包装,将正处于对数生长期的293t细胞按照1
×
106细胞/孔接种到6cm细胞培养皿中,常规培养过夜;次日,倒掉培养液并用pbs轻轻地洗涤一次,再加入1.5ml无抗、无血清的dmem培养液;再取250μl的dmem培养液,并加入10μl的转染试剂,常温下静置5min后,加入4μg/平皿的慢病毒载体混合物250μl,在室温下放置20min后,轻缓地将其加入至上述细胞培养液,轻轻摇晃使其混匀,混匀后放入37℃、5%co2温箱中培养6小时;6小时后丢弃培养液,再加入2ml含10%fbs、无抗生素的dmem培养基,继续培养72小时;72小时后,收集病毒上清液,离心管内3000rpm离心10分钟,并吸取上清分装到ep管中,-80℃保存备用;
[0053]
2)慢病毒感染,将处于对数生长期的胶质瘤细胞按照2
×
105细胞/孔接种在6孔板中,加入上述步骤1)制成病毒液,再加入终浓度6μg/ml的助染液,常规恒温孵育箱内培养过夜;次日更换新鲜的培养液,继续培养48h,在光镜下观察荧光。
[0054]
所述慢病毒载体混合物包括tmod3克隆质粒、壳蛋白质粒pmd2g和包装质粒pspax2,并将上述按照摩尔数4:1:2比例配制。
[0055]
本发明还公开了一种构建tmod3重组质粒与相应点突变的tmod3重组质粒的方法,包括下列步骤:
[0056]
1)片段扩增;使用高保真dna聚合酶进行片段扩增;
[0057]
2)琼脂糖凝胶电泳及凝胶回收;
[0058]
3)载体酶切;
[0059]
4)连接及感受态转化;
[0060]
5)质粒抽提。
[0061]
所述3)载体酶切中的表达载体pcdna3.1( )-3
×
flag-c。
[0062]
所述2)琼脂糖凝胶电泳及凝胶回收中用的琼脂糖胶包括tae缓冲液与琼脂糖。
[0063]
所述1)片段扩增中用到的引物如下:
[0064]
[0065][0066]
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明。
[0067]
实施例:
[0068]
1.免疫印迹检测tmod3蛋白及切割带
[0069]
1)蛋白样品准备:细胞或组织蛋白抽提后加入适量的3xloading buffer,金属浴100℃煮10min;
[0070]
2)聚丙烯酰胺凝胶电泳:用微量加样器将蛋白样样品及蛋白分子量标准小心地加入孔中,正确连接电泳槽,设置电泳为80v,待样品前沿进入分离胶后,将电压调为120v,直
到样品前沿迁移至凝胶底部,关闭电泳仪。
[0071]
3)转膜:先配好1
×
转膜缓冲液,并预冷处理,裁剪好pvdf膜,取出pvdf膜放入甲醇中浸泡约15秒,活化pvdf膜。蛋白电泳转膜装置的夹板正确顺序依次摆放。在冰浴中用250ma恒流转膜2小时;
[0072]
4)封闭:先将已经转膜好的pvdf膜移至1
×
tbst溶液器皿中,然后再浸入5%脱脂牛奶中,在室温下封闭1小时。
[0073]
5)一抗孵育:将所需要的一抗anti-flag(sigma-aldrich,cat.f1804)和anti-tmod3(proteintech,cat.12521-1-ap)、anti-aep(r&d systems,cat.af2199)按照抗体说明书上的比例要求,稀释在1
×
tbst液配置的5%脱脂牛奶中,放在摇床上4℃过夜。次日,取出已孵育好一抗的pvdf膜,需用1
×
tbst溶液洗,每隔10min换一次tbst液,共3次;
[0074]
6)二抗孵育:根据不同的种属一抗,选择hrp标记过的鼠/兔/羊二抗。将所需要的二抗按说明书上的稀释比例用1
×
tbst溶液配置的5%脱脂牛奶稀释,然后把清洗后的pvdf膜放置在二抗中孵育,密封后放在在摇床上或电动转子上孵育2小时。取出pvdf膜,继续用1
×
tbst洗15min,每5min换一次tbst溶液;
[0075]
7)显影:将化学发光显影剂将试剂盒中a、b液按照1:1的比例配好制成发光工作液,所需剂量要根据膜面积大小而定,在使用前需要避光;曝光前先用平头镊将pvdf膜从1
×
tbst中取出,用滤纸将膜背面水分略微吸干后放到压片盒内,正面向上。表面滴加适量的发光工作液,在显影仪内进行显影。
[0076]
2.构建flag标签标记的tmod3重组质粒及tmod3相应点突变的重组质粒
[0077]
1)片段扩增:使用2
×
phanta max master mix(dye plus)(诺维赞,p525-01)高保真酶进行片段扩增反应体系:
[0078][0079]
pcr反应程序:
[0080][0081]
引物如下:
[0082]
[0083]
[0084][0085]
2)琼脂糖凝胶电泳及凝胶回收:
[0086]
1%琼脂糖胶的配制:1xtae buffer 60ml;
[0087]
琼脂糖0.6g。
[0088]
用微波炉加热1min使得琼脂糖完全溶解,等琼脂糖溶解液冷却到60℃再加入2μl溴化乙锭染液,充分混匀后将琼脂糖溶液慢慢灌倒至胶模中,插好梳子,待30min后使其冷却至完全凝固;将配制好的1
×
tae电泳缓冲液倒入电泳槽内,并将凝胶放入电泳槽,电泳槽内的缓冲液要完全覆盖胶面。将pcr样品加到样品孔中,将1kb dna ladder作上样marker相应加入;连接电源,将电压调至120v,电泳30min;电泳完成后,切断电源,小心取出琼脂糖凝胶,将其置于凝胶成像系统下观看并分析目的基因条带的位置。利用琼脂糖凝胶回收试剂盒回收pcr产物,产物-20℃冻存备用。
[0089]
3)载体酶切
[0090]
酶切体系,37℃,水浴3h。
[0091]
ddh2o50μl10xfastdigest green buffer(thermo scientific)5μl内切酶(ecori)2.5μl内切酶(xhoi)2.5μl载体3μg
[0092]
4)连接及感受态转化:
[0093]
使用clonexpress ii one step cloning kit(诺维赞,c112-01)将目的片段连接在过表达载体pcdna3.1( )-3
×
flag-c上,然后转入感受态细胞dh5α;取200μl涂在浓度为100μg/ml含氨苄青霉素的lb-agarose固体培养基上,37℃细胞培养箱过夜培养;待培养基上长出单个白菌落后,挑取lb平板上白色单菌落并用含100μg/ml氨苄青霉素lb液体培养基再摇菌过夜,最后取100μl菌液送金唯智公司进行sanger测序。
[0094]
5)质粒抽提:选取测序正确的克隆,取菌液加至含100μg/ml amp抗性的lb液体培养基摇菌过夜,使用天根生物质粒小提试剂盒提取质粒,用nanodrop 200c检测质粒浓度。
[0095]
3.构建tmod3-wt及tmod3-n157a过表达u87-mg稳转细胞株。
[0096]
1)慢病毒包装
[0097]
将正处于对数生长期的lenti-x 293t细胞按照1
×
106细胞/孔接种到6cm细胞培
养皿中,常规培养过夜;次日,倒掉培养液并用pbs轻轻地洗涤一次,再加入1.5ml无抗、无血清的dmem培养液;再取250μl的dmem培养液,并加入10μl的lipofectamine 2000,常温下静置5min后,加入4μg/平皿的慢病毒载体混合物(包括tmod3克隆质粒、壳蛋白质粒pmd2g和包装质粒pspax2,并将上述按照摩尔数4:1:2比例配制)250μl,在室温下放置20min后,轻缓地将其加入至上述细胞培养液,轻轻摇晃使其混匀,混匀后放入37℃、5%co2温箱中培养6小时;6小时后丢弃培养液,再加入2ml含10%fbs、无抗生素的dmem培养基,继续培养72小时;72小时后,收集病毒上清液,离心管内3000rpm离心10分钟,并吸取上清分装到ep管中,-80℃保存备用。
[0098]
2)慢病毒感染
[0099]
将处于对数生长期的u87-mg细胞按照2
×
105细胞/孔接种在6孔板中,加入一定的病毒液,再加入终浓度6μg/ml的polybrene助染液,常规恒温孵育箱内培养过夜;次日更换新鲜的培养液,继续培养48h,在光镜下观察荧光。
[0100]
4.建立裸小鼠颅内胶质瘤原位动物模型及组织苏木精-伊红染色法(hematoxylin-eosin staining,h&e)
[0101]
1)建立裸小鼠颅内胶质瘤原位动物模型
[0102]
采用6周领的雄性裸鼠(8只/组),以立体定向仪注射gbm细胞-u87-mg制作裸鼠原位脑胶质瘤模型。参照裸小鼠脑解剖图谱,以前囟中点向右旁开2mm,往前1mm为目标注射位点。用5号针针头在颅骨上成形约1mm直径窗口,通过微注泵吸取5μl,约5x105细胞数。进针3mm,缓慢注入,注入后缓慢拔针。观察小鼠,当小鼠出现消瘦、少动等行为异常时行小鼠头颅mri成像检测,当出现不进食时,将其进行过量麻药注射,用手术器械掀开颅骨,取下脑组织。
[0103]
2)组织白片h&e染色
[0104]
a.65℃温箱进行充分干燥(脱蜡的前一天放进温箱或60℃烤片1-2h)。注意:进行高温干燥后迅速脱蜡,返回室温的情况下蜡容易变厚需延长脱蜡时间;
[0105]
b.二甲苯ⅰ10min,二甲苯ⅱ10min,二甲苯ⅲ10min;
[0106]
c.100%乙醇3次,各5min
[0107]
d.90%乙醇1次5min,80%乙醇1次5min,70%乙醇1次5min;
[0108]
e.自来水冲洗10min;
[0109]
f.1
×
pbs浸润5min;
[0110]
g.苏木素核染5min;
[0111]
h.自来水冲洗5min;
[0112]
i.1%盐酸乙醇1-2秒;
[0113]
j.自来水冲洗5min;
[0114]
k.dd h2o略洗;
[0115]
l.伊红染色2min;
[0116]
m.自来水稍洗;
[0117]
n.70%乙醇上下晃动3次,80%乙醇上下晃动3-6次,90%乙醇上下晃动3-6次,100%乙醇3次各上下晃动3-6次;
[0118]
o.二甲苯ⅲ10min,二甲苯ⅱ10min,二甲苯ⅰ10min;
[0119]
p.用适量的中性树脂封片,扫描。
[0120]
实验
[0121]
用免疫印迹法检测正常脑胶质细胞和多种常用胶质瘤细胞系中tmod3及其切割带、aep及内参蛋白gapdh的表达,筛选了天冬酰胺内肽酶靶向切割的特异性肽链位点,如图1所示;
[0122]
为了进一步的证明tmod3高切割率肿瘤对于aep抑制剂的高反应性,构建裸小鼠颅内构建肿瘤模型,如图2所示;通过提供tmod3高切割率肿瘤对于aep抑制剂的高反应性的动物实验方面的证据。
[0123]
以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。