用于产生针对hpv和与该病毒相关的癌症的预防性和治疗性dna的免疫学组合物的方法,杂合蛋白,表达载体,免疫学组合物,及其用途
发明领域
1.本发明涉及针对hpv和与该病毒相关的癌症的预防性和治疗性疫苗,其旨在用于任何对预防疾病感兴趣的人或者已发展出了癌症的已经被hpv感染的那些人。本发明还涉及dna表达载体,其能够有效地产生hpv16病毒的衣壳蛋白l2,以及还有与由人乳头瘤病毒引起的肿瘤的发展相关的病毒癌蛋白e6。特别地,本发明涉及通过基因克隆到表达载体中来获得重组的融合或杂合蛋白,其通过经由将一个或多个基因的核酸调控序列与一个或多个基因的蛋白质编码序列相组合而形成的融合基因的基因翻译来产生,其用于生成两种不同类型的应答:持久的体液免疫应答,其能够刺激针对hpv的特异性抗-l2和抗-e6抗体的产生(预防作用),以及激活细胞免疫应答,以对抗已经建立的肿瘤细胞并且诱导细胞因子tnf(肿瘤坏死因子)的表达(治疗作用)。
2.发明背景
3.宫颈癌是全世界女性中第三最常见的癌症类型,其是女性中由癌症造成的死亡的第二主要原因。人群中两种最流行的病毒类型是在最具侵袭性的癌症中检测到的hpv16和hpv18。这些癌症主要由高风险hpv(人乳头瘤病毒)的持续感染引起(guan p,howell-jonesr,l]n等人,human papillomavirus types in115,789hpv-positive women:a meta-analysis from cervical infection to cancer.int j.第131卷,第2349-2359页,2012)。
4.尽管有预防性疫苗可用,但是hpv感染在全世界仍然极为常见。据估计,目前宫颈癌在全世界影响着超过140万女性,导致每年超过30万名女性的死亡,主要影响发展中国家(who.strategic advisory group of experts(sage)on immunization who.world health organization,2017;des,diaz m,等人,worldwide prevalence and genotype distribution of cervical human papillomavirus dna in women with normal cytology:ameta-analysis.lancet infect dis,第7卷,第453-459页,2007)。
5.在对于这种高死亡率负有责任的因素之中,疫苗的高成本和冷藏要求是最限制在发展中国家中施行大规模预防性免疫接种的因素,在发展中国家中发生大约87%的宫颈癌死亡(globocane.estimatedincidence,mortality and prevalence worldwide in 2012,v 1.0[internet,2012)。在私人诊所中,针对hpv的二价疫苗的价格为每剂大约200雷亚尔,而四价疫苗的价格为每剂大约300雷亚尔,每5至8年需要2至3个加强剂量(cianciarullo am.profilaxia contra opapilomavirus humano.rev.sodebras,第9卷,第100期,第8-15页,2014.在下述处可得:http://www.sodebras.com.br/edicoes/n100.pdf)。
[0006]
今天,用于预防宫颈癌的主要形式是进行定期细胞学检查、巴氏涂片以及青春期
前女孩和男孩的预防性疫苗接种。在巴西,对于9至14岁的男孩和女孩,以及对于带有hiv或aids生活的9至26岁男性和女性、接受了器官和骨髓移植的患者和处于针对癌症的治疗中的人,最近由卫生部通过sus(统一卫生系统)免费可获得四价的预防性疫苗(cianciarullo am.profilaxia contra o papilomavirus humano.rev.sodebras,第9卷,第100期,第8-15页,2014.在下述处可得:http://www.sodebras.com.br/edicoes/n100.pdf;inca.2017.在下述处可得:http://portalsaude.saude.gov.br)。
[0007]
老年人也可以使用该疫苗,但是所述疫苗仅在私人疫苗接种诊所中是可得的。它被指示用于9至45岁的女孩和女性,如果它是四价疫苗;或者大于9岁的任何年龄的女孩和妇女,如果它是二价疫苗;9至26岁的男孩和男性,用四价疫苗。另外,该疫苗可以被处于治疗中或已经具有hpv感染的人使用,因为它可以针对其他类型的hpv病毒进行保护,并且防止新的生殖器疣的形成和癌症的风险(参见cianciarullo am.profilaxia contra o papilomavirus humano.sodebras,第9卷,第100期,第8-15页,2014.在下述处可得:http://www.sodebras.com.br/edicoes/n100.pdf;inca.2017.在下述处可得:http://portalsaude.saude.gov.br)。
[0008]
但是,此类作用旨在预防hpv感染,因为还没有针对已经建立的感染和损伤的特异性治疗。在由hpv所表达的蛋白质之中,我们突出l2和e6,它们是这项工作的靶标。l2蛋白存在于病毒衣壳中并且在不同类型的hpv之间是保守的,而e6是一种能够诱导被感染的细胞的恶性转化的致癌蛋白。完整的病毒基因组是恶性建立所需要的(herrero r.,gonz
á
lez p,markowitz le.present status of human papillomavirus vaccine development and implementation.lancet oncol,第16卷,第e206-216页,2015;wang d,li z,xiao j等人,identification of broad-genotype hpv l2 neutralization site for pan-hpv vaccine development by a cross-neutralizing antibody.plos one,第10卷,第e0123944页,2015;vande pol sb,klingelhutza j.papillomavirus e6 oncoproteins.virology,第445卷,第115-137页,2013;kims,chungh,kongh等人,identification of novel immunogenic human papillomavirus type 16e7 specific epitopes restricted to hla-a*b33;03for cervical cancer immunotherapy.yonsei med j,第58卷,第43-50页,2017).
[0009]
由于简单性和低的生产成本,dna疫苗比传统疫苗更具优势,因为它是热稳定的而无需冷藏,因不存在针对载体的免疫应答而允许重复剂量,具有引发体液和细胞免疫的潜力,并且因为在人中是高度可耐受的[hancock g,hellner k,darrell l.therapeutic hpv vaccines.best practice&res clin obstet gynecol,2017.在下述处可得:https://doi.org/10.1016/j.bpobgyn.2017.09.008)。
[0010]
在2006年,由fda(食品和药物管理局)批准和发布了首个针对hpv的预防性疫苗,用于在美国销售。
[0011]
目前,市场上可得的和由fda和anvisa(国家卫生监督局)发布的针对hpv的三种疫苗只是预防性的。两者均基于当在vlp(病毒样颗粒)中进行结构化时赋予l1蛋白的免疫原性。
[0012]
第一种疫苗于2006年获得许可,它是四价的并且称为由merck sharp dohme生产,其中在酵母(酿酒酵母(saccharomyces cerevisae))细胞中表达hpv 6、
11、16和18的l1蛋白。
[0013]
第二种疫苗于2008年获得许可,它是二价的并且称为由glaxo smith kline生产,由hpv 16和18的l1蛋白(它们构成该疫苗并且在sf9系的昆虫细胞的培养物中表达)组成。
[0014]
第三种疫苗于2014年获得许可,它是九价的并且称为来自同名疫苗的相同制造商,但是用来自9种不同类型的hpv的l1颗粒进行配制:6、11、16、18、31、33、45、52和58(cdc
–
疾病控制与预防中心,在下述处可得:http://vwvw.cdc.gov/vaccines/hep/vis/vis-statements/hpv-gardasil-9.html)。
[0015]
目前可得的疫苗在诱导特异性抗体的产生方面是高度有效的,即它们仅是预防性质的,并且仅针对在疫苗制剂中所包含的病毒类型。一些研究表明,这样的抗体能够诱导小的针对被其他类型的hpv感染的交叉保护,但是还不能对抗引起生殖器疣和赘生物的广泛范围的不同类型的hpv。
[0016]
一篇提交给在biotechnology usp/instituto butantan/ipt的跨部门研究生计划的硕士论文(于2009年以bruna fel
í
cio m.m.porchia之名发表;题目为“用于由人乳头瘤病毒类型16引起的肿瘤的治疗性疫苗的开发(desenvolvimento de uma vacinapara tumores causados pelo v
í
rus papiloma humano tipo 16)”)描述了一种针对由hpv-16诱导的肿瘤的疫苗策略,其采用与疱疹病毒类型1(hsv-1)的糖蛋白d(gd)进行基因融合后获得的e7蛋白的重组形式。将在细菌系统中生成的gde7蛋白在小鼠中作为疫苗进行测试,其中它在小鼠中对于肿瘤生长赋予80%的预防性保护。当以治疗方式进行测试时,可溶性gde7能够保护30%的动物。
[0017]
所提及的硕士论文以及本技术均使用融合蛋白。但是,在所提及的硕士论文中所描述的融合蛋白完全不同于由本发明申请所公开的融合蛋白。
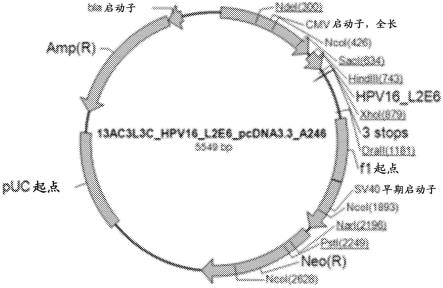
[0018]
以圣保罗大学(universidade depaulo-usp)和圣保罗州研究支持基金会(de amparopesquisa do estado depaulo-fapesp)之名于2010年8月18日提交并且于2012年5月2日公开的并且题目为“杂合蛋白、重组核酸序列、载体/质粒、药学和/或兽医学制剂以及其在控制由人乳头瘤病毒诱导的肿瘤和/或感染性或退行性疾病中的用途(prote
í
na h
í
brida,derecombinante,vetores/plasm
í
deos,deos,e/ou e seus usos no controle de tumores induzidos pelo v
í
rus do papiloma humano e/ouinfecciosas ou degenerativas)”的专利申请pi 10037497描述了一种非天然杂合蛋白,其通过人乳头瘤病毒类型16(hpv-16)的病毒癌蛋白e7与单纯疱疹病毒类型1(hsv-1)的糖蛋白d(gd)的经修饰的形式的基因融合而形成,在其信号肽中和在c-末端区域(包括牵涉锚定至细胞质膜的序列(相应于氨基酸序列320至344))中有缺失;编码所述重组蛋白质的重组核酸序列(seq id no:1和seq id no:2);包含所述重组序列的载体/质粒;以及包含所述杂合蛋白和/或编码所述蛋白质的重组序列的药学和/或兽医学制剂,优选地以疫苗的形式。另外,所提及的专利申请旨在遗传构建物的用途,用作对于其他抗原的疫苗佐剂,和/或在制备被指定用于控制由人乳头瘤病毒
诱导的肿瘤和疱疹病毒感染的药学和/或兽医学制剂中用作活性成分。
[0019]
专利申请pi 10037497以及本专利均公开了针对hpv的疫苗。但是,在专利申请pi 10037497中所描述的遗传构建物完全不同于由本技术所公开的融合蛋白。
[0020]
以cantab pharmaceuticals research limited之名于1996年7月29日提交并且于1999年7月20日公开的并且题目为“多肽或多肽组合物,适合于通过注射进行施用的免疫原性组合物,以及多肽或免疫原性组合物的用途(polipept
í
deo oude polipept
í
deo,deo,adequada para pore,uso de polipept
í
deo ou dede)”的专利申请pi 9612675-2描述了包含源自乳头瘤病毒的抗原的融合多肽和多肽聚集体,以及其组合物和其用途,例如与用于疫苗和免疫原性目的的佐剂一起在生成例如hpv-特异性免疫应答中的用途。可以纯化所述多肽以导致当在溶液或分散体中时可以通过灭菌过滤器的聚集体,和导致无定形聚集体。这样的多肽的一个例子为人乳头瘤病毒的l2和e7蛋白的融合蛋白。
[0021]
除了l2的融合过程和使用外,专利申请pi 9612675-2还描述了一种与本发明申请完全不同的治疗提议。专利申请pi 9612675-2开发出了一种用hpv-6(非致癌的)的l2和e7的免疫疗法,用于对抗生殖器疣;而本技术给出了hpv-16(致癌的)的l2和e6,用于预防和治疗宫颈癌和与致癌性hpv相关的其他癌症。
[0022]
以deutsches krebsforschungszentrum(dkfz)之名于2017年12月14日提交的并且题目为“hpv l2肽免疫原性的改善(improvement of hpv l2 peptide immunogenicity)”的国际专利申请wo 2017/211886涉及免疫原性多肽,其包含多个相应于hpv16的l2多肽的氨基酸20至50的人乳头瘤病毒(hpv)l2n-末端肽,其中所述hpv l2 n-末端肽是来自至少两种不同hpv基因型的l2-n-末端肽。所述国际专利申请wo 2017/211886还涉及用于在医学中使用和用于在针对hpv感染的疫苗接种中使用的所述免疫原性多肽。另外,国际专利申请wo 2017/211886涉及编码所述免疫原性多肽的多核苷酸和包含其的宿主细胞。
[0023]
如可以观察到的,国际专利申请wo 2017/211886以及搜索目标均公开了针对hpv的疫苗。但是,在国际专利申请wo 2017/211886中所描述的遗传构建物完全不同于由本发明申请所公开的融合蛋白。
[0024]
以deutsches krebsforschungszentrum stiftung desrechts和ipk,institutpflanzengenetik und kulturpflanzenforschung之名于2001年9月19日提交并且于2002年5月16日公开的并且题目为“编码经优化的真核hpv 16-l1和hpv 16-l2的dna序列(dna sequences,which code for optimised eukaryotic hpv 16-l1 and hpv 16-l2)”的国际专利申请wo 2002/38769涉及以就密码子使用进行了优化的dna序列,其编码hpv 16-l1衣壳蛋白或hpv 16-l2衣壳蛋白。所述dna序列包含在图5、6或7中所图解说明的dna序列或者其片段或变体,并且允许以高产量简单地重组产生hpv 16-l1或hpv 16-l2衣壳蛋白或其片段,而无需使用病毒载体。所述衣壳蛋白优选地用于生产疫苗。
[0025]
国际专利申请wo 2002/38769以及本技术均公开了针对hpv的疫苗。但是,在国际专利申请wo 2002/38769中所描述的遗传构建物公开了hpv 16-l1衣壳蛋白或hpv 16-l2衣壳蛋白,而本技术公开了l2/e6融合蛋白,其完全不同于由国际专利申请wo 2002/38769所公开的构建物。
[0026]
如可以观察到的,没有一篇现有技术文献描述或甚至建议用于人使用的针对hpv和与该病毒相关的癌症的治疗性疫苗。针对损伤和hpv-阳性癌症所使用的现有技术的治疗不是特异性的,并且依赖于损伤的程度。它们通常牵涉用具有细胞毒性作用的化学物质进行治疗,化学/物理/电烧灼,外科手术,放射疗法,化学疗法,或者治疗组合,其是高度侵袭性的、攻击性的和常常致残毁的。
[0027]
发明概述
[0028]
为了解决上面提及的问题,本发明将会提供相关于杂合重组蛋白l2/e6的使用而言显著的优点,因此其与诱导特异性细胞因子例如tnf和具有抗-l2和抗-e6作用的特异性抗体的产生的效果一起而产生,从而有效地对抗表达e6蛋白的被hpv转化的细胞(癌性的或肿瘤的)(治疗效应)而不干扰机体的健康细胞(组织特异的趋向性),以及新的通过hpv的机会性病毒感染(广谱预防效应)。因此,它不产生副作用,从而使得能够提高其性能并且给出更有利的成本/效益比。
[0029]
本发明涉及针对hpv和与该病毒相关的癌症的预防性和治疗性疫苗的开发,该疫苗旨在发展出了癌症的被hpv感染的人。本发明涉及dna表达载体,其能够有效地产生hpv16病毒的衣壳蛋白l2,以及还有与人乳头瘤病毒的肿瘤相关的病毒癌蛋白e6。
[0030]
特别地,本发明涉及通过基因克隆到表达载体中来获得重组的融合或杂合蛋白,其通过经由将一个或多个基因的核酸调控序列与一个或多个基因的蛋白质编码序列相组合而形成的融合基因的基因翻译来产生,其用于生成针对hpv的免疫应答。
[0031]
特别地,本发明提供了hpv16 l2和e6的氨基酸序列的融合物,其仅包含免疫原性表位(所选择的肽)而非整个基因,这是使得该致癌蛋白的恶性细胞转化活性(致癌作用)失能的事实,从而为l2/e6融合物赋予了安全性。另外,这些融合物保持或增加了l2和e6的免疫原性功效。考虑到更复杂的重组蛋白质的产生应当在真核表达系统(哺乳动物细胞)中进行,如本文中的情况那样,以克服原核系统(细菌)(其意味着不进行对于所表达的异源蛋白质的功能效率来说必需的某些翻译后修饰(例如,糖基化))的缺点,生物活性也可以不同于天然蛋白质;细菌具有高的内毒素含量;缺乏分泌机制;并且仍然出现内含体的形成,其更正意味着产物的最终成本的增加。
[0032]
本发明的如此产生的杂合重组蛋白l2/e6具有诱导细胞因子以及具有抗-l2和抗-e6作用的特异性抗体的产生的效应,从而有效地对抗表达e6蛋白的被hpv转化的细胞(癌性的或肿瘤的)(治疗效应)而不干扰机体的健康细胞(组织特异的趋向性),以及新的通过hpv的机会性病毒感染(广谱预防效应)。因此,它不产生副作用。
[0033]
由本发明所开发的疫苗,pcdna3.3/l2e6,已表明在下列方面是有效的:诱导持久的体液免疫应答,其能够以渐增方式和在整个实验期(49天)期间刺激抗-l2和抗-e6特异性抗体的产生,以及激活细胞免疫应答,从而对抗肿瘤细胞并且诱导细胞因子tnf的表达。
[0034]
因此,值得注意的是,本发明的疫苗不仅诱导产生针对hpv的特异性抗体的产生(预防作用),而且还诱导细胞因子的产生,如通过实验所证明的。细胞因子对于证明还存在
细胞应答的诱导是重要的,细胞应答负责对抗肿瘤细胞(治疗作用)。这是本工作相对于在本文中所呈现的其他工作的主要差别,因为那些工作仅诱导经由抗体的应答。
[0035]
迄今为止,世界上还没有被批准用于人使用的针对hpv和与该病毒相关的癌症的治疗性疫苗。dna疫苗是稳定的,容易生产、运输和储存,因为它们是热稳定的并且不需要冷藏。它们能够维持目的基因的表达,通过i类mhc来促进抗原呈递,并且允许重复剂量的施用,而不导致产生针对该疫苗的中和抗体。相比于其他疫苗而言,成本也是非常低的。它们不需要佐剂来保证其功能效率,并且它们在人中是高度可耐受的。
[0036]
本发明的疫苗通过遗传工程技术来获得:重组dna技术、基因克隆和重组蛋白质的基因表达。进行包含从hpv16的l2和e6蛋白中选择的肽的疫苗载体的构建,这些肽在哺乳动物细胞中进行表达。所述疫苗载体的扩增在大肠杆菌(escherichia coli)dh5α的细菌培养物中进行。在人上皮细胞系中和在鼠类模型中测试该载体的表达,在这种情况下以在预防或治疗模型中评价所述疫苗的功效,其中小鼠在用tc-1谱系的肿瘤细胞进行攻击之前或之后接受所述疫苗。
[0037]
在hek 293t和293f细胞中的l2e6蛋白的表达检定证明了所述载体在产生重组蛋白质中的功效,如在间接免疫荧光测定法和western印迹法中所证明的。
[0038]
在动物模型中的检定已经证明,所述疫苗能够诱导抗-l2和抗-e6特异性抗体的产生,如在elisa中所测试的,以及诱导细胞因子tnf的产生,如通过在流式细胞仪中的测定法所证明的。
[0039]
附图简述
[0040]
通过参考附图和下面的描述可以更好地理解本发明的结构和操作,以及其另外的优点:
[0041]
图1显示了表达载体的构建图谱。将l2e6插入片段插入到载体pcdna3.3中,侧翼为内切核酸酶位点hind iii和nhe i,从而被称为pcdna3.3/l2e6。所构建的质粒具有细菌复制起点puc、卡那霉素抗性基因amp(r)和cmv(巨细胞病毒)启动子。为了载体分析,在0.5x tae缓冲液(40mm tris,乙酸盐20mm,edta 1mm)中在0.8%(m/v)琼脂糖凝胶上进行电泳测定法,并且经历在blue green上样染料(lgc biotecnologia,cotia,sp,brazil)存在下的80v电泳走样。
[0042]
图2显示了经历了电泳以选择包含载体pcdna3.3/l2e6的菌落的琼脂糖凝胶的照片文件。
[0043]
图3显示了用表达重组l2蛋白的载体pcdna3.3/l2e6转染的细胞(绿色-b),细胞核通过pi来显现(红色-c),和在(a)中,图像(b)和(c)的叠加。
[0044]
图4显示了在间接免疫荧光测定法中,在用pcdna3.3/l2e6转染的293f细胞中的e6表达(绿色-a)。在(b)中,可以观察到通过pi试剂来显现的细胞核(红色)。在(c)中,图像(a)和(b)的叠加。
[0045]
图5显示了从用于检测和表征重组蛋白l2e6的western印迹测定法中获得的结果的照片文件,其中样品(1)和(5)为未转染的细胞的裂解物的等分试样;样品(2)和(6)为经转染并且表达l2e6的细胞的裂解物;样品(3)和(7)为从凝胶过滤色谱法测定法中获得的并且与抗-l2(3)和抗-e6(7)特异性单克隆抗体相互作用的洗脱出的中间体,这证明了被这两种商业抗体识别的低分子量蛋白质的存在;样品(4)为来自凝胶过滤过程的最终洗脱样品。
(mm)color burst
tm
分子量标准参照物。
[0046]
图6显示了在dna疫苗的预防评价测定法中动物称重的图。
[0047]
图7显示了在用dna疫苗事先进行免疫接种的动物中tc-1细胞的肿瘤体积的图。
[0048]
图8显示了来自本发明的dna疫苗的治疗研究的动物体重的图。
[0049]
图9显示了在用本发明的dna疫苗进行治疗后肿瘤体积的图。
[0050]
图10显示了通过elisa的抗-l2抗体检测测定法,其中包括在最后一个实验日(49天)从动物获得的血清样品的反应性的图,其证明了所有用疫苗pcdna3.3/l2e6进行免疫接种的动物都产生了特异性抗-l2抗体,如通过elisa测定法所检测的(截止=0.0636)。
[0051]
图11显示了通过elisa的抗-e6抗体检测测定法,其中包括在最后一个实验日(49天)从动物获得的血清样品的图,其证明了在实验结束时所有经免疫接种的动物都产生了的抗-e6抗体的反应性(截止=0.0675)。
[0052]
发明详述
[0053]
虽然本发明可能易受不同实施方案的影响,但是在附图中和在下面的详细讨论中显示了优选的实施方案,应当理解本实施方案应当被认为是本发明的原理的一个示例,而并不意欲将本发明限制于在本报告中所举例说明或描述的那些。
[0054]
本发明涉及疫苗,其能够以广谱保护作用针对hpv病毒感染进行保护,以及对抗已经被所述病毒修饰的细胞。特别地,本发明涉及通过基因克隆到表达载体中来获得重组的融合或杂合蛋白,其通过经由将一个或多个基因的核酸调控序列与一个或多个基因的蛋白质编码序列相组合而形成的融合基因的基因翻译来产生,其用于生成针对hpv的免疫应答。特别地,本发明提供了hpv16 l2和e6的氨基酸序列的融合物,其仅包含免疫原性表位,这是使得该致癌蛋白的转化活性失能的事实,从而为l2/e6融合物赋予了安全性。另外,这些融合物保持或增加了l2和e6的免疫原性功效。
[0055]
虽然体液免疫应答具有重要的预防效用,但是数条证据暗示由细胞介导的免疫应答在癌前损伤的消退和感染的消除中发挥关键作用,具有高度的治疗重要性。首先,高风险hpv的持续感染和侵袭前损伤在免疫抑制状态(例如,未治疗的hiv感染,或者接受移植后抗排斥疗法)下是显著地更频繁的。
[0056]
据报道,高程度的cin(宫颈上皮内赘生物)的自发消退与由细胞介导的免疫应答相关。退行损伤典型地被对于病毒癌蛋白e6和e7来说特异的cd8 t细胞所浸润。
[0057]
另外,在cin消退后的个体中检测到对于e2(一种关键的转录调节子)的cd4 t细胞应答。还报道了在间质中cd4:cd8比例的增加。相反地,在持续性和/或进行性cin损伤中存在cd4 t细胞数目的减少。在持续的hpv感染中也发现了调节t细胞(treg),其中频率随生殖器疣的大小而增加。
[0058]
在施用后,编码杂合蛋白l2/e6的dna疫苗将会在患者的组织中表达它们。如此产生的杂合重组蛋白l2/e6具有诱导细胞因子以及具有抗-l2和抗-e6作用的特异性抗体的产生的效应,从而有效地对抗表达e6蛋白的被hpv转化的细胞(癌性的或肿瘤的)(治疗效应)而不干扰机体的健康细胞(组织特异的趋向性),以及新的通过hpv的机会性病毒感染(广谱预防效应)。因此,它不产生副作用。
[0059]
1.表位的选择和载体的构建
[0060]
hpv16的l2和e6基因的序列获得自国际数据库genbank(r),其中所使用的e6基因
的登录码为aad33252和l2的登录参考号为nc_001526.2。从完整基因的序列开始,按照它们诱导免疫应答的能力来选择肽序列,如在其他工作中所描述的。
[0061]
从e6基因开始选择的肽在氨基酸残基50至57(ydfafrdl)(seq id no:5)之间,其负责通过激活细胞毒性t淋巴细胞来诱导细胞免疫应答。
[0062]
为了其在人细胞中的表达的更大成功,通过使用idt-integrated dna technology的密码子优化工具来对密码子进行优化,所获得的最终序列为tatgatttcgccttcagggacctc(seq id no:4)。
[0063]
对于l2基因,所选择的肽位于氨基酸残基17至36(qlyktckqagtcppdiipkv)(seq id no:2)之间,其中该序列如上面所描述的那样进行优化,从而导致:cagctgtataaaacttgtaagcaggccggtacgtgccccccagatatcattccaaaggtc(seq id no:3)。
[0064]
这两个序列通过3个“连接体”序列连接起来,从而导致96bp(碱基对)的序列,向其添加起始和终止序列,从而产生102bp的下述序列:atg cag ctg tat aaa acc tgt aaa cag gca ggt aca tgt ccg ccg gat att att ccg aaa gtt ggt ggt agc ggc tat gat ttt gcc ttt cgc gat ctg taa(seq id no:1)。最终序列由gene art
tm
公司(thermo fisher scientific)合成,从而产生称为l2e6的合成基因。
[0065]
2.载体的构建
[0066]
设计2种包含合成基因l2e6的载体并且由gene art
tm
公司(thermo fisher scientific)开发,其为基于商业载体pmat(thermo fisher scientific)的克隆载体,和在pcdna(thermo fisher scientific)中的表达载体或疫苗载体,它们将会在下面更好地进行描述。
[0067]
为了构建所述克隆载体,将合成基因l2e6插入到pma-t中,其中所述合成基因和所述载体的两个末端的侧翼为内切核酸酶sfi i的序列(thermo fisher scientific)。
[0068]
称为pma-t/l2e6的载体具有细菌复制起点col e1和卡那霉素抗性基因ampr。完整载体具有2494bp。
[0069]
为了构建表达载体,将l2e6插入片段插入到载体pcdna3.3中,侧翼为内切核酸酶位点hind iii和nhe i,从而被称为pcdna3.3/l2e6。所构建的质粒具有细菌复制起点puc、卡那霉素抗性基因amp(r)和cmv(巨细胞病毒)启动子。
[0070]
为了载体分析,在0.5x tae缓冲液(40mm tris,乙酸盐20mm,edta 1mm)中在0.8%(m/v)琼脂糖凝胶上进行电泳测定法,并且经历在blue green上样染料(lgc biotecnologia,cotia,sp,brazil)存在下的80v电泳走样。
[0071]
3.细菌的化学感受态
[0072]
为了扩增所述载体,使用大肠杆菌细菌菌株dh5a和top10。将所述细菌菌株在37℃下在以250rpm的摇动下在3ml的luria-bertani(lb)培养基(2%胰蛋白胨,1%酵母提取物,1%nacl)中培养大约18小时。
[0073]
然后,将该培养物的等分试样在包含加有1.5%琼脂的lb培养基的培养皿中进行划线,在37℃下温育大约18小时。
[0074]
次日,选择一个菌落以接种3ml的lb培养基并且将其在与上面所描述的相同的条件下进行培养。在该时间段后,使用1ml的该培养物来接种100ml的lb培养基并且在37℃下在摇动下进行培养直至在600nm下所述培养物的光密度(od600)达到0.4,其中所培养的细
菌处于指数生长期的中间。
[0075]
感受态的诱导按照由sambrook等人(2001)所建立的实验方案来进行,其中在达到所希望的细胞密度后,将细菌培养物转移至锥形管并且以5000xg离心10分钟并且在0.1m cacl2溶液中在冰上温育1小时。然后,将细菌再次进行离心并且重悬浮在加有10%甘油(w/v)的0.1m cacl2溶液中。
[0076]
将200μl的等分试样冷冻于-80℃直至使用。
[0077]
4.细菌转化
[0078]
从上面所描述的感受态细菌开始进行细菌转化,其中将10μl的大约15g的质粒dna和化学感受态细菌的等分试样的混合物在冰上温育30分钟,经历在42℃下的热休克2分钟,并且再次在冰上温育5分钟。然后,添加350μl的s.o.c培养基(2%胰蛋白胨,0.5%酵母提取物,10mm nacl,2.5mm kcl,10mm mgcl2,10mm mgso4,20mm葡萄糖),将混合物在37℃下在250rpm的摇动下温育90分钟。然后,将经转化的细菌接种在包含或不包含100μg/ml卡那霉素的lb-琼脂培养基平板中并且在37℃下温育18小时。
[0079]
在包含卡那霉素的lb-琼脂培养基平板上生长出的菌落鉴定了通过菌落pcr而选择出的阳性克隆,并且将其接种在包含3ml的lb培养基的管中,在37℃下在摇动下温育大约18小时。
[0080]
5.细菌菌落的选择
[0081]
为了在转化后选择细菌菌落,使用菌落pcr技术,其中通过使用从l2e6基因序列开始合成的特异性引物,设计2种引物,eak03和eak02,并且由exxtend biotecnologia ltda公司(campinas,sp,brazil)合成,它们能够生成144bp的产物。所述引物的序列可以在下面看到。
[0082]
eak03-cccyyaagcttgccaccatgcagc(seq id no:6)
[0083]
eak02-gagtgtctagatgccacgct(seq id no:7)
[0084]
将所述引物以100μm的贮备浓度重悬浮在te缓冲液(10mm tris/hcl,1mm edta)中。
[0085]
对于pcr,在微量管中分开地制备每种溶液,所述微量管包含25μl的pcr-mix溶液(1.5mm mgcl2,0.5u taq,5m dntps 200-lgc biotecnologia,cotia,sp,brazil)、0.5μl的25μm的每种引物和超纯水,以达到50μl的最终溶液体积。作为模板dna,使用每个经转化的细菌菌落的样品,在具有卡那霉素的lb培养基中进行选择和生长。在mastercycler epgradient热循环仪(eppendorf,germany)中按照下述实验方案进行扩增:95℃5分钟,在95℃下1分钟、在56℃下30秒和在72℃下1分钟的25个循环,随后为在72℃下7分钟的最终延伸。
[0086]
pcr产物的检测通过在0.5x tae缓冲液中在0.8%琼脂糖凝胶中的电泳来进行。通过添加0.5μl的blue green上样染料i来制备样品并且使其经历在80a下的走样30分钟。作为片段大小的参数,使用2种分子量标准参照物,即包含8个10000bp至100bp的片段的通用标准参照物(lgc biotecnologia)和包含12个1000bp至50bp的片段的第二50bp dna ladder标准参照物(lgc biotecnologia)。将所述凝胶在高效能紫外透照仪(high perfomance ultraviolet translluminator)(uvp ultraviolet products,upland,usa)中进行分析,并且在照片文件处理器alliance 9.7(uvitec cambridge,cambridge,
england)中捕捉图像。
[0087]
6.质粒dna的提取
[0088]
将通过菌落pcr而选择出的阳性克隆在5ml的lb培养基中在选择抗生素存在下在37℃下在摇动下培养大约18小时。次日,在环境温度下以12000xg离心1分钟以沉降出完整细菌。为了纯化质粒dna,使用genejet plasmid miniprep试剂盒(thermo fisher scientific),其基于与对于环状dna的选择性结合柱相组合的碱裂解程序,按照制造商的说明书来进行。将经纯化的dna在0.5x tae缓冲液中在0.8%琼脂糖凝胶中进行分析并且经历测序技术以确证目的基因插入到载体中,在分光光度计(actgene,new jersey,usa)中进行定量,并且贮存于-20℃。
[0089]
7.dna测序
[0090]
对质粒dna样品进行测序以确证l2e6基因的正确插入及其完整性。为此,通过分光光度法来定量如在前期所描述的那样从凝胶中纯化出的dna样品。等分出5μl质粒的体积并且添加2.5μl的浓度为5μm的eak03引物。将样品送至圣保罗大学的人类基因组中心,其中在设备abi 3730dna分析仪(thermo fisher scientific)上进行测序反应。
[0091]
8.细胞系和培养条件
[0092]
原则上,为了验证载体pcdna3.3/l2e6的表达,对于hek293t细胞进行转染过程,所述hek293t细胞在补充有10%的胎牛血清(fbs,cultilab,campinas,sp,brazil)的dulbecco改良的eagle培养基(dmem,cultilab,campinas,sp,brazil)d10中进行培养,保持在包含5%co2的潮湿气氛中,直至达到50-80%汇合。每3或4天进行再植。
[0093]
一种被选择用于大规模表达重组蛋白质的细胞系为293f,freestyle
tm 293expression system(life techonologies
tm
),其是为了允许在成分确定的和无血清的培养基中悬浮的细胞的大规模转染而开发的。
[0094]
将293f细胞在30ml的在无菌玻璃瓶中的freestyle
tm 293expression medium培养基(life technologies
tm
)之中,在37℃和5%co2下,在潮湿气氛中,在以大约135rpm的旋转摇动下进行培养。每3或4天进行细胞再植,以大约2-3
×
106个活细胞/ml的细胞密度,其中将细胞转移至锥形管并且以800rpm离心5分钟。然后,分析细胞生存力,并且在新鲜的预热的培养基中将细胞稀释至3
×
105个活细胞/ml的最终细胞密度。
[0095]
为了测定细胞生存力,使用通过锥虫蓝(在pbs中的0.4%)的排除法和在neubauer室中的计数。
[0096]
9.细胞转染
[0097]
按照制造商的说明书,使用转染试剂transfection reagents(emd biosciences/merck,darmstadt,germany)通过脂质转染法来进行hek 293t细胞的瞬时转染测定法。简而言之,将所述转染试剂通过涡旋振荡与dmem培养基的等分试样相混合,在环境温度下温育5分钟。以合适的比例向混合物添加目的质粒dna,轻轻地均质化,并且在环境温度下温育15分钟。然后,将培养基/转染试剂/dna这一混合物添加至细胞与完全培养基,并且在恒温箱中在37℃和5%co2下进行温育。在8小时后更换培养基,现在用包含抗生素和10%fbs的完全培养基。当收集细胞并且以免疫荧光和在sds-page电泳凝胶中进行分析(这将会在后面的主题中进行描述)时,温育持续了大约48小时。
[0098]
对于293f细胞,转染测定法按照制造商的说明书通过使用转染试剂293fectin来
进行。
[0099]
在转染的前一天,测定并且调整活293f细胞的细胞密度。在28ml的freestyle
tm expression medium培养基中添加7
×
105个细胞,在上面所描述的条件下进行培养。
[0100]
次日,将一个小等分试样的细胞培养物转移至微量管以测定细胞生存率,其应当保持在90%左右。为了转染3
×
107个活细胞,在不同的无菌锥形管中制备两种溶液:
[0101]
管1-在具有培养基的1ml的最终体积中的30μg的pcdna3.3/l2e6质粒dna,轻轻地均质化;
[0102]
管2-在具有培养基的1ml的最终体积中的60μl的293fectin
tm
,轻轻地混合并且在环境温度下温育5分钟。
[0103]
然后,将上面所描述的管1和2的内容物轻轻地混合,从而导致2ml的溶液,将其在环境温度下温育30分钟,以允许质粒dna与试剂形成复合物。
[0104]
在温育复合物的同时,将在培养物中的细胞在锥形管中以800rpm离心5分钟,其中用28ml的新鲜的、预热的freestyle
tm expression medium培养基替换在培养物中的培养基。
[0105]
最后,向28ml的培养基和处于悬浮中的细胞添加2ml的复合物,总共30ml的用于转染的溶液,将其在37℃和5%co2下,在潮湿气氛中,在定轨摇床中以大约125rpm的摇动下温育48小时。
[0106]
10.重组蛋白质的表达和表征
[0107]
10.1.蛋白质的细胞内表达
[0108]
在转染后,分离出所述细胞的等分试样用于通过免疫荧光测定法来分析细胞内重组蛋白质的表达。
[0109]
将hek 293t细胞在12-孔培养平板中在直径为13mm的圆形盖玻片上进行培养。将容易粘附的株系直接在盖玻片上在d10培养基中进行培养,保持在包含5%co2的潮湿气氛中大约18小时。次日,按照在前面条目中所描述的那样进行细胞转染测定法。
[0110]
对于使用如上面所描述的那样已经转染的293f细胞的测定法,将所述细胞在微量管中进行离心并且弃去上清液。
[0111]
在转染后,将这两个细胞系都在pbs中洗涤2次并且在1%的在pbs中的低聚甲醛溶液中在4℃下固定1小时。在连续洗涤以去除所有固定剂后,将所述细胞在pbs 5%bsa溶液中进行温育以封阻非特异性结合并且在环境温度下温育1小时。然后,将细胞在pbs中洗涤3次,并随后与在pbs中的0.5%bsa和0.05%tween 20之中进行稀释的特异性的抗-hpv16 l2或抗-hpv16 e6一抗一起在环境温度下温育1小时,期间频繁地摇动管。在重新洗涤后,将细胞与在pbs中的1.5%bsa和0.01%tween 20之中进行稀释的各自的特异性二抗一起在环境温度下温育1小时,期间频繁地摇动包含细胞和具有抗体的溶液的管。所使用的二抗为在山羊中产生的抗-小鼠igg488(molecularor)和在山羊中产生的抗-兔igg633。在最后一次在pbs中洗涤后,将293f细胞散布在用在pbs中的0.5%聚-l-赖氨酸包被的玻璃盖玻片上。
[0112]
最后,将包含hek 293t或293f细胞的盖玻片用包含表明核酸的存在和位置的碘化
丙锭(pi-molecularor)的mowiol(calbiochem,ca,usa)封固在载玻片上。
[0113]
将所述制备物避光保持在4℃下,直至在zeiss lsm 510meta激光扫描共聚焦显微镜中对其进行分析之时。
[0114]
10.2.重组蛋白质表达的分析
[0115]
在每个转染反应后,将细胞在缓冲液(0.5m tris ph 7.4,0.5m nacl,0.5m edta ph 8.0,0.2m egta,triton x-100,蛋白酶抑制剂混合物)中进行裂解,以10,000xg离心5分钟,弃去沉淀物,并且将上清液贮存于-20℃直至使用之时。
[0116]
为了确证转染,以更快速和更简单的方式通过斑点印迹测定法来分析细胞裂解物的样品。因此,将10μl的样品暴露于硝酸纤维素膜条(bio-rad laboratories,inc.)。在干燥后,将所述条在包含在pbst中的5%脱脂奶粉的溶液之中在摇动下在环境温度下温育1小时。然后,将所述膜条在pbst中洗涤4次10分钟,并且与在pbst中的1%脱脂奶粉中进行稀释的抗-hpv16 l2(santa cruz biotechnology,inc.)或抗-hpv16/18e6单克隆抗体一起在环境温度下在摇动下温育1小时。然后,将所述膜条在pbst中再次洗涤10分钟,4次,并且在pbst和1%脱脂奶粉中进行稀释的缀合有辣根过氧化物酶的抗-小鼠igg二抗之中在摇动下在环境温度下再温育1小时。然后,将样品在pbst中再洗涤4次(10分钟),并且通过底物溶液dab(二氨基联苯胺)-过氧化物酶(0.05%dab,0.015%h2o2,0.01m pbs,ph 7.2)来进行揭示,其在环境温度下在摇动和避光下温育直至10分钟。
[0117]
将在斑点印迹测定法中的阳性样品随后用于通过western印迹测定法来进行的重组蛋白质的表达分析。为此,制备16%的tricine-sds-page凝胶(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)并且经历在变性条件下的电泳分离(30v,300分钟),其包含在走样缓冲液中进行稀释的经转染的细胞的裂解物样品。然后,将凝胶在考马斯蓝溶液(7%乙酸,50%甲醇,0.1%考马斯亮蓝r-250)中进行染色,或者将蛋白质转移至硝酸纤维素膜以用于进行western印迹测定法。在4℃下在转移缓冲液(0.025m tris,0.192m甘氨酸,20%甲醇)中进行电泳转移(30v和15ma进行18小时,或者70v和35ma进行2小时)后,将膜在包含丽春红临时染料的溶液(0.1%丽春红s,5%乙酸)中进行染色以确证分子量指示物的转移和标记。然后,将膜在蒸馏水中进行洗涤以去除临时染色,并且在包含在pbst(0.05%tween 20,pbs)中进行稀释的5%脱脂奶粉的溶液中在环境温度下在摇动下温育1小时。在该时段后,将膜在pbst中洗涤4次并且与包含单克隆的抗-hpv16 l2一抗、在兔中产生的多克隆的抗-hpv16 l2一抗(由r.b.s.roden博士教授,john hopkins school of medicine,usa好意提供)和/或抗-hpv16 e6一抗的在pbst中的1%脱脂奶粉溶液一起在环境温度下在摇动下温育2小时。然后,将膜再次在pbst中洗涤4次并且在包含缀合有辣根过氧化物酶的各自的抗-小鼠igg或抗-兔igg二抗的溶液中在环境温度下在摇动下温育2小时,所述二抗处于在pbst中的1%脱脂奶粉溶液之中。通过使用ecl hrp化学发光底物试剂试剂盒(invitrogen)在对绿光敏感的胶片(kodak)上检测所述反应。
[0118]
11.蛋白质分析
[0119]
在最适合于分离1至100kd的蛋白质的16%的tricine-sds-page电泳凝胶(schagger,2006)中分析细胞裂解物样品。
[0120]
为此,首先制备16%的分离凝胶,其中将ab-6缓冲液(46.5g丙烯酰胺,3g双丙烯酰胺)在凝胶缓冲液(3m tris,1m hc1,0.3%sds,ph 8.45)加10%pa[(nh4)2s2o8]和temed[(ch3)2nch2ch2n(ch3)2]中进行稀释。快速地将凝胶放置在仪器中以进行聚合。然后,制备10%的新的分离凝胶,其中使用ab-3缓冲液(48g丙烯酰胺,1.5g双丙烯酰胺),其在相同的凝胶缓冲液、水、10%pa和temed中进行稀释。在制备后,将10%的凝胶小心地放置在16%的凝胶上。最后,制备堆叠的凝胶,其中将ab-3缓冲液在凝胶缓冲液、水、10%pa和temed中稀释至4%的最终浓度。
[0121]
对蛋白质样品进行定量,并且调整其浓度从而使得使每个样品包含大约15μg的蛋白质。按照制造商的说明书,通过使用bradford方法(bio-rad laboratories inc.)来进行蛋白质含量测定,因此,将样品在样品缓冲液(1m tris-cl ph 6.8,0.8%sds,0.1%溴酚蓝,40%甘油,14.4mβ-巯基乙醇)中进行稀释并且最后经历在tris-tricine缓冲液(0.1m tris;0.1m tricine;0.1%sds,ph 8.5)中的电泳分离(30v,300分钟)。在分离后,将凝胶用考马斯蓝溶液进行染色。
[0122]
12.肽的合成
[0123]
为了用作在本研究中所设计的肽的阳性对照,从fastbio ltda.公司(preto,sp)请求合成肽l2(pep2)和e6(pep1)。
[0124]
pep1是指从hpv16的e6蛋白中选择的肽,其序列为ydfafrdl,包含8个氨基酸并且纯度》85%。
[0125]
从hpv16的l2蛋白中选择的pep2具有序列lyktckqagtcppdiipkv,其具有19个氨基酸并且纯度》85%。
[0126]
所述肽以冻干形式收到,并且将其以5mg/ml的浓度重悬浮在超纯水中。
[0127]
13.tc-1肿瘤细胞的培养
[0128]
用hpv16的e6和e7基因转导c57bl/6小鼠的肺的原代细胞,然后用经激活的人c-has-ras基因再次转导所述无限增殖化细胞,从而生成表达hpv16的e6和e7蛋白的稳定的经转化的细胞系tc-1,其能够在具有相同遗传背景的小鼠中生成实体肿瘤(lin,1996)。
[0129]
将tc-1细胞在75cm2的聚苯乙烯瓶(tpp-tpp techno plastic products ag,switzerland)中在37℃和5%co2下在补充有10%胎牛血清(fbs)(cultilab,campinas,sp,brazil)的rpmi培养基(cultilab,campinas,sp,brazil)中进行培养。将细胞再植,或者每3或4天更换培养基。对于再植,使用250mg%的胰蛋白酶/edta溶液(cultilab)来去除附着至培养瓶底部的细胞,将其在37℃下温育直至15分钟。然后,将细胞在4℃下以800
×
g下离心15分钟。弃去上清液,并且将细胞重悬浮在新的培养基中。为了长期贮存细胞系,在液氮中,将细胞的等分试样贮存在包含10%fbs加10%dmso的rpmi培养基的溶液中。
[0130]
14.体内实验
[0131]
为了评价使用所构建的载体作为疫苗载体的可能性(因为所选择的质粒pcdna也允许这样的用途),进行体内测定法。
[0132]
对于动物中的测定法,本发明由butantan institute的动物使用伦理学委员会在实验方案号923/12之下进行了分析和批准。
[0133]
将平均体重为20g、由butantan institute的动物饲养所提供的、4至8周龄的雄性c57bl/6小鼠分为4个组(每组包含10只动物),维持在具有自由获取的食物和水以及受控的
光周期的动物饲养所。
[0134]
在实验之前和整个实验期间,每周对动物进行称重。
[0135]
14.1.预防评价
[0136]
选择两个具有4或6只动物的组用于对所提出的dna疫苗进行预防评价。
[0137]
第一组(称为组i,包含4只动物)在第一剂(第1天)和第二剂(第14天)之间以14天的间隔,和在第二剂和第三剂(第21天)之间以7天的间隔,以3剂接受50μl的肌内pbs溶液。
[0138]
构成组ii的另外6只动物以渐降的浓度接受3剂的在pbs溶液中的疫苗构建体pcdna3.3/l2e6。第一剂在第1天进行,并且动物接受50μg的dna疫苗。第二剂在14天后以20μg的浓度进行施用,而第三即最后一剂具有5μg的疫苗载体的浓度,在前一剂后7天应用。
[0139]
所述疫苗在后腿的胫前肌中以肌内方式进行施用,并且所述剂量在左和右后腿之间交替施用。所接种的体积从不超过50μl的溶液。
[0140]
在最后一剂之后七天(第28天),在每只动物的左背外侧区域中通过皮下途径用在pbs溶液中的105个tc-1细胞攻击所述两个组的所有动物。每天观察小鼠,并且在实施肿瘤细胞后8天可以检测到可触知的团块的形成。从肿瘤的检测开始,借助于数字测径器(china)每2天测量肿瘤。肿瘤以不规则形状生长,并且关于在同一平面中的长度和垂直轴、宽度进行测量。从这些数据开始,计算以cm3表示的每只小鼠的肿瘤体积,对数据进行分组并且使用student's t-检验(p=5.00%)和graphic-pad prism 6软件3.0版进行统计学分析。
[0141]
在第0、14、28、42天从所有动物中收集大约100μl的小的血液等分试样。按照动物实验中的伦理标准(tambourgi等人,2010),在植入肿瘤后大约3周(第49天)对小鼠进行安乐死,并且收集所有血液。
[0142]
从血液样品开始,通过以800rpm进行离心来收集动物的血清,其中获得大约30μl的血清并且将其贮存于-20℃直至分析之时。
[0143]
14.2.治疗评价
[0144]
为了评价在治疗与hpv相关的癌症中使用所构建的疫苗载体pcdna3.3/l2e6的功效,选择3个动物组用于测定法。
[0145]
所述组由10只动物形成,并且用在dmem培养基中的7
×
104个tc-1细胞进行攻击并且在每只动物的左背外侧区域中通过皮下途径进行接种。事先已通过刮毛对该区域进行了准备以有助于通过正确途径施加肿瘤细胞。
[0146]
在肿瘤细胞接种之后那一天,即第1天,对照组(组iii)的动物接受5μg的空载体pcdna3.3,和在第10天,施用包含5μg的相同载体的第二剂。
[0147]
每天监测动物,并且触摸该区域以验证肿瘤的植入。一旦检测到,就每2天借助于数字测径器手动测量肿瘤,或者直至肿瘤达到大约20mm的直径,此时将动物安乐死。
[0148]
对于实验测定法,将动物划分为2个新的组,其中第一组(组iv)在实验的第一天接受第一剂的dna疫苗即pcdna3.3/l2e6,和在第15天使接受第二剂。第一剂具有5μg的载体pcdna3.3/l2e6,而第二剂由5μg的疫苗载体构成。在28个实验日时,这些动物还接受5μg的第三个疫苗剂量。这两个剂量都在pbs溶液中进行稀释。
[0149]
第二个实验组(组v)的动物在第一个实验日,即在接受肿瘤细胞后1天,接受包含5μg pcdna3.3/l2e6的第一剂的dna疫苗,和在包含5μg的第一剂后10天接受第二剂。
[0150]
每天监测动物,并且触摸该区域以验证肿瘤的生长。一旦检测到,就每2天借助于数字测径器手动测量肿瘤,或者直至肿瘤达到大约20mm的直径,此时将动物安乐死。
[0151]
在第0、21、28和49天抽取小的血液等分试样以获得血清,并且贮存于-20℃直至使用之时。
[0152]
在无菌环境中收集动物(其是就dna疫苗的治疗作用进行测试的组即组iii、iv和v的一部分)的脾脏,将脾脏在无菌pbs溶液中洗涤2次并且按照下面所描述的进行培养。
[0153]
15.脾细胞的培养
[0154]
从每只动物中取出脾脏,在无菌pbs溶液中进行两次洗涤后,在培养皿中借助于注射器柱塞将其对着一块无菌纱布进行浸解。在浸解物上添加3ml的补充有10%胎牛血清的rpmi培养基(r10)。将细胞收集在无菌锥形管中,并且以12000rpm离心5分钟。
[0155]
在离心后,弃去上清液,并且将红细胞通过下述方式来进行裂解:添加500μl的无菌蒸馏水,快速均质化,并且添加另外500μl的两倍浓缩的并且无菌的pbs溶液,充分均质化。在以1000rpm再次离心10分钟后,再次弃去上清液并且将沉淀物用1ml的r10培养基重悬浮。
[0156]
在neubauer室中借助于在pbs中的0.4%锥虫蓝染料溶液来对活的脾细胞进行计数。
[0157]
将细胞以106个细胞/ml的浓度以三次重复分配在12-孔培养平板中,其中体积用1ml的r10培养基来完成。在每个孔中添加10μl的前面所描述的合成肽pep1(e6)。然后,将包含脾细胞和pep1的平板在37℃和5%的co2下在潮湿环境中温育48小时。在该时间段后,回收培养物上清液并且贮存于-80℃直至下面所描述的细胞因子含量测定分析之时。
[0158]
16.细胞因子检测测定法
[0159]
从在实验下的动物中收集的血清等分试样和脾细胞培养物上清液开始,按照制造商的说明书,借助于bd cba小鼠th1/th2细胞因子试剂盒(bdtm biosciences,usa)来进行可溶性细胞因子的含量测定。
[0160]
简而言之,通过实验组和日期来分开样品,其中以汇集物形式分析仅在第0、28和49天收集的血清样品,以及脾细胞培养物上清液样品。将样品与包被有针对5种不同类型细胞因子(il-2、il-4、il-5、inf-g和tnf)的特异性抗体的珠粒一起进行温育,连同与荧光蛋白pe(藻红蛋白)相缀合的检测试剂一起并且在环境温度下避光温育2小时。
[0161]
然后,将珠粒用洗涤缓冲液(试剂盒的组分)进行洗涤并且重悬浮在300μl的洗涤缓冲液中,其然后在流式细胞仪bd facscanto ii(bd
tm biosciences)中进行分析。数据通过使用fcap array软件3.0版(bd
tm biosciences)来进行分析。
[0162]
17.间接elisa
[0163]
为了分析通过疫苗pcdna3.3/l2e6的体液免疫应答的诱导,进行elisa测定法(酶联免疫吸附测定法),其中用在碳酸盐-碳酸氢盐缓冲液(0.2m na2co3,0.2m nahco3,ph 9.6)中的0.6mg/ml pep1或0.3mg/ml pep2来敏化具有高附着能力的平底平板(sarstedt,numbrecht,germany)并且在4℃下温育18小时。次日,回收抗原并且将平板用pbst洗涤3次。然后,添加150μl的pbst溶液 5%脱脂奶粉以封闭非特异性结合,并且在环境温度下温育1小时。将平板用pbst再次洗涤3次,并且在每个孔中分配在pbst溶液 1%脱脂奶粉中进行1:100稀释的、在第0、28和49天从动物中收集的血清样品。将一抗在环境温度下温育2小时。在
这段时间后,弃去样品并且将平板用pbst溶液再洗涤3次。然后,向孔中添加100μl的在pbst溶液 1%脱脂奶粉中进行1:250稀释的、缀合有过氧化物酶的在绵羊中产生的抗-小鼠igg二抗(sigma-aldrich),并且在环境温度下温育1小时30分钟。将平板用pbst溶液再次洗涤3次和用pbs洗涤1次。最后,每个孔接受100μl的揭示溶液(0.05m c6h8o7,0.05m na2hpo4,ph 5),在其中稀释包含5mg的opd(邻苯二胺二盐酸,invitrogen)片剂并且添加12μl的h2o2至30%。在环境温度下在避免直射光的位置处温育15分钟。然后,每个孔接受50μl的2.5m h2so4溶液以终止反应。然后,在multiskan ex阅读器(labsystems)上在492nm处读取平板。样品以三次重复进行测试。
[0164]
结果的分析通过下述方式来进行:通过阴性样品的平均值,加上3倍的这些样品的标准偏差值,再加上最终值的10%来计算截止(“cut off”)点。在公式中所使用的标准偏差的数目保证了结果的置信水平。
[0165]
截止点=平均值 3x s 10%
[0166]
在该截止点以上所获得的所有点都被认为是阳性样品。
[0167]
18.统计学分析
[0168]
统计学分析借助于graphpad软件(graphpad software,inc.)来进行。为了对于在动物实验中所获得的数据(动物体重和肿瘤体积)进行统计学分析,使用student's t检验(p=0.05%)。在细胞因子检测测定法中,使用anova参数检验(p《0.05)。
[0169]
19.l2e6序列的生物信息学分析
[0170]
从编码所定义的l2e6蛋白的dna序列开始,进行计算机分析以更好地了解待生成的产物和所述蛋白质的特征,以便辅助本研究的开发。
[0171]
表1显示了l2e6序列的生物信息学分析。从编码所定义的l2e6蛋白的dna序列开始,进行计算机分析以更好地了解待生成的产物和所述蛋白质的特征,以便辅助本研究的开发。基于从其氨基酸序列开始来预测蛋白质的特征的算法,在过去几年中出现了几种用于蛋白质组分析的软件和在线网站。在能够预测蛋白质的物理化学特征的在文献中最常使用和描述的网站之一为http://protcale.sourceforge.net/,其估计分子量、ph、pi并且进行氨基酸残基的计数。查询了几个参考网站,对数据进行了分析,并且汇编在下面的表格中,其中具有32个氨基酸残基的所定义的序列qlyktckqagtcppdiipkvggsgydfafrdl显示出其他特征:
[0172]
表1
–
在本研究中所设计的l2e6蛋白的物理化学特性,根据protein calculator网站(http://protcale.sourceforge.net/)
[0173]
物理化学特性 分子量大约3.5kdapi7.98估计的在ph 7.0处的电荷0.9
[0174]
使用其他的关于可能的翻译后改变的预测位点,通过链接http://www.cbs.dtu.dk/index.shtml通过technical university of denmark的“生物序列分析中心(center for biological sequence analysis;cbs)”的网站分析了几个参数。
[0175]
所述分析证明,所开发的l2e6肽具有关于乙酰化、磷酸化的预测位点,指明了输出至细胞核的信号的富含亮氨酸的位点,和在氨基酸残基23和24之间的切割位点,从而生成
具有可能的将该蛋白质输出至跨膜区的信号传导的信号肽。除了存在2个残基的氨基酸半胱氨酸外,这可以导致二硫键的形成,其具有翻译后修饰,从而生成在蛋白质的构象和稳定性方面的可能改变。
[0176]
图2显示了用于在用载体pcdna3.3/l2e6进行转化后选择细菌菌落的0.8%琼脂糖的电泳凝胶的照片文件。在用于扩增载体的细菌转化测定法后,使细菌菌落经历pcr以选择阳性克隆。将pcr产物在琼脂糖凝胶上进行分析,并且使其经历电泳(图2),其中(mm1)表示通用标准参照物,和(mm2)表示50bp dna ladder标准参照物。在(1)中为完整质粒pcdna3.3/l2e6的样品,在(2)和(3)中为来自通过pcdna3.3/l2e6转化的细菌菌落的pcr产物,和在(4)中为来自未转化的菌落的pcr产物。
[0177]
因此,选择在第3列(图2)中所呈现的菌落来用于细菌菌落的扩增,并且随后用于质粒dna的纯化。将回收的质粒dna通过分光光度法来进行定量,从而导致每个样品150ng/μl的平均值。
[0178]
如上面所描述的那样进行回收和定量的质粒dna的测序确证了在本工作中所开发的l2e6基因的正确形成和序列。
[0179]
图3和4显示了在hek293t细胞(图3)和293f细胞(图4)中进行的融合重组蛋白l2e6的细胞内表达的评价。
[0180]
通过间接免疫荧光测定法,可以证明重组蛋白质的表达,其被商业的抗-l2特异性单克隆抗体所识别。所述蛋白质以分布在整个细胞中的点的形式显现(图3和4)。
[0181]
图5显示了重组蛋白l2e6的表达分析。在用载体pcdna3.3/l2e6转染293f细胞后,如前面所描述的那样收集并且裂解细胞。将细胞裂解物在12%sds-page上进行分析,如在图5中所观察到的。所产生的重组蛋白l2e6的理论分子量将会是大约3.5kda。
[0182]
来自未转染的和经转染的细胞的细胞裂解物样品的走样图谱的比较揭示了低于8kda的极低分子量蛋白质的存在,其仅存在于经转染的样品中,这暗示它是重组蛋白l2e6。另外,进行western印迹测定法以确证重组蛋白质的表达和这些蛋白质被商业的特异性抗-l2和抗-e6单克隆抗体的识别,以便确证所表达的蛋白质的身份。所获得的结果揭示,所述两种单克隆抗体,抗-l2和抗-e6,识别了大约3.5kda的蛋白质,这暗示了目的蛋白质的身份的确证(图5)。
[0183]
从用于检测和表征重组蛋白l2e6的western印迹测定法中获得的结果的照片文件,其中样品(1)和(5)为未转染的细胞的裂解物的等分试样;样品(2)和(6)为经转染并且表达l2e6的细胞的裂解物;样品(3)和(7)为从凝胶过滤色谱法测定法中获得的并且与抗-l2(3)和抗-e6(7)特异性单克隆抗体相互作用的洗脱出的中间体,这证明了被这两种商业抗体识别的低分子量蛋白质的存在;样品(4)为来自凝胶过滤过程的最终洗脱样品。(mm)color burst
tm
分子量标准参照物。
[0184]
图6显示了在本工作中进行的体内测定法之中的预防评价,在用于在鼠类模型中分析所述载体作为dna疫苗的用途的实验之中。将动物分为4个实验组,它们就诱导对于用tc-1肿瘤细胞进行的攻击的预防性和治疗性保护作用的可能性进行评价。
[0185]
从每周对动物进行称重开始,可以观察到在整个实验期间体重保持不变。观察到在实验组动物和对照组动物(其从实验的第0(零)天起仅接受pbs)之间的体重的小差异,但是根据student's t检验,这样的差异不是在统计学上显著的,这暗示所述dna疫苗没有干
扰动物的体重增长或减轻(图6)。
[0186]
图7显示,在施加3剂的在本研究中所提出的dna疫苗后一周,用tc-1肿瘤细胞攻击动物以评价是否诱导了保护性免疫应答以及其在hpv-阳性细胞的肿瘤发展中的预防性保护能力。从肿瘤建立并且变得可触知的时刻开始,每2天测量它们并且分析数据。肿瘤体积在整个实验期间增加,这证明存在具有肿瘤发展的肿瘤植入。在同一组的动物之间没有在统计学上显著的差异,正如不可能观察到在实验组和对照组之间在动物的肿瘤体积方面的差异(图7),这暗示预防性地使用的所述dna疫苗不诱导能够阻止或控制肿瘤发展的免疫应答。但是,这样的结果是预料中的,因为处于开发中的疫苗的预防能力将会局限于其诱导产生能够防止细胞被hpv感染的特异性抗体的能力。
[0187]
图8显示了所述dna疫苗的治疗评价。在整个实验程序期间,每周对动物进行称重以监测其发育以及可能的通过施加dna疫苗而诱导的改变。当通过皮下途径施加时,tc-1细胞具有建立和形成实体和非侵袭性肿瘤的能力,但是它们的生长是快速的并且能够在动物皮肤中诱导外部伤口的形成。因此,在施加肿瘤细胞后,就肿瘤发展对动物进行监测,并且当它们诱导外露伤口的形成时或者当肿瘤团块的最大直径达到200mm时,对动物进行安乐死。以这种方式,在第28个实验日对对照组即组ii的所有动物进行安乐死,它们接受了肿瘤细胞并且未接受dna疫苗,而仅接受了空载体。因此,在接受了肿瘤细胞和用空载体进行的治疗的动物组中,可以观察到肿瘤植入从在接种赘生性细胞后第7天起诱导动物的体重减轻,但是这种体重差异不是在统计学上显著的。只有在第28个实验日,可以在动物中观察到巨大的体重下降(组iii和iv,图8),其当与先前的称重相比较时是在统计学上显著的(p》0.0001)。在同一组中,没有动物体重的显著差异(图8)。接受了肿瘤细胞和疫苗pcdna3.3/l2e6的动物在整个实验期间未表现出显著的体重减轻,包括以更短的在剂量之间的时间段接受了疫苗的组即组v,动物的生长显示出在整个实验过程中是连续的。
[0188]
图9显示,从在接种tc-1细胞后第10天开始,已经可以在接受了包含空载体的疫苗的组iii的所有动物中检测到可触知的(但还不是可测量的)肿瘤团块的存在。但是,随着肿瘤的快速生长,在2天后开始肿瘤直径的测量,随后每2天进行测量。所获得的数据证明了快速的肿瘤生长,其中在同一组中的动物之间具有相似的肿瘤体积。在以15天的间隔接受了3剂的疫苗pcdna3.3/l2e6的组iv的动物中,该组的3只动物从第12个实验日开始发展出了实体肿瘤。随着肿瘤的快速发展,在第28个实验日对这3只动物进行安乐死。该组的其余7只动物在整个分析时间段期间未发展出肿瘤。
[0189]
在以10天的间隔接受了仅2剂的疫苗pcdna3.3/l2e6的组v的动物中,其中8只未发展出任何与tc-1细胞的施加相关联的肿瘤,其在整个实验时间段期间保持。该组的两只动物具有肿瘤的发展,但是具有相比于对照组即组iii的动物而言小得多的体积。
[0190]
紧接在第二剂的dna疫苗的免疫接种后,在组之间,肿瘤体积的差异是在统计学上显著的(p《0.0001),这暗示它在组iv的动物中诱导了足以能够遏制肿瘤生长的免疫应答。随着时间流逝,在组iii和iv之间在肿瘤体积方面的这种差异变得更明显,如可以在图9中观察到的。接受了dna疫苗的组即组iv的动物的肿瘤体积保持增加,虽然只是轻微地增加,这暗示了直至在最后一剂后14天的稳定性,当测量再次显示出小的而不是在统计学上显著的增加时。另一方面,组v的动物,即呈现出肿瘤团块形成的那些,以非常缓慢的步调生长,当与呈现出肿瘤发展的其他动物相比较时。并且,当与其他动物相比较时,由这些肿瘤所达
到的最终体积要小得多。
[0191]
表2显示了细胞因子产生的分析。
[0192]
从在实验中所使用的动物获得的血清开始,进行细胞因子的检测和含量测定测定法,以试图描绘由该dna疫苗诱导的免疫应答的特性谱。
[0193]
借助于bd cba小鼠th1/th2细胞因子试剂盒将第0、28和49天的血清样品汇集物按组分开。在所有所测试的样品中可以检测到所分析的细胞因子的存在,但是对于细胞因子ifn、il-2、il-4和il-5所获得的结果,所发现的浓度是低的,并且不能观察到在治疗之前和之后所收集的样品的浓度差异,如可以在下面的表2中观察到的(表2)。
[0194]
通过使用mann&whitney非参数检验的统计学分析揭示,在对照组和实验组之间所检测的tnf浓度没有显著差异(p《0.05)。
[0195]
表2
–
在血清样品中检测到的细胞因子水平
[0196][0197]
但是在血清样品的tnf(肿瘤坏死因子)的分析中,可以观察到在最后一个实验日(第49天)该细胞因子的浓度的显著增加,如可以在下面的表中观察到的(表3)。
[0198]
表3
–
在所研究的动物的血清中检测到的tnf水平
[0199][0200]
还用当与合成肽pep1(e6)的等分试样一起进行温育时的脾细胞培养物上清液样品进行了相同的细胞因子检测分析。未检测到ifn、il-2、il-4和il-5的水平,因为所发现的
浓度都在标准浓度曲线之外。但是,在组iv和v的动物的样品中检测到高水平的tnf,如可以在表4中观察到的(下面)。
[0201]
表4
–
在脾细胞培养物上清液中检测到的tnf水平
[0202]
组tnf含量(pg/ml)iii
–
治疗评价,对照组42.02iv
–
治疗评价,实验组,以15天进行的剂量85.31*v
–
治疗评价,实验组,以10天进行的剂量97.40*
[0203]
图10和11显示了特异性抗体产生的分析。将从所有动物和组中收集的血清样品在间接elisa测定法中进行分析,以证明是否存在具有抗-l2或抗-e6特异性抗体的产生的由疫苗pcdna3.3/l2e6所诱导的体液免疫应答的诱导。以三次重复测试样品,并且如先前所描述的那样分析其结果。所获得的数据证明,在第0天的样品中在任何动物中均未检测到抗-l2或抗-e6抗体,如所预期的。但是,在第28天的样品中已经可以检测到高水平的特异性抗体的存在,但是在第49天发现反应性的峰值并且然后证明了抗-l2(图10)和抗-e6(图11)特异性抗体的存在。发展出肿瘤的组iv的动物与显示出较小的产生抗-l2和抗-e6抗体的能力的动物是相同的,编号为5、6、7和9。发展出实体肿瘤的组v的2只动物也具有最低的抗-l2和抗-e6抗体的产生水平,其为4和5。未在下面的图中出现的动物的数据代表了具有更大的肿瘤发展的那些,它们未坚持到49个实验日,在当达到前面提及的参数时被实施了安乐死。
[0204]
因此,虽然仅显示了本发明的一些实施方案,但是将会理解,可以由本领域技术人员在所述针对hpv和与该病毒相关的癌症的预防性和治疗性dna疫苗中进行各种省略、替换和改变,而不背离本发明的精神和范围。
[0205]
明确规定,以基本上相同的方式发挥相同功能以取得相同结果的所有的要素组合在本发明的范围之内。从所描述的一个实施方案至另一个实施方案的要素替换也完全是所意欲的和所考虑的。
[0206]
还需要理解的是,附图不一定是按比例的,而是它们仅是具有概念性质的。因此,该意图受到限制,如由所附的权利要求书的范围所指出的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。