1.本发明总体上涉及基于杂化聚合物(hybrid polymer)(例如,聚磷腈)的药物递送平台以及涉及产生、评价、施用该平台和用该平台治疗对象的方法。更具体地,本发明提供了:基于聚磷腈的药物递送平台,其包含一种或更多种具有受控分子量和/或多分散性的聚磷腈;以及用于将一种或更多种治疗药物(或前药)物质与聚磷腈缔合的选择性方法。
背景技术:
2.聚磷腈是一类广泛且公知的基于重复单元-(npr2)-n
的大分子,其中r可选自广泛多种的有机或无机取代基。据估计,截至1997年年中,已合成并表征了大约700种聚磷腈,并且已经出现了大约2,000份出版物和专利,其中对于这类聚合物的公开内容以每年近170至200份的速度出现。(参见,polyphosphazenes,j.of inorganic and organometallic polymers,1992,2(2),197-211)。
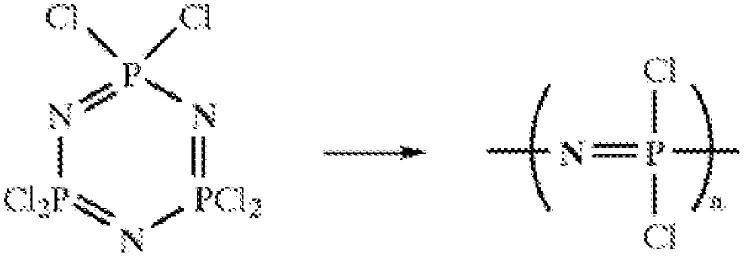
3.迄今为止,聚磷腈合成的主要途径是通过将六氯环三磷腈(环状三聚体)(也称为氯化磷腈)热聚合成聚(二氯磷腈)(其iupac名称为聚(次氮基二氯正膦次基))。该途径在以下方案1中示出。
4.方案1
5.六氯环三磷腈的聚合
[0006][0007]
尽管聚(二氯磷腈)是水解不稳定的弹性体,但其可以通过与广泛多种的亲核试剂进行大分子亲核取代反应而转化为广泛多种衍生物。如以下方案2中所示,聚(有机磷腈)通常通过使一种或更多种有机的或有机金属的亲核试剂(方案2中的r)与聚(二氯磷腈)反应来制备。(参见例如,allcock et al.,macromol 1986,19,1508,和blonsky et al.,j.am.chem.soc.1984,106,6854)。
[0008]
方案2
[0009]
聚(有机磷腈)的合成
[0010]
[0011]
聚合物骨架上的取代基很大程度上确定了所得聚合物的特性。通过适当选择取代基,可以获得具有以下的磷腈聚合物:例如目标玻璃化转变温度;目标物理特征,例如成膜特性;有机凝胶或水凝胶行为;期望的疏水性或亲水性;无定形或微晶特征;以及先进的液晶、光致变色或非线性光学特性。(mark;j.e.;allcock,h.r.;west,r.inorganic polymers prentice hall:englewood cliffs,n.j.1992chapter 3)。
[0012]
用于产生聚磷腈的另一种合成途径是以下方案3中所示的neilson-wisian-neilson反应(参见,nelson et al.,chem.rev.1988,88,541)。
[0013]
方案3
[0014][0015]
neilson-wisian-neilson途径的缺点包括聚合温度高、单体合成困难、仅能制备有限数量的聚合物以及分子量控制少。
[0016]
用于产生聚磷腈的flindt-rose matyjaszewski途径涉及以下反应。(方案4)。(参见,makromol.chem.macromol.symp.1992,54155,13)。
[0017]
方案4
[0018][0019]
该反应的聚合温度可低至90℃。该反应产生具有相当窄多分散性(《1.4)的聚合物。然而,该反应不能用于制备重要的合成工具聚(二氯磷腈)。可以使用该反应来制备[np(or1)2]
x
[np(or1)(or2)]y类型的嵌段共聚物,其中r1是卤化的烷氧基并且r2是脂肪族或芳基部分。该反应所必需的单体的合成可能是困难的。
[0020]
在又一种用于聚磷腈合成的合成方法中,hombacker和li反应提供了以下方案。(方案5)。
[0021]
方案5
[0022][0023]
然而,hombacker和li方法需要高温并且不能控制分子量。产物不具有窄的多分散性。
[0024]
dejaeger合成使用以下方案提供聚(二氯磷腈)。(方案6)
[0025]
方案6
[0026][0027]
dejaeger合成允许一些分子量控制,但无法产生具有窄多分散性的聚合物。另外,该途径需要高的反应温度,并且化合物pocl3具有很强的腐蚀性。
[0028]
叠氮化物前体也已用于制备聚磷腈。例如,r2pcl nan3产生-(n=pr2)n。然而,该途径是潜在危险的,因为叠氮化物具有爆炸性和毒性。此外,该方法无法控制分子量并且不能产生聚(二氯磷腈)。
[0029]
因此,用于制备聚磷腈的许多现有途径具有一个或更多个缺点,包括复杂的单体合成、困难的聚合物合成或允许产生仅有限范围的聚合物的升高的聚合温度。使用这些方法中的许多方法来制备或控制重要聚合物聚(二氯磷腈)的分子量和多分散性也是困难的。
[0030]
多分散性是聚合物样品的分子量不均匀性的量度。通过将聚合物的重均分子量(mw)除以数均分子量(mn)来计算多分散性。对于完美的单分散聚合物,mw/mn的值为1。例如,六氯环三磷腈的热聚合导致分子量为105至106或更大。这些聚合物的多分散性指数(polydispersity index,pdi)通常为2或更大。
[0031]
已知具有窄多分散性的聚合物比具有较宽多分散性的相同聚合物更容易结晶,具有更急剧的玻璃化转变温度,并且在给定温度下更突然地流动。用于药物递送的聚合物的多分散性影响递送装置的水解降解和释放特性。出于这个原因,美国食品和药物管理局(u.s.food and drug administration)要求用于医学应用(例如药物递送)的聚合物具有非常窄的多分散性。
[0032]
聚合物样品的如与分子量范围相对的绝对分子量对聚合物样品在工业和医学应用中的行为也至关重要。最重要的机械特性随重均分子量而变化很大。例如,强度随着分子量的提高而迅速提高,直到达到临界点。将聚合物加工成可用制品(例如膜、片、管或纤维)的能力随着分子量的提高而提高,但仅达到黏度开始变得过高的点。因此,通常期望获得高但特定的折中分子量,其以协调的方式优化强度和可加工性。这说明需要在聚合物合成期间控制分子量,以便可以实现适合于随后开发用作药物递送平台的具有低(或窄)多分散性和受控分子量的良好表征且有效产生的聚合物(例如,聚磷腈)。
[0033]
聚合物例如具有受控分子量和/或多分散性的聚磷腈被认为提供了有用的药物平台,前提是可以开发用于连接一种或更多种目的药物物质的成功方案。
[0034]
多种聚合物,包括但不限于聚磷腈,已显示出作为药物递送载剂的前景。然而,由于聚合物或由此产生的药物递送系统的涉及以下但不限于以下的缺点,尚未实现聚合物药物递送系统的大规模采用:低于合适的生物相容性、生物可降解性和不充足的亲水性(或作为替代地疏水性)。
[0035]
因此,需要的是用于产生聚合物、特别是聚磷腈、以及甚至更具体地聚(二氯磷腈)(例如,聚磷腈和聚磷腈嵌段共聚物和/或三臂星形(triarmed star)聚磷腈)的方法,其提供这样的聚合物产物:具有窄多分散性和/或随后可以得出的分子量,并用作相关患者群体中感兴趣的一种物质或治疗性物质(例如药物)或诊断性物质的载体。
[0036]
附图简述
[0037]
在附图中,一些实施方案在附图的图中通过示例而非限制的方式示出,其中:
[0038]
图1示出了通过实施例14中描述的方案产生的聚磷腈。
[0039]
图2示出了在本发明的一个实施方案中考虑的示例性聚磷腈紫杉醇(paclitaxel)缀合物。
[0040]
发明概述
[0041]
本发明属于聚合物合成和药物递送系统产生领域,并且具体地,本文提供了用于制备具有受控分子量和多分散性的杂化聚合物(例如聚磷腈)的便利且温和的方法。本发明还提供了用于制备这些聚磷腈的单体、环状三聚体、三臂星形聚磷腈和嵌段共聚物的便利途径。
[0042]
本发明的聚磷腈在与一种或更多种活性药物物质(或前药物质)缔合(例如,与其连接)之后是用于将目的化合物施用于对象的有用的递送平台和载体。在多个实施方案中,药物物质通常旨在向对象提供治疗益处。
[0043]
因此,在某些优选的实施方案中,本发明涉及基于聚磷腈的药物递送平台以及涉及产生、评价、施用该平台和用该平台治疗对象的方法。更具体地,本发明提供了:基于聚磷腈的药物递送平台,其包含一种或更多种具有受控分子量和/或多分散性的聚磷腈;以及用于将一种或更多种药物物质与聚磷腈缔合的选择性方法。
[0044]
还提供了用于制备聚磷腈的方法,该方法包括使用主族或过渡金属卤化物、或其他合适的卤化物盐(包括任何链长的线性磷腈盐)、或含有主族或过渡金属氯化物的预制的非磷腈聚合物作为引发剂进行的磷亚胺的阳离子溶液聚合反应。在某些优选的实施方案中,通过该方法制备具有式n{rn(h)r
′2p-(n=pr
′2)n}3的三臂星形聚磷腈。还提供了用于从反应物n(sir3)3和px5合成单体cl3p=nsime3和环状三聚体n3p3x6的方法。
[0045]
在一些优选的实施方案中,药物递送平台是基本上生物相容的、生物可降解的和亲水性的(或作为替代地基本上疏水的)聚合物化合物。在一些特别优选的实施方案中,药物递送平台包含聚合物化合物,该聚合物化合物包含杂化聚合物,该杂化聚合物具有含有通过多个可互换的单键和双键连接的氮和磷的主链,并且任选地还包含一种或更多种类型的有利侧链。合适的杂化聚合物化合物优选地但不排他地见于被配制为纳米粒(例如纳米球)、微球、胶束、膜或水凝胶的广泛类别的聚磷腈化合物中。本发明的聚磷腈化合物在产生之后或在产生同时用一种或更多种活性药物物质(或前药)物质衍生化(例如,负载)。合适的药物物质包括但不限于一种或更多种抗癌剂(例如化学治疗剂、激素治疗、靶向癌症药物和双膦酸盐/酯、抗癌剂和/或抗瘤剂、抗增殖剂、抗血管生成剂、抗转移剂、新辅助治疗和药剂、免疫治疗(例如,“检查点抑制剂”药剂))。
[0046]
在又一些实施方案中,合适的杂化聚合物化合物优选地但不排他地见于广泛类别的甲氧基聚(乙二醇)-嵌段-聚(ε-己内酯)(“mpeg-b-pcl或“mpeg-pcl”)化合物中,其随后用一种或更多种活性药物物质(或前药)物质,例如一种或更多种抗癌剂或药物衍生化。
[0047]
在一些优选的实施方案中,通过1h nmr、hplc、gc、ms、gc-ms和/或免疫学技术来分析药剂与药物载体的浓度、负载特性、吸附、吸收或其他化学缔合(例如共价键合、离子键合等)。
[0048]
治疗剂(例如化学治疗剂)与药物载体的优选载药比为约0.1%至约20%,更优选约5%至约10%,以及最优选为约7%药物/共聚物之比(w/w)。在其中所负载的治疗剂包含
抗癌剂例如但不限于紫杉醇的一些具体实施方案中,负载比为约4%至约10%,更优选约6%至约8%,以及最优选地为约7%药物/共聚物之比(w/w)。在某些优选的实施方案中,化学治疗剂包含以135至175mg/m2的典型经治疗证实的水平(即,与卵巢癌研究相关)负载在药物递送组合物中的紫杉醇。在另一些实施方案中,紫杉醇的水平是用于适应证的典型治疗水平的2倍、3倍、4倍以及潜在的5倍。尽管本发明不限于任何特定的机制,但预期当使用包含本发明的药物递送系统的组合物和方法时,在多种治疗剂和化学治疗剂的情况下可提高化学治疗剂(例如紫杉醇)的可施用水平。
[0049]
优选组合物的水溶解度范围为约1%至约10%,为约1%至约6%,以及更优选为约3%至约4%。
[0050]
在另一个实施方案中,一个或更多个靶向部分(例如,叶酸、糖和抗体等)可以缀合至药物载体上的化学活性部分或官能团,例如侧基官能团。例如,至少一个靶向部分可以与侧基官能团缀合,其中,所述靶向部分选自维生素、糖、凝集素、抗体和抗体片段、肽、受体、配体及其组合。在另一些实施方案中,组合物提供了一个或更多个靶向部分,包括叶酸、糖和抗体等。
[0051]
在一些优选的实施方案中,当负载有一种或更多种药物或治疗剂时,药物递送系统任选地经冷冻干燥和/或冻干。在这些实施方案中的一些中,任选地将一种或更多种冷冻保护剂添加至冷冻干燥和/或冻干的产物。合适的冷冻保护剂包括但不限于多糖(糖和糖醇)(例如,阿拉伯糖、核糖、核酮糖、木糖、木酮糖、来苏糖、阿洛糖、阿卓糖、果糖、半乳糖、葡萄糖、古洛糖、艾杜糖、甘露糖、山梨糖、塔洛糖、塔格糖、景天庚酮糖、甘露庚酮糖、蔗糖、麦芽糖、海藻糖、乳糖、蜜二糖、直链淀粉和甘露聚糖等)。(参见例如,lee,m.k.,“cryoprotectants for freeze drying of drug nano-suspensions:effect of freezing rate,”j.pharm.sci.,98(12)pp.4808-4817,2009)。本发明考虑使用一种或更多种糖冷冻保护剂,并且更优选使用蔗糖,以在冷冻干燥和/或冻干处理期间使药物递送系统稳定化。冷冻保护剂在特定药物递送系统中的百分比范围为约0.001%至约10%或更多、约0.01%至约10%或更多、约0.1%至约10%或更多、约0.001%至约5%或更多、约0.01%至约5%或更多、约0.1%至约5%或更多、约0.5%至约5%或更多、约0.5%至约10%或更多、约1%至约10%或更多、约2%至约8%或更多、约3%至约7%或更多和4%至约6%或更多,以及约5%。
[0052]
在另一些实施方案中,本发明的药物递送系统和组合物还包含一种或更多种赋形剂,例如,适合于肠内或肠胃外应用的可药用或生理学上可接受的有机或无机载体物质,其不会有害地与组合物反应。
[0053]
本文中的术语“赋形剂”是指添加至药物组合物以进一步促进缀合物的施用的惰性物质。赋形剂的一些实例包括但不限于碳酸钙、磷酸钙、多种糖和多种类型的淀粉、纤维素衍生物、明胶、植物油和聚乙二醇。
[0054]
如本文所使用的,短语“药物组合物”或术语“药物”是指本文提出的药物递送平台的制剂,其具有其他化学组分,例如可药用的和合适的载体和赋形剂,并且任选地具有另外的活性(治疗)剂。药物组合物的目的是促进组合物向对象的施用。
[0055]
在下文中,术语“可药用载体”是指不会对生物体造成显著刺激并且不会消除所施用的缀合物的生物活性和特性的载体或稀释剂。可药用载体的一些实例为但不限于:丙二
醇、盐水、有机溶剂与水的混合物和乳剂,以及固态(例如,粉末)和气态载体。合适的可药用载体包括但不限于水、盐溶液(例如林格(ringer’s)溶液)、醇、油、明胶和碳水化合物例如乳糖、直链淀粉或淀粉、脂肪酸酯、羟甲基纤维素和聚乙烯吡咯烷。这样的制剂可以是无菌的,并且如果期望的话,可与助剂例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压的盐、缓冲剂、着色剂和/或芳香物质等混合,该助剂不与施用于人的组合物有害地反应。本发明的某些方法提供了易于扩展的用于以增强的效率产生药物载体组合物和药物递送平台的生产方案。
[0056]
本发明的又一些实施方案提供了用于以大规模产生聚合物药物递送平台、同时保持与临床试验材料相比分别与实验材料和非临床试验材料相关的当前良好实验室规范(current good laboratory practice,“cglp”)和/或当前良好生产规范(current good manufacturing practice,“cgmp”)标准的生产方案。
[0057]
本发明组合物的一些优选实施方案提供了包含纳米粒(例如纳米球)的药物载体组合物,该纳米粒的尺寸范围为约5nm至约700nm,并且更优选地为约100nm或更小。可以使用如本领域已知的或容易适用的标准技术进行浓缩和/或过滤纳米粒。
[0058]
发明详述
[0059]
本发明总体上涉及基于杂化聚合物(例如,聚磷腈)的药物递送平台以及涉及产生、评价、施用该平台和用该平台治疗对象的方法。更具体地,本发明提供了:基于聚磷腈的药物递送平台,其包含一种或更多种具有受控分子量和/或多分散性的聚磷腈;以及用于将一种或更多种治疗药物(或前药)物质与聚磷腈缔合的选择性方法。
[0060]
还提供了用于制备聚磷腈的方法,该方法包括使用主族或过渡金属卤化物、或其他合适的卤化物盐(包括任何链长的线性磷腈盐)、或含有主族或过渡金属氯化物的预制的非磷腈聚合物作为引发剂进行的磷亚胺的阳离子溶液聚合反应。在某些优选实施方案中,通过该方法制备具有式n{rn(h)r
′2p-(n=pr
′2)n}3的三臂星形聚磷腈。还提供了用于从反应物n(sir3)3和px5合成单体cl3p=nsime3和环状三聚体n3p3x6的方法。
[0061]
提供了用于制备聚磷腈的方法,该方法包括使用主族或过渡金属卤化物、或其他合适的卤化物盐(包括任何链长的线性磷腈盐)作为引发剂进行的磷亚胺的阳离子溶液聚合反应。该方法代表了聚磷腈合成领域中的显著进展,因为其提供了对产物分子量的新控制程度,并提供了具有窄多分散性的产物。多分散性为1.6或更小(例如,1.4、1.2、1.1或1.05或更小)的聚(二氯磷腈)和相应的多分散性为1.2或更小(例如,1.1或1.05)的聚(有机磷腈)可以使用该方法制备。
[0062]
本发明在以下描述中公开,并在工作实施例中进行说明。工作实施例仅说明本发明的选定的一些具体实施方案,并不旨在限制本发明范围。鉴于本公开内容,本领域中的普通技术人员可以根据需要或期望常规地修改该过程。
[0063]
i.定义
[0064]
在本发明实施方案的上下文中,术语“生物活性剂”、“药物活性剂”、“药物”、“前药”等可互换使用。
[0065]
如本文所使用的,术语“治疗剂”、“药物活性剂”、“生物活性剂”和“药物”是指当在体内施用于动物如哺乳动物特别是人时,改变、抑制、激活或以其他方式影响生物学机制或事件的包括但不限于以下的有机和/或无机分子:小分子药物和生物分子,包括但不限于蛋
白质、多糖、核蛋白、脂蛋白、合成多肽、与蛋白质连接的小分子、糖类、寡糖、碳水化合物、糖聚合物、糖蛋白、类固醇、核酸、核苷酸、核苷、寡核苷酸(包括反义寡核苷酸)、cdna、核酸和维生素(包括但不限于维生素c和维生素e)、脂质,或其组合和部分。如本文所使用的,这些术语更具体地,在某些实施方案中,进一步是指在动物(例如,人)体内或体外使用的作为用于治疗、治愈或预防疾病、障碍或医学病症的药剂、药物或预防剂(例如,疫苗和免疫活性组合物)的任何物质,包括但不限于抗真菌剂(例如氟康唑(fluconazole)和伏立康唑(voriconazole))、抗癫痫药(例如卢非酰胺(rufinamide)和托吡酯(topiramate))、免疫抑制剂、抗氧化剂、麻醉剂、化学治疗剂、类固醇(例如类视黄醇、激素等)、抗生素、抗病毒剂、抗增殖剂、抗组胺和变态反应治疗(例如曲安奈德(triamcinolone acetonide))、抗凝剂、抗光老化剂、生物制剂(例如核苷酸、寡核苷酸、多核苷酸和核酸序列(例如dna和/或rna及其衍生物)、氨基酸、寡肽、多肽和蛋白质(例如治疗性的肽和蛋白质、和抗体及其片段和衍生物等)、双膦酸盐/酯、促黑素肽、非甾体和甾体抗炎化合物,以及靶向癌症药物。在一些另外的实施方案中,合适的化学治疗剂包括但不限于小分子化学治疗药物和抗癌剂和/或抗瘤剂、抗增殖剂、抗血管生成剂、抗转移剂、新辅助治疗和药剂、免疫治疗(例如,“检查点抑制剂”药剂))。
[0066]
根据本发明的一些优选实施方案,可与本文所述的药物递送平台缔合的治疗剂和/或生物活性剂通常是抗癌生物活性剂,其包括但不限于:用于癌症和癌症治疗的所有类型和阶段(例如,化学治疗性、增殖性、急性、遗传性、自发性的,等)的抗癌物质,抗增殖剂,化学敏化剂,抗炎剂(包括但不限于甾体和非甾体抗炎剂和解热剂),抗氧化剂,激素,免疫抑制剂,酶抑制剂,细胞生长抑制剂和抗黏附分子,dna、rna或蛋白质合成的抑制剂,抗血管生成因子,抗分泌因子,放射性药剂和显像剂。适用于本发明的示例性药物的更全面列表可见于:axel kleemann和jurgen engel的"pharmaceutical substances:syntheses,patents,applications",thieme medical publishing,1999;由susan budavari等编辑的"merck index:an encyclopedia of chemicals,drugs,and biologicals",crc press,1996;以及由united states pharmcopeial convention,inc.,rockville md.公开的美国药典-25/国家处方集-20,2001。
[0067]
如本文所使用的,术语“小分子”是指无论是天然存在还是人工产生(例如,通过化学合成)的具有相对低的分子量的分子。通常,小分子是单体并且具有小于约1500da的分子量。优选的小分子具有生物活性,因为其在动物,优选哺乳动物,更优选人中产生局部或全身作用。在某些优选实施方案中,小分子是药物。优选地,尽管不是必须的,药物是已经被适当的政府机构或团体认为其使用是安全且有效的药物。例如,由fda根据21c.f.r.
§§
330.5、331至361和440至460列出的人用药物、由fda根据21c.f.r.
§§
500至589列出的兽用药物根据本发明的使用都被认为是可接受的。
[0068]
根据本发明一些实施方案的抗癌药包括但不限于:氨萘非特(amonafide)、喜树碱(camptothecin)、秋水仙碱(colchicine)、苯丁酸氮芥(chlorambucil)、阿糖孢苷(cytarabine)、多柔比星(doxorubicin)、3-(9-吖啶基氨基)-5-(羟基甲基)苯胺、阿扎毒素(azatoxin)、阿西维辛(acivicin)、阿柔比星(aclarubicin)、盐酸阿考达唑(acodazole hydrochloride)、阿克罗宁(acronine)、阿霉素(adriamycin)、阿多来新(adozelesin)、阿地白介素(aldesleukin)、六甲蜜胺(altretamine)、安波霉素(ambomycin)、乙酸阿美蒽醌
(ametantrone acetate)、氨鲁米特(aminoglutethimide)、安吖啶(amsacrine)、阿那曲唑(anastrozole)、安曲霉素(anthramycin)、天冬酰胺酶、曲林菌素(asperlin)、阿扎胞苷(azacitidine)、阿扎替派(azetepa)、阿佐霉素(azotomycin)、巴马司他(batimastat)、苯佐替派(benzodepa)、比卡鲁胺(bicalutamide)、盐酸比生群(bisantrene hydrochloride)、二甲磺酸双奈法德(bisnafide dimesylate)、比折来新(bizelesin)、硫酸博来霉素(bleomycin sulfate)、布喹那钠(brequinar sodium)、溴匹立明(bropirimine)、白消安(busulfan)、放线菌素c(cactinomycin)、卡鲁睾酮(calusterone)、卡醋胺(caracemide)、卡贝替姆(carbetimer)、卡铂(carboplatin)、卡莫司汀(carmustine)、盐酸卡柔比星(carubicin hydrochloride)、卡折来新(carzelesin)、西地芬戈(cedefingol)、西罗霉素(cirolemycin)、顺铂(cisplatin)、克拉屈滨(cladribine)、甲磺酸克立那托(crisnatol mesylate)、环磷酰胺、达卡巴嗪(dacarbazine)、放线菌素d(dactinomycin)、盐酸道诺霉素(daunorubicin hydrochloride)、地西他滨(decitabine)、右奥马铂(dexormaplatin)、地扎胍宁(dezaguanine)、甲磺酸地扎胍宁、地吖醌(diaziquone)、多西他赛(docetaxel)、盐酸多柔比星、屈洛昔芬(droloxifene)、柠檬酸屈洛昔芬、丙酸屈他雄酮(dromostanolone propionate)、达佐霉素(duazomycin)、依达曲沙(edatrexate)、盐酸依氟鸟氨酸(eflornithine hydrochloride)、依沙芦星(elsamitrucin)、恩洛铂(enloplatin)、恩普氨酯(enpromate)、依匹哌啶(epipropidine)、盐酸表柔比星(epirubicin hydrochloride)、厄布洛唑(erbulozole)、盐酸依索比星(esorubicin hydrochloride)、雌莫司汀(estramustine)、雌莫司汀磷酸钠、依他硝唑(etanidazole)、依托泊苷(etoposide)、磷酸依托泊苷、艾托卜宁(etoprine)、盐酸法倔唑(fadrozole hydrochloride)、法扎拉滨(fazarabine)、维甲酰酚胺(fenretinide)、氟尿苷(floxuridine)、磷酸氟达拉滨(fludarabine phosphate)、氟尿嘧啶(fluorouracil)、氟西他滨(flurocitabine)、磷喹酮(fosquidone)、福司曲星钠(fostriecin sodium)、吉西他滨(gemcitabine)、盐酸吉西他滨(gemcitabine hydrochloride)、羟基脲(hydroxyurea)、盐酸伊达比星(idarubicin hydrochloride)、异环磷酰胺(ifosfamide)、伊莫福新(ilmofosine)、干扰素α-2a、干扰素α-2b、干扰素α-nl、干扰素α-n3、干扰素β-1α、干扰素γ-1β、异丙铂(iproplatin)、盐酸伊立替康(irinotecan hydrochloride)、醋酸兰瑞肽(lanreotide acetate)、来曲唑(letrozole)、醋酸亮丙瑞林(leuprolide acetate)、盐酸利阿唑(liarozole hydrochloride)、洛美曲索钠(lometrexol sodium)、洛莫司汀(lomustine)、盐酸洛索蒽醌(losoxantrone hydrochloride)、马索罗酚(masoprocol)、美登素(maytansine)、盐酸二氯甲基二乙胺(mechlorethamine hydrochloride)、醋酸甲地孕酮(megestrol acetate)、醋酸美仑孕酮(melengestrol acetate)、美法仑(melphalan)、美诺立尔(menogaril)、巯基嘌呤(mercaptopurine)、甲氨蝶呤(methotrexate)、甲氨蝶呤钠(methotrexate sodium)、氯苯氨啶(metoprine)、美妥替哌(meturedepa)、米丁度胺(mitindomide)、米托卡星(mitocarcin)、丝裂红素(mitocromin)、米托洁林(mitogillin)、米托马星(mitomalcin)、丝裂霉素(mitomycin)、米托司培(mitosper)、米托坦(mitotane)、盐酸米托蒽醌(mitoxantrone hydrochloride)、霉酚酸(mycophenolic acid)、诺考达唑(nocodazole)、诺拉霉素(nogalamycin)、奥马铂(ormaplatin)、奥昔舒仑(oxisuran)、紫杉醇、培门冬酶(pegaspargase)、培利霉素(peliomycin)、戊氮芥(pentamustine)、硫酸培洛
霉素(peplomycin sulfate)、培磷酰胺(perfosfamide)、哌泊溴烷(pipobroman)、哌泊舒凡(piposulfan)、盐酸吡罗蒽醌(piroxantrone hydrochloride)、普卡霉素(plicamycin)、普洛美坦(plomestane)、卟菲尔钠(porfimer sodium)、泊非霉素(porfiromycin)、泼尼莫司汀(prednimustine)、盐酸甲基苄肼(procarbazine hydrochloride)、嘌呤霉素(puromycin)、盐酸嘌呤霉素(puromycin hydrochloride)、吡唑霉素(pyrazofurin)、利波腺苷(riboprine)、罗谷亚胺(rogletimide)、沙芬戈(safingol)、盐酸沙芬戈(safingol hydrochloride)、司莫司汀(semustine)、辛曲秦(simtrazene)、磷乙酰天冬氨酸钠(sparfosate sodium)、司帕霉素(sparsomycin)、盐酸锗螺胺(spirogermanium hydrochloride)、螺莫司汀(spiromustine)、螺铂(spiroplatin)、链黑菌素(streptonigrin)、链脲佐菌素(streptozocin)、磺氯苯脲(sulofenur)、他利霉素(talisomycin)、紫杉醇(taxol)、替可加兰钠(tecogalan sodium)、替加氟(tegafur)、盐酸替洛蒽醌(teloxantrone hydrochloride)、替莫泊芬(temoporfin)、替尼泊苷(teniposide)、替罗昔隆(teroxirone)、睾内酯(testolactone)、硫咪嘌呤(thiamiprine)、硫鸟嘌呤(thioguanine)、噻替哌(thiotepa)、噻唑呋林(tiazofurin)、替拉扎明(tirapazamine)、盐酸拓扑替康(topotecan hydrochloride)、柠檬酸托瑞米芬(toremifene citrate)、醋酸曲托龙(trestolone acetate)、磷酸曲西立滨(triciribine phosphate)、三甲曲沙(trimetrexate)、葡萄糖醛酸三甲曲沙(trimetrexate glucuronate)、曲普瑞林(triptorelin)、盐酸妥布氯唑(tubulozole hydrochloride)、乌拉莫司汀(uracil mustard)、乌瑞替派(uredepa)、伐普肽(vapreotide)、维替泊芬(verteporfin)、硫酸长春碱(vinblastine sulfate)、硫酸长春新碱(vincristine sulfate)、长春地辛(vindesine)、硫酸长春地辛(vindesine sulfate)、硫酸长春匹定(vinepidine sulfate)、硫酸长春甘酯(vinglycinate sulfate)、硫酸长春罗新(vinleurosine sulfate)、酒石酸长春瑞滨(vinorelbine tartrate)、硫酸长春罗定(vinrosidine sulfate)、硫酸长春利定(vinzolidine sulfate)、伏氯唑(vorozole)、折尼铂(zeniplatin)、净司他丁(zinostatin)、盐酸佐柔比星(zorubicin hydrochloride)。另外的抗肿瘤剂和抗癌剂包括在antineoplastic agents(paul calabresi和bruce a.chabner)第52章中所公开的那些,以及goodman和gilman的"the pharmacological basis of therapeutics",第八版,1990年,mcgraw-hill,inc.(健康专业部门)1202-1263的介绍。
[0069]
在本发明的一些实施方案中可用的抗癌化学治疗剂的一些非限制性实例包括:含氨基的化学治疗剂,例如道诺霉素、多柔比星、n-(5,5-二乙酰氧基戊基)多柔比星、蒽环类抗生素、丝裂霉素c、丝裂霉素a、9-氨基氨基蝶呤(9-amino aminopertin)、抗霉素、n-乙酰基亚精胺、1-(2-氯乙基)-1,2-二甲磺酰肼、博来霉素、他利霉素(tally somucin)、及其衍生物;含羟基的化学治疗剂,例如依托泊苷、伊立替康、拓扑替康、9-氨基喜树碱、紫杉醇、多西他赛、埃斯泼霉素(esperamycin)、1,8-二羟基-双环[7.3.1]十三碳-4-烯-2,6-二炔-13酮、蛇形菌素(anguidine)、吗啉代多柔比星、长春新碱和长春碱、及其衍生物;含巯基的化学治疗剂和含羧基的化学治疗剂。另外的化学治疗剂包括但不限于:烷化剂,例如氮芥、乙烯亚胺和甲基三聚氰胺、烷基磺酸盐、亚硝基脲和三氮烯;抗代谢物,例如叶酸类似物、嘧啶类似物和嘌呤类似物;天然产物例如长春花生物碱(vinca alkaloid)、表鬼臼毒素
(epipodophyllotoxin)、抗生素、酶、紫杉烷、和生物响应调节剂;混杂药剂例如铂配位复合物、蒽醌、蒽环类抗生素、经取代脲、甲基肼衍生物、或肾上腺皮质抑制剂;或激素或拮抗剂例如肾上腺皮质类固醇、孕激素、雌激素、抗雌激素、雄激素、抗雄激素、促性腺激素释放激素类似物、博来霉素、多柔比星、紫杉醇、4-oh环磷酰胺和顺铂。
[0070]
根据其中多于一种治疗剂与本文所述的药物递送平台缔合的一些实施方案,这些组合物的特征在于治疗活性大于单独的或组合为药剂混合物的各药剂的第一种或更多种治疗活性中的每一种。相对于缀合物成员的治疗活性,由缀合物发挥的这种更大的治疗活性在本文中被称为协同治疗活性。
[0071]
根据一些实施方案,任选地,一种预期用于本文的治疗剂目前被一个或更多个药物批准机构(例如,fda)批准使用,其特征在于低或中等的抗癌活性。“低或中等的抗癌治疗活性”意指使用这样的药物被认为不足以通过处于对靶细胞有害并对靶细胞的生命周期造成破坏的水平而在一定程度上减轻正在治疗的病症的一种或更多种症状。替代地或另外地,当药物对靶细胞具有细胞毒性但对靶细胞没有足够特异性和/或对非靶细胞具有毒性时,该药物被认为具有低或中等抗癌治疗活性。尽管这样的药物在杀伤靶细胞方面是有效的,但由于副作用和毒性作用,其在其治疗有效量下可能不可用。
[0072]
如本文所使用的,短语“治疗有效量”描述了所施用的活性剂的量,其将在一定程度上减轻正在治疗的医学病症的一种或更多种症状。在本发明实施方案的上下文中,短语“治疗有效量”描述了所施用的组合物的量,其将对靶细胞具有细胞毒性,和/或通过处于对靶细胞有害并对靶细胞的生命周期造成破坏的水平而在一定程度上减轻正在治疗的病症的一种或更多种症状。在一些实施方案中,靶细胞是癌细胞。
[0073]
如本文所用,术语“脂肪族的”是指通常为c1至c
20
的烃,其可包含烷基、烯基或炔基部分中的一者或者烷基、烯基或炔基部分的组合,并且其可以为直链、支链或环状,或其组合。低级脂肪族基团通常为c1至c5。
[0074]
如本文所使用的术语“烷基”,除非另有说明,否则是指饱和的直链、支链或环状的伯、仲或叔烃,优选为c1至c
20
,并且具体包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、环戊基、异戊基、新戊基、己基、异己基、环己基、环己基甲基、3-甲基戊基、2,2-二甲基丁基和2,3-二甲基丁基。烷基可以任选地被选自羟基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸盐/酯、膦酸、磷酸盐/酯或膦酸盐/酯的一个或更多个部分取代,所述部分是未经保护的,或者必要时经保护的,如本领域技术人员已知的,例如如greene et al.(“protective groups in organic synthesis,”john wiley and sons,second edition,1991)所教导的。如本文所使用的术语“低级烷基”是指c1至c5的烷基。
[0075]
术语“烷基氨基”或“芳基氨基”是指分别具有一个或两个烷基或芳基取代基的氨基。
[0076]
如本文所使用的,除非另有定义,否则术语“经保护的”是指添加至氧或氮原子以防止氧或氮在其所在的分子的其他部分衍生化的过程期间另外反应的基团。广泛多种的氧和氮保护基是有机合成领域中的技术人员已知的。
[0077]
如本文所使用的术语“氨基酸”是指天然或合成的氨基酸,并且包括但不限于丙氨酰、缬氨酰、亮氨酰、异亮氨酰、脯氨酰、苯丙氨酰、色氨酰、甲硫氨酰、甘氨酰、丝氨酰、苏氨酰、半胱氨酰、酪氨酰、天冬酰胺酰、谷氨酰胺酰、天冬氨酰、谷氨酰、赖氨酰、精氨酰和组氨
酰。术语“氨基酸酯”是指天然或合成氨基酸的脂肪族、芳基或杂芳族羧酸酯。
[0078]
如本文所使用的,除非另有说明,否则术语“芳基”是指苯基、联苯基或萘基,并优选苯基。芳基可以任选地被选自羟基、氨基、烷基氨基、芳基氨基、烷氧基、芳氧基、硝基、氰基、磺酸、硫酸盐/酯、膦酸、磷酸盐/酯或膦酸盐/酯的一个或更多个部分取代,所述部分是未经保护的,或者必要时经保护的,如本领域技术人员已知的,例如如greene et al."protective groups in organic synthesis,"john wiley and sons,second edition,1991中所教导的。
[0079]
如本文所使用的术语“卤素”包括氯、溴、碘和氟。
[0080]
如本文所使用的术语“杂芳基”或“杂芳族”是指在芳环中包含至少一个硫、氧或氮的芳族部分。一些非限制性实例是呋喃基、吡啶基、嘧啶基、噻吩基、异噻唑基、咪唑基、四唑基、吡嗪基、苯并呋喃基、苯并硫代苯基、喹啉基、异喹啉基、苯并噻吩基、异苯并呋喃基、吡唑基、吲哚基、异吲哚基、苯并咪唑基、嘌呤基、咔唑基、唑基、噻唑基、异噻唑基、1,2,4-噻二唑基、异唑基、吡咯基、喹唑啉基、哒嗪基、吡嗪基、噌啉基、酞嗪基、喹喔啉基、黄嘌呤基、次黄嘌呤基、蝶啶基、5-氮杂胞苷基、5-氮杂尿嘧啶基、三唑并吡啶基、咪唑并吡啶基、吡咯并嘧啶基、吡唑并嘧啶基、腺嘌呤、n
6-烷基嘌呤、n
6-酰基嘌呤(其中酰基是c(o)(烷基、芳基、烷芳基或芳烷基))、n
6-苄基嘌呤、n
6-卤代嘌呤、n
6-乙烯基嘌呤、n
6-乙炔嘌呤、n
6-酰基嘌呤、n
6-羟基烷基嘌呤、n
6-硫代烷基嘌呤、胸腺嘧啶、胞嘧啶、6-氮杂嘧啶、2-巯基嘧啶、尿嘧啶、n
5-烷基嘧啶、n
5-苄基嘧啶、n
5-卤代嘧啶、n
5-乙烯基嘧啶、n
5-乙炔嘧啶、n
5-酰基嘧啶、n
5-羟基烷基嘌呤、以及n
5-硫代烷基嘌呤和异唑基。杂环碱基上的功能性氧和氮基团可以在反应连续事件期间如所需的或期望的进行保护。合适的保护基是本领域技术人员公知的,并且包括三甲基甲硅烷基、二甲基己基甲硅烷基、叔丁基二甲基甲硅烷基和叔丁基二苯基甲硅烷基、三苯甲基、烷基、酰基例如乙酰基和丙酰基、甲磺酰基和对甲苯磺酰基。
[0081]
术语“烷基杂环的”或“烷基杂芳族的”是指其中烷基共价连接至杂芳族的部分,其优选为c1至c4烷基杂芳族,以及更优选ch
2-杂芳族。
[0082]
如本文所使用的术语“芳烷基”是指具有烷基取代基的芳基。
[0083]
如本文所使用的,除非另有说明,否则术语“烷氧基”是指结构为-o-烷基的部分。
[0084]
如本文所指,术语“炔基”是指具有至少一个三键的c2至c
10
直链或支链烃。
[0085]
术语“经保护的氧基”是指已被本领域技术人员已知的任何氧保护基保护以免于发生不期望反应的氧原子,所述保护基包括但不限于:例如,三取代的甲硅烷基,例如三甲基甲硅烷基、二甲基己基甲硅烷基、叔丁基二甲基甲硅烷基、叔丁基二苯基甲硅烷基,三苯甲基,烷基,酰基例如乙酰基、丙酰基、苯甲酰基、对no2苯甲酰基、甲苯酰基、甲基磺酰基或对甲苯磺酰基。
[0086]
如本文所使用的术语“杂烷基”是指在碳链中或在碳链末端包含杂原子例如氧、硫或氮(具有由氢或氧完成的化合价)的烷基。这些化合物的一些实例包括一系列被杂原子例如氧、硫或氮中断的低级烷基,包括-o-[(烷基)o]
x-ch2)nh2,其中烷基在该部分内可变化,包括-o-[(ch2)
x
o]
y-ch2)
x
nh2、-o-[(ch2)
x
o]ych2)
x
nh(ch2)
x
so3h以及-o-[(烷基)-o]
y-(烷基),其中烷基在该部分内可变化,包括-o-[(ch2)
x
o]
y-(烷基),其中x为1至8(其在该部分内可变化)且y为1至40的整数。这些化合物的具体实例包括(甲氧基乙氧基)乙氧基、乙氧基乙
氧基和甲氧基乙氧基。杂烷基也可以被卤化,例如-och
2 cf3等。
[0087]
如本文所使用的术语“方法”是指用于完成给定任务的方式、手段、技术和程序,包括但不限于化学、药理学、生物学、生物化学和医学领域的从业人员已知的、或容易由所述从业人员从已知的方式、手段、技术和程序发展而来的那些方式、手段、技术和程序。除非本文另有说明或与上下文明显矛盾,否则本文所述的所有方法都可以以任何合适的顺序进行。除非另有声明,否则本文提供的任何和所有实例或示例性语言(例如,“例如”)的使用仅旨在更好地阐明本发明并且不对本发明的范围构成限制。说明书中的任何语言均不应被解释为表示对本发明的实践必要的任何未要求保护的要素。
[0088]
如本文所使用的术语“治疗”包括消除、基本上抑制、减缓或逆转病症的进展,基本上减轻病状的临床或美学症状或基本上防止病症的临床或美学症状的出现。
[0089]
术语“约”或“大约”意指在特定值的如本领域普通技术人员所确定的可接受的误差范围内,其部分地取决于测量或确定该值的方式,即测量系统的局限性。例如,根据本领域的实践,“约”可意指在1个或多于1个标准偏差以内。
[0090]
在本文件中,如在专利文件中常见的那样,没有数量词修饰的名词用于包括一个/种或多于一个/种,独立于“至少一个/种”或者“一个/种或更多个/种”的任何其他实例或用法。在本文件中,除非另有说明,否则术语“或/或者”用于指非排他性的或/或者,使得“a或b”包括“a但没有b”、“b但没有a”以及“a和b”。在所附权利要求书中,术语“包括/包含”和“在其中”用作相应术语“包含/包括”和“其中”的简明英语等同词。此外,在所附权利要求书中,术语“包括/包含”和“包含/包括”是开放式的,即,包括除在权利要求书中的这样的术语之后所列出的那些要素之外的要素的组合物、制剂或方法仍被认为落入该权利要求书的范围内。此外,在所附权利要求中,术语“第一”、“第二”和“第三”等仅用作标签,并不旨在对其对象施加数字要求。
[0091]
在本文中使用的词语“任选地”或“替代地”意指“在一些实施方案中提供而在另一些实施方案中未提供”。本发明的任何具体实施方案可以包括多个“任选的”特征,除非这些特征冲突。
[0092]
除非在本文中另有说明,否则本文中数值范围的记载仅旨在用作单独引用落入该范围内的每个单独值的速记方法,并且该范围内的每个单独的值被并入说明书中,就好像其在本文中单独记载一样。
[0093]
除非本文另有定义,否则与本发明结合使用的技术术语应具有本领域普通技术人员通常理解的含义。术语的含义和范围应当明确,但是,在有任何潜在的歧义的情况下,本文提供的定义优先于任何词典或外部定义。在本技术中,除非另有说明,否则“或/或者”的使用意指“和/或”。
[0094]
尽管已经参考特定示例性实施方案描述了本发明的实施方案,但是明显的是,在不脱离本发明主题的更广泛范围的情况下,可以对这些实施方案进行多种修改和改变。因此,说明书和附图被认为是说明性的而不是限制性的含义。构成其一部分的附图通过说明而非限制的方式示出了可以实践本主题的一些具体实施方案。足够详细地描述了所示出的实施方案以使本领域技术人员能够实践本文所公开的教导。可以使用另一些实施方案并由其衍生出另一些实施方案,使得可以在不脱离本公开内容的范围的情况下作出结构和逻辑上的替代和改变。因此,不应以限制性意义理解说明书,并且多种实施方案的范围仅由所附
权利要求以及这些权利要求所享有的等同方案的全部范围来限定。
[0095]
仅出于方便起见,本发明主题的这样的实施方案可以在本文中单独地或共同地通过术语“发明”来指代,并且如果实际上公开了多于一个的发明或发明构思,则不旨在将本技术的范围自动限制为任何单个发明或发明构思。因此,尽管本文已经说明和描述了具体的实施方案,但是应当理解,任何被计算为实现相同目的的排列可以代替所示的具体实施方案。本公开内容旨在涵盖多种实施方案的任何和所有修改或变化。以上实施方案的组合,以及本文未具体描述的另一些实施方案,对于本领域技术人员在阅读以上描述后将是显而易见的。
[0096]
ii.磷亚胺的选择
[0097]
磷亚胺用作制备聚磷腈的单体。在一个优选的实施方案中,磷亚胺的结构为:r3p=nsi(r')3,其中至少一个r取代基是氯、氟、溴或碘,并优选氯,并且其余的r和r'取代基是不包含对聚合过程有不利影响的官能团的任意基团。
[0098]
在一个优选的实施方案中,至少两个r取代基是卤素,并优选氯。优选的膦亚胺是三氯(三甲基甲硅烷基)膦亚胺,cl
3 p=nsime3。对聚合过程有不利影响的部分的一些实例包括-nh、-oh、酸性基团、碱基、不稳定的氟原子、有机锂试剂和格氏试剂(grignard reagent)。这些部分中的至少一些可以通过常规保护转化成非干扰基团,随后在适当的时间去保护。干扰基团通常是与增长端基团(可能是pcl
3
.pcl
6-单元)反应的那些基团。
[0099]
在一个实施方案中,r独立地为(并且根据需要被保护)氯、溴、碘、脂肪族,其包括烷基、烯基或炔基;芳烷基、烷芳基、芳基、杂烷基、杂芳基、氰基、氨基酸酯、羧酸酯、-氧基芳基,其包括但不限于-氧基苯基-对甲基、经保护的-氧基苯基co
2 h、经保护的-氧基苯基so
3 h、-氧基苯基羟基和-氧基苯基po
3 h;氧基脂肪族,其包括-氧基烷基、-氧基(脂肪族)co
2 h、-氧基(脂肪族)so
2 h、-氧基(脂肪族)po
3 h和-氧基(脂肪族)羟基,其包括-氧基(烷基)羟基;-氧基烷芳基、-氧基芳烷基、-硫代芳基、-硫代脂肪族,其包括-硫代烷基、-硫代烷芳基、脂肪族和芳基酮、膦氧化物或磷酰基化合物(p=o)、醚、砜和亚砜。
[0100]
如果与磷原子相连的r基团体积大,则其可影响聚合物的立构规整度。例如,通过适当选择r基团,可获得间同立构或全同立构聚磷腈。大体积基团例如芳基或萘基可以以间同立构的排列聚合。大基团可优选地交替其所在的磷侧以使空间相互作用最小化。
[0101]
r'优选独立地为脂肪族的,优选低级烷基、芳基、芳烷基或烷芳基。在一个优选的实施方案中,r'是低级烷基。-si(r')3部分的一些非限制性实例包括三甲基甲硅烷基、三苯基甲硅烷基、芳基二烷基甲硅烷基和叔丁基二甲基甲硅烷基。
[0102]
在反应期间,磷亚胺的磷上的r基团之一(通常是卤素例如氯)将被除去,并且磷原子上的剩余两个r基团将成为所得聚磷腈上的取代基。例如,如果磷亚胺中存在-pcl3部分,则将产生聚(二氯磷腈)。例如,如果存在-pcl2烷基或-pcl2芳基,则将分别产生-[n=p(cl(烷基)]
n-或-[n=p(cl(芳基)]
n-。
[0103]
应选择对于三聚来说稳定的膦亚胺。如果取代基总体上太大,则三聚体优于聚合物。然而,如果引发剂是长于三个重复单元的线性磷腈,则分子不能三聚化。然而,在某些情况下,这种尺寸的引发剂可能会抑制聚合。
[0104]
在一个实施方案中,选择至少一个手性的r'基团以促进手性聚合。如果阴离子是手性的并且与链端保持紧密缔合,则阴离子可影响聚合物链的立构规整度。一个实例是
pcl
4 r
*
,其中r是手性的。膦亚胺是cl(r)(r')p=ntms,其中r不等于r'。可根据已知方法制备膦亚胺。
[0105]
iii.引发剂的选择
[0106]
聚合引发剂是含有卤化物抗衡离子(优选氯化物)的阳离子物质,这将有助于从磷亚胺中除去-si(r')3。在一个实施方案中,反应引发剂是主族或过渡金属卤化物,或其他合适的卤化物盐。例如,引发剂可以是mx
n ym或ex
n ym,其中m是过渡金属元素(包括但不限于:v、cr、zr、nb、hf、ta、w、mo、mn、fe、ru、os、co、rh、ir、ni、d、pd、pt、cu、zn、cd和hg),e是主族元素(包括但不限于p、si、as、sb和ge),x是卤化物,y是对引发或聚合反应没有不利影响的任何无机或有机取代基(包括但不限于脂肪族如烷基和芳基),n为1至m或e的价态,并且m为价态减去n。例如,在五氯化磷(pcl5)中,磷的价态为5,而在wx6中,w的价态为6。一些实例为pcl5、ticl4(可能产生支化的聚合物)、tacl5(比pcl5更慢)、so
2 cl2、alcl3、vcl4、bf3、sncl4、sbcl5、zncl4、(ph)3cpf6、(ph)3csbf6、(ph)3cpcl6、(ph)3csbcl6、卤氧化物,例如pocl3、cro
2 cl、socl2和vocl3。可用作引发剂的线性磷腈盐的一些非限制性实例是:cl
3 p=n-pcl
3
a-,其中a是对反应没有不利影响的任何抗衡阴离子,其包括但不限于卤素、px
6-,并且优选氯离子或pcl
6-;以及(r)cl2p=n-(pcl3)
a-,例如rcl2p=n-pcl
3
pcl
631
。
[0107]
在一个替代实施方案中,线性磷腈盐用作引发剂,其为低聚物。例如,盐[cl3p=n-pcl3]
[pcl6]-可以与选定比率的cl3p=nsime3等同物反应以产生更长的阳离子p-n链。七个单体单元的线性磷腈盐通常是可作为单一产物获得的低聚物系列中最高的。在此之上,通常获得9和11个成员的链的混合物、或11和13个成员的链的混合物、或11、13和15个成员的链的混合物。一系列加成反应通过消除clsime3导致多种p-n盐的清洁逐步合成。为了获得3、5和7个成员的链,一次添加一个等同物。但是,为了获得更大的链,可以一次添加所有等同物。可以类似地制备其他低聚物磷腈盐,例如[rcl
2 p=n-pcl
3
]a
和r3p-[n=p(r')2]
z n=pr'2cl
a-,其中z为1至7。使用线性低聚物磷腈盐作为引发剂代表了一种用于制备聚磷腈嵌段共聚物的方法。
[0108]
使用线性磷腈盐的优点之一是其比金属盐更容易纯化且更容易官能化。此外,可以通过根据需要提高链长来提高磷腈盐的溶解度。
[0109]
实施例1
[0110]
三氯(三甲基甲硅烷基)膦亚胺的制备
[0111]
在以下中报道了三氯(三甲基甲硅烷基)磷亚胺cl
3 p=n-sime3的合成:honeyman,c.,route to new inorganic rings and polymers;the reactions of cl2rp=nsime3,(r=cl or ph)with main group and transition metal chlorides ms thesis,department of chemistry,university of toronto,1992。该合成涉及将在己烷中的单当量的lin(sime3)2逐滴添加至剧烈搅拌的冷的(-78℃)的pcl5在己烷中的浆液中。一个主要挑战是需要获得高纯度的cl3p=n-sime3。当用痕量的在ch2cl2中的pcl5处理时,通过该途径形成的单体没有以可再现的方式聚合,1h nmr谱和质谱(cl-ms)揭示了作为副产物的(me3si)2ncl的存在。该物质显示出抑制聚合。多次蒸馏没有去除(me3si)2ncl,因为该化合物在与cl3p=n-sime3相似的温度和压力下蒸馏。通过用pph3(以相对于ch2cl2中的(me3si)2ncl过量的量或化学计量的量)处理混合物以形成ph3p=nsime3和me3sicl来获得纯的cl3p=n-sime3。然后在减压下蒸馏所得混合物以得到纯的cl3p=n-sime3。通过蒸馏来纯化反应
产物,得到为透明、无色、对水分敏感的液体馏出物作为产物。
[0112]
替代地,为了避免另外的纯化步骤,还可以从pcl5与n(sime3)3在己烷中在-78℃下的反应中获得cl
3 p=n-sime3。尽管这种合成没有生成(me3si)2ncl杂质,但通过这种途径产生的cl
3 p=n-sime3的产率尚未得到优化。
[0113]
实施例2
[0114]
n(sime3)3与pcl5反应以形成cl
3 p=nsime3[0115]
如先前在文献中所报道的合成三(三甲基甲硅烷基)胺。将三甲基氯硅烷缓慢添加至四氢呋喃中的双(三甲基甲硅烷基酰胺)锂中,用磁力搅拌器搅拌并用冰浴冷却。在添加所有三甲基氯硅烷之后,将反应加热至回流持续48小时。在反应冷却至室温之后,使用真空过滤漏斗来过滤所形成的licl。使用干冰/丙酮捕集器(trap)在减压下蒸发溶剂。然后将剩余的固体升华以得到透明的无色产物。
[0116]
在0℃下,将五氯化磷(22.29g)在己烷(300ml)中搅拌。将溶解在己烷(200ml)中的三(三甲基甲硅烷基)胺(25.00g)逐滴添加至溶液。使反应缓慢升温至室温,搅拌24小时,并过滤。在室温和减压下对滤液进行分馏得到了产率为30%的cl
3 p=nsime3。
[0117]
实施例3
[0118]
n(sime3)3与pcl5反应以形成n3p3cl6[0119]
将三(三甲基甲硅烷基)胺(34.00g)溶解在二氯甲烷(300ml)中,用磁力搅拌器搅拌,并加热至回流。将溶解在二氯甲烷(300ml)中的五氯化磷(30.31g)逐滴添加至溶液。在所有溶液已添加之后,在真空下除去溶剂以提供固体物质,其为约76%三聚体、4%四聚体、3%五聚体和13%高级环状物和低聚物。
[0120]
为了促进三聚体n3p3cl6的形成,关键是在极性溶剂(例如二氯甲烷)中在回流下非常缓慢地将pcl5添加至n(sime3)3,以使线性cl3pnp(cl)2npcl
3
pcl
6-盐与n(sime3)3反应以形成环状三聚体。如果pcl5添加得太快,则热力学上有利的四聚体将成为主要产物。
[0121]
实施例4
[0122]
二氯(苯基)(三甲基甲硅烷基)膦亚胺cl2php=n-sime3的制备
[0123]
用于制备该化合物的程序类似于实施例1中针对cl
3 p=n-sime3描述的程序,不同之处在于:在-78℃下,在机械搅拌下向己烷(1000ml)中的四氯苯基正膦(80g,0.32mol)逐滴添加双三甲基甲硅烷基)酰胺锂lin(sime3)2(53g,0.32mol)在己烷(500ml)中的溶液。将透明、无色的产物蒸馏(bp 53℃,0.02mm hg)并确定为cl
3 php=n-sime3。产率47.0g(55%)。
[0124]
31
p nmr(ch2cl2)δ-11.8ppm;
13
c nmr(cdcl3)δ133.2ppm(δ,4j
cp
=4hz,p-ph),δ130.7ppm(δ,3j
cp-13hz,m-ph),δ128.7ppm(δ2jcp=19hz,o-ph),δ1.9ppm(δ,4j
cp
=7hz,ch3),ipso-ph未观察到;1h nmr(cdcl3)d 8.0ppm(δ,ofδ,3j
hp
=19hz,2j
hh
(om)=hz,2h,o-ph),δ,7.5ppm(br.,3h,p-and m-ph),δ0.2ppm(δ,4j
hp
=3hz,9h,ch3)。
[0125]
实施例5
[0126]
通过2当量的pcl5与1当量的cl3=n-sime3反应来制备[cl3p=n-pcl3][pcl6]
[0127]
将两当量五氯化磷(3.6g,17mmol)溶解在二氯甲烷(50ml)中并将所得搅拌溶液冷却至-78℃。将单当量的cl3p=n-sime3(2.0g,9mmol)快速添加至注射器,并立即使反应混合物温热至室温。在真空中除去溶剂,得到细的白色粉末,其被鉴定为[cl3p=n-pcl3][pcl6]。
产率4.3g(90%)。
31
p nmr(ch2cl2)δ22.4ppm(=pcl3),δ-2936([pcl6]-)。
[0128]
实施例6
[0129]
通过1当量的[cl
3 p=n-pcl3]
[pcl6]-与1当量的cl
3 p=n-sime3反应来制备[cl
3 p=n-pcl
2-n=pcl3]
-[pcl6]-[0130]
将盐[cl3p=n-pcl3]
[pcl6]-(1.5g,3mmol)溶解在二氯甲烷(50ml)中并将所得搅拌溶液冷却至-78℃。通过注射器快速添加cl
3 p=n-sime3(2.0g,9mmol,1当量)并立即使反应混合物温热至室温。在真空中除去溶剂,得到细的白色粉末,其被鉴定为[cl3p=n-pcl
2-n=pci3]
[pcl6]-。产率1.8g(92%)。
[0131]
31
p nmr(ch2cl2)δ14.6ppm(d,2j
pp 45hz)=pcl3,δ-10.5ppm(t,2j
pp 45hz)-pcl2,-,δ-293.6ppm[pcl6]-。
[0132]
iv.聚合条件
[0133]
所公开的用于制备聚磷腈的途径提供了用于控制聚合物分子量和结构的机会,并允许获得具有窄多分散性的聚磷腈。本文所述的合成途径可以产生低聚物至高分子量聚合物的产物。聚合物的典型分子量范围为大约103至106,但也可以制备在此范围之外的其他聚合物。重要的是,该过程可以在或接近环境温度下进行。
[0134]
本文所述的用于制备聚磷腈的途径就所需的化学品和所需的温度而言与目前可用的任何替代品相比要简单得多且便宜得多。此外,新聚磷腈的相对容易的制备和获得在聚磷腈化学领域中无论在学术上还是在工业上都至关重要。
[0135]
这种方法允许回收clsime3,这在经济和环境方面都是重要的。这与起始物料clsime3和pcl5或rpcl4的大规模可用性一起为聚磷腈的大规模合成且为聚(磷腈)的可用性和效用的显著扩展提供了有利的前景。
[0136]
用于进行溶液反应的操作非常简单并且易于在制造规模上实现。将选定的膦亚胺与溶剂混合,然后添加少量引发剂并搅拌溶液。
[0137]
重要的是,反应混合物是均匀溶液以获得窄的pdi。引发剂和膦亚胺、所形成的初始低聚物以及聚合物产物应该是可溶的以保持分子量控制和窄的pdi。因此,溶解度限制了单体和引发剂的选择。优选的是,在进行反应之前,用硅化试剂(例如clsime3)预处理玻璃或搪玻璃反应容器。
[0138]
反应在对聚合反应没有不利影响的任何有机溶剂中进行,即溶剂在反应条件下必须是惰性的。其也应该是干燥的。二氯甲烷和其他卤化惰性溶剂是用于聚(二氯磷腈)溶液合成的优选溶剂。其他合适的溶剂包括但不限于甘醇二甲醚、二甘醇二甲醚、甲苯、乙腈、二氧六环和环己烷。
[0139]
溶剂的选择将影响产物的分子量分布。如果使用二氧六环,则可以获得多峰gpc迹线。如果使用的溶剂太少(例如,不足以将所有反应物带入溶液中),则聚合可类似于在纯(neat)(即本体(bulk))条件下发生的聚合,并产生多峰gpc迹线。
[0140]
反应可以在不会过度影响反应物或产物的任何期望温度下进行。重要的是,大多数聚合反应根本不需要加热。反应通常在20至23℃的温度范围内进行。
[0141]
可以控制产物的分子量,例如,通过选择引发剂、单体/引发剂之比,通过将单体添加到预制的活跃链或活性链中,或通过控制反应的时间。
[0142]
可以使用提供期望产物的任何的膦亚胺与引发剂之比。在一个实施方案中,使用
100至5摩尔的单体与1摩尔的引发剂,优选20至5摩尔的单体。随着引发剂与磷亚胺之比提高,产物的分子量降低。pcl5和cl3pnpcl
3
a-是优选的引发剂。
[0143]
反应进行提供期望产物的任意量时间。通常,大约6至24小时的反应时间是典型的,然而,聚合反应可在两小时内完成。
[0144]
反应可以在环境压力或减压下、在空气中或在惰性气氛例如n2中进行,视起始物料和产物而定。
[0145]
如在实施例7中更详细地描述的,使用该方法可以获得的对分子量的控制和非常窄的多分散性将该方法与相应的本体(即,无溶剂)方法区分开来。
[0146]
实施例7
[0147]
膦亚胺本体聚合和溶液聚合的比较
[0148]
假定用痕量pcl5处理cl
3 p=nsime3可产生高分子量的聚(二氯磷腈),并且对磷亚胺与pcl5之比的控制可允许控制所产生的聚合物的分子量。在室温下将痕量pcl5(约10mg)添加至纯cl3p=nsime3(1.0g)在5天之后导致形成两相混合物。两相都是透明且无色的,但通过1h nmr谱发现上部更具流动性的层主要由me3sicl组成。整个试管内容物的
31
p nmr谱主要显示出聚(二氯磷腈)的尖单峰特征。因此,cl3p=nsime3向线性聚合物的转化基本上是定量的。将聚(二氯磷腈)产物用过量的naoch2cf3处理,并且所得聚合物给出了公知聚合物[n=p(och
2 cf3)2]n的
31
p nmr信号特征。通过凝胶渗透色谱法(gel permeation chromatography,gpc)对该聚合物的分析表明,相对于聚苯乙烯标准品,该聚合物仅具有mw=2.1
×
105和多分散性指数(pdi=mw/mn)=1.8的高分子量级分。然而,在随后通过在相同的无溶剂条件下提高pcl5与单体之比来获得低分子量聚(二氯磷腈)的尝试中,引发剂和初始阳离子产物基本上保持不溶。产生的聚合物的分子量值低于上述实验中的分子量值,但该聚合物的gpc迹线是多峰的。结果表明,由于过程的异质性,在无溶剂体系中缺乏分子量控制。
[0149]
相比之下,cl
3 p=nsime3与痕量pcl5在二氯甲烷溶液中的反应导致定量转化为具有非常窄的多分散性的聚(二氯磷腈)(通过对三氟乙氧基衍生物[n=p(och2cf3)2]n的
31
p nmr谱和gpc分析所估计的)。溶液中膦亚胺与pcl5之比的提高导致分子量提高,同时仍保持窄的pdi值,如下表1所示。
[0150]
表1
[0151][0152]
*
多峰的gpc迹线
[0153]
痕量的pcl5与phcl
2 p=nsime3在本体状态下在室温下的类似反应也产生了聚合
物产物。在这种情况下,聚合导致形成聚[芳基(氯)磷腈],[n=p(ph)cl]n,其被转化为已知的mn=8.0
×
104且多分散性为1.4的大分子[n=p(ph)(och2cf3)]n。进行了单体与引发剂之比对cl3p=n-sime3的分子量聚合的作用的研究。结果(见下表2)表明,溶液中膦亚胺与pcl5之比的提高导致分子量的提高,同时仍保持窄的pdi值。
[0154]
表2
[0155][0156]a通过gpc相对于聚苯乙烯获得的
[0157]b由单体与pcl5引发剂的初始比计算的
[0158]
实施例8
[0159]
由三氯(三甲基甲硅烷基)膦亚胺制备聚(二氯磷腈)
[0160]
三氯(三甲基甲硅烷基)膦亚胺的溶液聚合根据以下通用程序进行。所有玻璃器皿均用己烷中5%clsime3进行预处理,并在真空下干燥。cl3p=nsime3在使用之前升华并储存在氮气下。在氮气下,将pcl5(100mg)在ch2cl2(10ml)中的溶液添加至cl3p=nsime3(1.0g,4.4mol)在ch2cl2(35ml)中的经搅拌的溶液中。将溶液搅拌24小时。通过
31
p nmr来分析产物。
[0161]
使用以下所示出的技术和仪器进行分析。使用bruker wm-360mhz谱仪获得1h nmr(360.0mhz)、
13
c nmr(90.020mhz)和
31
p nmr(145.8mhz)谱。对于质子和碳,在δ=0时化学位移与四甲基硅烷有关。在δ=0时,磷的化学位移与85%h3po4相关,具有从参考值向低场的正位移值。所有杂核nmr谱都是质子解耦的。
[0162]
使用配备有hp1037a折光率检测器和polymer laboratories pl凝胶10μm柱的hewlett packard hp 1090凝胶渗透色谱仪来测定分子量。样品用四正丁基溴化铵在thf中的0.1重量%的溶液洗脱。使用聚苯乙烯标准品(waters)校准gpc柱,结果在表1中提供。
[0163]
实施例9
[0164]
由二氯(苯基)(三甲基甲硅烷基)膦亚胺制备聚氯(苯基)磷腈
[0165]
根据实施例7中描述的本体聚合方法,使用cl2php=nsime3而不是cl3p=nsime3来制备聚氯(苯基)磷腈。用三氟乙醇钠处理该聚合物得到与文献报道相同的聚合物。重均分子量为3.0
×
104,以及多分散性(mw/mn)为1.4。
[0166]
实施例10
[0167]
大缩合(macrocondensation)的证据
[0168]
在单体转化完成之后没有立即进行卤素替换,而是在取代之前在25℃下保持数天的聚(二氯磷腈)样品显示出分子量分布的变化。gpc色谱图并不像预期的那样由单个尖峰组成,而是由具有分子量更高的肩峰的峰组成。肩峰对应于原始峰分子量的大约两倍。这发
生在数个单体与引发剂之比下,并表明了其中两条聚合物链连接在一起以形成两倍分子量的单一聚合物的大缩合反应。为了研究这种现象,用23:1 1:pcl5比率的样品进行了聚合实验。将聚合溶液分成两等份。第一份样品在单体转化为聚合物之后立即用二氧六环中的naoch2cf3处理。该经取代的聚合物2的gpc色谱图包含一个尖峰,其对应于mn=2.0
×
104和pdi=1.09的值。第二份样品没有经取代,而是在25℃下以[n=pcl2]n形式搅拌20天。然后用在二氧六环中的naoch2cf3处理以产生mn=2.2
×
104和pdi=1.17的聚合物。然而,该聚合物的gpc色谱图在大约是第一聚合物分子量的两倍处有另外的高分子量的肩峰。这表明[n=pcl2]n大缩合可随时间发生。该过程的可能机制是两条聚合物链水解偶联以得到分子量是原来的两倍的大分子。另一种可能性是两条中性链端(cl3p=n-)偶联以形成二聚体物质。因此,为了获得分子量受控的聚合物,必须在单体转化完全之后立即对聚合物进行取代或将物质储存在低于0℃的温度下。
[0169]
v.封端
[0170]
在此过程中,正在增长的聚合物的链端在整个聚合期间是活跃的,以及在单体全部消耗之后也是活跃的。“活跃的”意指末端处于反应性状态,特别是处于阳离子状态。因此,其可用作用于聚合或衍生化的另外的反应性位点。
[0171]
在一个实施方案中,期望的部分与阳离子聚合物的末端反应以影响聚合物的物理性质,例如溶解度、玻璃化转变温度、亲脂性、形态学蠕变、结晶度、体积模量、黏度、电导率、折光率或热稳定性。链端可以以任何合适的方式失活,例如用氧源或通过亲核试剂。聚合物可以与例如so3、naor或nh2r反应,其中r是脂肪族或芳香族基团。so3可以选择性地与端基反应以停止增长。naor和nh2r可以任意地与端基和聚合物链反应。然而,在产生聚合物中使用这些化合物可以做出这些方便的选择。氢化物源也可以选择性地与端基反应。
[0172]
在一个实施方案中,含有可用于将另一期望部分连接至聚合物的官能团的部分与阳离子聚合物末端反应。术语“官能团”、“反应性基团”或“反应性官能团”在本文中可互换使用以描述能够进行通常导致键形成的化学反应的化学基团。根据本发明的一些实施方案,该键优选为共价键。导致键形成的化学反应包括但不限于环加成反应(例如第尔斯-阿尔德反应(diels-alder’s reaction)、1,3-偶极环加成huisgen反应和类似的“点击反应”)、缩合、亲核和亲电加成反应、亲核和亲电取代、加成和消除反应、烷基化反应、重排反应和任何其他已知的涉及反应性基团的有机反应。活性官能团的一些非限制性实例包括但不限于(并且根据需要被保护)胺、亚胺、烷基硅氧基硅烷、羟基、羧酸、羧酸氯化物、羧酸酐、酰胺、酯、磺酸、亚磺酰基、磺酰胺、磺酸根、磺酰氯、磷酸根、膦酸根、膦酸、膦酰氯、卤素或酰卤或烷基卤、烷氧基、芳氧基、叠氮化物、炔烃、醚、醛、酮、杂芳族化合物,其包括吡啶、亚氨基、硝基、亚硝酸根、铵盐、硅烷、硫代烷氧基、硫代芳氧基、硫代氨基甲酸根、硫代羰基、硫羟基、硫脲和脲。
[0173]
在一个替代实施方案中,可以将部分添加至聚合物中,该部分赋予聚合物特定的生物学特性,例如阳离子电荷(例如,聚赖氨酸或其他带正电荷的物质,用于组织黏附),或提供用于连接生物活性分子的位点,所述生物活性分子包括但不限于抗体、抗原、蛋白质、多糖、核蛋白、脂蛋白、合成多肽或与蛋白质、类固醇、核酸、核苷酸、核苷、寡核苷酸(包括反义寡核苷酸)、cdna、核酸或基因相连的小分子。
[0174]
在另一个实施方案中,活性链可以用具有式r'3p=nsir3的三(有机)膦亚胺封端。
此外,r'可以独立地为烷基、烯基、炔基、芳基、烷氧基、芳氧基。三(有机)膦亚胺的一个具体实例是(cf3ch2o)3p=nsime3,其中sime3基团的存在允许与聚合物阳离子反应,而磷上不存在氯单元导致终止。例如,当用2%摩尔当量的在ch2cl2中的pcl5引发的cl3p=n-sime3聚合溶液在聚合期间定期用痕量(cf3ch2o)3p=nsime3处理时,如通过
31
pnmr谱所监测的,聚合物阳离子的生长被抑制。在用naoch2cf3替代氯之后所得聚合物的gpc检测表明,用于封端聚合的分子量的范围一致。(见表3)。遗憾的是,末端-n=p(och
2 cf3)3基团在经封端聚合物中的存在无法由用20%摩尔当量的pcl5处理cl
3 p=n-sime3而合成的聚(二氯磷腈)低聚物样品的
31
p nmr谱得到证实。末端-n=p(och
2 cf3)3物质的共振可能被寡(二氯磷腈)物质的共振所掩盖。在为了确认这样的封端基团的存在的进一步努力中,通过用10%摩尔当量的pcl5处理cl3p=n-sime3而合成的[n=pcl2]n低聚物样品用me2(cf3ch2o)p=nsime3处理。通过
31
p nmr谱对该经封端物质的检查揭示了末端-n=pme2(och
2 cf3)物质来自9.4ppm处的双峰共振。在用naoch2cf3进行大分子取代之后,发现这种经封端低聚物的mn为5.9
×
103(pdi=1.05,通过gpc)。
[0175]
表3 hua[0176][0177]a所有实验均在单体与引发剂之比为50:1的情况下进行
[0178]b由单体与pcl5引发剂的初始比计算的
[0179]
实施例11
[0180]
增长聚磷腈链的活性
[0181]
研究了聚(二氯磷腈)的增长聚合物链的活性。制备了聚(二氯磷腈)在ch2cl2中的溶液,其中如通过
31
p nmr谱测定的,所有磷亚胺均已转化为聚合物。使这其中的一部分进行卤素取代以产生经三氟乙氧基取代的mw=1.1
×
104以及pdi=1.04的聚合物。向剩余的原始(未经取代的)溶液中另外添加磷亚胺导致cl3p=nsime3在48小时内持续转化为聚合物。来自该溶液的经三氟乙氧基衍生的聚合物的gpc迹线表明存在mw=9.2
×
105以及pdi=1.71的聚合物。
[0182]
因此,显示出活性链末端可以在添加更多单体之后恢复链增长。这为控制链长和链末端与其他单体或聚合物的偶联开辟了许多可能性。
[0183]
vi.聚磷腈的嵌段共聚合
[0184]
本文所公开的制备聚磷腈的方法首次提供了用于制备广泛多种的磷腈嵌段共聚物的途径。使用现有技术方法,唯一已知的嵌段共聚物是[np(or1)2]
x
[np(or1)(or2)]y,其中r1是卤化烷氧基并且r2是脂肪族或芳基部分。现在可以获得除这些有限聚合物之外的嵌段共聚物。
[0185]
可以使用至少三种不同的方法来制备聚磷腈的嵌段共聚物。在第一实施方案中,
嵌段共聚物通过由聚磷腈的活性末端基团引发的单体的阳离子聚合来制备。可以使用能够与阳离子位点反应的任何单体或聚合物。通过阳离子机制反应的单体的一些实例包括环氧化物、环氧乙烷、环硫化物、三烷、四氢呋喃、乙烯基醚、丙烯醛和其他能够进行阳离子聚合的烯烃,例如1-烷基烯烃(α-烯烃)、1,1-二烷基烯烃、1,3-二烯、苯乙烯、a-甲基苯乙烯、n-乙烯基咔唑、n-乙烯基吡咯烷酮以及醛和酮。另外,其他磷腈单体可用于产生磷腈-磷腈嵌段。然后可以使活性有机嵌段与另外的磷亚胺单体反应,该单体与第一磷腈聚合物嵌段中使用的单体相同或不同。该操作可以使用任何种类的阳离子有机单体和磷亚胺单体或没有有机嵌段的不同磷亚胺单体继续进行,持续期望的时长。应该在取代之前添加嵌段,因为取代可使链末端失活。
[0186]
在用于产生聚磷腈的嵌段共聚物的第二实施方案中,官能化的化合物与活性聚磷腈末端反应,所述活性聚磷腈末端具有引发除阳离子聚合之外的反应机制的部分,例如阴离子或自由基引发。可以使用可以连接到聚合物链末端并并入到第二嵌段中的任何引发剂。例如,具有溴苯基部分的封端可以转化为合适的有机金属物质(例如格氏试剂或有机锂试剂)以引发合适单体的阴离子聚合。烯烃部分可用于复分解反应。任选地,然后可以在适当的时间使阴离子末端与具有能够引发阳离子聚合的基团的单体或聚合物反应以添加另外的聚磷腈嵌段。这些单体的一些实例包括乙烯基醚和丁二烯。单体必须经历活性聚合以以这种方式形成磷腈-有机-磷腈的aba嵌段。例如,使用包含卤代烷基或卤代芳基部分(例如溴苯基部分)的封端可以转化为合适的有机金属试剂(例如格氏试剂或有机锂试剂)以允许通过阴离子机制聚合的单体的阴离子聚合,例如苯乙烯硅氧烷、乙烯丙烯酸酯、甲基丙烯酸酯、丙烯酰胺、甲基丙烯酰胺、丙烯腈和甲基丙烯腈。任选地,然后可以在适当的时间使阴离子末端与具有能够引发阳离子聚合的基团的单体或聚合物反应以添加另外的聚磷腈嵌段。具有反应性末端基团的预制聚合物(其可以用磷亚胺封端并转化为活性p=np
盐氨基或羟基封端的聚合物)的用途可以用作合成pcl6cl3p
-n=pr
2-聚合物-r2p=npcl
3
pcl
6-类型的大分子引发剂的模板。因此,多嵌段共聚物的合成通过从预聚物链端增长是可能的。
[0187]
在制备嵌段共聚物的第三实施方案中,用于磷腈聚合的引发剂可以包含在其他聚合物体系中。例如,具有n=pr3末端基团的有机聚合物可以用于引发磷腈聚合。
[0188]
实施例12
[0189]
有机聚合物/聚磷腈嵌段共聚物的制备
[0190]
在net3的存在下,将可商购获得的聚合物二齿胺nh
2-peg-nh2[其中peg=-ch2ch2o(ch2ch2o)
n-ch2ch
2-,mn=3400]与(cf3ch2o)2rp=nsime3混合以产生磷亚胺nh(r
2 p=nsime3)-(ch2ch2o)
n-ch2ch
2 n(h)(r
2 p=nsime3)。随后,将磷亚胺与两个摩尔当量的pcl5在-78℃下在ch2cl2中反应,这使得形成大分子引发剂nh(r2p=npcl
3
)pcl
6-(ch2ch2o)
n-ch2ch2n(h)[r2p=npcl
3
]pcl
6-。然后将该大分子引发剂用30倍过量的cl3p=nsime3处理,并且在25℃下3小时之后,通过31p nmr谱对反应混合物的检查显示完全转化为新形式的聚(二氯磷腈),nhr
2 p-(n=pcl2)
m-(ch2ch2o)
n-ch2ch2n(h)cl2p[n=pr2]m。将该产品在二氧六环溶液中用过量的三氟乙醇钠处理,以用三氟乙氧基替代氯原子并产生水解稳定的嵌段共聚物nhr
2 p-(n=pr2)-(ch2ch2o)
n-ch2ch2n(h)r2p[n=pr2]m,其中r=och2cf3。
[0191]
在thf中通过凝胶渗透色谱法(gpc)对该嵌段共聚物的分析表明,与聚苯乙烯标准品相比,该嵌段共聚物具有1.5
×
104的mn和1.16的多分散性指数。
[0192]
vii.三臂星形聚磷腈
[0193]
实施例13
[0194]
三臂星形聚磷腈n{ch2ch2nh(cf3ch2o)2p-[n=p(och2cf3)2]n}3的合成
[0195]
磷亚胺如在醇盐或胺存在下很容易发生取代反应,以产生(cf3ch2o)2rp=nsime3物质(r=ro-或rnh-)。考虑到这一点,在net3存在下,将三齿伯胺n(ch2ch2nh2)3与(cf3ch2o)2brp=nsime3混合,以产生三官能磷亚胺n{ch2ch
2 nh(cf3ch2o)2p=nsime3}3。n{ch2ch2nh(cf3ch2o)2p=nsime3}3与六摩尔当量的pcl5在-78℃下在ch2cl2中的后续反应使得形成三官能阳离子物质[n{ch2ch2nh(cf3ch2o)2p=n-pcl
3
}3][pcl
6-]3。然后将该物质在ch2cl2中用30倍过量(每个反应性位点)的cl3p=nsime3处理。在25℃下3小时之后,通过
31
p nmr谱对反应混合物的检查显示基于在-17ppm处的特征共振以及[n{ch2ch2nh(cf3ch2o)2p=n-pcl
3
}3][pcl
6-]3的双峰共振损失,显示cl3p=n-sime3完全转化为新形式的聚(二氯磷腈),(n=pci2)n。还检测到在约8.2ppm处的双峰共振,以及在-14.5和-15.5ppm处的三峰共振,这与星形聚合物n{ch2ch
2 nh(cf3ch2o)2p=n-pcl2n=pcl2[n=pcl2]n}3的存在一致。与星形聚合物相关的
31
p nmr共振的整合与基于初始反应物比率的理论值一致。将该产物用过量的三氟乙醇钠处理,以用三氟乙氧基替代氯原子,并产生水解稳定的星形聚合物n{ch2ch2nh(cf3ch2o)2p-[n=p(och2cf3)2]n}3。通过凝胶渗透色谱法(gpc)对该聚合物的分析表明,与聚苯乙烯标准品相比,该聚合物具有2.1
×
104的mn和1.03的多分散性指数。这些星形聚合物的分子量可以通过改变单体:引发剂之比来控制。(参见表4)。在可检出末端基团单元[-n-p(och2cf3)
2-]的情况下,通过
31
p nmr谱的末端基团分析也用于提供分子量估计。
[0196]
表4
[0197][0198]a用naoch2cf3替代cl之后通过gpc得到的分子量
[0199]b使用
31
p nmr谱通过末端基团分析得到的分子量
[0200]c以100%转化率计算的
[0201]
n{ch2ch2nh(cf3ch2o)2p-[n=p(och2cf3)2]n}3的低分子量样品与分子量相当(1.2
×
104)的线性类似物[n=p(och2cf3)2]n的物理特性初步比较显示,虽然线性聚合物是易于形成膜的结晶白色纤维材料,但三臂星形聚合物是淡黄色的黏性胶。分子量高于1.7
×
104的相应星形和线性聚合物表现出相似的物理特性。另外,mn高于2.1
×
104的n{ch2ch2nh(cf3ch2o)2p-[n=p(och2cf3)2]n}3的gpc色谱图显示出低估了分子量并提供了其支链性质的间接证据。由于聚磷腈公知的阻燃特性,这些分子量受控的星形聚合物可被证明可用作易燃有机聚合物的添加剂。
[0202]
实施例14
[0203]
具有受控分子量和多分散性的聚磷腈的通用合成方案
[0204]
本实施例描述了基于本领域已知方法的用途和常规调整的用于产生具有受控分子量和多分散性的聚磷腈组合物的通用方案。(参见例如,allcock h.r.,et al.,
“’
living’cationic polymerization of phosphoranimines as an ambient temperature route to polyphosphazenes with controlled molecular weights,”macromolecules,29:24,pp.7740-7747,18nov.1996;wang b.,“development of a one-pot in situ synthesis of poly(dichlorophosphazene)from pcl3,”macromolecules,38(2),pp.643-645,24dec.2005;allcock,h.r.,“synthesis,structures,and emerging uses for poly(organophosphazenes),”polyphosphazenes in biomedicine,engineering,and pioneering synthesis,ch.1,pp.3-26,2aug.2018;和gabino a.,et al.,“designed synthesis of polyphosphazene block copolymers for self-assembly,”polyphosphazenes in biomedicine,engineering,and pioneering synthesis,ch.10,pp.211-240,2aug.2018)。
[0205]
本领域中知晓用于在环境温度下合成聚(二氯磷腈)的多种方法,如本实施例中所引用的。通常,这些方法涉及在ch2cl2中使用少量pcl5引发cl3p=nsime3,以产生具有受控(窄)多分散性的聚(二氯磷腈),(npcl2)n。在这些类型的方法中,pbr5、sbcl5和ph3c[pf6]是室温下在ch2cl2中有效的引发剂。聚(二氯磷腈)的分子量可以通过改变单体与引发剂之比来控制。聚合物链在链增长之后是有活性的,因为进一步添加单体会导致形成更高分子量的聚合物。这些反应的1h和
31
p nmr谱分析可用于显示相对于单体浓度的一级反应动力学之后的聚合。通过添加痕量的me2(cf3ch2o)p=nsime3或(cf3ch2o)3p=nsime3,可以使活性聚合物链结束或封端。
[0206]
allcock et al.,1996,同上,提供了一种普遍适用的反应示意图,如下所示。
[0207][0208]
产品“j”(参见图1)的目标分子量可以通过常规实验和方法设计来控制。最后,纯化和定量步骤是技术人员理解和常规可用的。
[0209]
实施例15
[0210]
聚磷腈-紫杉醇缀合物[np(mpeg550)3(lys-oet)(aa)(ptx)]n的合成
[0211]
该实施例提供了用于合成合适的聚磷腈并随后将其与目的药物物质(例如,紫杉醇,“ptx”)缀合的方法。
[0212]
聚磷腈载体聚合物[np(mpeg550)3(lys-oet)]n的合成
[0213]
a.cl3p=nsime3的制备
[0214]
将lin(sime3)2(4.94g,29.5mmol)溶解在戊烷(100ml)中,并将溶液使用冰-丙酮浴
冷却至0℃。然后在10分钟内逐滴添加pcl3(3.98g,29mmol)。将所得混合物在0℃下搅拌30分钟,得到白色混悬液。然后将so2cl2(4.18g,31mmol)在10分钟内在0℃下逐滴添加至混悬液。使反应在0℃下进行30分钟。然后将混合物通过硅藻土过滤(使用之前在约120℃下干燥》48小时),然后用戊烷(2
×
20ml)洗涤。在真空(20mm hg,0℃)下去除所得淡黄色滤液中的挥发物以得到cl3p=nsime3(5.2g,78%),其为淡黄色液体,其纯度足以用于下一步骤。
[0215]
b.聚磷腈载体聚合物[np(mpeg550)3(lys-oet)]n的制备
[0216]
根据allcock et al的方法(allcock h.r.,et al.,18nov.1996,下文),在作为催化剂的pcl5存在下,从cl3p=nsime3制备聚(二氯磷腈)。典型的合成程序如下:在氮气氛下将pcl5(74mg,0.356mmol)在脱气的ch2cl2(20ml)中的溶液置于50ml rbf中并使用磁力搅拌器搅拌。然后在搅拌下将cl3p=nsime3(4g,17.81mmol)在脱气的ch2cl2(40ml)中的溶液添加至烧瓶中。通过1h-nmr谱监测反应混合物。在4小时之后,cl3p=nsime3完全转化为聚合物。减压去除挥发物以获得聚(二氯磷腈)([npcl2]n)(2.0g)。
[0217]
mpeg550的钠盐通过使mpeg550(14.22g,25.85mmol)与过量的金属钠(1.2g,52.17mmol)在无水甲苯中在回流温度下反应12小时来制备。在过滤所得溶液以去除过量金属钠之后,在-5℃至0℃下将滤液缓慢滴至聚(二氯磷腈)([npcl2]n)(2.0g,17.26mmol)溶解在无水thf(100ml)中的溶液中。将反应混合物在-5℃至0℃下搅拌2小时并在室温下进一步搅拌16至18小时以产生聚乙二醇化聚磷腈。
[0218]
将boc-赖氨酸乙基酯(na-boc-lys-oet,3.7g,13.5mmol)溶解在无水氯仿(100ml)中并用无水三乙胺(et3n,13.6g,134.4mmol)进行中和。将该溶液缓慢添加至上述制备的聚乙二醇化聚合物溶液中,并使其在室温下反应24小时。将反应混合物过滤以去除副产物(et3n.hcl或nacl盐),并将滤液在真空下浓缩以提供呈褐色稠油状的聚合物磷腈。
[0219]
通过将上述剩余物溶解在ch2cl2(20ml)和tfa(20ml)的混合溶液中来去除来自聚合物磷腈的
t-boc保护基。将反应混合物在室温下搅拌6小时,并在真空下蒸发溶剂。将产物用nahco3溶液中和,并使用再生纤维素膜(mwco:3.5kda)在水中透析24小时。
[0220]
将经透析的溶液冷冻干燥以获得纯载体聚合物[np(mpeg550)3(lys-oet)]n,使用分子量截止在25和100kda的纤维素膜在蒸馏水中对其进行分馏。产量:4.0g(mwco:25kda);1.0g(mwco:100kda)。
[0221]
实施例16
[0222]
静脉内毒性研究
[0223]
本研究的目的是确定试验动物在单次肠胃外施用之后的最大耐受剂量,在这种情况下是静脉内(iv)注射药物递送组合物至sprague-dawley大鼠,然后进行7天的观察期。
[0224]
测试药物递送组合物
[0225]
在该实施例中,药物递送组合物被优化以携带并递送活性化学治疗剂紫杉醇(ptx,约5%)。(见下文表5)。简而言之,在超净台中的无菌条件下,将用于形成和注射目的的无菌水添加至适量的药物递送组合物以提供350mg/ml、817mg/ml、1167mg/ml和1750mg/ml的浓度。根据需要搅拌、混合或涡旋经稀释的药物递送组合物以实现充分分布。将制备的药物递送组合物在环境温度下避光储存。将每个浓度的最终制剂在施用之前通过0.2μm过滤器。为每个剂量准备的目标体积是1.55ml。记录过滤之后分配的实际体积。用于施用的最终制剂可在制备之后长至4小时使用。
[0226]
动物对象
[0227]
本实施例中的对象由年龄适合于称量的完整雄性sprague-dawley大鼠组成。sprague-dawley大鼠的多种商业来源在供应对象动物方面是可接受的。施用开始时对象动物的最大体重为330gm,而最小体重为260gm。给对象动物提供笼舍、喂养其、向其提供任意饮水,并根据标准畜牧协议(standard animal husbandry protocol)对其进行观察。针对可影响研究结果的任何可观察到的疾病或损伤排除对象动物。
[0228]
从自供应商处收到之日起对对象动物进行bid观察,直至由于其例如但不限于以下的身体和行为属性被安乐死:1)体重损失(例如,相比于给药前的值,损失超过体重的20%);2)濒死状态(例如,抑郁、完全厌食和体温过低、昏迷/苍白/摸起来凉(持续较长时间));3)不能或极度不愿站立(例如,持续24小时);4)cns病症(例如,持续的头部倾斜、动作失调、共济失调、震颤、痉挛、抽搐、转圈或轻瘫,持续超过1小时);5)无法控制的疼痛/痛苦;6)长时间疼痛和/或痛苦的迹象;7)其他病症(例如,腹泻、便秘或呕吐,如果长期并导致消瘦和/或虚弱、长期或剧烈利尿导致严重脱水的话);和8)可能与研究特定活动相关的并发症(例如,导管移位、切口出血等)。
[0229]
如果观察到任何显著的异常临床观察结果并且兽医认为有必要对动物进行治疗以减轻疼痛和/或痛苦(这可能包括安乐死)的话,则向主治兽医发出警报。
[0230]
测试药物递送组合物施用
[0231]
简言之,根据表5,使对象1在第0天通过缓慢(1ml/分钟)推注iv注射接受1750g/kg(剂量体积5ml/kg)的药物递送组合物。在观察先前给药的对象1之后约1小时,使对象2在第0天通过缓慢(1ml/分钟)推注iv注射接受4083mg/kg(剂量体积5ml/kg)的药物递送组合物。在观察先前给药的对象2之后约1小时,使对象3在第0天通过缓慢(1ml/分钟)推注iv注射接受5833mg/kg(剂量体积5ml/kg)的药物递送组合物。最后,在观察先前给药的对象3之后约1小时,使对象4在第0天通过缓慢(1ml/分钟)推注iv注射接受8750mg/kg(剂量体积5ml/kg)的药物递送组合物。在施用药物递送组合物之后,观察所有对象动物7天。如果在施用活性药物递送组合物之后注意到不良临床事件,则停止给药。第7天,对动物实施人道安乐死并进行尸检。
[0232]
表5剂量水平
[0233][0234]
临床观察
[0235]
从自供应商处收到之日起对动物对象进行bid观察,直至由于这样的身体和行为属性被安乐死,身体和行为属性例如但不限于如上文提到的在下表6中设定的施用后时间
表中的。
[0236]
表6施用后临床观察
[0237][0238]
结果
[0239]
组1至3中的对象动物很好地耐受了它们各自的施用,在整个研究过程中没有观察到不良反应或没有记录到临床上显著的观察结果。在组1至3的动物中没有注意到显著的身体变化。由于观察到发病率,组4中的动物在施用之后20小时被安乐死。
[0240]
组1至3中的动物存活,直到第7天的预定终止。在预定/非预定终止之后,所有动物都经历了有针对性的大体尸检(gross necropsy)程序。根据临床观察,组1至组3总体健康状况良好。没有注意到任何动物出现显著的体重减轻。注意到组4在第0天和第1天尾巴出现红色/粉红色/绿色变色和坏死外观。根据异常观察结果的部位和大体尸检结果,异常临床观察结果可能是由于施用了8750mg/kg组合物。在对所有动物进行的有针对性的尸检(心脏、肺、肝、肾和脾)中没有发现异常组织。基于这些发现,施用的组合物对组织/器官的全身作用的成功标准得以满足。
[0241]
在用1750、4083和5833mg/kg所施用组合物的单次缓慢推注iv注射处理的动物中未观察到显著的全身或局部作用。8750mg/kg(组4)组合物的施用的特征在于尾巴的红色/粉色/绿色变色和坏死外观。
[0242]
示例性治疗剂和化学治疗剂
[0243]
虽然本发明的药物递送组合物和平台旨在限于任何特定的一种或更多种作用机制,但预期本组合物可用于递送多种相应的治疗剂和相应类别的治疗剂和药物。
[0244]
根据本发明的一些实施方案,与本文所述的药物递送平台缔合的治疗剂是根据它们各自的吸收、分布、代谢、排泄和毒性(adme-tox)的药代动力学和药理学参数(本文统称为adme-tox参数)来选择的。这些adme-tox参数决定了药物的一些治疗效力,因此虽然一些药物在体外可能非常有效,但由于吸收和/或分布缓慢,和/或代谢和/或排泄迅速,它们的adme-tox参数可能会使其效果降低。
[0245]
在一些实施方案中,抗癌药是烷化剂或烷化抗肿瘤剂。烷化剂构成了一类化学治疗剂,其表现出使广泛多种的分子(包括蛋白质、rna和dna)烷基化的能力,并且这种通过其烷基与dna共价结合的能力是其抗癌作用的主要原因。dna由两条链构成,并且分子可以与
dna的一条链结合两次(链内交联),或者可以与两条链结合一次(链间交联)。如果细胞在细胞分裂过程中试图复制交联的dna,或试图对其修复,则dna链可断裂,并且这导致称为细胞凋亡的一种程序性细胞死亡的形式。烷化剂将在细胞周期的任何时间点起作用,并因此被称为细胞周期非依赖性药物。因此,对细胞的作用是剂量依赖性的;死亡的细胞的比例与药物剂量直接成正比。烷化剂的亚型包括氮芥、亚硝基脲、四嗪、氮丙啶、顺铂和衍生物,以及非经典烷化剂。氮芥包括二氯甲基二乙胺、环磷酰胺、美法仑、苯丁酸氮芥、异环磷酰胺和白消安。亚硝基脲包括n-亚硝基-n-甲基脲(mnu)、卡莫司汀(bcnu)、洛莫司汀(ccnu)和司莫司汀(meccnu)、福莫司汀(fotemustine)和链脲菌素。四嗪包括达卡巴嗪、米托唑胺(mitozolomide)和替莫唑胺(temozolomide)。氮丙啶包括噻替哌、丝裂霉素和地吖醌(azq)。顺铂及衍生物包括顺铂、卡铂和奥沙利铂(oxaliplatin),它们通过与生物学上重要的分子中的氨基、羧基、巯基和磷酸基团形成共价键而损害细胞功能。非经典烷化剂包括甲基苄肼和六甲蜜胺(hexamethylmelamine)。
[0246]
在一些实施方案中,抗癌药是抗代谢剂或抗代谢物。抗代谢物是一组阻碍dna和rna合成的分子;其中许多具有与dna和rna的构建单元相似的结构。构建单元是核苷酸;其为包含核碱基、糖和磷酸基团的分子。核碱基分为嘌呤(鸟嘌呤和腺嘌呤)和嘧啶(胞嘧啶、胸腺嘧啶和尿嘧啶)。抗代谢物类似于核碱基或核苷(没有磷酸基团的核苷酸),但具有改变的化学基团。这些药物通过阻断dna合成所需的酶或掺入dna或rna中来发挥其作用。通过抑制参与dna合成的酶,抗代谢物阻止有丝分裂,因为dna不能自我复制。此外,在分子错误掺入到dna中之后,可能会发生dna损伤并诱导程序性细胞死亡(细胞凋亡)。与烷化剂不同,抗代谢物依赖于细胞周期,这意味着它们仅在细胞周期的特定部分(在本情况下为s期(dna合成期))发挥治疗性生物活性。出于该原因,在一定剂量下,效果趋于平稳,并且随着剂量的增加,成比例地不再发生细胞死亡。抗代谢物的亚型是抗叶酸剂、氟嘧啶、脱氧核苷类似物和硫嘌呤。抗叶酸剂的实例包括甲氨蝶呤和培美曲塞(pemetrexed)。甲氨蝶呤抑制二氢叶酸还原酶(dihydrofolate reductase,dhfr),这是从二氢叶酸再生四氢叶酸的酶。当酶被甲氨蝶呤抑制时,叶酸辅酶的细胞水平降低。这些是产生胸苷酸和嘌呤所需要的,这对于dna合成和细胞分裂都是必需的。培美曲塞是另一种影响嘌呤和嘧啶产生的抗代谢物,并因此也抑制dna合成。它主要抑制酶胸苷酸合酶,但也对dhfr、氨基咪唑甲酰胺核糖核苷酸甲酰基转移酶和甘氨酰胺核糖核苷酸甲酰基转移酶有作用。抗代谢物的氟嘧啶家族包括氟尿嘧啶和卡培他滨(capecitabine),而氟尿嘧啶是核碱基类似物,其在细胞中代谢以形成至少两种活性产物;5-氟尿苷一磷酸盐/酯(fump)和5-氟-2'-脱氧尿苷5'-磷酸盐/酯(fdump)。fump掺入到rna中且fdump抑制酶胸苷酸合酶;两者都会导致细胞死亡。卡培他滨可在本发明的一些实施方案的上下文中用作5-氟尿嘧啶的前药,而一旦从缀合物释放,卡培他滨在细胞中分解以产生活性药物5-氟尿嘧啶。脱氧核苷类似物包括阿糖胞苷、吉西他滨、地西他滨、维达扎(vidaza)(5-氮杂胞苷)、氟达拉滨、奈拉滨(nelarabine)、克拉屈滨、氯法拉滨(clofarabine)和喷司他丁(pentostatin)。硫嘌呤包括硫鸟嘌呤和巯基嘌呤。
[0247]
在一些实施方案中,抗癌药是抗微管剂或抗微管。抗微管剂是植物来源的化学物质,其通过阻止微管功能来阻断细胞分裂。微管是重要的细胞结构,由两种蛋白质构成;a-微管蛋白和β-微管蛋白,它们是细胞分裂以及其他细胞功能所需的中空棒状结构。微管是动态结构,这意味着它们永远处于组装和分解状态。长春花生物碱和紫杉烷是两组主要的
抗微管剂,并且虽然这两组药物都会引起微管功能障碍,但它们的作用机制却完全相反。长春花生物碱阻止微管的形成,而紫杉烷阻止微管分解;通过这样做,它们阻止癌细胞完成有丝分裂。在此之后,发生细胞周期停滞,这诱导了程序性细胞死亡(细胞凋亡)。另外,这些药物可影响血管生长;这是肿瘤为了生长和转移而利用的一个重要过程。长春花生物碱来源于马达加斯加长春花(madagascar periwinkle)、长春花(catharanthus roseus)(以前称为玫瑰红长春花(vinca rosea))。它们与微管蛋白上的特定位点结合,抑制微管蛋白组装成微管。原始的长春花生物碱是完全天然的化学物质,其包括长春新碱和长春碱。随着这些药物的成功,产生了半合成长春花生物碱:长春瑞滨、长春地辛和长春氟宁(vinflunine)。这些药物是细胞周期特异性的。它们与s期的微管蛋白分子结合并阻止m期所需的适当微管形成。
[0248]
紫杉烷是天然和半合成的抗癌药。其类别的第一药物紫杉醇最初是从太平洋紫杉短叶红豆杉(pacific yew tree,taxus brevifolia)中提取的。这些药物中的一些,如多西他赛,是由在另一种紫杉树红豆杉(taxus baccata)树皮中发现的化学物质半合成产生的。这些药物促进微管稳定性,阻止它们分解。紫杉醇在g2-m的边界阻止细胞周期,而多西他赛在s期期间发挥其作用。紫杉烷在配制成药物时存在困难,因为它们难溶于水,而根据本发明的一些实施方案,将其系链至缀合物可提高该药物的可用性。
[0249]
抗微管鬼臼毒素是抗肿瘤木脂素(抗癌药),主要从美国盾叶鬼臼(american mayapple)(美洲鬼臼(podophyllum peltatum))和喜马拉雅盾叶鬼臼(himalayan mayapple)(桃儿七(podophyllum hexandrum)或桃儿七(podophyllum emodi))中获得。它具有抗微管活性,并且其机制类似于长春花生物碱的机制,因为其与微管蛋白结合从而抑制微管形成。鬼臼毒素用于产生另外两种具有不同作用机制的药物:依托泊苷和替尼泊苷。
[0250]
在一些实施方案中,抗癌药是拓扑异构酶抑制剂。拓扑异构酶抑制剂是影响两种酶:拓扑异构酶i和拓扑异构酶ii的活性的药物。例如,在dna复制或转录期间当dna双链螺旋解旋时,相邻的未打开的dna会缠绕得更紧(超螺旋),就像打开绞绳(twisted rope)的中间一样。这种作用引起的压力部分是由拓扑异构酶辅助的。它们在dna中产生单链或双链断裂,从而降低dna链的张力。这允许在复制或转录过程中发生dna的正常解旋,并且拓扑异构酶i或ii的抑制会干扰这两个过程。
[0251]
两种拓扑异构酶i抑制剂伊立替康和拓扑替康是从喜树碱中半合成得到的,喜树碱是从中国观赏树喜树(camptotheca acuminata)中获得的。靶向拓扑异构酶ii的药物可分为两组。拓扑异构酶ii毒物导致与dna结合的酶水平升高。这阻止dna复制和转录,导致dna链断裂,并导致程序性细胞死亡(细胞凋亡)。这些药剂包括依托泊苷、多柔比星、米托蒽醌和替尼泊苷。第二组催化抑制剂是这样的药物:其阻断拓扑异构酶ii的活性,并因此阻止dna合成和翻译,因为dna不能正常解旋。该组包括新生霉素、美巴龙(merbarone)和阿克拉霉素(aclarubicin),它们还具有其他重要的生物活性机制。在一些实施方案中,抗癌药是细胞毒性抗生素剂或细胞毒性抗生素。细胞毒性抗生素是多组的药物,其具有多种生物活性机制(治疗作用)。该组包括蒽环类抗生素和其他药物,如放线菌素、博来霉素、普卡霉素和丝裂霉素。多柔比星和道诺霉素是前两种蒽环类抗生素,并且其从细菌波赛链霉菌(streptomyces peucetius)中获得。这些化合物的衍生物包括表柔比星和伊达比星。蒽环类抗生素组中的其他临床使用药物是吡柔比星(pirarubicin)、阿克拉霉素和米托蒽醌。蒽
环类抗生素的生物活性机制包括dna嵌入(分子插入在dna的两条链之间)、产生破坏细胞间分子的高反应性自由基和拓扑异构酶抑制。放线菌素是插入dna并阻止rna合成的复杂分子。博来霉素是从轮枝链霉菌(streptomyces verticillus)中分离出来的糖肽,也可以嵌入dna但产生破坏dna的自由基。这发生在博来霉素与金属离子结合、化学还原和与氧反应时。丝裂霉素是具有使dna烷基化的能力的细胞毒性抗生素。
[0252]
本发明聚合物药物载体和递送系统的优选实施方案被配制和优化以递送一种或更多种抗癌或抗肿瘤药剂或物质,例如但不限于:阿贝西利(abemaciclib)、醋酸阿比特龙(abiraterone acetate)、阿卡替尼(acalabrutinib)、阿霉素、马来酸阿法替尼(afatinib dimaleate)、飞尼妥(afinitor)(依维莫司(everolimus))、艾达乐(aldara)(咪喹莫特(imiquimod))、阿地白介素、安圣莎(alecensa)(艾乐替尼(alectinib))、艾乐替尼、力比泰(alimta)(培美曲塞二钠)、aliqopa(盐酸库潘尼西(copanlisib hydrochloride))、aloxi(盐酸帕洛诺司琼(palonosetron hydrochloride))、阿培利司(alpelisib)、alunbrig(布加替尼(brigatinib))、ameluz(盐酸氨酮戊酸(aminolevulinic acid hydrochloride))、氨磷汀(amifostine)、盐酸氨酮戊酸、阿那曲唑、阿帕鲁胺(apalutamide)、阿瑞匹坦(aprepitant)、阿可达(aredia)(帕米磷酸二钠(pamidronate disodium))、arimidex(阿那曲唑)、阿诺新(aromasin)(依西美坦(exemestane))、arranon(奈拉滨)、三氧化二砷(arsenic trioxide)、天冬酰胺酶菊欧杆菌(asparaginase erwinia chrysanthemi)、施维雅(asparlas)、(calaspargase pegol-mknl)、阿基仑赛(axicabtagene ciloleucel)、阿昔替尼(axitinib)、阿扎胞苷、azedra(lobenguane i 131)、balversa(厄达替尼(erdafitinib))、beleodaq(贝利司他(belinostat))、贝利司他、盐酸苯达莫司汀(bendamustine hydrochloride)、bendeka(盐酸苯达莫司汀)、贝沙罗汀(bexarotene)、比卡鲁胺、bicnu(卡莫司汀)、比美替尼(binimetinib)、硫酸博来霉素、硼替佐米(bortezomib)、bosulif(博舒替尼(bosutinib))、博舒替尼、braftovi(恩考芬尼(encorafenib))、布加替尼、bumel、白消安、卡巴他赛(cabazitaxel)、cabometyx(苹果酸卡博替尼(cabozantinib-s-malate))、苹果酸卡博替尼、calaspargase pegol-mknl、calquence(阿卡替尼)、camptosar(盐酸伊立替康)、卡培他滨、卡铂、卡非佐米(carfilzomib)、卡莫司汀、casodex(比卡鲁胺)、色瑞替尼(ceritinib)、cerubidine(盐酸道诺霉素)、苯丁酸氮芥、顺铂、克拉屈滨、氯法拉滨、clolar(氯法拉滨)、考比替尼(cobimetinib)、cometriq(苹果酸卡博替尼)、盐酸库潘尼西、copiktra(杜韦利西布(duvelisib))、cosmegen(放线菌素d)、cotellic(考比替尼)、克唑替尼(crizotinib)、环磷酰胺、阿糖胞苷、甲磺酸达布非尼(dabrafenib mesylate)、达卡巴嗪、dacogen(地西他滨)、达克替尼(dacomitinib)、放线菌素d、达洛鲁胺(darolutamide)、达沙替尼(dasatinib)、盐酸道诺霉素、daurismo(马来酸格拉吉布(glasdegib maleate))、地西他滨、去纤苷钠(defibrotide sodium)、defitelio(去纤苷钠)、地加瑞克(degarelix)、地尼白介素(denileukin diftitox)、地塞米松(dexamethasone)、盐酸德拉唑烷(dexrazoxane hydrochloride)、盐酸多柔比星、杜韦利西布、eligard(醋酸亮丙瑞林(leuprolide acetate))、elitek(拉布立酶(rasburicase))、表阿霉素(ellence)(盐酸表柔比星)、eloxatin(奥沙利铂)、艾曲泊帕乙醇胺(eltrombopag olamine)、elzonris(tagraxofusp-erzs)、emend(阿瑞匹坦)、甲磺酸恩西地平(enasidenib mesylate)、恩考芬尼、恩杂鲁胺
(enzalutamide)、盐酸表柔比星、厄达替尼、甲磺酸艾利布林(eribulin mesylate)、erivedge(维莫德吉(vismodegib))、erleada(阿帕鲁胺)、盐酸埃罗替尼(erlotinib hydrochloride)、erwinaze(天冬酰胺酶菊欧杆菌)、ethyol(氨磷汀)、凡毕复(etopophos)(磷酸依托泊苷)、依托泊苷、磷酸依托泊苷、依维莫司、evista(盐酸雷洛昔芬(raloxifene hydrochloride))、优维宁(evomela)(盐酸美法仑)、依西美坦、法乐通(fareston)(托瑞米芬)、farydak(帕比司他(panobinostat))、faslodex(氟维司琼(fulvestrant))、盐酸氟替尼(fedratinib hydrochloride)、弗隆(femara)(来曲唑)、非格司亭(filgrastim)、firmagon(地加瑞克)、磷酸氟达拉滨、氟他胺(flutamide)、folotyn(普拉曲沙(pralatrexate))、福沙马替尼二钠(fostamatinib disodium)、氟维司琼、fusilev(甲酰四氢叶酸钙盐(leucovorin calcium))、吉非替尼(gefitinib)、盐酸吉西他滨、gemzar(盐酸吉西他滨)、gilotrif(马来酸阿法替尼)、富马酸吉瑞替尼(gilteritinib fumarate)、马来酸格拉吉布、格列卫(gleevec)(甲磺酸伊马替尼(imatinib mesylate))、谷卡匹酶(glucarpidase)、醋酸戈舍瑞林(goserelin acetate)、格拉司琼(granisetron)、盐酸格拉司琼(granisetron hydrochloride)、granix(非格司亭)、halaven(甲磺酸艾利布林)、hemangeol(盐酸普萘洛尔(propranolol hydrochloride))、和美新(hycamtin)(盐酸拓扑替康)、爱治(hydrea)(羟基脲)、羟基脲、爱博斯(ibrance)(帕博西尼(palbociclib))、依鲁替尼(ibrutinib)、lclusig(盐酸普那替尼(ponatinib hydrochloride))、伊达比星pfs(盐酸伊达比星)、盐酸伊达比星、艾代拉里斯(idelalisib)、idhifa(甲磺酸恩西地平)、ifex(异环磷酰胺)、异环磷酰胺、甲磺酸伊马替尼、imbruvica(依鲁替尼)、咪喹莫特、imlygic(talimogene laherparepvec)、inlyta(阿昔替尼)、inrebic(盐酸氟替尼)、lobenguane 1131、易瑞沙(iressa)(吉非替尼)、盐酸伊立替康、istodax(罗米地辛(romidepsin))、艾伏尼布(ivosidenib)、伊沙匹隆(ixabepilone)、柠檬酸艾沙佐米(ixazomib citrate)、ixempra(伊沙匹隆)、jakafi(磷酸鲁索利替尼(ruxolitinib phosphate))、jevtana(卡巴他赛)、kepivance(帕利夫明(palifermin))、kisqali(瑞博西尼(ribociclib))、kymriah(替沙仑赛(tisagenlecleucel))、kyprolis(卡非佐米)、醋酸兰瑞肽、二甲苯磺酸拉帕替尼(lapatinib ditosylate)、硫酸拉罗替尼(larotrectinib sulfate)、来那度胺(lenalidomide)、甲磺酸乐伐替尼(lenvatinib mesylate)、lenvima(甲磺酸乐伐替尼)、来曲唑、甲酰四氢叶酸钙盐、瘤可宁(leukeran)(苯丁酸氮芥)、醋酸亮丙瑞林、levulan kerastik(盐酸氨酮戊酸)、洛莫司汀、朗斯弗(lonsurf)(三氟尿苷和盐酸替吡嘧啶(trifluridine and tipiracil hydrochloride))、lorbrena(劳拉替尼(lorlatinib))、劳拉替尼、lutathera(镥lu 177-dotatate)、镥(lu 177-dotatate)、lynparza(奥拉帕尼(olaparib))、丙卡巴肼(matulane)(盐酸甲基苯肼(procarbazine hydrochloride))、盐酸二氯甲基二乙胺、醋酸甲地孕酮、mekinist(曲美替尼(trametinib))、mektovi(比美替尼)、美法仑、盐酸美法仑、巯基嘌呤、美司钠(mesna)、甲氨蝶呤、溴甲纳曲酮(methylnaltrexone bromide)、米哚妥林(midostaurin)、丝裂霉素c(mitomycin c)、盐酸米托蒽醌、mozobil(普乐沙福(plerixafor))、氮芥(mustargen)(盐酸二氯甲基二乙胺)、马利兰(myleran)(白消安)、诺维本(navelbine)(酒石酸长春瑞滨)、奈拉滨、马来酸奈拉替尼(neratinib maleate)、nerlynx(马来酸奈拉替尼)、neulasta(培非格司亭(pegfilgrastim))、优保津(neupogen)(非格司亭)、多吉美(nexavar)(甲苯磺酸索拉非尼(sorafenib tosylate))、
nilandron(尼鲁米特(nilutamide))、尼洛替尼(nilotinib)、尼鲁米特、恩莱瑞(ninlaro)(柠檬酸艾沙佐米)、甲苯磺酸尼拉帕尼一水合物(niraparib tosylate monohydrate)、nplate(罗米司亭(romiplostim))、nubeqa(达洛鲁胺)、odomzo(索尼德吉(sonidegib))、奥拉帕尼、高三尖杉酯碱(omacetaxine mepesuccinate)、oncaspar(培门冬酶)、盐酸恩丹西酮(ondansetron hydrochloride)、ontak(地尼白介素)、甲磺酸奥希替尼(osimertinib mesylate)、奥沙利铂、紫杉醇(“ptx”)(taxol)(5β,20-环氧-1,2α,4,7β,10β,13α-六羟基tax11-烯-9-酮4,10-二醋酸2-苯甲酸13-酯与(2r,3s)-n-苯甲酰基-3-苯基异丝氨酸)、帕博西尼、帕利夫明、盐酸帕洛诺司琼、帕比司他、盐酸帕唑帕尼(pazopanib hydrochloride)、培门冬酶、培非格司亭、培美曲塞二钠、piqray(阿培利司)、普乐沙福、泊马度胺(pomalidomide)、pomalyst(泊马度胺)、盐酸普那替尼、普拉曲沙、强的松(prednisone)、盐酸甲基苯肼、proleukin(阿地白介素)、promacta(艾曲泊帕乙醇胺)、盐酸普萘洛尔、provenge(普列威)(sipuleucel-t)、乐疾宁(purinethol)(巯基嘌呤)、purixan(巯基嘌呤)、镭223二氯化物、盐酸雷洛昔芬、拉布立酶、瑞格非尼(regorafenib)、relistor(溴甲纳曲酮)、瑞复美(revlimid)(来那度胺)、rheumatrex(甲氨蝶呤)、瑞博西尼、盐酸罗拉匹坦(rolapitant hydrochloride)、罗米地辛、罗米司亭、柔红霉素(rubidomycin)(盐酸道诺霉素)、rubraca(樟脑磺酸瑞卡帕布(rucaparib camsylate))、樟脑磺酸瑞卡帕布、磷酸鲁索利替尼、雷德帕斯(rydapt)(米哚妥林)、sancuso(格拉司琼)、塞利尼索(selinexor)、sipuleucel-t、索尼德吉、甲苯磺酸索拉非尼、sprycel(达沙替尼)、stivarga(瑞格非尼)、马来酸苏尼替尼(sunitinib malate)、sustol(格拉司琼)、sutent(马来酸苏尼替尼)、synribo(高三尖杉酯碱)、tabloid(硫鸟嘌呤)、泰菲乐(tafinlar)(甲磺酸达布非尼)、tagraxofusp-erzs、泰瑞沙(tagrisso)(甲磺酸奥希替尼)、甲苯磺酸他拉唑帕尼(talazoparib tosylate)、talimogene laherparepvec、talzenna(甲苯磺酸他拉唑帕尼)、柠檬酸它莫西芬(tamoxifen citrate)、tarceva(盐酸埃罗替尼)、targretin(贝沙罗汀)、达希纳(tasigna)(尼罗替尼)、tavalisse(福沙马替尼二钠)、temodar(替莫唑胺)、替莫唑胺、替西罗莫司(temsirolimus)、沙利度胺(thalidomide)、thalomid(沙利度胺)、硫鸟嘌呤、塞替派、tibsovo(艾伏尼布)、替沙仑赛、盐酸拓扑替康、托瑞米芬、torisel(替西罗莫司)、totect(盐酸德拉唑烷)、曲贝替定(trabectedin)、曲美替尼、treanda(盐酸苯达莫司汀)、trexall(甲氨蝶呤)、三氟尿苷和盐酸替吡嘧啶、trisenox(三氧化二砷)、tykerb(二甲苯磺酸拉帕替尼)、三乙酸尿苷(uridine triacetate)、戊柔比星(valrubicin)、valstar(戊柔比星)、凡德他尼(vandetanib)、varubi(盐酸罗拉匹坦)、veip、velcade(硼替佐米)、维莫非尼(vemurafenib)、venclexta(维奈克拉(venetoclax))、维奈克拉、玻玛西林(verzenio)(阿贝西利)、维达扎(阿扎胞苷)、硫酸长春碱、硫酸长春新碱、酒石酸长春瑞滨、维莫德吉、vistogard(三乙酸尿苷)、维特拉克(vitrakvi)(硫酸拉罗替尼)、vizimpro(达克替尼)、voraxaze(谷卡匹酶)、伏立诺他(vorinostat)、votrient(盐酸帕唑帕尼)、xalkori(克唑替尼)、希罗达(xeloda)(卡培他滨)、多菲戈(xofigo)(镭223二氯化物)、xospata(富马酸吉瑞替尼)、xpovio(塞利尼索)、xtandi(恩杂鲁胺)、yescarta(阿基仑赛)、yondelis(曲贝替定)、zaltrap(阿柏西普(ziv-aflibercept))、zarxio(非格司亭)、zejula(甲苯磺酸尼拉帕尼一水合物)、佐博伏(zelboraf)(维莫非尼)、辛卡德(zinecard)(盐酸德拉唑烷)、阿柏西普、枢复宁(zofran)(盐酸恩丹西酮)、zoladex(醋酸戈舍瑞林)、唑来膦酸
(zoledronic acid)、zolinza(伏立诺他)、zometa(唑来膦酸)、zydelig(艾代拉里斯)、赞可达(zykadia)(色瑞替尼)、和zytiga(醋酸阿比特龙)等。
[0253]
本发明的组合物的多个实施方案被配制成和优化成用于治疗、减轻特定类型的肿瘤或癌症、或者特定器官、组织或结构的肿瘤或癌症,或者延缓其转移,所述肿瘤或癌症包括但不限于:急性淋巴细胞白血病(acute lymphoblastic leukemia,all)、急性髓系白血病(acute myeloid leukemia,aml)、肾上腺皮质癌、aids相关癌症(例如卡波西肉瘤(kaposi sarcoma)(软组织肉瘤)、aids相关淋巴瘤、肛门癌、阑尾癌和胃肠道类癌瘤、星形细胞瘤、非典型畸胎样/横纹肌样肿瘤、皮肤基底细胞癌、胆管癌(例如胆管细胞癌)、膀胱癌、骨癌(例如,尤因肉瘤(ewing sarcoma)和骨肉瘤和恶性纤维组织细胞瘤)、脑肿瘤、乳腺癌(例如,导管原位癌)、支气管肿瘤、伯基特淋巴瘤(burkitt lymphoma)、类癌瘤、未知原发性癌(carcinoma of unknown primary)、心脏肿瘤、中枢神经系统肿瘤、髓母细胞瘤和其他cns胚胎肿瘤、生殖细胞肿瘤、原发性cns淋巴瘤、宫颈癌、脊索瘤、慢性淋巴细胞白血病(chronic lymphocytic leukemia,cll)、慢性髓细胞性白血病(chronic myelogenous leukemia,cml)、慢性骨髓增殖性肿瘤、结直肠癌、颅咽管瘤、皮肤t细胞淋巴瘤(例如蕈样真菌病和塞扎里综合征(sezary syndrome))、胚胎瘤(例如髓母细胞瘤)、子宫内膜癌(子宫癌)、室管膜瘤、食管癌、成感觉神经细胞瘤、颅外生殖细胞肿瘤、性腺外生殖细胞肿瘤、眼癌(例如,眼内黑素瘤、视网膜母细胞瘤)、输卵管癌、骨纤维组织细胞瘤、恶性瘤(malignant)和骨肉瘤、胆囊癌、胃癌(gastric cancer)(胃癌(stomach cancer))、胃肠道类癌瘤、胃肠道间质瘤(gist)(软组织肉瘤)、卵巢生殖细胞肿瘤、睾丸癌、妊娠滋养细胞疾病、毛细胞白血病、喉癌、肝细胞(肝)癌、组织细胞增生症、朗格汉斯细胞(langerhans cell)、霍奇金淋巴瘤(hodgkin lymphoma)、下咽癌、胰岛细胞肿瘤、胰腺神经内分泌肿瘤、肾(肾细胞)癌、朗格汉斯细胞组织细胞增生症、唇癌和口腔癌、肝癌、非小细胞和小细胞肺癌、恶性骨纤维组织细胞瘤和骨肉瘤、黑素瘤、梅克尔细胞癌、恶性间皮瘤、转移癌、隐匿性原发性转移性鳞状颈癌、中线束癌(midline tract carcinoma)、多发性内分泌瘤病综合征、多发性骨髓瘤/浆细胞肿瘤、蕈样肉芽肿病、骨髓增生异常综合征、骨髓发育不良/骨髓增殖性肿瘤、慢性髓细胞性白血病(cml)、急性髓系白血病(aml)、慢性骨髓增殖性肿瘤、鼻腔和鼻窦癌、鼻咽癌、神经母细胞瘤、非霍奇金淋巴瘤(non-hodgkin lymphoma)、非小细胞肺癌、口咽癌、骨肉瘤和恶性纤维组织细胞瘤、胰腺癌、胰腺神经内分泌肿瘤、乳头瘤病、副神经节瘤、甲状旁腺癌、阴茎癌、嗜铬细胞瘤、垂体瘤、浆细胞肿瘤/多发性骨髓瘤、胸膜肺母细胞瘤、前列腺癌、直肠癌、横纹肌肉瘤、涎腺癌、肉瘤、尤因肉瘤、卡波西肉瘤、骨肉瘤、软组织肉瘤、子宫肉瘤、塞扎里综合征、小肠癌、皮肤鳞状细胞癌、隐匿性原发性鳞状颈癌、t细胞淋巴瘤、皮肤癌(例如蕈样肉芽肿病和塞扎里综合征)、睾丸癌、胸腺瘤和胸腺癌、甲状腺癌、尿道癌、子宫肉瘤、阴道癌、外阴癌、血管瘤和肾母细胞瘤等。
[0254]
示例性的制剂、给药和施用方法
[0255]
除非另有说明,否则本发明的实施将采用制备药物制剂的常规技术以及本领域公知的施用和给药技术。一般而言,本发明的药物递送系统和组合物的最终可施用制剂可以任选地通过本领域的标准方法制备。许多关于制备和制剂的考虑因素的标准文本是本领域已知的。(例如,参见remington’s pharmaceutical sciences)。
[0256]
在某些实施方案中,本公开内容的药物递送系统和组合物作为无菌和任选地不含
防腐剂的制剂提供。在另一些实施方案中,药物递送系统和组合物是无菌的,任选地不含防腐剂,并且被配制为单次使用或单位剂量形式。在另一些实施方案中,无菌制剂包含一种或更多种防腐剂、稳定剂、糖或糖醇。
[0257]
本发明的方法和药物递送系统和组合物提供了对对象的癌症和其他增殖性疾病的治疗,以通过施用有效剂量的一种或更多种本文中所述组合物在对象中产生药物或治疗益处。施用本发明化合物的方法可以通过计量的剂量或通过一种或更多种控释装置。组合物可以是适合于单次施用精确剂量的单位剂型。
[0258]
在一些实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的浓度小于
[0259]
100%,90%,80%,70%,60%,50%,40%,30%,20%,19%,18%,17%,16%,15%,14%,13%,12%,11%,10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.4%,0.3%,0.2%,0.1%,0.09%,0.08%,0.07%,0.06%,0.05%,0.04%,0.03%,0.02%,0.01%,0.009%,0.008%,0.007%,0.006%,0.005%,0.004%,0.003%,0.002%,0.001%,0.000g%,0.0008%,0.0007%,0.0006%,0.0005%,0.0004%,0.0003%,0.0002%,或0.0001%w/w,w/v或v/v。
[0260]
在一些另外的实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的浓度大于
[0261]
90%,80%,70%,60%,50%,40%,30%,20%,19.75%,19.50%,19.25%19%,18.75%,18.50%,18.25%18%,17.75%,17.50%,17.25%17%,16.75%,16.50%,16.25%16%,15.75%,15.50%,15.25%15%,14.75%,14.50%,14.25%14%,13.75%,13.50%,13.25%13%,12.75%,12.50%,12.25%12%,11.75%,11.50%,11.25%11%,10.75%,10.50%,10.25%10%,9.75%,9.50%,9.25%9%,8.75%,8.50%,8.25%8%,7.75%,7.50%,7.25%7%,6.75%,6.50%,6.25%6%,5.75%,5.50%,5.25%5%,4.75%,4.50%,4.25%,4%,3.75%,3.50%,3.25%,3%,2.75%,2.50%,2.25%,2%,1.75%,1.50%,125%,1%,0.5%,0.4%,0.3%,0.2%,0.1%,0.09%,0.08%,0.07%,0.06%,0.05%,0.04%,0.03%,0.02%,0.01%,0.009%,0.008%,0.007%,0.006%,0.005%,0.004%,0.003%,0.002%,0.001%,0.0009%,0.0008%,0.0007%,0.0006%,0.0005%,0.0004%,0.0003%,0.0002%,或0.0001%w/w,w/v,或v/v。
[0262]
在另一些另外的实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的浓度在以下范围内:约0.0001%至约50%、约0.001%至约40%、约0.01%至约30%、约0.02%至约29%、约0.03%至约28%、约0.04%至约27%、约0.05%至约26%、约0.06%至约25%、约0.07%至约24%、约0.08%至约23%、约0.09%至约22%、约0.1%至约21%、约0.2%至约20%、约0.3%至约19%、约0.4%至约18%、约0.5%至约17%、约0.6%至约16%、约0.7%至约15%、约0.8%至约14%、约0.9%至约12%、约1%至约10%w/w、w/v或v/v。
[0263]
在一些实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的浓度在以下范围内:约0.001%至约10%、约0.01%至约5%、约0.02%至约4.5%、约0.03%至约4%、约0.04%至约3.5%、约0.05%至约3%、约0.06%至约2.5%、约0.07%至约2%、约0.08%至约1.5%、约0.09%至约1%、约0.1%至约0.9%w/
w、w/v或v/v。
[0264]
在一些另外的实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的量等于或小于
[0265]
10g,9.5g,9.0g,8.5g,8.0g,7.5g,7.0g,6.5g,6.0g,5.5g,5.0g,4.5g,4.0g,3.5g,3.0g,2.5g,2.0g,1.5g,1.0g,0.95g,0.9g,0.85g,0.8g,0.75g,0.7g,0.65g,0.6g,0.55g,0.5g,0.45g,0.4g,0.35g,0.3g,0.25g,0.2g,0.15g,0.1g,0.09g,0.08g,0.07g,0.06g,0.05g,0.04g,0.03g,0.02g,0.01g,0.009g,0.008g,0.007g,0.006g,0.005g,0.004g,0.003g,0.002g,0.001g,0.0009g,0.0008g,0.0007g,0.0006g,0.0005g,0.0004g,0.0003g,0.0002g,或0.0001g.
[0266]
在一些实施方案中,本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的量大于
[0267]
0.0001g,0.0002g,0.0003g,0.0004g,0.0005g,0.0006g,0.0007g,0.0008g,0.0009g,0.001g,0.0015g,0.002g,0,0025g,0.003g,0.0035g,0.004g,0.0045g,0.005g,0.0055g,0.006g,0.0065g,0.007g,0.0075g,0.008g,0.0085g,0.009g,0.0095g,0.01g,0.015g,0.02g,0.025g,0.03g,0.035g,0.04g,0.045g,0.05g,0.055g,0.06g,0.065g,0.07g,0.075g,0.08g,0.085g,0.09g,0.095g,0.1g,0.15g,0.2g,0.25g,0.3g,0.35g,0.4g,0.45g,0.5g,0.55g,0.6g,0.65g,0.7g,0.75g,0.8g,0.85g,0.9g,0.95g,1g,1.5g,2g,2.5,3g,3.5,4g,4.5g,5g,5.5g,6g,6.5g,7g,7.5g,8g,8.5g,9g,9.5g,或10g.
[0268]
另一些实施方案提供了本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物的在以下范围内的量:0.0001至10g、0.0005至9g、0.001至8g、0.005至7g、0.01至6g、0.05至5g、0.1至4g、0.5至4g、1至3g、或1至10g。
[0269]
目标剂量可以以单剂量施用。或者,目标剂量可以以约或超过约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30个或更多个剂量施用。
[0270]
可以根据任何规定的方案重复施用计划,包括本文描述的或本领域已知的任何施用计划。本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物可以以一个剂量或多个剂量施用。确定最有效的施用方式和施用剂量的方法是本领域技术人员公知的,并且会随着所使用的特定组合物、使用目的、所接触的靶细胞或靶组织以及所治疗的对象而变化。在1、2、3、4、5、6、7、8、9或10或50或更多分钟、小时、天、周、月、或甚至年的过程中单次或多次施用(例如,约或超过约1、2、3、4、5、6、7、8、9或10或50个、更多个剂量)。
[0271]
在一些特别优选的实施方案中,每1至3天、1至7天、1至10天、1至12天、1至14天、1至28天、1至30天或更多天,如医生所规定的天数,或以其他认为是治疗益处所需的天数,施用一个剂量的组合物。可以通过治疗医生所选择的剂量水平和模式进行施用。本领域中已知,由于化合物药代动力学中的个体间差异,给药方案的个体化是最佳治疗所需的。根据本公开内容和本领域技术人员,可以通过常规实验确定本发明组合物的给药。
[0272]
另外,要注意的是,类似于药物和药物化学领域中描述的方法,合适的药物制剂还可以任选地包括除了本发明的一种或更多种化合物之外的其他试剂,包括但不限于:赋形剂、稀释剂、增容剂、稳定剂、色素(color)、矫味剂、配制剂(例如,凝胶和增稠剂)、抗氧化剂(例如,抗坏血酸、丁羟茴醚、丁羟甲苯、柠檬酸、edta、磷酸、抗坏血酸钠、焦亚硫酸钠、酒石
酸、叔丁基氢醌)、防腐剂、无菌水溶液、缓冲剂、糖等,如通常已知和接受的。
[0273]
在另一些实施方案中,一种或更多种另外的小分子药物和/或生物药剂可以优先与本发明的本发明的药物递送系统和组合物中提供的一种或更多种活性药物或治疗性化合物组合成混合物(或与其同时施用)以在对象中实现有益的或甚至协同的结果。
[0274]
本发明的组合物可以配制成用于递送到对象的口中(例如,通过摄取、经颊(buccal)和/或舌下放置(deposit))。在另一些实施方案中,组合物被配制成用于注射(例如,肌内、皮内、鞘内、腹膜内、动脉内和/或皮下等)、输注(例如,骨内和/或静脉内等)、冲洗(irrigation)、滴注(例如,逐滴滴注)等。在另一些实施方案中,配制成用于局部递送(包括,例如,经眼、经阴道、经直肠、鼻内)。在某些情况下,所期望制剂的递送由一种或更多种机械装置辅助,例如微针和贴剂、注射器、泵、导管、端口(port)、吸入剂递送装置、生物弹道(biolistic)递送装置等。
[0275]
药物的配制和施用技术可见于"remington's pharmaceutical sciences"mack publishing co.,easton,pa最新版本,其通过引用并入本文。
[0276]
根据一些实施方案,组合物被包装在包装材料中并以包装材料中或包装材料上的印刷品辨识,用于治疗可通过所连接以形成缀合物的至少一种药物治疗的医学病症。
[0277]
本发明的修改和变化对于本领域的技术人员来说从本发明的上述描述中将是显而易见的。这样的修改和变化旨在落入所附权利要求书的范围内。
[0278]
通过引用并入
[0279]
所有美国专利公开、美国专利申请和美国专利均在此明确并具体地通过引用整体并入,特别是美国专利5,698,664和5,914,388。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。