1.本发明涉及医疗卫生技术领域,具体是指一种治疗三阴性乳腺癌的脱细胞基质复合水凝胶及其制备方法。
背景技术:
2.乳腺癌(breast cancer,bc)是女性中常见癌症,三阴性乳腺癌(triple negative breast cancer,tnbc) 是最具侵袭性和异质性的bc亚型。临床上通过手术清除乳腺肿瘤后,仍存在较高的复发或转移风险,其重要原因是手术无法将原位残留的肿瘤细胞彻底清除。tnbc独特的细胞表型、侵袭性、转移潜能以及受体、靶点的缺乏,使得化疗成为其首选治疗方案,然而与其它bc亚型相比,tnbc的预后效果最差,其治疗干预需求仍未得到满足。因此急需开发出一种新型、安全和高效的免疫治疗方式,以完善tnbc预后治疗的研究工作。
技术实现要素:
3.本发明的目的在于提供治疗三阴性乳腺癌的脱细胞基质复合水凝胶及其制备方法,以解决上述背景技术中提出的问题。
4.为解决上述技术问题,本发明提供的技术方案为:治疗三阴性乳腺癌的脱细胞基质复合水凝胶的制备方法,具体包括以下步骤:
5.一)脱细胞基质的制备:
6.1)同种异体化细胞的提取:
7.1a)基质细胞的提取(以肿瘤相关成纤维细胞为例):将balb/c小鼠肿瘤组织及癌旁组织放入培养皿,用含20%双抗(青霉素与链霉素)的pbs洗涤3次,用剪刀将组织破碎并置于50ml离心管中,用5-10ml 胶原酶在37℃下孵育消化1h,经100μm孔径的滤网过滤,滤后的细胞悬液转入50ml离心管中,于200 g转速下离心3min,摒弃上清液后加入10ml pbs小心吹打细胞,继续离心3min,吸去上清液后用含10% fbs的培养基吹散细胞并分装至培养皿中进行体外培养,细胞开始贴壁生长后,用pbs小心清洗培养皿,肿瘤相关成纤维细胞可贴壁生长,其它细胞随pbs滑落,获得贴壁的肿瘤相关成纤维细胞并体外培养扩增;
8.1b)免疫细胞的提取(以巨噬细胞为例):取balb/c小鼠的股骨与胫骨,去除皮肤与肌肉组织后,用含20%双抗的pbs洗涤3次,用剪刀去除关节头,用1ml注射器吸取培养基后冲洗骨髓腔,获得细胞悬液后在400g转速下离心5min,用红细胞裂解液去除红细胞,将获得的骨髓细胞转入100mm培养皿中进行体外培养,培养基为含20%fbs、1%双抗、20ng/ml gm-csf和20ng/ml lps的dmem条件培养基,继续培养1周后获得m1极性表型的骨髓来源巨噬细胞;
9.2)脱细胞基质的提取:配制10mg/ml的海藻酸钠溶液,收集基质细胞与免疫细胞后按细胞数1:1的比例与海藻酸钠溶液混匀,总细胞密度为5
×
106个/ml,将含有免疫细胞的海藻酸钠溶液用去除针头的1 ml注射器吸取,小心滴入20mm的cacl2溶液中,形成水凝胶微球,待微球稳定后转入培养基中体外培养1周;用液氮冷却水凝胶微球并迅速用研钵破碎,
加入海藻酸降解酶使微球降解完全,用去dna酶与去rna酶降解微球内的核酸,于5000g转速下用pbs反复离心清洗3次,在-50℃下冻干获取脱细胞基质;
10.二)脱细胞基质复合水凝胶的制备:配制10mg/ml的透明质酸钠与10mg/ml的海藻酸钠混合溶液,加入10mg/ml的脱细胞基质后充分搅拌混匀,将混合溶液用去除针头的1ml注射器吸取后,小心滴入 20mm的cacl2溶液中,形成脱细胞基质复合水凝胶。
11.一种由上述步骤所制得的治疗三阴性乳腺癌的脱细胞基质复合水凝胶。
12.本发明优点在于:纯天然、无化学药物,提取方法简便、易操作,免疫治疗效果良好、对健康组织无毒副作用,天然无毒,使用简便,安全有效,有效缓解瘤内免疫抑制水平,防止肿瘤复发及转移,具有很好的推广前景。
13.本发明治疗三阴性乳腺癌的脱细胞基质复合水凝胶的使用方法:本发明所制脱细胞基质复合水凝胶,使用时将水凝胶微球填塞至三阴性乳腺癌术后创口内,缝合创口即可,1周内水凝胶降解,有效缓解瘤内免疫抑制水平,防止肿瘤复发及转移。
附图说明
14.图1是水凝胶维持m1型巨噬细胞抗肿瘤功能活化图。
15.图2是脱细胞基质选择性杀灭肿瘤细胞,促巨噬细胞抗肿瘤功能活化图。
16.图3是脱细胞基质可在免疫抑制环境中调控巨噬细胞极性图。
17.图4是基质复合水凝胶可植入肿瘤术后动物模型图。
18.图5是脱细胞基质复合水凝胶可有效防止肿瘤复发图。
19.图6是瘤内巨噬细胞数量变化情况图。
具体实施方式
20.下面用具体实施例说明本发明,并不是对本发明的限制。
21.实施例
22.治疗三阴性乳腺癌的脱细胞基质复合水凝胶的制备方法,具体包括以下步骤:
23.一)脱细胞基质的制备:
24.1)同种异体化细胞的提取:
25.1a)基质细胞的提取(以肿瘤相关成纤维细胞为例):将balb/c小鼠肿瘤组织及癌旁组织放入培养皿,用含20%双抗(青霉素与链霉素)的pbs洗涤3次,用剪刀将组织破碎并置于50ml离心管中,用5-10ml 胶原酶在37℃下孵育消化1h,经100μm孔径的滤网过滤,滤后的细胞悬液转入50ml离心管中,于200 g转速下离心3min,摒弃上清液后加入10ml pbs小心吹打细胞,继续离心3min,吸去上清液后用含10%fbs的培养基吹散细胞并分装至培养皿中进行体外培养,细胞开始贴壁生长后,用pbs小心清洗培养皿,肿瘤相关成纤维细胞可贴壁生长,其它细胞随pbs滑落,获得贴壁的肿瘤相关成纤维细胞并体外培养扩增;
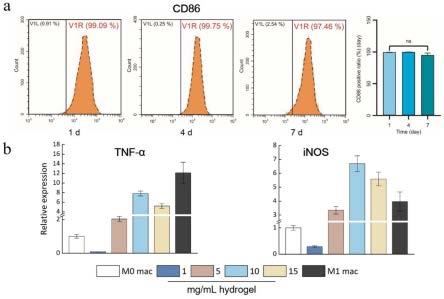
26.1b)免疫细胞的提取(以巨噬细胞为例):取balb/c小鼠的股骨与胫骨,去除皮肤与肌肉组织后,用含20%双抗的pbs洗涤3次,用剪刀去除关节头,用1ml注射器吸取培养基后冲洗骨髓腔,获得细胞悬液后在400g转速下离心5min,用红细胞裂解液去除红细胞,将获得的骨髓细胞转入100mm培养皿中进行体外培养,培养基为含20%fbs、1%双抗、20ng/ml gm-csf和20ng/ml lps的dmem条件培养基,继续培养1周后获得m1极性表型的骨髓来源巨噬细
胞;
27.2)脱细胞基质的提取:配制10mg/ml的海藻酸钠溶液,收集免疫细胞后与海藻酸钠溶液混匀,细胞密度为5
×
106个/ml,将含有免疫细胞的海藻酸钠溶液用去除针头的1ml注射器吸取,小心滴入20mm 的cacl2溶液中,形成水凝胶微球,待微球稳定后转入培养基中体外培养1周;用液氮冷却水凝胶微球并迅速用研钵破碎,加入海藻酸降解酶使微球降解完全,用去dna酶与去rna酶降解微球内的核酸,于 5000g转速下用pbs反复离心清洗3次,在-50℃下冻干获取脱细胞基质;
28.二)脱细胞基质复合水凝胶的制备:配制10mg/ml的透明质酸钠与10mg/ml的海藻酸钠混合溶液,加入10mg/ml的脱细胞基质后充分搅拌混匀,将混合溶液用去除针头的1ml注射器吸取后,小心滴入 20mm的cacl2溶液中,形成脱细胞基质复合水凝胶。
29.一种由上述步骤所制得的治疗三阴性乳腺癌的脱细胞基质复合水凝胶。
30.以下结合图纸对本发明在实际操作时的情况进行说明。
31.(1)水凝胶维持m1型巨噬细胞抗肿瘤功能活化:
32.在前期工作中,采用10mg/ml浓度的水凝胶体外培养m1型巨噬细胞,培养过程中细胞维持cd86 阳性,表现出稳定的极性(图1a)。培养7天后,巨噬细胞在不同浓度水凝胶中的极性标志性基因表达量有所不同,在10mg/ml的水凝胶中m1型极化的标志性基因表达量较高,与培养皿中的巨噬细胞较为接近(图1b)。以上工作对本发明构建可维持m1型巨噬细胞极性表性及增殖环境的三维复合水凝胶具有重要意义。
33.图1是水凝胶维持m1型巨噬细胞抗肿瘤功能活化图。
34.a.流式细胞术检测m1型巨噬细胞在水凝胶中培养7天内可维持良好极性;b.qpcr检测m1型巨噬细胞在各浓度水凝胶中体外培养,极性的标志性基因表达情况。
35.(2)脱细胞基质在体外选择性杀灭肿瘤细胞,对巨噬细胞无毒副作用:
36.基于上述结果获取m1型巨噬细胞的脱细胞基质,该基质可选择性直接杀灭肿瘤细胞,促肿瘤细胞凋亡,对巨噬细胞无毒副作用(图2a、2b);还可促m0和m2型巨噬细胞分泌no、tnf-α和inos等(图 2c、2d、2e),逆转免疫抑制微环境,间接杀灭肿瘤细胞,为本发明提出脱细胞基质发挥抗肿瘤功能提供重要实验依据。
37.图2是脱细胞基质选择性杀灭肿瘤细胞,促巨噬细胞抗肿瘤功能活化图。
38.a.脱细胞基质选择性杀伤小鼠乳腺癌细胞4t1,对巨噬细胞无毒副作用;b.脱细胞基质引起小鼠肺癌细胞llc凋亡,对巨噬细胞无影响;c.no试剂盒检测表明,脱细胞基质促m0和m2型巨噬细胞释放no; d.tnf-α试剂盒检测表明,脱细胞基质促m0和m2型巨噬细胞分泌tnf-α;e.wb检测结果表明,脱细胞基质促m0和m2型巨噬细胞分泌inos。
39.(3)免疫抑制环境下,脱细胞基质活化m1型巨噬细胞,逆转肿瘤相关巨噬细胞极性:
40.前期研究中采用transwell小室构建肿瘤细胞存在时的免疫抑制微环境,显示脱细胞基质可促m1型巨噬细胞持续高表达极化标志基因tnf-α、cd86,下调cd206表达量(图3a);并降低m2型巨噬细胞的极化标志基因arg-1、cd206表达,上调inos表达量(图3b)。该结果提示,脱细胞基质可逆转免疫抑制微环境,是本发明提出抑瘤分子机制的重要保证。
41.图3是脱细胞基质可在免疫抑制环境中调控巨噬细胞极性图。
42.a.采用transwell体外共培养巨噬细胞与小鼠乳腺癌细胞4t1,可有效活化m1型巨
噬细胞;b.采用 transwell体外共培养巨噬细胞与4t1,可有效逆转m2型巨噬细胞的极性。
43.(4)脱细胞基质可制备为水凝胶支架材料,植入肿瘤术后动物模型:
44.小鼠肿瘤术后动物模型成功构建,并可植入脱细胞基质复合水凝胶(图4),进而考察体内抑瘤效能,是本发明肿瘤治疗相关实验所具备条件的有力体现。
45.图4是基质复合水凝胶可植入肿瘤术后动物模型图。
46.a.脱细胞基质复合水凝胶的外观;b.鼠源乳腺癌细胞4t1在balb/c小鼠皮下建立肿瘤动物模型;c.基质复合水凝胶植入肿瘤切除术后的创口处。
47.(5)基质复合水凝胶清除原位肿瘤细胞,提高抗肿瘤巨噬细胞浸润:
48.在前期工作中,脱细胞基质复合水凝胶可有效防止肿瘤复发,提高小鼠生存率(图5),植入基质复合水凝胶的小鼠生长情况良好,瘤内cd86阳性细胞数量增多,cd206阳性细胞数量减少(图6)。该结果显示,脱细胞基质高效清除术后残留的原位肿瘤细胞,为进一步阐明其作用机制奠定研究基础。
49.图5是脱细胞基质复合水凝胶可有效防止肿瘤复发图。
50.a.手术流程图;b.肿瘤体积变化;c.术后21天对照组与实验组小鼠肿瘤复发情况对比;d.小动物成像观测各组小鼠肿瘤体积变化情况。
51.图6是瘤内巨噬细胞数量变化情况图。饲养21天后处死小鼠,取肿瘤进行流式细胞实验,植入基质复合水凝胶的实验组中m1型巨噬细胞数量增多,m2型巨噬细胞数量减少。
52.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。