一种bre在制备抑制骨吸收、抗骨质疏松基因治疗药物中的应用
技术领域
1.本发明属于生物医学技术领域,具体涉及一种bre在制备抑制骨吸收抗骨质疏松基因治疗药物中的应用。
背景技术:
2.骨的新陈代谢由成骨细胞介导的骨形成和破骨细胞介导的骨吸收两个过程构成,骨形成过程和骨吸收过程相互协调,共同维持骨的正常新陈代谢。但随着年龄的增长或由于疾病因素的诱导,会导致骨形成和骨吸收的动态平衡被打破。如随着年龄的增加骨吸收活性逐渐要强于骨形成活性,进而导致骨量逐渐的减少,当骨量减少到一定程度后即发展为骨质疏松,导致骨脆性增加,骨强度降低,骨折风险增加。尤其是在女性绝经后,由于体内雌激素水平的变化,导致骨吸收被显著激活,出现骨量的快速丢失现象。此外骨关节炎,类风湿性关节炎等骨疾病均有骨吸收的异常激活。大量文献报道包括乳腺癌,前列腺癌在内的多种肿瘤在骨转移灶的部位均出现了骨吸收的激活现象。此外多种药物如糖皮质激素也会引起骨吸收的显著激活,导致骨丢失。因而骨吸收的异常激活与多种疾病的发生发展均有直接的关系,抑制骨吸收是治疗骨吸收激活相关疾病的有效策略。目前临床常用的抑制骨吸收的药物如双膦酸盐类,迪诺塞麦等对骨质疏松显示出了较好的疗效,但现有抑制骨吸收的药物所存在的安全隐患和疗效有限的问题仍不容忽略。如双膦酸盐类药物会诱导下颌骨坏死、非典型股骨骨折、胃肠道不良反应、诱导发热、肌肉关节疼痛、肾脏毒性等副作用。而最新批准上市的靶向rankl的单抗药物迪诺塞麦也存在增加下颌骨坏死的副作用。
3.破骨细胞作为直接参与骨吸收过程的细胞,已有研究显示破骨细胞的数量和活性在骨质疏松,骨关节炎等多种疾病过程中均显著增强。因此,进一步深入探究破骨细胞分化和活性调控的分子生物学机制,寻找抑制骨吸收激活的靶点并筛选更加安全有效的治疗药物,具有重要的研究价值及临床转化前景。
4.bre是一个在骨组织高表达的基因,以往研究报道bre可参与肿瘤、dna损伤修复等过程,但目前没有研究报道将bre用于抑制骨吸收对抗骨质疏松药物的开发及在体内外评价bre对骨吸收的抑制作用和对骨质疏松的治疗作用。
技术实现要素:
5.针对现有技术普遍存在的缺陷,本发明提供了一种bre在制备抑制骨吸收基因治疗药物中的应用。本发明通过构建体外破骨细胞分化模型,利用q-pcr检测bre在人破骨细胞和小鼠破骨细胞分化过程中的表达水平变化趋势,发现bre表达在破骨细胞分化过程显著下调;通过在破骨细胞分化过程中过表达bre,发现bre可显著抑制破骨细胞的分化;通过构建ovx小鼠骨质疏松模型,并将表达bre的aav-bre病毒注射至小鼠股骨,发现aav-bre可以抑制ovx小鼠的骨吸收并对抗骨质疏松。说明bre具备在体内抑制骨吸收对抗骨丢失进而治疗骨质疏松的作用。最终本发明为骨吸收异常激活相关疾病如骨质疏松的防治提供了新
的策略。
6.为了达到上述目的,本发明采用的技术方案如下:
7.本发明提供了一种bre在制备抑制骨吸收、抗骨质疏松的药物中的应用。
8.本发明还提供了一种bre在筛选抑制骨吸收、抗骨质疏松的药物中的应用,所述药物提升bre的表达水平。
9.优选地,所述药物为载体药物,所述载体含有bre基因。
10.优选地,所述载体为脂质体、纳米载体、病毒载体。
11.优选地,所述病毒载体为腺病毒载体、腺相关病毒载体,慢病毒载体。
12.本发明还提供了一种bre在制备检测骨吸收异常、骨质疏松的试剂中的应用,所述试剂检测骨吸收异常、骨质疏松时bre的表达。
13.本发明还提供了一种bre在制备检测骨吸收异常、骨质疏松的试剂盒中的应用,所述试剂盒检测骨吸收异常、骨质疏松时bre的表达。
14.优选地,所述试剂盒包括检测bre表达水平的试剂。
15.本发明提供了一种提高bre表达水平的试剂在制备抑制骨吸收、抗骨质疏松的药物中的应用。
16.本发明所述的bre,为人源bre或鼠源bre,所述人源bre的核苷酸序列如seq id no.1所示;所述鼠源bre的核苷酸序列如seq id no.2所示。
17.atgtccccagaagtggccttgaaccgaatatctccaatgctctcccctttcatatctagcgtggtccggaatggaaaagtgggactggatgctacaaactgtttgaggataactgacttaaaatctggctgcacatcattgactcctgggcccaactgtgaccgatttaaactgcacataccatatgctggagagacattaaagtgggatatcattttcaatgcccaatacccagaactgcctcccgattttatctttggagaagatgctgaattcctgccagacccctcagctttgcagaatcttgcctcctggaatccttcaaatcctgaatgtctcttacttgtggtgaaggaacttgtgcaacaatatcaccaattccaatgtagccgcctccgggagagctcccgcctcatgtttgaataccagacattactggaggagccacagtatggagagaacatggaaatttatgctgggaaaaaaaacaactggactggtgaattttcagctcgtttccttttgaagctgcccgtagatttcagcaatatccccacataccttctcaaggatgtaaatgaagaccctggagaagatgtggccctcctctctgttagttttgaggacactgaagccacccaggtgtaccccaagctgtacttgtcacctcgaattgagcatgcacttggaggctcctcagctcttcatatcccagcttttccaggaggaggatgtctcattgattacgttcctcaagtatgccacctgctcaccaacaaggtgcagtacgtgattcaagggtatcacaaaagaagagagtatattgctgcttttctcagtcactttggcacaggtgtcgtggaatatgatgcagaaggctttacaaaactcactctgctgctgatgtggaaagatttttgttttcttgtacacattgacctgcctctgtttttccctcgagaccagccaactctcacatttcagtccgtttatcactttaccaacagtggacagctttactcccaggcccaaaaaaattatccgtacagccccagatgggatggaaatgaaatggccaaaagagcaaaggcttatttcaaaacctttgtccctcagttccaggaggcagcatttgccaatggaaagctctag(seq id no.1);
18.atgtctccagaaattgccttgaaccgaatttctccaatgctctccccattcatatcaagcgtggtccgaaatgggaaggtgggactggatgctacaaactgtttgagaattacggacttgaagtctggctgtacatcattgactcctggacccaactgtgaccgcttcaaactgcacatcccgtacgctggggagacgttaaaatgggacataattttcaatgctcagtacccagagctgcctcctgatttcatctttggagaggatgctgagtttctgccagacccctctgcgctgcacaaccttgcctcctggaacccttcaaaccctgagtgcctgttgctcgtggtgaaggagctggtgcagcagtaccaccagttccagtgcggccgcctccgtgagagctcgcgcctcatgtttgagtaccagacgctcctggaagagcctc
agtatggagagaacatggaaatttatgctggaaagaaaaacaactggactggtgaattttcagctcgttttctattgaagttaccagtagatttcagcaacattcccacataccttctcaaggatgtaaatgaagaccctggagaagatgtggcccttctttctgtcagttttgaggatactgaagctacccaggtgtaccccaagttgtacttgtcaccccgaattgagcatgcactcggaggctcctctgctcttcacatccctgctttccccggaggaggatgtctcattgattatgtgcctcaagtgtgccacctgctcaccaacaaggtacagtatgtgattcaaggctatcacaaaagaagagagtacatcgcagctttcctcagtcactttggcacaggtgtcgtggaatatgatgcagaaggcttcacaaaacttactctgctgctgatgtggaaagacttttgttttcttgtccacattgacctgcccctgtttttccctcgagatcagcctacgctcacatttcagtcagtctatcactttaccaacagtggacagctttactcccaagcacaaaaaaactacccatacagccccagatgggatggaaatgaaatggccaagagagcaaaggcttatttcaaaacctttgtccctcagttccaggaggccgcatttgccaatggaaagctctag(seq id no.2)。
19.通过q-pcr检测bre在人破骨细胞和小鼠破骨细胞分化过程中的表达水平变化趋势,所述q-pcr的检测过程如下:
20.s1、设计特异性基因克隆引物,pcr扩增人源和小鼠源bre序列,并克隆至pcdna3.1 真核细胞表达载体,分别获得人源pcdna3.1-bre质粒、鼠源pcdna3.1-bre质粒;
21.s2、提取小鼠骨髓巨噬细胞,构建体外破骨细胞分化模型,将步骤s1所得的鼠源pcdna3.1-bre质粒及对照pcdna3.1
质粒转染至小鼠骨髓巨噬细胞中;或者构建thp-1破骨细胞分化模型,将步骤s1所得人源pcdna3.1-bre质粒及对照pcdna3.1
质粒转染至人thp-1细胞中;
22.s3、利用q-pcr检测破骨分化标志性基因,并利用trap染色分析破骨细胞数量。
23.步骤s1所述扩增人源bre序列的特异性基因克隆引物为hbre,所述扩增人源bre序列的特异性基因克隆引物为mbre;所述引物hbre的上游引物序列如seq id no.3所示;所述引物hbre的下游引物序列如seq id no.4所示;所述引物mbre的上游引物序列如seq id no.5所示;所述引物mbre的上游引物序列如seq id no.6所示。
24.hbre-f:ccaagcttatgtccccagaagtggcc(seq id no.3)
25.hbre-r:cggggtaccctagagctttccattggc(seq id no.4)
26.mbre-f:ccaagcttatgtctccagaaattgcc(seq id no.5)
27.mbre-r:cggggtaccctagagctttccattgg(seq id no.6)
28.本发明通过设计特异性基因克隆引物,pcr扩增人源和小鼠源bre序列,并克隆至pcdna3.1( )真核细胞表达载体,获得pcdna3.1-bre(人源)和pcdna3.1-bre(鼠源)质粒,用于后续细胞和动物模型实验。通过q-pcr检测bre在人破骨细胞和小鼠破骨细胞分化过程中的表达水平变化趋势。
29.提取小鼠骨髓巨噬细胞,构建体外破骨细胞分化模型,将pcdna3.1-bre(鼠源)质粒及对照pcdna3.1( )质粒转染至小鼠骨髓巨噬细胞中,或构建thp-1破骨细胞分化模型,将pcdna3.1-bre(人源)质粒及对照pcdna3.1( )质粒转染至人thp-1细胞中,通过q-pcr检测破骨分化标志性基因,trap染色分析破骨细胞数量,发现bre可显著抑制破骨细胞的分化。
30.通过构建卵巢切除(ovx)小鼠骨质疏松模型,并将表达bre的aav-bre病毒注射至小鼠股骨进行bre基因治疗,通过microct检测,发现aav-bre可以对抗ovx诱导的骨质疏松,trap染色分析显示aav-bre可以显著下调破骨细胞的数量进而抑制骨吸收。说明bre具备在
体内抑制骨吸收对抗骨丢失的作用。
31.与现有技术相比,本发明具有如下优势:本发明通过体内外系列实验证实bre可抑制破骨细胞分化,本发明通过在ovx骨质疏松模型中的体内药效评价,证实过表达bre具备在体内抑制骨吸收对抗骨丢失的作用。因此,本发明为骨吸收异常激活相关疾病如骨质疏松的防治提供了新的策略。
附图说明
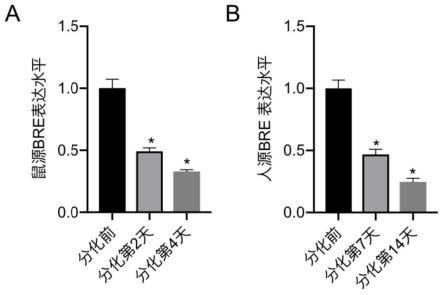
32.图1为bre在破骨细胞分化过程中的表达情况;
33.图2为过表达bre的情况;
34.图3为小鼠骨组织破骨细胞的数量分析结果图。
具体实施方式
35.以下通过公开一些实施例来进一步阐明本发明的疗效特点。所涉及到的方法是本领域的技术人员能够掌握和运用的技术手段。但是,实施例的介绍不得理解为任何意义上的对本发明权利要求的限制。此外需要说明的是,本发明所述bre可以为质粒或腺病毒、慢病毒、腺相关病毒等转化体或bre转录获得的rna分子。
36.实施例1基因克隆构建bre真核表达载体
37.以人或小鼠细胞的cdna为模板,pcr扩增人和小鼠bre基因,并克隆至pcdna3.1( )载体。挑取细菌转化的克隆,进行测序鉴定。将测序鉴定正确的克隆保存菌种,并用无内毒素质粒提取试剂盒(天根生物,货号dp117)提取质粒用于后续实验。详细过程如下:
38.(1)基因扩增:所有基因的扩增均采用takara公司max dna polymerase试剂进行,基因pcr扩增过程如下:a、从-20℃取出冻存的扩增引物和dna聚合酶,提前准备好枪头、pcr管等耗材,并预热pcr仪器;b、按照如下体系进行50μl pcr反应体系的配制:max dna polymerase 25μl;primer forward(10μm)1.5μl;primer reverse(10μm)1.5μl;cdna or plasmid template《200ng;3dh2o up to 50μl;c、混合均匀后,放入pcr仪中进行扩增,扩增程序如下:98℃10sec,55℃15sec,72℃5-10sec/kb,30cycles,72℃5min,4℃forever;d、扩增完成后进行pcr产物的胶回收;
39.(2)胶回收:所有胶回收实验均采用e.z.n.a cycle-pure kit试剂盒进行,过程如下:a、用1%琼脂糖凝胶分离pcr扩增产物或酶切后的dna片段;b、对照dna marker在切胶仪上切下目标条带并放入ep管中称重;c、按照1g凝胶加入1ml binding buffer的比例加入binding buffer,混合后65℃加热直至凝胶完全融化,可隔2min涡旋混匀一次;d、将溶解后的凝胶全部转移至dna结合柱内,12000
×
g室温离心1min;e、用300μl hibind buffer清洗柱子一次,12000
×
g室温离心1min;f、随后用700μl spw wash buffer洗柱子两次,每次12000
×
g室温离心1min;g、洗涤完成后,12000
×
g室温离心空管2min;h、向柱内垂直滴加30-50μl 3dh2o,室温静置5min,12000g
×
离心1min;i、收集胶回收片段,测定浓度后于-20℃保存;
40.(3)酶切:所用限制性内切核酸酶均为takara公司quickcut系列快速反应酶,酶切过程如下:a、从-20℃取出10
×
quickcut buffer并溶解;b、在pcr管内配制酶切体系:10
×
quickcut buffer 5μl,dna或质粒1.5μg,quickcut内切酶1μl,3dh2o up to 50μl;c、混合
均匀各组分后,根据内切酶的最适反应温度37℃/30℃水浴锅酶切30min;d、酶切产物可于-20℃进行保存或立刻进行电泳分离;
41.(4)连接:所用t4 dna连接酶购自takara公司,反应体系为:t4 dna连接酶1μl,10
×
反应缓冲液2μl,目的基因片段300ng,质粒酶切片段100ng,3dh2o up to 20μl;在pcr管内混合均匀各组分后,于16℃水浴连接过夜,连接产物可直接用于转化实验;
42.(5)转化:a、从-80℃冰箱取出感受态dh5α细菌,置于冰上融化;b、待完全融化后于超级台内加入5-10μl连接产物,混合均匀;c、将感受态细菌置于冰上30min,可间隔10min轻轻混匀一次;d、冰浴结束后,将ep管放在泡沫架上,于42℃水浴中热击90sec,再冰浴3min;e、冰浴结束后,加入1ml lb液体培养基,于摇床150rpm培养1h;f、取50-100μl培养基均匀涂布于含合适抗生素的lb平板上,于37℃恒温培养箱倒置培养。f、24-48h观察是否有细菌克隆长出;
43.(6)克隆鉴定:a、在超净台内用接种环挑取单克隆接种于5ml含有抗生素的lb液体培养基中,于37℃200rpm摇床培养16h;b、超净台内吸取500μl菌液加入ep管中,随后12000
×
g室温离心2min收集菌体;c、完全吸弃残留培养基,并用80μl灭菌3dh2o重悬菌体;d、金属加热器上100℃处理8min,随后12000
×
g室温离心2min,取上清进行pcr检测;e、pcr结束后琼脂糖电泳检测是否为目标克隆;f、对于鉴定正确的目标克隆,取部分菌液保存菌种,部分菌液送测序公司进行测序鉴定;g、对于测序鉴定正确的克隆做好标记并保存至-20℃/-80℃冰箱备用。
44.实施例2破骨细胞分化诱导模型
45.人thp-1诱导模型:将人thp-1细胞饲养于含10%fbs的1640培养液中用于破骨细胞分化诱导,将thp-1细胞以5
×
105细胞/ml的密度铺板,并加入100ng/ml pma刺激1天,随后更换为1640 10%fbs 50ng/ml m-csf 100ng/ml rankl的分化诱导培养基,隔天给细胞换液,细胞培养14天后进行后续的分子检测和trap染色。
46.小鼠骨髓巨噬细胞诱导模型:将2月龄c57bl/6小鼠的骨髓用无血清α-mem培养基冲出,用含10%fbs的α-mem培养液重悬细胞,在5%co2的37℃恒温培养箱中培养24小时。随后离心收集悬浮细胞,按照3
×
106细胞/ml的细胞密度接种培养板,加入50ng/ml m-csf诱导3天得到小鼠骨髓巨噬细胞,3天后加入50ng/ml m-csf和100ng/ml rankl诱导细胞,隔天给细胞换液,细胞培养4天后进行后续的分子检测和trap染色。
47.实施例3细胞转染
48.利用lipo2000转染bre表达载体至小鼠骨髓巨噬细胞或thp-1细胞,转染按照说明书进行,取2000ng质粒加入含125μl opti-mem培养基的ep管中吹打混匀,取5μl lipo2000转染试剂加入含125μl opti-mem培养基的ep管中吹打混匀,将2个含有试剂的ep管室温静置5min,随后1:1混合2个ep管内的试剂制成转染混合物,室温静置20min,此后将转染混合物250μl加入至培养板内。转染2天后进行基因和蛋白表达水平的分析。
49.实施例4破骨细胞trap染色分析
50.按照trap染色试剂盒(sigma-aldrich,#387)说明书进行。配置染色液:取1.5ml ep管,将试剂
①
fast garnet gbc base solution和
②
sodium nitrite solution各50μl混匀静置2min;另取15ml离心管,加入试剂
③
naphthol as-bi phosphate solution 50μl,试剂
④
acetate solution 200μl,试剂
⑤
tartrate solution 100μl,加入4.5ml 37℃蒸馏水
和配好的试剂
①
和
②
的混合液100μl,混合均匀后37℃温浴备用。
51.细胞固定与染色:取分化后的细胞(96孔板为例)或组织切片,加入50μl4%多聚甲醛室温固定15min,弃掉多聚甲醛,50μl 37℃蒸馏水洗2次后,加入30μl如上配制的染色液于37℃染色1h,50μl蒸馏水洗1次,加入20μl蒸馏水,显微镜下观察破骨细胞并计数。注意:加液过程中要缓慢加入,避免细胞脱落。
52.实施例5总rna提取及基因表达水平分析
53.细胞总rna的提取按照天根生化科技(北京)有限公司trnzol universal总rna提取试剂(dp424)进行。6孔板每个孔加入1ml trizol裂解细胞并用枪头反复吹打,室温作用5分钟。将裂解液移入1.5ml离心管中,加入200μl氯仿,盖紧管盖,涡旋混匀室温静置3分钟,4℃,12000g/min离心15分钟。将上层水相液体转移至新的1.5ml离心管中,加入500μl异丙醇,涡旋混匀室温静置10分钟,4℃,12000g/min离心10分钟。将上清用移液器吸取,丢弃,保留底部白色沉淀。加入1ml 75%乙醇(depc水配制),用手轻轻将白色沉淀弹起,然后在4℃条件下,7500g/min离心5分钟。弃上清,室温干燥10-15分钟,加入30-40μl depc水重新溶解,rna置于-80℃冰箱中保存或直接使用。
54.使用反转录试剂盒(takara,货号rr047a),根据试剂盒的操作流程,将提取的1000ng总rna反转录成cdna。反转录过程如下:(1)测定浓度后,按照10μl反转录体系加入500ng总rna的量计算需要加入的rna和depc水的体积;(2)向pcr管中依次加入depc水,总rna和5
×
primescripttm rt master mix(takara),并混合均匀;(3)于pcr仪上按照37℃15min,85℃5sec,4℃hold的程序进行反转录扩增;(4)扩增后的cdna用灭菌的三蒸水稀释30-50倍使用,可于-20℃长期保存。
55.参考试剂盒说明书(takara,货号rr820a)使用实时荧光定量pcr技术检测基因的表达水平。实时荧光定量pcr技术过程如下:
56.(1)提前准备好检测引物,灭菌三蒸水,96孔pcr板,荧光定量试剂;(2)根据待检测基因的数目分配反应产物在96孔pcr板中的具体位置;(3)按照每个待检测基因每个样品三个复孔的比例配制反应液:20μl反应体系中含cdna模板2μl,premix ex taqtm ii(takara)试剂10μl,上游引物(10μm)1μl,下游引物(10μm)1μl,三蒸水6μl;(4)将全部反应液加入相应孔后,用专用封口膜封闭96孔pcr板,并2500rpm离心3min;(5)离心完成后,于bio-rad公司cfx96 touchtm荧光定量pcr检测系统上机检测,反应程序为:a、预变性95℃30sec;b、pcr反应:95℃5sec,60℃30sec,读板,循环40次;c、拟合曲线并读板;(6)反应完成后,用系统自带分析软件进行数据分析,排除3个复孔中ct值差异大于0.5的数值,并根据内参基因计算各检测基因的相对表达水平。
57.图1为bre在破骨细胞分化过程中的表达情况,其中,a为鼠源bre在小鼠骨髓破骨细胞分化过程中的表达水平;b图为人源bre在人thp-1破骨细胞分化过程中的表达水平;结果显示bre在破骨细胞分化过程中显著下调。图2为过表达bre的情况,其中,a图显示过表达鼠源bre抑制小鼠骨髓破骨细胞分化标志基因的表达;b图显示过表达鼠源bre降低破骨细胞数量;c图显示过表达人源bre抑制人thp-1破骨细胞分化标志基因的表达;d图显示过表达人源bre抑制破骨细胞的生产数量。
58.q-pcr引物列表如下:
[0059][0060]
实施例6构建卵巢切除(ovx)小鼠骨质疏松模型并进行bre基因治疗
[0061]
取同窝12周龄c57bl/6雌性未孕小鼠,腹腔注射戊巴比妥钠/水合氯醛深度麻醉小鼠。用75%酒精棉球消毒小鼠皮肤,进行卵巢摘除。侧卧放置小鼠,并用75%酒精棉球消毒小鼠背侧、腹侧皮肤。在小鼠大腿根部稍上方水平,脊柱侧方不到1cm的地方,用眼科剪剪开一个与脊柱平行的约5mm长的皮肤切口,仔细剪开下方腰肌,仔细寻找包绕卵巢的脂肪组织,见到粉红色的卵巢后,在卵巢两侧结扎,摘除卵巢。对照组为进行手术操作但不摘除卵巢的假手术对照组。将小鼠分为4组,每组6只小鼠,包括假手术对照组给予aav-对照病毒组,ovx模型组给予aav-对照病毒组,ovx模型组给予aav-bre病毒组,阳性对照药物唑来磷酸盐组,ovx小鼠按照80μg/kg剂量腹腔注射一次药物。aav-对照病毒和aav-bre病毒由赛业(广州)生物科技有限公司构建。于ovx造模1个月后给小鼠股骨注射2
×
106tu aav病毒进行基因治疗,治疗1个月后用4%多聚甲醛心脏灌流固定小鼠。取出小鼠的股骨。4%多聚甲醛固定1周,microct(μct50,scanco medical)对骨样本进行扫描,并分析骨小梁的体积比(bv/tv)和骨小梁的数量(tb.n)。对各组小鼠的组织切片进行trap染色分析(染色方法如实施例4所述),分析小鼠骨组织破骨细胞的数量(oc.n/b.pm(1/mm))以反映骨吸收的激活程度。具体结果如下图3所示:
[0062]
a图为治疗后microct分析小鼠股骨的骨小梁三维重建图,可以看出bre基因治疗显著提升了小鼠骨量,效果与阳性药物唑来磷酸盐相当。
[0063]
b图为microct输出的反应骨量的定量参数,同样发现bre基因治疗可以显著上调
ovx小鼠骨体积、骨小梁数量,效果与阳性对照药物唑来磷酸盐相当。
[0064]
c图为对骨组织trap染色后破骨细胞数量的定量,bre基因治疗显著降低了小鼠的破骨细胞数量,效果与阳性对照药物唑来磷酸盐相当,由此说明bre基因治疗可在体内抑制破骨细胞介导的骨吸收。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。