1.本发明属于药物制剂技术领域,具体涉及一种工程化细胞膜纳米颗粒及其制备方法和应用。
背景技术:
2.近年来,纳米载体已经发展到肿瘤临床应用的领域,每年有非常多的载体通过临床前研究,但是通过临床实验的纳米体系少之又少。限制纳米载体临床转化最大的障碍就是输送效率,经过静脉注射入血的纳米载体会面临各种各样的生物屏障,比如在循环过程中的单核吞噬细胞系统和血脑屏障、在微环境中的高组织间隙压力和细胞外基质、在入胞或入核时细胞膜或细胞核膜的阻碍等等。这其中对输送效率影响最大的屏障就是单核吞噬细胞系统。单核吞噬细胞系统包括存在在血液循环中的单核细胞和分布在组织中的组织驻留巨噬细胞,其主要的是生理作用就是清除外源物质。对于应对单核吞噬细胞系统对纳米载体的截留作用,可以从两个角度对输送体系进行设计,分别是对纳米颗粒的理化特性进行改良和对单核吞噬细胞系统的内吞能力进行调节。一般来说,为了避免基于表面特性的快速排泄,许多纳米颗粒配方都加入了亲水聚合物作为隐形涂层,比如聚乙二醇、聚氨基酸、聚乙烯基吡咯烷酮、聚甘油等两性离子聚合物。但一方面这些修饰方法缺少靶向性,另一方面是以peg为代表的亲水聚合物在多次注射之后会产生免疫原性,仍旧会被很快地清除掉。
技术实现要素:
3.本发明的目的在于针对现有技术的不足,提供了一种工程化细胞膜纳米颗粒及其制备方法和应用。
4.本发明的目的是通过以下技术方案来实现的:
5.第一方面,本发明提供一种工程化细胞膜纳米颗粒的制备方法,包括以下步骤:
6.(1)制备稳定表达trail蛋白的lx2细胞系:将处于对数生长期的lx2细胞培养至细胞贴壁;然后使用含lv-trail-zsgreen过表达慢病毒的培养基对lx2细胞进行转染,在37℃培养24h后,用dmem培养基换含有lv-trail-zsgreen过表达慢病毒的培养基继续培养48h,随后使用含200μmol/l的g418培养基进行抗性筛选,得到稳定转染可稳定表达trail蛋白的lx2细胞系;
7.(2)制备工程化细胞膜:将步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系在4℃pbs洗三次之后,用低渗细胞裂解液重悬之后在4℃摇床上裂解4-6h,之后再使用输出功率为195-260w,探头超声1-3min;随后进行差速离心,提出细胞膜沉淀;最后将提出的细胞膜沉淀使用pbs重悬,通过微型挤出器将细胞膜悬液从聚碳酸酯膜中来回挤压9-14次,得到工程化细胞膜;
8.(3)制备纳米颗粒内核:将氯喹和乳酸-羟基乙酸共聚物按质量比1-1.5:10的比例共混于无水二氯甲烷中,水相使用聚乙烯醇,所述水相通过将聚乙烯醇溶于去离子水中配
成,每100ml去离子水中加入4g聚乙烯醇;随后在冰上进行超声乳化,超声条件为输出功率为260w,时长10min;将超声乳化形成的白色乳液缓慢滴加到12-14ml单蒸水中,在室温下搅拌4-5h,以挥发二氯甲烷并固化纳米颗粒内核;最后以3000rpm转速超滤离心30min后收集纳米颗粒内核;
9.(4)制备工程化细胞膜纳米颗粒:将步骤(2)制备得到的工程化细胞膜和步骤(3)制备得到的纳米颗粒内核按质量比1:1共混,过微型挤出器将共混液从200nm孔径的聚碳酸酯膜中来回挤压9-13次,得到工程化细胞膜纳米颗粒。
10.进一步地,步骤(2)中所述差速离心包括:首先在1,000-1500g离心力、4℃的离心条件下离心10-15min,取上清液;上清液在10000-12000g离心力、4℃的离心条件下,离心30-40min;最后在900000-100000g离心力、4℃的离心条件下,离心1-3h。
11.进一步地,所述低渗细胞裂解液,包括0.25
×
pbs、蛋白酶抑制剂和磷酸酶抑制剂。
12.进一步地,所述步骤(2)中所述聚碳酸酯膜孔径为50nm、100nm、200nm或400nm。
13.进一步地,所述聚碳酸酯膜孔径优选为200nm。
14.第二方面,本发明提供了一种上述方法制备得到的工程化细胞膜纳米颗粒。
15.第三方面,本发明提供了一种工程化细胞膜纳米颗粒在制备治疗肿瘤的药物中的应用。
16.本发明的有益效果是:1.本发明所提供的工程化细胞膜由成纤细胞作为主要的源细胞,成纤细胞作为正常的体细胞,由于其细胞膜上表达的异嗜性粘附蛋白,可以达到靶向肿瘤细胞的作用;成纤细胞在经过基因工程设计的病毒载体稳定转染后,能够在细胞膜上表达治疗性蛋白,这可以赋予细胞膜纳米囊泡更大的治疗潜力,并且蛋白质通过稳定的膜结构进行输送,可以延长其在血液循环中的半衰期,有效维持了功能性蛋白的生物活性;
17.2.本发明所述的工程化细胞膜纳米颗粒外层由工程化细胞膜包裹,使纳米颗粒拥有更加优化的表面理化性质,降低由外源纳米颗粒引起的调理蛋白和补体激活而进一步导致纳米颗粒的清除;同时内核包载的小分子药物也可以通过降低单核吞噬细胞系统对纳米颗粒的内吞活性,从另一方面减少纳米颗粒被非特异性清除;为了达到更好的治疗目的,内核包载的小分子药物选用的是可以与外层细胞膜上表达的治疗性蛋白有协同增效作用的药物;其引入不仅大大提高了纳米颗粒的输送效率,还对纳米颗粒的治疗作用产生了加成的效果。
附图说明
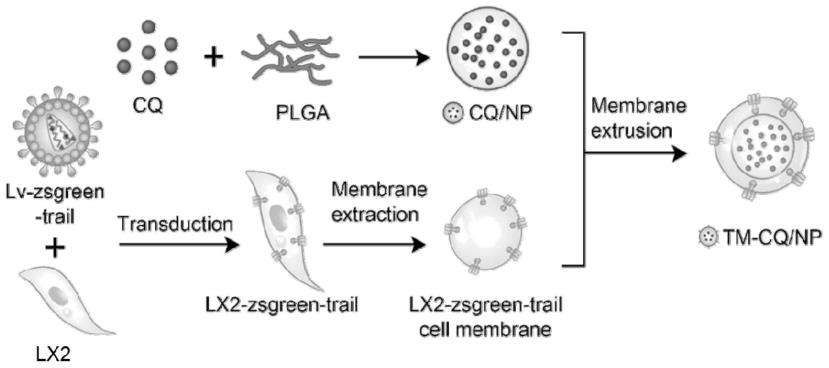
18.图1为工程化细胞膜纳米颗粒(tm-cq/np)的制备及结构示意图;
19.图2为激光共聚焦显微镜检测图;
20.图3为流式细胞仪检测图;
21.图4为蛋白质印迹法检测图;
22.图5为工程化细胞膜的透射电镜图;
23.图6为cq/np和tm-cq/np的动态光散射图;
24.图7为通过结晶紫检测tm-cq/np与m-np、tm-np、cq/np、m-cq/np诱导细胞凋亡的作用图;
25.图8为np组、m-np组和cq m-np组在kupffer细胞上的内吞水平图,图8中图a为激光
共聚焦显微镜检测图,图8中图b为流式细胞仪检测结果图;
26.图9为通过小动物活体成像方法检测np和m-np在尾静脉注射6h后在各器官中的分布情况图;
27.图10为肝癌细胞和kupffer细胞中rhob阳性细胞的平均荧光强度图,图10中图a为肝癌细胞中rhob阳性细胞的平均荧光强度图,图10中图b为kupffer细胞中rhob阳性细胞的平均荧光强度图;
28.图11为np、m-np和cq m-np在尾静脉注射6h后在各器官中的分布情况图;
29.图12为np、m-np和cq m-np在肝癌原位模型上的不同肝细胞群的分布情况图,图12中图a为肝脏中收集的kupffer细胞摄取纳米颗粒的流式散点图,图12中图b为肝脏中收集的kupffer细胞摄取纳米颗粒的流式直方图,图12中图c为肝脏肿瘤细胞中纳米颗粒摄取的流式散点图,图12中图d为肝脏肿瘤细胞中纳米颗粒摄取的流式直方图;
30.图13为pbs组、tm-np组、cq/np组和tm-cq/np组在肝癌原位模型上的抑瘤曲线图;
31.图14为pbs组、tm-np组、cq/np组和tm-cq/np组在肝癌原位模型上的瘤重统计图。
具体实施方式
32.为了使本发明的目的、技术方案及优点更加明白清楚,结合附图和实施例,对本发明进一步的详细说明,应当理解,此处所描述的具体实施例仅仅用以解释本发明,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,均在本发明保护范围。
33.图1为本发明工程化细胞膜纳米颗粒(tm-cq/np)的制备及结构示意图。
34.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
35.实施例工程化细胞膜纳米颗粒(tm-cq/np)的制备
36.(1)稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)的制备
37.将处于对数生长期的lx2细胞按照100000个/孔的数量接种到六孔板中,培养12h后待细胞贴壁;然后使用含lv-trail-zsgreen过表达慢病毒的培养基对lx2细胞进行转染,在37℃培养24h后,用新鲜培养基替换含有lv-trail-zsgreen过表达慢病毒的培养基继续培养48h,此时每孔中细胞融合度达到90%左右,随后使用含200μmol/l的g418培养基进行抗性筛选,得到稳定转染可稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)。
38.所述新鲜培养基为dmem培养基。
39.所述lv-trail-zsgreen过表达慢病毒来自上海吉凯基因医学科技股份有限公司,包含可表达trail蛋白的基因片段,可表达zsgreen荧光蛋白的基因片段。
40.所述g148是一种氨基糖苷类抗生素,在分子遗传试验中是稳定转染最常用的抗性筛选试剂;所示g418培养基是在新鲜培养基中添加了g418制备而成。
41.图2为激光共聚焦显微镜检测图。分别将未转染的lx2细胞和步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)接种到共聚焦成像皿中,培养12h后待细胞贴壁;随后在共聚焦成像皿中加入2μmol/l的蓝色荧光染料(hoechst 33342)进行孵
育,30min后将含蓝色荧光染料的培养基更换为新鲜培养基,随后使用激光共聚焦显微镜观察和记录两种细胞zsgreen荧光蛋白的表达情况,;从图2可知,未转染的lx2细胞无荧光,而稳定表达trail蛋白的lx2细胞系表达大量的绿色荧光,说明步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系转染成功。
42.图3为流式细胞仪检测图。分别将未转染的lx2细胞和步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)培养12h后待细胞贴壁;随后用胰酶消化重悬,用4℃的pbs洗两遍后,在流式细胞管中重悬调节为10^6cells/ml的细胞悬液;通过流式细胞仪的fl2通道分别分析未转染的lx2细胞和步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系中zsgreen阳性细胞的阳性率。从图3中可知,通过流式细胞仪对表达zsgreen绿色荧光蛋白的细胞计数,计算在细胞总量中成功转染的比例,可以通过流式细胞仪检测到步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)相比未转染的lx2细胞有42.4%的阳性率。
43.(2)工程化细胞膜(lx2-zsgreen-trail cell membrane)的制备
44.将步骤(1)制备得到的稳定表达trail蛋白的lx2细胞系(lx2-trail-zsgreen)在4℃pbs洗三次之后,用加入了蛋白酶抑制剂的低渗细胞裂解液重悬之后在4℃摇床上裂解4h,之后再使用输出功率为195w,探头超声1min;随后进行差速离心,提出细胞膜沉淀;所述差速离心包括:首先在1000g离心力、4℃的离心条件下离心10min,取上清液;上清液在10000g离心力、4℃的离心条件下,离心30min;最后在100000g离心力、4℃的离心条件下,离心1h得到透明细胞膜沉淀;最后将提出的细胞膜沉淀使用pbs重悬,通过微型挤出器将细胞膜悬液从200nm孔径的聚碳酸酯膜中来回挤压11次,得到粒径比较均一的工程化细胞膜(lx2-zsgreen-trail cell membrane)。
45.所述低渗细胞裂解液,包括0.25
×
pbs、蛋白酶抑制剂和磷酸酶抑制剂。
46.图4为蛋白质印迹法检测图。使用bca试剂盒分别测定lx2细胞裂解物(lx2 cell lysate,cl)、稳定表达trail蛋白的lx2细胞系裂解物(lx2-trail-zsgreen cl)、lx2细胞膜(lx2cell membrane)和工程化细胞膜(lx2-zsgreen-trail cell membrane)的膜蛋白浓度,测定结果如图4所示,可以看出稳定表达trail蛋白的lx2细胞系裂解物(lx2-trail-zsgreen cl)和工程化细胞膜(lx2-zsgreen-trail cell membrane)都能表达trail蛋白。
47.图5为工程化细胞膜的透射电镜图;从图5中可以看出工程化细胞膜具有经典的核壳结构。
48.(3)纳米颗粒内核(cq/np)的制备
49.纳米颗粒内核(cq/np)的制备采用单乳化法,其制备过程为:将10mg氯喹(cq)和100mg乳酸-羟基乙酸共聚物(plga)共混于1ml无水二氯甲烷中,水相使用浓度为4%聚乙烯醇(pva),所述水相通过将聚乙烯醇溶于去离子水中配成,每100ml去离子水中加入4g聚乙烯醇;随后使用探头超声在冰上进行乳化,超声条件为输出功率为260w,时长10min;将超声乳化形成的白色乳液缓慢滴加到14ml单蒸水中,在室温下搅拌5h,以挥发二氯甲烷并固化纳米颗粒内核(cq/np)。最后以3000rpm转速超滤离心30min后收集纳米颗粒内核(cq/np);所述氯喹(cq)为小分子药物。
50.(4)工程化细胞膜纳米颗粒(tm-cq/np)的制备
51.将1mg步骤(2)制备得到的工程化细胞膜(lx2-zsgreen-trail cell membrane)和
1mg步骤(3)制备得到的纳米颗粒内核(cq/np)共混,通过微型挤出器将共混液从200nm孔径的聚碳酸酯膜中来回挤压11次,得到工程化细胞膜纳米颗粒(tm-cq/np)。
52.图6为纳米颗粒内核(cq/np)和工程化细胞膜纳米颗粒(tm-cq/np)的透射电镜图。将步骤(3)步骤备得到的纳米颗粒内核(cq/np)稀释到浓度1mg/ml,将(4)制备得到的工程化细胞膜纳米颗粒(tm-cq/np)稀释到1mg/ml,使用动态光散射仪(dls)分别对cq/np和tm-cq/np进行粒径分布的检测,并拍摄透射电镜图如图6所示。通过动态光散射检测cq/np粒径约为221.5nm,聚合物分散性指数(polymer dispersity index,pdi)为0.179;tm-cq/np粒径约为294nm,pdi为0.268。从图6中可以看出通过单乳化法制备的cq/np是均一的圆形颗粒;tm-cq/np可以看到明显的核壳结构,而且粒径均一,表明工程化细胞膜已经完整地包裹在cq/np纳米颗粒外面。
53.应用例1
54.(1)细胞毒性实验
55.结晶紫染色检测过程:将huh7细胞按照5
×
10^4个/孔的数量接种到12孔板中,培养12h后待细胞贴壁;对huh7细胞分别使用含有细胞膜包覆的空载纳米颗粒(nanoparticles coated with fibroblast membrane,m-np)、表达trail蛋白的细胞膜包覆的空载纳米颗粒(nanoparticles coated with trail-expressing fibroblast membrane,tm-np)、纳米颗粒内核(cq-encapsulated nanoparticles,cq/np)、细胞膜包覆的装载cq的纳米颗粒(cq-encapsulated nanoparticles coated with fibroblast membrane,m-cq/np)、工程化细胞膜纳米颗粒(cq-encapsulated nanoparticles coated with trail-expressing fibroblast membrane,tm-cq/np)的培养基处理24h作为实验组,对huh7细胞使用新鲜培养基处理24h作为对照组(control);随后分别将含有m-np、tm-np、cq/np、m-cq/np或tm-cq/np的培养基弃去,用pbs溶液洗两遍后,将板子倒放在滤纸上,控干水分;往5个实验组(m-np、tm-np、cq/np、m-cq/np和tm-cq/np)和1个对照组(control)的孔板中每孔加入50μl结晶紫染色液,在室温下以每分钟20次振荡的频率在摇床上孵育20min。将板中结晶紫染色液弃去,用pbs洗四遍后,将板子倒放在滤纸上,控干水分,在显微镜下观察细胞;检测结果如图7所示。
56.图7为通过结晶紫染色液检测tm-cq/np与m-np、tm-np、cq/np、m-cq/np诱导细胞凋亡的作用图。通过图7可以看出,经m-np处理的huh7细胞与不做任何处理的对照组(control)进行对比,m-np实验组中huh7细胞数有明显减少,说明trail细胞膜本身对肿瘤细胞就有毒性;同时经cq/np和m-cq/np处理的huh7细胞与不做任何处理的对照组(control)进行对比,cq/np和m-cq/np实验组中huh7细胞数有一定程度的减少,说明cq/np和m-cq/np也可以小程度的杀伤肿瘤细胞,而且两者的毒性几乎相同,这说明lx2细胞膜包裹cq/np是没有增加杀伤作用的效果的;tm-cq/np实验组处理后的huh7细胞数最少,说明tm-cq/np的细胞毒性最大,也说明氯喹(cq)可以协同增效trail的肿瘤细胞杀伤效果。
57.(2)氯喹(cq)对纳米颗粒内核(cq/np)在kupffer细胞上的内吞实验
58.激光共聚焦显微镜观察纳米载体的细胞内吞:将kupffer细胞(肝血窦内的巨噬细胞)按照10^5个/皿的数量接种到共聚焦成像皿中,孵育12h待细胞贴壁;在kupffer细胞贴壁后,分为3组,即np组、m-np组和cq m-np组;在np组中,贴壁后的kupffer细胞先在含有50μmol/l氯喹(cq)的培养基中在37℃处理24h,之后在加入1mg np处理60min;在m-np组中,贴
壁后的kupffer细胞先在新鲜培养基中在37℃处理24h,之后在加入1mg m-np处理60min;在cq m-np组中,贴壁后的kupffer细胞先在含有50μmol/l氯喹(cq)的培养基中在37℃处理24h,之后在加入1mg m-np处理60min;np组、m-np组和cq m-np组都经过rhob荧光染料处理;np组、m-np组和cq m-np组处理60min后,用pbs柔和地洗两遍细胞,随后使用激光共聚焦显微镜观察和记录np组、m-np组和cq m-np组中kupffer细胞的内吞情况。
59.流式细胞仪检测纳米载体的细胞内吞:将kupffer细胞按照10^5个/皿的数量接种到共聚焦成像皿中,孵育12h待细胞贴壁;在kupffer细胞贴壁后,分为3组,即np组、m-np组和cq m-np组;在np组中,贴壁后的kupffer细胞先在含有50μmol/l氯喹(cq)的培养基中在37℃处理24h,之后在加入1mg np处理60min;在m-np组中,贴壁后的kupffer细胞先在新鲜培养基中在37℃处理24h,之后在加入1mg m-np处理60min;在cq m-np组中,贴壁后的kupffer细胞先在含有50μmol/l氯喹(cq)的培养基中在37℃处理24h,之后在加入1mg m-np处理60min;np组、m-np组和cq m-np组都经过rhob荧光染料处理,用pbs柔和地洗两遍细胞,用胰蛋白酶将细胞消化重悬在400μl预冷的pbs中;通过流式细胞仪的fl2通道分析np组、m-np组和cq m-np组经加药处理后rhob阳性细胞的平均荧光强度,每个样品定量选取活细胞群中的1
×
10^4个细胞进行检测。每一组数据均为同种细胞在相同处理方式下三次独立实验的平均值。
60.图8为np组、m-np组和cq m-np组在kupffer细胞上的内吞水平图,图8中图a为激光共聚焦显微镜检测图,图8中图b为流式细胞仪检测结果图。从图8中图a可以看出,经m-np组处理后的kupffer细胞中rhob的荧光强度明显弱于np组处理的;而cq m-np组中,通过经过cq培养后的细胞膜包覆的空载纳米颗粒(cq m-np)处理后的kupffer细胞更弱。从图8中图b可以看出,经m-np组处理后的kupffer细胞中rhob的荧光强度(mfi)明显低于np组处理的;而cq m-np组中,通过经过cq培养后的细胞膜包覆的空载纳米颗粒(cq m-np)处理后的kupffer细胞更弱。说明kupffer细胞对于经过cq培养后的细胞膜包覆的空载纳米颗粒(cq m-np)的摄取进一步地降低。
61.(2)纳米载体的器官分布和肝脏细胞群分布实验
62.将200μl纳米颗粒(nanoparticles,np)或者m-np(np和m-np分别经过dir荧光染料处理,dir荧光染料的浓度为4μg/只)通过尾静脉注射到icr小鼠(雌性,8周龄)体内,在6h通过眼眶静脉丛采血(约50μl),取血时对小鼠进行麻醉,全血收集于采血专用的肝素钠管中,随后对其进行引颈处死。剖取其心(heart)、肝(liver)、脾(spleen)、肺(lung)和肾(kidney),进行称重,按照1mg器官质量加入10μl含5%苯甲基磺酰氟(pmsf)的pbs,每个1.5ml离心管中加入2-3颗研磨珠后,在4℃中研磨5min。得到的组织研磨液同血液一起加到黑色96孔板中,用小动物活体成像检测孔板中各孔样品的荧光强度,结果如图9所示。从图9中可以看出,肝的荧光强度明显强于其他器官,说明np和m-np主要聚集在肝脏。
63.所述苯甲基磺酰氟(pmsf)是一种不可逆的丝氨酸蛋白酶抑制剂。
64.肝癌细胞原位成功接种后两周的裸鼠分组后,通过尾静脉分别注射200μl pbs、纳米颗粒(nanoparticle,np)或者含有细胞膜包覆的空载纳米颗粒(m-np),所述pbs、np和m-np分别经过rhob荧光染料处理,rhob荧光染料的浓度为1μg/只;注射了pbs作为对照组(control),注射了np或m-np作为实验组;使用水合氯醛将小鼠麻醉,注射后6h对小鼠进行肝灌注,提出分散的肝细胞群后使用磁珠分离,经过分离后得到的肝癌细胞(tumor cells)
np组也有2-3倍的增长,相较于pbs组有微弱的抑制肿瘤增长的效果,而tm-cq/np组的肿瘤几乎没有增长,说明tm-cq/np组相对于pbs、cq/np和tm-np组有显著的抗癌活性。
71.图14为pbs组、tm-np组、cq/np组和tm-cq/np组在肝癌原位模型上的瘤重统计图。统计每组裸鼠的体重并做统计学差异分析。从图14中可以看到tm-cq/np组的肿瘤重量显著低于pbs、cq/np和tm-np组,抑瘤效果显著。而pbs、cq/np和tm-np组相比tm-cq/np组并没有明显差异,说明tm-cq/np组的治疗效果明显优于其他组。
72.本发明通过工程化细胞膜纳米颗粒制备方法制备得到的工程化细胞膜纳米颗粒可用于制备治疗肿瘤的药物。
73.本发明采用工程化细胞膜(lx2-zsgreen-trail cell membrane)包裹纳米颗粒内核(cq/np),工程化细胞膜可以减少由外源纳米载体引起的调理蛋白和补体的激活。工程化细胞膜包裹纳米颗粒内核提供了一种新型的仿生平台,它还可以模拟源细胞与周围生物成分相互作用时的功能。成纤维细胞在细胞膜上表达有生物活性的黏附蛋白,可以通过与肿瘤细胞上的粘附蛋白间产生异嗜连接,伴随其转移。在纳米颗粒包覆成纤维细胞膜时,在获得磷脂双分子层结构的同时拥有异源靶向的特性,使它们有可能成为靶向肿瘤部位的材料。而为了降低单核吞噬细胞系统对纳米载体的截留作用,对单核吞噬细胞系统的内吞能力进行调节的方法,一般多采用空载体或者小分子药物,使单核吞噬细胞的吞噬达到饱和状态或者是内吞能力受到抑制的状态。cq是常用的抑制细胞对病毒吞噬活力的抑制剂,其主要是通过抑制网格蛋白的生成,抑制了病毒入胞的主要内吞通路。同时,cq也被证明是一种巨噬细胞特异性的内吞抑制剂。将对纳米载体和单核吞噬细胞系统的两种设计方法融合在同一载体中,是之前的研究未曾尝试过的。
74.在细胞膜包覆技术的基础之上,利用细胞膜的结构,通过基因工程设计将一些功能性的治疗蛋白表达在细胞膜上,可以进一步拓宽细胞膜载体平台的应用范围。trail,肿瘤坏死因子相关凋亡诱导配体,是一种二型跨膜蛋白,它可以通过形成三聚体的形式结合到trail受体(死亡受体)上,引起细胞下游的凋亡通路激活。cq由于可以上调死亡受体的表达,能够达到增敏trail的凋亡功效,可以用作与trail协同增效的小分子一同输送,为肿瘤的治疗提供一种新的思路。
75.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。