1.本发明属于医药技术领域,具体涉及吡咯喹啉醌在制备预防/治疗/改善糖尿 病和/或糖尿病并发症糖尿病肾病药物中的应用。
背景技术:
2.糖尿病是以高血糖为主要特征的一种慢性代谢性疾病,是目前影响人类健 康最主要的代谢性疾病。
3.糖尿病肾病(dn)是一种严重的糖尿病微血管并发症,也是糖尿病患者发 病和死亡的主要原因之一。
4.细胞焦亡是一种炎症引发的程序性细胞死亡,已有研究表明,细胞焦亡参 与了dn病程的发生发展。研究表明,在高血糖情况下,过量的葡萄糖会产生 多余的还原能力,还原能力的过剩导致过多的电子从电子传输链(etc)泄漏而 形成超氧离子。大量活性氧(ros)的产生会破坏线粒体,线粒体功能障碍会 进一步产生更多的ros,ros促使nlrp3募集asc和caspase-1形成炎症小体, 进而激活焦亡信号通路。而细胞焦亡进一步促使胰岛β细胞数量减少和胰岛素靶 器官的胰岛素抵抗形成,加重糖尿病病情的发展和并发症的发生。因此,抑制 肾脏细胞线粒体损伤,减少ros的产生,从而抑制肾脏经典细胞焦亡通路的激 活,可能成为预防或治疗dn的一种有效策略。
5.吡咯喹啉醌(pqq)是一种带负电荷的、水溶性的复合物,是甲醇脱氢酶 的辅酶,类似水溶性b族维生素,几乎存在于所有食品中,具有抗炎、抗氧化 和清除自由基的作用。pqq可以作为脱氢酶辅酶参与呼吸链电子传递,调节线 粒体功能,还可直接与线粒体活性氧发生反应,以维持ros的动态平衡,减少 氧化应激水平升高引起的线粒体内脂质过氧化和呼吸链的失活。
6.然而,目前尚未有pqq通过缓解焦亡信号通路激活改善/治疗dn的研究, 也没有相关的文献报道。因此,阐明pqq保护dn的分子机制,证明pqq对 糖尿病及其并发症的改善/治疗作用具有重要意义。可以拓宽pqq在健康功能食 品和药物研制等方面的应用,使其有望成开发为一种健康功能食品或药物,用 于预防或治疗dn,为dn的预防和治疗提供新思路。
技术实现要素:
7.本发明的目的是提供吡咯喹啉醌在制备治疗/改善糖尿病肾病药物中的应 用。
8.本发明所述的吡咯喹啉醌,又称4,5-二氢-4,5-二氧-1h-吡咯并[2,3-f]喹啉
ꢀ‑
2,7,9-三羧酸,分子式为c
14
h6n2o8,化学结构如下式:
[0009]
[0010]
本发明提供了吡咯喹啉醌在治疗/改善糖尿病肾病所致肾纤维化中的应用。
[0011]
本发明提供了吡咯喹啉醌在缓解糖尿病所引起的炎症反应中的应用。
[0012]
本发明提供了吡咯喹啉醌在改善糖尿病小鼠血糖水平方面的应用。
[0013]
本发明提供了吡咯喹啉醌在维持糖尿病小鼠体重,改善肝肾功能指标方面 的应用。
[0014]
本发明的吡咯喹啉醌通过抑制nlrp3炎性小体介导的焦亡信号通路来发挥 改善糖尿病肾病的作用。
[0015]
本发明的吡咯喹啉醌对糖尿病引起的其他并发症也有不同程度的治疗/改善 作用。
[0016]
本发明开拓性地提出了pqq在治疗/改善糖尿病肾病方面的应用,可以拓宽 pqq在健康功能食品和药物研制等方面的应用,使其有望成开发为一种健康功 能食品或药物,用于预防或治疗dn,为dn的预防和治疗提供新思路。
附图说明
[0017]
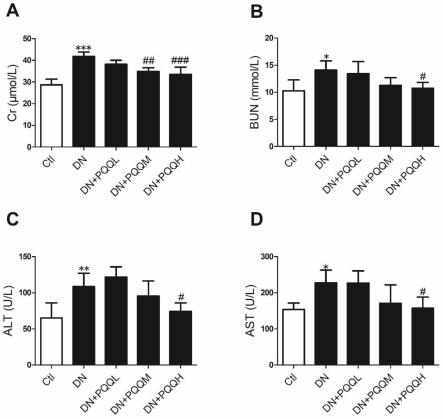
图1为本发明所述pqq治疗12周后,糖尿病小鼠肝肾功能指标的变化。 结果显示(图1),与对照组小鼠相比,糖尿病小鼠的肾脏功能指标cr(p《 0.001),bun(p《0.05)水平明显升高,而pqq干预可有效抑制这一改变。 与对照组小鼠相比,糖尿病小鼠的肝脏功能指标alt(p《0.01)、ast(p《0.05) 明显升高,而pqq干预可缓解肝功能损伤。这些结果提示,糖尿病会引起糖尿 病小鼠肾功能和肝功能损伤,pqq治疗可以有效缓解糖尿病小鼠所受的肾功能 和肝损伤。
[0018]
图2为本发明所述pqq治疗12周后,糖尿病小鼠肾脏纤维化程度的改变。 与对照组小鼠相比,糖尿病小鼠在肾组织中的细胞外基质沉积显著增加(p《 0.001),用20或40mg/kg bw/天pqq进行治疗可有效减少了肾纤维化的面积 (图2a、b)。
[0019]
图3为本发明所述pqq治疗12周后,糖尿病小鼠肾脏组织细胞形态的改 变。与对照组相比,dn组小鼠肾小球发生固缩,肾小管肿大,空泡样改变,20 mg/kg bw/day和40mg/kg bw/day pqq可改善dn小鼠肾小球的病理状况。
[0020]
图4为本发明所述pqq治疗12周后,糖尿病小鼠肾脏组织中肾小球和肾 小管间质中的胶原蛋白水平改变。利用western blotting和real-time荧光定量 pcr技术,分析肾皮质中纤维化相关因子colⅰ和tgf-β1在翻译和转录水平上 的表达变化。结果分析显示,与对照组相比,糖尿病组小鼠colⅰ(p《0.05)和 tgf-β1(p《0.01)的蛋白表达水平明显升高,pqq治疗组中colⅰ(p《0.05) 和tgf-β1蛋白的表达水平降低(p《0.01)(图4a、b)。colⅰ和tgf-β1 在mrna水平的变化与蛋白质表达水平变化一致(图4c,d)。提示pqq治 疗可以通过减少细胞外基质沉积,缓解dn所致肾纤维化。
[0021]
图5为本发明所述pqq治疗12周后,糖尿病小鼠体内炎症水平的变化。 糖尿病引起的体内高糖环境会引起炎症因子水平的升高,而炎症将加重dn的 肾纤维化。与对照组相比,糖尿病小鼠肾组织样本中il-1β(p《0.001)、il-6 (p《0.001)和tnf-α(p《0.001)浓度显着上调。然而,pqq干预显著降低 糖尿病小鼠的炎性细胞因子浓度。
[0022]
图6为本发明所述pqq治疗12周后,糖尿病小鼠肾脏组织中nlrp3炎症 小体介导的焦亡信号通路的改变。细胞焦亡信号通路在dn的发生发展中起着 重要作用,因此可以通过
判定细胞焦亡信号通路的激活水平,了解pqq对dn 的保护作用。与对照小鼠相比,糖尿病小鼠肾皮质中nlrp3(p《0.05)、asc (p《0.05)、cleaved caspase-1(p《0.01)、caspase-1(p《0.05)、il-1β(p《 0.05)和il-18(p《0.05)的蛋白质表达水平显著升高,而pqq干预减少了糖 尿病小鼠中的这些蛋白质水平(p《0.05,图6a-f)。pqq干预还抑制了糖 尿病小鼠中nlrp3(p《0.01)、caspase-1(p《0.01)、il-1β(p《0.05)和il-18 (p《0.05)的mrna水平的增加(p《0.05,图6g-j)。
具体实施方式
[0023]
下面结合实施例,对本发明作进一步的阐述,对本发明实施例中的技术手 段、操作方法进行更加完整、明确的描述。
[0024]
糖尿病肾病小鼠动物模型构建
[0025]
8周龄雄性c57bl/6小鼠在温度22
±
1℃、湿度55
±
5%的条件下自由进食 和饮水,小鼠饲料的营养成分如下所示。
[0026][0027]
小鼠连续5天腹腔注射stz(50mg/kg bw/day),诱导1型糖尿病。另取 10只小鼠作为正常对照组(ctl),以相同剂量腹腔注射0.05mol/l柠檬酸钠缓 冲液(ph=4.5)。5天后,用血糖仪检测小鼠空腹血糖水平,将空腹血糖≥16.7 mmol/l的小鼠作为糖尿病小鼠进行后续分组研究。糖尿病小鼠随机分为4组, 每组10只,分别为:糖尿病肾病组(dn组),糖尿病肾病 低剂量pqq组(dn pqql组),糖尿病肾病 中剂量pqq组(dn pqqm组),糖尿病肾病 高 剂量pqq组(dn pqqh组)。pqq通过灌胃方式给予,低、中、高剂量分 别为10、20、40mg/kg bw/day,ctl组和dn组以相同剂量给予去离子水,所 有小鼠均连续灌胃12周。每两周测量空腹血糖,12周后用2%avertin麻醉, 取肾脏用于后续实验。
[0028]
动物基本生理状况观察和记录
[0029]
每天观察小鼠肢体、毛发等生理状况,每天添加适量饲料和饮水,并更换 干净垫料。每两周测量小鼠体重并记录。
[0030]
空腹血糖测定
[0031]
更换小鼠垫料,禁食不禁水4h。操作者将小鼠从饲养笼中取出并装入小鼠 固定器,将其整条尾巴暴露于外,用酒精棉擦拭小鼠尾尖。将血糖试纸插入血 糖仪,待其准备完成,显示可以进行测试后,用一次性血糖针插入小鼠尾部, 然后从尾根部向尾尖部按摩,擦去第一滴血。然后将血糖试纸靠近血液,利用 虹吸作用将血液吸入试纸,等待血糖仪显示读数后进行记录,并以干棉球擦拭 干净小鼠尾尖并按压止血,更换血糖试纸测试下一只小鼠。
[0032]
血生化分析
[0033]
连续灌胃12周后,用2%avertin溶液麻醉小鼠。从眼内眦静脉收集小鼠血 样,37
℃静置15min后,3000rpm转速离心15min,收集血清。利用全自动生 化分析仪测定血清样品中cr、bun、alt、ast水平。
[0034]
肾脏组织masson染色
[0035]
配置weigert铁苏木素染色液工作液:将试剂盒染液a与染液b等量混合。 石蜡切片在二甲苯中脱蜡5min,换用新鲜二甲苯再脱蜡5-10min。用weigert 铁苏木素染色液工作液染色10min。酸性乙醇分化液来进行分化、水洗。用 masson蓝化液进行返蓝、水洗。再依次用蒸馏水洗1min,弱酸工作液洗1min, 磷钼酸溶液洗2min,弱酸工作液洗1min。放入苯胺蓝染色液中染色2min,弱 酸工作液洗1min,二甲苯透明3次,每次2min。封片剂封片,显微镜下观察, 胶原纤维呈蓝色,正常组织呈红色。
[0036]
肾脏组织he染色
[0037]
肾脏组织在室温下用4%多聚甲醛固定24h,用石蜡包埋,切成5μm厚切 片。依次用无水乙醇作用5min,90%乙醇作用2min,80%乙醇作用2min,70% 乙醇作用2min,蒸馏水作用2min。苏木素染色液染色10min,浸自来水约10min 洗去多余的染色液,再用蒸馏水洗涤数秒钟。之后,用分化液分化约30s,自来 水冲洗10min。伊红染色液染色2min。再依次用70%乙醇作用10s,80%乙醇 作用10s,90%乙醇作用10s,无水乙醇作用10s,再用二甲苯透明5min。换 用新鲜的二甲苯,再透明5min。封片剂封片。显微镜下观察,细胞核呈蓝色, 而细胞浆呈粉红色或红色。
[0038]
蛋白质提取
[0039]
取小鼠肾脏皮质约0.03g于1.5ml离心管中,配制蛋白裂解液(ripa:10% sds:蛋白酶抑制剂:磷酸酶抑制剂=60:40:1:1),每管加入200-300μl蛋 白裂解液。在冰上将肾脏组织充分研磨成匀浆,用超声充分裂解。4℃,13500rpm 离心30min,取上清液保存于-80℃冰箱,用于后续实验。
[0040]
蛋白质处理
[0041]
用bca法测定蛋白浓度。稀释待测样品至合适浓度,bca试剂盒中a液 和b液按50:1比例混合,96孔板每孔中加入200μl bca混合液、19μl pbs 缓冲液,1μl待测蛋白样,轻轻震荡混匀后置于37℃培养箱中孵育30min。30 min后利用酶标仪测定蛋白标准曲线及蛋白样吸光度值。根据标准曲线及蛋白样 的吸光度值计算出蛋白的浓度,蛋白质上样量为80μg/孔,用ripa裂解液将所 有样品调整至相同体积,加入5
×
loading buffer后充分混匀,干式恒温器加热5 min(100℃),使蛋白质变性。
[0042]
western blotting检测蛋白质表达水平 电泳:将胶板固定在胶架上,放入电泳槽中,倒入电泳液至总体积的1/3,排除 气泡后,再将电泳液加至刻度线。首先,按分组在孔内加入一定体积的蛋白处 理样,然后在蛋白样本两边分别加入一孔3μlmarker(左边)和一孔1μlmarker (右边)。扣上电泳槽盖子,接通电源,设置电压70v,电泳时间持续20-30min, 直到marker分开后再将电压调至110v,根据目的蛋白分子量的大小调整电泳 时间,约为1-1.5小时。
[0043]
转膜:提前准备好冰槽,转膜槽置于冰槽中。将所需滤纸和nc膜用冰冷的转膜 液浸泡数分钟。将胶板从胶架上取下,浸泡在转膜液中。从玻璃胶板上割下胶, 然后按海绵垫1张、滤纸2张、胶、nc膜、滤纸2张、海绵垫1张的顺序放入 转膜夹中,将每一层的气泡排干净且保持湿润。将夹好的转膜夹放入转膜槽中, 加转膜液至刻度,盖上盖子,接通电源,将电
流调节至300ma,根据蛋白分子 量大小调整转膜时间,约75-105min。
[0044]
封闭:转膜完成后将nc膜取出,浸泡在配制好的封闭液中,室温下摇床55rpm 摇晃封闭2h。
[0045]
孵育一抗:根据抗体说明书,用一抗二抗稀释液将一抗原液稀释到合适倍数后 倒入抗体盒中,将2张剪出有目的蛋白的nc膜背靠背放入相应抗体盒中,于4℃ 冰箱的摇床上55rpm摇晃孵育过夜。colⅰ(1:1000),tgf-β1(1:400),nlrp3 (1:500),asc(1:1000),caspase-1(1:1000),cleaved caspase-1(1:1000),il-1β(1:1000)、il-18(1:1000),gapdh(1:4000)。
[0046]
孵育二抗:根据抗体说明书,用一抗二抗稀释液将二抗原液1:10000稀释。从 4℃冰箱中取出nc膜,置于室温摇床上55rpm摇晃1小时。之后用pbst在摇 床上摇晃洗膜3次,每次10min。之后,将nc膜平铺于桌面上,根据目的蛋 白一抗特异性加入700nm兔源或800nm鼠源荧光二抗,室温避光孵育1小时。 孵育完成后pbst洗膜3次,每次10min。
[0047]
扫膜:洗膜后使用红外荧光扫描系统odyssey扫描检测,gapdh或β-actin为内 参,根据灰度值对蛋白条带进行分析。
[0048]
提取rna
[0049]
生物安全柜紫外照射15min,再用depc水配制的75%酒精擦拭操作台面 及用具。动物:将肾脏组织从-80℃冰箱中取出,剪取适量肾皮质组织(约0.03g) 置于1.5ml ep管中。每管加入1mltrnzol试剂,研磨棒将肾脏组织研碎。细 胞:将六孔板中培养基弃去,每孔加入1ml trnzol试剂,用细胞刮刀将所有 细胞刮下,然后吸取至1.5ml ep管中。室温静置5min,使得核酸蛋白复合物 完全分离。
[0050]
向管中加入200μl氯仿,剧烈摇晃15s,静置3min后,13500rpm离心 15min。离心后溶液分层,小心吸取上层水相溶液到另一个新的1.5ml ep管中, 再向其中加入500μl异丙醇。静置10min,13500rpm离心10min。离心后将 上清液弃去,保留rna沉淀。加入1ml 75%乙醇洗涤沉淀,13500rpm离心1 min后弃去液体,将管子置于通风口挥干乙醇。最后用50μl depc水溶解沉淀。 用nanodrop核酸蛋白测定仪测rna浓度及纯度。
[0051]
rna逆转录
[0052]
逆转录体系如下:rna 1000ng、2
×
rt buffermix 10μl、20
×
enzyme mix1μl,不足部分用无rna酶水补齐,配制成20μl反应体系。反应程序为:25℃10 min
→→
85℃5min
→→
37℃120min
→→
4℃∞。
[0053]
荧光定量real-time pcr
[0054]
反应混合物体系如下:按10μl sybr green染料、各基因上下游引物各1 μl,ddh2o 7μl的比例配制反应混合物,轻轻混匀后取19μl/孔加入0.2ml pcr 反应板中,每孔再加入各基因1μl cdna。pcr 96孔板1000rpm离心1min, 使液体沉在孔底。置于荧光定量pcr仪中,95℃5min预变性后,按下列程序 完成反应:95℃15s
→
65℃30s
→
72℃30s,40循环。实验所需引物如下所示。
[0055][0056]
elisa检测
[0057]
用预冷的pbs冲洗肾脏组织以除去表面残留的血液或杂质,剪取约0.03g 肾脏组织置于1.5ml ep管中,按1:9的重量体积比加入pbs,在冰上用研磨 棒将肾脏组织充分研磨,后用涡旋器对细胞液进行涡旋震荡,使其充分裂解, 每次破碎时间为30s,共涡旋3次,间隔静置5min。涡旋完成后将细胞液静置 15min,低温高速离心机3000rpm离心30min,吸取上清液分装于ep管中,-80℃ 冰箱保存。
[0058]
elisa实验开始前20min从冰箱中取出试剂盒,平衡至室温。用双蒸水将20
×
浓 缩洗涤液稀释成1
×
工作液。标准品开盖前先1000rpm离心一分钟,然后加入标 准品&标本通用稀释液0.8ml至冻干标准品中,静置15min,待其充分溶解后, 轻轻混匀(浓度为1000pg/ml)。然后根据需要进行稀释至以下浓度:500、250、 125、62.5、31.25、15.6、7.8、0pg/ml。使用前20min,用生物素化抗体稀释 液将30
×
浓缩生物素化抗体稀释成1
×
工作液,现用现配。使用前20min,用酶 结合物稀释液将30
×
浓缩酶结合物稀释成1
×
工作液,现用现配。
[0059]
1.取出实验所需板条。
[0060]
2.空白孔加标准品&标本通用稀释液,其余相应孔中加标本或不同浓度标准品 (100μl/孔),用封板胶纸封住反应孔,37℃恒温箱,避光孵育90min。
[0061]
3.提前20min准备生物素化抗体工作液。
[0062]
4.洗板5次。
[0063]
5.空白孔加生物素化抗体稀释液,其余孔加入生物素化抗体工作液(100μl/孔)。 用新封板胶纸封住反应孔,37℃恒温箱,避光孵育60min。
[0064]
6.提前20min准备酶结合物工作液。避光室温(22-25℃)放置。
[0065]
7.洗板5次。
[0066]
8.空白孔加酶结合物稀释液,其余孔加入酶结合物工作液(100μl/孔)。用新封 板胶纸封住反应孔,37℃恒温箱,避光孵育30min。
[0067]
9.打开酶标仪电源,预热仪器,设置好检测程序。
[0068]
10.洗板5次。
[0069]
11.加入显色底物(tmb)100μl/孔,37℃恒温箱,避光孵育15min。
[0070]
12.加入反应终止液100μl/孔,混匀后即刻测量od450值(3分钟内)。
[0071]
13.每个标准品和标本的od值应减去空白孔的od值。以标准品浓度作横坐标, od值作纵坐标,采用二次多项式方程拟合制作标准曲线。通过标本的od值可 在标准曲线上查出其浓度。
[0072]
表1为本发明所述pqq治疗12周后,糖尿病小鼠体重的变化。与对照组 小鼠相比,糖尿病小鼠的平均体重显著降低(p《0.001),用40mg pqq/kg bw/ 天进行干预可显着改善
糖尿病引起的体重下降(p《0.05)。
[0073]
表2为本发明所述pqq治疗12周后,糖尿病小鼠空腹血糖的变化。与对 照组小鼠相比,糖尿病小鼠的空腹血糖浓度显著升高(p《0.001),用40mg/kgbw/天pqq治疗可以有效降低糖尿病小鼠的血糖浓度(p《0.05)。提示pqq 干预可以有效缓解糖尿病小鼠血糖的升高。
[0074]
表1pqq对糖尿病小鼠体重影响
[0075][0076]
数据用平均值
±
sd表示,
***
p《0.001vs.ctl,
#
p《0.05vs.dn,n=10。dn,c57bl/6糖尿 病小鼠;dn pqql,c57bl/6糖尿病小鼠灌胃10mg/kg bw/day pqq;dn pqqm,c57bl/6 糖尿病小鼠灌胃20mg/kg bw/day pqq;dn pqqh,c57bl/6糖尿病小鼠灌胃40mg/kgbw/day pqq。bw,体重。
[0077]
表2pqq对糖尿病小鼠空腹血糖的影响
[0078][0079]
数据用平均值
±
sd表示,
***
p《0.001vs.ctl,
#
p《0.05vs.dn,n=10。dn,c57bl/6糖尿 病小鼠;dn pqql,c57bl/6糖尿病小鼠灌胃10mg/kg bw/day pqq;dn pqqm,c57bl/6 糖尿病小鼠灌胃20mg/kg bw/day pqq;dn pqqh,c57bl/6糖尿病小鼠灌胃40mg/kgbw/day pqq。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。