一种sige检测试剂盒及其检测方法
技术领域
1.本发明属于生物医学检测技术领域,尤其是涉及一种sige检测试剂盒及其检测方法。
背景技术:
2.标记免疫分析融合抗原-抗体结合的高度特异性和标记(示踪)物质检测的高度敏感性于一体,广泛应用于临床医学体液标本中超微量物质的定量分析。根据是否需要分离结合标记物(bind,b)和游离标记物(free,f),标记免疫分析分为均相免疫分析和非均相免疫分析。均相免疫分析不需分离去除游离标记物,直接测定结合标记物的信号,即获得剂量曲线或标准曲线,如荧光偏振免疫分析和光激化学发光分析(lica)。非均相免疫分析需要先分离去除游离标记物,再测定结合标记物的信号,才能获得剂量曲线或标准曲线,如化学发光免疫分析(clia)和电化学发光免疫分析(eclia)。
3.标记免疫分析测定抗体的方式包括:间接法、双抗原夹心法、竞争法、中和法等。其中间接法可通过抗抗体(抗人-igg或抗人-igm)区分待检抗体的免疫球蛋白类别,从而对判断感染性疾病的病程有重要价值,因此是常用的分析模式。经典间接法需采用两步法进行,已知抗原与待检抗体结合,标记抗抗体(第二抗体)与待检抗体结合,两步之间需分离去除非特异性(与抗原无关)抗体,否则非特异性抗体同样会与第二抗体结合,消耗大量第二抗体并提升空白的信号值。
4.在非均相标记免疫分析技术中,通过“分离洗涤”去除未参与结合的游离标记物,是分析过程的关键环节之一。然后无论是手工操作,还是仪器自动完成,均会导致洗涤误差。同时,洗涤过程也会导致标本之间交叉污染,强阳性标本会影响临近标本的检测结果。而均相标记免疫分析技术的特点是全程无分离洗涤过程,不存在洗涤误差。
5.虽然均相免疫分析技术中无需分离洗涤步骤,但是血清或血浆中的一些物质却会干扰标记信号检测或干扰化学发光反应。此外,在均相标记免疫分析技术中涉及化学发光的领域,有的涉及氧化还原反应,如血液标本中含有一些氧化-还原药物(如维生素c)同样干扰光信号的产生过程,严重影响检测结果的准确性。
技术实现要素:
6.本发明针对现有技术的不足提供了一种sige检测试剂盒及其检测方法。利用该试剂盒分析待检样本中抗原或抗体的方法能够消除均相免疫检测中的基质效应,改变了均相免疫检测不能使用间接法测定抗体及检测抗原时出现钩状效应的现状。
7.为此,本发明第一方面提供了一种无基质效应的均相检测试剂盒,其包括:
8.第一组合物,其包含能够与单线态氧反应生成可检测信号的受体以及与之结合的第二抗体或第二抗体片段,所述第二抗体或第二抗体片段能够与待检样品中被分析物的第一表位特异性结合;
9.第二组合物,其包含供体,所述供体能够在激发状态产生单线态氧;
10.第三组合物,其包含磁体微球,所述磁体微球用于分离待检样品中的基质以及待检样品中未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质。
11.本技术的发明人惊讶地发现,利用本发明所述试剂盒分析待检样本中抗原或抗体的方法,增加了去除血清/血浆基质的过程,有效避免血清/血浆基质对均相检测中的后续发光过程产生的影响,改变了均相免疫分析技术不能使用间接法测定抗体及检测抗原时出现钩状效应的现状。此外,本发明所述去除血清/血浆基质的过程,不同于一般非均相免疫分析的分离洗涤,其目的不是去除游离标记物,而是去除血清/血浆中可能的干扰物质,只需去除大部分干扰物质即可(80%以上),对洗涤精度没有过高的要求,不会对精密度(重复性)产生影响。另外,本发明试剂盒的通用性强,可以检测多种项目。
12.在本发明的一些实施方式中,所述试剂盒还包括第四组合物,所述第四组合物包含能够与被分析物的第二表位特异性结合的第一抗体或第一抗体片段。
13.根据本发明,所述磁体微球和所述供体均包被有特异性结合配对成员中的一员,所述第一抗体包被有特异性结合配对成员中的另一员。
14.在本发明的另一些实施方式中,所述试剂盒还包括第四组合物,所述第四组合物包含能够与被分析物的第三表位特异性结合的已知抗原。
15.根据本发明,所述磁体微球和所述供体均包被有特异性结合配对成员中的一员,所述已知抗原表面包被有特异性结合配对成员中的另一员。
16.在本发明的一些优选方式中,所述特异性结合配对成员为生物素-链霉亲和素系统。
17.在本发明的另一些优选实施方式中,所述磁体微球通过生物素标记的牛血清白蛋白和/或生物表标记的球蛋白间接被链霉亲和素包被。
18.根据本发明,所述磁体微球选的粒径为100nm~1μm,优选为200nm~800nm,更优选为300nm~600nm。
19.本发明第二方面提供了一种使用如本发明第一方面所述试剂盒检测待检样本中是否存在被分析物的均相检测方法,其包括以下步骤:
20.s1,通过磁场将由磁体微球-被分析物所形成的第一复合物与待检样品中的基质以及未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质相分离;
21.s2,将第一组合物、第二组合物与第一复合物接触以形成第二复合物;
22.s3,利用能量或者活性化合物接触所述第二复合物,激发供体产生单线态氧,所述受体与接收到的单线态氧反应生成可检测的化学发光信号;
23.s4,分析所述化学发光信号,判断待检样品中是否存在被分析物和被分析物的含量或浓度。
24.在本发明的一些实施方式中,步骤s1之前还有步骤s0,其将待测样本、第三组合物和第四组合物接触以生成所述的第一复合物。
25.根据本发明,当所述被分析物为待检抗原时,所述第四组合物包括能够与被分析物的第二表位特异性结合的第一抗体或第一抗体片段,所述第一复合物中的磁体微球和被分析物通过第一抗体或第一抗体片段相结合。
26.根据本发明,当所述被分析物为待检抗体时,所述第四组合物包含能够与被分析物的第三表位特异性结合的已知抗原,所述第一复合物中的磁体微球和被分析物通过已知
抗原相结合。
27.在本发明的一些优选实施方式中,所述方法包括以下步骤:
28.s0,将待检样本、第三组合物和第四组合物混合,得到包含由磁体微球-被分析物所形成的第一复合物的第一混合物;
29.s1,利用磁场吸附第一复合物,移除所述第一混合物中含有基质以及其他非特异物质的液体。
30.在本发明的一些具体实施例中,步骤s1中移除的液体体积占第一混合物中液体体积的80%-95%。
31.根据本发明,所述步骤s1和所述步骤s2之间没有洗涤步骤。
32.根据本发明,所述步骤s2和所述步骤s3之间没有洗涤步骤。
33.在本发明的一些优选实施方式中,步骤s2中,先移除磁场后,再将第一组合物和第二组合物加入到第一复合物中以形成第二复合物。
34.根据本发明,所述待检样本中的被分析物选自血清或血浆中的病原体抗体、自身抗体、过敏原特异性抗体和过敏原总抗体中的一种或多种。
35.本技术的发明人惊讶地发现,本发明的方法改变了均相免疫检测中的光激化学发光分析不能使用间接法测定抗体的现状。由于待检抗体在非特异性抗体中所占的比例较小,现有光激化学发光分析程序中无分离洗涤过程,无法去除非特异性抗体,非特异性抗体同样可结合抗抗体包被的受体微球,从而干扰检测系统。因此,常规光激化学发光分析不能采用“已知抗原-待检抗体-标记抗抗体”的间接分析模式,只能采用双抗原夹心或竞争分析模式,对待检抗体进行检测,而双抗原夹心或竞争分析模式对已知抗原或竞争抗体的要求较高,且不能区分待检抗体免疫球蛋白的类别。上述的新型均相检测中的光激化学发光分析,在已知抗原(与被分析抗体结合的抗原)与被分析抗体结合后增加磁场分离环节,能有效去除非特异性抗体和其他干扰物,从而消除非特异性抗体和其他干扰物的影响。
36.另外,上述利用磁场在均相免疫分析方法过程中分离去除血清/血浆基质的过程与非均相免疫分析的分离洗涤过程不同,不会对精密度(重复性)产生影响。非均相免疫分析的“分离洗涤”过程,是在标记抗体与相应待检抗原或标记抗原与相应的待检抗体发生后进行的,其目的是去除游离标记物对信号检测产生的影响,同时也去除血清/血浆中的干扰物质。但是,此种分离洗涤需重复进行3-5次,才能彻底去除游离标记物,不仅增加检测时间,更重要的是由于的洗涤过程难标准化,会带来较大误差(洗涤误差),从而影响分析方法的精密度。而本发明去除血清/血浆基质的过程,是在加入供体微球和受体微球之前进行,分离目的不是去除游离标记物,而是去除血清/血浆中可能的干扰物质,只需去除大部分干扰物质即可,对洗涤精度也没有过高的要求。
37.本发明第三方面提供了一种如本发明第二方面所述方法中所涉及的第二复合物,其包括:
38.中心体部分,其选自免疫分子中的任一种;
39.能够与单线态氧反应生成可检测发光信号的受体部分,其通过第二抗体或第二抗体片段与中心体相结合,所述第二抗体或第二抗体片段能够与中心体的第四表位特异性结合;
40.能够在激发状态下产生单线态氧的供体部分,其通过桥体与中心体相结合,所述
桥体与中心体上不与所述第四表位重叠的第五表位特异性结合;
41.磁体部分,其通过桥体与中心体结合,所述桥体与中心体上不与所述第四表位重叠的第六表位特异性结合。
42.在本发明的一些实施方式中,所述桥体选自能够与中心体特异性结合的已知抗原、第一抗体或第一抗体片段。
43.在本发明的另一些实施方式中,所述磁体通过生物素标记的牛血清白蛋白和/或生物表标记的球蛋白间接被链霉亲和素包被,所述桥体包被有生物素。
44.根据本发明,所述中心体选自人血清或血浆中的病原抗体、自身抗体或过敏原特异性抗体中的一种。
45.本发明第四方面提供了一种如本发明第一方面所述试剂盒或本发明第二方面所述的方法或本发明第三方面所述的第二复合物在临床检测血清或血浆中的抗原或抗体中的应用。
附图说明
46.下面将结合附图详细说明本发明。
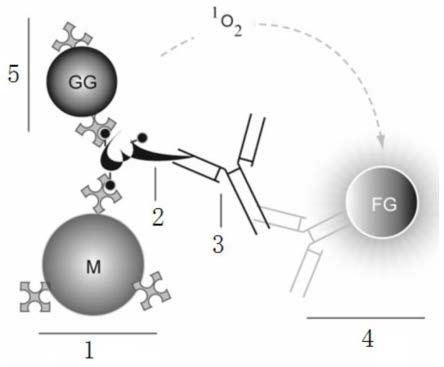
47.图1为本发明所述方法分析待检样本中抗体的原理图示意图。图中附图标记的含义如下:1链霉亲合素标记的磁体微球;2生物素标记的已知抗原;3被分析抗体;4与受体微球结合的第二抗体;5链霉亲和素标记的供体微球。
48.图2为本发明所述方法分析待检样本中抗原的原理图示意图。图中附图标记的含义如下:1链霉亲合素标记的磁体微球;2生物素标记的的第一抗体;3被分析抗原;4与受体微球结合的第二抗体;5链霉亲和素标记的供体微球。
49.图3为采用与链霉亲和素间接结合的磁体微球分析待检样本中抗原的原理示意图。图中附图标记的含义如下:1链霉亲合素标记的磁体微球;1-1磁体微球;1-2生物素标记牛血清白蛋白或球蛋白;1-3链霉亲合素;2与生物素结合的第一抗体;3被分析抗原;4与受体微球结合的第二抗体;5链霉亲和素标记的供体微球。
具体实施方式
50.为使本发明容易理解,下面将详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。
51.在提供了数值范围的情况下,应当理解所述范围的上限和下限和所述规定范围中的任何其他规定或居间数值之间的每个居间数值均涵盖在本发明内。这些较小范围的上限和下限可以独立包括在较小的范围中,并且也涵盖在本发明内,服从规定范围中任何明确排除的限度。在规定的范围包含一个或两个限度的情况下,排除那些包括的限度之任一或两者的范围也包含在本发明中。
52.除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。
[0053]ⅰ.术语
[0054]
本发明所述用语“待检样本”是指可能含有被分析物的一种混合物,被分析物包括但不限于蛋白质、激素、抗体或抗原。可以被用在本发明公开的方法中的典型待检样本包括体液,如血液、血浆、血清、尿、精液、唾液等。
[0055]
本发明所述用语“抗体”和“免疫球蛋白”以最广含义使用,包括任何同种型的抗体或免疫球蛋白,保留对抗原的特异性结合的抗体片段,包括但不限于fab、fv、scfv、和fd片段、嵌合抗体、人源化抗体、单链抗体、双特异性抗体、和包含抗体的抗原结合部分和非抗体蛋白的融合蛋白。在任何需要的情况下,抗体可以进一步与其它部分,诸如特异性结合配对成员,例如生物素或链霉亲和素(生物素-链霉亲和素特异性结合配对成员中的一员)等缀合。
[0056]
本发明所述用语“单克隆抗体”是指由单克隆的b淋巴细胞分泌的免疫球蛋白,其可以通过本领域技术人员所公知的方法来制备得到。
[0057]
本发明所述用语“多克隆抗体”是指由一个以上的b淋巴细胞克隆产生的免疫球蛋白集合,其可以通过本领域技术人员所公知的方法来制备得到。
[0058]
本发明所述用语“抗原”是指能够刺激机体产生免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应的物质。
[0059]
本发明所述用语“结合”指由于例如共价、静电、疏水、离子和/或氢键等相互作用,包括但不限于如盐桥和水桥等相互作用引起的两个分子间的直接联合。
[0060]
本发明所述用语“特异性结合”,是指两种物质之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。
[0061]
本发明所述用语“特异性结合配对成员”是指这样一对分子,它们能够相互特异性结合,例如,酶-底物、抗原-抗体、配基-受体。一个具体的特异性结合配对成员对的例子是生物素-链霉亲和素系统,其中“生物素”广泛存在于动植物组织中,其分子上有两个环状结构,分别为咪唑酮环和噻吩环,其中咪唑酮环是与链霉亲和素结合的主要部位。活化的生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括蛋白质、核酸、多糖和脂类等;而“链霉亲和素”是由链霉菌分泌的一种蛋白质,分子量为65kd。“链霉亲和素”分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素。因此每个抗原或抗体可同时偶联多个生物素分子,从而产生“触手效应”提高分析灵敏度。
[0062]
在任何需要的情况下,本发明中所用任何试剂,包括抗原、抗体、受体或供体,可以根据实际需要缀合生物素-链霉亲和素特异性结合配对成员中的任一员。
[0063]
本发明所述用语“供体”是指通过能量或者活性化合物的激活后能够产生与受体反应的诸如单线态氧的活性中间体的敏化剂。供体可以是光活化的(如染料和芳香化合物)或者化学活化的(如酶、金属盐等)。在本发明一些具体实施例中,所述供体是光敏剂,所述光敏剂可以是本领域已知的光敏剂,优选相对光稳定且不与单线态氧有效反应的化合物,其非限定性的例子包括例如美国专利us5709994(该专利文献在此全文引为参考)公开的亚甲基蓝、玫瑰红、卟啉、酞菁和叶绿素等化合物,以及这些化合物的具有1-50个原子取代基的衍生物,所述取代基用于使得这些化合物更具有亲脂性或更具有亲水性、和/或作为连接至特异性结合配对成员的连接基团。本领域技术人员已知的其他光敏剂的例子也可以在本发明中使用,例如美国专利us6406913中记载的内容,该专利文献并入本文以供参考。在本发明另一些具体实施例中,所述供体是化学活化的其他敏化剂,其非限定性的例子是某些
化合物,它们催化过氧化氢转化为单线态氧和水。其他一些供体的例子包括:1,4-二羧基乙基-1,4-萘内过氧化物、9,10-二苯基蒽-9,10-内过氧化物等,加热这些化合物或者这些化合物直接吸收光会释放单线态氧。
[0064]
本发明所述用语“受体”是指能够与单线态氧反应可以产生可检测信号的化合物。供体被能量或者活性化合物诱导激活并释放高能态的单线态氧,该高能态的单线态氧被近距离的受体俘获,从而传递能量以激活所述受体。在本发明的一些具体实施例中,所述受体是这样的物质,其经历与单线态氧的化学反应以形成不稳定的亚稳态中间体,所述亚稳态中间体可以分解,同时或随后发光。这些物质的典型例子包括但不限于:烯醇醚、烯胺、9-烷叉黄原胶、9-烷叉-n-烷基吖啶满、芳乙烯醚、双环氧乙烯、二甲基噻吩、芳香性咪唑或光泽精。在本发明的另一些具体实施例中,所述受体是能够与单线态氧反应以形成可以分解成酮类或羧酸衍生物的氢过氧化物或二氧环丁烷的烯烃类;可以通过光的作用分解的稳定二氧环丁烷;可以与单线态氧反应以形成二酮类的乙炔类;可以形成偶氮化合物或偶氮羰基化合物的腙类或酰肼类,诸如鲁米诺;和可以形成内过氧化物类的芳族化合物。可以根据本公开和要求保护的发明利用的受体的具体的、非限制性实例记载于美国专利号us5340716(该专利文献在此全文引为参考)。在本发明另一些具体实施例中,所述受体包含烯烃化合物和金属螯合物,其是非粒子化的并且在含水介质中可溶,这种受体的情况可参见专利pct/us2010/025433(该专利文献在此全文引为参考)
[0065]
在本发明中,所述“供体”和/或“受体”可以通过功能基团被包被在基体上形成“供体微球”和/或“受体微球”。本发明所述“基体”是本领域技术人员所公知的微球或微粒,其可以是任何尺寸的,其可以是有机的或是无机的,其可以是可膨胀或不可膨胀的,其可以是多孔的或非多孔的,其具有任何密度,但优选具有和水接近的密度,优选能漂浮于水中,且由透明、部分透明或不透明的材料构成。所述基体可以有或没有电荷,当带有电荷时,优选是负电荷。所述基体可以是固体(如聚合物、金属、玻璃、有机和无机物诸如矿物、盐和硅藻)、小油滴(如碳氢化合物、碳氟化合物、硅质流体)、囊泡(如合成的诸如磷脂、或天然的诸如细胞、及细胞器官)。基体可以是乳胶颗粒或是含有有机或无机聚合物的其他颗粒、脂双层如脂质体、磷脂囊泡、小油滴、硅颗粒、金属溶胶、细胞和微晶染料。基体通常具有多功能性,或者能够通过特异或非特异的共价或非共价相互作用而结合到供体或受体上。有许多官能团是可用的或者将其合并进来。典型的官能团包括羧酸、乙醛、氨基、氰基、乙烯基、羟基、巯基等。适用于本发明的基体的一个非限制性的例子是羧基改性的乳胶颗粒。这种基体的详细情况可参见美国专利us5709994与us5780646(这两篇专利文献在此全文引为参考)。
[0066]
本发明所述用语“表位”是指能够特异性结合免疫球蛋白或者t细胞受体的任何蛋白决定簇。在本发明的一些具体实施例中,表位是抗原表面能够被抗体特异性集合的区域。表位决定簇通常可以包括分子的化学活性表面基团,例如但不限于:氨基酸、糖侧链、磷酰基和/或磺酰基。在本发明的其他一些具体实施例中,表位可以具体特定三位结构特征以及特定电荷特征。
[0067]
本发明所述用语“免疫分子”的种类很多,其中有些具有结构和进化上的同源性,主要的有以下几类:膜表面抗原受体、主要组织相容性复合物抗原、白细胞分化抗原、粘附分子、抗体、补体、细胞因子、抗原等;特别地,本发明所述“免疫分子”主要指抗原及抗体。
[0068]ⅱ.实施例
[0069]
如前所述,经典间接法检测抗体的过程中必须有分离洗涤过程以除去非特异性抗体和游离抗体的影响,而均相检测中的光激化学发光分析(lica)的特点是全程无分离洗涤过程,因而不能去除血清或血浆中干扰标记信号检测或干扰化学发光反应的物质,不能采用间接法检测抗体,也不能区分待检抗体免疫球蛋白的类别。
[0070]
本技术的发明人通过在检测过程中引入磁体微球,在加入含供体的第一组合物和含受体的第二组合物之前,通过磁分离去除血清/血浆中去除大部分干扰物质,有效避免了干扰物质对检测结果的影响。
[0071]
为此,本发明第一方面所涉及的无基质效应的均相检测试剂盒,其包括以下试剂:
[0072]
第一组合物,其包含能够与单线态氧反应生成可检测信号的受体以及与之结合的第二抗体或第二抗体片段,所述第二抗体或第二抗体片段能够与待检样品中被分析物的第一表位特异性结合;
[0073]
第二组合物,其包含供体,所述供体能够在激发状态产生单线态氧;
[0074]
第三组合物,其包含磁体微球,所述磁体微球用于分离待检样品中的基质以及待检样品中未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质。具体地,本发明所述的无基质效应的均相检测试剂盒,其包括以下试剂:
[0075]
(a)与第二抗体或第二抗体片段结合的受体溶液;所述受体能够与单线态氧反应生成可检测信号;所述第二抗体或第二抗体片段能够与待检样品中被分析物的第一表位特异性结合;所述受体溶液的0.25mg/ml-0.75mg/ml;
[0076]
(b)供体溶液,所述供体能够在激发状态产生单线态氧;所述供体溶液的浓度为35mg/ml-45mg/ml;
[0077]
(c)磁体微球溶液,所述磁体微球用于分离待检样品中的基质以及待检样品中未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质;所述磁体微球溶液的浓度为15mg/ml-20mg/ml;
[0078]
(d)与被分析物的第二表位特异性结合的第一抗体或第一抗体片段溶液(被分析物为抗原);或与被分析物的第三表位特异性结合的已知抗原溶液(被分析物为抗体);所述第一抗体或第一抗体片段溶液的浓度与已知抗原溶液的浓度均为0.25mg/ml-0.75mg/ml。
[0079]
在本发明中,所述第二抗体选自抗人单克隆抗体和/或多克隆抗体;在一个具体实施方式,所述第二抗体选自抗人ige多克隆抗体。
[0080]
在本发明中,所述第一抗体选自抗人单克隆抗体和/或多克隆抗体,在一个具体实施方式,所述第一抗体选自抗人ige单克隆抗体。
[0081]
上述试剂根据试剂需要,所述磁体微球和供体、第一抗体和已知抗原可以与链霉亲和素或生物素相连,从而通过“特异性结合配对成员”之间的特异性相互作用而实现两个分子的连接。另外,所述试剂中的供体和受体可以被包被在基体颗粒上形成供体微球和受体微球。
[0082]
所述链霉亲和素可以直接或间接地与磁体微球结合;优选地,所述链霉亲和素间接地与磁体微球结合。所述链霉亲和素间接地与磁体微球结合的方式为:首先在磁体微球的表面连接被生物素标记的牛血清白蛋白和/或被生物表标记的球蛋白,然后链霉亲和素通过生物素间接地与磁体微球结合。该方式会进一步拓展磁体微球表面的空间,以减少生物分子结合的空间位阻效应。采用与链霉亲和素间接结合的磁体微球分析待检样本中抗原
的原理示意图如图3所示。
[0083]
更具体地,本发明所述的无基质效应的均相检测试剂盒,其包括以下试剂:
[0084]
(a)与第二抗体或第二抗体片段结合的受体微球溶液;所述受体微球能够与单线态氧反应生成可检测信号;所述第二抗体或第二抗体片段能够与待检样品中被分析物的第一表位特异性结合;
[0085]
(b)生物素标记的供体微球溶液,所述供体微球能够在激发状态产生单线态氧;
[0086]
(c)链霉亲和素标记的磁体微球溶液,所述磁体微球用于分离待检样品中的基质以及待检样品中未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质;
[0087]
(d)链霉亲和素标记的与被分析物的第二表位特异性结合的第一抗体或第一抗体片段溶液(被分析物为抗原);或链霉亲和素标记的与被分析物的第三表位特异性结合的已知抗原溶液(被分析物为抗体)。
[0088]
本发明第二方面所涉及的使用如本发明第一方面所述试剂盒检测待检样本中是否存在被分析物的均相检测方法,其包括使用如本发明第一方面所述试剂盒检测待检样本中是否存在抗体的方法和使用如本发明第一方面所述试剂盒检测待检样本中是否存在抗原的方法。
[0089]
具体地,使用如本发明第一方面所述试剂盒检测待检样本中是否存在抗体的方法,其原理图如图1所示,具体包括以下步骤:
[0090]
s0,将待检样本、试剂(c)和试剂(d)混合,得到包含由磁体微球-被分析抗体所形成的第一复合物的第一混合物;所述试剂(d)为链霉亲和素标记的与被分析物的第三表位特异性结合的已知抗原溶液。
[0091]
s1,利用磁场吸附第一复合物,移除所述第一混合物中所含有的基质以及其他非特异物质的液体,使第一复合物与待检样品中的基质以及未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质相分离。
[0092]
s2,移除磁场,将试剂(a)和试剂(b)与第一复合物接触以形成第二复合物。
[0093]
s3,利用能量或者活性化合物接触所述第二复合物,激发供体微球产生单线态氧,所述受体微球与接收到的单线态氧反应生成可检测的化学发光信号。
[0094]
s4,分析所述化学发光信号,判断待检样品中是否存在被分析抗体;以及根据被分析抗体的标准曲线判断被分析抗体的含量或浓度。
[0095]
本发明中“所述被分析抗体的标准曲线”指的是利用被分析抗体的标准品获得的“抗体浓度-信号值”的数学函数曲线。
[0096]
使用如本发明第一方面所述试剂盒检测待检样本中是否存在抗原的方法,其原理图如图2所示,具体包括以下步骤:
[0097]
s0,将待检样本、试剂(c)和试剂(d)混合,得到包含由磁体微球-被分析抗体所形成的第一复合物的第一混合物;所述试剂(d)为链霉亲和素标记的与被分析物的第二表位特异性结合的第一抗体或第一抗体片段溶液。
[0098]
s1,利用磁场吸附第一复合物,移除所述第一混合物中所含有的基质以及其他非特异物质的液体,使第一复合物与待检样品中的基质以及未与所述第一抗体或第一抗体片段特异性结合的其他非特异物质相分离。
[0099]
s2,移除磁场,将试剂(a)和试剂(b)与第一复合物接触以形成第二复合物。
[0100]
s3,利用能量或者活性化合物接触所述第二复合物,激发供体微球产生单线态氧,所述受体微球与接收到的单线态氧反应生成可检测的化学发光信号。
[0101]
s4,分析所述化学发光信号,判断待检样品中是否存在被分析抗原;以及根据被分析抗原的标准曲线判断被分析抗体的含量或浓度。
[0102]
本发明中“所述被分析抗原的标准曲线”指的是利用被分析抗原的标准品获得的“抗原浓度-信号值”的数学函数曲线。
[0103]
上述利用双抗体夹心测定抗原的均相免疫检测分析方法,通过引入磁分离过程,去除血清或血浆中的无关组分,防止这些组分对后续的化学发光过程产生影响,有效提高了分析试剂抗“钩状效应”的能力。
[0104]
实施例
[0105]
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。
[0106]
实施例1利用本发明所述方法间接检测sige抗体
[0107]
检测体系由链霉亲合素标记的磁体微球(m-sa)溶液、链霉亲合素标记的供体微球(gg-sa)溶液、生物素标记的已知抗原(蛋清蛋白(bio-ag))溶液、与受体微球结合的抗人ige抗体(fg-anti-hige)溶液组成。
[0108]
主要试剂:
[0109]
(1)链霉亲合素标记的磁体微球溶液:商品有售,浓度17.5mg/ml。稀释液为0.1m的tris-hcl溶液,含3%(3g/100ml)的牛血清白蛋白(bsa)。
[0110]
(2)生物素标记的蛋清蛋白过敏原溶液:由博阳生物科技(上海)有限公司提供,浓度为0.50mg/ml。稀释液为0.1m的tris-hcl溶液,含3%(3g/100ml)的牛血清白蛋白(bsa)。
[0111]
(3)与受体微球结合的抗人ige抗体(单克隆抗体)(fg-anti-hige)溶液:由博阳生物科技(上海)有限公司提供,浓度为0.50mg/ml。稀释液为0.1m的tris-hcl溶液,含3%(3g/100ml)的牛血清白蛋白(bsa)。
[0112]
(4)链霉亲合素标记的供体微球(gg-sa)溶液博阳生物科技(上海)有限公司提供,浓度为40mg/ml。
[0113]
(5)光激化学发光微孔板(96-t):由博阳生物科技(上海)有限公司提供。
[0114]
(6)用作本发明的供体微球和受体微球的制备方法、组成结构及其含量可以参见中国专利cn100429197c中的实施例1(该专利文献在此全文引为参考)。
[0115]
检测步骤:
[0116]
(1)微孔板内分别加入25ml生物素标记的蛋清蛋白过敏原溶液,25ml待检血清/血浆样本(生理盐水稀释40倍),25ml链霉亲合素标记的磁体微球溶液,混匀后置37℃温育20分钟,获得包含第一复合物的第一混合物。蛋清蛋白过敏原捕获待检sige抗体形成免疫复合物,该复合物经生物素-链霉亲和素系统被磁体微球捕获。
[0117]
(2)将微孔板贴近磁铁,借助磁场将磁体微球吸至一侧,从另一侧用负压泵小心将液体吸干,注意不要吸走磁体微球。保留磁体微球,并去除体系中的干扰组分,特别是非特异性ige抗体。
[0118]
(3)移开磁场,加入100ml与受体微球结合的抗人ige抗体(fg-anti-hige)溶液,混
匀后置37℃温育20分钟,然后加入175ml链霉亲合素标记的供体微球(gg-sa)溶液,混匀后置37℃温育10分钟,获得包含第二复合物的第二混合物。
[0119]
抗人ige抗体与待检sige抗体结合,与供体微球相连的链霉亲合素和与蛋清蛋白过敏原相连的生物素结合,使得供体微球和受体微球靠近,如附图1所示。
[0120]
(4)用光激化学发光分析仪(激发波长680nm,测定波长615nm)读取第二混合物的化学发光信号值,根据sige抗体的标准品溶液获得标准曲线,计算待检样本中sige抗体含量,检测结果如表1所示。
[0121]
表1:血清/血浆样本中蛋清蛋白sige抗体的检测结果
[0122][0123]
从表1可知,本发明可采用间接法准确检测出血清/血浆中的待检sige抗体,改变了光激化学发光分析不能使用间接法测定抗体的现状。
[0124]
实施例2利用本发明所述方法检测血清总ige(tige)抗体
[0125]
检测体系由链霉亲合素标记的磁体微球溶液、链霉亲合素标记的供体溶液、生物素标记的抗人ige多克隆抗体溶液、与受体结合的抗人ige单克隆抗体溶液组成。
[0126]
主要试剂:
[0127]
(1)链霉亲合素标记的磁体微球溶液:商品有售,浓度17.5mg/ml。稀释液为0.1m的tris-hcl溶液,含3%(3g/100ml)的牛血清白蛋白(bsa)。
[0128]
(2)生物素标记的抗人ige多克隆抗体(bio-anti-hige)溶液:由博阳生物科技(上海)有限公司提供,浓度为0.5mg/ml。
[0129]
(3)与受体结合的抗人ige单克隆抗体溶液:根据专利pct/us2010/025433中记载的实施例来制备的。与受体结合的抗人ige单克隆抗体的结构为:抗人ige单克隆抗体-bsa-(二甲基噻吩)-(bhhct),其是非粒子化的,在水溶液中可溶,溶液的浓度为0.50mg/ml。
[0130]
(4)链霉亲合素标记的供体溶液:根据专利us5780646的实施例所述的方法将200g叶绿素a放入200nm的羧基改性的乳胶颗粒中,并将链霉亲和素包被在表面以形成本发明所述的链霉亲合素标记的供体,溶液的浓度为0.50mg/ml。
[0131]
检测步骤:
[0132]
(1)微孔板内分别加入25ml生物素标记的抗人ige多克隆抗体溶液,25ml待检血清/血浆样本,25ml链霉亲合素标记的磁体微球溶液,混匀后置37℃温育20分钟,获得含第一复合物的第一混合物。样本中的ige与抗人ige多克隆抗体形成免疫复合物,该复合物经生物素-链霉亲和素系统被磁体微球捕获。
[0133]
(2)将微孔板贴近磁铁,借助磁场将磁体微球吸至一侧,从另一侧用负压泵小心将液体吸干,注意不要吸走磁体微球。保留磁体微球,并去除体系中血清或血浆基质。
[0134]
(3)移开磁场,加入100ml与受体结合的抗人ige单克隆抗体溶液,混匀后置37℃温育20分钟;然后加入175ml链霉亲合素标记的供体溶液,混匀后置37℃温育10分钟,获得第二混合物。
[0135]
(4)用光激化学发光分析仪(激发波长680nm,测定波长615nm)读取第二混合物的化学发光信号值,根据tige抗体标准品溶液获得标准曲线,计算待检样本中tige抗体的含量。检测结果如表2所示。
[0136]
表2:血清/血浆样本tige抗体的检测结果
[0137][0138]
从表2可知,本发明可采用双抗原夹心法准确检测出血清/血浆中的tige抗体,且有效避免了检测抗原时出现的钩状效应。
[0139]
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。