1.本发明属于生物医药领域,具体涉及一种具备活性氧和炎症双重抑制作用的小分子水凝胶及其制备方法。
背景技术:
2.活性氧的过量产生以及炎症的爆发是缺血再灌注损伤的主要原因,通过仅清除活性氧或抑制炎症的单一的治疗策略,收效甚微,toll样受体4(tlr4)作为tlr受体的一种,是贯通活性氧和炎症的重要纽带。既往的研究发现大黄酸(rhein)对tlr4/nf-κb通路有强大的抑制作用,但大黄酸的水溶性很差,限制了它的应用。以双苯丙氨酸(ff)为基础的多肽自组装由于其良好的生物相容性,廉价以及易于设计和制备等优点,在生命科学领域广泛应用。该体系的引入为解决大黄酸自身的限制提供了可能。同时为增强该多肽的抗氧化能力,我们引入了表没食子儿茶素没食子酸(egcg),最终得到目的化合物egcg@rh-gel。期望通过ros和tlr4的双重抑制作用,阻断活性氧-炎症循环,实现对心肌缺血再灌注损伤的治疗。
技术实现要素:
3.基于以上现有技术,本发明的目的在于提供了一种具备活性氧和炎症双重抑制作用的小分子水凝胶及其制备方法,其制备的小分子药物水凝胶,可以对缺血再灌注所造成的活性氧与炎症微环境的持续性改善,从而实现对缺血在灌注损伤的治疗。
4.为了实现以上目的,本发明采用的技术方案为:
5.一种具备活性氧和炎症双重抑制作用的小分子水凝胶及其制备方法,包括以下步骤:
6.步骤一、制备大黄酸-多肽化合物(rh-pep)和空载体-多肽化合物,其多肽序列为rhein-d
fdfg-ss-ergd/nap-d
fdfg-ss-ergd;
7.步骤二、将大黄酸-多肽化合物配制pbs溶液;
8.步骤三、将配制后的溶液和表没食子儿茶素没食子酸(egcg)溶液共混,在还原型谷胱甘肽的作用下共组装形成小分子药物水凝胶。
9.为了更好的实现本发明,进一步的,步骤一中制备大黄酸-多肽化合物和空载体-多肽化合物步骤为:
10.1)以碳酸氢钠,胱胺二盐酸盐,1,4-丁二酸酐,二氧六环、9-芴甲基-n-琥珀酰亚胺碳酸酯(fmoc-osu)为原料合成fmoc-ss;
11.2)以fmoc固相合成方法合成rhein-d
fdfg-ss-ergd和nap-d
fdfg-ss-ergd。
12.为了更好的实现本发明,进一步的,步骤一中大黄酸-多肽化合物结构式为:
[0013][0014]
空载体-多肽化合物化合物结构式为:
[0015][0016]
为了更好的实现本发明,进一步的,fmoc-ss的合成步骤为:
[0017]
(1)合成中间反应物1:按比例称取胱胺二盐酸盐和碳酸氢钠,其摩尔比为1:2~3,加入到250ml烧瓶中,加入两种物质20倍质量的水,室温搅拌至澄清,再加入1/5烧瓶体积的二氧六环后搅拌均匀,称取胱胺二盐酸盐等摩尔的1,4-丁二酸酐加入上述反应瓶中,室温反应8~12h,即得中间产物1。
[0018]
(2)合成fmoc-ss:中间产物1反应完全后,称取上述第一步中胱胺二盐酸盐等摩尔的9-芴甲基-n-琥珀酰亚胺碳酸酯(fmoc-osu)和碳酸氢钠;碳酸氢钠直接加入中间产物1的反应瓶中,fmoc-osu先在与上述第一步中体积相等的二氧六环中混合均匀,混合液用恒压滴液漏斗滴至上述反应瓶中,室温反应过夜。反应完成后,减压过滤反应液,保留滤液。用旋转蒸发仪浓缩滤液,将浓缩滤液用1m盐酸调ph至1~2,静置室温,白色固体物完全析出后,减压抽滤保留固体,冷冻干燥,即得fmoc-ss。
[0019]
为了更好的实现本发明,进一步的,fmoc固相合成步骤为
[0020]
1)称取二氯树脂(载量:1.4mmol/g)倒入干燥的固相管中,加入适量二氯甲烷(dcm),放摇床上30min,通氮气5min,使二氯树脂充分膨胀,压出二氯甲烷溶剂;
[0021]
2)根据固相管中二氯树脂容量,称取天冬氨酸asp(d)(fmoc-asp(tbu)-oh),加入等摩尔的dipea,用二氯甲烷溶解,混合,加入到固相反应器中,再往反应溶液等量的dipea,反应1~2h;
[0022]
3)反应结束后,压干反应液,使用二氯甲烷洗5遍,每次洗1min,然后加入封闭液反应15~30min以封闭树脂上的活性集团,压干反应液;其中封闭液为二氯甲烷、甲醇和dipea组成,配制体积比为dcm:meoh:diea=17~20:2:1。
[0023]
4)挤出封闭液,并用二氯甲烷洗5次,每次1min,再用n,n-二甲基甲酰胺(dmf)洗5次,每次1min;
[0024]
5)切掉fmoc保护基团:用20%的哌啶(溶剂为dmf),切割20~40min,脱除天冬氨酸上的保护基fmoc,使之裸露出氨基,压干反应液,用dmf洗5遍每次1min;
[0025]
6)称取下一个氨基酸甘氨酸gly(g)(fmoc-gly-oh)和等摩尔的hbtu于干燥的小瓶中,加入等摩尔的diea,用dmf溶解,超声助溶后,加入固相管反应2h,之后挤出溶液,并用dmf洗5次,1min/次;用20%的哌啶(溶剂为dmf),切割20~40min,脱除保护基fmoc,使之裸
露出氨基,压干反应液,用dmf洗5遍每次1min;
[0026]
7)重复上述步骤6),接着依次加入fmoc-arg(pbf)-oh,fmoc-glu(tbu)-oh,fmoc-ss,fmoc-gly-oh,fmoc-d
phe(tbu)-oh(d-构型),fmoc-d
phe(tbu)-oh(d-构型),以及最后的大黄酸。随着肽链的延长,反应难度也逐渐增加,因此,反应后续的氨基酸用量逐渐增加到第一个氨基酸用量的3~6倍以提高目的多肽的产率;
[0027]
8)反应完成后,用dmf洗5次,再用dcm洗5次,每次1min,配切割液适量,切割液为95%的是三氯乙酸tfa,配制成三异丙基硅烷tis和水的混合溶液,其体积分数为95%tfa:2.5%tis:2.5%h2o,切割1h后收集切割液。再用dcm洗3次,2min/次,并收集液体。
[0028]
9)收集的液体在旋转蒸发仪上旋干,加入适量无水乙醚,静置3-5min,可见白色沉淀析出,之后用高速离心机离心后去上清,白色沉淀进行冻干得粗产物,产物经高效液相色谱仪提纯后使用。
[0029]
为了更好的实现本发明,进一步的,步骤二中pbs溶液为磷酸二氢钠和磷酸氢二钠的混合磷酸盐溶液,配制为磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水定容至1000ml,溶液ph值为7.4。
[0030]
为了更好的实现本发明,进一步的,步骤二中配制的大黄酸-多肽化合物溶液浓度为每1000ml pbs溶液溶解rh-pep 10.0~15.0g。
[0031]
为了更好的实现本发明,进一步的,步骤三中共混时egcg和rh-pep用量的质量比为1:20~25。
[0032]
为了更好的实现本发明,进一步的,步骤三中水凝胶制备步骤为:
[0033]
1)将rh-pep,倒入成胶小瓶,并用pbs溶液溶解;
[0034]
2)用1mol/l的碳酸钠调ph至中性并加入的egcg;
[0035]
3)加入4eq的ph=7.4的gsh溶液;
[0036]
4)混合均匀后倒置即可形成稳定的水凝胶。
[0037]
有益效果
[0038]
本发明的有益效果如下:
[0039]
(1)通过本发明制备的小分子药物水凝胶,可以对缺血再灌注所造成的活性氧与炎症微环境的持续性改善,从而实现对缺血在灌注损伤的治疗。
[0040]
(2)通过本发明制备的小分子药物水凝胶,是将egcg和rh-pep进行共组装而成的水凝胶分子,在使用时有缓释效果,同时比单一使用rh-pep进行活性氧的清除和炎症微环境改善方面有很大的提升,从而增加机体损伤使用效果。
附图说明
[0041]
图1:实施例4中大黄酸-多肽以及egcg和大黄酸-多肽的成胶前后图片
[0042]
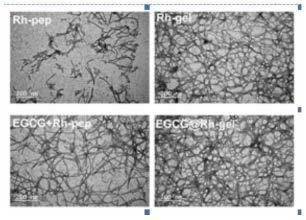
图2:实施例4中egcg和大黄酸-多肽的成胶透射电镜图
[0043]
图3:实施例4得到的大黄酸多肽水凝胶和egcg和大黄酸-多肽的共组装水凝胶对dpph自由基的清除能力测试
[0044]
图4:实施例4得到的大黄酸多肽水凝胶和egcg和大黄酸-多肽的共组装水凝胶对h9c2细胞缺氧复氧后细胞内活性氧水平荧光图
[0045]
图5:实施例4得到大黄酸多肽水凝胶和egcg和大黄酸-多肽的共组装水凝胶对
h9c2细胞缺氧复氧后细胞内炎症因子表达的qpcr检测
具体实施方式
[0046]
下面结合具体实施例对本发明作进一步详细说明,但所述实施例仅用于本发明而不是限制本发明。
[0047]
实施例1
[0048]
fmoc-ss的合成:
[0049]
(1)合成中间反应物1:按比例称取胱胺二盐酸盐和碳酸氢钠,其摩尔比为1:2~3,加入到250ml烧瓶中,加入两种物质20倍质量的水,室温搅拌至澄清,再加入1/5烧瓶体积的二氧六环后搅拌均匀,称取胱胺二盐酸盐等摩尔的1,4-丁二酸酐加入上述反应瓶中,室温反应8~12h,即得中间产物1。
[0050]
(2)合成fmoc-ss:中间产物1反应完全后,称取上述第一步中胱胺二盐酸盐等摩尔的9-芴甲基-n-琥珀酰亚胺碳酸酯(fmoc-osu)和碳酸氢钠;碳酸氢钠直接加入中间产物1的反应瓶中,fmoc-osu先在与上述第一步中体积相等的二氧六环中混合均匀,混合液用恒压滴液漏斗滴至上述反应瓶中,室温反应过夜。反应完成后,减压过滤反应液,保留滤液。用旋转蒸发仪浓缩滤液,将浓缩滤液用1m盐酸调ph至1~2,静置室温,白色固体物完全析出后,减压抽滤保留固体,冷冻干燥,即得fmoc-ss,称重为4.7g(10mmol),终产率为70%。
[0051]
实施例2
[0052]
多肽化合物rhein-d
fdfg-ss-ergd/nap-d
fdfg-ss-ergd的固相法合成:
[0053]
1)称取1g二氯树脂(载量:1.4mmol/g)倒入干燥的固相管中,加入适量二氯甲烷dcm,放摇床上30min,通氮气5min,使二氯树脂充分膨胀,压出dcm溶剂;
[0054]
2)称取天冬氨酸asp(d)(fmoc-asp(tbu)-oh)0.411g(1mmol),加入165μl(1mmol)dipea,用dcm溶解,混合,加入到固相反应器中,再往反应溶液中加入165μl(1mmol)dipea,反应2h;
[0055]
3)反应结束后,压干反应液,使用二氯甲烷洗5遍,每次洗1min,然后加入封闭液反应15min以封闭树脂上的活性集团,压干反应液;其中封闭液为二氯甲烷、甲醇和dipea组成,配制体积比为dcm:meoh:diea=17:2:1,配制封闭液10ml;
[0056]
4)挤出封闭液,并用二氯甲烷洗5次,每次1min,再用n,n-二甲基甲酰胺(dmf)洗5次,每次1min;
[0057]
5)切掉fmoc保护基团:用20%的哌啶(溶剂为dmf),切割30min,脱除天冬氨酸上的保护基fmoc,使之裸露出氨基,压干反应液,用dmf洗5遍每次1min;
[0058]
6)称取下一个氨基酸甘氨酸gly(g)(fmoc-gly-oh)0.298g(1mmol)和0.38g(1mmol)的hbtu于干燥的小瓶中,加入330μl(1mmol)的diea,用dmf溶解,超声助溶后,加入固相管反应2h,之后挤出溶液,并用dmf洗5次,1min/次;用20%的哌啶(溶剂为dmf),切割30min,脱除保护基fmoc,使之裸露出氨基,压干反应液,用dmf洗5遍每次1min;
[0059]
7)重复上述步骤6),接着依次加入fmoc-arg(pbf)-oh,fmoc-glu(tbu)-oh,fmoc-ss,fmoc-gly-oh,fmoc-phe(tbu)-oh(d-构型),fmoc-phe(tbu)-oh(d-构型),以及最后的大黄酸。随着肽链的延长,反应难度也逐渐增加,因此,反应后续的氨基酸用量逐渐增加,每次增加用量1.2倍;
[0060]
8)反应完成后,用dmf洗5次,再用dcm洗5次,每次1min,配切割液10ml,切割液为95%的是三氯乙酸tfa,配制成三异丙基硅烷tis和水的混合溶液,其体积分数为95%tfa:2.5%tis:2.5%h2o,切割1h后收集切割液。再用dcm洗3次,2min/次,并收集液体。
[0061]
9)收集的液体在旋转蒸发仪上旋干,加入20ml无水乙醚,静置5min,可见白色沉淀析出,之后用高速离心机离心后去上清,白色沉淀进行冻干得粗产物,产物经高效液相色谱仪提纯后使用。
[0062]
得到的粗产物为3.16g,纯度为61.7%,经液相色谱提纯后,得到纯品1.62g,收率83.08%。
[0063]
实施例3
[0064]
多肽化合物rhein-d
fdfg-ss-ergd/nap-d
fdfg-ss-ergd的固相法合成:
[0065]
1)称取2g二氯树脂(载量:1.4mmol/g)倒入干燥的固相管中,加入适量二氯甲烷dcm,放摇床上30min,通氮气5min,使二氯树脂充分膨胀,压出dcm溶剂;
[0066]
2)称取天冬氨酸asp(d)(fmoc-asp(tbu)-oh)0.411g(1mmol),加入165μl(1mmol)dipea,用dcm溶解,混合,加入到固相反应器中,再往反应溶液中加入165μl(1mmol)dipea,反应1h;
[0067]
3)反应结束后,压干反应液,使用二氯甲烷洗5遍,每次洗1min,然后加入封闭液反应15min以封闭树脂上的活性集团,压干反应液;其中封闭液为二氯甲烷、甲醇和dipea组成,配制体积比为dcm:meoh:diea=20:2:1,配制封闭液10ml;
[0068]
4)挤出封闭液,并用二氯甲烷洗5次,每次1min,再用n,n-二甲基甲酰胺(dmf)洗5次,每次1min;
[0069]
5)切掉fmoc保护基团:用20%的哌啶(溶剂为dmf),切割40min,脱除天冬氨酸上的保护基fmoc,使之裸露出氨基,压干反应液,用dmf洗5遍每次1min;
[0070]
6)称取下一个氨基酸甘氨酸gly(g)(fmoc-gly-oh)0.298g(1mmol)和0.38g(1mmol)的hbtu于干燥的小瓶中,加入330μl(1mmol)的diea,用dmf溶解,超声助溶后,加入固相管反应2h,之后挤出溶液,并用dmf洗5次,1min/次;用20%的哌啶(溶剂为dmf),切割40min,脱除保护基fmoc,使之裸露出氨基,压干反应液,用dmf洗5遍每次1min;
[0071]
7)重复上述步骤6),接着依次加入fmoc-arg(pbf)-oh,fmoc-glu(tbu)-oh,fmoc-ss,fmoc-gly-oh,fmoc-d
phe(tbu)-oh(d-构型),fmoc-d
phe(tbu)-oh(d-构型),以及最后的大黄酸。随着肽链的延长,反应难度也逐渐增加,因此,反应后续的氨基酸用量逐渐增加,每次增加用量1.1倍;
[0072]
8)反应完成后,用dmf洗5次,再用dcm洗5次,每次1min,配切割液10ml,切割液为95%的是三氯乙酸tfa,配制成三异丙基硅烷tis和水的混合溶液,其体积分数为95%tfa:2.5%tis:2.5%h2o,切割1h后收集切割液。再用dcm洗3次,2min/次,并收集液体。
[0073]
9)收集的液体在旋转蒸发仪上旋干,加入20ml无水乙醚,静置5min,可见白色沉淀析出,之后用高速离心机离心后去上清,白色沉淀进行冻干得粗产物,产物经高效液相色谱仪提纯后使用。
[0074]
得到的粗产物为3.48g,纯度为56.1%,经液相色谱提纯后,得到纯品1.54g,收率78.97%。
[0075]
实施例4
[0076]
配制浓度为1wt%的egcg和大黄酸多肽的共组装水凝胶,具体步骤如下:
[0077]
1)称取5mg rh-pep,倒入成胶小瓶,并用pbs溶解;
[0078]
2)用1mol/l碳酸钠调ph至中性并加入0.2mg的egcg;
[0079]
3)加入4eq的gsh溶液(ph=7.4),最后用pbs定容到400μl;
[0080]
4)之后通过小瓶倒置观察是否形成稳定的水凝胶,结果如图1所示。
[0081]
对实施4得到的水凝胶进行自由基及炎症清除测试,测试内容方法和结果如下:
[0082]
(一)dpph清除实验
[0083]
使用80%甲醇制备浓度为0.01mmol/l的dpph溶液。然后将20μl水凝胶与380μl dpph溶液共混,在黑暗中孵育60分钟。对照组为400μl dpph溶液。通过酶标仪检测溶液在400~600nm波长处的吸光度。
[0084]
水凝胶对dpph自由基的清除作用,计算公式如下:
[0085]
清除效果(%)=(a515nm control
–
a515nm hydrogel)/a515nm control
×
100%
[0086]
其结果如图3所示,相较于单纯的大黄酸多肽水凝胶,egcg与大黄酸多肽的共组装水凝胶的dphh的清除效率明显要高,达到了45%,而大黄酸多肽水凝胶只有7.6%,说明egcg的添加有效地提升了水凝胶的活性氧清除能力。
[0087]
(二)细胞的活性氧清除能力检测
[0088]
1)将h9c2细胞以细胞密度为2
×
105/孔,铺在24孔板中,全培养72小时;
[0089]
2)培养结束后复氧,并用pbs小心的吹洗3次。之后分别加入10μm的dhe和dcfh-da染色工作液,1ml/孔,避光,于37℃培养箱中培养30分钟;
[0090]
3)之后将工作液吸出,pbs洗3遍,之后再用hoechst染色液染核,500μl/孔,避光于培养箱中培养半小时;
[0091]
4)将hoechst染色液吸出,并用pbs吹洗3次,之后与荧光显微镜下观察,dhe显红色荧光,并与和重叠,其红色荧光越强代表细胞内超氧阴离子水平越高,活性氧水平也就越高。dcfh-da显绿色荧光,其荧光强度越强,表示总活性氧水平越高。
[0092]
结果如图4所示,egcg与大黄酸多肽的共组装水凝胶具有很强的超氧阴离子以及活性氧清除作用相较于大黄酸多肽的共组装水凝胶,这表明egcg的加入是必不可少的一环。
[0093]
(三)qpcr检测细胞内炎症因子表达水平的变化
[0094]
h9c2细胞铺板于6孔板,细胞密度达80%后行缺氧复氧处理,之后加入80μm的大黄酸多肽的共组装水凝胶,空载体水凝胶以及egcg与大黄酸多肽的共组装水凝胶处理48小时后,通过qpcr检测炎症因子的表达情况,其结果如图5所示,egcg与大黄酸多肽的共组装水凝胶组的炎症因子tnf-α、il-1β、il-6表达低于其他各组,表明共组装水凝胶具备优越的炎症抑制作用。
[0095]
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。