1.本发明属于炎症性肠病药物技术领域,具体涉及有机硅季铵盐在制备治疗炎症性肠病药物中的应用。
背景技术:
2.炎症性肠病(ibd)是一种肠道特异性炎症,主要包括克罗恩病(cd)与溃疡性结肠炎(uc)。随着工业化的发展与饮食逐渐西方化,炎症性肠病的发病率在我国逐年升高,成为了我国常见的消化系统疾病。其发病机制尚不明确,与免疫反应异常有关,遗传基因、肠道屏障受损等多种因素参与其发病过程,大多数炎症性肠病患者病情反复发作,迁延不愈。相比于正常人,炎症性肠病患者的肠道屏障受损,细菌易穿透黏液层直接与肠上皮接触并定植形成生物膜,造成肠道炎症,因此ibd患者肠粘膜中细菌生物膜的检出率较高。
3.目前,ibd尚无理想的治疗药物,因此寻找新的治疗药物刻不容缓。
技术实现要素:
4.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
5.本发明提供有机硅季铵盐在制备治疗炎症性肠病药物中的应用。
6.作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐包括有机硅单季铵盐和有机硅双季铵盐。
7.作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐的结构式为:
[0008][0009]
作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐的结构式为:
[0010][0011]
其中,r和r’为c
8-18
烷基,所述x-为阴离子。
[0012]
优选地,所述r和r’为c
12h25
,所述x-为cl-。
[0013]
作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐的结构式为:
[0014][0015]
其中,r和r’为c
8-18
烷基,所述x-为阴离子。
[0016]
优选地,所述r和r’为c
12h25
,所述x-为cl-。
[0017]
作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述炎症性肠病包括溃疡性结肠炎。
[0018]
作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐为体内给药。
[0019]
作为本发明所述的有机硅季铵盐在制备治疗炎症性肠病药物中的应用的一种优选方案:所述有机硅季铵盐以灌肠方式给药。
[0020]
本发明的有益效果:本发明研究发现,有机硅季铵盐能够改善溃炎性肠炎(uc),降低外周血中炎症因子的表达,同时对肠道屏障功能具有一定调节作用,有机硅季铵盐治疗后,有效改善肠道炎症,并且不会明显引起菌群组成的改变,为治疗人类溃疡性结肠炎(uc)提供了依据。
附图说明
[0021]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
[0022]
图1为dss诱导小鼠急性溃疡性结肠炎(uc)示意图。
[0023]
图2为实验期间小鼠肠道炎症的整体情况。
[0024]
图3为正常及造模组小鼠结肠组织结构变化。
[0025]
图4为juc对炎性细胞因子的影响。
[0026]
图5为各组小鼠结肠粘膜表面透射电镜图(1000
×
)。
[0027]
图6为小鼠粘液屏障功能评估。
[0028]
图7为小鼠肠道屏障功能的评估。
[0029]
图8为小鼠回盲部内容物16s rdna测序。
具体实施方式
[0030]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
[0031]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
[0032]
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
[0033]
实施例1:
[0034]
实验动物:spf级c57bl/6j雄性黑鼠50只,6-8周龄,体质量(22
±
4)g,许可证号scxk(浙)2019-0001。
[0035]
动物分组、造模及给药:小鼠饲养于恒温(20
±
2℃)、恒湿(45
±
5%)环境,5只/笼,2笼/组,12h光/黑暗循环标准实验鼠笼中,适应性饲养1周后开始造模。
[0036]
50只小鼠随机分为健康对照组10只和造模组40只。将造模组小鼠随机分为dss(葡聚糖硫酸钠) pbs组、dss juc(有机硅季铵盐)组、dss mtz组以及dss 5-asa组。参照cooper等的方法建立dss小鼠结肠炎模型,造模组小鼠连续自由饮用新鲜配置的3%葡聚糖硫酸钠(dss)7天,造成急性溃疡性结肠炎(ulcerative colitis,uc)模型,正常对照组小鼠自由饮用灭菌蒸馏水。实验过程如图1所示。造模第7天开始灌肠给药治疗,小鼠体重约25g,灌肠剂量200μm/只(0.008ml/g*day),每2天1次。造模组分别使用pbs、juc、mtz(1g/l)及5-asa灌肠,灌肠前小鼠需禁食12小时,每只小鼠腹腔注射10%水合氯醛溶液(5μm/只),5-10min后麻醉起效,每只灌肠200μm后拎尾倒立2分钟,再放回原笼位。实验期间,每天观察并记录小鼠体重变化、粪便性状和便血情况,进行疾病活动度评分,实验结束后(第12天)脱颈处死小鼠。摘除小鼠眼球取血,静置离心后取血清;取距肛门1cm处结肠组织4%多聚甲醛固定,用于后续he染色及免疫组化、免疫荧光;取距肛门1-2cm处结肠组织于电镜固定液中固定,用于后续电镜观察;余结肠组织储存于-80℃超低温冰箱保存。取小鼠盲肠的内容物,放入冻存管内在液氮中速冻,于-80℃超低温冰箱保存。每组随机选取6个样本送到基因公司进行肠道菌群多样性检测。
[0037]
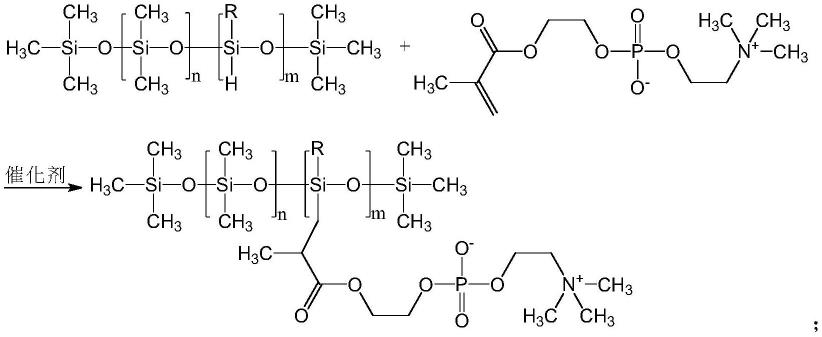
本实施例的有机硅季铵盐以下式结构为例(分子量412):
[0038][0039]
本发明有机硅季铵盐也可以采用下述结构式:
[0040][0041]
其中,r和r’为c
8-18
烷基,所述x-为阴离子。
[0042]
优选地,r和r’为c
12h25
,所述x-为cl-。
[0043]
或者:
[0044][0045]
其中,r和r’为c
8-18
烷基,所述x-为阴离子。
[0046]
优选地,r和r’为c
12h25
,所述x-为cl-。
[0047]
实施例2:
[0048]
实验方法:
[0049]
血清的采集及检测:摘除眼球取血,静置30分钟后离心机4000rpm离心10分钟,分离血清后分装,放入-20℃冰箱保存,用于后续炎症因子的检测。
[0050]
结肠组织的采集及he染色:打开小鼠腹腔后分离结肠组织,观察结肠的大体形态并测量结肠的长度。取距肛门1cm处结肠组织4%多聚甲醛固定,用于后续he染色及免疫组化、免疫荧光;余结肠组织储存于-80℃超低温冰箱保存备用。多聚甲醛固定后的结肠组织进行常规石蜡包埋,切片,石蜡切片。切片加入苏木素染液3-5min,水洗返蓝后流水冲洗。切片依次放入85%,95%的梯度酒精脱水,加入伊红染液中染色后脱水封片。在光学显微镜下观察组织学情况,并进行病理评分。(判断标准见表1)每个组织切片随机选取3个以上高倍
视野(
×
200),由2人进行盲法评分,取平均值作为最终结果,评分标准见表1。
[0051]
表1组织学损伤评分标准
[0052][0053]
结肠组织炎症因子免疫组化:4%多聚甲醛固定后的结肠组织进行常规石蜡包埋,切片,石蜡切片。经二甲苯和梯度乙醇脱蜡后使用柠檬酸钠修复液,用烤箱加热,对其进行抗原热修复,3%的过氧化氢封闭内源性过氧化物酶,山羊血清封闭非特异性抗原,加ⅰ抗4℃过夜后加入辣根过氧化物酶标记的ⅱ抗,之后经dab显色、苏木素复染、流水返蓝、梯度乙醇溶液和二甲苯脱水,盖玻片封片。显微镜镜检。
[0054]
结肠ab-pas染色:切片脱蜡后蒸馏水洗2min,加入阿利新蓝染液染色10-20min后水洗,加入碘酸溶液氧化5min,schiff试剂浸染10-20min后冲洗。苏木素染核后用酸性和分化液分化,水洗返蓝。经梯度乙醇脱水后封片剂。
[0055]
肠道屏障相关蛋白免疫荧光:结肠组织冰冻切片,在-20℃乙醇中固定20min,加入自发荧光淬灭剂5min,牛血清蛋白孵育30min;切片在4℃下的一抗中温育过夜,避光室温下荧光二抗(hrp-山羊抗兔抗体)孵育50min;加dapi染液复染洗细胞核,避光室温孵育10min,pbs洗涤后用抗荧光淬灭封片剂封片,使用荧光显微镜分析。
[0056]
电镜观察肠黏膜:取距肛门1-2cm处结肠组织,组织体积一般不超过1mm
×
1mm
×
1mm,迅速投入电镜固定液4℃固定2-4小时,于电镜固定液中4℃固定2-4h,0.1m磷酸缓冲液pb(ph 7.4)固定后漂洗,梯度酒精及丙酮脱水后渗透过夜,包埋切片后铀铅双染色后干燥、电镜下观察,采集图像分析。
[0057]
16srdna测序:采用dna抽提试剂盒对小鼠盲肠内容物的基因组dna进行提取,之后利用琼脂糖凝胶电泳检测dna的纯度和浓度。以稀释后的基因组dna为模板,使用细菌16srrna(v3-v4)区域引物,前引物为343-5
’‑
tacggraggcagcag-3’,后引物为798r-5
’‑
aggg-tatctaatcct-3’进行pcr扩增和纯化。根据序列比对采用pynast软件对otus代表序列进行系统进化关系的构建。测序数据进行预处理生成优质序列后,根据序列的相似性将序
列归为多个可操作分类单元(operational taxonomic units,otus)。参数为序列相似度大于或等于97%被归为一个otu单元。用qiime软件包挑选出各个otu的代表序列,并将所有代表序列与greengenes数据库进行对比注释。最终对数据信息进行alpha多样性,beta多样性,菌群分类学组成及16s功能基因预测分析等一系列的综合性分析及处理。
[0058]
统计学分析:采用imagej进行细胞计数分析。采用graphpad prism进行统计分析与图表绘制,小鼠体重,结肠长度,炎症因子水平多组间均值比较进行单因素方差分析,tukey检验比较两两组间差异,疾病活动性评分及病理学评分采用student-t检验比较两组间均值差异,p<0.05为有显著性差异。
[0059]
实施例3:
[0060]
实验结果:
[0061]
juc对dss诱导的uc的影响:诱导dss第3天,小鼠体重下降,粪便潜血强阳性。第5天出现明显血便,dai评分显著升高(p《0.01)。juc、mtz及5-asa治疗后,小鼠体重减轻及肠道挛缩得到明显改善,dai评分降低。uc组结肠组织损伤严重,肠黏膜脱落坏死,可见炎性细胞广泛浸润,典型隐窝脓肿形成。juc灌肠治疗后可降低uc的组织学评分,为juc作为uc的有效治疗提供证据。
[0062]
图2为实验期间小鼠肠道炎症的整体情况。(a):各组小鼠体重变化趋势;(b):各组小鼠疾病活动度评分变化趋势;(c):结肠长度比较;(d):正常与造模组小鼠的结肠肉眼观;*p<0.05,**p《0.01,****p《0.0001,均为与dss pbs组比较。图3为正常及造模组小鼠结肠组织结构变化。(a):正常小鼠与肠炎小鼠结肠组织he染色图;(b):组织学损伤评分对比,***p《0.001。
[0063]
juc对炎性细胞因子的影响:uc患者中主要的促炎细胞因子包括il-6、il-1β和tnf-α。为了探讨juc对炎症的影响,我们测量了血清中这三种炎症因子的水平,并对结肠末端组织切片进行免疫组化分析(图4)。uc模型组这三种细胞因子均显著高于对照组,juc处理后显著低于对照组。图4为正常组小鼠与溃疡性结肠炎小鼠的炎症评估。(a):各组小鼠外周血中il-6的表达量;(b):各组小鼠外周血中tnf-α的表达量;(c):各组小鼠外周血中il-1β的表达量;(d):各组小鼠末端结肠炎症因子的免疫组化(200
×
)。
[0064]
有机硅季铵盐对肠道屏障功能的影响:粘蛋白是由上皮细胞产生的一种高分子量糖蛋白,它在肠内形成粘液屏障,以保护肠腔。与对照组相比,uc组杯状细胞明显减少。紧密连接(tjs)是粘膜屏障的重要组成部分,可以防止有害物质泄漏出肠腔。为了确定探索juc对肠道屏障功能的影响,我们采用ab-pas染色观察杯状细胞、免疫荧光分析tj蛋白水平及透射电镜观察上皮细胞间紧密连接的变化。如图5-7所示,uc模型组zo-1和occludin的表达较对照组低,表明肠道屏障功能受损,而juc处理后zo-1和occludin的表达增高。dss诱导uc后,透射电镜可见异常的细胞间连接,包括顶端连接复合物和细胞旁间隙的扩张。同时镜下可见黏液层受损变薄,肠黏膜表面绒毛稀疏,juc治疗后阻止了这些异常紧密的细胞间连接。图5为各组小鼠结肠粘膜表面透射电镜图(1000
×
)。图6为小鼠粘液屏障功能评估。(a):小鼠结肠组织ab-pas染色(200
×
);(b):杯状细胞计数。图7为小鼠肠道屏障功能的评估。(a):各组小鼠结肠粘蛋白muc2免疫荧光;(b):各组小鼠结肠屏障相关蛋白免疫荧光(200
×
)。
[0065]
juc对肠道菌群的影响:为确定juc是否影响肠道菌群组成,对小鼠盲肠内容物进
行16s rdna测序,并对每组6个样本进行分析,获得otu数据,利用维恩图的方式呈现。5组共检测到926个otus,对照组独有227个otus,dss pbs组61个otus,dss juc组130个otus,dss mtz组111个otus,dss 5-asa组93个otus。群落结构直方图显示,uc组细菌多样性下降,梭状芽胞杆菌丰度增加。dss juc组与dss pbs组的群落结构差异无统计学意义。alpha多样性可以用来评估物种的丰富度和分布均匀度。α多样性相关小提琴图可以分析组内样本分散程度以及不同组别间多样性的差异,dss组多样性明显降低,治疗后多样性增加。beta多样性主要是基于otu序列相似性或群落结构来比较群体之间的差异。采用主坐标分析法和热图法研究小鼠肠道菌群多样性。与对照组小鼠的细菌群落相比,dss组小鼠的细菌群落具有明显的分离性。有趣的是,juc、mtz或5-asa治疗后的beta多样性在治疗组和对照组之间是中间的。从不同物种属水平的热图可以看出,对照组中roseburia和butyriamonas等益生菌的丰度较高。uc组益生菌的丰度降低,bacteroides、dorea和厌氧菌的丰度较高,juc处理后厌氧菌的丰度降低。图8为各组小鼠回盲部内容物16s rdna测序。(a):otu比较韦恩图;(b):rank-abundance曲线(c):α多样性相关小提琴图;(d):各组群落结构柱状图;(e):热图。
[0066]
综上,炎症性肠病(ibd)的发病机制尚不明确,与免疫反应异常有关,遗传基因、肠道屏障受损等多种因素参与其发病过程,大多数炎症性肠病患者病情反复发作,迁延不愈,溃炎性肠炎(uc)目前尚无彻底治愈的方法,指南推荐使用的治疗药物旨在诱导和维持临床缓解,促进结肠粘膜愈合,避免病程中进一步手术干预。本发明研究发现,有机硅季铵盐能够改善溃炎性肠炎(uc),降低外周血中炎症因子的表达,同时对肠道屏障功能具有一定调节作用。有机硅季铵盐治疗后,有效改善肠道炎症,并且不会明显引起菌群组成的改变,为治疗人类溃疡性结肠炎(uc)提供了依据。
[0067]
实施例4:
[0068]
毒理实验:检测依据:参照卫生部(2002年版)《消毒技术规范》,第二部分,2.3.1急性经口毒性试验。
[0069]
试验方法:—次最人限度试验。设计剂量为50oomg/kg b.wt.,称取样品50oomg加纯净水至20ml配制成受试物。小鼠禁食过夜后,经口一次灌胃给予,灌胃容量为20ml/kg b.wt.。灌胃后4h给食,观察期14d。
[0070]
小鼠灌胃后未见明显中毒表现,观察期内无动物死亡,大体解剖未见明显异常。试验动物死亡结果见下表:
[0071]
小鼠急性经口毒性试验结果
[0072][0073]
结论:样品对雌雄小鼠急性经口ld
50
值均大于50oomg/kg b.wt.,属实际无毒级
[0074]
急性眼刺激实验:检测依据:参照卫生部(2002年版)《消毒技术规范》,第二部分2,3.4急性眼刺激试验。
[0075]
试验方法:取受试物0.1ml直接滴入家兔一侧眼结膜囊内,被动闭合眼睑4s,30s后用生理盐水冲洗,另一侧眼滴以生理盐水作为对照。于滴眼后1h、24h、48h、72h、4d、7d观察记录眼刺激反应
[0076]
受试物对家兔急性眼刺激试验结果(30sec冲洗)
[0077]
受试物对家兔急性眼刺激试验结果 (30sec冲洗)
[0078][0079]
平均评分即每只动物的24h、48h、72h评分之和除以观察数3。
[0080][0081]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。