1.本公开属于前列腺癌智能辅助诊断技术领域,尤其涉及一种前列腺图像分割方法及前列腺癌智能辅助诊断系统。
背景技术:
2.本部分的陈述仅仅是提供了与本公开相关的背景技术信息,不必然构成在先技术。
3.目前临床上对前列腺癌的主要筛查手段是血清前列腺特异性抗原检测和直肠指诊检查。然而,血清前列腺特异性抗原的测试水平在实际检测中受到多种因素的影响,比如对前列腺癌患者进行直肠指检、留置导尿管、前列腺炎、性生活以及使用非那雄胺等多种药物,因此在临床上单独应用血清前列腺癌特异性抗原的检测在预估前列腺癌的检出率方面存在着相当大的误差和临床漏诊的情况。直肠指检的操作虽然简单易行且属于无创检查,但是该项操作主要是通过主观做出判断,而且在探查的过程中只能探查到贴近前列腺后包膜的肿瘤,因此,在前列腺癌的诊断中,直肠指检在临床上检测前列腺癌同样具有相当大的局限性。
4.同时,由于前列腺癌mpmri有大量的影像数据,诊断过程均需要医生手动标识,耗费大量时间以及劳动力;此外,人工诊断结果存在主观性,往往受限于医生的经验而出现误诊的情况。
技术实现要素:
5.本公开为了解决上述问题,提供了一种前列腺图像分割方法及前列腺癌智能辅助诊断系统,所述方案通过利用多模态mpmri医疗影像数据对前列腺癌区域进行精准判断,首先,通过区域分类方法进行mpmri图像分割,再通过轻量级卷积神经网络识别前列腺癌病灶,并采用进化算法优化卷积神经网络性能,一方面基于所述分割方法有效提高了图像分割的准确性;另一方面,通过所述诊断系统有效提高了临床前列腺癌辅助诊断的精确性。
6.根据本公开实施例的第一个方面,提供了一种前列腺图像分割方法,包括:
7.获取待分割的前列腺mpmri图像序列;
8.基于预先训练的特征提取网络模型,分别提取不同序列mri图像的若干不同层级特征图,并基于串联方式构成串联特征图;
9.基于获得的串联特征图及注意力机制,对所述串联特征图的特征通道权重进行重新标定,获得融合mpmri图像有效信息的融合特征图;
10.基于所述融合特征图,通过区域建议网络及区域特征聚集网络获得候选区域特征图;
11.基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果。
12.进一步的,基于获得的串联特征图及注意力机制,对所述串联特征图的特征通道
权重进行重新标定,具体为:
13.所述注意力机制采用se模块,通过所述se模块分别对每个串联特征图的不同特征通道进行相关性建模,标定不同特征通道权重;基于全局池化层,将不同特征通道的空间信息压缩为一个通道描述子;利用全连接层和relu层对不同特征通道间的相互依赖性进行建模,通过sigmoid激活函数获得不同特征通道的权重;通过尺度化操作,将得到的权重与特征通道相乘,重新标定特征通道权重,获得融合特征图。
14.进一步的,所述基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果;具体为:
15.对于获得的候选区域特征图,利用边框回归算法对候选区域进行修正;基于区域分类分支网络获得候选区域所包含检测目标的类别及概率,并通过预先训练的图像分割网络获得候选区域内检测目标的分割结果。
16.进一步的,所述通过区域建议网络及区域特征聚集网络获得候选区域特征图,具体为:基于所述融合特征图,通过rpn网络获得候选区域,并基于roialign方法获得候选区域特征图。
17.进一步的,所述不同序列包括adc图像和tw2图像;
18.或,
19.所述特征提取网络模型采用并行的两个se-resnet网络;
20.或,
21.对于获得的候选区域特征图,基于边框回归算法对候选区域进行修正,并输出候选区域包含的检测目标类别及概率值。
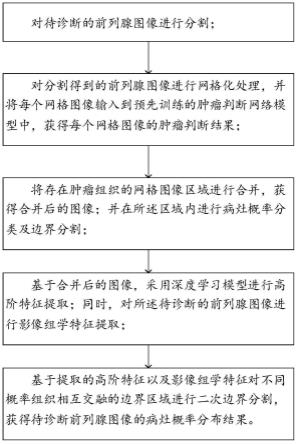
22.根据本公开实施例的第二个方面,提供了一种前列腺癌智能辅助诊断系统,包括:
23.对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
24.对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
25.将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
26.基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
27.基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
28.进一步的,所述对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,具体为:将分割得到的前列腺图像划分为大小为g*g网格,采用g/2为步长在网格图像中进行遍历,将每次遍历结果输入到所述肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果。
29.进一步的,所述肿瘤判断模型采用locnet网络模型;
30.或
31.所述基于合并后的图像,采用深度学习模型进行高阶特征提取,具体采用cnn网络模型。
32.进一步的,对于所述深度学习模型的训练过程,基于进化算法对其网络参数及结构进行优化。
33.根据本公开实施例的第三个方面,提供了一种电子设备,包括存储器、处理器及存储在存储器上运行的计算机程序,所述处理器执行所述程序时实现如下步骤:
34.对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
35.对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
36.将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
37.基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
38.基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
39.根据本公开实施例的第四个方面,提供了一种非暂态计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如下步骤:
40.对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
41.对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
42.将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
43.基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
44.基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
45.与现有技术相比,本公开的有益效果是:
46.(1)本公开所述方案提供了一种前列腺图像分割方法及前列腺癌智能辅助诊断系统;所述方案通过利用多模态mpmri医疗影像数据对前列腺癌区域进行精准判断,首先,通过区域分类方法进行mpmri图像分割,再通过轻量级卷积神经网络识别前列腺癌病灶,并采用进化算法优化卷积神经网络性能,一方面基于所述分割方法有效提高了图像分割的准确性;另一方面,通过所述诊断系统有效提高了临床前列腺癌辅助诊断的精确性。
47.(2)基于本公开所述方案,能够有效实现前列腺mpmri标准化高效阅片,完成图像数据预处理,实现前列腺疑似结节识别和标记,优化神经网络分类性能,提高前列腺癌诊断准确率,最终提高mpmri在前列腺癌诊断过程中的辅助价值;有效克服了传统mpmri阅片仅仅依靠影像学医生经验的局限性,能够对多参数磁共振成像阅片形成统一的标准,提高阅片的效率和前列腺癌诊断的准确性。
48.本公开附加方面的优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本公开的实践了解到。
附图说明
49.构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
50.图1为本公开实施例中所述的一种前列腺图像分割方法流程图;
51.图2为本公开实施例中所述的一种前列腺癌智能辅助诊断系统的工作流程图;
52.图3为本公开实施例中所述的se-block结构图;
53.图4为本公开实施例中所述的图像分割网络模型结构示意图;
54.图5为本公开实施例中所述的locnet模型结构;
55.图6为本公开实施例中所述的ecnn网络结构;
56.图7(a)为本公开实施例中所述的resnet模块结构示意图;
57.图7(b)为本公开实施例中所述的进化算法流程。
具体实施方式
58.下面结合附图与实施例对本公开做进一步说明。
59.应该指出,以下详细说明都是例示性的,旨在对本公开提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本公开所属技术领域的普通技术人员通常理解的相同含义。
60.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
61.在不冲突的情况下,本公开中的实施例及实施例中的特征可以相互组合。
62.实施例一:
63.本实施例的目的是提供一种前列腺图像分割方法。
64.如图1所示,提供了一种前列腺图像分割方法,包括:
65.获取待分割的前列腺mpmri图像序列;
66.基于预先训练的特征提取网络模型,分别提取不同序列mri图像的若干不同层级特征图,并基于串联方式构成串联特征图;
67.基于获得的串联特征图及注意力机制,对所述串联特征图的特征通道权重进行重新标定,获得融合mpmri图像有效信息的融合特征图;
68.基于所述融合特征图,通过区域建议网络及区域特征聚集网络获得候选区域特征图;
69.基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果。
70.进一步的,基于获得的串联特征图及注意力机制,对所述串联特征图的特征通道权重进行重新标定,具体为:
71.所述注意力机制采用se(squeeze-and-excitation:通道注意力机制)模块,通过所述se模块分别对每个串联特征图的不同特征通道进行相关性建模,标定不同特征通道权重;基于全局池化层,将不同特征通道的空间信息压缩为一个通道描述子;利用全连接层和
relu层对不同特征通道间的相互依赖性进行建模,通过sigmoid激活函数获得不同特征通道的权重;通过尺度化操作,将得到的权重与特征通道相乘,重新标定特征通道权重,获得融合特征图。
72.进一步的,所述基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果;具体为:
73.对于获得的候选区域特征图,利用边框回归算法对候选区域进行修正;基于区域分类分支网络获得候选区域所包含检测目标的类别及概率,并通过预先训练的图像分割网络获得候选区域内检测目标的分割结果。
74.进一步的,所述通过区域建议网络及区域特征聚集网络获得候选区域特征图,具体为:基于所述融合特征图,通过rpn网络获得候选区域,并基于roialign方法获得候选区域特征图。
75.进一步的,所述不同序列包括adc图像和tw2图像;
76.或,
77.所述特征提取网络模型采用并行的两个se-resnet网络;
78.或,
79.对于获得的候选区域特征图,基于边框回归算法对候选区域进行修正,并输出候选区域包含的检测目标类别及概率值。
80.具体的,为了便于理解,以下结合附图对本实施例所述方案进行详细说明:
81.为了解决现有技术存在的问题,本实施例提供了一种基于区域分类的前列腺mpmri图像分割方法,包括:
82.s1:提取不同序列mri图像的3个层级特征,通过串联的方式构成串联特征;
83.s2:对每个串联特征不同特征通道间的相关性建模,自动标定不同特征通道权重;
84.s3:使用全局池化层,将不同特征通道的空间信息压缩为一个通道描述子。
85.s4:提升有用的特征通道,抑制无关的特征通道,得到融合了mp-mri有效信息的融合特征。
86.s5:使用基于非极大值的图像清洗方法,抑制去除前列腺边缘可能性较小的候选区域,得到最终的候选区域和精确的前列腺分割结果。
87.进一步的,所述方案基于区域分类的前列腺mpmri图像分割方法技术路线,从mpmri信息融合、特征提取和图像清洗三个方面实现图像的精确分割,具体的:
88.mpmri信息融合步骤:使用并行的2个se-resnet网络,分别提取不同序列mri图像的3个层级特征图,通过串联的方式构成串联特征图。使用se-block分别对每个串联特征图不同特征通道间的相关性建模,自动标定不同特征通道权重。在se-block中,使用全局池化层,将不同特征通道的空间信息压缩为一个通道描述子;使用2个全连接层和1个relu层对不同特征通道间的相互依赖性进行建模,通过sigmoid激活函数得到不同特征通道的权重。通过尺度化操作,将得到的权重与特征通道相乘,重新标定特征通道权重,提升有用的特征通道,抑制无关的特征通道,得到融合了mp-mri有效信息的融合特征图。
89.特征提取步骤:由特征提取网络提取输入图像特征图,由rpn(region proposal network)给出特征图上的候选区域。通过roialign层得到候选区域特征图。候选区域特征图被输入到头网络中,由头网络中的边框回归算法对候选区域进行修正;由区域分类分支
网络给出候选区域包含检测目标的类别及可能性;由分割网络给出候选区域内检测目标的分割结果。
90.图像清洗步骤:使用基于非极大值的图像清洗方法,抑制去除前列腺边缘可能性较小的候选区域,得到最终的候选区域和精确的前列腺分割结果。
91.其中,如图3所示,为本实施例中所述的se-block结构图;如图4所示,为本实施例中所述的图像分割网络模型结构示意图。
92.实施例二:
93.本实施例的目的是提供一种前列腺癌智能辅助诊断系统。
94.如图2所示,提供了一种前列腺癌智能辅助诊断系统,包括:
95.对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
96.对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
97.将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
98.基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
99.基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
100.进一步的,所述对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,具体为:将分割得到的前列腺图像划分为大小为g*g网格,采用g/2为步长在网格图像中进行遍历,将每次遍历结果输入到所述肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果。
101.进一步的,所述肿瘤判断模型采用locnet网络模型;
102.或
103.所述基于合并后的图像,采用深度学习模型进行高阶特征提取,具体采用cnn网络模型。
104.进一步的,对于所述深度学习模型的训练过程,基于进化算法对其网络参数及结构进行优化。
105.具体的,为了便于理解,以下结合附图对本实施例所述方案进行详细说明:
106.为了解决现有技术中存在的问题,本实施例提供了一种基于轻量级卷积神经网络的前列腺癌识别方法,包括:
107.s1:采用g/2为步长在网格图像中进行遍历,将每次的遍历结果输入locnet;
108.s2:进行病灶概率分类及边界分割;
109.s3:对mpmri图像进行影像组学特征提取,再通过特征选择产生新的特征集;
110.s4:确定像素点的归属,完成对边界较为模糊的组织间进行分类和概率边界分割,并且根据分割的边界完成概率地图的绘制;
111.进一步的,基于cnn方法具有更高的计算效率,而基于集成学习方法则具有更佳的模糊分类性能。因此,将基于轻量级卷积神经网络,融合cnn和集成学习方法,从图像识别和
特征融合两个方面实现mpmri医学影像的前列腺癌识别,具体的:
112.首先,为了提高肿瘤检测及定位速度,对图像分割所得的前列腺mpmri图像进行网格化处理,将图像划分为大小为g*g的网格。采用g/2为步长在网格图像中进行遍历,将每次的遍历结果输入locnet,则输入locnet的子图集合可表示为
113.pi={p
(i,1)
,p
(i,2)
,
…
,p
(i,n)
,i∈1,2,
…
,n}
114.其中,每个子图的大小均为g*g,n为输入locnet的子图集合数量。
115.其次,将pi输入locnet计算并输出其所属类别cl。cl为1表示存在前列腺肿瘤组织,否则为0。在检测过程中采用与mpmri图像网格化结构相同的矩阵mask记录每个pi的标记信息,具体表示为:
[0116][0117]
其中,loc(pi)表示locnet对pi进行分类的结果。在mask记录的基础上,对标记为1的网格区域进行合并,并在该区域内进行病灶概率分类及边界分割。其中,所述概率分类及边界分割具体采用如下方案:通过区域建议网络及区域特征提取网络获得候选区域特征图,基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果;基于获得的串联特征图及注意力机制,对所述串联特征图的特征通道权重进行重新标定,基于获得的候选区域特征图,通过预先训练的图像分割网络获得候选区域内检测目标的分割结果。利用边框回归算法对候选区域进行修正;基于区域分类分支网络获得候选区域所包含检测目标的类别及概率,并通过预先训练的图像分割网络获得候选区域内检测目标的分割结果;上述步骤的具体细节在实施例一种已经进行了详细描述,故此处不再赘述。
[0118]
最后,对mpmri图像进行影像组学特征提取,提取的影像特征记为f1,f2,...,fn。将以上图像通过cnn特征提取器完成mr图像的高阶特征提取,特征记为fcnn。将以上影像组学特征和cnn特征形成特征集f,再通过特征选择,采用l1正则化lasso对f进行特征处理,产生新的特征集f`。针对不同概率组织相互交融的边界区域,确定像素点的归属,完成对边界较为模糊的组织间进行分类和概率边界分割,并且根据分割的边界完成概率地图的绘制。
[0119]
进一步的,本实施例中涉及深度学习模型的利用,故涉及深度学习模型参数和结构的优化,本实施例采用如下方案:
[0120]
s1:通过ecnn(evolutionary convolutional neural network)算法对学习率与网络结构进行编码以创建初始染色体群,网络结构信息包括2d卷积层完全连接层,resnet模块及各层中的激活函数、滤波器数目、滤波器尺寸、步长和丢失率等有关信息。
[0121]
s2:对于编码的初始染色体,通过随机改变染色体的学习率或神经网络结构实现变异操作。对学习率执行变异操作时,学习率在一定范围内随机生成;对网络结构执行变异操作时,通过添加、删除、替换层或resnet模块与随机选择层属性信息来实现。其中,网络层从2d卷积层、全连接层、池化层中随机选择,层中的激活函数、滤波器数目、滤波器尺寸、步长、丢失率等层属性信息均通过随机选择生成。由于变异操作的随机性可能导致无效神经网络结构的产生,因此,每次应用变异操作之后,都会执行适应度评估以保证所得到网络结构的有效性。如果变异生成适应度低的无效结构,则舍弃适应度最低个体且再次执行变异
操作,在第三代中选择适应度最高的有效结构作为最优网络模型。
[0122]
s3:通过适应度函数计算来评估染色体对环境适应性好或差的数值。选择操作通常基于概率进行选择,其中具有更高适应度值的个体被选择的概率更高,以此来保证后代种群的总体质量逐代提高。适应度函数的选择直接影响着寻找最优网络模型的收敛速度,因此采用ecnn网络的准确率作为适应度函数以保证选择时的精确性。
[0123]
进一步的,如图5所示,为本实施例中所述的locnet模型结构示意图;如图6所示,为本实施例中所述的ecnn网络结构示意图;如图7(a)所示,为实施例中所述的resnet模块结构示意图;如图7(b)为本实施例中所述的进化算法流程示意图。
[0124]
实施例三:
[0125]
本实施例的目的是提供一种电子设备。
[0126]
一种电子设备,包括存储器、处理器及存储在存储器上运行的计算机程序,所述处理器执行所述程序时实现如下步骤:
[0127]
对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
[0128]
对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
[0129]
将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
[0130]
基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
[0131]
基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
[0132]
实施例四:
[0133]
本实施例的目的是提供一种非暂态计算机可读存储介质。
[0134]
一种非暂态计算机可读存储介质,其上存储有计算机程序,该程序被处理器执行时实现如下步骤:
[0135]
对待诊断的前列腺图像进行分割,其中,所述分割方法采用上述的一种前列腺图像分割方法;
[0136]
对分割得到的前列腺图像进行网格化处理,并将每个网格图像输入到预先训练的肿瘤判断网络模型中,获得每个网格图像的肿瘤判断结果;
[0137]
将存在肿瘤组织的网格图像区域进行合并,获得合并后的图像;并在所述区域内进行病灶概率分类及边界分割;
[0138]
基于合并后的图像,采用深度学习模型进行高阶特征提取;同时,对所述待诊断的前列腺图像进行影像组学特征提取;
[0139]
基于提取的高阶特征以及影像组学特征对不同概率组织相互交融的边界区域进行二次边界分割,获得待诊断前列腺图像的病灶概率分布结果。
[0140]
在更多实施例中,还提供:
[0141]
一种电子设备,包括存储器和处理器以及存储在存储器上并在处理器上运行的计算机指令,所述计算机指令被处理器运行时,完成实施例一中所述的方法。为了简洁,在此
不再赘述。
[0142]
应理解,本实施例中,处理器可以是中央处理单元cpu,处理器还可以是其他通用处理器、数字信号处理器dsp、专用集成电路asic,现成可编程门阵列fpga或者其他可编程逻辑器件、分立门或者晶体管逻辑器件、分立硬件组件等。通用处理器可以是微处理器或者该处理器也可以是任何常规的处理器等。
[0143]
存储器可以包括只读存储器和随机存取存储器,并向处理器提供指令和数据、存储器的一部分还可以包括非易失性随机存储器。例如,存储器还可以存储设备类型的信息。
[0144]
一种计算机可读存储介质,用于存储计算机指令,所述计算机指令被处理器执行时,完成实施例一中所述的方法。
[0145]
实施例一中的方法可以直接体现为硬件处理器执行完成,或者用处理器中的硬件及软件模块组合执行完成。软件模块可以位于随机存储器、闪存、只读存储器、可编程只读存储器或者电可擦写可编程存储器、寄存器等本领域成熟的存储介质中。该存储介质位于存储器,处理器读取存储器中的信息,结合其硬件完成上述方法的步骤。为避免重复,这里不再详细描述。
[0146]
本领域普通技术人员可以意识到,结合本实施例描述的各示例的单元即算法步骤,能够以电子硬件或者计算机软件和电子硬件的结合来实现。这些功能究竟以硬件还是软件方式来执行,取决于技术方案的特定应用和设计约束条件。专业技术人员可以对每个特定的应用来使用不同方法来实现所描述的功能,但是这种实现不应认为超出本公开的范围。
[0147]
上述实施例提供的一种前列腺图像分割方法及前列腺癌智能辅助诊断系统可以实现,具有广阔的应用前景。
[0148]
以上所述仅为本公开的优选实施例而已,并不用于限制本公开,对于本领域的技术人员来说,本公开可以有各种更改和变化。凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。