1.本技术大体涉及医学免疫学检测领域;具体而言,本技术提供了个体中新冠病毒(covid-19)引发的抗体检测的方法和工具。
背景技术:
2.对于新冠病毒感染的检测目前最普遍的是核酸检测法,但是由于多种因素(例如个体鼻拭子取样中病毒颗粒数量的差异、核酸降解或实验室处理过程中pcr反应的糖抑制),基于qpcr的核酸检测可能会出现假阴性。因此,抗体测试是新冠病毒感染检测的一种重要补充手段。
3.发明概述
4.第一方面,本技术提供了用于检测个体中新冠病毒(covid-19)感染引发的抗体的胶体金试纸条,其包含上样区、胶体金标记区、检测区和吸水区,其中所述胶体金标记区包含带有胶体金标记的新冠病毒s蛋白的受体结合区域抗原、新冠病毒n蛋白抗原和抗鸡igy抗体。
5.在一些实施方案中,新冠病毒s蛋白的受体结合区域抗原包含seq id no:1所示的氨基酸序列。
6.在一些实施方案中,新冠病毒n蛋白抗原包含seq id no:2所示的氨基酸序列。
7.在一些实施方案中,按照摩尔比,新冠病毒s蛋白的受体结合区域抗原与新冠病毒n蛋白抗原的比例为2:1至1:1。
8.在一些实施方案中,抗鸡igy抗体为山羊、绵羊、小鼠、大鼠、兔、人、豚鼠、猪、马或牛来源的抗鸡igy抗体。
9.在一些实施方案中,抗鸡igy抗体的质量与所述新冠病毒s蛋白的受体结合区域抗原与所述新冠病毒n蛋白抗原质量之和的比例为1:2至2:1。
10.在一些实施方案中,胶体金标记区还包含封闭剂。在一些具体实施方案中,封闭剂为牛血清白蛋白(bsa)。
11.在一些实施方案中,检测区包括包被抗人igm抗体的第一子检测区、包被有抗人igg抗体的第二子检测区和包被有鸡igy抗体的第三子检测区。在一些具体实施方案中,所述抗人igm抗体、抗人igg抗体和鸡igy抗体的量基本相同。
12.在一些实施方案中,抗人igm抗体和抗人igg抗体独立地选自山羊、绵羊、小鼠、大鼠、兔、豚鼠、猪、马或牛来源的抗体。在一些具体实施方案中,抗人igm抗体、抗人igg抗体和抗鸡igy抗体为同一物种来源的抗体。
13.第二方面,本技术提供了用于检测或监测个体中新冠病毒(covid-19)感染的试剂盒,包括:
14.第一方面所述的胶体金试纸条,以及
15.与所述胶体金试纸条配套使用的卡盒。
16.第三方面,本技术提供了第一方面所述的胶体金试纸条在制备用于检测或监测个
体中新冠病毒(covid-19)感染的试剂盒中的用途。
17.第四方面,本技术提供了制备第一方面所述的胶体金试纸条的方法,包括以下步骤:
18.(1)配制或提供胶体金溶液;
19.(2)将待标记蛋白(新冠病毒s蛋白的受体结合区域抗原、新冠病毒n蛋白抗原和抗鸡igy抗体中单独一种或任意的组合)加入步骤(1)的胶体金溶液,并充分混合,使胶体金充分包被待标记蛋白;
20.(3)向步骤(2)的产物加入封闭剂(例如,牛血清白蛋白(bsa)),混匀后静置,然后去除上清;
21.(4)向步骤(3)的沉淀加入复溶液,使沉淀充分分散;
22.(5)将步骤(4)的产物(如果步骤(2)不是使用全部待标记蛋白的混合物,则将各待标记蛋白或部分混合物的步骤(4)的产物混合)施加于胶体金标记区材料上,并干燥;
23.(6)将抗人igm抗体、抗人igg抗体和鸡igy抗体分别在检测区材料上对应第一子检测区、第二子检测区、第三子检测区的位置划线,并干燥;以及
24.(7)将上样区材料、吸水区材料、步骤(5)获得的胶体金标记区材料、步骤(6)获得的检测区材料进行装配。
25.第五方面,本技术提供了检测或监测个体中新冠病毒(covid-19)感染的方法,包括以下步骤:
26.(1)提供第二方面所述的试剂盒,并将所述胶体金试纸条与卡盒装配在一起;以及
27.(2)从所述胶体金试纸条的上样区加载所述个体的生物样品,并观察所述检测区中显示的结果。
28.附图简要描述
29.图1展示了本技术的胶体金试剂盒的示意性结构。
30.序列简要描述
31.seq id no:1为新冠病毒s蛋白的受体结合区域的氨基酸序列。
32.seq id no:2为新冠病毒n蛋白的氨基酸序列。
33.发明详细描述
34.开发准确、可靠的新冠病毒感染检测工具具有重要的医学和社会意义。胶体金试纸是一种基于横流免疫层析分析的工具,特别适用于检测个体的生物样本中的目标蛋白。在新冠病毒感染检测中,胶体金试纸技术可用于检测新冠病毒感染引发的抗体,包括igg和igm抗体。新冠病毒抗体检测与核酸检测具有一些类似的用途,例如,无症状感染者的检测和发现、新冠肺炎患者治愈出院前检查、密切接触者或其他人群的隔离期监测等,因此可以作为核酸检测的一个辅助工具。相比于核酸检测,胶体金试纸检测需要的设备更简单,甚至可以由待测对象居家自行检测。此外,鉴于抗体检测和核酸检测目标分子的性质不同,抗体检测还能带来一些核酸检测无法实现的目的,例如,社区传染大数据收集、免疫力确认、鉴定有可能成为治疗性抗体供体的候选者以及疫苗有效性评估等等。本技术的发明人针对该目标,进行了深入的前期分析和测试、制备工艺优化以及后期的性能和可靠性测试,开发并得到了新冠病毒感染检测工具以及本技术的各项发明。另外,对于igg和igm抗体的检测对于感染溯源和流行病学研究也有指示意义。
35.虽然本技术含有许多细节,但这些不应被解释为对发明或要求保护的任何范围的限制,而应被解释为可对特定发明的特定实施方案具有特异性的特征的描述。在本技术的单独实施方案中描述的某些特征也可以在单个实施方案中组合实现。相反地,在单个实施方案中描述的各种特征也可以在多个实施方案中单独地或以任何合适的子组合来实现。此外,尽管特征可以在上文中被描述为以某些组合起作用并且甚至最初如此被要求保护,但是来自所要求保护的组合的一个或多个特征可以在一些情况下从组合中删除,并且所要求保护的组合可以涉及子组合或子组合的变型。
36.除非另外说明,本文中的术语的含义与本领域技术人员通常理解的含义相同,例如,涉及胶体金试纸条、试剂盒以及数值单位中的术语。
37.在本文中,词语“包括”和“包含”表示开放式,也可以是封闭式。例如,所述“包括”或“包含”可以表示还可以包括或包含没有列出的其他组分或步骤或其他要素,也可以仅包括或包含列出的组分或步骤或其他要素。
38.在本文中,术语“约”(例如,在组分含量和反应参数中)以本领域技术人员通常能够理解的含义来解释。一般情况下,术语“约”可以理解为给定数值的正负5%范围内的任意数值,例如,约x可以代表95%x至105%x的范围中的任意数值。
39.在本文中,术语“基本”、“基本上”或类似用语代表本领域技术人员基于专业技术知识能够判断出的相同/相似性、覆盖度、完成度等。例如,a和b的量基本相同,可以理解为a和b互相处于对方的95%至105%的量的范围内。
40.第一方面,本技术提供了用于检测个体中新冠病毒(covid-19)感染引发的抗体的胶体金试纸条,其包含上样区、胶体金标记区、检测区和吸水区,其中所述胶体金标记区包含带有胶体金标记的新冠病毒s蛋白的受体结合区域抗原、新冠病毒n蛋白抗原和抗鸡igy抗体。
41.本技术开发的胶体金试纸条与常规的胶体金试纸条在大体的工作原理和结构上是类似的,通常包括上样区(也称为样品区、样品垫等)、胶体金标记区(也称为金标区、金标垫等)、检测区和吸水区(也称为吸水垫等)。结构示意图如图1所示。本技术中的“个体”通常指人类个体,但是也包括其他哺乳动物。
42.本文中的新冠病毒s蛋白是指新冠病毒的spike蛋白,spike蛋白是冠状病毒最重要的致病蛋白,其包含的受体结合区域(receptor binding domain,rbd)负责识别细胞的受体,rbd和人体细胞膜上的跨膜受体蛋白ace2结合,从而帮助自身进入细胞内部,感染后机体可产生相应的rbd特异性抗体。
43.本文中的新冠病毒n蛋白与病毒基因组rna相互缠绕形成病毒核衣壳,在病毒rna的合成过程中发挥重要的作用。同时,n蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体就可能产生高水平的抗n蛋白抗体。当病毒入侵人体后,在病毒蛋白抗原的刺激下人体免疫系统会自动反应,产生相应的特异性抗体来抵抗病毒,其中最常见的抗体为igg和igm。
44.本技术的发明人经过调研和分子后认为,针对新冠病毒s蛋白的受体结合区域以及n蛋白的抗体检测基本可以覆盖新冠病毒感染的情形,仅引发两者之外的抗体的感染情形极少或可以忽略不计。
45.胶体金标记区包含的抗鸡igy抗体为质控抗体,其与检测区的质控子检测区(即,
第三子检测区)包被的鸡igy抗体一同确保检测过程的完成性。抗鸡igy抗体可以为任何物种来源的抗抗体(即,二抗),例如山羊、绵羊、小鼠、大鼠、兔、人、豚鼠、猪、马或牛来源。本技术中对于鸡igy抗体/抗鸡igy抗体这一对质控抗体的使用能够提高检测性能,包括尽量降低由于个体人体中带有抗异质抗体而使得质控与检测干扰呈现假阳性的可能性。
46.新冠病毒的结构已得到解析和测序,本技术的新冠病毒s蛋白的rbd抗原可以包含seq id no:1所示的氨基酸序列,n蛋白抗原可以包含seq id no:2所示的氨基酸序列。本领域技术人员能够理解,在胶体金试纸制备中,s蛋白的rbd抗原和n蛋白通常是重组表达出的,而重组表达难免引入纯化标签(例如组氨酸标签)、连接肽、酶切位点等外源序列,这样的额外序列预期不会影响抗原表位,不是必须去除。因此,本技术的新冠病毒s蛋白的rbd抗原或n蛋白抗原可以由seq id no:1所示的氨基酸序列或seq id no:2所示的氨基酸序列以及任选的纯化标签(例如组氨酸标签)、连接肽和/或酶切位点组成。
47.申请人在研发过程中发现,胶体金标记区中新冠病毒s蛋白的rbd抗原、n蛋白抗原和抗鸡igy抗体之间的比例对于检测结果的灵敏性和特异性有一定影响,并对于进行了优化。因此在一些实施方案中,按照摩尔比,新冠病毒s蛋白的rbd抗原与n蛋白抗原的比例为2:1至1:1;抗鸡igy抗体的质量与新冠病毒s蛋白的rbd抗原与n蛋白抗原质量之和的比例为1:2至2:1。
48.在一些实施方案中,胶体金标记区还包含用于减少或消除蛋白非特异性结合的封闭剂。在一些具体实施方案中,封闭剂为牛血清白蛋白(bsa)。
49.本技术开发的胶体金试纸条的检测区可以包括包被抗人igm抗体的第一子检测区、包被有抗人igg抗体的第二子检测区和包被有鸡igy抗体的第三子检测区(即,质控子检测区)。这样的设置可以同时检测igm抗体和igg抗体,但是如果仅希望检测igm抗体和igg抗体之一的话,可以仅设置对应的子检测区。对于第一、第二、第三子检测区的位置没有特别要求,但是通常作为质控子检测区的第三子检测区位于样品流动方向的下游。
50.抗人igm抗体、抗人igg抗体和鸡igy抗体的量可以基本相同,这样的配置可以赋予各个子检测区之间更好的对比性。
51.对于抗人igm抗体和抗人igg抗体的物种来源没有特别的限制,例如它们可以独立地为山羊、绵羊、小鼠、大鼠、兔、豚鼠、猪、马或牛来源的。但是,从提高对比性的角度而言,抗人igm抗体、抗人igg抗体和前文讨论的抗鸡igy抗体来源于同一物种是更为理想的。
52.对于第一、第二、第三子检测区的结果代表性,必须第三子检测区显色才代表检测过程正常完成,因此第三子检测区不显色的测试被视为无效测试。在第三子检测区显色的情况下,第一和第二子检测区独自或同时显色分别代表igm抗体、igg抗体或二者同时检出。
53.胶体金试纸条还可以包括底板,上样区、胶体金标记区、检测区和吸水区由底板支持。
54.底板以及各个区的材料可以采用常用的材料。例如,底板可以由聚氯乙烯(pvc)制成;上样区、胶体金标记区、检测区的材料可以为硝酸纤维素膜、聚酯纤维膜或玻璃纤维膜载体;吸水区可以由吸水膜或吸水纸制成。
55.第二方面,本技术提供了用于检测或监测个体中新冠病毒(covid-19)感染的试剂盒,包括:
56.第一方面所述的胶体金试纸条,以及
57.与所述胶体金试纸条配套使用的卡盒。
58.第三方面,本技术提供了第一方面所述的胶体金试纸条在制备用于检测或监测个体中新冠病毒(covid-19)感染的试剂盒中的用途。
59.一般情况下,胶体金检测试剂盒会配备有与试纸条配套使用的卡盒,在检测前将试纸条按照说明装入卡盒即可。卡盒通常设置有与上样区相通、用于加载待测样品的样品窗口,以及与检测区相通能暴露各个子检测区的结果观察窗口。
60.在一些情况下,试剂盒还可以包括缓冲液,用于在待测样品上样后施用,以提供体系流动性。
61.第四方面,本技术提供了制备第一方面所述的胶体金试纸条的方法,包括以下步骤:
62.(1)配制或提供胶体金溶液;
63.(2)将待标记蛋白(新冠病毒s蛋白的受体结合区域抗原、新冠病毒n蛋白抗原和抗鸡igy抗体中单独一种或任意的组合)加入步骤(1)的胶体金溶液,并充分混合,使胶体金充分包被待标记蛋白;
64.(3)向步骤(2)的产物加入封闭剂(例如,牛血清白蛋白(bsa)),混匀后静置,然后去除上清;
65.(4)向步骤(3)的沉淀加入复溶液,使沉淀充分分散;
66.(5)将步骤(4)的产物(如果步骤(2)不是使用全部待标记蛋白的混合物,则将各待标记蛋白或部分混合物的步骤(4)的产物混合)施加于胶体金标记区材料上,并干燥;
67.(6)将抗人igm抗体、抗人igg抗体和鸡igy抗体分别在检测区材料上对应第一子检测区、第二子检测区、第三子检测区的位置划线,并干燥;以及
68.(7)将上样区材料、吸水区材料、步骤(5)获得的胶体金标记区材料、步骤(6)获得的检测区材料进行装配。
69.本技术的胶体金试纸条的制备方法可以大体利用胶体金试纸条的常规制备方法,发明人在研发过程中进行反复的测试和优化并发现有利于提高测试性能的工艺特征,包括:
70.a.胶体金标记区中新冠病毒s蛋白的rbd抗原、n蛋白抗原和抗鸡igy抗体之间的相互比例,参见上文;
71.b.利用鸡igy抗体/抗鸡igy抗体作为一对质控抗体,参见上文;
72.c.封闭后的复溶液配方:
73.蔗糖:1.5-2.5g/l,
74.聚合物:pvp、bsa、peg4000、peg6000、peg8000和peg20000中的一种或几种组合,浓度20-50g/l,
75.表面活性剂:triton-x 100、tween-20、tween-80、s9和s19中的一种或几种组合,浓度20-40g/l,
76.缓冲液:磷酸缓冲液、tris-hcl缓冲液、pbs和硼酸盐缓冲液中的一种或多种组合,浓度20-40mm,ph 7.2-7.6,
77.nacl:0.2-1g/l,
78.溶剂:水;
79.d.将s蛋白的rbd抗原和n蛋白抗原混合制备为胶体金标记溶液,将抗鸡igy抗体单独制备胶体金标记溶液,在施加于胶体金标记区材料前混合。
80.作为非限制性实例,本技术的胶体金试纸条的制备方法可以包括以下工艺:
81.胶体金制备
82.1)取1g haucl4加入到99g超纯水中,配制成1%haucl4溶液。
83.2)取1g柠檬酸三钠加入到99g超纯水中,配制成1%柠檬酸三钠溶液。
84.3)向三角瓶内加入1g 1%haucl4溶液,再加入99g超纯水,称量三角瓶重量并记录。
85.4)将三角瓶置于磁力加热搅拌器上搅拌加热,当温度达到98℃左右时,向其中加入1-2g的1%柠檬酸三钠溶液,颜色由黄色到无色再到黑色,最后变成褐红色,当颜色不变后再继续加热5min。
86.5)将4)得到的溶液置于室温下逐渐冷却,再称量三角瓶质量,用超纯水补齐到3)所记录的质量,经紫外检测器526nm扫描确认,胶体金粒径约为20-30nm。
87.6)制备的胶体金用锡箔纸密封4℃保存。
88.复溶液的配制
89.按照配方配制复溶液
90.胶体金标记抗原
91.1)取1ml胶体金,加入20-40μl 0.1m k2co3调节ph至碱性。
92.2)向1)中的溶液加入rbd蛋白和n蛋白,比例2:1-1:1,总量10-20μg,剧烈混匀使胶体金完全包被rbd蛋白和n蛋白,并在室温下静置5-10min。
93.3)向2)得到的溶液中加入20μl 20%bsa溶液封闭,上下翻转混匀并在室温下静置5-10min。
94.4)将3)得到的溶液以3000-8000rcf离心5-10min,去除上清后加入0.5-1ml复溶液,用超声将沉淀均匀分散。
95.5)取1ml胶体金,加入10-30μl 0.1m k2co3。
96.6)向5)得到的溶液加入10-20μg山羊抗鸡igy抗体,剧烈混匀使胶体金完全包被山羊抗鸡igy抗体,并在室温下静置5-10min。
97.7)向6)得到的溶液中加入20μl 20%bsa溶液封闭,上下翻转混匀并在室温下静置5-10min。
98.8)将7)得到的溶液以3000-8000rcf离心5-10min,去除上清后加入0.5-1ml复溶液,用超声将沉淀均匀分散。
99.9)将溶液4)和溶液8)按照体积比1:1的比例混合均匀后,用20-200μl量程移液枪均匀铺在金标垫上。
100.10)将金标垫置于37-42℃烘箱烘干0.5-1h,将烘干后的金标垫置于干燥密封处保存。
101.划线
102.用0.5-1.5mg/ml山羊抗人igm抗体和山羊抗人igg抗体在硝酸纤维素膜(nc膜)上分别划检测线,用0.5-1.5mg/ml鸡igy抗体划质控线,检测线与质控线均按照0.6-1.0μl/cm速度划线。划线后的nc膜置于37-42℃烘箱烘干1-3h。将烘干后的膜置于干燥处密封保存。
103.产品制作
104.由上到下按照吸水垫、nc膜、金标垫和样品垫的顺序搭接贴在30cm pvc底板上,用切条机按照所需宽度(例如,3-5mm)切成条,得到检测试纸条。在检测时,将检测试纸条装入卡盒即可开始上样。
105.第五方面,本技术提供了检测或监测个体中新冠病毒(covid-19)感染的方法,包括以下步骤:
106.(1)提供第二方面所述的试剂盒,并将所述胶体金试纸条与卡盒装配在一起;以及
107.(2)从所述胶体金试纸条的上样区加载所述个体的生物样品,并观察所述检测区中显示的结果。
108.本技术提供的胶体金试剂盒与本领域中常规胶体金试剂盒大体相同,适用的检测样品包括全血、血清、血浆等。
109.上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
实施例
110.下面结合具体实施例,进一步阐述本技术。应理解,这些实施例仅用于说明本技术而不用于限制本技术的范围。下述实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造商建议的条件。除非另行定义,文中所使用的所有专业术语或科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本技术中。本文中所述的较佳的实施方法与材料仅作示范之用。
111.实施例1.胶体金试纸条的制备
112.胶体金制备
113.1)取1g haucl4加入到99g超纯水中,配制成1%haucl4溶液。
114.2)取1g柠檬酸三钠加入到99g超纯水中,配制成1%柠檬酸三钠溶液。
115.3)向三角瓶内加入1g 1%haucl4溶液,再加入99g超纯水,称量三角瓶重量并记录。
116.4)将三角瓶置于磁力加热搅拌器上搅拌加热,当温度达到98℃左右时,向其中加入1-2g的1%柠檬酸三钠溶液,颜色由黄色到无色再到黑色,最后变成褐红色,当颜色不变后再继续加热5min。
117.5)将4)得到的溶液置于室温下逐渐冷却,再称量三角瓶质量,用超纯水补齐到3)所记录的质量,经紫外检测器526nm扫描确认,胶体金粒径约为20-30nm。
118.6)制备的胶体金用锡箔纸密封4℃保存。
119.复溶液的配制
120.按照以下配方配制复溶液:
121.蔗糖:1.5-2.5g/l,
122.聚合物:pvp、bsa、peg4000、peg6000、peg8000和peg20000中的一种或几种组合,浓度20-50g/l,
123.表面活性剂:triton-x 100、tween-20、tween-80、s9和s19中的一种或几种组合,
浓度20-40g/l,
124.缓冲液:磷酸缓冲液、tris-hcl缓冲液、pbs和硼酸盐缓冲液中的一种或多种组合,浓度20-40mm,ph 7.2-7.6,
125.nacl:0.2-1g/l,
126.溶剂:水。
127.胶体金标记抗原
128.1)取1ml胶体金,加入20-40μl 0.1m k2co3调节ph至碱性。
129.2)向1)中的溶液加入rbd蛋白和n蛋白(抗原氨基酸序列分别如seq id no:1和seq id no:2所示,由体外重组表达方式获得),比例2:1-1:1,总量10-20μg,剧烈混匀使胶体金完全包被rbd蛋白和n蛋白,并在室温下静置5-10min。
130.3)向2)得到的溶液中加入20μl 20%bsa溶液封闭,上下翻转混匀并在室温下静置5-10min。
131.4)将3)得到的溶液以3000-8000rcf离心5-10min,去除上清后加入0.5-1ml复溶液,用超声将沉淀均匀分散。
132.5)取1ml胶体金,加入10-30μl 0.1m k2co3。
133.6)向5)得到的溶液加入10-20μg山羊抗鸡igy抗体(商购),剧烈混匀使胶体金完全包被山羊抗鸡igy抗体,并在室温下静置5-10min。
134.7)向6)得到的溶液中加入20μl 20%bsa溶液封闭,上下翻转混匀并在室温下静置5-10min。
135.8)将7)得到的溶液以3000-8000rcf离心5-10min,去除上清后加入0.5-1ml复溶液,用超声将沉淀均匀分散。
136.9)将溶液4)和溶液8)按照体积比1:1的比例混合均匀后,用20-200μl量程移液枪均匀铺在金标垫上。
137.10)将金标垫置于37-42℃烘箱烘干0.5-1h,将烘干后的金标垫置于干燥密封处保存。
138.划线
139.用0.5-1.5mg/ml山羊抗人igm抗体(商购)和山羊抗人igg抗体(商购)在硝酸纤维素膜(nc膜)上分别划检测线,用0.5-1.5mg/ml鸡igy抗体(商购)划质控线,检测线与质控线均按照0.6-1.0μl/cm速度划线。划线后的nc膜置于37-42℃烘箱烘干1-3h。将烘干后的膜置于干燥处密封保存。
140.产品制作
141.由上到下按照吸水垫、nc膜、金标垫和样品垫的顺序搭接贴在30cm pvc底板上,用切条机按照所需宽度(例如,3-5mm)切成条,得到检测试纸条。试纸条可以密封包装,与另外密封包装的卡盒、缓冲液等包装为试剂盒形式。在检测时,将检测试纸条装入卡盒即可开始上样。
142.实施例2.新冠病毒抗体检测
143.本实施例描述利用实施例1的试剂盒进行新冠病毒抗体检测的大体流程,后续实施例依照本实施例操作。
144.检测样本
145.1.本试剂盒特别适用于全血、血清或血浆样本的检测。
146.2.如果血清或血浆作为检测样本,尽可能快地将它们从血液中分离,以避免溶血。仅使用透明、未溶血的样本。
147.3.测试最好在样本收集后尽快进行。不要将样本在室温下长时间放置。血清和血浆样本可以在2-8℃储存至多3天。对于长期储存,样本应保持低于-20℃。如果测试在收集后2天内进行,则通过静脉穿刺收集的全血应储存在2-8℃下。不能冷冻全血样本。指尖收集的全血最好立即实施测试。
148.4.在测试之前使样本达到室温。冷冻样本必须在测试之前完全解冻并充分混合。样本不宜运输。
149.测试流程
150.在测试之前,使试剂盒、测试样本、缓冲液(可以包括在试剂盒中,也可以另外提供)和/或对照样本(如果有的话)平衡至室温(15-30℃)。
151.1.将试剂盒拆封并进行组装(试纸条和卡盒也可以装配好再密封包装),并尽快进行测试(最好1小时内)。
152.2.将测试装置放置在水平表面上。
153.对于血清或血浆样本:
154.将5μl血清/血浆样本上样至上样区,然后立即加入2滴(约80μl)上样缓冲液。
155.对于全血样本:
156.将1滴全血(约10μl)上样至上样区,然后立即加入2滴(约80μl)上样缓冲液。
157.3.等待彩色线出现。在2分钟后,如果红色没有移动通过测试窗口或如果血液仍然存在于上样区,则再加入1滴上样缓冲液。
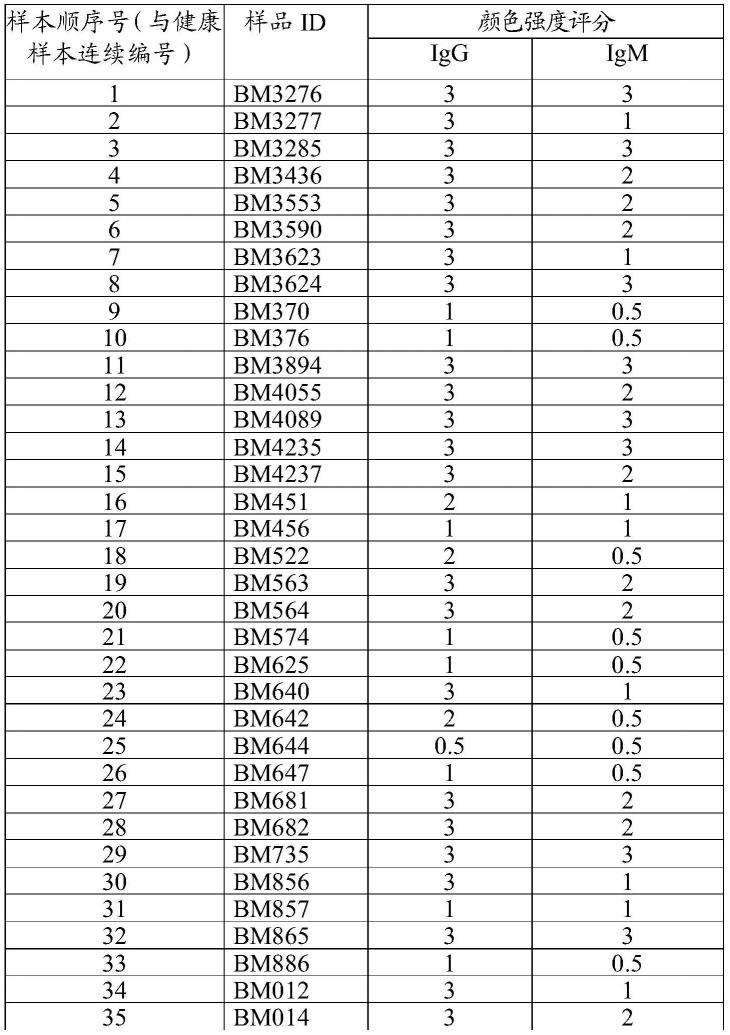
158.4.结果应在5分钟内读取,最快可能2分钟就看到阳性结果。15分钟后的结果无解读意义。
159.结果解读
160.无论测试线结果如何,必须质控线显色才属于有效测试。在质控线显色的情况下,观察代表igm抗体、igg抗体的测试线,其中之一显色或者均显色代表对应的阳性结果。此外,试剂盒还可以配备比色卡,用于对阳性结果进行半定量,例如以强/中/弱等文字评级模式或3/2/1等数字评级模式(本技术实施例的试剂盒采用后者)。
161.实施例3.新冠病毒抗体检测性能测试
162.在知情同意原则下,获得了45名新冠病毒核酸检测阳性个体和20名未感染健康个体的血清样本。发明人对上述65份样本分别使用本技术实施例的试剂盒进行了测试。对于20份健康血清样本,利用本技术的试剂盒的测试均给出阴性结果。对于45份核酸检测阳性血清样本,利用本技术的试剂盒的测试得到的抗体检测阳性结果如表1所示。
163.表1.
[0164][0165][0166]
进一步扩大样品量实验,在对200多份核酸检测阳性样本检测得出的统计数据显示,本技术的试剂盒的灵敏性对于igg抗体检测为96%,对于igm抗体检测为82%。
[0167]
实施例4.可靠性/有效性测试
[0168]
4.1与化学发光法的比较
[0169]
样品和方法
[0170]
由davita提供总共85名包括新冠病毒感染和未感染的个体的血清样品。预先通过diazyme dz-lite新冠病毒igm和igg clia测试(clia测试)测定针对新冠病毒的igg和igm抗体的浓度,该测试在diazyme maglumi 2000plus化学发光分析仪上运行,截止值设定为1au/ml。利用本技术的胶体金试剂盒对上述血清样品进行测试,拍摄试纸条上的反应带,用imagej将反应带数字化,将密度截止值设定为1,由三名独立观察者通过眼球目视检测验证一致。
[0171]
结果
[0172]
表3显示了两种测试结果一致性百分比。
[0173]
表3
[0174][0175]
从以上结果可以看出,本技术的胶体金试剂盒的灵敏性较高,其检测限与clia化学发光测试的1au/ml的检测限相当,并且结果一致性也较高。
[0176]
4.2阴性样本测试
[0177]
样品与方法
[0178]
91名个体的血清样本来自2017年收集的评价脑钠肽(bnp)作为心血管疾病的生物标志物的研究中。在本次测试前,这些血清样本储存在-80℃下,在先前的bnp研究中冻融不超过3次。这些血清样品的收集日期远早于报告第一例新冠病毒肺炎的日期,认为是阴性样本。利用本技术的试剂盒对该91份血清样本进行测试。
[0179]
结果
[0180]
表4显示了测试结果。
[0181]
表4
[0182][0183][0184]
如表4的结果所示,本技术的胶体金试剂盒的假阳性率较低,特异性较好,并且-80℃长时间储存的血清样品对阴性结果的影响不大。
[0185]
4.3指尖血测试
[0186]
样品与方法
[0187]
作为阴性血清样本,选择2017年收集的评价抗ccp1(环瓜氨酸化肽1)抗体作为类风湿关节炎(ra)的生物标志物研究中的共20名个体的血清样品。在本次测试前,这些血清样本储存在-80℃下,在先前的ra研究中冻融不超过3次。这些血清样品的收集日期远早于
报告第一例新冠病毒肺炎的日期,认为是阴性样本。
[0188]
阳性血清样本为选自实施例4.1部分的由利用化学发光法和本技术试剂盒共同认定的20份血清样本。
[0189]
从健康个体收集指尖全血,并将上述阳性和阴性血清样品以1:5的比例掺入指尖全血中。
[0190]
利用本技术的试剂盒对上述40份血清样本进行测试。
[0191]
结果
[0192]
表5显示了测试结果。
[0193]
表5
[0194][0195]
如表5的结果所示,本技术的胶体金试剂盒可用于指尖血检测,但是igm可能会出现假阴性,原因估计是在一些情况下血清中igm比较低。
[0196]
4.4交叉反应性测试
[0197]
样品与方法
[0198]
阳性血清样本为选自实施例4.1部分的由利用化学发光法和本技术试剂盒共同认定的6份血清样本。
[0199]
将上述血清样品进行处理:
[0200]
(1)用pbs(1%bsa)缓冲液(20-400
×
)预稀释至弱阳性;
[0201]
(2)预稀释后与商购热灭活新冠病毒(分离物:usawa1/2020)(1:5体积比)混合;
[0202]
(3)预稀释后与购自zeptometrix的呼吸病原体组合a混合;
[0203]
(4)预稀释后与购自zeptometrix的呼吸病原体组合b混合;
[0204][0205][0206]
利用本技术的试剂盒对上述处理的血清样本进行测试。
[0207]
结果
[0208]
表6显示了测试结果。
[0209]
表6
[0210][0211]
如表6的结果所示,当新冠病毒igg/igm抗体阳性样本与灭活新冠病毒混合后,抗体/抗原结合,使得抗体不再被检出,而呼吸病原体组合a和b中的多种呼吸病原体对于检测结果没有影响,说明本技术的试剂盒具有良好的病原体特异性,交叉反应性很低或不存在。
[0212]
4.5模型分析
[0213]
样品与方法
[0214]
选择15名新冠病毒igg/igm抗体测试中结果阴性、弱阳性和强阳性(各5个)的个体的血清样本。
[0215]
将2μl上述血清样本分别掺入来自同一供体(在本研究之前经血清测试确认为抗体阴性)的8μl血清、血浆、静脉穿刺全血和指尖全血中,然后利用本技术的试剂盒对上述混合血液样本进行测试。
[0216]
结果
[0217]
本研究的结果(具体数据未示出)表明,本技术的试剂盒在血清、血浆、静脉穿刺全血和指尖全血样品的不同模型下结果一致,适用性强。
[0218]
4.6igg和igm抗体的区分性
[0219]
样品与方法
[0220]
本实施例通过dtt对于igg和igm抗体的不同中和性质,测定本技术的试剂盒对于igg和igm抗体的区分性。
[0221]
测试样品为5名新冠病毒igg/igm抗体测试中结果阳性的个体的血清样本。
[0222]
对照样品为重组抗spike人源化igg和igm抗体。
[0223]
将测试样品和对照样品在37℃下用5mm dtt预处理15分钟,然后在纽扣透析袋中在4℃对500ml pbs缓冲液(ph 7.5)进行透析过夜以去除dtt。同时,在缺少dtt的情况下,对测试样品和对照样品重复了相同的操作作为对照。
[0224]
利用本技术的试剂盒对上述得到的样本进行测试。
[0225]
结果
[0226]
表7显示了测试结果。
[0227]
表7
[0228][0229]
如表7的结果所示,本技术的试剂盒能够实现igg和igm抗体的良好区分。
[0230]
最后,应理解的是,虽然本说明书的各个方面描述了具体实施方案,但本领域技术人员容易理解,这些公开的实施方案仅是本文公开的主题的原理的说明。因此,应该理解的是,除非明确说明,所公开的主题不限于本文所述的具体组合物、方法和/或配方等。此外,本领域普通技术人员将认识到,在不脱离本说明书的精神的情况下,根据本文的教导可以做出某些改变、修改、置换、变更、增加、减少和亚组合。因此,本技术所附的权利要求旨在被解释为包括在其真实精神和范围内的所有这些改变、修改、置换、变更、增加、减少和亚组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。