1.在本说明书中公开作为有效成分包含含有没食子儿茶素没食子酸酯的绿茶提取物的降低体脂用组合物及其制备方法。
背景技术:
2.肥胖是因通过食物摄取的能量和通过身体活动消耗的能量之间的不均衡而过剩的能量堆积为体脂的状态,意指脂肪组织内脂肪细胞的数量增加或者脂肪细胞的大小变大而脂肪增加的状态。除此之外,还周知对肥胖作用的有遗传因素、由于西方化的饮食生活导致的环境因素、心理因素、能量代谢异常等各种原因。若所述肥胖状态持续长时间,则会引起糖尿病、高血脂、心脏病、脑卒中、动脉硬化症、脂肪肝等的各种代谢性疾病和成人病。
3.作为优选的肥胖治疗方法,提出了联合通过运动促进能量消耗和摄取副作用少的肥胖治疗用药剂才是最安全且有效的方法。然而,实际情况是,有报告指出肥胖治疗用药剂有脂肪痢、腹部疼痛、呕吐、瘙痒、肝受损、头痛、食欲不振、失眠、便秘等的严重的副作用,并且对安全性的明确的可靠性得不到支持。因此,要求开发出对人体显示抗肥胖的优异的功效的同时,还保障100%安全性的物质。作为一例,在大韩民国公开专利第10-2015-0105563号中公开了包含中药材料的提取物的肥胖的预防以及治疗用组合物。然而,实际情况是,对于通过生物体内的脂肪燃烧/分解机制和能量代谢增进机制等的多方面的研究而开发的有效的肥胖治疗用物质仍旧不足。
4.【现有技术文献】
5.【专利文献】
6.(专利文献1)大韩民国公开专利第10-2015-0105563号
技术实现要素:
7.本公开是为了解决如上所述的问题而提出的,本公开的目的在于,提供作为有效成分包含含有没食子儿茶素没食子酸酯的绿茶提取物,从而显示降低体脂的优异功效的组合物及其制备方法。
8.为了达成前述的本公开的目的,本公开提供作为有效成分包含以提取物的总重量为基准含有4重量%以上的没食子儿茶素没食子酸酯的绿茶提取物的降低体脂用组合物及其制备方法。
9.根据本公开,作为有效成分包含以提取物的总重量为基准含有4重量%以上的没食子儿茶素没食子酸酯的绿茶提取物,从而具有降低体脂的功效优异的优点。由此,具有通过多方面研究,提供有效的肥胖治疗用物质的效果。
附图说明
10.图1以及图2是示出绿茶提取物的抑制脂质合成基因的表达的功效评价结果的图表。
11.图3是示出绿茶提取物的抑制脂质的合成或者堆积的功效评价结果的图像以及图表。
12.图4是示出绿茶提取物成分的抑制脂质的合成或者堆积的功效评价结果的图表。
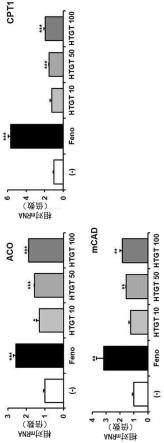
13.图5、图6以及图8是示出绿茶提取物的增加脂肪酸氧化基因的表达的功效评价结果的图表。
14.图7是示出绿茶提取物成分的增加脂肪酸氧化基因的表达的功效评价结果的图表。
15.图9是示出绿茶提取物的促进中性脂肪分解的功效评价结果的图表。
16.图10、图11以及图13是示出绿茶提取物的促进线粒体的活性的功效以及促进atp生成的功效评价结果的图表。
17.图12是示出绿茶提取物成分的促进线粒体的活性的功效以及促进atp生成的功效评价结果的图表。
18.图14以及图16是绿茶提取物成分的增加褐色脂肪细胞相关基因的表达的功效评价结果的图表。
19.图15以及图17是绿茶提取物的增加褐色脂肪细胞相关基因的表达的功效评价结果的图表。
20.图18是示出绿茶提取物的促进脂肪细胞内能量代谢活性的功效评价结果的图表。
具体实施方式
21.对于在本说明书中使用的术语,考虑其在本公开中的功能而尽量选择了目前广泛使用的一般术语,然而其可以根据在本领域从事的技术人员的意图、判例或者新技术的出现等而不同。另外,在特殊情况下还有申请人任意选定的术语,在该情况下,会在相应的具体实施方式部分中详细记载其含义。因此,在本公开中使用的术语不应依据单纯的术语名称而应依据该术语所具有的含义和在整个本公开中的内容进行定义。
22.除非不同地定义,则包括技术或者科学术语在内,在此使用的所有术语具有与本发明所属技术领域中具有通常知识的人一般所理解的相同的含义。一般所理解的术语应解释为具有与相关技术的上下文中所具有的含义相同的含义,除非在本公开中明确定义,则不应解释为理想或者过于形式上的含义。
23.数值范围包括本公开中定义的数值。经本说明书的所有最大的数值限制如明确记载有低的数值限制,包括所有的更低的数值限制。经本说明书的所有最小的数值限制如明确记载有更高的数值限制,包括所有的更高的数值限制。经本说明书的所有的数值限制如明确记载有更窄的数值限制,包括更宽的数值范围内的更好的所有的数值限制。
24.以下,参照实施例以及附图具体说明本公开。然而,显然本发明不限定于以下实施例以及附图。
25.在一方面,本公开提供一种作为有效成分包含含有没食子儿茶素没食子酸酯(gallocatechingallate,gcg)的绿茶提取物的降低体脂用组合物。
26.所述“绿茶提取物”不管提取方法、提取溶剂、提取的成分或提取物的形式,包括从茶科属的常绿树的茶(camellia sinensis)中提取的物质或者从接种枯草芽孢杆菌(bacillus subtilis spp.)并发酵的茶叶等中提取的物质,并且包括将所述提取的物质用
特定溶剂分馏的分馏物。所述茶包括选自由茶树的叶子、花、茎、果实、根、茎和根的心材而成的组的一种以上,优选地,可以是叶子。此外,所述提取物的形式可以优选为粉末。所述提取或分馏可以使用水、有机溶剂或它们的混合溶剂进行。有机溶剂可以使用醇、异丙醇、丙酮、己烷、乙酸乙酯、二氧化碳或者它们中的两种以上的混合溶剂,但不限于此,在不破坏绿茶的有效成分或破坏最小的条件下,可以在室温下或加热来进行提取或分馏。所述醇可以是c1~c5的低级醇。提取或分馏的次数和方法没有特别地限制,例如,可以使用冷浸提取、超声波提取、回流冷却提取、热水提取等的方法,优选地,可以冷浸或加热来提取或分馏有效成分并进行过滤后,通过减压浓缩所得到的滤液来获得本发明的绿茶提取物。
27.绿茶中包含多酚化合物(黄烷醇(flavanols)、黄烷双醇(flavandiols)、黄酮类(flavonoid)、酚酸(phenolic acid)),所述多酚化合物的大部分为作为“儿茶素(catechin)”类化合物周知的黄酮醇。除此之外,绿茶中含有色素类、包含茶氨酸和谷氨酸的28种氨基酸类、无机质、多种酶类、有机酸以及碳水化合物等。作为所述“儿茶素(catechin)”类化合物,可以举出儿茶素(catechin,c)、表儿茶素(epicatechin,ec)、没食子儿茶素(gallocatechin,gc)、表没食子儿茶素(epigallocatechin,egc)、儿茶素没食子酸酯(catechin gallate,cg)、表儿茶素没食子酸酯(epicatechin gallate,ecg)、没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的主要8种化合物。更加具体地,可以是(-)-儿茶素、(-)-表儿茶素、(-)-没食子儿茶素、(-)-表没食子儿茶素、(-)-儿茶素没食子酸酯、(-)-表儿茶素没食子酸酯、(-)-没食子儿茶素没食子酸酯以及(-)-表没食子儿茶素没食子酸酯。
28.所述“没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)”作为表没食子儿茶素没食子酸酯的差向异构体,本发明人为了探索降低体脂用组合物而反复深入研究的结果,惊奇地发现当所述没食子儿茶素没食子酸酯在提取物内的含量、表没食子儿茶素没食子酸酯以及所述没食子儿茶素没食子酸酯的重量比、总儿茶素含量在特定范围内时,具有降低体脂活性,由此完成了本发明。
29.所述“总儿茶素含量”意指所述8种儿茶素类化合物,即儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素、儿茶素没食子酸酯、表儿茶素没食子酸酯、没食子儿茶素没食子酸酯以及表没食子儿茶素没食子酸酯的总含量。
30.所述“有效成分”意指显示想要的活性的成分或者与本身没有活性的载体一起能够显示活性的成分。
31.所述“作为有效成分包含”可以意指作为显示降低体脂功效或者显示预防、改善或治疗肥胖的功效的成分包含。
32.所述“降低体脂”功能意指即便没有体重的变化,也通过降低体脂来降低体脂率的功效以及通过抑制体脂的增加来抑制体脂率的增加的功效。在给药或摄取本公开的降低体脂用组合物的期间,通过定期进行较轻的运动,可以进一步提高体脂的降低效果。通过给药或摄取本公开中的降低体脂用组合物,抑制体脂的增加,其结果还具有防止肥胖的效果。通过减少过剩的体脂,还具有治疗、改善、预防因肥胖或者体重超标而引起的疾病,例如糖尿病、动脉硬化、高血压、癌症、高脂血症、类风湿、高尿酸血症、退行性关节炎、痛风、脑卒中、缺血性心脏病、呼吸障碍、胰腺炎、肾炎、白内障、阿尔茨海默症、过敏性疾病、老化、多汗症、缺血性疾病、作为糖尿病的并发症的肾病或神经障碍或视网膜障碍相关疾病的效果。在神
经障碍中,对突发性耳聋、眼或脸部异常(麻痹或痛症)、直立性低血压、出汗异常、腹泻或便秘(消化器官症状)、排尿障碍、四肢疼痛、知觉异常、肌肉萎缩、坏疽的治疗、改善、预防有效果。在眼障碍中,对白内障、单纯视网膜病、增生前视网膜病以及增生视网膜病有效果。另外,在缺血性疾病中,对脑梗塞、心肌梗塞的预防、改善或治疗也有效果。
33.在本公开的一实现例中,所述绿茶提取物以提取物的总重量为基准,以4重量%以上的含量含有所述没食子儿茶素没食子酸酯。更加具体地,可以是4重量%以上、4.5重量%以上、5重量%以上、5.3重量%以上、5.5重量%以上、5.59重量%以上或者5.6重量%以上,但不限于此。另外,所述没食子儿茶素没食子酸酯的含量的上限不受特别限制。
34.在本公开的一实现例中,所述绿茶提取物以提取物的总重量为基准,以4重量%至15重量%的含量含有所述没食子儿茶素没食子酸酯。更加具体地,可以是4重量%以上、4.5重量%以上、5重量%以上、5.5重量%以上或者5.6重量%以上;15重量%以下、14.5重量%以下、14重量%以下、13.5重量%以下、13重量%以下、12.5重量%以下、12重量%以下、11.5重量%以下、11重量%以下、10.5重量%以下、10重量%以下、9.5重量%以下、9重量%以下、8.5重量%以下、8重量%以下、7.5重量%以下、7重量%以下、6.5重量%以下、6重量%以下或者5.6重量%以下,但不限于此。
35.在本公开的一实现例中,所述绿茶提取物以提取物的总重量为基准,以4重量%至15重量%的含量含有所述表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)。更加具体地,可以是4重量%以上、4.5重量%以上、5重量%以上或者5.3重量%以上;15重量%以下、14.5重量%以下、14重量%以下、13.5重量%以下、13重量%以下、12.5重量%以下、12重量%以下、11.5重量%以下、11重量%以下、10.5重量%以下、10重量%以下、9.5重量%以下、9重量%以下、8.5重量%以下、8重量%以下、7.5重量%以下、7重量%以下、6.5重量%以下、6重量%以下、5.5重量%以下或者5.3重量%以下,但不限于此。
36.在本公开的一实现例中,所述绿茶提取物的1日适用量为10mg/kg至2000mg/kg。更加具体地,1日适用量可以是10mg/kg以上、20mg/kg以上、25mg/kg以上、50mg/kg以上、75mg/kg以上、100mg/kg以上、125mg/kg以上、150mg/kg以上、175mg/kg以上、200mg/kg以上、225mg/kg以上、250mg/kg以上、275mg/kg以上、300mg/kg以上、325mg/kg以上、350mg/kg以上、375mg/kg以上或者400mg/kg以上;2000mg/kg以下、1750mg/kg以下、1500mg/kg以下、1250mg/kg以下、1000mg/kg以下、975mg/kg以下、950mg/kg以下、925mg/kg以下、900mg/kg以下、875mg/kg以下、850mg/kg以下、825mg/kg以下、800mg/kg以下、775mg/kg以下、750mg/kg以下、725mg/kg以下、700mg/kg以下、675mg/kg以下、650mg/kg以下、625mg/kg以下、600mg/kg以下、575mg/kg以下、550mg/kg以下、525mg/kg以下、500mg/kg以下、475mg/kg以下、450mg/kg以下、425mg/kg以下或者400mg/kg以下,但不限于此。所述适用也可以是1日1次至数次分开适用。例如,可以是1日2次至24次、3日1次至2次、1周1次至6次、2周1次至10次、3周1次至15次、4周1次至3次或者1年1次至12次来适用。
37.所述“适用”意指通过任意的适当方法向适用对象提供所述组合物,是包含给药、涂敷、吸收以及摄取等的含义。此时,适用对象意指可以适用所述组合物的人类、猴子、狗、山羊、猪或者老鼠等所有动物。
38.在本公开的一实现例中,本公开的所述绿茶提取物的含量可以相对于组合物总重量,包含0.4重量%至100重量%的含量。更加具体地,可以是0.4重量%以上、0.5重量%以
上、1重量%以上、10重量%以上、20重量%以上、30重量%以上、40重量%以上、50重量%以上、60重量%以上、70重量%以上、80重量%以上或者90重量%以上;100重量%以下、90重量%以下、80重量%以下、70重量%以下、60重量%以下、50重量%以下、40重量%以下、30重量%以下或者20重量%以下,但不限于此。
39.所述绿茶提取物的含量可以根据剂型、用途、适用次数以及适用路径而不同。尤其是,在本公开的组合物的剂型中,当制备为注射剂等非口服剂型时,或者当制备为食品、药丸以及糖浆等口服剂型时,本公开的所述有效成分的含量可以根据组合物在肠内的吸收率、消化率等而不同。考虑到本公开的组合物的一日适用量,对于体重为60kg的适用对象,可以适用600mg至120000mg。将一日适用量假设为150g,则可以是本公开的所述绿茶提取物的含量相对于组合物总重量,包含0.4重量%至80重量%的含量。
40.在本公开的一实现例中,所述绿茶提取物以1:0.33至3的重量比含有表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)以及没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)。更加具体地,所述重量比可以是1:0.33以上、1:0.35以上、1:0.4以上、1:0.45以上、1:0.5以上、1:0.55以上、1:0.6以上、1:0.65以上、1:0.7以上、1:0.75以上、1:0.8以上、1:0.9以上、1:1以上、1:1.05以上、1:1.051以上、1:1.052以上、1:1.053以上、1:1.054以上、1:1.055以上、1:1.056以上或者1:1.057以上;1:3以下、1:2.5以下、1:2以下、1:1.5以下、1:1.4以下、1:1.3以下、1:1.2以下、1:1.1以下、1:1.09以下、1:1.08以下、1:1.07以下、1:1.06以下、1:1.059以下、1:1.058以下或者1:1.057以下,但不限于此。
41.在本公开的一实现例中,所述绿茶提取物以提取物的总重量为基准,以19重量%至30重量%的含量含有儿茶素(catechin,c)、表儿茶素(epicatechin,ec)、没食子儿茶素(gallocatechin,gc)、表没食子儿茶素(epigallocatechin,egc)、儿茶素没食子酸酯(catechin gallate,cg)、表儿茶素没食子酸酯(epicatechin gallate,ecg)、没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)。所述8种儿茶素类化合物的含量为“总儿茶素含量”,更加具体地,可以是19重量%以上、19.5重量%以上、20重量%以上、20.5重量%以上、21重量%以上、21.5重量%以上、22重量%以上或者24.6重量%以上;30重量%以下、29.5重量%以下、29重量%以下、28.5重量%以下、28重量%以下、27.5重量%以下、27重量%以下、26.5重量%以下、26重量%以下、25.5重量%以下、25重量%以下、24.5重量%以下、24重量%以下、23.5重量%以下、23重量%以下、22.5重量%以下或者24.6重量%以下,但不限于此。
42.在本公开的一实现例中,所述组合物为促进脂肪细胞内中性脂肪分解用组合物。通过将中性脂肪分解为丙三醇以及游离脂肪酸,可以分解储备的脂肪。
43.在本公开的一实现例中,所述有效成分增加选自由pgc-1α(过氧化物酶体增殖物激活受体γ辅激活因子1α,peroxisome proliferator-activated receptor gamma coactivator 1-alpha)、aco(脂酰辅酶a氧化酶,acyl-coa oxidase)、cpt1(肉毒碱棕榈酰转移酶,carnitine palmitoyl transferase 1)以及mcad(中链酰基辅酶a脱氢酶,medium chain acyl-coa dehydrogenase)而成的组的一种以上的脂肪酸氧化基因的表达。
44.在本公开的一实现例中,所述组合物减小脂肪细胞的大小。所述“脂肪细胞的大
小”意指脂肪细胞的直径。所述脂肪细胞的大小由堆积在细胞内的脂肪的量来确定,因此减小脂肪细胞的大小可以减少细胞内的脂肪的量。
45.在本公开的一实现例中,所述组合物是抑制脂肪细胞内(triglyceride,tg,甘油三酯)合成或者堆积用组合物。多余能量主要会以中性脂肪的形式储藏在体内,作为降低体脂的第一个步骤,有必要抑制所述中性脂肪的合成或者堆积。
46.在本公开的一实现例中,所述组合物可以抑制脂质合成基因的表达,从而抑制脂肪细胞内中性脂肪的合成或者堆积。所述脂质例如可以是中性脂肪。所述脂质合成基因可以举出srebp1c(固醇调节元件结合蛋白1c,sterol-regulatory element binding protein 1c)、acc(乙酰辅酶a羧化酶;acetyl-coa carboxylase)、fas(脂肪酸合成酶,fatty acid synthase)以及scd-1(硬脂酰辅酶a去饱和酶-1,stearoyl-coa desaturase-1,scd-1),但不限于此。在本公开的一实现例中,所述有效成分抑制选自由srebp1c、acc、fas以及scd-1而成的组的一种以上的脂质合成基因的表达。
47.在本公开的一实现例中,所述组合物为促进脂肪细胞内线粒体的活性用组合物。如果肥胖的话,即便在脂肪细胞中脂肪分解,若作为分解产物的游离脂肪酸等不通过能量代谢适当消耗,则它们移动至其它细胞以及组织,发生再次引起脂肪堆积等的脂质调节异常(lipid dysregulation)作用,从而可能成为代谢疾病的原因。因此,只有在脂肪细胞内分解的脂肪被消耗而转换为atp(腺嘌呤核苷三磷酸),才能达成降低体脂功效,因此需要促进线粒体的活性而激活能量代谢。即,只有联合促进脂肪细胞内中性脂肪的分解以及促进线粒体的活性,才能发挥最佳的降低体脂功效。
48.在本公开的一实现例中,所述组合物为增加基础代谢量用组合物。本公开的组合物通过包含所述有效成分,增加脂肪酸氧化基因的表达,促进脂肪细胞内线粒体的活性,从而具有增加基础代谢量、抑制肌肉损伤、强化持久力、强化肌肉、抑制肌肉痛等的效果。
49.在本公开的一实现例中,所述组合物诱导白色脂肪细胞的米色脂肪细胞化。
50.脂肪细胞作为构成脂肪组织的主要细胞,根据功能、形态特征以及分化起源而分为白色脂肪细胞(white adipocyte)、褐色脂肪细胞(brown adipocyte)、米色脂肪细胞(beige/brite adipocyte)。
51.所述“白色脂肪细胞(white adipocyte)”意指储藏脂肪的脂肪细胞,是引发糖尿、肥胖等成人病的细胞。所述白色脂肪细胞将能量储藏至中性脂肪(triglyceride,tg,甘油三酯),并为了全身使用而在需要能量时调动游离脂肪酸。游离脂肪酸的解放需要中性脂肪的分解(tg的加水分解),其主要是通过激活包含脂肪甘油三酯脂酶(adipose triglyceride lipase,atgl)以及激素敏感性脂肪酶(hormone sensitive lipase,hsl)的细胞质脂肪酶的camp依赖性蛋白激酶a(camp dependent protein kinase a)来调节。
52.所述“褐色脂肪细胞(brown adipocyte)”以及“米色脂肪细胞(beige/brite adipocyte)”意指将脂肪燃烧为能量的细胞,在褐色脂肪细胞中,诱导在atp合成中降低线粒体的梯度的质子(protons)的解偶联(uncoupling),从而产生非颤抖性产热。因此,褐色脂肪细胞以及米色脂肪细胞是对调节体温以及生产能量起到重要作用的细胞。
53.褐色脂肪细胞和米色脂肪细胞具有一些区别。褐色脂肪细胞从肌肉细胞之类的前体细胞(myf5 /pax7 precursor)分化,主要发现于肩胛骨、锁骨、肾脏等的位置。周知的是,当是老鼠时,褐色脂肪细胞在出生之前完成分化,并终生维持其功能和形态,与此相反地,
当是人类时,褐色脂肪细胞在幼小时期暂时出现,成人之后逐渐消失。米色脂肪细胞是从白色脂肪细胞(横向分化;trans-differentiation)或者白色脂肪前体细胞(pdgfrα /sca1 precursor)诱导分化(de novo differentiation),当暴露于寒冷时,特殊地出现在白色脂肪组织(主要是皮下脂肪)中。
54.若白色脂肪细胞转换为褐色脂肪细胞,则相比在体内储藏的脂肪,燃烧的脂肪的量增加,因此,即便摄取相同热量的食物,也容易维持体重,可以改善肥胖。然而,本公开的所述组合物相比向褐色脂肪细胞的分化,诱导白色脂肪细胞的米色脂肪细胞化。所述组合物通过将白色脂肪细胞进行米色脂肪细胞化的作用,诱导起到与褐色脂肪细胞类似的作用的脂肪细胞的能量代谢转换(fat transformation),所谓米色脂肪细胞化现象。
55.在本公开的一实现例中,所述组合物在脂肪细胞中增加ucp1(uncoupling protein 1,解偶联蛋白1)的表达。所述ucp1存在于褐色脂肪细胞内的线粒体内膜中,起到阻止氧化和磷酸化的结合。ucp1在白色脂肪细胞等其它细胞中不表达,从而作为褐色脂肪细胞的分子标记来使用。ucp1使光合磷酸化不发展为atp合成,将能量通过热释放。
56.在本公开的一实现例中,所述组合物为预防、改善或者治疗肥胖用药剂学组合物。
57.所述“肥胖”意指在体内脂肪组织过多的状态。男性是体脂为体重的25%以上时,女性是体重的30%以上时,称为肥胖,当通过食物摄取的热量大于通过身体活动消耗的热量时,引起肥胖。有肥胖的话,外形上看着庞大,还伴随有容易气喘、关节疼痛、糖尿病、高血压等症状。
58.所述“药剂学组合物”意指适合向需要疾病的预防、改善或者治疗的个体给药的组合物。
59.所述“个体”意指需要疾病的预防或者治疗的对象,更加具体地,意指人类或者非人类即灵长类、小鼠(mouse)、老鼠(rat)、狗、猫、马以及牛等的哺乳类。
60.所述“预防”意指通过给药本公开的组合物来抑制或者延缓肥胖的所有行为。所述“改善”意指通过给药所述组合物来使肥胖好转或者有益改变的所有行为。所述“治疗”意指通过给药本公开的组合物来使肥胖的疑似以及发病个体的症状好转或者有益改变的所有行为。
61.在本公开中,当有效成分包含在药剂学组合物中时,除了根据本公开的有效成分之外,可以混合药剂学上可允许的载体,即生理盐水、灭菌水、点滴液、缓冲生理盐水、环糊精、葡萄糖溶液、麦芽糖糊精溶液、丙三醇、乙醇、脂质体以及该成分中的一种以上进行使用,根据需要可以还包括抗氧化剂、缓冲液等其它常规添加剂。另外,可以进一步添加稀释剂、分散剂、表面活性剂、结合剂及/或润滑剂,从而剂型化为水溶液、悬浊液、乳浊液等之类的注射用剂型、丸剂、胶囊、颗粒或者片剂。
62.所述药剂学组合物以药学上有效的量进行给药。所述“药学上有效的量”意指以可适用的合理的受益/危险比率对于预防或者治疗疾病充分的量,有效容量水平可以根据包括疾病的种类、疾病的严重程度、药物的活性、对药物的敏感度、给药时间、给药路径以及排出比率、治疗期间、同时使用的药物等的因素及其它药学上公知的因素来确定。
63.所述药剂学组合物可以剂型化为口服剂型(例如,粉末、片剂、胶囊、糖浆、药丸或者颗粒)或者非口服剂型(例如,注射剂),可以制备为全身剂型或局部剂型。
64.所述药剂学组合物可以作为个别治疗剂来给药或者与其它治疗剂一起给药,可以
与现有的治疗剂依次或者同时给药,可以单一或者多重给药。考虑上述所有要素,重要的是在无副作用的情况下给药能够以最少的量得到最大效果的量,其可以通过本领域技术人员容易确定。另外,所述药剂学组合物可以单独使用或者与手术、放射线治疗、激素治疗、化学治疗以及使用生物学反应调节剂的方法联合使用。
65.在本公开的一实现例中,所述组合物为预防或改善肥胖用食品组合物。
66.所述“预防”意指通过给药本公开的组合物来抑制或者延缓肥胖的所有行为。所述“改善”意指通过给药所述组合物来使肥胖好转或者有益改变的所有行为。
67.所述“食品”有肉类、香肠、面包、巧克力、糖类、零食类、饼干类、比萨、方便面、其它面类、口香糖类、包括冰淇淋类的乳制品、各种汤、饮料、茶、饮品剂、酒精饮料、维生素复合剂、健康功能(性)食品以及健康食品等,包括所有通常含义下的食品。
68.所述健康功能(性)食品(functional food)作为与特殊保健用食品(food for special health use)相同的术语,意指除了供应营养之外,加工为有效显示生物体调节功能的药学、医疗效果高的食品。其中,功能(性)意指对人体的结构以及功能调节营养元素或者得到对生理学作用等之类的保健用途有用的效果。所述健康食品(health food)意指相比一般食品具有积极的维持健康或增进健康的效果,健康辅助食品(health supplement food)意指健康辅助目的的食品。根据情况,混用健康功能食品、健康食品、健康辅助食品的术语。
69.所述食品可以通过本领域中通常使用的方法来制备,在所述制备中,可以添加本领域中通常添加的原料以及成分来制备。另外,只要是所述食品的剂型或者认定为食品的剂型,可以不受限制来制备。本发明的食品用组合物可以制备为各种形式的剂型,而且与一般药品不同,是将食品作为原料,从而具有不产生长期服用药品时可能产生的副作用等的优点,而且携带性优异,因此本发明的食品可作为用于增进肥胖的预防或者改善效果的助剂来摄取。
70.在本公开的一实现例中,所述组合物为预防、改善肥胖用饲料组合物。
71.所述“饲料”意指用于家畜的食用、摄取、消化或者对此合适的任意的天然或者人工定食、一餐饭等或者所述一餐饭的成分。所述饲料可以包括饲料添加剂或者辅助饲料。所述饲料的种类不受特别限制,可以使用本技术领域中通常使用的饲料。作为所述饲料的非限制性的示例,可以举出谷物类、根果类、食品加工副产物类、藻类、纤维质类、制药副产物类、油脂类、淀粉类、瓜类或者谷物副产物类等之类的植物性饲料;蛋白质类、无机物类、有机物类、矿物性类、油脂类、单细胞蛋白质类、动物性浮游生物类或者食物类等之类的动物性饲料。它们可以单独使用或者混合2种以上来使用。
72.在本公开的一实现例中,所述绿茶提取物是包括将绿茶用75℃至100℃的蒸汽以1kgf/cm2至2kgf/cm2的压力处理1小时至7小时期间的高温处理步骤来得到。
73.在另一方面,本公开提供一种根据第1项至第12项中的任一项所述的组合物的制备方法,所述组合物的制备方法包括将绿茶用75℃至100℃的蒸汽以1kgf/cm2至2kgf/cm2的压力处理1小时至7小时期间的高温处理步骤。
74.在本公开的一实现例中,在所述高温处理步骤之前,可以还包括向绿茶添加水以及c1至c4的醇中的任一个以上,在50℃至65℃下提取30分钟至4小时而收获第一绿茶提取物的步骤,可以还包括提取之后进行过滤以及减压浓缩而收获第一绿茶提取物的步骤。可以
还包括所述提取之后进行过滤以及减压而去除所述水以及c1至c4的醇中的任一个以上的步骤。
75.所述c1至c4的醇可以是乙醇。在另一方面,所述醇可以是20%以上、30%以上、40%以上、50%以上、60%以上或者70%以上的醇。在又一其它方面,所述醇可以是70%以下、60%以下、50%以下、40%以下或者30%以下的醇。
76.在本公开的一实现例中,收获所述第一绿茶提取物的步骤的提取温度可以是50℃以上、55℃以上、60℃以上、62℃以上、64℃以上;65℃以下、62℃以下、60℃以下、55℃以下、52℃以下,但不限于此。
77.在本公开的一实现例中,收获所述第一绿茶提取物的步骤的提取时间可以是30分钟以上、40分钟以上、50分钟以上、60分钟以上、70分钟以上、80分钟以上、90分钟以上、100分钟以上、120分钟以上、140分钟以上、160分钟以上、180分钟以上、200分钟以上、220分钟以上;240分钟以下、220分钟以下、200分钟以下、180分钟以下、160分钟以下、140分钟以下、120分钟以下、100分钟以下、90分钟以下、80分钟以下、70分钟以下、60分钟以下、50分钟以下、40分钟以下,但不限于此。
78.在本公开的一实现例中,所述高温处理步骤的蒸汽温度为75℃至100℃。更加具体地,可以是75℃以上;100℃以下、98℃以下、95℃以下、90℃以下、85℃以下、80℃以下或者75℃以下,但不限于此。
79.在本公开的一实现例中,所述高温处理步骤的蒸汽压力为1kgf/cm2至2kgf/cm2。更加具体地,可以是1kgf/cm2以上、1.2kgf/cm2以上、1.4kgf/cm2以上或者1.5kgf/cm2以上;2kgf/cm2以下、1.8kgf/cm2以下、1.7kgf/cm2以下或者1.5kgf/cm2以下。
80.在本公开的一实现例中,所述高温处理步骤可以伴随搅拌,所述高温处理步骤的搅拌时间可以是1小时以上、2小时以上、3小时以上、4小时以上或者5小时以上;7小时以下、6小时以下或者5小时以下,但不限于此。
81.在本公开的一实现例中,在所述高温处理步骤之后,可以还包括进行过滤以及减压浓缩的步骤。
82.作为另一方式,本公开提供一种在制备降低体脂用组合物中的含有没食子儿茶素没食子酸酯的绿茶提取物的用途。
83.作为另一方式,本公开提供一种降低体脂方法,包括将作为有效成分包含含有没食子儿茶素没食子酸酯的绿茶提取物的组合物适用于需要它的个体中的步骤。
84.作为另一方式,本公开提供一种用于使用于降低体脂的含有没食子儿茶素没食子酸酯的绿茶提取物。
85.【实施例】
86.以下,通过实施例详细说明本公开。然而,以下实施例仅是有助于全面理解本公开的示例,本公开的内容不限于以下实施例。
87.《制备例1》一般绿茶提取物、后发酵绿茶提取物以及高温处理绿茶提取物的制备
88.1.一般绿茶提取物(green tea extract,gte)的制备
89.向100g的绿茶(camellia sinensis,济州o'sulloc农场,大韩民国)添加1000ml的50%乙醇,在60℃下回流搅拌1小时。将所述试料的温度降低至室温,将通过过滤得到的溶液进行减压蒸馏,收获23g的深褐色粉末的一般公示型绿茶提取物(green tea extract,
gte)(收率为23%)。
90.2.后发酵绿茶提取物(fermented green tea extract,fgt)的制备
91.向100g的绿茶(camellia sinensis,济州o'sulloc农场,大韩民国)添加水而将水分含量调至40重量%。其中,接种5
×
106cfu/g的枯草芽孢杆菌(bacillus subtilis),在50℃下发酵3天之后,在80℃下发酵4天。将发酵的绿茶用80℃的热风干燥至水分含量为4重量%至6重量%之后,在10℃下熟成100天,制备出后发酵绿茶。将1kg的所述后发酵绿茶浸到15l的50%(v/v)乙醇溶液中,在70℃下回流3小时期间之后,在常温下提取12小时。对提取物进行过滤,以真空状态进行减压浓缩并冷冻干燥,制备出粉末形式的后发酵绿茶提取物(fermented green tea extract,fgt)。收率为15%至20%,制得的粉末在4℃下保存至使用之前。
92.3.高温处理绿茶提取物(heat-transformed green tea extract,htgt)的制备
93.为了制备高温处理绿茶提取物,向100g的绿茶(camellia sinensis,济州o'sulloc农场,大韩民国)添加1000ml的50%乙醇,在60℃下回流搅拌1小时,进行过滤以及减压蒸馏,收获第一绿茶提取物。浓缩所述第一绿茶提取物之后,在1.5kgf/cm2的75℃温度的蒸汽下搅拌5小时期间。之后,将温度降低至室温,过滤不溶性物质,进行减压浓缩,收获10g的高温处理绿茶提取物(heat-transformed green tea extract,htgt)。此时,针对按照1小时至7小时的搅拌时间段得到的所述高温处理绿茶提取物,执行与在以下试验例1中相同的成分分析,确认到在第5个小时通过热而表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)向没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)的转换最多,与此同时,8种总儿茶素的量也不再减少,因此将搅拌时间设定为5小时。
94.《试验例1》绿茶提取物的成分分析
95.1.分析方法
96.将在制备例1中制备的绿茶提取物(一般绿茶提取物、后发酵绿茶提取物以及高温处理绿茶提取物)利用0.45μm的pvdf过滤器进行过滤、前处理之后,注入到分析仪(高效液相色谱仪;hplc)中。作为分析中使用的溶剂,使用了hplc级试剂,数据处理使用了沃特世(waters)公司的empower ii程序来执行成分分析。分析仪的条件示出在以下表1中。
97.【表1】
[0098][0099]
2.分析结果
[0100]
在表2中示出所述测定结果光谱。c意指儿茶素,ec意指表儿茶素,gc意指没食子儿茶素,egc意指表没食子儿茶素,cg意指儿茶素没食子酸酯,ecg意指表儿茶素没食子酸酯,gcg意指没食子儿茶素没食子酸酯,egcg意指表没食子儿茶素没食子酸酯。单位全部为该物质相对于绿茶提取物整体重量的重量%。
[0101]
【表2】
[0102][0103]
从上述表2可以确认到,高温处理绿茶提取物(htgt)的组分与一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)的组分不同。具体地,当为高温处理绿茶提取物(htgt)时,相比一般绿茶提取物(gte),egc的含量(3.6重量%)低。另外,可以确认到,相比一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt),egcg的含量(5.3重量%)低,总儿茶素含量(24.6重量%)低,并且进一步生成作为在一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)中未检测到的成分的3种表儿茶素差向异构体。
[0104]
如表2所示,绿茶提取物、后发酵绿茶提取物、高温处理绿茶提取物显示为总儿茶素含量(绿茶提取物为40.4重量%,后发酵绿茶提取物为13.2重量%,高温处理绿茶提取物为24.6重量%)以及表儿茶素的含量(绿茶提取物为39.3重量%,后发酵绿茶提取物为9.9重量%,高温处理绿茶提取物为11.2重量%)不同,作为高温处理绿茶提取物的主要功效成分的egcg以及gcg的含量比率也是19.0:0.3(绿茶提取物)、5.7:3.0(后发酵绿茶提取物)、5.3:5.6(高温处理绿茶提取物)而完全不同。因此,应将所述3种绿茶提取物以及绿茶加工提取物视为具有彼此不同的代谢功效的独立的材料。
[0105]
《参考例1》脂肪细胞的分化
[0106]
利用包含10%的小牛血清(bovine calf serum,bcs;hyclone)、1%的青霉素/链霉素(p/s;sigma aldrich)的dmem(dulbecco’s modified eagle’s medium;sigma aldrich),在培养器中以标准条件(37℃,5%的co2)培养来自3t3-l1小鼠的脂肪细胞株(美国菌种保藏中心;american type culture collection,atcc)。为了细胞分化,在板上100%填满细胞之后,48小时之后替换成添加有10%的胎牛血清(fetal bovine serum,fbs;hyclone)、1%的p/s、0.5mm的3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,ibmx;sigma aldrich)、1μm的地塞米松(dexamethasone;sigma aldrich)、5μg/ml的胰岛素(insulin;sigma aldrich)的dmem培养基,进一步培养48小时。之后,每隔两天替换成包含10%的fbs以及5μg/ml的胰岛素、1%的p/s的培养基,进一步培养10天,诱导脂肪细胞分化。
[0107]
《参考例2》基因表达评价方法
[0108]
利用trizol
tm
试剂(thermo fisher scientific;赛默飞世尔科技)提取rna,利用revertaid
tm
第一链cdna合成试剂盒(revertaid
tm 1st strand cdna synthesis kit;thermo fisher scientific)合成cdna。利用伯乐(bio-rad)公司的cfx96实时定量pcr(real-time quantitative pcr,qpcr)仪器,用看家基因(housekeeping gene;cyclophilin)定量了评价对象基因的表达水平。
[0109]
《试验例2》绿茶提取物的抑制脂质合成基因的表达的功效评价1
[0110]
1.评价方法
[0111]
如参考例1所述,对完成分化的脂肪细胞,分别用10μg/ml、50μg/ml以及100μg/ml(htgt10、htgt50以及htgt100)的制备例1中制备的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0112]
在图1中示出按照参考例2的方法对脂肪合成相关基因(srebp1c、acc、fas以及scd-1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0113]
2.评价结果
[0114]
图1显示,如作为对照组的feno处理组那样,本公开的高温处理绿茶提取物(htgt)的处理浓度依赖性地抑制脂质合成基因的表达。由此可以确认到,包含高温处理绿茶提取物(htgt)的组合物具有优异的抑制脂质的合成或者堆积的功效。
[0115]
《试验例3》绿茶提取物的抑制脂质合成基因的表达的功效评价2
[0116]
如所述表2所示,一般绿茶提取物(gte)的总儿茶素含量为40.4重量%,高温处理绿茶提取物(htgt)的总儿茶素含量为24.6重量%。因此,将一般绿茶提取物(gte)的总儿茶素含量校正(24.6/40.4≒0.61)为与高温处理绿茶提取物(htgt)的总儿茶素含量相同,并执行了如下实验。
[0117]
1.评价方法
[0118]
如参考例1所述,对完成分化的脂肪细胞,分别用61μg/ml以及100μg/ml(gte61以及gte100)的制备例1中制备的一般绿茶提取物(gte)处理24小时,一方面,用100μg/ml(htgt100)的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对
照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0119]
在图2中示出按照参考例2的方法对脂肪合成相关基因(srebp1c、acc以及fas)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0120]
2.评价结果
[0121]
图2显示,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理抑制脂质合成基因的表达。另外,当将一般绿茶提取物(gte)的总儿茶素含量校正为与高温处理绿茶提取物(htgt)的总儿茶素含量相同时,显示为相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理更加优异地抑制脂质合成基因的表达。
[0122]
《试验例4》绿茶提取物的抑制脂质合成或者堆积的功效评价
[0123]
1.评价方法
[0124]
为了确认通过高温处理绿茶提取物(htgt)的抑制脂质合成相关基因的表达实际上是否干涉脂肪合成以及堆积,如参考例1所示,对完成分化的脂肪细胞,分别用10μg/ml、50μg/ml以及100μg/ml(htgt10、htgt50以及htgt100)的制备例1中制备的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0125]
之后,将细胞用磷酸盐缓冲生理盐水(phosphate-buffered saline,pbs;sigma aldrich)清洗2次之后,用福尔马林(formalin)溶液(sigma aldrich)进行固定。15分钟之后,再次用pbs清洗2次之后,利用300nm的尼罗红(nile-red)溶液(sigma aldrich)对细胞内堆积的中性脂肪进行染色。30分钟之后,再次用pbs清洗3次之后,用荧光显微镜观察细胞。在图3中示出显示出脂质的量的图像以及将其定量化的图表。
[0126]
2.评价结果
[0127]
从图3确认到,本公开的高温处理绿茶提取物(htgt)具有在脂肪细胞内浓度依赖性地抑制脂质合成或者堆积的功效。
[0128]
《试验例5》绿茶提取物成分的抑制脂质合成或者堆积的功效评价
[0129]
为了比较基于绿茶提取物的成分中没食子儿茶素没食子酸酯(gcg)以及表没食子儿茶素没食子酸酯(egcg)的含量比的抑制脂质合成或者堆积的功效,执行了如下实验。
[0130]
1.评价方法
[0131]
如参考例1所述,对完成分化的脂肪细胞,用以重量为基准10:0至0:10(10:0、8:2、6:4、5:5、4:6、2:8、0:10)的表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)以及没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)处理24小时。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0132]
之后,将细胞用磷酸盐缓冲生理盐水(phosphate-buffered saline,pbs;sigma aldrich)清洗2次之后,用福尔马林(formalin)溶液(sigma aldrich)进行固定。15分钟之后,再次用pbs清洗2次之后,利用300nm的尼罗红(nile-red)溶液(sigma aldrich)对细胞内堆积的中性脂肪进行染色。30分钟之后,再次用pbs清洗3次之后,用荧光显微镜观察细胞。在图4中示出将脂质的量定量化的图表(***p《0.001vs.(-)、**p《0.01vs.(-)、&&&p《0.001vs.gcg100%(0:10)、&&p《0.01vs.gcg100%(0:10)、&p《0.05vs.gcg100%(0:10))。
[0133]
2.评价结果
[0134]
从图4确认到,当本公开的高温处理绿茶提取物(htgt)的成分中没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的含量比为6:4与4:6之间时,抑制脂质的合成或者堆积的功效优异。
[0135]
《试验例6》绿茶提取物的增加脂肪酸氧化基因的表达的功效评价1为了确认基于本公开的高温处理绿茶提取物(htgt)的处理浓度的增加脂肪酸氧化基因的表达的功效,执行了如下实验。
[0136]
1.评价方法
[0137]
如参考例1所述,对完成分化的脂肪细胞,分别用10μg/ml、50μg/ml以及100μg/ml(htgt10、htgt50以及htgt100)的制备例1中制备的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0138]
利用trizol
tm
试剂(thermo fisher scientific;赛默飞世尔科技)提取rna,利用revertaid
tm
第一链cdna合成试剂盒(revertaid
tm 1st strand cdna synthesis kit;thermo fisher scientific)合成cdna。利用伯乐(bio-rad)公司的cfx96实时定量pcr(real-time quantitative pcr,qpcr)仪器,用看家基因(housekeeping gene;cyclophilin)定量了脂肪酸氧化相关基因(aco、cpt1以及mcad)的表达水平。在图5中示出其结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0139]
2.评价结果
[0140]
图5显示,如作为对照组的feno处理组那样,本公开的高温处理绿茶提取物(htgt)的处理浓度依赖性地增加脂肪酸氧化基因的表达。由此可以预测到,包含高温处理绿茶提取物(htgt)的组合物具有优异的脂肪酸氧化功效。
[0141]
《试验例7》绿茶提取物的增加脂肪酸氧化基因的表达的功效评价2
[0142]
为了比较本公开的高温处理绿茶提取物(htgt)、一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)的增加脂肪酸氧化基因的表达的功效,执行了如下实验。
[0143]
1.评价方法
[0144]
如参考例1所述,对完成分化的脂肪细胞,分别用100μg/ml(gte100、fgt100以及htgt100)的制备例1中制备的一般绿茶提取物(gte)、后发酵绿茶提取物(fgt)、高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了100μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0145]
在图6中示出按照参考例2的方法对脂肪酸氧化相关基因(pgc-1α、aco以及cpt1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0146]
2.评价结果
[0147]
图6显示,相比一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)的处理,本公开的高温处理绿茶提取物(htgt)的处理优异地增加脂肪酸氧化基因的表达。由此可以确认到,包含高温处理绿茶提取物(htgt)的组合物具有优异的脂肪酸氧化功效。
[0148]
《试验例8》绿茶提取物成分的增加脂肪酸氧化基因的表达的功效评价3
[0149]
为了比较基于绿茶提取物的成分中没食子儿茶素没食子酸酯(gcg)以及表没食子儿茶素没食子酸酯(egcg)的含量乃至含量比的增加脂肪酸氧化基因的表达的功效,执行了如下实验。
[0150]
1.评价方法
[0151]
如参考例1所述,对完成分化的脂肪细胞,按照示出一般绿茶提取物(gte)、后发酵绿茶提取物(fgt)、高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的成分含量的所述表2,用gte以及egcg(gte:0.3重量%的gcg、19.0重量%的egcg;fgt:3.0重量%的gcg、5.7重量%的egcg;htgt:5.6重量%的gcg、5.3重量%的egcg)处理24小时。作为用于确认实验结果的对照组,使用了100μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0152]
在图7中示出按照参考例2的方法对脂肪酸氧化相关基因(pgc-1α、aco以及cpt1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0153]
2.评价结果
[0154]
从图7可以预测到,显示为本公开的高温处理绿茶提取物(htgt)的处理优异地增加脂肪酸氧化基因的表达的所述试验例7的结果缘于本公开的高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的含量乃至含量比。
[0155]
《试验例9》绿茶提取物的增加脂肪酸氧化基因的表达的功效评价3如上述表2所示,一般绿茶提取物(gte)的总儿茶素含量为40.4重量%,高温处理绿茶提取物(htgt)的总儿茶素含量为24.6重量%。因此,将一般绿茶提取物(gte)的总儿茶素含量校正(24.6/40.4≒0.61)为与高温处理绿茶提取物(htgt)的总儿茶素含量相同,并执行了如下实验。
[0156]
1.评价方法
[0157]
如参考例1所述,对完成分化的脂肪细胞,分别用61μg/ml以及100μg/ml(gte61以及gte100)的制备例1中制备的一般绿茶提取物(gte)处理24小时,一方面,用100μg/ml(htgt100)的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0158]
在图8中示出按照参考例2的方法对脂肪酸氧化相关基因(aco以及cpt1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0159]
2.评价结果
[0160]
图8显示,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理优异地增加脂肪酸氧化基因的表达。另外,当将一般绿茶提取物(gte)的总儿茶素含量校正为与高温处理绿茶提取物(htgt)的总儿茶素含量相同时,显示为相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理更加优异地增加脂肪酸氧化基因的表达。
[0161]
《试验例10》绿茶提取物的促进中性脂肪分解的功效评价
[0162]
1.评价方法
scientific)染料(dye)对线粒体进行染色之后,测定荧光值进行定量。一方面,为了一同确认随着线粒体数的增加是否促进能量的生成,利用atp测定试剂盒(atp assay kit,sigma aldrich)观察细胞内atp量。在图11中示出其结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0178]
2.评价结果
[0179]
从图11可以确认到,相比一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)的处理,本公开的高温处理绿茶提取物(htgt)的处理在脂肪细胞中优异地增加线粒体的量乃至活性,并优异地促进atp的生成。
[0180]
《试验例13》绿茶提取物成分的促进线粒体的活性的功效以及促进atp生成的功效评价
[0181]
为了比较基于绿茶提取物的成分中没食子儿茶素没食子酸酯(gcg)以及表没食子儿茶素没食子酸酯(egcg)的含量乃至含量比的促进线粒体的活性的功效以及促进atp生成的功效,执行了如下实验。
[0182]
1.评价方法
[0183]
如参考例1所述,对完成分化的脂肪细胞,按照示出一般绿茶提取物(gte)、后发酵绿茶提取物(fgt)、高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的成分含量的所述表2,用gte以及egcg(gte:0.3重量%的gcg、19.0重量%的egcg;fgt:3.0重量%的gcg、5.7重量%的egcg;htgt:5.6重量%的gcg、5.3重量%的egcg)处理24小时。作为用于确认实验结果的对照组,使用了100μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0184]
接着,使用mitotracker
tm green fm(invitrogen by thermo fisher scientific)染料(dye)对线粒体进行染色之后,测定荧光值进行定量。一方面,为了一同确认随着线粒体数的增加是否促进能量的生成,利用atp测定试剂盒(atp assay kit,sigma aldrich)观察细胞内atp量。在图12中示出其结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0185]
2.评价结果
[0186]
从图12可以预测到,显示为本公开的高温处理绿茶提取物(htgt)的处理在脂肪细胞中优异地增加线粒体的量乃至活性,并优异地促进atp的生成,所述试验例12的结果缘于本公开的高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的含量乃至含量比。
[0187]
《试验例14》绿茶提取物的促进线粒体的活性的功效以及促进atp生成的功效评价3
[0188]
如上述表2所示,一般绿茶提取物(gte)的总儿茶素含量为40.4重量%,高温处理绿茶提取物(htgt)的总儿茶素含量为24.6重量%。因此,将一般绿茶提取物(gte)的总儿茶素含量校正(24.6/40.4≒0.61)为与高温处理绿茶提取物(htgt)的总儿茶素含量相同,并执行了如下实验。
[0189]
1.评价方法
[0190]
如参考例1所述,对完成分化的脂肪细胞,分别用61μg/ml以及100μg/ml(gte61以及gte100)的制备例1中制备的一般绿茶提取物(gte)处理24小时,一方面,用100μg/ml(htgt100)的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0191]
接着,使用mitotracker
tm green fm(invitrogen by thermo fisher scientific)染料(dye)对线粒体进行染色之后,测定荧光值进行定量。一方面,为了一同确认随着线粒体数的增加是否促进能量的生成,利用atp测定试剂盒(atp assay kit,sigma aldrich)观察细胞内atp量。在图13中示出其结果(***p《0.001vs.(-)、**p《0.01vs.(-))。
[0192]
2.评价结果
[0193]
图13显示,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理在脂肪细胞中增加线粒体的量乃至活性,并促进atp的生成。另外,当将一般绿茶提取物(gte)的总儿茶素含量校正为与高温处理绿茶提取物(htgt)的总儿茶素含量相同时,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理显示为更加优异地增加线粒体的量乃至活性,并促进atp的生成。
[0194]
《试验例15》绿茶提取物成分的增加褐色脂肪细胞相关基因的表达的功效评价1
[0195]
1.评价方法
[0196]
如参考例1所述,对完成分化的脂肪细胞,分别用0.1μm、1μm、5μm、10μm以及20μm的显示尤其在高温处理绿茶提取物(htgt)中含得多(表2)的没食子儿茶素没食子酸酯(gallocatechingallate,gcg)处理24小时。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0197]
在图14中示出按照参考例2的方法对作为褐色脂肪细胞相关标记的ucp1(uncoupling protein 1,解偶联蛋白1)、cidea(cell death-inducing dffa-like effector a,细胞死亡诱导dffa样效应因子a)、cox8b(cytochrome c oxidase subunit 8b,细胞色素c氧化酶亚基8b)、dio2(iodothyronine deiodinase 2,甲状腺素去碘酶2)、e1ov13(elongation of very long chain fatty acids,超长链脂肪酸的延伸)、pgc1a(peroxisome proliferator-activated receptor c coactivator 1a,过氧化物酶体增殖物激活受体c辅助活子1a)以及prdm16(pr domain containing 16,pr结构域蛋白16)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0198]
2.评价结果
[0199]
图14显示,显示为尤其在本公开的高温处理绿茶提取物(htgt)中含得多的没食子儿茶素没食子酸酯(gallocatechingallate,gcg)的处理增加与脂肪分解相关的elovl3以及作为解偶联蛋白1的ucp1的表达。然而,观察到与向褐色脂肪细胞的分化相关的prdm16的表达变化不大,从而预测gcg相比向褐色脂肪细胞的分化,诱导通过将白色脂肪细胞进行米色脂肪细胞化的作用而起到与褐色脂肪细胞类似的作用的脂肪细胞的能量代谢转换(fat transformation),所谓米色脂肪细胞化现象。
[0200]
《试验例16》绿茶提取物的增加褐色脂肪细胞相关基因的表达的功效评价1
[0201]
为了比较本公开的高温处理绿茶提取物(htgt)、一般绿茶提取物(gte)以及后发
酵绿茶提取物(fgt)的增加褐色脂肪细胞相关基因的表达的功效,执行了如下实验。
[0202]
1.评价方法
[0203]
如参考例1所述,对完成分化的脂肪细胞,分别用100μg/ml(gte100、fgt100以及htgt100)的制备例1中制备的一般绿茶提取物(gte)、后发酵绿茶提取物(fgt)、高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了100μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0204]
在图15中示出按照参考例2的方法定量作为褐色脂肪细胞相关标记的ucp1(uncoupling protein 1,解偶联蛋白1)的表达水平的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0205]
2.评价结果
[0206]
图15显示,相比一般绿茶提取物(gte)以及后发酵绿茶提取物(fgt)的处理,本公开的高温处理绿茶提取物(htgt)的处理优异地增加作为解偶联蛋白1的ucp1的表达。
[0207]
《试验例17》绿茶提取物成分的增加褐色脂肪细胞相关基因的表达的功效评价2
[0208]
为了比较基于绿茶提取物的成分中没食子儿茶素没食子酸酯(gcg)以及表没食子儿茶素没食子酸酯(egcg)的含量乃至含量比的增加褐色脂肪细胞相关基因的表达的功效,执行了如下实验。
[0209]
1.评价方法
[0210]
如参考例1所述,对完成分化的脂肪细胞,按照示出一般绿茶提取物(gte)、后发酵绿茶提取物(fgt)、高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的成分含量的所述表2,用gte以及egcg(gte:0.3重量%的gcg、19.0重量%的egcg;fgt:3.0重量%的gcg、5.7重量%的egcg;htgt:5.6重量%的gcg、5.3重量%的egcg)处理24小时。作为用于确认实验结果的对照组,使用了100μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0211]
在图16中示出按照参考例2的方法对作为褐色脂肪细胞相关标记的ucp1(uncoupling protein 1,解偶联蛋白1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0212]
2.评价结果
[0213]
从图16可以预测到,显示为本公开的高温处理绿茶提取物(htgt)的处理优异地增加作为解偶联蛋白1的ucp1的表达的所述试验例16的结果缘于本公开的高温处理绿茶提取物(htgt)的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)的含量乃至含量比。
[0214]
《试验例18》绿茶提取物的增加褐色脂肪细胞相关基因的表达的功效评价2
[0215]
如上述表2所示,一般绿茶提取物(gte)的总儿茶素含量为40.4重量%,高温处理绿茶提取物(htgt)的总儿茶素含量为24.6重量%。因此,将一般绿茶提取物(gte)的总儿茶素含量校正(24.6/40.4≒0.61)为与高温处理绿茶提取物(htgt)的总儿茶素含量相同,并执行了如下实验。
[0216]
1.评价方法
[0217]
如参考例1所述,对完成分化的脂肪细胞,分别用61μg/ml以及100μg/ml(gte61以及gte100)的制备例1中制备的一般绿茶提取物(gte)处理24小时,一方面,用100μg/ml(htgt100)的高温处理绿茶提取物(htgt)处理24小时。作为用于确认实验结果的对照组,使用了30μm的抑制脂肪合成并促进脂肪酸氧化的非诺贝特(fenofibrate,feno)。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0218]
在图17中示出按照参考例2的方法对作为褐色脂肪细胞相关标记的ucp1(uncoupling protein 1,解偶联蛋白1)的表达水平进行定量的结果(***p《0.001vs.(-)、**p《0.01vs.(-)、*p《0.05vs.(-))。
[0219]
2.评价结果
[0220]
图17显示,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理优异地增加作为解偶联蛋白1的ucp1的表达。另外,当将一般绿茶提取物(gte)的总儿茶素含量校正为与高温处理绿茶提取物(htgt)的总儿茶素含量相同时,相比一般绿茶提取物(gte)的处理,本公开的高温处理绿茶提取物(htgt)的处理显示为更加优异地增加作为解偶联蛋白1的ucp1的表达。
[0221]
《试验例19》绿茶提取物的促进脂肪细胞内能量代谢活性的功效评价
[0222]
为了确认显示为尤其在本公开的高温处理绿茶提取物(htgt)中含得多的没食子儿茶素没食子酸酯(gallocatechingallate,gcg)实际上是否增加细胞的有氧呼吸,执行了如下实验。
[0223]
1.评价方法
[0224]
如参考例1所述,对完成分化的脂肪细胞,用20μm的显示为尤其在高温处理绿茶提取物(htgt)中含得多(表2)的没食子儿茶素没食子酸酯(gallocatechingallate,gcg)处理24小时。作为阴性对照组,对赋形剂(vehicle;蒸馏水)进行了处理。
[0225]
接着,利用xf分析仪(xf analyzer,agilent,圣克拉拉,加利福尼亚州,美国)测定氧气浓度以及耗氧率(oxygen consumption rate,ocr)。更加具体地,在a、b、c各个时间点依次注入1.5μm的寡霉素a(oligomycin a)、1.5μm的羰基氰基p-(三氟甲氧基)苯基亚肼基(carbonyl cyanide p-(trifluoromethoxy)phenylhydrazone,fccp)以及分别为0.5μm的鱼藤酮/抗霉素a(rotenone/antimycin a)。
[0226]
ocr根据蛋白质浓度被标准化。在图18中示出随时间的ocr、atp生成量(atp production)、质子漏(proton leak)(***p《0.001、**p《0.01、*p《0.05)。
[0227]
2.评价结果
[0228]
从图18可以确认到,没食子儿茶素没食子酸酯(gcg)的处理与是否用调整线粒体活性的各种药物(寡霉素、fccp、鱼藤酮/抗霉素a)进行处理无关而增加ocr,通过所述细胞呼吸的结果,能量的生成(atp production,atp生成量)以及能量的解偶联(proton leak,质子漏)全部增加。由此可以确认到,没食子儿茶素没食子酸酯(gcg)的处理在脂肪细胞中实际上增加有氧呼吸。
[0229]
以下,说明根据本发明的组合物的剂型例,然而药剂学组合物以及食品组合物可以应用为各种剂型,这仅用于具体说明而不用于限定本发明。
[0230]
【剂型例1】丸剂的制备
[0231]
按照以下表3中记载的组分,通过常规方法制备丸剂。
[0232]
【表3】
[0233][0234][0235]
【剂型例2】片剂的制备
[0236]
按照以下表4中记载的组分,通过常规方法制备片剂。
[0237]
【表4】
[0238]
成分含量(重量%)高温处理绿茶提取物(htgt)24乳糖20.5糊精20麦芽糖醇粉末20木糖醇粉末13糖酯(sugar ester)2.5
[0239]
【剂型例3】颗粒剂的制备
[0240]
按照以下表5中记载的组分,通过常规方法制备颗粒剂。
[0241]
【表5】
[0242]
成分含量(重量%)高温处理绿茶提取物(htgt)24木糖醇11益寿糖65
[0243]
【剂型例4】注射剂的制备
[0244]
按照以下表6中记载的组分,通过常规方法制备注射剂。
[0245]
【表6】
[0246]
成分含量(mg)高温处理绿茶提取物(htgt)8~40注射用灭菌蒸馏水适量ph调节剂适量
[0247]
【剂型例5】饮品剂的制备
[0248]
按照以下表7中记载的组分,通过常规方法制备饮品剂。
[0249]
【表7】
[0250][0251][0252]
在各种方式中,本公开至少涉及以下方式,至少包括以下方式。
[0253]
【方式1】一种降低体脂用组合物,作为有效成分包含以提取物的总重量为基准含有4重量%以上的没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)的绿茶提取物。
[0254]
【方式2】根据方式1所述的组合物,其中,所述绿茶提取物以提取物的总重量为基准,以4重量%至15重量%的含量含有所述没食子儿茶素没食子酸酯。
[0255]
【方式3】根据方式1或2所述的组合物,其中,所述绿茶提取物以提取物的总重量为基准,以4重量%至15重量%的含量含有表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)。
[0256]
【方式4】根据方式1至3中任一项所述的组合物,其中,以1:0.33至3的重量比含有表没食子儿茶素没食子酸酯以及没食子儿茶素没食子酸酯。
[0257]
【方式5】根据方式1至4中任一项所述的组合物,其中,所述绿茶提取物以提取物的总重量为基准,以19重量%至30重量%的含量含有儿茶素(catechin,c)、表儿茶素(epicatechin,ec)、没食子儿茶素(gallocatechin,gc)、表没食子儿茶素(epigallocatechin,egc)、儿茶素没食子酸酯(catechin gallate,cg)、表儿茶素没食子酸酯(epicatechin gallate,ecg)、没食子儿茶素没食子酸酯(gallocatechin gallate,gcg)以及表没食子儿茶素没食子酸酯(epigallocatechin gallate,egcg)。
[0258]
【方式6】根据方式1至5中任一项所述的组合物,其中,所述组合物为促进脂肪细胞内中性脂肪分解用组合物。
[0259]
【方式7】根据方式1至6中任一项所述的组合物,其中,所述组合物增加选自由pgc-1α、aco、cpt1以及mcad而成的组的一种以上的脂肪酸氧化基因的表达。
[0260]
【方式8】根据方式1至7中任一项所述的组合物,其中,所述组合物减小脂肪细胞的大小。
[0261]
【方式9】根据方式1至8中任一项所述的组合物,其中,所述组合物为抑制脂肪细胞内中性脂肪合成或者堆积用组合物。
[0262]
【方式10】根据方式1至9中任一项所述的组合物,其中,所述组合物抑制选自由srebp1c、acc、fas以及scd-1而成的组的一种以上的脂质合成基因的表达。
[0263]
【方式11】根据方式1至10中任一项所述的组合物,其中,所述组合物为促进脂肪细胞内线粒体的活性用组合物。
[0264]
【方式12】根据方式1至11中任一项所述的组合物,其中,所述组合物为增加基础代谢量用组合物。
[0265]
【方式13】根据方式1至12中任一项所述的组合物,其中,所述组合物诱导白色脂肪
细胞的米色脂肪细胞化。
[0266]
【方式14】根据方式1至13中任一项所述的组合物,其中,所述组合物为预防、改善或者治疗肥胖用药剂学组合物。
[0267]
【方式15】根据方式1至14中任一项所述的组合物,其中,所述组合物为预防或者改善肥胖用食品组合物。
[0268]
【方式16】根据方式1至15中任一项所述的组合物,其中,所述绿茶提取物包括将绿茶用75℃至100℃的蒸汽以1kgf/cm2至2kgf/cm2的压力处理1小时至7小时的高温处理步骤而得到。
[0269]
【方式17】一种组合物的制备方法,所述组合物为根据方式1至13中任一项所述的组合物,所述组合物的制备方法包括:将绿茶用75℃至100℃的蒸汽以1kgf/cm2至2kgf/cm2的压力处理1小时至7小时的高温处理步骤。
[0270]
通过所述提及的优选实施例说明了本发明,然而可以在不脱离本发明的主旨和范围的情况下进行各种修改或者变形。因此,在所附的权利要求书中包括属于本发明的主旨的这种修改或者变形。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。