通过肿瘤中使用il-7融合蛋白增加淋巴细胞数的方法
技术领域
1.本专利申请要求由2019年9月4日提交的第62/895787号美国临时申请和2019年11月15日提交第62/935828号美国临时申请提供。
背景技术:
2.t细胞识别癌抗原,破坏癌细胞,分化增殖为记忆细胞,从而在攻击癌症的免疫应答中发挥关键作用。因此,多样化识别各种抗原在t细胞癌细胞中的表达,扩大t细胞克隆以响应癌症特异抗原并在癌症组织中分化为记忆t细胞可最大限度的提高抗癌治疗效果。此外,标准抗癌疗法——细胞毒性化疗和放疗均会破坏血液中的骨髓和免疫细胞,从而使抗癌免疫功能所需的t细胞缺失,因而抵消了免疫治疗药物的抗癌作用。最近一份报告显示,癌症患者缺失t细胞可导致化疗缓解率及患者存活率下降。目前,il-2是唯一被批准作为诱导t细胞增殖和功能亢进的细胞因子疗法。但是,诱导免疫抑制的调节t细胞的增殖限制了il-2疗法的疗效,过度免疫反应引起的细胞因子风暴和毛细血管渗漏综合征等严重副作用限制了il-2的临床应用。
3.与之相反的是,白细胞介素-7(il-7)是t细胞的重要生长和激活因子,它主要参与了初始t细胞和记忆t细胞的分化、增殖和存活,这些细胞在参与抗原识别和寻的同时摧毁癌细胞。白细胞介素-7不会诱导调节t细胞增殖,从而抑制效应t细胞的激活。此外,当体内il-7水平升高时,t细胞增殖,il-7与主要表达于增殖t细胞中的il-7受体(cd127)结合从而入细胞内(胞吞转运)。它维持体内平衡,被称为体内平衡细胞因子。因此,过度免疫反应引起的细胞因子风暴等严重免疫相关副作用一直是细胞因子治疗在临床安全性上主要问题,而这些严重免疫相关副作用在cytheris先前进行重组人il-7(rhil-7)临床试验(代号为cyt107)中则未见报道。
4.il-7由基因il7编码并与il-7受体(cd127)结合。il-7是一种免疫刺激细胞因子,可促进b细胞和t细胞介导的免疫反应。il-7在适应性免疫系统中起重要作用。
5.本文引用了同时待审申请(美国专利申请号15/126313)的全部内容,该申请提出了具有更强表达及半衰期的修饰il-7蛋白,含有所述修饰il-7的融合蛋白以及其它们生成方法。
技术实现要素:
6.技术问题
7.本发明提供了一种通过采用修饰il-7或含有所述修饰il-7的融合蛋白来增加淋巴细胞数的方法。
8.技术方案
9.本发明的一个实施例提供了一种在有需要的受试者中增加淋巴细胞数的方法,包括对受试者给予修饰il-7或其融合蛋白治疗。
10.受试者可以是患有癌症或恶性肿瘤的哺乳类动物。癌症可以是实体瘤。在本发明
的一个示例性实施方案中,实体瘤可以是局部晚期或转移性实体瘤或恶性胶质瘤。
11.在本发明一个实施例中,受试者可以是人。
12.在本发明一个实施方案中,受试者可能先前或正同时进行癌症治疗。修饰il-7或其融合蛋白可以单独或与其它抗癌药物同时使用。
13.因此,本公开整体上包括以下实施例。
14.1.一种用于在有需要的受试者中增加淋巴细胞数的方法,包括给予
15.(i)下式(i)所示的修饰白细胞介素-7:
16.a-il-7
ꢀꢀꢀꢀ
式(i)
17.其中a是由1个至10个氨基酸残基组成的寡肽,且
18.il-7是能够与il-7受体结合的多肽;或者
19.(ii)白细胞介素-7融合蛋白,包含:
20.第一结构域,所述第一结构域含有式(i)所示的修饰白细胞介素-7;
21.第二结构域,所述第二结构域含有1个至10个氨基酸残基组成的寡肽,所述氨基酸残基包括蛋氨酸、甘氨酸或其组合;以及
22.延长白细胞介素-7融合蛋白半衰期的第三结构域,
23.所述受试者的给药剂量为600μg/kg以上。
24.2.上述1的方法中,所述受试者为患有癌症、感染、右心室慢性衰竭、霍奇金病和淋巴系统癌症、白血病、胸导管渗漏或破裂、抗癌药(如:化疗)、抗病毒剂或糖皮质激素等处方药副作用、低蛋白饮食导致的营养不良、放疗、尿毒症、自身免疫性疾病、免疫缺陷综合征、压力大、创伤、胸腺切除或其组合病症;或特发性急性辐射综合征(ars)或其组合病症的患者。
25.3.上述1或2的方法中,il-7的氨基酸序列选自由seq id no:1至seq id no:6组成的组中。
26.4.上述1至3中任一方法中,a与il-7的n端连接。
27.5.上述1至4任一方法中,a为蛋氨酸(m)、甘氨酸(g)、蛋氨酸-蛋氨酸、甘氨酸-甘氨酸、蛋氨酸-甘氨酸、甘氨酸-蛋氨酸、蛋氨酸-蛋氨酸-蛋氨酸、蛋氨酸-蛋氨酸-甘氨酸、蛋氨酸-甘氨酸-蛋氨酸、甘氨酸-蛋氨酸-蛋氨酸、蛋氨酸-甘氨酸-甘氨酸、甘氨酸-蛋氨酸-甘氨酸、甘氨酸-甘氨酸-蛋氨酸、甘氨酸-甘氨酸-甘氨酸、mmmm、mgmm、mggm、mggg、mgmg、gmmm、gmgg、gggg、mmmmm、mmgmm、mmggm、mgmmg、mmmmg、ggggg、ggmmm、gggmg、mgmgmg、mmmggg、mmggmm、ggmmgg、mgmgmgmg、mmmmgggg、mmggmmgg、mmmmgggg、mgmgmgmgmg或/和mmmmmggggg。
28.6.上述5的方法中,所述第三结构域与所述第一结构域或所述第二结构域的n端或c端连接。在本发明的一个实施例中,第三结构域与第二结构域的c端连接。
29.7.上述1至6中任一方法,所述第三结构域为选自由免疫球蛋白的fc区或其部分、白蛋白、白蛋白结合多肽、pro/ala/ser(pas)、人绒毛膜促性腺激素β亚基的c端肽(ctp)、聚乙二醇(peg)、非结构化亲水长氨基酸序列(xten)、羟乙基淀粉(hes)、白蛋白结合小分子及其组合组成的组中的一种。
30.8.上述1至7中任一方法中,所述第三结构域包含修饰免疫球蛋白的fc区。
31.9.上述1至8中任一方法中,所述修饰免疫球蛋白选自由igg1、igg2、igg3、igg4、iga1、iga2、igd、ige及其组合组成的组中。
7融合蛋白的给药频率是每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周或12周给药2次或多次。
55.21.上述1至19的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率是每间隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
56.22.上述1至21的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药方式为:肠外、肌内、皮下、眼部、静脉、腹腔、皮内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内或肿瘤内给药。
57.23.上述1至22的任一方法包括给予所述(ii)白细胞介素-7融合蛋白。
58.24.上述1至23的任一方法中,所述(i)修饰白细胞介素-7的氨基酸序列为seq id no:18,所述(ii)白细胞介素-7融合蛋白的氨基酸序列为seq id no:24。
59.25.上述1至24的任一方法中,根据4.0版不良事件通用术语标准(ctcae)测定,所述受试者的血液或血清中淋巴细胞数为1000个/μl以下。
60.26.上述1至25的任一方法中,所述淋巴细胞是t细胞。
61.27.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为720μg/kg,给药频率为每隔1周、2周、3周或4周左右给药2次或多次。
62.28.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为840μg/kg,给药频率为每隔2周、3周、4周或5周左右给药2次或多次。
63.29.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为960μg/kg,给药频率为每隔2周、3周、4周、5周或6周左右给药2次或多次。
64.30.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1200μg/kg,给药频率为每隔3周、4周、5周、6周、7周或8周左右给药2次或多次。
65.31.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1440μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、10周、12周、或2个月、3个月左右给药2次或多次。
66.32.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量大于约600μg/kg、大于约700μg/kg、大于约800μg/kg、大于约900μg/kg、大于约1000μg/kg、大于约1100μg/kg、大于约1200μg/kg、大于约1300μg/kg、大于约1400μg/kg、大于约1500μg/kg、大于约1600μg/kg、大于约1700μg/kg、大于约1800μg/kg、大于约1900μg/kg,或大于约2000μg/kg。
67.33.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为:610μg/kg至1200μg/kg、650μg/kg至1200μg/kg、700μg/kg至1200μg/kg、750μg/kg至1200μg/kg、800μg/kg至1200μg/kg、850μg/kg至1200μg/kg、900μg/kg至1200μg/kg、950μg/kg至1200μg/kg、1000μg/kgkg至1200μg/kg、1050μg/kg至1200μg/kg、1100μg/kg至1200μg/kg、1200μg/kg至2000μg/kg、1300μg/kg至2000μg/kg、1500μg/kg至
2000μg/kg、1700μg/kg至2000μg/kg、610μg/kg至1000μg/kg、650μg/kg至1000μg/kg、700μg/kg至1000μg/kg、750μg/kg至1000μg/kg、800μg/kg至1000μg/kg、850μg/kg至1000μg/kg、900μg/kgkg至1000μg/kg、950μg/kg至1000μg/kg。
68.34.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为700μg/kg至900μg/kg、750μg/kg至950μg/kg、700μg/kg至850μg/kg、750μg/kg至850μg/kg、700μg/kg至800μg/kg、800μg/kg至900μg/kg、750μg/kg至850μg/kg、850μg/kg至950μg/kg。
69.35.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为:650μg/kg、680μg/kg、700μg/kg、720μg/kg、740μg/kg、750μg/kg、760μg/kg、780μg/kg、800μg/kg、820μg/kg、840μg/kg、850μg/kg、860μg/kg、880μg/kg、900μg/kg、920μg/kg、940μg/kg、950μg/kg、960μg/kg、980μg/kg、1000μg/kg、1020μg/kg、1040μg/kg、1060μg/kg、1080μg/kg、1100μg/kg、1120μg/kg、1140μg/kg、1160μg/kg、1180μg/kg、1200μg/kg、1220μg/kg、1240μg/kg、1260μg/kg、1280μg/kg、1300μg/kg、1320μg/kg、1340μg/kg、1360μg/kg、1380μg/kg、1400μg/kg、1420μg/kg、1440μg/kg、1460μg/kg、1480μg/kg、1500μg/kg、1520μg/kg、1540μg/kg、1560μg/kg、1580μg/kg、1600μg/kg、1620μg/kg、1640μg/kg、1660μg/kg、1680μg/kg、1700μg/kg、1720μg/kg、1740μg/kg、1760μg/kg、1780μg/kg、1800μg/kg、1820μg/kg、1840μg/kg、1860μg/kg、1880μg/kg、1900μg/kg、1920μg/kg、1940μg/kg、1960μg/kg、1980μg/kg或2000μg/kg。
70.36.上述32至35的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率为:每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、或每12周一次。
71.37.上述26的方法中,所述t细胞是cd4
t细胞和/或cd8
t细胞。
72.38.上述26的方法中,所述t细胞是cd4
/cd8
t细胞。
73.39.上述1至38的任一方法中,所述受试者的血液中淋巴细胞数为800个/μl以下。
74.40.上述1至39的任一方法中,所述受试者的血液中淋巴细胞数为500个/μl以下。
75.41.上述1至40的任一方法中,所述受试者的血液中淋巴细胞数为200个/μl以下。
76.42.上述15至41的任一方法中,对所述受试者同时给予抗癌药治疗。
77.43.上述42的方法中,所述抗癌药是抗癌化合物。
78.44.上述1至43的任一方法中,给予所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白治疗后肿瘤浸润淋巴细胞(tils)的数量与给药前的tils数量相比有所增加。
79.45.上述1至44的任一方法中,所述til是cd4
til。
80.46.上述1至44的任一方法中,所述til是cd8
til。
81.47.上述44至46的任一方法中,给药后til数量至少增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、125%、150%、200%、250%或300%。
82.48.上述1至26的任一方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为:650μg/kg至680μg/kg、680μg/kg至700μg/kg、700μg/kg至720μg/kg、720μg/kg至740μg/kg、740μg/kg至750μg/kg、750μg/kg至760μg/kg、760μg/kg至780μg/kg、780μg/kg至800μg/kg、800μg/kg至820μg/kg、820μg/kg至840μg/kg、840μg/kg至850μ
g/kg、850μg/kg至860μg/kg、860μg/kg至880μg/kg、880μg/kg至900μg/kg、900μg/kg至920μg/kg、920μg/kg至940μg/kg、940μg/kg至950μg/kg、950μg/kg至960μg/kg、960μg/kg至980μg/kg、980μg/kg至1000μg/kg、1000μg/kg至1020μg/kg、1020μg/kg至1040μg/kg、1040μg/kg至1060μg/kg、1060μg/kg至1080μg/kg、1080μg/kg至1100μg/kg、1100μg/kg至1120μg/kg、1120μg/kg至1140μg/kg、1140μg/kg至1160μg/kg、1160μg/kg至1180μg/kg、1180μg/kg至1200μg/kg、1200μg/kg至1220μg/kg、1220μg/kg至1240μg/kg、1240μg/kg至1260μg/kg、1260μg/kg至1280μg/kg、1280μg/kg至1300μg/kg、1300μg/kg至1320μg/kg、1320μg/kg至1340μg/kg、1340μg/kg至1360μg/kg、1360μg/kg至1380μg/kg、1380μg/kg至1400μg/kg、1400μg/kg至1420μg/kg、1420μg/kg至1440μg/kg、1440μg/kg至1460μg/kg、1480μg/kg、1480μg/kg至1500μg/kg、1500μg/kg至1520μg/kg、1520μg/kg至1540μg/kg、1540μg/kg至1560μg/kg、1560μg/kg至1580μg/kg、1580μg/kg至1600μg/kg、1600μg/kg至1620μg/kg、1620μg/kg至1640μg/kg、1640μg/kg至1660μg/kg、1660μg/kg至1680μg/kg、1680μg/kg至1700μg/kg、1700μg/kg至1720μg/kg、1720μg/kg至1740μg/kg、1740μg/kg至1760μg/kg、1760μg/kg至1780μg/kg、1780μg/kg至1800μg/kg、1800μg/kg至1820μg/kg、1820μg/kg至1840μg/kg、1840μg/kg至1860μg/kg、1860μg/kg至1880μg/kg、1880μg/kg至1900μg/kg、1900μg/kg至1920μg/kg、1920μg/kg至1940μg/kg、1940μg/kg至1960μg/kg、1960μg/kg至1980μg/kg或1980μg/kg至2000μg/kg。
83.49.上述48的方法中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率为:按照上述剂量每隔2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给药2次、3次、4次或5次。
附图说明
84.图1a、图1b和图1c分别显示大鼠中通过iv、sc和im途径的药代动力学曲线。
85.图2a和图2b分别用线性标度和对数标度按剂量显示了gx-i7浓度-时间曲线。
86.图3a和图3b分别显示血清暴露量(c
max
和auc
last
)与剂量相关性。
87.图4a和图4b显示低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组中淋巴细胞绝对数(alc)较基线的变化。图4a显示实体癌患者组的结果,图4b显示恶性胶质瘤患者组的结果。
88.图5a和图5b显示低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组中cd3
计数较基线的变化。图5a显示实体癌患者组的结果,图5b显示恶性胶质瘤患者组的结果。
89.图6a和图6b显示低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组中cd4
计数较基线的变化。图6a显示实体癌患者组的结果,图6b显示恶性胶质瘤患者组的结果。
90.图7a和图7b显示低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组中cd8
计数较基线的变化。图7a显示实体癌患者组的结果,图7b显示恶性胶质瘤患者组的结果。
91.图8a和图8b分别显示非淋巴细胞减少实体癌患者组(基线alc≥1000个细胞/mm3)和淋巴细胞减少(基线alc<1000个细胞/mm3)实体癌患者组中淋巴细胞绝对数(alc)的变化,这些患者分别分至低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂
量(720μg/kg至1200μg/kg)组。*p<0.05,**p<0.01,***p<0.001,基于wilcoxon配对符号秩检验的较基线(第0周)组对比。
92.图9a和图9b分别显示非淋巴细胞减少恶性胶质瘤患者组(基线alc≥1000个细胞/mm3)和淋巴细胞减少(基线alc<1000个细胞/mm3)实体癌患者组中淋巴细胞绝对数(alc)的变化,这些患者分别分至低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组。*p<0.05,**p<0.01,***p<0.001,基于wilcoxon配对符号秩检验的较基线(第0周)组对比。
93.图10a、图10b和图10c分别显示低剂量(60μg/kg至120μg/kg)、中剂量(240μg/kg至480μg/kg)和高剂量(720μg/kg至1200μg/kg)组中给予il-7融合蛋白治疗后cd4
和cd8
细胞中ki67、cd127和treg比率的变化。ns:无显著意义,*p<0.05、**p<0.01、***p<0.001基于wilcoxon配对符号秩检验的较基线(第0周)组对比。
94.图11显示猴模型中采血时间线。
95.图12a和图12b分别显示受试猴血样中ki67在cd8
和cd4
细胞中的表达模式。
96.图13a和图13b显示低剂量(120μg/kg)组(图13a)、中剂量组(360μg/kg至600μg/kg)、高剂量组(840μg/kg至1440μg/kg)(图13b)从0时间点(第0周)至15周多次给药后的淋巴细胞绝对数(alc)较基线值的变化。
97.图14a、图14b和图14c显示恶性胶质瘤患者用tmz(替莫唑胺,150mg/m2)、阿瓦斯汀/伊立替康(a;阿瓦斯汀10mg/kg,i;伊立替康100mg/m2)和pcv(pcv;ccnu 240mg、长春新碱2mg、丙卡巴肼150mg和100mg、长春新碱2mg)进行化疗的同时多次给予il-7融合蛋白(每隔8周或以上)后淋巴细胞绝对数(alc)较基线(第0周)值的变化。
98.图15a和图15b显示给予il-7融合蛋白治疗后cd4
和cd8
t细胞亚群的变化以及趋化因子受体ccr和其他免疫细胞(b细胞和nk细胞)的变化。ns:无显著意义;p>0.05,*p<0.05,**p<0.01,***p<0.001基于wilcoxon配对符号秩检验的较基线(0周)组对比。
具体实施方式
99.定义
100.除非另有说明,否则以下术语和短语涵盖下述含义。除非另有明确说明,否则以下术语和短语不排除该术语或短语在其所属领域内已具有的含义。由于本专利的各个方面由权利要求书限定,因此这些定义仅用于描述特定的实施方案,并非限制本专利。除非另有定义,否则本文使用的所有技术和科学术语的含义与本领域普通技术人员通常理解的含义相同。
101.本文中定义的术语“药物组合物”是指含有至少一种且于哺乳类动物以防治特定疾病或病症的药物。在实施方案中,哺乳动物可以是人。
102.本文所定义的术语“药学上可接受”是指在正确的医学判断范围内适合与人类患者组织接触而没有过度毒性、无刺激过敏反应且并发症问题与合理风险率相当的的化合物、材料、组合物和/或剂型。
103.本文所用术语“治疗”包括缓解、减少、减轻人类患者中的至少一种症状或对延缓疾病发展有效。例如,治疗可以是减轻疾病的一种或几种症状或完全根除疾病,例如癌症。在本公开的含义内,术语“治疗”还表示阻止、延迟疾病发作(即,在疾病有临床症状之前)
和/或降低疾病发展或恶化的风险。术语“保护”在本文中用于表示预防、延迟或治愈受试者的疾病发展、持续或恶化(视情况而定)。
104.本文所用术语“防止”包括至少预防一种所述病情、疾病相关的、或由其引起的疾病。
105.术语——药物组合物“药学有效量”或“临床有效量”是指在该剂量下较基线临床可见体征和症状有明显的改善。
106.本文所用短语“需进行该治疗的人类患者”是指被诊断为患有所述增殖性病变的人类患者。
107.术语“约”或“大约”的含义应为给定值或范围的10%、9%、8%、7%、6%或5%内。
108.术语“减少了”或“减少”在本文中通常用于表示减少量具有统计显著性。在某些实施例中,“减少了”或“减少”是指相较于参考水平下降了至少10%,例如:下降了至少20%、30%、40%、50%、60%、70%、80%、90%或100%(例如,相较参考水平无下降或下降水平不可检出),或相较于参考水平的下降范围为10%至100%。在标志或症状中,这些术语是指该下降水平具有统计显著性,例如,所述下降至少为10%、20%、30%、40%或更多,且优选为下降到无所述疾病个体的正常范围内的可接受水平。
109.修饰il-7
110.实施例中所用的修饰il-7可能具有以下结构:
111.a-il-7,式(i)
112.其中a是由1个至10个氨基酸残基组成的寡肽;il-7,即白细胞介素-7,是一种能与il-7受体(也称为cd127)结合的多肽、或具有il-7活性或与之类似活性的多肽。
113.本文所用术语“具有il-7活性或类似活性的多肽”是指具有与il-7相同或相似的序列和活性的多肽或蛋白质。除非在某实施例中另有说明,否则该术语可与il-7融合蛋白或修饰il-7融合蛋白的第一结构域互换使用。
114.il-7包含的多肽由seq id no:1至seq id no:6所示的氨基酸序列组成。此外,il-7与seq id no:1至seq id no:6的序列一致性可为70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高。可用已知序列比对或比较软件来确定肽序列的序列一致性。例如,序列一致性可以通过默认设置下的blastp程序(blast.ncbi.nlm.nih.gov/blast.cgi?page=proteins)来确定。
115.il-7可以包括il-7蛋白或其片段,其中,该片段能够结合il-7受体。本文所用术语“il-7蛋白”在概念上可包括“il-7蛋白及其片段,其中该片段能够结合il-7受体”。il-7可以是从人、大鼠、小鼠、猴、牛或羊获得。
116.除非另有说明,否则术语“蛋白质”、“多肽”和“肽”可互换使用。
117.具体而言,人il-7的氨基酸序列可由以下序列表示:seq id no:1(基因库保藏号:p13232);大鼠il-7的氨基酸序列可由以下序列表示:seq id no:2(基因库保藏号:p56478);小鼠il-7的氨基酸序列可由以下序列表示:seq id no:3(基因库保藏号:p10168);猴il-7的氨基酸序列可由以下序列表示:seq id no:4(基因库保藏号:np_001279008);牛il-7的氨基酸序列可由以下序列表示:seq id no:5(基因库保藏号:p26895),羊il-7的氨基酸序列可由以下序列表示:seq id no:6(基因库保藏号:q28540)。
118.此外,il-7蛋白或其片段可以包括各种修饰蛋白或肽,如:变体。上述修饰方法为:
对野生型il-7进行替换、删除或添加至少一种蛋白质同时不改变il-7的功能。这些不同的蛋白质或肽与野生型蛋白质的序列一致性至少约为70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
119.通常,用丙氨酸取代野生型氨基酸残基,但可以进行保守氨基酸取代,这样对整个蛋白质电荷(即极性或疏水性)没有影响或影响甚微。
120.保守氨基酸取代可参考下表1。
121.表1
[0122][0123][0124]
各氨基酸的新增保守取代包括氨基酸的“同源物”。具体而言,“同源物”是指某种氨基酸中亚甲基(ch2)被插入到该氨基酸侧链的β位侧链中。“同源物”的实例可包括但不限于高苯丙氨酸、高精氨酸、高丝氨酸等。
[0125]
在a-il-7的修饰il-7的结构中,部分a可以直接或通过连接基团连接到il-7的n端,除非另有说明,否则该术语在概念上可与il-7融合蛋白的第二结构域互换。
[0126]
在某实施例中,a可以连接到il-7的n端。a包含1个至10个氨基酸,该氨基酸可以选自蛋氨酸、甘氨酸及其组合。在某实施例中,当a是单个氨基酸残基时,即为甘氨酸。
[0127]
甲硫氨酸和甘氨酸不会在人体中诱导免疫反应。由大肠杆菌生成的蛋白质药物在
n端始终包含有蛋氨酸,但未报告有任何不良反应。此外,甘氨酸被广泛用作为gs连接基团,据报道它不会在度拉糖肽等商业药品中诱发免疫反应(细胞生物化学与生物物理学,1993年1月至6月;22(103):189-224)。
[0128]
在示例性实施例中,a可以是包含1个至10个氨基酸的寡肽,所述氨基酸选自蛋氨酸(met,m)、甘氨酸(gly,g)及其组合。在某实施例中,a可以是由1个至5个氨基酸组成的寡肽。例如,a的n端序列可选自蛋氨酸(m)、甘氨酸(g)、蛋氨酸-蛋氨酸、甘氨酸-甘氨酸、蛋氨酸-甘氨酸、甘氨酸-蛋氨酸、蛋氨酸-蛋氨酸-蛋氨酸、蛋氨酸-蛋氨酸-甘氨酸、蛋氨酸-甘氨酸-蛋氨酸、甘氨酸-蛋氨酸-蛋氨酸、蛋氨酸-甘氨酸-甘氨酸、甘氨酸-蛋氨酸-甘氨酸、甘氨酸-甘氨酸-蛋氨酸、甘氨酸-甘氨酸-甘氨酸、mmmm、mgmm、mggm、mggg、mgmg、gmmm、gmgg、gggg、mmmmm、mmgmm、mmggm、mgmmg、mmmmg、ggggg、ggmmm、gggmg、mgmgmg、mmmggg、mmggmm、ggmmgg、mgmgmgmg、mmmmgggg、mmggmmgg、mmmmgggg、mgmgmgmgmg或/和mmmmmgggggg。在某实施例中,a可以是蛋氨酸、甘氨酸、蛋氨酸-蛋氨酸、甘氨酸-甘氨酸、蛋氨酸-甘氨酸、甘氨酸-蛋氨酸、蛋氨酸-蛋氨酸-蛋氨酸、蛋氨酸-蛋氨酸-甘氨酸、蛋氨酸-甘氨酸-蛋氨酸、甘氨酸-蛋氨酸-蛋氨酸、蛋氨酸-甘氨酸-甘氨酸、甘氨酸-蛋氨酸-甘氨酸、甘氨酸-甘氨酸-蛋氨酸或甘氨酸-甘氨酸-甘氨酸。
[0129]
修饰il-7的融合蛋白或修饰il-7融合蛋白
[0130]
本专利的另一方面提供一种il-7融合蛋白,包含:第一结构域,所述第一结构域包含具有il-7活性或类似活性的多肽;第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的氨基酸序列,所述氨基酸残基由蛋氨酸、甘氨酸或其组合组成;以及延长il-7融合蛋白半衰期的第三结构域。
[0131]
所述第三结构域可以连接至第一结构域或第二结构域的n端或c端。此外,包括第一结构域和第二结构域的修饰il-7可以连接到第三结构域的两端。
[0132]
所述第三结构域可以是用于增加体内半衰期的融合标签,优选包括选自由免疫球蛋白fc区其部分、白蛋白、白蛋白结合多肽、pro/ala/ser(pas)、人绒毛膜促性腺激素β亚基的c端肽(ctp)、聚乙二醇(peg)、非结构化亲水长氨基酸序列(xten)、羟乙基淀粉(hes)、白蛋白结合小分子及其组合组成的组中的一种。
[0133]
当第三结构域是免疫球蛋白fc区时,可为修饰免疫球蛋白的fc区。特别地,在修饰免疫球蛋白的fc区中,抗体依赖型细胞毒性(adcc)或补体依赖型细胞毒性(cdc)由于修饰了fc受体和/或补体的结合亲和力而减弱。修饰免疫球蛋白可以选自由igg1、igg2、igg3、igg4、iga1、iga2、igd、ige及其组合组成的组中。具体而言,所述修饰免疫球蛋白的fc区从n端向c端方向可包括铰链区、ch2结构域和ch3结构域。特别地,铰链区可以包括人igd铰链区;ch2结构域可以包括人igd的部分氨基酸残基和人igg4ch2结构域的部分氨基酸残基;ch3结构域可以包括人igg4ch3结构域的部分氨基酸残基。
[0134]
另外,两个融合蛋白可以形成二聚体,例如,当第三结构域是fc区时,fc区可以相互结合形成二聚体。
[0135]
本文所用术语“fc区”、“fc片段”或“fc”是指包含免疫球蛋白重链恒定区2(ch2)和重链恒定区3(ch3)但不包含重链、轻链及轻链恒定区(cl1)的可变区域,且还可重链恒定区的铰链区。在某实施例中,杂合fc或其杂合fc片段可称为(hfc)或(hyfc)。
[0136]
此外,本文所用术语(fc区变体)是指通过取代fc区中部分氨基酸或通过结合不同
种类的fc区而得到的变体。fc区变体可以防止在铰链区被切断。具体地,seq id no:9序列的第144个氨基酸和/或第145个氨基酸可修饰。变体优选为:第144个氨基酸k被g或s取代以及第145个氨基酸e被g或s取代的变体。
[0137]
另外,修饰免疫球蛋白的fe区或fe区变体可由下式(i)表示:
[0138]
式(i)
[0139]n’‑
(z1)p-y-z2-z3-z4-c’。
[0140]
上式(i)中,
[0141]n′
是多肽的n端,c
′
是多肽的c端;
[0142]
p为整数0或1;
[0143]
从seq id no:7的第90位至第98位的氨基酸残基中,z1是从第98位的氨基酸残基向n端方向具有5个至9个连续氨基酸残基的氨基酸序列;
[0144]
从seq id no:7的第99位至第162位的氨基酸残基中,y是从第162位氨基酸残基向n端方向具有5个至64个连续氨基酸残基的氨基酸序列;
[0145]
从seq id no:7的第163位至第199位的氨基酸残基中,z2是从第163位氨基酸残基向c端方向具有4个至37个连续氨基酸残基的氨基酸序列;
[0146]
从seq id no:8的第115位至第220位的氨基酸残基中,z3是从第220位氨基酸残基向n端方向具有71个至106个连续氨基酸残基的氨基酸序列;以及
[0147]
从seq id no:8的第221位至第327位的氨基酸残基中,z4是从第221位氨基酸残基向c端方向具有80个至107个连续氨基酸残基的氨基酸序列。
[0148]
另外,与原始形式相比,所述fc片段可以是具有原始糖链、增加糖链或减少糖链的形式,或为去糖基形式。所述免疫球蛋白fc糖链可以通过常规方法修饰,如:化学法、酶法和微生物基因工程法。从fc片段中去除糖链会导致与第一补体成分c1的c1q部分的结合亲和力急剧下降,adcc或cdc下降或缺失,从而在体内诱导不必要的免疫反应。因而,去糖基化或非糖基化形式的免疫球蛋白fc区可能更适合作为药物载体。本文所用术语“去糖基化”是指在fc区中以酶促方式从fc片段上去除糖基。此外,术语“非糖基化”是指fc片段是由原核生物以非糖基化形式产生,做为优选在大肠杆菌中产生。
[0149]
此外,所述修饰免疫球蛋白的fc区可以包括氨基酸序列seq id no:9(hyfc)、seq id no:10(hyfcm1)、seq id no:11(hyfcm2)、seq id no:12(hyfcm3)或seq id no:13(hyfcm4)。此外,修饰免疫球蛋白的fc区可以包括氨基酸序列seq id no:14(非裂解小鼠fc)。
[0150]
修饰免疫球蛋白的fc区可以如美国专利号7867491所述,且修饰免疫球蛋白的fc区生成方式可参考美国专利号7867491进行,该专利全部内容以引用方式纳入本文。
[0151]
所述第二结构域可以直接或通过连接基团连接到第一结构域的n端。具体地,所得形式可为:第二结构域-第一结构域或第二结构域-连接基团-第一结构域。
[0152]
所述第三结构域可以直接或通过连接基团与第一结构域或第二结构域连接。具体地,所得形式可以是第二结构域-第一结构域-第三结构域、第三结构域-第二结构域-第一结构域、第二结构域-第一结构域-连接基团-第三结构域、第三结构域-连接基团-第二结构域-第一结构域、第二结构域-连接基团-第一结构域-连接基团-第三结构域或第三结构域-连接基团-第二结构域-第一结构域。
[0153]
当所述连接基团是肽基时,连接可以发生在任何连接区域中。可使用本领域已知的交联剂偶联。例如:交联剂可包括但不限于1,1-双(重氮乙酰基)-2-苯基乙烷、戊二醛、4-叠氮水杨酸等n-羟基琥珀酰亚胺酯;含3,3
′‑
二硫代二(琥珀酰亚胺基丙酸酯)等二琥珀酰亚胺酯的亚氨酸酯,以及双-n-马来酰亚胺-1,8-辛烷等双官能团马来酰亚胺。
[0154]
另外,连接基团可以是白蛋白连接基团或肽连接基团。肽连接基团可以是由含gly和ser残基的10-20个氨基酸残基组成的肽。
[0155]
当连接基团由一种化学键形成时,所述化学键可以是二硫键、二胺键、硫-胺键、羧基-胺键、酯键和共价键。
[0156]
修饰il-7可具有a-il-7的结构,包括具有il-7活性或其类似活性的多肽和由1个至10个氨基酸组成的寡肽。
[0157]
在某实施例中,修饰il-7的氨基酸序列可选自由seq id no:15至seq id no:20组成的组中。此外,修饰il-7的序列与seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19或seq id no:20所示氨基酸序列的一致性至少约为70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
[0158]
在另一个示例性实施例中,修饰il-7或il-7融合蛋白包含第一结构域,所述第一结构域包括具有il-7活性或其类似活性的多肽;第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的氨基酸序列,所述氨基酸残基由蛋氨酸、甘氨酸或其组合组成;第三结构域,所述第三结构域是修饰免疫球蛋白的fc区,与第一结构域的c端偶联。
[0159]
所述il-7融合蛋白可以具有以下所示的氨基酸序列:seq id no:21至seq id no:25。此外,il-7融合蛋白的序列与seq id no:21、seq id no:22、seq id no:23、seq id no:24或seq id no:25的氨基酸序列的一致性至少约为:70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。
[0160]
seq id no:21至seq id no:25所示il-7融合蛋白可被seq id no:29至seq id no:39所示多核苷酸序列编码。
[0161]
核酸分子还可包括信号序列或前导序列。
[0162]
本文所用术语“信号序列”是指指导生物活性分子药物和融合蛋白分泌的片段,其在宿主细胞中翻译后被切断。某实施例的信号序列是编码氨基酸序列启动蛋白质穿过内质网(er)膜运动的多核苷酸。某实施例中的有效信号序列包括抗体轻链信号序列,例如:抗体14.18(gillies等,《免疫学方法杂志》,1989年。125:191-202),抗体重链信号序列,例如,mopci41,抗体重链信号序列(sakano等,《自然》,1980年。286:676-683),以及本领域已知的其他信号序列(例如,watson等,《核酸研究》,1984年。12:5145-5164)。
[0163]
信号肽的特征在本领域内是众所周知的,信号肽通常具有16-30个氨基酸,但也可增减其氨基酸残基。传统的信号肽由三个区域组成:碱性n端区、中央疏水区和极性更大的c端区。
[0164]
中央疏水区包括4个至12个疏水残基,它们通过膜脂双层在未成熟多肽的易位期间固定信号序列。启动后,er腔内的信号序列经常细胞酶(也称为信号肽酶)切断。特别地,信号序列可以是组织纤溶酶原激活(tpa)的分泌信号序列、单纯疱疹病毒糖蛋白d(hsv gds)或生长激素的信号序列。可优选使用哺乳类动物等高等真核细胞中使用的分泌信号序列。另外,作为分泌信号序列,可使用野生型il-7中包含的信号序列,或者用宿主细胞中表
达频率高的密码子取代后使用。
[0165]
编码修饰il-7或il-7融合蛋白的分离核酸分子可以包含在表达载体中。
[0166]
本文所用术语“载体”可理解为包含核苷酸序列的核酸途径,该核苷酸序列可被引入宿主细胞中重组并插入宿主细胞的基因组中,或自发复制为附加体。载体可包括线性核酸、质粒、噬菌粒、粘粒、rna载体、病毒载体及其类似物。病毒载体可包括但不限于逆转录病毒、腺病毒和腺相关病毒。
[0167]
本文所用术语靶蛋白的“基因表达”或“表达”可理解为dna序列的转录、mrna转录物的转译以及融合蛋白产物或其片段的分泌。
[0168]
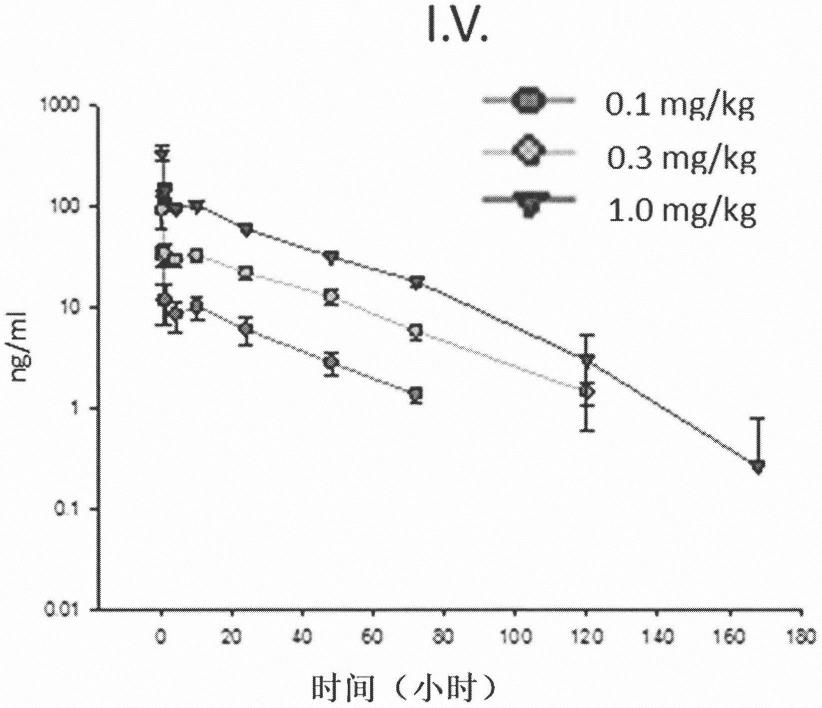
本文所用术语“宿主细胞”是指可引入重组表达载体的原核细胞和真核细胞。本文所用术语“转导”、“转化”和“转染”是指使用本领域已知的技术将核酸(例如,载体)引入细胞中。
[0169]
本文所用术语靶蛋白的“基因表达”或“表达”可理解为:dna序列的转录、mrna转录物的转译和fc融合蛋白产物或其抗体或抗体片段的分泌。
[0170]
有效表达载体可以是rccmv(invitrogen,卡尔斯巴德)或其变体。表达载体可包括用于促进哺乳动物细胞中靶基因连续转录的人巨细胞病毒(cmv)和用于增加转录后rna稳定状态的牛生长激素的聚腺苷酸化信号序列。在示例性实施例中,表达载体是pad15,是修饰形式的rccmv。
[0171]
通过转导或转染某实施例中dna序列,可以将表达载体纳入适合靶蛋白表达和/或分泌的相应宿主细胞中。
[0172]
相应宿主细胞可包括但不限于永生杂交瘤细胞、ns/0骨髓瘤细胞、293细胞、中国仓鼠卵巢(cho)细胞、hela细胞、人羊水衍生细胞(capt细胞)、cos细胞。
[0173]
所述修饰il-7蛋白及其融合蛋白的生成方法可见共同待审专利申请(美国专利申请号:15/126313),本文引用了该方法的全部内容。
[0174]
成分
[0175]
本文引入了美国专利申请号15/773273的全部内容,该专利公开了一种含有修饰il-7融合蛋白的制剂。在某些实施方案中,药物制剂可以包含:(a)修饰il-7融合蛋白;(b)浓度为10mm至50mm的基础缓冲液;(c)浓度为2.5w/v%至5w/v%的糖;以及(d)浓度为0.05w/v%至6w/v%的表面活性剂。该制剂还可包含氨基酸、糖醇(例如,山梨糖醇、木糖醇、麦芽糖醇、甘露糖醇或其混合物)。该制剂的ph值约为5。
[0176]
含有修饰il-7或il-7融合蛋白的药物组合物可直接用于受试者(如:局部注射、移植或局部注入组织区域),或通过适当方式全身给药(例如:肠胃外或口服)。当组合物通过静脉内、皮下、眼内、腹腔内、肌内、口服、直肠内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内、鼻内或气雾剂方式进行肠道外给药时,组合物优选包含有水性或生理适用的体液悬浮液或其部分溶液。因此,生理上可接受的载体或转运体可以添加到组合物中并递送至患者,这不会对患者的电解质和/或体液平衡造成负面影响。因此,生理上可接受的载体或转运体可以为生理盐水。
[0177]
另外,包含核酸的dna构建体(或基因组构建体)可以用作基因治疗方案的一部分,所述核酸包括修饰il-7或il-7融合蛋白。
[0178]
为了重建或补充所需蛋白质的功能,可以将能够在特定细胞中表达融合蛋白的表
达载体与生物有效载体一起施用。即:能够在体内有效地将编码所需蛋白或il-7融合蛋白的基因递送到细胞中的制剂或组合物。
[0179]
为了采用编码修饰il-7或il-7融合蛋白的核酸进行基因治疗,可将受试者基因插入病毒载体、重组细菌质粒或重组真核质粒中。病毒载体可以包括重组逆转录病毒、腺病毒、腺相关病毒、单纯疱疹病毒-1等,移植t细胞,或增殖的体外分离t细胞聚集物。
[0180]
修饰il-7或其融合蛋白的使用和治疗方案
[0181]
所述修饰il-7或其融合蛋白可用于制备增殖性疾病的治疗药物,其中,该药物的治疗有效剂量为600μg/kg至2000μg/kg,向有需要的受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给予2次或多次。
[0182]
在某实施例中,所述修饰il-7或其融合蛋白可用于制备增殖性疾病的治疗药物,其中,所述药物的治疗有效剂量为600μg/kg至2000μg/kg,向有需要的受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给予2次或多次。
[0183]
所述修饰il-7或其融合蛋白用于治疗增殖性疾病,包括给予治疗有效剂量的式(i)所示化合物或其药学上可接受的盐,治疗有效剂量约为720μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1700μg/kg或以上、或2000μg/kg的修饰il-7或其融合蛋白,向有需要的受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0184]
所述修饰il-7或其融合蛋白可用于制备增殖性疾病的治疗药物,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,其中,治疗有效剂量约为720μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1700μg/kg或以上、或约2000μg/kg的修饰il-7或其融合蛋白,向有需要的受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0185]
所述修饰il-7或其融合蛋白用于治疗增殖性疾病,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,其中,治疗有效剂量约为720μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上或2000μg/kg的修饰il-7或其融合蛋白,向有需要的受试者的给药频率为:每间隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或每间隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0186]
所述修饰il-7或其融合蛋白用于制备增殖性疾病的治疗药物,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,其中,治疗有效剂量约为720μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上、2000μg/kg的修饰il-7或其融合蛋白,向有需要的受试者的给药频率为:每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0187]
所述修饰il-7或其融合蛋白用于制备提高有需要的受试者的淋巴细胞数或淋巴细胞生成的药物,其中,所述药物的治疗有效剂量约为600μg/kg至2000μg/kg,向所述受试
者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给药2次或多次。
[0188]
在某实施例中,修饰il-7或其融合蛋白用于制备增加有需要的受试者的受试者淋巴细胞数或淋巴细胞生成的药物,其中所述药物的治疗有效剂量约为600μg/kg至2000μg/kg,向所述受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给药2次或多次。
[0189]
修饰il-7或其融合蛋白用于增加有需要的受试者的淋巴细胞数或淋巴细胞生成,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,治疗有效剂量约为720μg/kg或以上、960μg/kg或以上、1200g/kg或以上、1700μg/kg或以上、或2000μg/kg的修饰il-7或其融合蛋白,向所述受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0190]
修饰il-7或其融合蛋白用于制备增加有需要的受试者的淋巴细胞数或淋巴细胞生成的药物,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,治疗有效剂量约为720μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1700μg/kg或以上、2000μg/kg的修饰il-7或其融合蛋白,向所述受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0191]
修饰il-7或其融合蛋白用于增加有需要的受试者的淋巴细胞数或淋巴细胞生成,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,治疗有效剂量约为20μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上、2000μg/kg的修饰il-7或其融合蛋白,向所述受试者的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或多次。
[0192]
修饰il-7或其融合蛋白用于制备增加有需要的受试者的淋巴细胞数或淋巴细胞生成的药物,包括以治疗有效剂量给予式(i)所示化合物或其药学上可接受的盐,治疗有效剂量约为720μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上、或2000μg/kg的修饰il-7或其融合蛋白,向所述受试者的给药频率为间隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周,或间隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药2次或3次。
[0193]
在某实施例中,针对上述用途的增殖性疾病是癌症或肿瘤,包括但不限于实体瘤、淋巴系统癌或白血病。
[0194]
实体瘤可包括滑膜肉瘤、浸润性导管癌、直肠癌、结肠癌、卵巢癌、升结肠癌、肛门癌、侵袭性导管癌、腺癌、伴有主动脉旁转移的直肠癌、神经内分泌癌(子宫颈)、乙状结肠癌或恶性胶质瘤。
[0195]
在某实施方案中,所述受试者可能先前接受过或正同时接受包括手术、放疗和化疗的一种或多种癌症治疗。
[0196]
所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白或包含它们的药物组合物可通过肠外、肌内、皮下、眼部、静脉、腹腔、皮内、眶内、脑内、颅内、脊柱内、心室内、
鞘内、脑池内、囊内或肿瘤内给药。
[0197]
在某些方面中,根据4.0版不良事件通用术语标准(ctcae),所述受试者的淋巴细胞数为1000个/μl以下。所述淋巴细胞可能为t细胞。所述t细胞可包括cd4
和/或cd8
t细胞。可采用全血或血清测量血液样本中的淋巴细胞。因此,与淋巴细胞数相关的术语“血液”包括全血和/或血清。
[0198]
在另一方面中,所述受试者血液中的淋巴细胞数为800个/μl或以下、500个/μl或以下、或200个/μl或以下。
[0199]
在一个方面中,给予所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白治疗后肿瘤浸润淋巴细胞(til)数量与给药前tils数量相比有所增加。所述til可能是cd4
til和/或cd8
til。
[0200]
给药后的til数量至少增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、125%、150%、200%、250%、300%。
[0201]
在某实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为720μg/kg,给药频率为每隔1周、2周、3周、4周、5周、6周、7周或8周给药2次或多次。
[0202]
在某实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为840μg/kg,给药频率为每隔2周、3周、4周、5周、6周、7周或8周给药2次或多次。
[0203]
在另一实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为960μg/kg,给药频率为每隔2周、3周、4周、5周、6周、7周、8周、9周或10周给药2次或多次。
[0204]
在又一实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1200μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周、10周、11周或12周给药2次或多次。
[0205]
在又一实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1440μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、1个月、2个月或3个月给药2次或多次。
[0206]
根据某实施例,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量可约为600μg/kg以上、700μg/kg以上、800μg/kg以上、900μg/kg以上、1000μg/kg以上、1100μg/kg以上、1200μg/kg以上、1300μg/kg以上、1400μg/kg以上、1500μg/kg以上、1600μg/kg以上、1700μg/kg以上、1800μg/kg以上、1900μg/kg以上或2000μg/kg以上,给药频率为每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次或每15周一次。
[0207]
在某些方面中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为610μg/kg至1200μg/kg、650μg/kg至1200μg/kg、700μg/kg至1200μg/kg、750μg/kg至1200μg/kg、800μg/kg至1200μg/kg、850μg/kg至1200μg/kg、900μg/kg至1200μg/kg、950μg/kg至1200μg/kg、1000μg/kg至1200μg/kg、1050μg/kg至1200μg/kg、1100μg/kg至1200μg/kg、1200μg/kg至2000μg/kg、1300μg/kg至2000μg/kg、1500μg/kg至2000μg/kg、1700μg/kg至2000μg/kg、610μg/kg至1000μg/kg、650μg/kg至1000μg/kg、700μg/kg至1000μg/kg、750
μg/kg至1000μg/kg、800μg/kg至1000μg/kg、850μg/kg至1000μg/kg、900μg/kg至1000μg/kg、950μg/kg至1000μg/kg,给药频率为每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次、每15周一次。
[0208]
在另一方面中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量可约为700μg/kg至900μg/kg、750μg/kg至950μg/kg、700μg/kg至850μg/kg、750μg/kg至850μg/kg、700μg/kg至800μg/kg、800μg/kg至900μg/kg、750μg/kg至850μg/kg、850μg/kg至950μg/kg,给药频率为每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次、或每15周一次。
[0209]
根据又一个实施例,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为650μg/kg、680μg/kg、700μg/kg、720μg/kg、740μg/kg、750μg/kg、760μg/kg、780μg/kg、800μg/kg、820μg/kg、840μg/kg、850μg/kg、860μg/kg、880μg/kg、900μg/kg、920μg/kg、940μg/kg、950μg/kg、960μg/kg、980μg/kg、1000μg/kg、1020μg/kg、1040μg/kg、1060μg/kg、1080μg/kg、1100μg/kg、1120μg/kg、1140μg/kg、1160μg/kg、1180μg/kg、1200μg/kg、1220μg/kg、1240μg/kg、1260μg/kg、1280μg/kg、1300μg/kg、1320μg/kg、1340μg/kg、1360μg/kg、1380μg/kg、1400μg/kg、1420μg/kg、1440μg/kg、1460μg/kg、1480μg/kg、1500μg/kg、1520μg/kg、1540μg/kg、1560μg/kg、1580μg/kg、1600μg/kg、1620μg/kg、1640μg/kg、1660μg/kg、1680μg/kg、1700μg/kg、1720μg/kg、1740μg/kg、1760μg/kg、1780μg/kg、1800μg/kg、1820μg/kg、1840μg/kg、1860μg/kg、1880μg/kg、1900μg/kg、1920μg/kg、1940μg/kg、1960μg/kg、1980μg/kg、或2000μg/kg。给药频率为每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次或每15周一次。
[0210]
在某个实施例中,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为650μg/kg至680μg/kg、680μg/kg至700μg/kg、700μg/kg至720μg/kg、720μg/kg至740μg/kg、740μg/kg至750μg/kg、750μg/kg至760μg/kg、760μg/kg至780μg/kg、780μg/kg至800μg/kg、800μg/kg至820μg/kg、820μg/kg至840μg/kg、840μg/kg至850μg/kg、850μg/kg至860μg/kg、860μg/kg至880μg/kg、880μg/kg至900μg/kg、900μg/kg至920μg/kg、920μg/kg至940μg/kg、940μg/kg至950μg/kg、950μg/kg至960μg/kg、960μg/kg至980μg/kg、980μg/kg至1000μg/kg、1000μg/kg至1020μg/kg、1020μg/kg至1040μg/kg、1040μg/kg至1060μg/kg、1060μg/kg至1080μg/kg、1080μg/kg至1100μg/kg、1100μg/kg至1120μg/kg、1120μg/kg至1140μg/kg、1140μg/kg至1160μg/kg、1160μg/kg至1180μg/kg、1180μg/kg至1200μg/kg、1200μg/kg至1220μg/kg、1220μg/kg至1240μg/kg、1240μg/kg至1260μg/kg、1260μg/kg至1280μg/kg、1280μg/kg至1300μg/kg、1300μg/kg至1320μg/kg、1320μg/kg至1340μg/kg、1340μg/kg至1360μg/kg、1360μg/kg至1380μg/kg、1380μg/kg至1400μg/kg、1400μg/kg至1420μg/kg、1420μg/kg至1440μg/kg、1440μg/kg至1460μg/kg、1480μg/kg、1480μg/kg至1500μg/kg、1500μg/kg至1520μg/kg、1520μg/kg至1540μg/kg、1540μg/kg至1560μg/kg、1560μg/kg至1580μg/kg、1580μg/kg至1600μg/kg、1600μg/kg至1620μg/kg、1620μg/kg至1640μg/kg、1640μg/kg至1660μg/kg、1660μg/kg至1680μg/kg、1680μg/kg至1700μg/kg、1700μg/kg至1720μg/kg、1720
μg/kg至1740μg/kg、1740μg/kg至1760μg/kg、1760μg/kg至1780μg/kg、1780μg/kg至1800μg/kg、1800μg/kg至1820μg/kg、1820μg/kg至1840μg/kg、1840μg/kg至1860μg/kg、1860μg/kg至1880μg/kg、1880μg/kg至1900μg/kg、1900μg/kg至1920μg/kg、1920μg/kg至1940μg/kg、1940μg/kg至1960μg/kg、1960μg/kg至1980μg/kg、1980μg/kg至1200μg/kg,给药频率为每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、或每10天一次、每20天一次、每30天一次、每40天一次、每50天一次、每60天一次、每90天一次或每100天一次。
[0211]
在某个实施例中,所述受试者可能已经接受过、正在接受或将要接受化疗。化疗药物和修饰il-7或其融合蛋白可以同时或依次给药。
[0212]
参考示例1-寡肽与il-7偶联的修饰il-7蛋白的制备
[0213]
制备修饰il-7,其中寡肽与il-7的n端偶联。il-7采用了人il-7的序列(seq id no:1)同时使用了蛋氨酸(m)、甘氨酸(g)、mm、gg、mg、gm、mmm、mmg、mgm、gmm、mgg、gmg、ggm、ggg、ddd或mmmm序列作为寡肽。
[0214]
如图1a所示,制备了具有
′a′‑
il-7结构的不同形式的修饰il-7。在本示例中,蛋氨酸(m)、甘氨酸(g)、mm、gg、mg、gm、mmm、mmg、mgm、gmm、mgg、gmg、ggm、ggg、ddd或mmmm序列用作第二结构域(寡肽,
′a′
)。此外,生成了mgmm、mggm、mggg、mgmg、gmmm、gmgg、gggg、mmmmmm、mmgmm、mmggm、mmmgmg、mmmmg、ggggg、ggmmm、ggmgmg、mgmgmg、mmmggg、mmggmm、ggmmgg、mgmgmgmg、mmmmgggg、mmggmmgg、mmmmgggg、mgmgmgmgmg及mmmmmggggg作为“a”。
[0215]
il-7作为与寡肽融合的第一个结构,采用了核酸序列seq id no:28。所得的完整核酸序列中il-7与寡肽融合,然后将该核酸序列插入到表达载体中。以相同方式制备没有寡肽修饰的il-7蛋白作为阴性对照。
[0216]
将包含a-il-7基因的表达载体转染到hek293细胞中。以300m l悬浮培养物计,使用208.3ug dna和416.6ug(μl)聚乙烯亚胺(pei)(w/w)制备复合物,然后转染到hek293f细胞中。转染6天后,获得细胞培养物并进行免疫印迹分析,由此评估靶蛋白的表达率。然后,将培养物以8000rpm速度离心处理30分钟,去除培养物碎片,使用孔径为0.22um的无菌过滤膜过滤。最后得到了含有m-il-7、g-il-7、mm-il-7、gg-il-7、mg-il-7、gm-il-7、mmm-il-7、mmg-il-7、mgm-il-7、gmm-il-7、mgg-il-7、gmg-il-7、ggm-il-7、ggg-il-7、ddd-il-7和mmmm-il-7等修饰il-7的培养液。此外,还生成了mgmm-il-7、mggm-il-7、mggg-il-7、mgmg-il-7、gmmm-il-7、gmgg-il-7、gggg-il-7、mmmmm-il-7、mmgmm-il-7、mmggm-il-7、mgmgmg-il-7、mmmmg-il-7、ggggg-il-7、ggmmm-il-7、ggmgg-il-7、mgmgmg-il-7、mmmggg-il-7、mmggmm-il-7、ggmmgg-il-7、mgmgmgmg-il-7、mmmmgggg-il-7、mmggmmgg-il-7、mmmmgggg-il-7、mgmgmgmgmg-il-7及mmmmmggggg-il-7。
[0217]
参考示例2.fc区与il-7的c末端偶联的il-7融合蛋白的制备制备il-7融合蛋白,即:第二结构域-第一结构域-第三结构域,其中由异质氨基酸序列组成的多肽进一步偶联至修饰il-7的c端。第一个结构域采用了人il-7的序列(seq id no:1),同时采用m、g、mm、gg、mg、gm、mmm、mmg、mgm、gmm、mgg、gmg、ggm、ggg、ddd或mmmm作为第二结构域。第三个结构域采用了fc区的序列(seq id no:9或seq id no:14)。在其他实施例中,mgmm、mggm、mggg、mgmg、gmmm、gmgg、gggg、mmmmm、mmgmm、mmggm、mgmmg、mmmmg、ggggg、ggmmm、ggmgg、mgmgmg、mmmggg、mmggmm、ggmmgg、mgmgmgmg、mmmmgggg、mmggmmgg、mmmmgggg、mgmgmgmgmg或
mmmmmggggg连接到il-7至fc的n端生成了il-7至fc融合蛋白。
[0218]
制备了由第二结构域、第一结构域和第三结构域组成的各种形式的il-7融合蛋白。在本实施例中,采用蛋氨酸(m)、甘氨酸(g)、mm、gg、mg、gm、mmm、mmg、mgm、gmm、mgg、gmg、ggm、ggg、ddd或mmmm序列作为第二结构域;采用人il-7作为第一结构域,采用杂合fc(hfc、hyfc)或小鼠非裂解性fc作为第三结构域。在其它实验中,mgmm、mggm、mggg、mgmg、gmmm、gmgg、gggg、mmmmmm、mmgmm、mmggm、mgmmg、mmmmg、ggggg、ggmmm、ggmgmg、mgmgmg、mmmggg、mmggmm、ggmmgg、mgmgmgmg、mmmmgggg、mmggmmgg、mmmmgggg、mgmgmgmgmg或mmmmmggggg作为第二结构域生成修饰il-7融合蛋白。
[0219]
具体而言,作为杂合fc使用了美国专利号7867491公开的hfc,本文已引用其全部内容。所述hfc可以与生理活性蛋白偶联,从而在体内半衰期方面比现有修饰免疫球蛋白的fc区更优越。
[0220]
制备基因表达载体,其制备方式与实施例1相同,转染该基因表达载体,培养细胞以制备含有各种il-7融合蛋白的培养液。最后得到含有g-il-7-hyfc、m-il-7-hyfc、mm-il-7-hyfc、gg-il-7-hyfc、mg-il-7-hyfc、gm-il-7-hyfc、mmm-il-7-hyfc、mmg-il-7-hyfc、mgm-il-7-hyfc、gmm-il-7-hyfc、mgg-il-7-hyfc、gmg-il-7-hyfc、ggm-il-7-hyfc、ggg-il-7-hyfc、ddd-il-7-hyfc或mmmm-il-7-hyfc蛋白的培养液。生成了mgmm-il-7-hyfc、mggm-il-7-hyfc、mggg-il-7-hyfc、mgmg-il-7-hyfc、gmmm-il-7-hyfc、gmgg-il-7-hyfc、gggg-il-7-hyfc、mmmmm-il-7-hyfc、mmgmm-il-7-hyfc、mmggm-il-7-hyfc、mgmmg-il-7-hyfc、mmmmg-il-7-hyfc、ggggg-il-7-hyfc、ggmmm-il-7-hyfc、ggmgmg-il-7-hyfc、mgmgmg-il-7-hyfc、mmmggg-il-7-hyfc、mmggmm-il-7-hyfc、ggmmgg-il-7-hyfc、mgmgmgmg-il-7-hyfc、mmmmgggg-il-7-hyfc、mmggmmgg-il-7-hyfc、mmmmgggg-il-7-hyfc、mgmgmgmgmg-il-7-hyfc或mmmmmggggg-il-7-hyfc。
[0221]
在某个方面中,使用了代号为gx-i7的修饰il-7-fc融合蛋白(seq id no:24)。gx-i7包含seq id no:18所示的修饰il-7以及与修饰il-7c端融合的hyfc。
[0222]
在某个方面中,il-7融合蛋白的给药剂量可约为60μg/kg或以上。剂量范围可约为60μg/kg至2000μg/kg。剂量可约这60μg/kg或以上、120μg/kg或以上、240μg/kg或以上、480μg/kg或以上、720μg/kg或以上、960μg/kg或以上、μg/kg或以上、1200μg/kg或以上、1700μg/kg或以上、或2000μg/kg。在另一个实施例中,剂量可约为60μg/kg或以上、360μg/kg或以上、600μg/kg或以上、840μg/kg或以上、或1440μg/kg或以上。
[0223]
在一个实施例中,剂量可约为60μg/kg或以上、120μg/kg或以上、240μg/kg或以上、360μg/kg或以上、480μg/kg或以上、600μg/kg或以上、720μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上、或2000μg/kg。
[0224]
在某些方面中,修饰白细胞介素-7或白细胞介素-7融合蛋白的给药剂量约为720μg/kg,给药频率为每隔1周、2周、3周、4周、5周、6周、7周或8周给药2次或多次。在某些方面,修饰白细胞介素-7或白细胞介素-7融合蛋白的给药剂量约为840μg/kg,给药频率为每隔2周、3周、4周、5周、6周、7周或8周给药2次或多次。在其他方面,修饰白细胞介素-7或白细胞介素-7融合蛋白的给药剂量约为960μg/kg,给药频率为每隔2周、3周、4周、5周、6周、7周、8周、9周或10周给药2次或多次。在某些方面中,修饰白细胞介素-7或白细胞介素-7融合蛋白的给药剂量约为1200μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周、10周、11周或
12周给药2次或多次。在其它某些方面中,修饰白细胞介素-7或白细胞介素-7融合蛋白的给药剂量约为1440μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周给药2次或多次。
[0225]
i.临床前研究
[0226]
a.il-7融合蛋白大鼠单次给药后的药代动力学试验
[0227]
为了观察il-7融合蛋白的药代动力学特性,使用正常大鼠进行药代动力学试验。通过静脉内、皮下和肌内注射进行药代动力学试验。将gx-i7(seq id no:24)作为il-7融合蛋白。
[0228]
正常大鼠通过静脉、皮下和肌内注射方式单次给予il-7融合蛋白后,评估药物的体内动力学和生物利用度的试验结果。
[0229]
静脉内给药时,auc
last
和c
max
分别为349.7(0.1mg/kg)、1,440.6(0.3mg/kg)、4225.9(1.0mg/kg)h
·
ng/ml和34.3(0.1mg/kg)、86.7(0.3mg/kg)、324.5(1.0mg/kg)ng/ml,表明这些值的增加与剂量有关。各给药组在0.1mg/kg、0.3mg/kg、1.0mg/kg下的t
max
为0.083小时,终末t
1/2
为22.6小时、22.6小时、22.0小时,平均终末t
1/2
为22.4小时。根据静脉注射组测量血药浓度的时间点,即:72小时(0.1mg/kg)、120小时(0.3mg/kg)及168小时(1.0mg/kg),计算生物利用度。
[0230]
皮下给药时,auc
last
和c
max
分别为363.8(0.1mg/kg)、1675.9(0.3mg/kg)、9765.4(1.0mg/kg)h
·
ng/ml和4.1(0.1mg/kg)、16.4(0.3mg/kg)和105.9(1.0mg/kg)ng/ml。由此证实了,各给药组在0.1mg/kg、0.3mg/kg、1.0mg/kg下的t
max
分别增加至48.0小时、36.0小时、48.0小时,在0.3mg/kg、1.0mg/kg下的终末t1/2分别为39.4小时、24.3小时。根据静脉注射组的血药浓度,可得出生物利用度分别为104(0.1mg/kg)、116(0.3mg/kg)和231(1.0mg/kg)。
[0231]
肌内给药时,auc
last
和c
max
分别为732.3(0.1mg/kg)、2898.3(0.3mg/kg)、11027.8(1.0mg/kg)h
·
ng/ml和12.5(0.1mg/kg)、51.2(0.3mg/kg)和147.9(1.0mg/kg)ng/ml。由此证实这些值的增加与剂量有关。所有给药组在0.1mg/kg、0.3mg/kg、1.0mg/kg下的tmax约为10.0小时,各给药组在0.1mg/kg、0.3mg/kg、1.0mg/kg下的终末t1/2分别为48.3小时、39.0小时和25.6小时。根据静脉注射组的血药浓度,可得生物利用度分别为209(0.1mg/kg)、201(0.3mg/kg)和261(1.0mg/kg)。
[0232]
令人关注的是,在该实验中,修饰il-7融合蛋白肌内给药的生物利用度高于静脉内给药,而目前大部分药物在皮下或肌内给药时的生物利用度要低于静脉内给药。如图1a至图1c所示。
[0233]
b.猴il-7融合蛋白给药后药代动力学试验
[0234]
进行4周单剂量毒性试验,毒性动力学指标证实了il-7融合蛋白在食蟹猴中的药代动力学特征。单次给药0.6mg/kg、2mg/kg、6mg/kgil-7融合蛋白后,测量1周内的毒性动力学指标。结果显示,auc
last
和c
max
分别为608(0.6mg/kg)、2730(2mg/kg)、15824(6mg/kg)h
·
ng/ml和6(0.6mg/kg)、29(2mg/kg)、172(6mg/kg)ng/ml,表明这些值的增加与剂量有关。各给药组在0.6mg/kg、2mg/kg、6mg/kg下的t
max
为22小时至40小时,终末t
1/2
为164小时、90小时和69小时。据推测,0.6mg/kg下给药组的终末t
1/2
可能是由于终末期il-7融合蛋白的血药浓度略微上升造成的,可看作为是由于il-7融合蛋白血药浓度低造成的生物变异,因此,除去
0.6mg/kg给药组,只计算其余组的平均终末t
1/2
,所得值约为80小时。结果见表2。
[0235]
表2 药代动力学参数
[0236][0237]
1)nd:未检出
[0238]
c.正常大鼠和猴类安全测试
[0239]
用正常大鼠和食蟹猴进行了2周试验以确定il-7融合蛋白重复给药毒性的剂量,并且根据设定剂量下重复给药及给药持续时间测定亚慢性毒性。进行了4周的重复毒性试验,以评估毒性恶化、晚发和可逆情况。安全药理试验中,正常大鼠的il-7融合蛋白(gx-i7)剂量为0mg/kg、1.2mg/kg、4mg/kg、12mg/kg,食蟹猴的il-7融合蛋白(gx-i7)剂量为0mg/kg、0.6mg/kg、2mg/kg、6mg/kg。在正常大鼠和食蟹猴中,各评估剂量下的il-7融合蛋白(gx-i7)对受试动物的一般行为、神经系统、呼吸系统和心血管系统均无显着影响。
[0240]
正常大鼠每周一次皮下注射il-7融合蛋白(gx-i7),持续4周,共5次,即使剂量高达12mg/kg/周时,也未观察到药物导致的毒性反应。虽然观察到试验药物相关的症状,但在重复给药后未观察到血液中的药物暴露。这似乎是由于药物自身抗体(抗药抗体)带来的屏蔽作用,因此,正常大鼠每周注射一次il-7融合蛋白(gx-i7),注射4周无法确定最大无毒剂量(noael)。食蟹猴皮下注射4周重复毒性试验中,即使剂量高达6mg/kg/周,也未观察到药物毒性,因此il-7融合蛋白(gx-i7)的最大无毒剂量(noael)设定为6mg/kg/周。转换为相应的人体等效剂量(hed)为2mg/kg。
[0241]
ii.临床研究
[0242]
a.目标和人口统计特征
[0243]
该临床试验的受试对象为(a)患有局部晚期或转移性实体癌的患者和(b)辅助化疗后有严重治疗相关淋巴细胞减少的恶性胶质瘤患者。每隔3周、4周、6周、8周、9周或12周给予il-7融合蛋白,并评估安全性、耐受性和淋巴细胞绝对数增加效果。
[0244]
(1)剂量递增转移性实体癌患者组纳入的所有受试者先前进行的标准治疗均无疗效,或组织病理诊断为局部进行性、复发性或转移无治实体癌。根据癌症诊断病史及相关治
疗史对患者进行验证,并通过其他病史和筛查确认其符合本研究的选择/排除标准。纳入的21名受试者包括10名结肠癌(47.6%)、5名直肠癌(23.8%)、2名乳腺癌(9.5%)、1名卵巢癌(4.7%)、1名滑膜肉瘤(4.7%)、1名肛门癌(4.7%)和1名宫颈癌(4.7%)。根据收集到的所有安全性、药代动力学/免疫原性分析结果,选出剂量扩增阶段的待评估剂量(建议为第2期剂量,rp2d)和给药间隔。
[0245]
(2)针对恶性胶质瘤患者进行临床研究,根据来自剂量递增阶段1-5队列患者(共15名患者)的安全性、药效学/免疫原性分析结果选出第2期建议剂量(rp2d)。根据研究人员的临床意义和风险评估,没有严重毒性和显著临床疾病进展的受试者继续给予试验药物。
[0246]
参与患者的年龄范围为32岁至81岁,包括女性和男性患者。患者先前被确认为滑膜肉瘤、浸润性导管癌、直肠癌、结肠癌、卵巢癌、升结肠癌、肛门癌、侵袭性导管癌、腺癌、直肠癌伴主动脉旁转移、神经内分泌癌(宫颈)、乙状结肠癌症或恶性胶质瘤。受试者之前接受过一种或多种癌症治疗,包括手术、放疗和化疗。
[0247]
b.研究设计:
[0248]
对剂量递增阶段(每个疗程的第21天、第28天、第42天、第56天、第63天、第84天)的局部晚期或转移性实体癌和恶性胶质瘤患者肌内注射固定剂量的修饰il-7融合蛋白(gx-i7),注射频率为每隔21天、28天、42天、56天、63天、84天,注射时间为每疗程的第1天。
[0249]
剂量递增阶段包括:il-7融合蛋白肌内注射的9个阶段(或5个阶段),剂量为60μg/kg、120μg/kg、240μg/kg、480μg/kg、720μg/kg、960μg/kg、1200μg/kg、1700μg/kg、2000μg/kg或60μg/kg、360μg/kg、600μg/kg、840μg/kg、1440μg/kg,如表3所示。评估安全性、耐受性和药代动力学/药效变化。肌内注射时,划分注射部分并进行注射,这样每个注射部位的注射量不超过2ml。
[0250]
表3.给药组和剂量递增
[0251]
[0252][0253]
c.安全性
[0254]
1.实体瘤患者
[0255]
通过剂量递增阶段受试者(总计21名局部晚期或转移性实体癌患者)的不良反应(异常实验室检查值、受试者主诉的临床症状和体征、研究人员评估等)评估安全性。结果如表4所示。
[0256]
在全部不良反应中,44例(16/21,76.2%)不良药物反应(adr)被判定为“与试验药物有关”。按照nci-ctcae(4.0版),将药物不良反应(adr)分为29例轻度(1级),15例中度(2级),3级、4级、5级不良反应为0例。共报告了3起严重不良事件(sae),均被评估为“与试验药物无关”。从adr报告频率来看,注射部位反应最常见,为25例(14/21,66.7%),发热8例,皮疹4例,食欲减退2例,乏力、背痛、便秘、流感样疾病和肌痛各报告1例。因此可确定该药物不会导致严重不良反应。
[0257][0258]
2.恶性胶质瘤患者
[0259]
通过剂量递增阶段报15名恶性胶质瘤患者报告的不良反应(异常实验室检查值、受试者主诉的临床症状和体征、研究人员评估等)评估安全性。见表5。
[0260]
全部不良反应中,32例(13/15,86.7%)药物不良反应(adrs)被判定为“与有药有
关”。60μg/kg组有1名患者(33.3%,2例),360μg/kg组有3名患者(100.0%,10例),600μg/kg组有3名患者。(100.0%,5例),840μg/kg组有3名患者(100.0%,7例),1440μg/kg组有3名患者(100.0%,8例)。按照nci-ctcae(4.0版)将药物不良反应(adr)分为:21例轻度不良反应(1级),11例中度不良反应(2级),无3级、4级、5级adr。根据adr的报告频率,注射部位反应发生频率最高,有9例(11/15,66.0%)。荨麻疹6例,瘙痒3例,发热、发热、红肿各2例,注射部位疼痛、肌痛、外周水肿、乏力、皮疹各1例。因此可确定该药物不会导致严重不良反应。
[0261]
表5.恶性胶质瘤患者的全部不良事件和药物不良反应
[0262]
[0263][0264]
*teae:治疗期出现的不良事件
[0265]
3.药代动力学特征
[0266]
计算各受试者的药代动力参数值,并用各剂量组的平均值、标准偏差、最小值和最大值进行统计描述。
[0267]
修饰il-7融合蛋白gx-17给药前(0小时)和给药后0.5小时、6小时、12小时、24小时、48小时、72小时、168小时、336小时和504小时采集血样,用市售elisa试剂盒(human il-7 quantikine hs elisa kit hs750,由r&d systems提供)分析il-7的血药浓度,结果如附表(pk参数)和附图所示。
[0268]
各剂量组中每个受试者的血药浓度-时间曲线如图2所示,药代动力学参数如表6所示。各剂量组肌内注射il-7融合蛋白前后的血药浓度测量结果。可看到il-7的血液浓度以剂量依赖方式增加。
[0269]
第一次肌内注射时,修饰il-7融合蛋白的血药浓度在12小时至48小时内达到各剂量的最高血药浓度后开始下降,半衰期(t1/2)为33小时至147小时,与前者存在差异。
[0270]
尽管个体之间存在差异,但随着试验药物剂量的增加,c
max
和auc
last
呈增加趋势,并且c
max
和auc
last
在1200μg/kg剂量下的增加量高于960μg/kg下的增加量,从而呈现出一种趋势。c
max
和auc
last
随剂量变化的关系如图3a和图3b显示。
[0271]
表6.单次肌内注射后血清中il-7融合蛋白的pk参数汇总
[0272][0273]
[注]c
max
=最大浓度;t
max
=达到最大浓度的时间;auc
0-168h
=从时间点0小时到168小时的曲线下面积;
1)
中值(最小值,最大值),
2)
几何均值
±
sd
[0274]
4.药效学(pd)特征
[0275]
(a)实体癌患者的临床试验
[0276]
为了评估作为探索性药效学指标指示局部晚期或转移性实体癌患者中il-7融合蛋白活性的生物标志物,对21名剂量递增阶段的受试者注射试验药物。采集注射前后的外周血,并测定血液中的各种免疫细胞类型和百分比变化。
[0277]
(b)恶性胶质瘤患者临床试验
[0278]
对剂量递增阶段的15名受试者注射试验药物以评估作为探索性药效学指标指示恶性胶质癌患者中il-7融合蛋白活性的生物标志物。采集注射前后的外周血,并测定血液中的各种免疫细胞类型和比例变化。
[0279]
4.1注射il-7融合蛋白前后的淋巴细胞绝对数(alc)变化
[0280]
为了测量淋巴细胞绝对数(alc),按整个患者组中各个剂量组(cohort)注射il-7融合蛋白,采集注射前及注射3周后的患者血液。用分析仪测量alc绝对值。
[0281]
低剂量(60μg/kg至120μg/kg&60μg/kg)、中剂量(240μg/kg至480μg/kg&360μg/kg至600μg/kg)、高剂量(720μg/kg至1200μg/kg&840μg/kg至1440μg/kg)的实体癌和恶性胶质瘤患者组中,给药3周alc绝对值较基线的变化如图4a和图4b所示。结果证实,高剂量组(720μg/kg至1440μg/kg)中,alc绝对值的变化较基线值增加了4.4倍。同时证实,cd3
、cd4
、cd8
t细胞也有相同的增加趋势。如图5a、图5b、提6a、图6b、图7a和图7b所示。
[0282]
4.2淋巴细胞减少患者中alc的变化
[0283]
将注射il-7融合蛋白前alc基线水平低于1000个/mm3的所有实体癌患者和恶性胶
质瘤患者归为淋巴细胞减少患者,每隔3周或6周给予il-7融合蛋白(实体癌),或每隔4周、8周、9周、12周给予il-7融合蛋白(gbm)。随后观察各淋巴细胞减少组和非淋巴细胞减少组的alc变化,结果显示在图1和图3中。图8a、图8b、图9a和图9b所示。
[0284]
分析结果证实在非淋巴细胞减少患者组中alc值显着增加,且给药3周后,alc低于1000个/mm3的淋巴细胞减少患者组的alc值增加至正常水平。此外,还证实了非淋巴细胞减少患者组的较基线值增幅变化与淋巴细胞减少患者组类似,特别是在高剂量组中。
[0285]
4.3ki67、cd127(il-7rα)和t细胞亚型(亚群)分析结果
[0286]
将ki67表达变化作为实体癌患者中alc增加的先导指标,由此可以证实cd4
t细胞和cd8
t细胞中ki67表达量的增加与剂量有关。另一方面还证实了高剂量下il-7受体——cd127的表达水平较基线水平有明显下降。此外,cd4
t细胞和cd8
t细胞数量(cd4
/treg比率及cd8
/treg比率)较调节免疫系统的调节t细胞(treg细胞)的变化表明各剂量组中cd4
和cd8
t细胞较基线的增加量高于treg细胞较基线的增加量。如图10a、图10b和图10c所示。
[0287]
4.4分析最佳给药时间间隔下ki67表达和alc变化
[0288]
4.4.a.确定给药间隔的临床前研究结果
[0289]
为确认il-7融合蛋白的反应性以设定给药间隔,在各时间点体外给予il-7融合蛋白7天后,用猴类实验中获得的血样确认ki67反应性。采血时间点如图11所示。
[0290]
il-7融合蛋白给药前14天、10天、3天及给药后的结果表明,il-7融合蛋白增加了pbmcs中的ki67表达。第4天、第11天和第18天采集的血样中证实了il-7融合蛋白可降低ki67的表达。cd4
和cd8
t细胞中都观察到了这种趋势,并证实第31天、第45天、第59天、第73天的血液样本中ki67表达上升。
[0291]
结果表明,il-7融合蛋白首次使t细胞增殖后,可能需要一定的时间才会出现再次增殖。据估计,转折点会越来越大。此外,观察到某些个体(zc5m03)大约在5周至6周时恢复其反应性。如图12a和图12b所示。
[0292]
4.4.b.设定给药时间间隔的临床研究结果
[0293]
单次给予癌症患者il-7融合蛋白,测得的alc变化表明高剂量组中首次给药后alc的增加可最多维持12周。这表明在设置给药时间间隔上可以维持8周至12周或更长时间(例如,15周)。如图13a和图13b所示。
[0294]
在一项关于恶性胶质瘤患者的研究中,il-7融合蛋白不仅仅是单独给药,还可以与其它抗癌药联用,如:针对恶性胶质瘤患者的标准疗法——化疗(tmz)。通过重复给药,alc显着增加。结果表明,通过单次或重复给予il-7融合蛋白可将通常被当前化疗药物(优先杀死快速增殖细胞)降低的淋巴细胞绝对数(alc)数维持在一定水平上。因此,il-7融合蛋白有望用于增强或改善抗癌治疗。如图14a、图14b和图14c所示。
[0295]
4.5给予il-7融合蛋白后t细胞亚群、nk细胞和b细胞的变化
[0296]
分析il-7融合蛋白——gx-i7治疗患者组的cd4
t细胞及cd8
t细胞亚型,可发现cd4
t细胞和cd8
t细胞的增加与剂量相关。初始cd4
和cd8
t细胞较基线的增幅最大。ccr5表达较各剂量基线值也有所增加,这表明il-7融合蛋白可诱导t细胞迁移到肿瘤部位。nk细胞相较于基线的增加也与剂量有关。但b细胞较基线没有增加。如图15a和图15b所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。