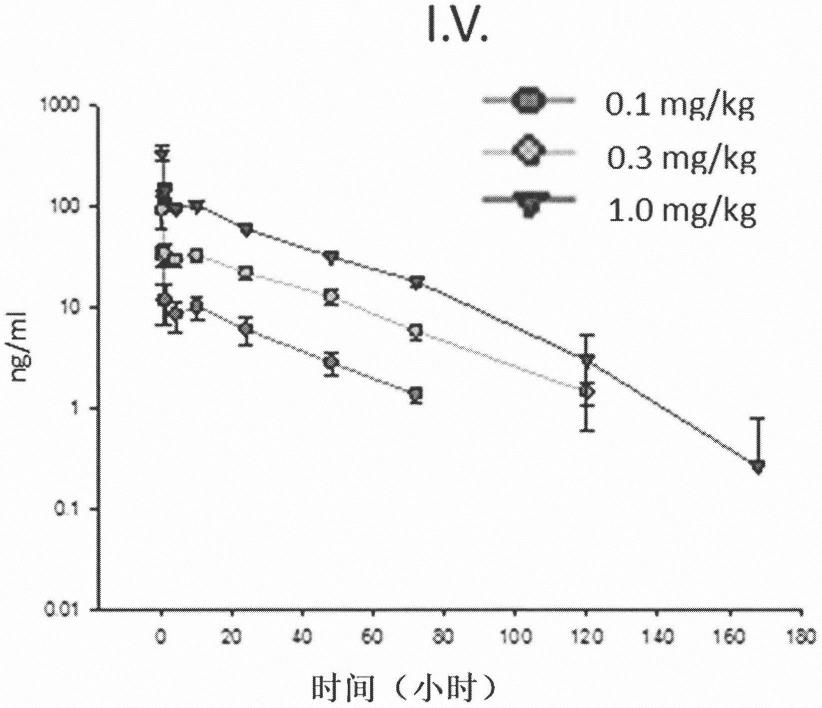
技术特征:
1.一种在有需要的受试者中增加淋巴细胞数的方法,其特征在于,包括给予(i)下式(i)所示的修饰白细胞介素-7:a-il-7
ꢀꢀ
式(i)其中a是由1个至10个氨基酸残基组成的寡肽,且il-7是能够与il-7受体结合的多肽;或者(ii)白细胞介素-7融合蛋白,包含:(a)所述修饰白细胞介素-7;(b)第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的寡肽,所述寡肽由蛋氨酸、甘氨酸或其组合组成;以及(c)第三结构域,所述第三结构域延长所述白细胞介素-7融合蛋白的半衰期,受试者的给药剂量约为600μg/kg以上。2.根据权利要求1所述的方法,其特征在于,所述受试者为患有癌症、感染、右心室慢性衰竭、霍奇金病、胸导管渗漏或破裂、抗癌药(如:化疗)、抗病毒剂或糖皮质激素等处方药副作用、低蛋白饮食导致的营养不良、放疗、尿毒症、自身免疫性疾病、免疫缺陷综合征、胸腺切除或其组合病症;或特发性急性辐射综合征(ars)或其组合病症的患者。3.根据权利要求1或2所述的方法,其特征在于,所述il-7的氨基酸序列选自由seq id no:1至seq id no:6组成的组中。4.根据权利要求3所述的方法,其特征在于,a与il-7的n端相连。5.根据权利要求3所述的方法,其特征在于,a为蛋氨酸、甘氨酸、蛋氨酸-蛋氨酸、甘氨酸-甘氨酸、蛋氨酸-甘氨酸、甘氨酸-蛋氨酸、蛋氨酸-蛋氨酸-蛋氨酸、蛋氨酸-蛋氨酸-甘氨酸、蛋氨酸-甘氨酸-蛋氨酸、甘氨酸-蛋氨酸-蛋氨酸、蛋氨酸-甘氨酸-甘氨酸、甘氨酸-蛋氨酸-甘氨酸、甘氨酸-甘氨酸-蛋氨酸或甘氨酸-甘氨酸-甘氨酸。6.根据权利要求5所述的方法,其特征在于,所述第三结构域连接至所述第一结构域或所述第二结构域的n端或c端。7.根据权利要求4至6中任一项所述的方法,其特征在于,所述第三结构域为选自由免疫球蛋白fc区或其部分、白蛋白、白蛋白结合多肽、pro/ala/ser(pas)、人绒毛膜促性腺激素β亚基的c端肽(ctp)、聚乙二醇(peg)、非结构化亲水长氨基酸序列(xten)、羟乙基淀粉(hes)、白蛋白结合小分子及其组合组成的组中的一种。8.根据权利要求7所述的方法,其特征在于,所述第三结构域包含修饰免疫球蛋白的fc区。9.根据权利要求8所述的方法,其特征在于,所述修饰免疫球蛋白选自由igg1、igg2、igg3、igg4、iga1、iga2、igd、ige及其组合组成的组中。10.根据权利要求9所述的方法,其特征在于,所述修饰免疫球蛋白的fc区从n端向c端方向包含铰链区、ch2结构域和ch3结构域,其中所述铰链区包含人igd铰链区;所述ch2结构域包含人igd和人igg4ch2结构域的部分氨基酸残基;所述ch3结构域包含人igg4ch3结构域的部分氨基酸残基。11.根据权利要求10所述的方法,其特征在于,所述修饰免疫球蛋白的fc区由下式(i)表示:
式(i):n
’‑
(z1)p-y-z2-z3-z4-c’,其中,n
′
是多肽的n端,c
′
是多肽的c端;p为整数0或1;从seq id no:7的第90位至第98位的氨基酸残基中,z1是从第98位的氨基酸残基向n端方向具有5个至9个连续氨基酸残基的氨基酸序列;从seq id no:7的第99位至第162位的氨基酸残基中,y是从第162位氨基酸残基向n端方向具有5个至64个连续氨基酸残基的氨基酸序列;从seq id no:7的第163位至第199位的氨基酸残基中,z2是从第163位氨基酸残基向c端方向具有4个至37个连续氨基酸残基的氨基酸序列;从seq id no:8的第115位至第220位的氨基酸残基中,z3是从第220位氨基酸残基向n端方向具有71个至106个连续氨基酸残基的氨基酸序列;以及从seq id no:8的第221位至第327位的氨基酸残基中,z4是从第221位氨基酸残基向c端方向具有80个至107个连续氨基酸残基的氨基酸序列。12.根据权利要求1所述的方法,其特征在于,所述第三结构域的氨基酸序列选自由seq id no:9至seq id no:14组成的组中。13.根据权利要求2所述的方法,其特征在于,所述癌症是实体瘤、淋巴系统癌或白血病。14.根据权利要求13所述的方法,其特征在于,所述实体瘤是滑膜肉瘤、浸润性导管癌、直肠癌、结肠癌、卵巢癌、升结肠癌、肛门癌、侵袭性导管癌、腺癌、伴有主动脉旁转移的直肠癌、神经内分泌癌(子宫颈)、乙状结肠癌或恶性胶质瘤。15.根据权利要求1、2、13或14中任一项所述的方法,其特征在于,所述受试者先前已经接受过、正同时接受或将接受包括手术、放疗和/或化疗的一种或多种癌症治疗。16.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量范围约为大于600μg/kg至2000μg/kg。17.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为720μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1700μg/kg或以上、或2000μg/kg。18.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为720μg/kg或以上、840μg/kg或以上、或1440μg/kg或以上。19.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为720μg/kg或以上、840μg/kg或以上、960μg/kg或以上、1200μg/kg或以上、1440μg/kg或以上、1700μg/kg或以上、2000μg/kg。20.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率为每隔1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周或15周给药两次或多次。21.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率为每隔10天、20天、30天、40天、50天、60天、70天、80天、90天或100天给药两次或多次。
22.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白通过肠道外、肌内、皮下、眼部、静脉、腹腔、皮内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内或肿瘤内给药。23.根据权利要求1或2所述的方法,其特征在于,包括给予所述(ii)白细胞介素-7融合蛋白。24.根据权利要求23所述的方法,其特征在于,所述(ii)白细胞介素-7融合蛋白包含seq id no:24的氨基酸序列。25.根据权利要求1或2所述的方法,其特征在于,根据4.0版不良事件通用术语标准(ctcae),所述受试者血液中淋巴细胞数为约1000个/μl以下。26.根据权利要求25所述的方法,其特征在于,所述淋巴细胞是t细胞。27.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药频率为每隔1周、2周、3周、4周、5周或6周给予2次或多次。28.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为840μg/kg,给药频率为每隔2周、3周、4周、5周或6周给药2次或多次。29.根据权利要求1或2的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为960μg/kg,给药频率为每隔2周、3周、4周、5周、6周、7周、8周或9周给药2次或多次。30.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1200μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周或10周给药2次或多次。31.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为1440μg/kg,给药频率为每隔3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、2个月或3个月给药2次或多次。32.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量大于约600μg/kg、大于约700μg/kg、大于约800μg/kg、大于约900μg/kg、大于约1000μg/kg、大于约1100μg/kg、大于约1200μg/kg、大于约1300μg/kg、大于约1400μg/kg、大于约1500μg/kg、大于约1600μg/kg、大于约1700μg/kg、大于约1800μg/kg、大于约1900μg/kg、大于约2000μg/kg。33.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为610μg/kg至1200μg/kg、650μg/kg至1200μg/kg、700μg/kg至1200μg/kg、750μg/kg至1200μg/kg、800μg/kg至1200μg/kg、850μg/kg至1200μg/kg、900μg/kg至1200μg/kg、950μg/kg至1200μg/kg、1000μg/kg至1200μg/kg、1050μg/kg至1200μg/kg、1100μg/kg至1200μg/kg、1200μg/kg至2000μg/kg、1300μg/kg至2000μg/kg、1500μg/kg至2000μg/kg、1700μg/kg至2000μg/kg、610μg/kg至1000μg/kg、650μg/kg至1000μg/kg、700μg/kg至1000μg/kg、750μg/kg至1000μg/kg、800μg/kg至1000μg/kg、850μg/kg至1000μg/kg、900μg/kg至1000μg/kg、950μg/kg至1000μg/kg。34.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述
(ii)白细胞介素-7融合蛋白的给药剂量约为700μg/kg至900μg/kg、750μg/kg至950μg/kg、700μg/kg至850μg/kg、750μg/kg至850μg/kg、700μg/kg至800μg/kg、800μg/kg至900μg/kg、750μg/kg至850μg/kg、850μg/kg至950μg/kg。35.根据权利要求1或2所述的方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白的给药剂量约为650μg/kg、680μg/kg、700μg/kg、720μg/kg、740μg/kg、750μg/kg、760μg/kg、780μg/kg、800μg/kg、820μg/kg、840μg/kg、850μg/kg、860μg/kg、880μg/kg、900μg/kg、920μg/kg、940μg/kg、950μg/kg、960μg/kg、980μg/kg、1000μg/kg、1020μg/kg、1040μg/kg、1060μg/kg、1080μg/kg、1100μg/kg、1120μg/kg、1140μg/kg、1160μg/kg、1180μg/kg、1200μg/kg、1220μg/kg、1240μg/kg、1260μg/kg、1280μg/kg、1300μg/kg、1320μg/kg、1340μg/kg、1360μg/kg、1380μg/kg、1400μg/kg、1420μg/kg、1440μg/kg、1460μg/kg、1480μg/kg、1500μg/kg、1520μg/kg、1540μg/kg、1560μg/kg、1580μg/kg、1600μg/kg、1620μg/kg、1640μg/kg、1660μg/kg、1680μg/kg、1700μg/kg、1720μg/kg、1740μg/kg、1760μg/kg、1780μg/kg、1800μg/kg、1820μg/kg、1840μg/kg、1860μg/kg、1880μg/kg、1900μg/kg、1920μg/kg、1940μg/kg、1960μg/kg、1980μg/kg、2000μg/kg。36.根据权利要求1或2所述方法,其特征在于,所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白以每周一次、每两周一次、每3周一次、每4周一次、每5周一次、每6周一次、每7周一次、每8周一次、每9周一次、每10周一次、每11周一次、每12周一次、每13周一次、每14周一次或每15周一次的频率给药。37.根据权利要求26所述的方法,其特征在于,所述t细胞是cd4
和/或cd8
t细胞。38.根据权利要求26所述的方法,其特征在于,所述t细胞是cd4
/cd8
t细胞。39.根据权利要求25所述的方法,其特征在于,所述受试者血液中的淋巴细胞数约为800个/μl以下。40.根据权利要求25所述的方法,其特征在于,所述受试者血液中的淋巴细胞数约为500个/μl以下。41.根据权利要求25所述的方法,其特征在于,所述受试者血液中的淋巴细胞数约为200个/μl以下。42.根据权利要求1或2所述的方法,其特征在于,所述受试者已经使用过、正同时使用或将使用抗癌药。43.根据权利要求42所述的方法,其特征在于,所述抗癌药是抗癌化合物。44.根据权利要求25或42所述的方法,其特征在于,给予所述(i)修饰白细胞介素-7或所述(ii)白细胞介素-7融合蛋白治疗后肿瘤浸润淋巴细胞(til)的数量与给药前til数量相比有所增加。45.根据权利要求44所述的方法,其特征在于,所述til是cd4
til。46.根据权利要求44所述的方法,其特征在于,所述til是cd8
til。47.根据权利要求44所述方法,其特征在于,给药后til的数量至少增加10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、125%、150%、200%、250%、300%。48.一种以下(i)和/或(ii)用于在有需要的受试者中增加淋巴细胞数的用途,其特征在于,包括给予(i)下式(i)所示的修饰白细胞介素-7:
a-il-7
ꢀꢀ
式(i)其中a是由1个至10个氨基酸残基组成的寡肽,且il-7是能够与il-7受体结合的多肽;和/或(ii)白细胞介素-7融合蛋白,包含:(a)所述修饰白细胞介素-7;(b)第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的寡肽,所述寡肽包括蛋氨酸、甘氨酸或其组合;以及(c)第三结构域,所述第三结构域延长所述白细胞介素-7融合蛋白的半衰期,所述受试者的给药剂量约为600μg/kg以上。49.一种以下(i)和/或(ii)用于制造在有需要的受试者中增加淋巴细胞数的治疗药物的用途,所述药物的给药剂量约为600μg/kg以上,其特征在于,(i)下式(i)所示的修饰白细胞介素-7:a-il-7
ꢀꢀ
式(i)其中a是由1个至10个氨基酸残基组成的寡肽,且il-7是能够与il-7受体结合的多肽;和/或(ii)白细胞介素-7融合蛋白,包含:(a)所述修饰白细胞介素-7;(b)第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的寡肽,所述寡肽包括蛋氨酸、甘氨酸或其组合;以及(c)第三结构域,所述第三结构域延长所述白细胞介素-7融合蛋白的半衰期。50.一种用于在有需要的受试者中增加淋巴细胞数的药物组合物,其特征在于,包含活性成分:(i)下式(i)所示的修饰白细胞介素-7:a-il-7
ꢀꢀ
式(i)其中a是由1个至10个氨基酸残基组成的寡肽,且il-7是能够与il-7受体结合的多肽;和/或(ii)白细胞介素-7融合蛋白,包含:(a)所述修饰白细胞介素-7;(b)第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的寡肽,所述寡肽包括蛋氨酸、甘氨酸或其组合;以及(c)第三结构域,所述第三结构域延长所述白细胞介素-7融合蛋白的半衰期,其中所述药物组合物的给药剂量大于约600μg/kg。
技术总结
本发明涉及一种在有需要的受试者中增加淋巴细胞数的方法,包括给予受试者(i)修饰白细胞介素-7(式(I)所示):A-IL-7,其中A是由1个至10个氨基酸残基组成的寡肽,IL-7是能够与IL-7受体结合的多肽;或(ii)白细胞介素-7融合蛋白,其包含:(a)所述修饰白细胞介素-7;(b)第二结构域,所述第二结构域包含具有1个至10个氨基酸残基的寡肽,所述寡肽包含蛋氨酸、甘氨酸或其组合;以及(c)第三结构域,所述第三结构域延长所述白细胞介素-7融合蛋白的半衰期。7融合蛋白的半衰期。7融合蛋白的半衰期。
技术研发人员:成永哲 禹晶媛 许珉奎 杨尚仁 梁世焕
受保护的技术使用者:新免疫技术有限公司
技术研发日:2020.09.04
技术公布日:2022/7/12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。