1.本发明属于生物技术领域,具体涉及一种双斑东方鲀精巢组织细胞系及其应用。
背景技术:
2.双斑东方鲀 (takifugu bimaculatus),属鲀形目,鲀科,东方鲀属,为近海暖温性底层鱼类,分布于我国南海、东海和黄海南部。其经济价值高、开发潜力大的水产珍品。建立鱼类细胞系能为鱼类病毒分离、抗病毒机制、疫苗研发、转基因技术、嵌合体组织工程等研究提供极大的便捷,且设施人力等资源的要求相对活体实验低,重复性好,研究周期短。细胞系为开展鱼类毒理、病理、遗传分析等研究提供了重要的体外模型。
3.目前关于双斑东方鲀细胞系的建立未见报道;仅有关于其他东方鲀属的部分细胞系的建立及少部分分离培养。王培军等采用组织块培养和细胞悬液培养暗纹东方鲀(takifugu obscurus)的肾脏组织对暗纹东方纯组织细胞的原代培养方法进行了研究和探索,但并没有达到预期的效果;samuel等对星点东方鲀(takifugu niphobles)和红鳍东方鲀(takifugu rubripes)的眼、大脑、肝脏、鳍、脾脏、肾脏、鳔和肌肉进行原代培养,其中眼细胞的生长速度最快,对两种河鲀的各种组织中衍生的细胞进行多次继代培养,红鳍东方鲀眼细胞在近一年的过程中已经连续培养维持超过60次继代。zhang等(zhang et al. initiation of two ovarian cell lines from fugu rubripes (temminck et. schlegel)[j]. 海洋学报(英文版), 2015. 701-711.)从红鳍东方鲀卵巢中建立了称为tsoc1和tsoc2的细胞系,tsoc1由梭形上皮样细胞组成,而另一种由鹅卵石样细胞组成;并研究了包括温度,fbs浓度和ph在内的生长条件。yang等已建立红鳍东方鲀精巢细胞系,命名为trs,并证明了可有效地将外源基因或蛋白质传递到trs中。
[0004]
本研究将双斑东方鲀的精巢进行分离培养,获得其原代细胞,并进行连续继代培养,最终建立稳定的双斑东方鲀精巢组织细胞系,为双斑东方鲀性腺发育机制研究提供了一种新的体外模型。
技术实现要素:
[0005]
本发明的目的在于针对上述现有问题,提供一种双斑东方鲀精巢组织细胞系及其应用。本发明将双斑东方鲀的精巢进行分离培养,获得其原代细胞,并进行连续继代培养,最终建立稳定的双斑东方鲀精巢组织细胞系,为双斑东方鲀性腺发育机制研究提供了一种新的体外模型。
[0006]
为实现上述目的,本发明采用如下技术方案:一株双斑东方鲀精巢组织细胞系,所述细胞系分类命名为双斑东方鲀精巢细胞tbtc,已于2021年10月11日于中国典型培养物保藏中心保藏,保藏号为cctcc no:c2021230,保藏地址为中国武汉,武汉大学。
[0007]
一株双斑东方鲀精巢细胞系(tbtc)的构建方法,包括以下步骤:(1)双斑东方鲀精巢组织的获取:将7个月大,长8-10cm的双斑东方鲀幼鱼在含三
抗的灭菌海水中暂养1
ꢀ‑ꢀ
2h,使用添加1wt
‰
次氯酸钠的灭菌海水对鱼体表面进行消毒15 min,然后滴入占灭菌海水体积0.005
ꢀ‑ꢀ
0.015%的丁香酚,直至鱼体翻转,腹部朝上,对刺激应激无反应为止;以灭菌纱布块擦除鱼体表面粘液,再以浸有酒精的纱布擦拭鱼体表面后,将鱼体移入超净台,用解剖器具取出性腺组织,取一部分放入多聚甲醛(pfa)中固定用于切片观察确定性腺组织为精巢组织,一部分于含三抗的pbs溶液中漂洗3
ꢀ‑ꢀ
4次用于原代细胞培养;上述三抗为三抗的100
ꢀ×
浓缩液:含10,000 u/ml青霉素、10,000 μg/ml链霉素及10,000 u/ml两性霉素b;三抗的灭菌海水:配制时每100 ml灭菌海水加入1 ml三抗的100
ꢀ×
浓缩液;含三抗的pbs溶液:100 ml pbs溶液加入1 ml三抗的100
ꢀ×
浓缩液;(2)组织切片:将双斑东方鲀精巢组织经固定、包埋、切片、染色后中性树胶封片保存,光学显微镜观察并拍照,(3)原代培养:将上述双斑东方鲀精巢组织切碎至1 mm3的小组织块,以pbs溶液漂洗2次;漂洗后将上述小组织块转移至15 ml离心管中,使用含三抗的pbs溶液清洗3次,小心吸去液体;
①
干贴法:将清洗干净的组织碎块在t25细胞培养瓶中均匀地铺开,倒置培养24 h后,小心加入5 ml完全培养液,继续培养;此期间每三天更换一半培养液;
②
单细胞接种法:向15 ml离心管中加入5 ml 0.25wt%胰酶消化组织块30 min来获得单细胞,并利用70 μm细胞过滤筛过滤消化的细胞,转移至15 ml离心管中,收集细胞沉淀,用5 ml完全培养液重悬细胞后接种于细胞培养瓶中,于27℃恒温培养启动原代培养,每2
ꢀ‑ꢀ
3天更换一半完全培养液;
③
半干贴法:向15 ml离心管中加入1 ml 0.25wt%胰酶消化组织块10 min后加入3 ml完全培养液,吹打均匀,将细胞和组织块同时接种至t25细胞培养瓶中,于27℃恒温培养启动原代培养,每2
ꢀ‑ꢀ
3天更换一半完全培养液;(4)传代培养:原代培养时由于细胞分布不均匀,单细胞局部产生接触抑制时,采用0.25wt%胰酶消化细胞,并向原培养瓶中加入5 ml完全培养基重悬细胞,待原瓶贴壁细胞增殖至80-90%覆盖率时,移除旧培养液,加入5 ml含1vol%三抗的pbs溶液清洗1次;然后以0.25wt%胰酶消化法传代悬起细胞,以细胞悬液与完全培养液的体积比为1:2进行传代;以后每隔3
ꢀ‑ꢀ
4天传代一次,直至50代,成功建立双斑东方鲀精巢组织细胞系。优选的,其中细胞悬液与完全培养液的体积比为1:2。
[0008]
上述完全培养液:以l-15培养液为基础培养液,胎牛血清(fbs)、β-巯基乙醇、n-乙酰葡糖糖胺、羧甲基纤维素钠、人碱性成纤维生长因子(human fgf
‑ꢀ
basic)、人上皮细胞生长因子(human egf)、人肝细胞生长因子(human hgf)、青霉素、链霉素、鱼血清与鱼胚提取物(tee)的添加量分别为15vol%~20vol%、0.5vol
‰
、50 μg/ml、50 μg/ml、20 μg/l、10 μg/l、2 μg/l、100 iu/ml、100 μg/ml、1vol%和1vol%。优选的,完全培养液中胎牛血清(fbs)的添加量为15vol%。
[0009]
上述鱼血清的制备方法:用15% (w/v) edta浸润10 ml注射器,从双斑东方鲀成鱼的尾静脉取血到15 ml的置于冰上的离心管中。3,500g离心15 min,转移上清液到50 ml离心管中,4
ꢀ°
c孵育过夜,3,500 g再离心30 min,上清液用0.2 μm过滤器过滤除菌,每10 ml
一管分装储存于15 ml离心管中,
‑ꢀ
20
°
c储存。
[0010]
上述鱼胚提取物(tee)的制备方法:至少收集2000个发育至第7天(30 hpf或受精后孵化前)的健康双斑东方鲀胚胎,用1
ꢀ×ꢀ
pbs清洗3次,
‑ꢀ
20℃保存备用。取500个左右胚胎,在玻璃匀浆器中用冷的1
ꢀ×ꢀ
pbs在冰上匀浆,将匀浆液转移到15 ml离心管中。在液氮—37
ꢀ°
c水浴反复冻结—融解3次后,将匀浆液进行4
°
c、3,500g离心30 min。转移上清液至新的1.5 ml离心管中,18,000g、4
°
c离心至少30 min以保证匀浆液分为3层:最上层是脂质层,最底层是碎片,中间层是双斑东方鲀胚胎提取物(tee),清晰且呈绿色。收集tee到15 ml离心管中,尽可能减少脂质污染。如果分层不清晰,重复离心分层步骤以获取最佳的分层效果和tee产量。tee用0.2 μm过滤器过滤除菌,并用1
ꢀ×ꢀ
pbs调整体积到1 ml含400个胚胎的量(即1胚胎/2.5 μl)。然后每1 ml 分装到一个1.5 ml离心管中,
‑ꢀ
20
°
c储存。
[0011]
上述一株双斑东方鲀精巢细胞系在双斑东方鲀性腺发育相关功能基因研究中的应用。
[0012]
上述一株双斑东方鲀精巢细胞系在基因编辑和功能分析中的应用。
[0013]
上述一株双斑东方鲀精巢细胞系在药理学,或基因筛选中的应用。
[0014]
与现有技术相比,本发明的有益效果:(1)本发明成功构建了首个双斑东方鲀精巢细胞系。本发明的双斑东方鲀精巢细胞系的细胞性状优良,以长纤维状细胞为主,分裂旺盛,传代时间短,易消化,贴壁率好,耐饥饿。
[0015]
(2)本发明细胞系的构建方法重复性强、构建的细胞系稳定性好。
[0016]
(3)本发明的构建方法所使用的完全培养液中包括l-15培养液、胎牛血清fbs、β-巯基乙醇、n-乙酰葡糖糖胺、羧甲基纤维素钠、human fgf
‑ꢀ
basic、human egf、human hgf、青霉素及链霉素,l-15培养液和胎牛血清fbs为细胞生长提供了充足的营养;β-巯基乙醇、n-乙酰葡糖糖胺、羧甲基纤维素钠、human fgf
‑ꢀ
basic、human egf和human hgf的加入可以刺激细胞活性、加速细胞分裂增殖,同时为细胞体外培养提供了良好的缓冲环境,能够使细胞在长期培养时维持稳定的ph;鱼血清与鱼胚提取物有助于提高鱼细胞培养中细胞的有丝分裂活性,可能是目前培养基中的关键添加剂之一;青霉素、链霉素与两性霉素b加大了抗菌谱,特别在原代培养时,能有效地抑制细菌生长,防止细胞污染。
[0017]
附图说明:图1 双斑东方鲀精巢组织切片及h.e.染色的显微镜照片。ps:初级精母细胞,s:成熟精子,ss:次级精母细胞。
[0018]
图2 双斑东方鲀精巢组织细胞系原代培养的显微镜照片。a:原代培养干贴法第5天的显微镜照片;b:原代培养干贴法第8天的显微镜照片;c:原代培养单细胞接种法第3天的显微镜照片;d:原代培养单细胞接种法第7天的显微镜照片;e:原代培养半干贴法第3天的显微镜照片;f:原代培养半干贴法第7天的显微镜照片;图3 双斑东方鲀精巢组织细胞系传代培养的显微镜照片。a:传代培养第1代的显微镜照片;b:传代培养第5代的显微镜照片;c:传代培养第10代的显微镜照片;d:传代培养第15代的显微镜照片;e:传代培养第20代的显微镜照片;f:传代培养第30代的显微镜照片;g:传代培养第35代的显微镜照片;h:传代培养第40代的显微镜照片;i:传代培养第50代的显微镜照片。
[0019]
图4 双斑东方鲀精巢组织细胞系冻存后复苏24h后的显微镜照片。a:冻存前精巢细胞活性分析;b:复苏时精巢细胞活性分析;c:复苏24h后的显微镜照片;d:复苏72h后的显微镜照片。
[0020]
图5 双斑东方鲀精巢组织细胞系生长特性分析。a:不同传代比例对双斑东方鲀精巢组织细胞系的增殖曲线;b:不同血清(fbs)浓度对双斑东方鲀精巢组织细胞系增殖的影响;c:不同培养液对双斑东方鲀精巢组织细胞系增殖的影响;d:不同温度下对双斑东方鲀精巢组织细胞系增殖的影响;图6 双斑东方鲀精巢组织细胞系的来源与类型细胞鉴定。a:双斑东方鲀精巢组织细胞系的来源与类型细胞鉴定b:双斑东方鲀精巢组织细胞的染色体核型分析。tbtc:双斑东方鲀精巢组织细胞;t:精巢组织;o:精巢组织;s:脾脏组织;b:脑组织;k:头肾组织;h:心脏组织;m:肌肉组织。
[0021]
图7 电转染后双斑东方鲀精巢组织细胞状况。a-c:电转染后双斑东方鲀精巢组织细胞状况的共聚焦显微镜照片;d-e:精巢组织细胞转染后再传代的荧光显微镜下的照片。
[0022]
图8 双斑东方鲀精巢组织细胞系干扰dmrt1基因结果。a:干扰了dmrt1基因24h后的tbtc细胞状态;b:干扰了dmrt1基因的tbtc细胞继续培养72h后的细胞状态。c:干扰了dmrt1基因的tbtc半定量结果;d:干扰了dmrt1基因的tbtc定量结果。
[0023]
图9 双斑东方鲀精巢组织细胞系关于dmrt1基因原位杂交的结果。a: 红色荧光;b: 蓝色荧光;c: 红色荧光 蓝色荧光。
[0024]
图10 双斑东方鲀精巢组织细胞系过表达nanog基因结果。a:未过表达nanog基因tbtc的细胞状态;b:过表达nanog基因tbtc的细胞状态。c:过表达nanog基因tbtc的半定量结果;d:过表达nanog基因tbtc的western blot结果。
[0025]
图11双斑东方鲀精巢组织细胞系饥饿处理的显微镜照片。a:饥饿处理30天后的显微镜照片;b:饥饿处理后传代并更换完全培养液36h的显微镜照片。
具体实施方式
[0026]
以下结合实施实例对本发明做进一步说明,需要指出的是,本实施实例仅用于解释本发明,而非对本发明的限制。
[0027]
实施例 1一株双斑东方鲀精巢组织细胞系(tbtc)的建立方法,包括以下步骤:(1)双斑东方鲀精巢组织的获取:将7个月大,长8-10 cm的双斑东方鲀幼鱼在含三抗的灭菌海水中暂养1 ~2 h,使用添加1wt
‰
次氯酸钠的灭菌海水对鱼体表面进行消毒15 min。结束时滴入占灭菌海水体积0.005
ꢀ‑ꢀ
0.015%的丁香酚,直至鱼体翻转,腹部向上,对刺激无应激反应为止,以灭菌纱布块擦除鱼体表黏液,再以浸有酒精的纱布擦拭鱼体表面后,将鱼体移入超净台,用解剖器具取出性腺组织,取一小部分放入多聚甲醛(pfa)中固定用于切片鉴定组织,一部分于含三抗的pbs溶液中漂洗3
ꢀ‑ꢀ
4次用于原代细胞培养。
[0028]
上述三抗为三抗的100
ꢀ×
浓缩液即含10,000 u/ml青霉素、10,000 μg/ml链霉素及10,000 u/ml两性霉素b;三抗的灭菌海水:配制海水时每100 ml灭菌海水加入1 ml三抗的100
ꢀ×
浓缩液;含三抗的pbs溶液:100 ml pbs液加入1 ml三抗的100
ꢀ×
浓缩液。配制海水时每
100 ml海水加入1 ml三抗的100
ꢀ×
浓缩液。
[0029]
(2)组织切片
①
固定:性腺组织块在4wt%的多聚甲醛中4 ℃固定9-10 h。
[0030]
②
脱水:取出性腺组织,用4 ℃ 1
ꢀ×ꢀ
pbs洗去固定液,再经甲醇梯度脱水(70vol%、80vol%、90vol%各20 min,100vol%两次,每次30 min)。
[0031]
③
透明:用二甲苯透明(1/2 100vol%甲醇+1/2二甲苯、100%二甲苯、100%二甲苯各10分钟)。
[0032]
④
透蜡:在恒温箱中透(1/2二甲苯+1/2 石蜡,45℃ 20分钟;纯石蜡
①
、纯石蜡
②
,60 ℃各25分钟)(组织块从1/2二甲苯+1/2 石蜡到石蜡
①
会残留一些杂质,所以经过石蜡
②
再处理能够更好的进行透蜡);
⑤
包埋:组织块快速放进包埋盒底部中央,滴加石蜡,待其凝固后,4 ℃保存备用;
⑥
切片:使用石蜡切片机切片,切片厚度5 μm,在42 ℃水浴锅中用捞片法展片贴片,42 ℃烘干,4 ℃保存备用。
[0033]
⑦
脱蜡:石蜡切片在二甲苯中浸泡15 min;
⑧
复水:二甲苯 100%乙醇(1:1)10 min,再经乙醇梯度复水(100vol%、95vol%、85vol%、70vol%、50vol%各5 min),双蒸水浸泡5 min;
⑨
染色:苏木精染色5-20 min(视不同组织而定),流水冲洗,再用1%伊红水溶液染色30s-3 min(视不同组织而定),流水冲洗;
⑩
脱水:乙醇梯度脱水(70vol%、85vol%、95vol%各5 min,100vol%
①
、100vol%
②
各10 min)(切片从95vol%乙醇到100%乙醇
①
会带有一些水分,所以经过100%乙醇
②
再处理能够更好的进行脱水处理);
⑪
透明:100%乙醇 二甲苯(1:1)中浸泡5 min,二甲苯ⅰ、ⅱ中各10 min(切片从100%乙醇 二甲苯(1:1)到二甲苯ⅰ会带有一些乙醇,所以经过二甲苯ⅱ再处理能够更好的进行透明处理);
⑫
封片:使用中性树胶封片保存,光学显微镜观察并拍照。如图1所示,本实施例所取性腺为精巢组织,分布有精小叶,在精小叶内有分布着精原细胞、初级精母细胞、次级精母细胞等。
[0034]
(3)原代培养:将双斑东方鲀精巢组织以两把11号手术刀交叉切碎至1 mm3大小的小组织块。将切好的小组织块以pbs溶液漂洗2次;漂洗后将上述小组织块转移至15ml离心管中,使用含三抗的pbs溶液清洗3次,小心吸去液体;
①
干贴法:将清洗干净的组织块在t25细胞培养瓶中均匀地铺开,倒置培养24h后,小心加入5 ml完全培养液,继续培养;此期间每三天更换一半培养液;
②
单细胞接种法:向15 ml离心管中加入5 ml 0.25wt%胰酶消化组织块30 min来获得单细胞,并利用70 μm细胞过滤筛过滤消化的细胞,转移至15 ml离心管中,收集细胞沉淀,用5 ml完全培养液重悬细胞后接种于细胞培养瓶中,于27 ℃恒温培养箱启动原代培养,每2
ꢀ‑ꢀ
3天更换一半完全培养液;
③
半干贴法:向15 ml离心管中加入1 ml 0.25wt%胰酶消化组织块10 min后加入3 ml完全培养液,吹打均匀,将细胞和组织块同时接种至t25细胞培养瓶中,于27℃恒温培养启动原代培养,每2
ꢀ‑ꢀ
3天更换一半完全培养液;
如图2 a-e所示,双斑东方鲀精巢组织启动原代培养后,干贴法于第5天即有少许细胞从组织块周围迁出(图2 a),至第8天细胞已有明显扩增(图2 b);单细胞接种法于第3天即有少许细胞开始贴壁(图2 c),至第7天细胞已扩增至60~70%(图2 d);半干贴法于第3天即有少许细胞开始贴壁并伴有少许细胞从组织块周围迁出(图2 e),至第7天贴壁细胞已扩增至70%~80%,迁出的细胞也扩增明显(图2 f)。
[0035]
所述完全培养液:以l-15培养液为基础培养液,胎牛血清、β-巯基乙醇、n-乙酰葡糖糖胺、羧甲基纤维素钠、人碱性成纤维生长因子(human fgf
‑ꢀ
basic)、人上皮细胞生长因子(human egf)、人肝细胞生长因子(human hgf)、青霉素、链霉素、鱼血清与鱼胚提取物(tee)的添加量分别为15vol%~20vol%、0.5vol
‰
、50 μg/ml、50 μg/ml、20 μg/l、10 μg/l、2 μg/l、100 iu/ml、100 μg/ml、1vol%和1vol%。
[0036]
上述鱼血清的制备方法:用15% (w/v) edta浸润10 ml注射器,从双斑东方鲀成鱼的尾静脉取血到15 ml的置于冰上的离心管中。3,500g离心15 min,转移上清液到50 ml离心管中,4
ꢀ°
c孵育过夜,3,500 g再离心30 min,上清液用0.2 μm过滤器过滤除菌,每10 ml一管分装储存于15 ml离心管中,
‑ꢀ
20
°
c储存。
[0037]
上述鱼胚提取物(tee)的制备方法:至少收集2000个发育至第7天(30 hpf或受精后孵化前)的健康双斑东方鲀胚胎,用1
ꢀ×ꢀ
pbs清洗3次,
‑ꢀ
20℃保存备用。取500个胚胎,在玻璃匀浆器中用冷的1
ꢀ×ꢀ
pbs在冰上匀浆,将匀浆液转移到15 ml离心管中。在液氮—37
ꢀ°
c水浴反复冻结—融解3次后,将匀浆液进行4
°
c、3500g离心30 min。转移上清液至新的1.5 ml离心管中,18,000g、4
°
c离心至少30 min以保证匀浆液分为3层:最上层是脂质层,最底层是碎片,中间层是双斑东方鲀胚胎提取物(tee),清晰且呈绿色。收集tee到15 ml离心管中,尽可能减少脂质污染。如果分层不清晰,重复离心分层步骤以获取最佳的分层效果和tee产量。tee用0.2 μm过滤器过滤除菌,并用1
ꢀ×ꢀ
pbs调整体积到1 ml含400个胚胎的量(即1个胚胎/2.5 μl)。然后每1 ml 分装到一个1.5 ml离心管中,
‑ꢀ
20
°
c储存。
[0038]
注意:在加入培养基前,取冷冻的tee在室温(25
°
c)融化,18,000g、4
ꢀ°
c离心至少30 min以去除碎片。分层不清晰和上清液转移不干净会影响tee质量。
[0039]
(4)传代培养:原代培养时由于细胞分布不均匀,单细胞局部产生接触抑制时,采用0.25wt%胰酶消化细胞,并向原培养瓶中加入5 ml完全培养基重悬细胞。待原瓶贴壁细胞覆盖率达到80-90%或是更高时,原代细胞会出现较明显的接触抑制,此时以胰酶消化法启动传代培养。采用经典细胞消化步骤:移除原先培养瓶中的旧培养液;加入5 ml pbs溶液(含1%(v/v)三抗),清洗1次以去除原培养液中的血清、二价金属离子(此类物质会极大的影响胰蛋白酶的消化作用);去除上述pbs溶液,加入0.5 ml 0.25wt%的商品化的含edta的胰酶消化液(gibco,25200072),晃动瓶体,使胰酶溶液与底层细胞充分接触,倒出胰酶消化液(此步应较快进行,否则易造成消化过度;移除胰酶消化液时应留有足够使平底保持湿润的溶液,否则瓶底易出现部分区域变干而影响消化);移出培养瓶,倒置显微镜下观察,至大多数细胞变圆解除贴壁后,立即移入超净台加入5 ml完全培养液终止消化;吹打,镜检吹打效果,如若残余细胞过多则可重复消化一次;以1:2-10的比例将细胞悬液接种至新培养瓶,补齐培养液至5 ml后将培养瓶置于27℃恒温培养,以后每隔3-4天传代一次。
[0040]
如图3 a
ꢀ‑ꢀ
i 所示,双斑东方鲀精巢组织细胞系从1代至第50代较稳定地呈现,以长纤维状为主。
hgf)、青霉素、链霉素、鱼血清与鱼胚提取物(tee)),取形态良好的双斑东方鲀精巢组织细胞,将细胞消化传至75 cm2培养瓶中,待其细胞覆盖率达90%时再将细胞传至含不同fbs浓度的培养基中,3天后采用五点计数法对各瓶细胞进行计数并作图分析。
[0049]
如图5 b所示,fbs浓度过低或者培养液不含fbs都对细胞不友好,精巢组织细胞很难正常生长,几乎不会进行扩增;而适当提高fbs浓度,细胞会明显增加扩增速度,15vol%和20vol%的fbs浓度使细胞能得到较好的扩增,总体来看,细胞的扩增效率和fbs浓度呈正相关。
[0050]
实施例 5实施例1的双斑东方鲀精巢细胞系不同培养液对tbtc细胞的影响为了确定tbtc的最适基础培养基,我们在实验前分别配置以m199、mem、dmem/f-12、l-15为基础培养基的添加15vol%胎牛血清fbs以及0.5vol
‰
、50 μg/ml、50 μg/ml、20 μg/l、10 μg/l、2 μg/l、100 iu/ml、100 μg/ml、1vol%和1vol%的β-巯基乙醇、n-乙酰葡糖糖胺、羧甲基纤维素钠、人碱性成纤维生长因子(human fgf
‑ꢀ
basic)、人上皮细胞生长因子(human egf)、人肝细胞生长因子(human hgf)、青霉素、链霉素、鱼血清(自制)与鱼胚提取物(自制)的完全培养液,再取增殖能力较好的细胞进行培养,在27℃下使用不同培养基培养,每隔1天使用细胞特征分析仪对每组细胞分别进行计数,并作图分析。
[0051]
如图5 c所示,在1
ꢀ‑ꢀ
2天细胞在各种培养液中均能较好地扩增生长,m199和mem培养液中的细胞在经过短暂地增殖后细胞几乎停止了扩增,说明m199和mem培养液并不适合tbtc细胞。在l-15培养液中的增殖速度明显快于其他三种,且能持续扩增,因此,l-15培养液为最适合tbtc细胞的培养液。
[0052]
实施例 6实施例1的双斑东方鲀精巢组织细胞系不同温度对tbtc细胞的影响为了确定tbtc的最适温度,我们在实验前按照实施案例4配置好l-15完全培养液,再取增殖能力较好的细胞进行培养,分别在21℃、23℃、27℃、30℃培养,每隔1天观察细胞并使用五点交叉取样法对各瓶细胞进行计数和做图分析。每隔1天使用细胞特征分析仪对每组细胞分别进行计数,并作图分析。
[0053]
如图5 d所示,在24℃和27℃下,细胞能够得到较好的生长,扩增速度快,细胞形态良好,其中在27℃时细胞的增殖速度略快与24℃;而21℃和30℃明显不是很适合fgo细胞的生长,说明温度过高或者过低都不利于细胞的生长,特别是在30℃下,细胞贴壁较少,不能快速增殖,甚至贴壁的细胞也会很快脱落,不适合继代培养。
[0054]
实施例 7实施例1的双斑东方鲀精巢细胞系的鉴定与验证使用rt-pcr技术,对双斑东方鲀精巢细胞系进行鉴定如图6。
[0055]
coi基因(上游引物序列为: 5
’‑
atccttcctccttctgct-3’,下游引物序列为: 5
’‑
ttgtatttaggtttcggtca-3’),在各组织和tbtc细胞中都有扩增出,割胶纯化后,测序序列与ncbi双斑东方鲀coi基因的序列比对结果在98%以上;dmrt1基因(上游引物序列为: 5
’‑
gagtcatggcggctcaggt-3’,下游引物序列为: 5
’‑
cacgctaaagatgggtggg-3’),在精巢和精巢细胞有明显的表达,pcr产物测序比对率99%;amh基因(上游引物序列为: 5
’‑
tgacctttgacctgccacc-3’,下游引物序列为: 5
’‑
ttccaccaatcaggagttcttt-3’),在精巢和精巢细胞有明显的表达,pcr产物测序比对率99%;而foxl2基因(上游引物序列为: 5
’‑
aaagagcgacccaaagagga-3’,下游引物序列为: 5
’‑
agaacgggaacttactgatgatgt-3’),在精巢与精巢细胞均没有表达,表明tbtc细胞是来自精巢组织。
[0056]
实施例 8实施例1的双斑东方鲀精巢细胞系的染色体分析:取分裂旺盛的双斑东方鲀精巢细胞,接种至75 cm2细胞培养瓶,待细胞增长处于对数期,加入终浓度为20 μg/ml的秋水仙碱,继续培养6
ꢀ‑ꢀ
8 h后收集细胞得到细胞悬液。将细胞悬液移至15 ml离心管,1,000 g离心10 min,轻轻吸出上清液,加入4 ml 0.075 m kcl低渗30 min;加入0.5 ml新鲜配置预冷的卡诺氏固定液预固定10 min,2,000 g离心10 min;取细胞沉淀加入0.5 ml卡诺氏固定液,以移液枪重悬沉淀;再加入1 ml卡诺氏固定液;30 cm高度向玻璃载玻片(于-20 ℃预处理)滴片,水平放置以使其彻底延展,65℃干燥;而后浸入含giemsa染液工作液的染缸中染色10 min,双蒸水冲洗以去除玻片表面渣滓,干燥,中性树脂封片,1,000
ꢀ×
油镜观察计数。
[0057]
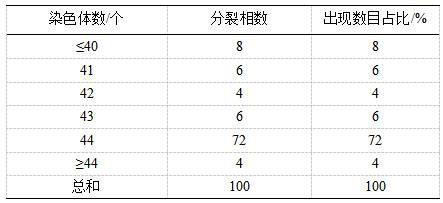
如图6 b和表1所示,对双斑东方鲀精巢组织细胞系的染色体分析72%观测到的分裂相细胞染色体数目为44条。
[0058]
表1 双斑东方鲀精巢组织细胞系的染色体图(100
×
)实施例 9实施例1的双斑东方鲀精巢组织细胞系转染pegfp-n1质粒s1:感受态细菌细胞制备:采用大肠杆菌dh5α菌种,采用经典氯化钙法制备感受态细胞,-80℃长期保存。
[0059]
:质粒制备:按照hipure plasmid maxiprep kit质粒大提试剂盒(transgene公司)说明书提取pegfp-n1质粒,-20℃保存。
[0060]
:质粒转化:取1 ng质粒dna溶液置于ep管中,冰浴放置。从-80℃冰箱取出100 μl感受态细菌悬液,迅速溶解,加入dna溶液中,冰浴10 min。42℃,水浴2 min。将ep管于37℃ 220 rpm培养1 h。而后将转化后的菌液涂布于含抗生素的lb固体培养平板上。
[0061]
:转染细胞:取旺盛生长的双斑东方鲀精巢组织细胞系细胞,待细胞覆盖率至70%-80%后,即在电转细胞的前一天晚上换液,此次换液不含双三抗。用0.25wt%的胰酶在37℃消化细胞,收集悬浮细胞于15 ml离心管内。800-1,000g离心收集细胞。离心3-5 min,弃掉上清。吸取一定量的opti-mem i充分重悬细胞(建议2 ml),再次离心收集细胞。弃掉上清。(最
大程度地洗掉血清,血清会影响转化效率);加入同样体积的opti-mem i,悬浮细胞,进行第二次离心收集细胞。结束后,弃上清,用250 μl opti mem i悬浮至1
ꢀ×ꢀ
106个/ml细胞,使得电阻达到200欧姆。充分悬浮细胞,每20 ul的重悬细胞加入pegfp-n1质粒5 μg,每个gap=2mm电极杯中添加25 μl细胞-质粒混合物;充分混匀细胞,分装至电极杯中,每个电极杯26 μl。设置程序,进行电转实验。在27℃,5% co2恒温培养箱内正常培养细胞直至观察分析,于48 h后dapi染色并使用共聚焦荧光显微镜拍照。如图7 a-c所示,转染48 h后,于共聚焦荧光显微镜下镜检能够检测到绿色荧光,pegfp-n1质粒在该细胞系中有表达。如图7 d-e所示,转染后的细胞进行传代,仍然可以看到绿色荧光,说明建立的双斑东方鲀精巢组织细胞系能适应外源基因的转染实验及稳定表达。
[0062]
实施例 10实施例1的双斑东方鲀精巢组织细胞系干扰dmrt1基因s1.获得线性化dna:通过与红鳍东方鲀dmrt1基因(genbank: xm_011615831.2)和ncbi(https://www.ncbi.nlm.nih.gov/nucleotide/)中双斑东方鲀染色体水平参考基因组(genbank: gca_004026145.2)比较,获得双斑东方鲀dmrt1基因。根据测序结果所获得的河鲀毒素结合蛋白dmrt1基因的序列片段,设计rnai干扰引物(f:agaagcagagcaaagcgtct; r:accggactacaaatgcccag),回收得到250bp的产物后,将其连接到pgem-t载体上,经过重组、转化挑单克隆,分别得到正向、反向阳性克隆,利用聚合酶(tqa enzyme)分别将他们pcr线性化处理;线性化产物割胶回收。
[0063]
合成与检测:体外转录制备ssrna,在200 μl pcr管中加入以下反应体系:具体转录过程如下:1)将pcr管置于pcr仪中37℃孵育3 h;2)向管内加入1 μl dnase i后,将pcr管放回pcr仪中37℃孵育30 min以去除管内的模板dna;3)向管中加入ph为8.0 的0.5 m edta 1 μl,吹打混匀,以终止dnase i的反应;4)将pcr管中的溶液转移至一个灭菌的1.5 ml ep管,并向管中依次加入4 m licl 2.5 μl,无水乙醇75 μl,将ep管放置于-80℃超低温冰箱中过夜(14
ꢀ‑ꢀ
16 h)以充分沉淀rna;5)在4℃下,12,000 g,离心30 min,小心移除上清,留下管底部的白色沉淀;
6)向管内加入加500 μl提前预冷的70%乙醇,在4℃条件下,12,000 g,离心15 min;7)小心移去上清,开盖干燥5 min左右;8)加入50 μl depc水溶解rna;9)制备dsrna:将经过溶解的正反向ssrna等量混合后,置于pcr仪中,反应参数为:75℃, 15 min;65℃, 15 min;最后以0.2 ℃/s下降至25℃;10)用1%琼脂糖凝胶电泳检测dsrna质量和大小,同时用紫外分光光度计测定浓度并全部稀释到1 μg/μl;11)向剩余样品中加入rnasin 1 μl,保存于-80℃以供后续干扰实验使用。
[0064]
细胞电转染:取增殖较好的tbtc细胞细胞,在电转细胞的前一天晚上换液,此次换液不含双抗。用胰酶消化,离心收集细胞,弃上清。吸取2 ml的opti-mem i充分重悬细胞,再次离心收集细胞,弃掉上清。加入同样体积的opti-mem i,悬浮细胞,进行第二次离心收集细胞。结束后,弃上清,用25 μl opti mem i悬浮细胞,使电阻达200欧姆。充分悬浮细胞,加入dsrna,每个gap=2 mm电极杯中添加2 μg的dsrna;充分混匀细胞,分装至电极杯中,每个电极杯26 μl。设置程序,进行电转实验;每个实验设置6个平行实验。正常培养细胞直至观察分析,于48 h后提取细胞rna,合成cdna第一链,进行semi quantitative pcr验证实验,设计性别相关基因的引物进行qrt-pcr实验。
[0065]
r1:如图8 a
ꢀ‑ꢀ
b所示细胞形态学的变化:干扰了dmrt1基因的tbtc细胞状态较差,细胞变圆,继续培养后细胞并没有恢复之前的长纤维状。
[0066]
r2:如图8 c所示通过semi quantitative pcr实验,干扰了dmrt1的tbtc细胞dmrt1的表达量显著降低,表明tbtc确实受到dmrt1基因的干扰。
[0067]
r3:如图8 d所示通过qrt-pcr实验,雄性特异表达基因dmrt1的表达量显著降低,雄性相关基因amh,cyp19a,amh的表达量都明显降低;而雌性相关基因foxl2,sox3和cyp19a的表达量都显著增加。
[0068]
实施例 11实施例1的双斑东方鲀精巢细胞系的细胞原位杂交技术。
[0069]
:样品准备:根据待测细胞培养条件培养细胞,观察细胞状态,当细胞密度达到80%以上进行传代,待细胞长满后调整细胞浓度为5
×
10
4 cells/ml,将细胞接种于盖玻片,每个盖玻片100 μl,37℃恒温培养24 h。细胞爬片用4%pfa固定20 min后,pbs洗2遍,10-20 μg/ml蛋白酶k溶液37℃处理30 min;4% pfa室温固定5 min;pbs洗5次,5 min/次;s2:预杂交:细胞爬片浸润在预杂交液hybe-(无肝素和探针)中60
°
c预杂交1 h;s3:杂交:杂交液hybe (含肝素和探针,探针浓度为0.5-2 ng/μl杂交液),60℃杂交过夜;s4:洗涤与封闭:60℃下梯度溶液洗涤:预杂交液
→
75%预杂交液/2
×
ssc
→
50%预杂交液/2
×
ssc
→
25%预杂交液/2
×
ssc
→2×
ssc,各洗1次,8 min/次
→
0.2
×
ssc洗涤2次,20 min/次;室温下梯度洗涤:75% 0.2
ꢀ×ꢀ
ssc 25% pbs
ꢀ→ꢀ
50% 0.2
ꢀ×ꢀ
ssc 50% pbs
ꢀ→ꢀ
25% 0.2
ꢀ×ꢀ
ssc 7 5% pbs
ꢀ→ꢀ
pbs,5 min/次;室温下封闭液封闭1 h;s5:抗体孵育:移除封闭液,加入1:500稀释的anti-dig-ap抗体,4
°
c过夜;洗涤:室温下1
×
pbs洗涤5次,15 min/次。注意:以下所有操作步骤都需要严格避光。
[0070]
:显色:将alexa fluor 647荧光二抗在封闭液(封闭液中1
×
pbst替换为
×
pbs/0.5% triton x-100)中按1:1,000的比例稀释,小心移去样品中的洗涤液,加入二抗容液,室温摇动孵育2 h;小心移除二抗溶液,用1
×
pbs/0.5% triton x-100溶液洗涤细胞3次,每次10 min;用干净的滤纸吸除细胞周围的洗涤液后,滴加dapi染色1 min;用干净的滤纸吸除dapi后,滴加抗淬灭剂至完全覆盖细胞爬片;s7:封片与观察:用leica tcs sp8激光扫描共聚焦倒置显微镜观察样品。
[0071]
如图9所示结果:阳性信号在精巢组织细胞的细胞质有表达(阳性信号为红色荧光,细胞核被染为蓝色)。
[0072]
实施例 12实施例1的双斑东方鲀精巢细胞系过表达nanog基因。
[0073]
:质粒制备:按照hipure plasmid maxiprep kit 质粒大提试剂盒(transgene公司)说明书提取pnanog-n1质粒,-20℃保存。
[0074]
:转染细胞:取旺盛生长的双斑东方鲀精巢细胞系细胞,待细胞覆盖率至70%-80%后,按照实施例8的电转染步骤,设置程序,进行电转实验,设置6个平行实验。
[0075]
:semi quantitative pcr:正常培养细胞直至观察分析,于48 h后提取细胞rna,合成cdna第一链,进行semi quantitative pcr验证实验;s4:western blot实验检测nanog蛋白的表达:(1)蛋白提取:制备裂解液(每1 ml冷的ripa裂解液中加入20 μl蛋白酶抑制剂pmsf混合物,混合均匀后放置于冰上备用);向细胞样品中加入1 ml裂解液,反复吹打细胞样品并吸入另一预冷的干净离心管中,4℃ 10,000 rpm离心5 min;将上清吸入另一预冷的干净离心管中,用于下游实验。将蛋白样品加入到新的离心管中并按4:1的比例加入5
ꢀ×ꢀ
sds-page loading buffer后,置于金属浴中,100℃变性15 min,分装后于-20℃保存备用。
[0076]
(2)制胶:10%分离胶(5 ml):5%浓缩胶(1 ml):
(3)电泳:将配好的1
×
缓冲液倒入电泳槽,然后80 v恒压电泳30 min后换120 v恒压电泳50 min左右,指示剂需泳动到胶底部直至跑出。其中缓冲液(5
×
)的配制方法如下:工作液稀释到1
×
使用。
[0077]
(4)转膜:pvdf膜在转膜前要提前用镊子夹取至甲醇浸泡30 s左右,使其湿润,然后再转移到转膜缓冲液中平衡30 min。夹板的黑色为底,按照海绵-滤纸-凝胶-pvdf膜-滤纸-海绵的顺序置于转膜夹板中,夹好后放入转膜槽中,转膜时要防止各层之间产生气泡,设置200 ma恒流,4℃冰箱中转膜90 min。转膜缓冲液(1
×
)需现配现用,其配制方法如下:(5)封闭:转膜完成后,将转好的膜正面朝上,用1
ꢀ×ꢀ
pbst洗膜一次,再用1
ꢀ×ꢀ
pbs洗一次,每次5 min。随后放置于加有5% bsa封闭液的小盒中(1
ꢀ×ꢀ
pbs稀释),37 ℃封闭1 h。
[0078]
(6)一抗孵育:1
ꢀ×ꢀ
pbst洗膜两次,再用1
ꢀ×ꢀ
pbs洗一次,每次5 min。将pvdf膜正面朝上小心转移至另一新的小盒中,加入按适当比例稀释的一抗,先用摇床缓慢摇动20 min,再将小盒放置于4 ℃冰箱中孵育过夜。
[0079]
(7)二抗孵育:将一抗回收,把pvdf膜转移至另一新的小盒中加入适量1
×
pbst洗膜两次,再用1
ꢀ×ꢀ
pbs洗一次,每次5 min。然后取辣根过氧化物酶标记二抗按照1:1000的比例用含5% bsa的1
ꢀ×ꢀ
pbs进行稀释,将稀释后的二抗加入小盒中,室温下孵育1 h。
[0080]
(8)显色:用1
ꢀ×ꢀ
pbst洗膜两次,再用1
ꢀ×ꢀ
pbs洗一次,每次5 min。pvdf膜正面朝上向膜上加入2 ml显色剂使膜被充分覆盖,然后使用e-blot touch imager分析并拍照。
[0081]
r1:如图10 a-b所示细胞形态学的变化:细胞明显比未过表达nanog的细胞增殖速度更快。
[0082]
r2:如图10 c所示通过semi quantitative pcr实验,发现外源基因nanog确实导入到tbtc中,且表达量较高。
[0083]
r3:如图10 d所示western blot结果,实验组的精巢组织细胞的nanog蛋白表达量显著性增加。
[0084]
实施例 13实施例1的双斑东方鲀精巢细胞系的饥饿处理
取细胞覆盖率80%
ꢀ‑ꢀ
100%的双斑东方鲀精巢细胞,用完全培养液换液,于27℃,5% co2下培养,30 d后发现培养液颜色由橙色变成浅黄色,说明培养液中的营养物质被大量消耗。显微镜下观察双斑东方鲀精巢细胞形态,如图11 a所示,可见由大量细胞解除贴壁而形成空洞状;部分细胞由于营养消耗细胞发生皱缩,在显微镜下观察折光性增强;细胞仍有较多细胞存活且形态未发生变化。如图11 b所示,当再次传代并补给新鲜的完全培养液后,存活下来的细胞可以再次增殖,分裂仍然旺盛,形态也未发生变化。
[0085]
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
