1.本发明涉及微生物发酵技术领域,特别涉及一种地衣芽孢杆菌及其应用。
背景技术:
2.硒是机体正常生命活动所必需的微量元素,在维持氧化还原平衡、免疫调节、拮抗重金属、抑制癌症、保护dna和染色体免受氧化损伤等方面发挥着重要作用。然而,硒在人体无法长期储存,也无法合成,人体必须从膳食中不断获得硒元素来供机体需要,但硒的摄入量受其所生活的环境因素如土壤、水、食物所影响。摄入不足易导致生长发育迟缓、甲状腺功能异常,甚至引起克山病、大骨节病等,美国国家科学院公布成人硒参考摄入量(dri)为55μg/d。我国是世界范围内地理环境硒缺乏范围最广、缺硒程度最严重的国家之一。
3.目前主要补硒形式分为无机硒与有机硒,不同形态的硒生物利用率不同,有机硒通常由硒经过生物转化与氨基酸结合而成,一般以硒代氨基酸和硒蛋白形式存在,其生物利用率较高毒性小,目前食源补硒主要以此形式,但转化速度慢,耗时长。无机硒分为亚硒酸盐和稀酸盐类无机硒,以及单质硒。其中,前述盐类无机硒生物利用率低且安全范围较窄,较易产生毒性,日本、美国等发达国家早已禁止在食品中添加此类无机硒;而单质硒分为灰色、黑色、红色类,灰色与黑色的单质硒被证明无生物活性,红色单质硒也称纳米硒,为纳米级尺寸的单质硒,其体积小且具有特殊的理化性质,活性强、吸收好,安全使用量高于无机硒和有机硒,在急性毒性测试中,同一小鼠死亡率下,纳米硒的使用剂量约为无机硒的六倍。亚慢毒性测试结果显示,喂养小鼠时单质纳米硒的添加量达到6mg/kg时也不会引起小鼠的重量降低和肝硬化的发生,而添加的无机硒或有机硒达到4-5mg/kg时就会引起上述情况的发生。
4.纳米硒,具有抗癌、抗氧化、降糖、抑菌等活性,在饲料、肥料、药物等方向均有应用。目前,纳米硒的合成方法主要有3种,分别为物理法、化学法、以及生物法。物理法采用高温、高压或者激光催化等转化,费用高,环境生态危害大,较少采用。化学法通过化学反应合成,存在不安全因素如刺激危险的化学物质、废液等,并且所合成的纳米硒纯在形态不规则、易聚集、稳定性差等问题。
技术实现要素:
5.本发明的主要目的是提出一种地衣芽孢杆菌及其应用,旨在提供一种地衣芽孢杆菌,该菌种能够将有毒亚硒酸钠还原为低毒纳米硒,且对亚硒酸钠的耐受性强。
6.为实现上述目的,本发明利用采自广东省中山市南区蔬菜田中的土壤,从其中分离纯化得到一株地衣芽孢杆菌。本发明分离纯化得到的地衣芽孢杆菌已经在中国典型培养物保藏中心保藏,地址:中国武汉武汉大学,分类命名为地衣芽孢杆菌(bacillus licheniformis)f1,保藏编号为cctcc no.m20211387,保藏时间为2021年11月8日。
7.此外,本发明还提出一种纳米硒,所述纳米硒由如上文所述的地衣芽孢杆菌还原无机硒得到。
8.此外,本发明还提出一种如上文所述的地衣芽孢杆菌在制备环境修复制剂上的应用。
9.此外,本发明还提出一种如上文所述的地衣芽孢杆菌在制备补硒剂和/或抗氧化剂上的应用。
10.本发明技术方案中,提出一种地衣芽孢杆菌f1,该菌株能够对有毒的亚硒酸钠进行还原,得到低毒的纳米硒,且该菌株耐热性、对亚硒酸钠的耐受性均较好,能够作为生产纳米硒的优势菌种,用于制备具有补硒或抗氧化功能的食品、药品或者饲料等,或者适用于高硒污染环境的治理。
附图说明
11.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
12.图1为本发明提出的地衣芽孢杆菌及其还原得到的纳米硒的sem扫描图;
13.图2为实施例2中菌落在lb平板的形态图;
14.图3为实施例2中菌落在亚硒酸钠平板的形态图;
15.图4为实施例2中地衣芽孢杆菌菌株的电子显微镜镜检图;
16.图5为实施例2中基于地衣芽孢杆菌的16s rrna序列构建的菌株系统发育树;
17.图6为实施例6中地衣芽孢杆菌的生长曲线图;
18.图7为实施例6中地衣芽孢杆菌在不同浓度的亚硒酸钠溶液下培养48h后的菌体颜色变化对比图;
19.图8为实施例6中地衣芽孢杆菌对无机硒的还原率-培养时间关系图;
20.图9为实施例6中地衣芽孢杆菌的次生代谢产物对三种自由基的清除活性对比图。
21.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
22.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。
23.需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
24.纳米硒,具有抗癌、抗氧化、降糖、抑菌等活性,在饲料、肥料、药物等方向均有应用。目前,纳米硒的合成方法主要有3种,分别为物理法、化学法、以及生物法。物理法采用高温、高压或者激光催化等转化,费用高,环境生态危害大,较少采用。化学法通过化学反应合
成,存在不安全因素如刺激危险的化学物质、废液等,并且所合成的纳米硒纯在形态不规则、易聚集、稳定性差等问题。
25.鉴于此,本发明利用采自广东省中山市南区蔬菜田中的土壤,从其中分离纯化得到一株地衣芽孢杆菌。本发明分离纯化得到的地衣芽孢杆菌已经在中国典型培养物保藏中心保藏,地址:中国武汉武汉大学,分类命名为地衣芽孢杆菌(bacillus licheniformis)f1,保藏编号为cctcc no.m20211387,保藏时间为2021年11月8日。
26.该菌株能够对有毒的亚硒酸钠进行还原,得到低毒的纳米硒。该纳米硒粒径小、且具有较好的生物活性,作为功能性食品、药品或者饲料,有利于动物、人体对硒的吸收。同时,地衣芽孢杆菌具有为机体提供营养物质、增强机体免疫力、维持肠道微生态平衡等益生活性,更有作为功能性食品、药品或者饲料的优势;而且,其具有的较好的降胆固醇、降尿酸作用,也进一步提高了其作为功能性食品、药品或者饲料的优势。
27.此外,地衣芽孢杆菌具有分泌抗菌物质、诱导植物抗性、改善根际环境等能力,能够用于植物生长;具有吸附重金属、降解农药、净化水体及空气污染的功效,能够用于改善环境,且其本身具备的还原硒的功能,也使得其能够用于硒污染环境的治理。
28.进一步地,本发明提出的地衣芽孢杆菌(bacillus licheniformis strain)f1对亚硒酸钠具有极强的耐受性,具体来说,本菌种能够适应浓度为150mmol/l的亚硒酸钠,在其中平稳生长,也就是说,本发明提出的地衣芽孢杆菌f1能够适应高硒环境,能够适用于高硒环境污染的治理中。本地衣芽孢杆菌f1能够在低至ph2.5的环境下存活,且存活率达到72%以上,具备较好的耐酸能力;同时,地衣芽孢杆菌f1能够在0.6%(质量体积浓度,g/l)的胆盐环境下存活,具备较好的耐胆盐能力;因此,本地衣芽孢杆菌f1具备顺利通过胃肠道的能力,当其作为菌剂,或者被制成食品、药品等时,能够顺利通过胃肠道,适应机体环境,顺利定植,更好地发挥其功能特性。
29.此外,本发明还提出一种纳米硒,所述纳米硒由如上文所述的地衣芽孢杆菌还原无机硒得到。
30.所述纳米硒粒径在250nm以下,容易被机体吸收,发挥作用;且该纳米硒具有较低的细胞毒性,更适合用于制备食品、医药、饲料等食用性产品。
31.本发明进一步提出上述纳米硒的制备方法,所述制备方法包括以下步骤:将上述地衣芽孢杆菌f1接种至含有无机硒盐的lb液体培养基中进行培养,然后经过分离、纯化,即可得到纳米硒。
32.其中,无机硒盐包括亚硒酸钠。进一步地,亚硒酸钠的浓度不高于150mmol/l。
33.此外,本发明还提出一种如上文所述的地衣芽孢杆菌在制备环境修复制剂上的应用。
34.本地衣芽孢杆菌f1具有分泌抗菌物质、诱导植物抗性、改善根际环境等能力,能够用于植物生长;具有吸附重金属、降解农药、净化水体及空气污染的功效,能够用于改善环境,且其本身具备的还原硒的功能,也使得其能够用于硒污染环境的治理;进一步地,本地衣芽孢杆菌f1能够适应浓度不高于150mmol/l的高硒环境,能够适用于高硒污染的环境的治理。
35.具体应用时,可以将地衣芽孢杆菌f1制成单一菌剂或者与其他菌株复配制成复合菌剂直接用于污染环境,或者与其他环境修复组分混合制成环境修复剂使用。
36.此外,本发明还提出一种如上文所述的地衣芽孢杆菌在制备补硒剂和/或抗氧化剂上的应用。
37.本地衣芽孢杆菌f1能够对有毒的亚硒酸钠进行还原,得到低毒的纳米硒。该纳米硒粒径小、且具有较好的生物活性,易于被机体吸收,能够用于制备具有补硒功能的功能性食品、功能添加剂、医药以及饲料。
38.以功能添加剂为例,具体应用时,可以使用由本地衣芽孢杆菌f1转化无机硒得到的纳米硒作为主要功效成分、或者作为功效成分之一与其他功能组分复配制成添加剂。
39.本地衣芽孢杆菌f1的次生代谢产物具有较好的抗氧化性能,能够对dpph自由基、abts自由基、羟基自由基等自由基进行清除。因此,可以将该次生代谢产物作为主要功效成分用于制备具有抗氧化功效的功能性食品、功能添加剂、医药以及饲料。
40.具体地,所述次生代谢产物可以通过如下步骤制得:
41.将上述地衣芽孢杆菌f1接种至含有无机硒盐的lb液体培养基中进行培养,得到含有纳米硒的发酵液;
42.将所述发酵液离心后,取上清,用体积比为1:5的乙酸乙酯-水溶剂萃取,收集乙酸乙酯层,旋蒸,即得次生代谢产物。
43.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
44.实施例1菌株的分离
45.土壤样品取自广东省中山市南区蔬菜田中的土壤。
46.将采集来的土壤样品均匀分散到lb平板上,培养得到不同形态的菌落,将不同形态的菌落分别接种到含亚硒酸钠的lb固体培养基上,观察这些菌株的生长情况和颜色,挑选出长势较好且颜色较红的菌株,经鉴定,该菌株为地衣芽孢杆菌f1。
47.实施例2菌株的鉴别
48.下述试验采用的菌株均为实施例1分离得到的菌株。
49.(1)将菌株在lb平板上37℃培养形成菌落,观察菌落形态、颜色等特征。结果如图2所示,菌落呈圆形,表面不光滑,山丘状突起,表面暗,粗糙,有黏液光泽。
50.进一步对其进行镜检,参阅图4,结果显示:菌体呈短棒状,单个或2个并排排列,易连接成长条,芽孢呈椭圆形,中间膨大,芽孢在中间或偏一端。
51.将菌株在亚硒酸钠平板上培养形成菌落,观察菌落形态,结果如图3所示,可以看出,在亚硒酸钠平板上菌落呈红色圆形,光滑,有黏液光泽,且明显菌落数少于lb平板,即亚硒酸钠对菌株生长可能有抑制作用。
52.(2)对菌株进行生理生化检测,结果记入下表1中。
53.表1生理生化结果
54.实验结果葡萄糖 蔗糖 乳糖-甘露糖 阿拉伯糖
吲哚测试-氧化酶 枸橼酸盐利用
55.注: 阳性;-阴性
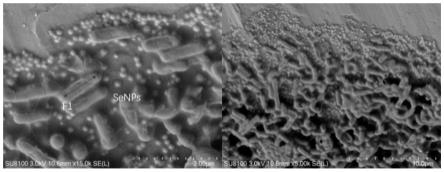
56.参阅上述检测结果,将之与《常见细菌系统鉴定手册》进行比对,可以鉴定出本菌株为地衣芽孢杆菌(bacillus licheniformis)。
57.(3)对菌株进行基因组测序
58.从生工生物工程(上海)股份有限公司获得该菌株的16s rrna序列,利用blast软件进行基因序列比对分析,发现菌株f1与bacillus licheniformis strain as13相似度最高为100%,基于它们的16s rrna基因序列所构建的系统发育进化树如图5。根据试验结果,初步确认本菌株为地衣芽孢杆菌(bacillus licheniformis),即实施例1分离得到的菌株为一株具有亚硒酸钠还原性的芽孢杆菌属菌株。
59.实施例3菌株的发酵
60.取实施例1分离得到的地衣芽孢杆菌f1菌种。将菌种以1%接种量接入100ml lb液体培养基中180rpm,37℃恒温振荡培养至生长对数期,加入1.73g亚硒酸钠使lb培养基亚硒酸钠浓度为100mmol/l,培养6h后,在10000rpm下离心30min,取沉淀用生理盐水洗涤3次,获得菌株发酵产物。
61.在上述菌株发酵产物中加入电镜固定液,进行sem扫描,结果如图1所示,红色箭头为菌株所还原的纳米硒。参阅图1,菌株呈短杆状,纳米硒的粒径约190-250nm,呈圆球状并且在菌株内外均有分布,可见,本菌株能够将亚硒酸钠还原,得到纳米硒。
62.实施例4纳米硒的纯化
63.取活化好的实施例1分离得到的地衣芽孢杆菌f1的种子液,按1%接种量接种至含有亚硒酸钠的lb液体培养基中180rpm,37℃恒温振荡培养至观察发酵液变红,将含有纳米硒的发酵液收集于离心管中,置于离心机内10000rpm,离心30min,收集沉淀,为菌体和纳米硒混合物;用无菌水清洗沉淀2~3次。将沉淀置于研钵中,加入液氮立即研磨;研磨后的菌粉用无菌水悬浮,在冰上细胞超声破碎6-10min;将纳米硒悬液分别过20、10、5、3、1.2、0.8μm的滤膜。将纳米硒悬液移至分液漏斗中,加入1/5体积的正己烷,充分混匀,静置,收集下层;然后在10000rpm离心30min,收集沉淀,用无菌水清洗2~3次,取沉淀,得纳米硒。
64.实施例5次生代谢产物的提取
65.取活化好的实施例1分离得到的地衣芽孢杆菌f1的种子液,按1%接种量接种至含有亚硒酸钠的lb液体培养基中180rpm,37℃恒温振荡培养至观察发酵液变红,将含有纳米硒的发酵液收集于离心管中,置于离心机内10000rpm,离心30min,收集上清,用体积比为1:5的乙酸乙酯-水溶剂萃取,收集乙酸乙酯层,旋蒸,称重得次生代谢产物,加无水乙醇配制次生代谢产物溶液。
66.实施例6性能检测
67.(1)菌株生长曲线的测定:制备含亚硒酸盐浓度为0、50、150mm(本文中,mm即为mmol/l)不同浓度的lb液体培养基。按1%的接种量将实施例1分离得到的菌株分别接种于含100ml上述培养基的三角摇瓶中,180rpm,37℃恒温振荡培养。每个样品5组重复。每隔1-3h进行取样。将上述取出的菌液,在600nm波长下测定其吸光度值,绘制生长曲线,结果如图
6所示。
68.参阅图6,菌株在3-11h为生长对数期,第23h后进入稳定期;浓度为50mm的亚硒酸钠对菌株先是抑制其生长,但细胞活性并未被完全杀死,菌株仍可在高浓度亚硒酸钠中缓慢生长,在第10h后进入生长对数期,并且在第29h后超过ck,该浓度的亚硒酸钠也许对菌株的生长起到了促进的作用,在第51h后迅速进入衰亡期;在浓度为150mm的亚硒酸钠浓度中,菌株生长缓慢,并无明显生长对数期,在第43h进入平稳期,即高浓度亚硒酸钠对菌株的生长抑制效果非常明显,具有较大细胞毒性。
69.(2)菌株还原亚硒酸钠最大浓度测定:将实施例1分离得到的菌株在含有不同亚硒酸钠浓度(50mm、100mm、150mm、200mm、250mm、300mm)的液体lb培养液中培养48h后,菌体的颜色变化如图7所示。根据培养液的颜色,若溶液呈红色则菌株有效的将亚硒酸钠还原为红色纳米硒,颜色越深说明还原得到的纳米硒含量越高。
70.结果分析:图中,随着浓度越高,溶液颜色越浅,50mm-150mm对应的溶液呈红色,200mm及以上浓度的溶液颜色较浅。从图中对比可以看出,150mm为该菌株所能还原的最大亚硒酸钠浓度,也即,本发明提出的地衣芽孢杆菌f1能够耐受150mm亚硒酸钠浓度。
71.(3)菌株纳米硒还原率测定:分别称取10、20、30、40、50mg单质硒粉至于试管中,每支试管加入30ml na2s溶液(1mol/l),使se0与na2s充分反应,1h后测定溶液在500nm处的吸光值,每个样品三次重复,最后,以吸光值为y轴,硒浓度为x轴绘制标准曲线。取活化好的实施例1分离得到的地衣芽孢杆菌f1的种子液,将种子液按1%接种量分别接种至含有3、10mm亚硒酸钠的lb液体培养基中,连续摇培12、24、48、60h。从上述各个处理中取培养液8000rpm离心10min,收集沉淀。用1mol/l nacl清洗沉淀三次,再向得到的沉淀中加入30ml硫化钠溶液(1mol/l),轻轻振荡使其充分溶解混匀,在常温下静置1h,之后通过8000rpm离心10min将未溶解的细胞残留物去除干净,收集上清,测定在500nm处的吸光值,每个样品三次重复,最后,根据准曲线公式计算出吸光值对应的纳米硒浓度。本研究采用两梯度浓度亚硒酸钠分别为3mm、10mm,并且为保证菌株生长质量,根据生长曲线结果选择最长还原时间为60小时,探究菌株f1随时间以及亚硒酸钠浓度的纳米硒的还原率。结果如图8所示。
72.还原率(%)=(产物中的纳米硒浓度/初始硒处理浓度)
×
100%
73.结果分析:参阅图8,菌株在亚硒酸钠浓度为3mm时还原率整体高于10mm,由上述实验可知,亚硒酸钠浓度增大会对菌株的生长有抑制作用,从而抑制或延缓菌株的还原纳米硒效果。随时间增加菌株还原率均呈梯度增长,且在第60h达到最高,浓度为3mm的亚硒酸钠环境中菌株纳米硒还原率可高达67.90
±
0.60%。
74.(4)菌株耐受酸和胆盐实验
75.取实施例1分离得到的地衣芽孢杆菌f1,进行过夜生长。将约1ml过夜生长的菌液转移到用盐酸调节至ph 2.5和3.5的9ml新鲜lb培养基中,并在37℃,180r/min恒温摇床孵育4h。结果如表2所示。
76.取实施例1分离得到的地衣芽孢杆菌f1,进行过夜生长。将约1ml过夜生长的菌液转移到含有0.3%(质量体积百分比,g/l)和0.6%(质量体积百分比,g/l)牛胆盐的lb培养基中并在37℃孵育4h。取孵育0小时和4小时样液,通过梯度稀释法测定活细胞的数量。存活率由琼脂上存在的活细胞数量决定,并以每毫升样品的集落形成单位(cfu)计算。结果记入表2。
77.表2菌株耐酸耐胆盐结果
[0078][0079]
如表2所示,菌株在ph2.5及3.5的环境下存活率可达72.56
±
3.78%及77.73
±
1.32%,在胆盐浓度0.3%及0.6%的环境中存活率为41.01
±
1.16%及37.94
±
2.94%,具备较好的耐酸耐胆盐的能力,证明菌株具备顺利通过胃肠道的能力。
[0080]
(5)菌株耐热性检测
[0081]
取实施例1分离得到的地衣芽孢杆菌f1,接种至斜面培养基上进行培养。刮取斜面培养物于100ml,0.4%灭菌的cacl2溶液中,37℃恒温振摇培养4h,诱导芽孢产生,制备芽孢悬液。取培养4h后的芽孢悬液于90℃或100℃水浴15min,吸取100μl,使用平板梯度稀释法计算芽孢数,未经热处理的样品做对照组计算芽孢存活率。结果记入表3。
[0082]
存活率sr(%)=(cfu热处理组/cfu对照组)
×
100%
[0083]
表3菌株芽孢耐热性结果
[0084]
温度(℃)存活率(%)9094.43
±
1.4710064.75
±
2.27
[0085]
从上表可以看出,本菌株在90℃及100℃环境下存活率可达94
±
1.47%及64
±
2.27%,具备较强的耐热能力,有助于在中高温生产、运输及储存过程中保持稳定存活,减少保护剂等添加剂的使用,降低成本。
[0086]
(6)菌株自凝集率测定
[0087]
取实施例1分离得到的地衣芽孢杆菌f1,进行过夜生长。过夜活化的菌株发酵液以6000rpm离心10分钟,沉淀用pbs洗涤三次,并重新悬浮在pbs(ph 7.4)中,在600nm(a0)处吸光度调节为0.8
±
0.05,涡旋30秒,并在静态条件下于37℃孵育。悬浮液在1h(a1)、4h(a1)和24h(a1)在600纳米下测量其od值,每个样品三次重复。结果记入表4。
[0088]
自凝集率(%)=(a0-a1)/a0
×
100%
[0089]
(式中:a0为初始菌液的od600;a1静置t h后上清液的od600)
[0090]
表4菌株自凝集率测定
[0091]
1h4h24h9.06
±
0.0016.12
±
0.0065.77
±
0.01
[0092]
从上表可以看出,本发明提出的地衣芽孢杆菌f1在第24h自凝集率可达65.77
±
0.01%,具有较强的自凝集性,有助于充分发挥其益生作用。
[0093]
(7)次生代谢产物抗氧化性测定
[0094]
取实施例5制得的次生代谢产物溶液。
[0095]
1)抗dpph自由基活性测定
[0096]
吸取0.25mmol/l dpph溶液(无水乙醇配制)600μl,分别加入10mg/ml的senps溶液或次生代谢产物溶液70μl,用蒸馏水定容至670μl,于暗处反应30min,测定517nm处吸光值。
根据吸光度值计算dpph自由基清除率。结果如图9所示。
[0097]
计算公式:清除率%=ab-(aa-ac)/ab
×
100%;
[0098]
式中:aa为样品与dpph溶液混合后的吸光值;ac为样品与dpph溶液混合后的吸光值;ab为dpph与水混合后的吸光值。
[0099]
2)抗abts自由基活性测定
[0100]
吸取abts工作液(0.2ml abts 0.2ml k2s2o8(黑暗环境下室温放置12h),无水乙醇稀释,控制734nm吸光度在0.7左右)600μl,分别加入10mg/ml的senps溶液或次生代谢产物溶液70μl,用蒸馏水定容至670μl,于37℃培养箱中反应30min,测定734nm处吸光值。根据吸光度值计算abts自由基清除率,结果如图9所示。
[0101]
计算公式:清除率%=a0-a1/a0
×
100%;
[0102]
式中:a0为水代替样品测得的吸光值;a1为样品与abts溶液混合后的吸光值。
[0103]
3)抗羟基自由基活性测定
[0104]
在试管中依次加入9mmol/l feso4溶液200μl、9mmol/l水杨酸-乙醇溶液200μl,分别加入10mg/ml的senps或次生代谢产物溶液70μl,用蒸馏水定容至470μl,以及30%的h2o2溶液200μl,静置30min,510nm波长处测定吸光度。根据吸光度值计算羟基自由基清除率,结果如图9所示。
[0105]
计算公式:清除率%=a0-a1/a0
×
100%
[0106]
式中:a0为水代替样品测得的吸光值;a1为样品与溶液混合后的吸光值。
[0107]
从图9中可以看出,实施例5获得的次生代谢产物溶液对三种自由基(dpph、oh、abts)均具有一定的体外清除活性。
[0108]
(8)益生活性测定
[0109]
1)菌株降胆固醇能力测定
[0110]
吸取胆固醇标准溶液4ml,旋蒸挥发尽溶剂,加入4ml邻苯二甲醛溶液,震荡,静置10min后,加入2.0ml浓硫酸,混匀,显色10min,用不加胆固醇标准溶液的邻苯二甲醛和浓硫酸为空白调零,测定550nm处的吸光值。以胆固醇质量(μg)为横坐标,od550为纵坐标,绘制胆固醇标准曲线。取实施例1分离得到的地衣芽孢杆菌f1,将其发酵菌液调节od值为0.8
±
0.05,按1%接种量接种于lb-chol培养基(lb培养基中加入0.2%巯基乙酸钠,0.3%牛胆盐100μg/ml胆固醇)中。以未接菌的lb-chol培养基做对照。37℃培养24h,8000rpm,离心10min,收集上清液。取离心后的上清液4ml,加入2.0ml 50%koh,混和均匀后加入3.0ml 95%乙醇,漩涡震荡1min。将离心管置于60℃水槽中,静置15min,取出后迅速冷却到室温,向离心管中加入3.0ml正己烷,混和均匀后加入2.0ml蒸馏水,盖塞漩涡震荡1min,静置15min后,取1.0ml正己烷层溶液旋蒸挥发尽溶剂后,加入2.0ml当天配置的邻苯二甲醛溶液,混匀,室温下静置10min,加入1.0ml浓硫酸,漩涡震荡,显色10min后,测定od550,根据标准曲线计算样品中胆固醇含量并计算清除率。
[0111]
结果分析:地衣芽孢杆菌f1在含胆固醇的lb培养基中培养24h后的胆固醇清除达率30.00
±
1.23%,说明本发明提出的地衣芽孢杆菌f1具有较好的胆固醇清除率。
[0112]
2)降尿酸能力测定
[0113]
称取0.5g尿酸于三角瓶中,另准备一瓶100ml营养琼脂,培养基115℃高温高压蒸汽灭菌15min后,待营养琼脂培养基温度降至60℃时,将两者轻轻混匀,注意不要有气泡产
生。定量移取20m l至无菌平皿中,制成初筛培养基,采用打孔法在尿酸培养基中加入菌液40μl(实施例1分离得到的地衣芽孢杆菌f1的发酵菌液),放入37℃培养箱培养18h,观察透明圈。若有透明圈即进行液体复筛,即尿酸氧化酶酶活测定。在1.5ml微量离心管中加入1000μl菌液,放入微量冷冻离心机中13000r/min离心2min,弃上清。再加500μl的50mmol/l硼酸-硼酸钠缓冲液,13000r/min冷冻离心2min,弃上清。放入液氮中速冻1min,反复冻融三次。加入1000μl的50mmol/l硼酸-硼酸钠缓冲液,漩涡混合器混匀后,放入微量冷冻离心机中,13000r/min离心2min,其上清液即为粗酶液。尿酸在290nm处有光吸收。在干净的试管中加入4.0ml尿酸溶液(0.001%尿酸)及1.0ml双蒸水,混匀后于40℃平衡5min,加入1.0m l的粗酶液用涡旋混合仪混匀,于40℃反应5min,加入0.4ml的20%koh溶液混匀终止反应,经紫外可见分光光度计检测a290值,以失活的酶液作为对照,计算尿酸氧化酶酶活力。尿酸氧化酶酶活力单位(u)定义,在p h8.5,40℃条件下,每分钟将1μmol/l尿酸氧化成尿囊素所需的酶量定义为一个酶活性单位。
[0114]
结果分析:在含尿酸的培养基中打孔并注入f1发酵液,培养后发现存在透明圈,即菌株f1具有降解尿酸的能力;通过尿酸氧化酶活力测定,菌株f1酶活力可达33.25
±
0.48(u/ml),具备降尿酸能力。
[0115]
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。